Геохимия, 2022, T. 67, № 2, стр. 101-118
Биологическая роль микроэлементов и вирусные патологии
В. В. Ермаков a, *, Л. Н. Иованович b, **
a Институт геохимии и аналитической химии и. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
b ALFA BK University
11070 Belgrad, Palmira Toljatija, 3, Serbia
* E-mail: vad-ermak@yandex.ru
** E-mail: ecologica.drustvo@gmail.com
Поступила в редакцию 24.03.2021
После доработки 25.05.2021
Принята к публикации 06.06.2021
- EDN: KJLHRD
- DOI: 10.31857/S0016752522020042
Аннотация
Обзор литературы посвящен новому направлению в биогеохимии и геохимической экологии – связи микромира (вирусов) с проявлениями патологий животных и человека. Рассмотрены некоторые аспекты биологического действия селена, цинка, меди и йода, их влияние на проявление и течение вирусных инфекций. Акцентировано внимание на антиоксидантных, мембранопротекторных, иммуномостимулирующих, гормональных функциях микроэлементов, антибактериальных и противовирусных свойствах металлической меди и ее соединений. Существующие критерии оценки Se-статуса территорий сопоставлены с заболеваемостью населения РФ COVID-19 и ВИЧ. Показано, что в ряде случаев дефицит селена в среде связан с более высокой восприимчивостью к РНК-вирусным инфекциям. Подчеркнута необходимость совершенствования критериев оценки микроэлементного статуса территорий, развития исследований в области геохимической экологии вирусов и их роли в биосфере.
ВВЕДЕНИЕ
В связи с открытием бактериофага как нового проявления живого вещества, В.И. Вернадский писал: “Работы над бактериофагами открывают новые проявления жизни в биосфере. Во-первых, они указывают , что могут существовать организмы, еще более мелкие, чем бактерии, обладающие еще большей геохимической энергией” (Вернадский, 1940). И далее: “Жизнь и здесь достигает своего возможного физического предела”. В данной работе В.И. Вернадский подчеркивает не только важность открытия новых ультрамикроорганизмов, но и их способность участвовать в биогенной миграции вещества.
Другими паразитирующими субстанциями внутри живого мира оказались вирусы. Они были открыты Д.И. Ивановским в 1892 г. при изучении патологии листьев табака – табачной мозаики. Ее причиной оказалась субстанция, проходящая через поры фильтра и обладающая инфекционностью. Дальнейшие исследования показали, что инфекционное начало отличалось от бактерий меньшими размерами (Ивановский, 1892). Это было новое болезнетворное начало, названное впоследствии Мартином Бейеринком вирусом (Beijerinck, 1898).
По мнению В.М. Жданова, вирусы (царство Virae) являются облигатными внутриклеточными паразитами, широко распространенными среди позвоночных и беспозвоночных животных, растений, простейших, грибов, бактерий, архей. У вирусов нет обмена веществ, а поступление энергии происходит за счёт обмена веществ клетки хозяина. Несмотря на мелкий размер (20–400 нм), вирусы являются полноценными организмами, обладая наследственностью в процессе воспроизведения себе подобных, изменчивостью (генетической и фенотипической), и подвергаясь в ходе эволюции естественному отбору. Изменчивость достигается за счёт генных мутаций, в результате рекомбинации, генетической реассортации, под влиянием среды обитания и во взаимодействии с организмом хозяина, а также с другими вирусами (Жданов и др., 2012). Некоторые вирусы насекомых регулируют численность популяций и могут переходить в латентное состояние (Ермакова, Тарасевич, 1968).
Таким образом, микромир включает не только обычные микроорганизмы (бактерии грибы, актиномицеты) и ультрамикробактерии (Archaea, Actinibacteria, Cytophaga, Proteobacteria), но и царство Virae, широко представленное в биосфере. Численность ультрамикроорганизмов в почвах весьма велика и составляет десятки и сотни миллионов клеток в 1 г почвы (Лысак и др., 2010).
Несмотря на бурное развитие вирусологии, генетики и молекулярной биологии место вирусов в жизни организмов, экологии, эволюции биосферы и их геохимическая роль изучены недостаточно.
В настоящее время человечество все острее испытывает отрицательное воздействие последствий ускоренного техногенного развития. Результатом техногенеза явились многочисленные экологические проблемы: кислотные дожди, озоновые дыры, загрязнение природной среды вредными химическими элементами и токсичными соединениями, а также дефицит жизненно важных микроэлементов в биогеохимической пищевой цепи, что сопровождается проявлением пандемий и новых, неизвестных ранее вирусных патологий. К таким заболеваниям можно отнести синдром приобретенного иммунодефицита (СПИД), вирусные гепатиты, болезни Эбола и Коксаки, “бешенство” крупного рогатого скота, a также синдромы и болезни, вызываемые вирусом птичьего гриппа (САРС-1), вирусом Корона (САРС-2) (COVID-19), а также синдром Кавасаки у детей (Jovanović, Ermakov, 2020).
Конкретные механизмы, связывающие глобальные изменения в биосфере с теми или иными болезнями, пока еще не раскрыты, и это значительно затрудняет принятие адекватных мер и синтеза новых эффективных лекарственных препаратов для лечения заболеваний. Вместе с тем, за последние 20 лет наметился определенный прогресс и в этой области.
Данная статья посвящена мало изученной области геохимической экологии -взаимосвязи проявления вирусных патологий и микроэлементозов.
СЕЛЕН
Биологическая роль селена
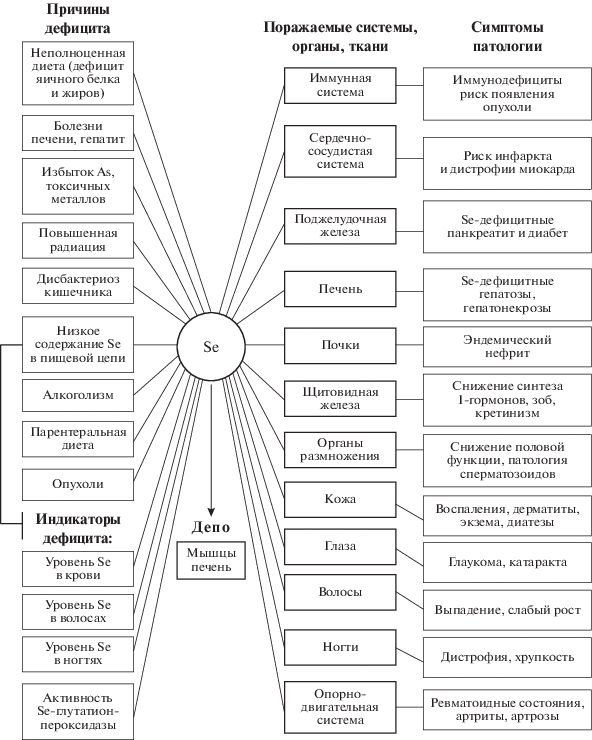
Многочисленные исследования показывают, что один из химических элементов, вернее его недостаток в питании человека играет критическую роль в развитии самых опасных болезней нашего времени. Этим микроэлементом является Se (Ермаков, Ковальский, 1974; Голубкина, Папазян, 2006; Combs, 2015).
История изучения биологической роли Se включает 3 периода. До 1957 г. Se и его соединения считали исключительно токсичными для организмов. Причина этого – массовые отравления скота в некоторых районах Великой равнины США. Следующим этапом интереса к Se является открытие К. Шварца и С. Фольца в 1957 г. о предотвращении развития некроза печени крыс и экссудативного диатеза цыплят очень низкими дозами селенита натрия. Это послужило началом использования соединений Se в терапии беломышечной болезни животных и других заболеваний (Schwarz, Foltz, 1957).
Третий этап – открытие селенсодержащего фермента глутатионпероксидазы, регулирующего антиоксидантное состояние организма и выявление обширных территорий с недостатком Se в среде, кормах и продуктах питания (Ermakov, Jovanović, 2010; Голубкина и др., 2017). Тем не менее, биохимические функции Se у животных и человека не были известны до 1973 г. В 1973 г. почти одновременно Дж. Ротрак и соавторами (Rotruck et al., 1973), а также группа немецких ученых под руководством Л. Флэч (Flohe et al., 1973) продемонстрировали, что Se входит в состав молекулы ранее известного фермента глутатионпероксидазы (СРх), который, подобно каталазе, защищает мембраны эритроцитов от окисления, разрушая перекись водорода.
Дефицит Se в среде был установлен практически одновременно в 60-е гг. прошлого столетия в Новой Зеландии, Австралии, США и Восточном Забайкалье (Ermakov, Jovanovic, 2010a). С недостатком Se в среде и продуктах питания связывают более 30 патологий животных и человека, включая эндокринные, сердечно-сосудистые и опухолевые заболевания (Ермаков и др., 2018).
Современный интерес к биологическому значению Se не ослабевает, его физиологические и биохимические функции четко определены, но создание и внедрение новых эффективных и безопасных препаратов протекает медленно, несмотря на массу апробированных средств.
В настоящее время доказано наличие целого семейства селенсодержащих глутатионпероксидаз, которые могут действовать и против различных органических гидропероксидов в самых различных клетках животных. Обнаружено около 30 селенопротеинов, каждый из которых играет немаловажную роль в клеточной биохимии (Turner, Finch, 1991).
Селенопротеинами, помимо Se-глутатионпероксидаз, являются три деиодиназы, несколько тиоредоксинредуктаз, селенофосфатсинтетаза 2, селенопротеин Р, W, T, M, R и ряд других биологически активных селенопротеинов, функция которых пока недостаточно изучена. Ряд Se-белков содержит селенидный лиганд к молибдоптериновому кофактору никотинатдегидрогеназы и ксантиндегидрогеназы. Se также может включаться в состав модифицированных азотистых оснований в тРНК (в виде 2-селено-5-метиламинометил-уридина) (Arthur, 2000; Patching, Gardiner, 1999; Behne, Reriakopoulos, 2001) (рис. 1).
Se необходим для роста клеток организма (Levander, Beck, 1999). Например, культуры иммунных и нервных клеток растут на бессывороточных средах только при добавлении селена, инсулина и трансферрина. Наиболее существенными биологическими функциями соединений Se являются: антиоксидантная, мембранопротекторная, иммунорегулирующая, эндокринная и антимутагенная.
Значение селена в профилактике и лечении вирусных заболеваний
Представляет интерес связь недостатка микроэлементов с этиологией вирусных заболеваний (Гусейнов, Сафаров, 2007). Так, установлена трансформация невирулентного РНК-ового вируса Коксаки типа В3 (CVB3/0) в вирулентный у мышей при содержании их на рационе с недостатком селена в результате необратимой мутации, связанной с видоизменением структуры генома (Beck et al., 1995; Levander, Beck, 1999). По-видимому, это имеет непосредственное отношение к миопатии – эндемической болезни Кешана, распространенной в районах КНР и РФ с недостатком селена в среде (Ermakov, Jovanović, 2010a).
Установлены определенные микроэлементные взаимодействия хозяин-паразит, хозяин-микроорганизмы. Известно, что организм человека и животных аккумулирует необходимые микроэлементы, такие как Fe, Mn, Cu и Zn, с конкретными соединениями (включая белки) и используя в процессе борьбы с патогеном. Таким образом, пул микроэлементов отражается на устойчивости к инфекции. Статус Se также может влиять на взаимодействие хозяин-патоген, но патогены обладают механизмами противодействия этой защитной способности хозяина. Как микроорганизмы, так и паразиты (гельминты) весьма устойчивы к воздействию особо высоких и, следовательно, токсичных уровней ионов металлов (Gabrashanska et al., 2016). Вторичный защитный механизм обусловлен продуцированием иммунными клетками хозяина реактивного кислорода и азота, что может привести к повреждению клеток тканей и органов хозяина. Кроме того, газотрансмиттеры оксида азота (оксидант) и оксида углерода косвенно участвуют в других метаболических процессах, связанных с реализацией иммунного ответа.
Доказательства важной роли Se в возникновении и развитии СПИДа получены в ряде исследований. Вначале было замечено, что распространение СПИДа географически связано с областями низкого содержания Se в почвах. В Африке в селенодефицитных областях инфекция ВИЧ приобрела пандемический характер, и от СПИДа страдает свыше четверти населения (Гусейнов, Сафаров, 2007).
При пониженном уровне Se наблюдается повышенная смертность от СПИДа. Исследования, проведенные Э. Тэйлором, также показывают, что СПИД, саркома Карпоши и другие раковые образования более распространены в областях с селенодефицитными почвами, и что это справедливо, по-видимому, не только применительно к Африке, но и к распространению СПИДа во всем мире (Taylor, 1997; Taylor et al., 2000).
Дефицит Se в значительной мере влияет на выживание пациентов, зараженных ВИЧ. Об этом впервые сообщила группа исследователей, возглавляемая Марианной К. Баум из Университета Майами, США. Было обнаружено, что зараженные ВИЧ-1 пациенты с дефицитом Se, умирают от связанных с ВИЧ причин в 20 раз чаще, чем пациенты с адекватными уровнями селена. Из всех исследованных веществ Se имел наиболее сильно выраженный сдерживающий эффект на число смертельных исходов при заболевании СПИД. Авторы предположили, что взаимосвязь между дефицитом Se и смертностью при СПИД связана с ролью Se, как антиоксиданта и/или его воздействием на регуляцию активности генов в ответ на ВИЧ-инфекцию (Urban, Jarstrand, 1986; Turner, Finch, 1991; Taylor et al., 1997a; Zhao et al., 2000).
E. Тэйлор предположил, что важную роль в регулировании проявления ВИЧ, должны играть селенопротеины, а именно, глутатионпероксидаза. Он предложил новый вирусный механизм, согласно которому ВИЧ вызывает снижение уровня Se в организме, ускоряя прогрессирование болезни: в то время как нормальный уровень Se, возможно, предотвращает размножение вируса, что отражается на ослаблении развития болезни (Taylor et al., 1997b). Впоследствии, чтобы доказать, что часть генома ВИЧ-1 действительно кодирует селеноэнзим глутатионпероксидазу млекопитающих, Е. Тэйлор и соавторы клонировали этот гипотетический ВИЧ-1 ген и инъецировали его в почечные клетки собаки и клетки МСР7 (Taylor, 1997; Taylor et al., 1997a). В обоих случаях в клетках, приобретших ген ВИЧ-1, сильно увеличился синтез селеноэнзима глутатионпероксидазы. Это убедительно доказывает, что ВИЧ-1 (и вероятно также ВИЧ-2, вирус Коксаки В, вирусы гепатитов В и С) способны производить глутатионпероксидазу для своих функций. В свете этих данных, казалось бы, логично ожидать, что инфекции от них будут минимальными в регионах с высоким содержанием Se. Однако в действительности появились многочисленные свидетельства обратного – высокое диетическое потребление Se приводит к большей устойчивости организма ко всем указанным вирусам (Clark et al., 1986; Combs, Gray, 1998).
Сравнивая данные по заболеваемости ВИЧ в РФ (Коронавирус, 2020), Se-статусу регионов России (Ermakov, 2001) и среднему содержанию Se в зерне (Голубкина и др., 2017) и сыворотке крови жителей страны (Голубкина и др., 2017; Голубкина, Папазян, 2006), не было установлено существенной корреляции. Так, для 20 субъектов РФ коэффициент корреляции между заболеваемостью ВИЧ (% заболеваемости от всего населения субъектов РФ), бальной оценкой статуса Se и средней концентрацией Se в зерне оказалось слабой (r = –0.340 и –0.288, соответственно). Связи между заболеваемостью и средним содержанием Se в сыворотке крови не выявлено (r = –0.01).
Для взрослых и детей, болеющих СПИДом, характерны как резкий недостагок Se в плазме крови, так и сниженное число Т-хелперов или CD4 клеток, а известно, что эти лимфоциты являются основной мишенью действия ВИЧ. Г. Фостер (Foster, 2002) утверждает, что падение уровня Se вызывает сокращение СD4 клеток, что, в свою очередь, вызывает снижение Se в сыворотке крови.
Г. Фостер (Foster, 2002) отмечает, что и некоторые другие вирусы, подобно ВИЧ, снижают содержание Se, причем их геном также содержит ген человеческого фермента глутатионпероксидазы, что позволяет вирусу неограниченно размножаться, истощая глутатион организма хозяина, который является ингибитором обратной транскриптазы – фермента, необходимого для репликации вируса. Эта группа вирусов включала ВИЧ-1 и ВИЧ- 2, а также, вирус Коксаки В и вирусы гепатитов В и С (Beck et al., 1995; Taylor, 1997; Levander, Beck, 1999; Foster, 2002; Гусейнов, Сафаров, 2007).
Биологическая роль Se неоднократно подчеркивалась при изучении вирусных инфекций, обусловленных COVID-19 (Mehri, Marjan, 2013). Так, ученые университета Суррея (КНР) установили достоверную корреляцию между содержанием Se в рационе и процентом выздоровления или летальных исходов пациентов с болезнью COVID-19. В провинциях с высоким содержанием Se в почве наблюдалась меньшая смертность от коронавируса COVID-19 по сравнению с районами, где наблюдается дефицит этого микроэлемента (Zhang, Liu, 2020; Zhang et al., 2020) (рис. 2).
Рис. 2.
Корреляция между частотой излечения COVID-19 в 17 городах за пределами Хубэя, Китай,
18 февраля 2020 г. и селеновым статусом городского населения (концентрация селена
в волосах) анализировалась с использованием взвешенной линейной регрессии (среднее
значение ± SD = 35.5 + 11.1, R2 = 0.72, F-тест P < 0.0001). Каждая точка данных представляет собой степень излечения, рассчитанную
как число вылеченных пациентов, деленное на число подтвержденных случаев, выраженное
в процентах. Размер маркера пропорционален количеству случаев.  95% Ди; __ подобранные значения; O – степень излечения (Zhang et al., 2020).
95% Ди; __ подобранные значения; O – степень излечения (Zhang et al., 2020).
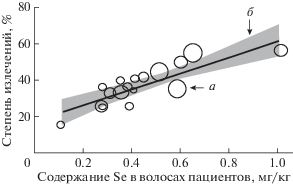
Недостаток Se в рационе больных COVID-19 способствует мутациям, репликации и вирулентности РНК-вирусов. Соединения Se полезны для восстановления антиоксидантной способности хозяина, снижения апоптоза и повреждения эндотелиальных клеток, а также агрегации тромбоцитов. Кроме того, по-видимому, низкий статус Se является распространенным явлением в условиях риска развития тяжелой формы COVID-19, особенно у пожилых людей (Hiffler, Rakotoambinina, 2020).
Экологические причины дефицита селена
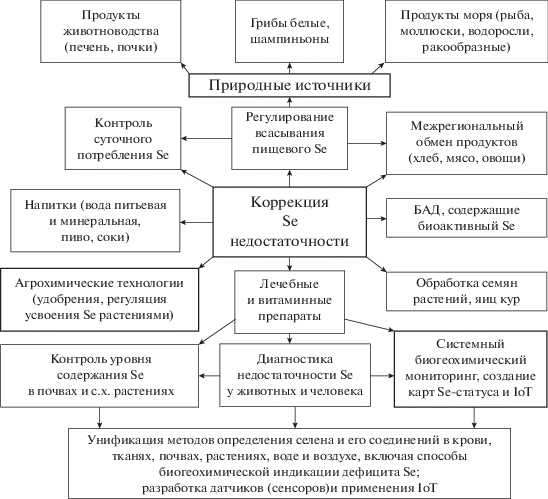
Общепризнано, что наиболее сильно загрязняет воздух промышленное производство – сжигание углеводородов для нужд энергетики (образование золы), а также выхлопные выбросы различных двигателей, в том числе, автомобилей, самолетов, мотоциклов. Снижение уровня Se в сыворотке крови можно наблюдать у жителей крупных промышленных городов и работников химической промышленности (Голубкина и др., 2017).
В целом, три главных фактора вносят вклад в дефицит Se в почве. Кислотные дожди, вызванные большими количествами серы и азота в воздухе изменяют способность почвы связывать биологичски активные химические элементы. Изменение баланса рН увеличивает биодоступность одних химических элементов (в основном токсичных) и уменьшает биодоступность других – таких, как Se, Zn, Mg. Подкисление почв и природных вод понижает содержание Se и Zn в глобальной цепи питания, что, вероятно, может оказать влияние на рост числа раковых заболеваний, СПИДа и CODID-19.
В целом, уровень содержания Se в биогеохимической пищевой цепи связан с проявлением эндемических Se-дефицитных патологий. Существенная роль в снижении экологического статуса Se в биосфере принадлежит техногенной составляющей. В частности, в условиях интенсивного использования фосфорсодержащих удобрений и экстенсивного земледелия снижается усвоение микроэлемента растениями (Ермаков, 2012; Голубкина и др., 2017). Se-дефицитное состояние усугубляется избытком As и тяжелых металлов (антагонистов Se), поступающих в ландшафты в результате разработки многочисленных полиметаллических месторождений и других техногенных процессов (Ermakov, Jovanovic, 2010a; Бигалиев, 2018; Radosavljević et al., 2018). Повышение кислотности почвы влияет на качество почвы, что приводит к увеличению подвижности ионов тяжелых металлов и алюминия. Это увеличивает скорость выщелачивания ионов тяжелых металлов из почвы и их поглощения корневой системой растений. Интенсивность поглощения тяжелых металлов растениями зависит не только от содержания металлов в почве, но и от взаимодействия с ионами других металлов. В связи с повышением кислотности почвы происходит увеличение подвижности и миграция микроэлементов из почв и закисление природеых вод (Моисеенко, 2009).
Таким образом, снижается питательная ценность сначала растительных культур, а затем и пищевых продуктов. Пищевые цепи содержат все меньше биологически важных химических элементов.
Полагают, что при ухудшении экологической обстановки, недостатке белка и витаминов в рационе питания человека, а также при дефиците необходимых макро- и микроэлементов в продуктах питания, происходит снижение Se статуса населения на фоне общего ослабления иммунитета (Keen, Gershwin, 1990).
Роль пищевых добавок в предотвращении и лечении болезни очевидна. Люк Монтанье (Montagnier, 1999) утверждает, что СПИД характеризуется устойчивым окислительным дисбалансом и уменьшением уровня глутатиона в крови пациентов. Это усиливает окислительный стресс. Ученый полагает, что антиоксиданты полезны для подавления репликации вируса и апоптоза у пациентов со СПИДом.
С целью коррекции Se-дефицитных состояний и повышения иммунитета используют различные препараты Se в составе поливитаминов и биологически активных добавок (БАД) (рис. 3). При этом наиболее эффективным является селенит натрия, несмотря на его очевидную токсичность (Галочкин, Галочкина, 2011). Селенит натрия, но не селенат, может окислять SH-группы в дисульфидной изомеразе вирусного белка, что делает неспособным вирус проникать через здоровую клеточную мембрану (Kieliszek, Lipinski, 2020). В терапии вирусных патологий используют и другие антиоксиданты (витамин Е, кверцетин розмариновая кислота и лютеолин) в сочетании с антивирусными, антибактериальными и иммуномодулирующими средствами (Крылова, и др., 2016; Magagnoli at al., 2020; Zhang, Lie, 2020; Zhang et al., 2020; Yao et al., 2020).
COVID-19 в России и селеновый статус
Для оценки связи вирусной падемии и Se-статуса использовали информацию по заболеваемости ковидом-19 на территории России от 05.06.2020 г. (Коронавирус, 2020) и от 29.01. 2021 г. (Коронавирус, 2021). Бальная оценка экологического статуса различных регионов РФ проводилась по разработанной ранее схеме (Ermakov, 2001), учитывая, содержание Se в травянистых растениях (укосы), в поверхностных и подземных водах, годовое количество осадков и распространение беломышечной болезни сельскохозяйственных животных. Число баллов по регионам изменялось от 9 до 40. Кроме того, заболеваемость COVID-19 сравнивалась со средней концентрацией Se в сыворотке крови жителей РФ по существующим данным (Голубкина и др., 2017; Голубкина, Папазян, 2006).
Ряды чисел включали 52 административные единицы. Результаты исследований по связи степени заболеваемости COVID-19 за 05.09.2020 г. с использованием программы Ms-Excel 2013, показали слабую отрицательную связь проявления патологии с Se-статусом территорий. Коэффициент корреляции между заболеваемостью ковидом-19 жителей России и статусом оказался равным – 0.362. При этом связи между заболеваемостью и содержанием Se в сыворотке крови не наблюдалось (r = +0.049).
Сопоставление заболеваемости населения в 52 субъектах РФ по данным на 29.01.2021 г. (Коронавирус, 2021) с Se-статусом позволило выявить явную отрицательную корреляцию (r = –0.726). Однако между заболеваемостью COVID-19 (число случаев на 1000 жителей РФ) и средним содержанием Se в сыворотке крови корреляция была слабой (r = –0.344) (рис. 4). Она оказалась слабой и при сопоставлении заболеваемости со средним содержанием Se в зерне (r = –0.165) (Голубкина и др., 2017).
Рис. 4.
Соотношение числа жителей России, заболевших COVID-19 (а), средней концентрации селена в сыворотке крови человека (б) и бальной оценки селенового статуса Se субъектов РФ (в). 1 – Московская обл., 2 – Нижегородская обл., 3 – Свердловская обл., 4 – Ростовская обл., 5 – Воронежская обл., 6 – Красноярский край, 7 – Архангельская обл., 8 – Иркутская обл., 9 – Хабаровский край, 10 – Челябинская обл., 11 – Вологодская обл., 12 – Мурманская обл., 13 – Саратовская обл., 14 – Ставропольский край, 15 – Самарская обл., 16 – Пермский край, 17 – Алтайский край, 18 – Омская обл., 19 – Приморский край, 20 – Республика Карелия, 21 – Забайкальский край, 22 – Оренбургская область, 23 – Краснодарский край, 24 – Вологодская обл., 25 – Пензенская обл., 26 – Кировская обл., 27 – Новосибирская обл., 28 – Ленинградская обл., 29 – Республика Бурятия, 30 – Кемеровская обл., 31 – Псковская обл., 32 – Брянская обл., 33 – Тверская обл., 34 – Тульская обл., 35 – Тюменская обл., 36 – Ярославская обл., 37 – Белгородская обл., 38 – Ивановская обл., 39 – Калужская обл., 40 – Астраханская обл., 41 – Республика Башкортостан, 42 – Новгородская обл., 43 – Владимирская обл., 44 – Смоленская обл., 45 – Рязанская обл., 46 – Чувашская Республика, 47 – Кабардино-Балкарская Республика, 48 – Костромская обл., 49 – Республика Татарстан, 50 – Курганская обл., 51 – Республика Северная Осетия-Алания, 52 – Республика Марий Эл.
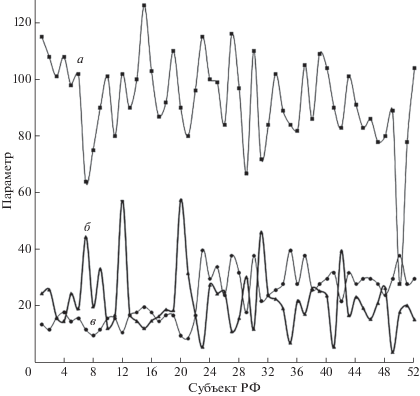
Отсутствие связи между проявлением вирусной патологии и концентрацией Se в сыворотке крови, по-видимому, связано с тем, что содержание Se в крови человека и животных варьирует в зависимости от пищевого статуса микроэлемента. Se-статус, как интегральный параметр, отражающий уровень содержания Se в среде, более консервативен. Он соответствует более существенной части суточного потребления Se, зависящего от содержания микроэлемента в среде (местные сельскохозяйственные продукты, вода). В этом случае на Se-статус определенное влияние оказывает неконтролируемое потребление его в организм человека за счет продуктов, импортируемых из других регионов и государств. Тем не менее, Se-статус изменяется меньше, чем концентрация микроэлемента в крови.
Следует отметить, что Se статус в рамках административных единиц может быть весьма пестрым. В пределах относительно нормальных по уровню селена территорий могут встречаться участки с очень низким или даже повышенным содержанием селена в биогеохимических пищевых цепях. Подобная ситуация характерна для Красноярского края, Челябинской области, Хабаровского края, Карелии, Тувы (Ермаков, Ковальский, 1974; Ermakov, Jovanovic, 2010; Голубкина и др., 2017).
Различие полученных результатов оценки связи вирусной патологии с Se-статусом в 2020 и 2021 гг., по-видимому, связано с характером распространения пандемии и ростом заболеваемости в 2021 г.
Следует заметить, что для оценки соотношения между заболеваемостью и Se-статусом более рационально использовать известный биогеохимический индикатор – содержание микроэлемента в волосяном покрове животных и волосах человека. Именно этим воспользовались китайские ученые (Zhang et al., 2020). При этом биоматериал был получен непосредственно у больных пациентов. Заметим, что при диагностике Se-микроэлементозов у сельскохозяйственных животных этот метод оказался успешным (Ermakov, Usenko, 2004). Однако применение данного маркера для диагностики недостаточности Se в организме человека сдерживается недостаточностью систематизированных данных.
ЦИНК
Биологическая роль цинка
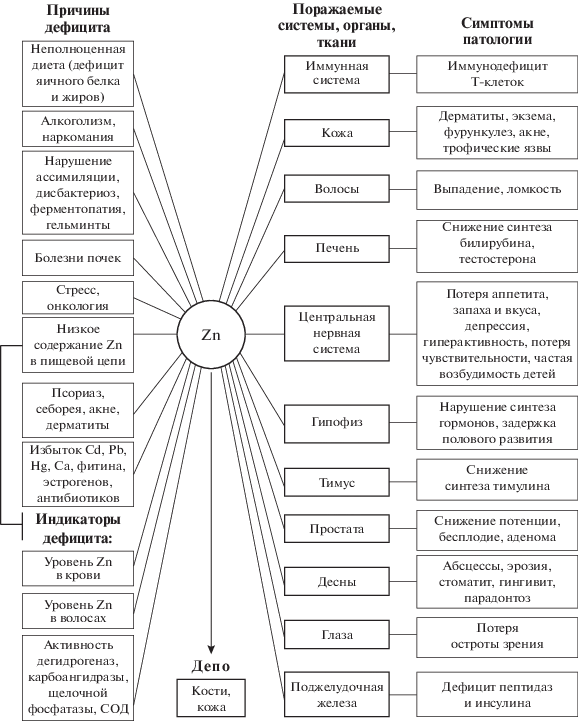
Цинк – жизненно важный микроэлемент для всех организмов (Риш, 2003; Chasapsis et al., 2012; Ермаков и др., 2018). Он не только присутствует в растениях, животных и организме человека, но и участвует в реализации жизненно важных функций, отраженных на рис. 5. Млекопитающие умеренно поддерживают пул Zn за счет регуляции его всасывания в кишечнике, взаимодействия с глутатионом и металлотионеинами. Именно избыток Zn в клеточном цитозоле индуцирует синтез металлотионеинов, обеспечивая его относительный гомеостаз (Gibson, Ferguson, 1998).
Если токсическое действие избытка цинка в организме встречается крайне редко, то дефицит этого микроэлемента наблюдается часто. К патологиям, связанным с недостатком Zn в среде и продуктах питания относят ряд гормональных заболеваний, задержку роста, анорексию, патологии кожи, расстройства функций воспроизведения, пищеварения, алкоголизм, серповидноклеточную анемию, почечную недостаточность, ряд заболеваний печени, болезнь Крона и желудочно-кишечные расстройства.
Дефицит Zn может возникать в результате недостаточного употребления продуктов, содержащих микроэлемент, или недостаточного всасывания в кишечнике. Большинство продуктов, богатых Zn, имеют животное происхождение. Пищевая клетчатка и фитаты, входящие в состав таких продуктов питания, как злаки и бобовые, связываются с Zn и ухудшают его всасывание (Ruel et al., 1997). Дети с симптомами дефицита Zn подвержены повышенному риску задержки роста и развитию диареи, а также таких респираторных заболеваний, как острые инфекции нижних дыхательных путей (Black, 2003). Результаты ряда исследований позволяют предположить, что назначение Zn может снижать число случаев и степень тяжести бронхиолита и пневмонии у детей (Aggarwal et al., 2007).
Особую роль Zn играет в процессах, связанных с иммунитетом и блокированием бактериальных и вирусных патологий (Keen, Gershwin, 1990; Tang et al., 1996). Полагают, что Zn снижает восприимчивость к острым инфекциям нижних дыхательных путей, поскольку регулирует различные функции иммунной системы, включая защиту целостности клеток дыхательных путей при воспалении или повреждении легких (Bao, Knoell, 2006). Благоприятные последствия приема препаратов Zn были установлены в Южной Азии, где детям назначали не менее 70 мг Zn в неделю. В ходе других экспериментов было показано, что назначение Zn снижает распространение пневмонии (Haider et al., 2006). Однако обобщение результатов опытов по применению препаратов Zn при лечении острых инфекций нижних дыхательных путей, включая пневмонию, показало неоднозначность терапевтического эффекта (Turner et al., 2000; Takkuoche, 2002; Brooks et al., 2005).
Известно, что Zn участвует в передаче генетической информации практически на всех ее этапах. Он является незаменимым компонентом свыше 20 ДНК- и РНК-полимераз и может сам функционировать в качестве неэнзиматической полимеразы in vitro. Zn входит также в состав свыше 200 содержащих “цинковые пальцы” белков, регулирующих генетические процессы и выполняющих в большинстве случаев функцию факторов активации транскрипции. Эта функция заключается обычно в том, что Zn пальцы, узнавая определенные последовательности ДНК, обеспечивают связывание с ними специфических регуляторных белков. Zn является также компонентом аминоацил-тРНК-синтетаз и фактора трансляции ЕF-1 (Dardenne, Jean-Marie, 1994; Rink, Kirchner, 2000; Риш, 2003).
Необходимость Zn для иммунной системы была известна на протяжении десятилетий. Недостаток Zn часто сочетается с иммунодефицитом (Rink, Kirchner, 2000). Как правило, различают общее влияние Zn на клеточный цикл и пролиферацию и специфическое воздействие на клетки иммунной системы (Dardenne, Jean-Marie, 1994). Установлено снижение количества Т-клеток вследствие атрофии тимуса, вызванной снижением синтеза тимулина – гормона тимуса, который активен в его Zn-связанном состоянии (рис. 6).
Тимулин участвует в дифференциации Т-клеток. Влияние дефицита Zn на систему B-лимфоцитов является менее выраженным. Количество моноцитов/макрофагов и дендритных клетках увеличивается при дефиците Zn, поскольку дефицит Zn способствует дифференциации миелоидных клеток в моноцитах/макрофагах, а также в дендритных клетках созревания. При этом дифференциация нейтрофилов не зависит от Zn дефицита (Render et al., 2015).
Принципиальная клиническая особенность острого дефицита Zn у человека – задержка роста. Она также приводит к нарушению иммунной системы, к аллергии, потере запаха и вкуса, выпадению волос, белым пятнам под ногтями, к болезням кожных покровов и нарушению сна (рис. 6). Последствия маргинального или слабого дефицита Zn менее очевидны и могут быть легко преодолены. Снижение темпов роста и ослабление устойчивости к инфекции часто являются единственными проявлениями слабого дефицита цинка у человека.
Симптомы токсичности возникают при повышенном потреблении Zn (4–8 г) и могут нанести вред иммунной системе. Кроме того, было показано, что длительное воздействие высоких доз потребления Zn приводит к нарушению обмена веществ и других микроэлементов. Как правило, при избытке Zn в организме может возникнуть дефицит Cu (Chan et al., 1998).
Взаимодействие Zn, вызванное высоким потреблением Fe, усиливается при увеличении потребления аскорбиновой кислоты. Отрицательное воздействие Zn на усвоение Fe наблюдается при соотношении Fe : Zn 2 : 1. Всасывание Fe снижается при недостатке витамина С и избытке фитата в рационе. Возможно, антагонизм зависит не от общего уровня Fe, а от доли Fe, присутствующего в окисленной или восстановленной форме (Sandstrom, 1985). При лечении сердечно-сосудистых заболеваний наблюдается синергизм Se и Zn (Gać et al., 2020). Однако, большие дозы Zn, назначаемые взрослым пациентам, приводили к гипокупремии (Prasad et al., 1978).
Необходимо отметить, что Zn и Fe присутствуют в организме млекопитающих практически в одних и тех же количествах. Кроме того, потребление Zn не должно превышать 100 мг/сут. Потребление Fe в больших количествах может привести к тошноте, диарее, головокружению, сонливости и галлюцинациям (Mehri, Marjan, 2013).
Основные источники Zn: красное мясо, птица, рыба, зерновые, орехи, яйца и семена. Зеленые листовые овощи и фрукты являются слабыми источниками Zn из-за высокого содержания воды (Ермаков и др., 2018).
Полагают, что канцерогенное действие тяжелых металлов, замещающих Zn в факторах транскрипции, объясняется генерированием свободных радикалов, повреждающих ДНК. В настоящее время ведется конструирование искусственных факторов транскрипции с Zn пальцами, распознающими известные последовательности ДНК (ТАТА-бокс и сайт связывания p53) или синтетических олигонуклеотидов длиной 18–27 нуклеотидных остатков. Создание искусственных факторов транскрипции, позволяющих адресно регулировать экспрессию определенных генов, открывает принципиально новые подходы в области молекулярно-генетических исследований и лечении широкого круга заболеваний, включая рак (Риш, 2003; Chasapis et al., 2012).
Цинк и вирусы
Zn модулирует противовирусный и антибактериальный иммунитет и влияет на воспалительные реакции в организме человека и животных. Несмотря на отсутствие широких клинических исследований, существуют данные о том, что модуляция цинкового статуса может быть важной при COVID-19. Так, опыты in vitro показывают, что Zn2+ обладает противовирусной активностью за счет ингибирования РНК-полимеразы SARS-CoV-2. Этот эффект может лежать в основе терапевтической эффективности хлорохина, известного как ионофор Zn. Косвенные данные также указывают на то, что Zn2+ может снижать активность ангиотензин-превращающего фермента 2 (ACE2), являющегося рецептором для вируса SARS-CoV-2 (Риш, 2003; Chasapis et al., 2012). Усиление противовирусных иммунных реакций, активируемых Zn, может происходить в результате повышения синтеза некоторых компонентов интерферона. При этом Zn, обладая противовоспалительной активностью, в ряде случаев способствует снижению развития бактериальной инфекции. Благодаря своим иммуностимулирующим свойствам, Zn входит в число БАД, используемых при ОРВИ.
В связи с возникшей пандемией, вызванной коронавирусом COVID-19, соединения Zn и Se в сочетании с другими препаратами (хлорохин, гидроксихлорохин) проходят испытания в ряде стран для снижения патологических проявлений заболевания. Ученые подчеркивают, что комбинация Zn и транспортной молекулы, содержащей Zn, облегчает проникновение его в клетки, эффективно подавляя репликацию РНК-вирусов (Te Velthuis et al., 2010). Представляет интерес комбинация соединений Zn с флавоноидами (квертицин). По-видимому, в данном случае усиливается антиоксидантное действие препаратов при развитии патологий, обусловленных как бактериями, так и вирусами. Однако существуют неоднозначные заключения (Magagnoli et al., 2020).
МЕДЬ
Биологическая роль меди
Недостаток Cu, изменяя активность многих ферментов, вызывает значительные нарушения процессов обмена веществ, например, обмена липидов (снижение количества сфингомиелина и ацетальфосфатидов в белом веществе головного и спинного мозга, нарушение миелинизации центральной нервной системы), хромопротеидов (падение концентрации гемоглобина, частично в связи с задержкой созревания эритроцитов и уменьшения продолжительности их жизни), синтеза эластина и коллагена (повреждение соединительной ткани, разрыв аорты и сердечных сосудов), пуринового обмена (возможно повышение активности ксантиноксидазы, образования мочевой кислоты, активности уратоксидазы), угнетение окисления большинства субстратов цикла трикарбоновых кислот (цитрата, малата, α-кетоглутарата, пирувата и других (Kovalskii, 1977; Ермаков и др., 2018).
Снижение функции окислительных ферментов при недостатке Cu вызывает нарушение многих процессов обмена веществ. Организм животного вовлекается в порочный круг взаимосвязанных реакций, что приводит к возникновению эндемического заболевания атаксии, поражающей овец, особенно новорожденных ягнят, крупный рогатый скот, буйволов. При этом в головном и спинном мозге образуются полости за счет ослабления синтеза сфингомиелина и ацетальфосфатидов, а также благодаря понижению окислительных процессов, снижения окисления сульфгидрильных групп нейрокератина в дисульфидные, что открывает доступ к тканевым протеолитическим ферментам (табл. 1)
Таблица 1.
Физиолого-биохимическая характеристика меди
| Открытие необходимости | Hart et al. (1928) |
| Биологическое значение | Цитохром-С-оксидаза, церулоплазмин, супероксиддисмутаза, тирозиназа, лизидоксидаза, моноаминооксидаза |
| Всасывание | >20% от поступаемого количества в желудке и тонком отделе кишечника |
| Выделение | С желчью и мочой, видовая специфичность |
| Антагонисты | S, Mo, Cd, Pb, Fe, P, Ca, Ag, витамин С, фруктоза |
| Минимальная потребность | Животные с однокамерным желудком – 4 мг/кг сухого корма; жвачные – 8 мг/кг сухого вещества; человек – <1 мг/день; рекомендация для взрослых – 1 мг/день |
| Симптомы недостаточности | Снижение потребления кормов, замедление роста, анемия, ранняя смертность эмбрионов, абортирование плода, отек, атаксия, изменения скелета, изменения сосудов, депигментация волос, нарушение синтеза кератина, нервные расстройства, нарушение синтеза миелина, нерегулярные продолжительные интервалы течки, диарея, ослабление иммунной системы |
| Индикаторные органы | Головной мозг, печень, сыворотка крови, волосы |
| Области недостаточности | Заболоченные участки, торфяные массивы, участки песчаного делювия, граниты |
| Избыток | Чрезвычайно чувствительны овцы: 15 мг/кг сухого рациона; крупный рогатый скот – 100 мг/кг сухого корма; свиньи – >250 мг/кг сухого рациона |
| Генетические дефекты | Синдром Menke (Cu-недостаточность), болезнь индийских детей, наследственная медная интоксикация (болезнь Willson) |
У новорожденных ягнят развиваются тяжелые, необратимые морфологические изменения в нервной системе: полушария напряжены, извилины сглажены, белое вещество головного мозга набухает, в нем обнаруживаются полости. Наблюдается повреждение сосудов мозга (нарушение проницаемости стенок, застой, дистония). На этой почве также могут образовываться полости и отек мозга, что нарушает тканевое дыхание. Отмечается комбинированное поражение двигательных и чувствительных путей. При гистологическом исследовании периферической нервной системы обнаружены дистрофические и некробиотические изменения спинальных ганглиев, периферических нервных стволов и их разветвлений в мышцах. Нарушение обмена меди и окислительных процессов в тканях центральной нервной системы, а также патолого-морфологические изменения в них отражают клинические симптомы эндемической атаксии: при стоянии ягнят неустойчивость задней части туловища, при ходьбе – некоординированность движений, судороги, параличи (Гиреев, 1968).
Гомеостаз Cu регулируется сложной системой транспортеров Cu и белков-шаперонов. Медная недостаточность – это преимущественное нарушение синтеза окислительных ферментов. Благодаря этому происходит вовлечение в патологический процесс многих обменных процессов, весь организм охватывается заболеванием. Эндемия поражает 1–27% (максимум 46%) всего поголовья овец, а смертность достигает 70–80% от числа заболевших. Введение в организм солей меди может предупредить развитие болезни (Anke et al., 1996).
С другой стороны, существуют патологии животных, связанные с избытком Cu в кормах и среде (Bath, 1979). Это различные формы “медной желтухи” (энзоотической желтухи). При избытке Cu происходит ее аккумуляция в печени с последующим внезапным разрушением эритроцитов и резким повышением концентрации билирубина. Заболевание является хроническим и характеризуется высоким внезапным летальным исходом, желтухой, анемией, гемоглобинией, гемоглобинурией, метгемоглобинией и глубокой пигментацией почек. При этом концентрация Cu у павших животных (овец) повышается до 700 мкг/г. С профилактической целью эффективны соли молибдена (Rish, 2001; Harr et al., 2002). Соединения Cu в высоких концентрациях токсичны также для некоторых гидробионтов, растений и микроорганизмов (Моисеенко, 2009).
Токсичность Cu при ее избытке в рационе связана с патогенезом нарушения функции печени, нейродегенеративных изменений и других патологических состояний. Она может возникать при нарушении гомеостаза Cu. Способность инициировать окислительное повреждение чаще всего относят к Cu-индуцированной клеточной токсичности. Полагают, что токсичность Cu сопровождается нарушением липидного обмена, экспрессией генов, агрегацией альфа-синуклеина, активацией кислой сфингомиелиназы и высвобождением церамида, изменением пространственного распределения Cu в гепатоцитах и белках нервной глии (Gaetke et al., 2014).
Cu оказывает существенное конкурирующее влияние на метаболизм Fe и Mo. Наряду с Zn, Cu включается в фермент супероксид-дисмутазу, участвуя таким образом в блокировании избытка высокотоксичных кислородных радикалов, образующихся в процессе метаболизма веществ, Супероксид-дисмутаза (СОД, КФ 1.15.1.1) относится к группе антиоксидантных ферментов, катализирует дисмутацию супероксида в кислород и пероксид водорода, а также препятствует окислению ряда биологически активных веществ (Ermakov et al., 2016). Определение активности СОД в крови животных и человека имеет важное диагностическое значение при развитии ряда патологий. При этом большую роль в активности СОД играет уровень Cu и Zn.
Антимикробные и противовирусные свойства меди
Антимикробные свойства Cu известны человечеству с глубокой древности. Медный купорос оказался эффективным фунгицидом, и он используется для пропитки древесины в строительстве. Оказалось, что бактерицидными свойствами обладает медная посуда. Медные чаши для питья использовали в древней Индии. И до сих пор в этой стране для воды принято использовать посуду из меди. В США большинство водопроводных труб сделаны из меди и медных сплавов. Наибольшее распространение в строительстве Cu получила во время первой промышленной революции в конце XIX века. Металл широко использовали в отделке помещений и для декорирования интерьеров. Однако в ХХ веке на смену Cu пришли нержавеющая сталь и закаленное стекло, а затем – пластмассы.
В настоящее время установлено, что соединения Cu и наночастицы металла эффективны в борьбе с патогенными бактериями и вирусами. Так в экспериментах Филлис Дж. Кун в 1983 г. была доказана способность Cu к обеззараживанию поверхностей различных медьсодержащих предметов (Kuhn, 1983). Вместе с группой студентов она провела опыты по тампонированию ручек дверей и других предметов, изготовленных из различных материалов. После этого ватные тампоны помещали в чашки Петри и через несколько дней исследовали микрофлору. Оказалось, что медные поверхности были гораздо более чистыми, нежели стальные или пластиковые. Даже латунь, состоящая из 67% Cu и 33% Zn, убивала бактерии гораздо лучше, чем сталь или пластик. В результате экспериментов исследователи рекомендовали не избавляться от медных деталей интерьера, либо заменять их на аналогичные.
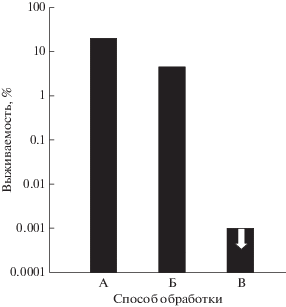
Эффективность Cu и медных сплавов в качестве противомикробных покрытий была оценена с использованием инвазии золотистым стафилококком Staphylococcus aureus. В этом случае на алюминиевые или стальные поверхности наносился микрослой наночастиц Cu посредством плазменного, электродугового и холодного напыления. После стерилизации на подготовленные пластины наносили суспензию, содержащую стафилококк от больных пациентов. Через 2 ч делали смывы с подложек и их аликвоты вносили на специальную среду в чашки Петри с последующим ростом колоний стафилококка (Champagne, Helfritch, 2013). Установлено, что способ холодного напыления показал преимущественную противомикробную эффективность, вызванную высокой скоростью напыляемых частиц при ударе, что приводит к высокой плотности дислокации и высокой ионной диффузии (рис. 7).
Рис. 7.
Выживаемость золотистого стафилококка на Al-диске с Cu-распылением после двухчасового воздействия. Обработка: А – плазменное напыление. Б – электродуговое напыление, В – холодное напыление (Champagnie, Heifritch, 2013).
В работе А.А. Рахметовой (2011) установлено, что антимикробное действие наночастиц Cu зависит от их содержания: в концентрациях от 1 до 10 мкг/мл наночастицы Cu образца № 1 оказывают бактерицидное действие в концентрации 0.5 мкг/мл – бактериостатическое, а при концентрации наночастиц 0.1 мкг/мл антимикробное действие не проявляется.
Спектр воздействия Cu на микроорганизмы весьма широк. Результаты независимых лабораторных исследований, проведенных по утвержденным EPA-протоколам (Агентство по охране окружающей среды, США), доказали, что на поверхности меди, латуни и бронзы в первые 2 часа контакта погибают более 99.9% таких бактерий, как:
• золотистый стафилококк (Staphylococcus aureus),
• аэробактер (Enterobacter aerogenes),
• кишечная палочка (Escherichia coli),
• синегнойная палочка (Pseudomonas aeruginosa),
• листерия моноцитогенная (Listeria monocytogenes),
• энтерококк, устойчивый к ванкомицину (Enterococcus faecalis (VRE)),
• резистентный к ванкомицину и метициллин-резистентный золотистый стафилококк (meticillin-resistant Staphylococcus aureus (MRSA)),
• клостридиума диффициле (Clostridium difficile),
• cальмонелла (бацилла Гартнера – Salmonella enteriditis)
• туберкулезная бацилла (Tubercle bacillus),
• акинетобактерия Бауманна (Acinetobacter baumannii).
Кроме того, Cu продемонстрировала способность к уничтожению аденовируса, грибка кандиды (Candida albicans), чёрной плесени (Aspergillus niger), вируса гриппа типа А и полиовируса. Другие материалы, даже серебросодержащие покрытия, не обладают подобной эффективностью. По мнению других авторов наночастицы Cu оказывают более выраженное ингибирующее воздействие на рост клинических штаммов золотистого стафилококка, чем суспензия наночастиц Fe. Степень ингибирования зависит также от дозы ультрадисперсных порошков и времени инкубации (Бабушкина и др., 2010; Molteni et al., 2010; Lemire et al., 2013; Warnes, 2014)
При этом поверхности из противомикробной Cu, латуни и бронзы обеспечивали продолжительное антибактериальное действие, которое не ослабевало в течение двух часов, уничтожая подавляющее большинство бактерий даже после влажного и сухого протирания и повторного загрязнения.
Механизм, с помощью которого Cu уничтожает бактерии, сложен, но эффект его прост. Ученые предположили, что влияние медных поверхностей на бактерии происходит в два последовательных этапа. Сначала проявляется взаимодействие между поверхностью Cu и наружной мембраной микроорганизма, в результате чего мембрана патогена разрушается. А на втором этапе через возникшие в мембране отверстия клетка микроорганизма теряет влагу и питательные вещества. При этом определенную роль в инактивации микрорганизмов играет трансмембранный потенциал клетки (Wobus et al., 2006; Griffith, 2012).
Спустя десятилетия в связи с проявлением вирусных пандемий ученые детально оценили роль Cu в обезвреживании различных вирусов, включая предшественника COVID-19, коронавируса 229E и собственно вируса COVID-19 (Warnes et al., 2015). Так, группа ученых во главе с Уильямом Кивил (William Keevil) предложила использовать медь в борьбе с коронавирусом: медными элементами следует оснастить как можно больше общественных мест. Целесообразно сделать из этого металла дверные ручки, лестничные перила, а также поручни в автобусах и поездах. При этом COVID-19 на медных поверхностях обезвреживается уже через четыре часа посредством ионов Cu, которые атакуют липидную мембрану вируса и, проникая внутрь, разрушают его нуклеиновую кислоту (Warnes et al., 2015).
Кроме медных материалов, в настоящее время начинают использовать наномедь как противовирусный препарат (Фролов, 2020). Ученые Национального исследовательского технологического университета – “МИСиС” во главе с Г. Фроловым синтезировали новый препарат “спиртозоль” для обработки индивидуальных средств защиты и различных поверхностей на основе Cu. Препарат представляет собой суспензию наночастиц Cu размером от 1 до 3 нм в растворе антисептика цетилпиридиния хлорида в этиловом спирте. При дезинфекционной обработке при влажном воздухе Cu на поверхности материала превращается в положительно заряженный ион гидроксида Cu, что обеспечивает необходимую защиту обработанных предметов от вирусов и других патогенов. В этом случае ионы гидроксида Cu являются “мягким” электрофильным реагентом, который вступает в химическое взаимодействие с серосодержащими структурами вируса, а также меняет рН-среды в кислую сторону. Это приводит к разрушению оболочки любого микроорганизма, в том числе и вириона. Однако в высокой концентрации они опасны так же и для клеток организма хозяина, могут вызывать раздражение кожных покровов. Ученые предлагают использовать препараты на основе ионов Cu и ее соединений в качестве сильного внешнего дезинфектора совместно с антисептиком цетилпиридинием хлоридом (Фролов, 2020).
ЙОД
Биологическое значение йода
Поступая с пищей в желудочно-кишечный тракт, соединения йода восстанавливаются до йодидов и всасывается в основном в тонком кишечнике. Всосавшийся йод с кровью разносится по организму, задерживается тканями, избыток депонируется в липидах. Основная часть его (до 60%) поглощается щитовидной железой и используется для синтеза гормонов. В щитовидной железе из йодидов крови под действием фермента йодидазы освобождается металлоидный йод. Молекулярный йод связывается с аминокислотой тирозином, образуются моно- и дийодтирозин, из которых синтезируются гормоны щитовидной железы – трийодтиронин (Т3) и тетрайодтиронин (Т4). Эти гормоны поступают в кровь, где связываются с глобулинами и альбуминами плазмы. Йодсодержащие гормоны щитовидной железы стимулируют синтез и повышают активность многих ферментов и таким образом участвуют в регуляции обмена веществ, физиологических процессов и функций (Rish, 2001; Ермаков и др., 2018).
Йод участвует в развитии и дифференцировке тканей. Он усиливает поглощение кислорода тканями и увеличивает коэффициент его использования. Активизирует теплопродукцию, синтез белков в клетках, повышает активность и внутриклеточное содержание циклического 3,5‑аденозинмонофосфата. Стимулирует трофические и иммунные процессы, эритропоэз, лейкопоэз, секреторную деятельность пищеварительных и молочных желез, синтез молочного жира, деятельность половых органов, развитие плода (Риш, 2003).
С недостатком йода в среде и организме млекопитающих связывают различные йод-дефицитные патологии. Одной из наиболее распространенных является эндемический зоб. Тем не менее, как отмечалось выше, эндокринная роль йода связана с селеном. Поэтому в метаболических и патофизиологических процессах оба микроэлемента взаимосвязаны. Патологии, связанные с избытком йода встречаются редко. Как правило, это в основном аллергические реакции (покраснение кожи, одышка, и др.) (Андрюков и др., 2015).
В настоящее время известны случаи применения йода в профилактике и терапии при пандемии COVID-19. Об уникальных бактерицидных свойствах йода известно давно (Kelly, 1961). Во время азиатского гриппа в 1957 г. использование краски Мандла (третман) предотвращало развитие гриппа. В группе, не получавшей третман, гриппом заболело 14%, по сравнению с 2.8% в группе, получавшей препарат. Кроме того, при уже развившемся гриппе начало приема йода после трех дней болезни значительно снизило число случаев по сравнению с контрольной группой, причем эффект проявился через два дня после начала приема третмана (Menon, 1957).
Патофизиологические исследования показывают, что йод может поддерживать врожденную иммунную систему в борьбе с бактериальными и вирусными инфекциями (Fischer et al., 2011; Derscheid et al., 2014). В 2013 году на новорожденных ягнятах, инокулированных респираторно-синцитиальным вирусом (RSV), было показано, что лечение йодом приводило к меньшему поражению легких и меньшей экспрессии антигена RSV в легких. Также на трехнедельных ягнятах было продемонстрировано, что добавление йода снижает тяжесть RSV-инфекции (Derscheid et al., 2014). Наконец, эпидемиологические данные показывают, что в условиях текущей пандемии COVID-19 у японцев, известных своим высоким потреблением йода, очень низкое количество летальных исходов от COVID-19 по сравнению с другими странами, несмотря на то, что в Японии проживает самое старое население в мире и политика изоляции до сих пор была достаточно мягкой (WHO, 2019).
Принимая во внимание вышеупомянутые патофизиологические, клинические и эпидемиологические данные исследователи предполагают, что йод является ключевым микроэлементом в оптимальном функционировании иммунной системы и может быть эффективен в борьбе с пандемией COVID-19 как в лечебных, так и в профилактических целях. Профилактика может быть легко достигнута благодаря очень ограниченным побочным эффектам и быстрому усвоению пероральных добавок. Кроме того, следует иметь в виду, что в настоящее время от йододефицита страдает треть населения мира (Verheesen, Traksel. 2020)
ЗАКЛЮЧЕНИЕ
Представленная работа отражает одну из стадий современного состояния биосферы – ее техногенное преобразование и нарастающие экологические проблемы. Несмотря на очевидные успехи в области генетики, молекулярной биологии и вирусологии, мы становимся свидетелями непредсказуемых заболеваний человека – тяжелых вирусных патологий.
С экологической точки зрения существующие проблемы еще раз подчеркивают единство и сложность взаимодействия отдельных групп организмов и жизненных кофакторов. Проявление вирусной пандемии COVID-19 рассматривается учеными как одна из стадий изменчивости РНК-содержащих вирусов в результате сочетания техногенной эволюции среды обитания, нарушения устоявшихся связей между различными организмами. COVID-19 – яркий пример генных мутаций, обусловленных экологическими и социальными факторами. Вслед за экологической генетикой начинает формироваться экологическая вирусология, где центральное место занимает взаимодействие хозяин – вирус. Механизмы, лежащие в основе таких взаимодействий, являются сложными и недостаточно изученными. Но роль геохимических факторов, как и других особенностей среды обитания организмов, здесь особенно важна.
Связь вирусных инфекций с биогеохимическими факторами показывает справедливость одной из концепций геохимической экологии – законе минимума. С одной стороны, геохимический фактор (в данном случае статус необходимых микроэлементов) обостряет жизненные связи между организмами в состоянии дефицита. С другой стороны, это происходит и в отношении избытка микроэлементов в биогеохимической пищевой цепи. Так, дефицит Se отражается на более высокой восприимчивости к РНК-вирусным инфекциям человека и более тяжелым исходом заболевания. Но при избытке селена в среде в организме человека и животных развивается токсикоз и наблюдается ослабление иммунитета.
Этот пример характерен не только для Se, но для других жизненно важных микроэлементов (Zn, Cu, I, Co). При этом токсические свойства металлов используются в создании антибактериальных и антивирусных технологий, что показано при взаимодействии вирусов и бактерий с поверхностью медных изделий, наночастицами металла и его растворимыми формами.
Приведенные выше факты участия микроэлементов в укреплении иммунитета, а также в предотвращении развития рака и некоторых опасных вирусных заболеваний (гепатит, геморрагическая лихорадка Эбола, COVID-19) свидетельствуют о новых гранях биологической роли микроэлементов. Как Se, так и Zn, Cu и I способствуют профилактике сердечно-сосудистых заболеваний, участвуют в регулировании репродуктивных функций и работы щитовидной железы, предупреждении развития катаракты и других заболеваний. Это, несомненно, указывает на важность жизненно необходимых микроэлементов в поддержании здоровья населения.
Однако, несмотря на ряд фактов о связи дефицита микроэлементов с проявлениями вирусных инфекций необходимы дополнительные более глубокие вирусологические, биохимические и эпидемиологические исследования. На данном этапе положительный эффект добавок микроэлементных препаратов при лечении некоторых вирусных патологий можно рассматривать как терапевтический.
Кроме того, в современных сложных геохимических условиях необходимы новые критериальные интегрированные оценки статуса микроэлементов.
Список литературы
Андрюков Б.Г., Гвозденко Г.А., Демьяненко Н.Б. (2015) Избыток йода в организме – экологический фактор риска развития аутоиммунных заболеваний щитовидной железы. Здоровье. Медицинская экология. Наука. 2(60), 6-16.
Бабушкина И.В., Бородулин В.Б., Коршунов Г.В., Пучиньян Д.М. (2010) Изучение антибактериального действия нано-частиц меди и железа на клинические штаммы Staphylococcus aureus. Саратовский научно-медицинский журн. 6(1), 11-14
Бигалиев А.Б. (2016) Экологическая генетика. Алматы: Эверо, 216 с.
Вернадский В.И. (1940) Бактериофаг и скорость передачи жизни в биосфере // Вернадский В.И. Биогеохимические очерки. 1922–1931. М.-Л.: изд-во АН СССР, 118-125.
Галочкин В.А., Галочкина В.П. (2011) Органические и минеральные формы селена, их метаболизм, биологическая доступность и роль в организме.Cельскохозяйственная биология. (4), 3-15.
Гиреев Г.И. (1968) Биологическая роль микроэлемента меди в метаболизме нуклеиновых кислот в организме животных. Доклады РАСХН. (8), 24-27.
Голубкина, Н.А., Папазян. Т.Т. (2006) Селен в питании. Растения, животные, человек. М.: Печатный город. 254 с.
Голубкина Н.А. Синдирева А.В., Зайцев В.Ф. (2017) Внутрирегиональная вариабильность селенового статуса населения. Медицинская экология. 12(1), 107-127.
Гусейнов В.Г., Сафаров Н.С. (2007) Селен и некоторые вирусные заболевания. Биомедицина. (2), 3-6.
Ермаков В.В. (2012) Эволюция биогеохимических провинций в России. Изменение природной среды в XX в. (ответ. ред. В.М. Котляков, Д.И. Люри). М.: Молнет, 307-321.
Ермаков В.В., Ковальский В.В. (1974) Биологическое значение селена М.: Наука, 300 с.
Ермаков В.В., Тютиков С.Ф., Сафонов В.А. (2018) Биогеохимическая индикация микроэлементозов. М.: издание РАН, 386 с.
Ермакова Г.И., Тарасевич Л.М. (198) Применения метода флюоресцирующих антител для обнаружения полиэдренного агента в яйцах (грене) тутового шелкопряда. Вопросы вирусологии. (1) 89-93.
Жданов В.М., Львов Д.К., Забережный А.Д. Место вирусов в биосфере (2012) Вопросы вирусологии. (1), 21-32.
Ивановский Д.И. (1892) О двух болезнях табака: Табачная пепелица. Мозаичная болезнь // С.-П.: тип. В. Демакова, 19 с.
Коронавирус в России – ситуация на 5 сентября 2020// https://koronavirustoday.ru/news/russia/koronavirus-v-rossii-situacziya-na-29-yanvarya-2021/
Oбpaщeниe 05.09.2020 г.
Коронавирус в России – ситуация на 29 января 2021// https://koronavirustoday.ru/news/russia/koronavirus-v-rossii-situacziya-na-29-yanvarya-2021/
Oбpaщeниe 29.01.2021 г.
Крылова Н.В., Попов А.М., Леонова Г.Н. (2016) Антиоксиданты как потенциальные противовирусные препараты при флавирусных инфекцияхю Антибиотики и Химиотерапия. 61(5-6), 26-31.
Лысак Л.В., Лапыгина Е.В., Конова И.А., Звягинцев Д.Г. (2010) Численность и таксономический состав ультрамикробактерий в почвах. Микробиология. 79(3), 428-432.
Моисеенко Т.И. (2009) Водная экотоксикология: теоретические и прикладные аспекты. М.: Наука, 399 с.
Рахметова А.А. (2011) Изучение биологической активности наночастиц меди, различающихся по дисперсности и фазовому составу. Автореф. … канд. биологических наук. М., 24 с
Риш, М.А. (2003) Наследственные микроэлементозы. Труды Биогеохим. лаб. 24, 301.
Фролов Г. (2020) Сообщение о препарате МИСиС спиртозоле. Университет науки и технологий: https:// misis.ru/university/news/misc/2020-04/6622/ Обращение 05.09.2020 г.
Aggarwal R., Sentz J., Miller M.A. (2007) Role of zinc administration in prevention of childhood diarrhea and respiratory illnesses: a meta-analysis. Pediatrics. 119(6), 1120-1130.
Anke M., Glei M., Muller M. et al. (1996) Trace and ultra trace elements in human and animal physiology. In Thyroid and Trace Elements, 6th Thyroid-Symposium. Berlin-Wien: Blackwell Wissenschaft, 1-12.
Arthur Y.R. (2000) The Glutatione peroxidase. Cell Mol. Life. 556, 1825-1835.
Bao S., Knoell D.L. (2006) Zinc modulates airway epithelium susceptibility to death receptor- mediated apoptosis. American J. Physiology – Lung Cellular and Molecular Physiology 290, L433-L441.
Bath G.F. (1979) Enzootic icterus – a form of chronic copper poisoning. J. South African Veterinary. 50(1), 3-14.
Beck M.A., Shi Q., Morris V.C., Levander O.A. (1995) Rapid genomic evolution of a non-virulent coxsackievirus B3 in selenium-deficient mice results in selection of identical virulent isolates. Nat. Med. 1(5), 433-436.
Behne D. Kyriakopoulos A. (2001) Mammalian selenium-containing proteins. Annu Rev Nutr. 2, 453-473.
Beijerinck M.W. (1898) Über ein Contagium vivum fluidum als Ursache der Fleckenkrankheit der Tabaksblätterю Verhandelingen der Koninklyke akademie van Wettenschappen te Amsterdam. 65, 1-22.
Black R.E. (2003). Zinc deficiency, infectious disease and mortality in the developing world. J. Nutrition. 133, 1485S-1489S.
Brooks W.A., Santosham M., Naheed A. et al. (2005) Effect of weekly zinc supplements on incidence of pneumonia and diarrhoea in children younger than 2 years in an urban, low-income population in Bangladesh: randomized controlled trial. The Lancet. 366, 999-1004.
Brown K.H., Rivera J.A., Bhutta Z. et al. (2004) International Zinc Nutrition Consultative Group (IZiNCG) Technical Document no. 1. Assessment of the risk of zinc deficiency in populations and options for its control. Food and Nutrition Bulletin. 25, S94–S203.
Champagne V.K., Helfritch D. (2013) A demonstration of the antimicrobial effectiveness of various copper surfaces. J. Biological Engineering. 7(1), 8.
Chan S., Gerson B., Subramania S. (1998) The role of copper, molybdenum, selenium, and zinc in nutrition and health. Clin. Lab. Med. 18(4), 673-685.
Chasapis C.T., Loutsidou A.C., Spiliopoulou A.C., Stefanidou M.E. (2012) Zinc and human health: an update. Archives of Toxicology. 86(4), 521-534.
Clark L.C., Combs G.F., Turnbull B.M. (1986) Effects of Selenium Supplementation for Cancer Prevention in Patients with Carcinoma of the Skin. A Randomized Controlled Trial. Nutrional Prevention of Cancer Study Group. J. American Medical Association. 276, 1957-1963.
Combs G.F. (2015) Biomarker of selenium status. Nutrients. 7, 2209-2236.
Combs G.F., Gray W.P. (1998) Chemoprevenrive agents: Selenium. Pharmacol Ther. 79, 179-192.
Dardenne M., Jean-Marie P. (1994) Interactions between zinc and thymulin. Metal-Based Drugs. 1(2–3), 233-239.
Derscheid R.J., Van Geelen A., Berkebile A.R. et al. (2014) Increased concentration of iodide in airway secreti.ons is associated with reduced respiratory syncytial virus disease severity. Am. J. Respir. Cell Mol. Biol. 143(12), 1244-1256.
Ermakov V.V. (2001) Problems of extremal geochemical ecology and biogeochemical study of the biosphere In Biogeochemistry and Geochemical Ecology (Ed. V.V. Ermakov). M.: Publ. GUN NPC TMG MZ RF, 98-144.
Ermakov V., Jovanovic L. (2010) Selenium deficiency as a consequence of human activity and its correction. J. Geochem. Exploration. 107(2), 193-199.
Ermakov V., Jovanovic L. (2010a) Characteristics of selenium migration in soil-plant system of East Meshchera and Transbaikalia. J. Geochem. Exploration. 107(2), 200-205.
Ermakov V.V., Safonov V.A., Yakimenko V.N. (2016) Express method for determining the activity of superoxide dismutase in blood. In Reports of the Moscow Society of Nature Tester (Responsible editors A. p. Sadchikov, S. A. Ostroumov). 62. M.: Publ. house of LLC “Max-Press”, 10-15.
Ermakov V.V., Usenko S.I. (2004) Method of diagnostics of chronic microelementoses in farm animals. Bull. of Integrated Field Science Center of Tohoku University (Sendai, Japan). 1(3), 59-64.
Fischer A.J., Lennemann N.J., Krishnamurthy S. et al. (2011). Enhancement of respiratory mucosal antiviral defenses by the oxidation of iodide. Am J Respir Cell Mol Biol. 45, 874-881
Flohe L.W., Gunzler W.A., Schock H.H. (1973) Glutathion peroxidase: a selenoenzyme. FEBS Letters. 32, 132-134.
Foster H.D. (2002) What really causes AIDS. Victoria: Trafford Publishing, 198 p.
Gabrashanska M., Tsocheva-Gaytandzhieva N., Nanev V. (2016). Selected trace elements in experimental fasciolosis with diethylnitrosamine treatment// Ecologica (Belgrad), 23(83), 525-528.
Gać P., Czerwińska K., Macek P., Jaremków A., Mazur G., Pawlas K., Poręba R. (2020) The importance of selenium and zinc deficiency in cardiovascular disorders. Environ. Toxicol. Pharmacol. 82(10), 103553
Gaetke L.M., Chow-Johnson H.S., Chow C.K. (2014) Copper: Toxicological relevance and mechanisms. Arch Toxicol. 88(11), 1929-1938.
Gibson R.S., Ferguson E.L. (1998). Assessment of dietary zinc in a population. Am. J. Clin. Nutr. 68, 430S-434S.
Griffiths P.D. (2012) Norovirus: tribulation and possible trial. Rev Med Virol. 2, 67-68.
Haider B.A.,Saeed M.A., Bhutta Z. et al. (2006) Zinc supplementation for the prevention of pneumonia in children aged 2 months to 59 months. Cochrane Database Sys. Rev. (2) Art. № CD005978.
Hart E.B., Waddell J., Elvehjem C.A. (2002) Iron in Nutrition. VII. Copper as supplement to iron for hemoglobin in the rat.1928. J. Biol. Chem. 277(34), 797-812.
Hiffler L., Rakotoambinina B. (2020) Selenium and RNA virus interactions: Potential implications for SARS-CoV-2 infection (COVID-19). Frontiers in Nutrition. 7, 1-9.
Jovanović L.N., Ermakov V.V. (2020) The importance of selenium and zinc in the prevention and treatment of viral diseases. Ecologica. 27(99), 357-365.
Keen C.L., Gershwin M.E. (1990) Zinc Deficiency and Immune Function. Annu Rev Nutr. 10, 415-431.
Kelly F.C. (1961) Iodine in medicine and pharmacy since its discovery – 1811–1961. J R Soc. Med. Oбpaщeниe 5.01.2021 г.https://doi.org/10.1177/003591576105401001
Kieliszek M., Lipinski B. (2020) Selenium supplementation in the prevention of coronavirus infections (COVID-19). Med. Hypotheses. 143(5). https://doi.org/10.1016/j.mehy.2020.109878
Kovalskij V.V. (1977). Geochemische Ökologie. Biogeochemie.Berlin, VEB Deutscher Landwirtschaftsverlag, 352 s.
Kuhn Ph. (1983) Doorknobs: A source of Nosocomial Infection. Diagnostic Medicine. 1(1), 2.
Lemire J.A., Harrison J.J., Turner R.J. (2013) Antimicrobial activity of metals: mechanisms, molecular targets and applications. Nat Rev Microbiol. 11, 371-384.
Levander O.A., Beck M.A. (1999) Selenium and viral virulence. Brit. Med. Bull. 66(3), 528-533.
Magagnoli J., Narendran S., Pereira D. (2020) Outcomes of hydroxychloroquine usage in United States veterans hospitalized with Covid-19. Med.-2020. Mode of access: https://doi.org/10.1101/2020.04.16.20065920. Date of access 11th June, 2020.
Mehri A., Marjan R.F. (2013) Trace Elements in Human Nutrition: A Review. Int. J. Med. Invest. 2(3), 115-128.
Menon I.G.K. (1959). The 1957 pandemic of influenza in India. Bull World Health Organ: 20, 199-224.
Molteni C., Abicht H.K., Solioz M. (2010) Killing of bacteria by copper surfaces involves dissolved copper. Appl. Environ. Microbiol. 76, 4099-4101.
Montagnier L. (1999) Virus: the Co-Discoverer of HIV Tracks its Rampage and Charts the Future. N.Y.: WW Norton, 256 p.
Patching S.G., Gardiner P.H.E. (1999) Recent developments in selenium metabolism and chemical speciation: a review. J. Trace Elements Med. Biol. 13, 193-214.
Prasad A.S., Brewer G.I., Schoomaker E.B., Rabbani P. (1978) Hypocupremia induced by zinc therapy in adults. J. American Medical Association. 240(20), 2166-2168.
Radosavljevic Z., Jovanovic L., Ermakov V. et al. (2018) Challenges of green economy. International Monograph. Belgrad: University Union-Nikola Tesla, 236 p.
Rehder D., Black R.E., Bomhorst J. (2015) Metals in Host-Microbe Interaction.The Host Perspective. In Trace Metals and Infectious Diseases (Eds. Nriagu J.O., Skaar E.P.) Massachusetts: The MIT Press, 199-221.
Rink L., Kirchner H. (2000) Zinc-altered immune function and cytokine production. J.Nutr. 130, 1407S-1411S.
Rish M.A. (2001) Genetic disorders of trace element metabolism in man and animals. In Biogeochemistry and Geochemical Ecology (Ed. V.V. Ermakov). M.: Publ. GUN NPC TMG MZ RF, 198-234.
Rotruck J., Pope A., Ganther H. et al. (1973) Selenium: biochemical role as a component of glutathione peroxidase. Science. 179(73), 588-590.
Ruel M.T., Rivra T.A., Santizo V.C. et al. (1997) Impact of zinc supplementation on morbidity from diarrhea and respiratory infections among rural Guatemalan children. Pediatrics. 99(6), 808-813.
Safonov V.A. (2018). Biological Role of Selenium and Correction Effects of Its Content in the Organism of Animals // Geochem. Int. 56(1), 1046-1050.
Sandstrom B. (1985) Effects of inorganic iron on the absorption of zinc from a test solution and a composite meal. In Trace elements in man and animals-TEMA.5 (Eds. Mills C.D., Brenner L., Chester J.K.). Farnham Royal, CAB International, 414-416.
Schwarz K., Foltz C. (1957) Selenium as an integral part of factor 3 against necrotic dietary liver degeneration. J. Am. Chem. Soc. 79, 3292-3293.
Takkouche B., Regueira-Méndez C., García-Closas R. et al. (2002) Intake of Vitamin C and Zinc and Risk of Common Cold: A Cohort Study. Epidemiology. 13(1), P. 38-44.
Tang A.M., Graham N.M., Saah A.J. (1996) Effects of micronutrient intake on survival in human immunodeficiency virus type 1 infection. Am J.Epidemiol. 143(12), 1244-56.
Taylor E.W. (1997) Selenium and viral diseases: facts and hypotheses. J. Orthomolecular Medicine. l2(4), 227-239.
Taylor E.W., Bhat A., Nadimpalli R.G. et al. (1997) HIV-1 encodes a sequence overlapping env.gp41 with highly significant similarity to selenium dependent glutathione peroxidases. AIDS Res. Hum. Retrovir. 15(5), 393-394.
Taylor E.W., Nadimpalli R.G., Ram C.S. (1997) Genomic structures of viral agents in relation to the biosynthesis of selenoproteins. Biol Trace Elem Res. 56(l), 63-91
Turner R.B., Cetnarowski W.E. (2000) Effect of Treatment With Zinc Gluconate or Zinc Acetate on Experimental and Natural Colds. Clin Infect Dis. 31(5). 1202-1208.
Turner R.J., Finch J.M. (1991) Selenium and the immune response. Proc.Nutr Soc. 50, 275-285.
Te Velthuis A.J.W., Van den Worm S.H.T., Sims A.C., Baric R.S., Snijder E.J., van Hemert M.J. (2010) Zn(2+) Inhibits Coronavirus and Arterivirus RNA Polymerase Activity in Vitro and Zinc Ionophores Block the Replication of These Viruses in Cell Culture. PLoS Pathogens 6(11), e1001176.
Urban T., Jarstrand C. (1986) Selenium effects on human neutrophilic granulocyte function in vitro. Immunopharmacol. 12, 167-172.
Verheesen R.H., Traksel R.A.M. (2020) Iodine, a preventive and curative agent in the COVID-19 pandemic? Med Hypotheses 144, :109860.https://doi.org/10.1016/j.mehy.2020.109860.Epub 2020 May 23. https://pubmed.ncbi.nlm.nih.gov/32540604/. Обращение 01 февраля 2021 г.
Warnes S.L. (2014) Laboratory studies to investigate the efficacy and mechanism of action of copper alloys to kill a range of bacterial pathogens and inactivate norovirus. Thesis of DF. University of Southampton. Faculty for natural and environmental sciences. Centre for Biological Sciences. Southampton, 157 p.
Warnes S.L., Little Z.R., Keevil C.W. (2015) Human Coronavirus 229E Remains Infectious on Common Touch Surface Materials. mBio. 6(6), 1697-1715.
WHO. Coronavirus disease 2019. (2020). Oбpaщeниe 10.01. 2021 г.https://doi.org/10.1001/jama.2020.2633
Wobus C.E., Thackray L.B., Virgin H.W. (2006) Murine norovirus: a model system to study norovirus biology and pathogenesis. J. Virol. 80. 5104-5112.
Yao X., Ye F., Zhang M. (2020) In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clin. Infect. Dis. 71(15), 732-739.
Zhang L., Liu Y. (2020) Potential interventions for novel coronavirus in China: A systematic review. J. Med. Virol. 92, 479-490. https://doi.org/10.1016/j.mehy.2020.109878
https://pubmed.ncbi.nlm.nih.gov/32540604/. Обращение 01 февраля 2021 г.
Zhao L., Cox A.G., Ruzicka J.A. et al. (2000) Molecular modeling and in vitro activity of an HIV-1-encoded glutathione peroxidase. Proc Nad Acad Sci USA. 97(12), 6356-6361.
Zhang J., Taylor E., Bennett K. et al. (2020) Assosiation between regional selenium status and reported outcome of COVID-19 cases in China. The American Journal of Clinical Nutrition. 111(6), 1297-1299.
Дополнительные материалы отсутствуют.