Геохимия, 2022, T. 67, № 2, стр. 171-181
Оценка химического состава шунгита Зажогинского месторождения для его использования в биотехнологии
А. П. Пономарев a, *, С. Ф. Тютиков b, **, И. В. Подколзин c, ***, Д. Б. Большаков c, ****
a Владимирский государственный университет имени Александра Григорьевича и Николая Григорьевича Столетовых
600000 Владимир, ул. Горького, 87, Россия
b Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
c Испытательный центр Федерального центра защиты животных, ФГБУ “ВНИИЗЖ”
600901 Владимир, мкр. Юрьевец, Россия
* E-mail: ponomarev.a44@yandex.ru
** E-mail: tyutikov-sergey@rambler.ru
*** E-mail: ivap1964@gmail.com
**** E-mail: dmitry_b@yandex.ru
Поступила в редакцию 19.01.2021
После доработки 05.04.2021
Принята к публикации 07.04.2021
- EDN: DWLFKI
- DOI: 10.31857/S0016752522020078
Аннотация
Определены уровни содержания и закономерности перехода из твердой фазы шунгита в водный экстракт фуллерена C60; макроэлементов (Ca, Na, Mg, K); микро-, ультрамикроэлементов и тяжелых металлов (Fe, Cu, Zn, Mn, Se, Mo, Co, Ni, As, Br, Pb, Cd, Sn, Ga, Ge, Te, Ta, Al, Rb, Ba, Sr, Cs, Zr, In, Sb, Hf, W, Re, Tl, Th, U); а также редкоземельных элементов (Sc, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Усовершенствованный метод получения концентрированного водного экстракта шунгита (ВЭШ) адаптирован для использования в биотехнологии. Эффективное хелатирование редкоземельных элементов из экстракта достигается применением комплексоната ЭДТА с последующей визуализацией эффекта их взаимодействия методом классической кристаллоскопии. Выявлено влияние препарата шунгита, подавляющее развитие патогенной микрофлоры. Основой влияния ВЭШ на нанобактерии и вирионы вируса ящура следует признать присутствие редкоземельных элементов (РЗЭ). Катионы этих элементов образуют химические связи с отрицательно заряженными фосфатными остатками в составе клеточных мембран и нуклеиновых кислот, приводя к образованию конгломератов. Выполненные исследования шунгита Зажогинского месторождения открывают широкие возможности для разработки биотехнологии очистки сыворотки крови от различных бактерий, вирусов и нанобактерий.
ВВЕДЕНИЕ
С биогеохимической точки зрения, шунгит может рассматриваться как ископаемое “биокосное тело” и представляет собой интереснейший материал для исследования химического состава живого вещества в отдаленные геологические эпохи (Вернадский, 1994). В состав шунгита входят фуллерены, за открытие которых в 1996 году Ричард Смолли, Роберт Керл и Харольд Крото были удостоены Нобелевской премии по химии (Buseck et al., 1992). Являясь одной из четырех аллотропных форм углерода, фуллерен обладает уникальными свойствами. В связи с тем, что молекула фуллерена С60 содержит фрагменты с 5-кратной симметрией, нигде в неорганической природе не встречающейся, принято считать ее молекулярным кристаллом, являющимся неким связующим звеном между живой и неживой природой.
Помимо фуллеренов в состав шунгита входит множество химических элементов, относящихся как к жизненно важным, так и к токсичным. Особый интерес для исследования представляет группа редкоземельных элементов (РЗЭ), как наименее изученная с точки зрения их биологических свойств (Pol et al., 2014). Исходя из вышеизложенного, была определена цель исследования – определить химический состав водного экстракта шунгита Зажогинского месторождения с целью оценки возможностей его использования в биотехнологии.
Принимая во внимание незначительное содержание фуллеренов в составе шунгита, трудно объяснить наблюдаемые эффекты препаратов на его основе одним лишь присутствием этой аллотропной формы углерода. По-видимому, следует учитывать весь комплекс биологически активных соединений, входящих в состав органической массы и минеральной составляющей шунгитовой породы. Исследователи отмечают, что органоминеральный комплекс шунгита представлен разнообразной смесью сложных веществ, которые выходят в раствор вместе с фуллеренами и определяют их свойства (Калинин, Ковалевский, 2013; Кротоус, 2016). Установлено, что фуллерены хорошо растворяются в органических растворителях – бензоле, толуоле, четыреххлористом углероде.
Принято считать, что кислотность водных экстрактов шунгита (ВЭШ) обусловлена образованием серной кислоты (Калинин, Ковалевский, 2013). Поверхность породы Зажогинского месторождения покрыта сернистыми соединениями. Когда ее погружают в воду при свободном доступе воздуха, образуется серная кислота. Эта кислота в воде начинает разрушать сам шунгит и выделяет из него большинство микроэлементов (МЭ) и ультрамикроэлементов (УМЭ), подвижных в кислой среде (рН концентрированного шунгитового настоя достигает 2.5–3.0).
В медицинской и ветеринарной практике находят применение препараты, содержащие РЗЭ. Установлено их влияние на различные процессы, необходимые для нормального развития и функционирование организма (Иванов и др., 2009; Тремасова и др., 2011). Еще в 1924 г. Гаммерстен наблюдал, что соли лантана осаждают ДНК из раствора. Максимальное осаждение происходило при рН 2.5–4.0. Фосфатные группы полинуклеотидной цепи находятся на расстоянии 6 ангстрем друг от друга. Предполагается, что ионы лантана могут соединять фосфатные группы соседних нуклеотидных цепей, образуя структуру агрегированных друг с другом нитей различных молекул ДНК. Являясь хорошими комплексообразователями, РЗЭ связываются многими органическими лигандами, что и обуславливает их биологические функции. Имеются данные, что РЗЭ могут образовывать прочные соединения с фосфатами (в том числе входящими в состав мембран и нуклеотидов), что наиболее выражено в кислой среде (Искандаров, 2016). Медицинскими исследованиями установлено, что одним из специфических эффектов при введении РЗЭ в организм человека является их воздействие на кровь. Наиболее сильными антикоагуляционными свойствами обладают препараты неодима, празеодима и церия (Гуляев, 2004). Ветеринарными специалистами изучены биологические свойства РЗЭ, что позволило разработать ряд лечебно-профилактических препаратов для животных (Искандаров, 2016). Изучение антиген-стимулирующих свойств РЗЭ на линейных мышах Balb, выявило стимуляцию антителогенеза на антигены из убитых прогреванием вакцинных культур бруцелл, а также стафилококков и сальмонелл.
МЕТОДИКА
Получение водного экстракта и определение фуллеренов и химических элементов
Для исследований использовали природный шунгит в виде щебня, изготовленный в соответствии с ТУ 5714-007-12862296-01 “Дробленые и молотые шунгиты Зажогинского месторождения”. Анализ на содержание химических элементов в составе ВЭШ проводили методом масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) на приборе Elan DRCII (Perkin-Еlmer SCIEX Instruments, USA). Концентрирование ВЭШ проводили методом выпаривания и с использованием вакуумного роторного испарителя.
В качестве растворителя для экстракции фуллеренов из шунгита использовали бромбензол ос. ч. по ТУ 6-09-3774-74, поскольку в нем С60 и С70 имеют достаточно высокую растворимость (3.3 и 2.8 мг/мл соответственно). Растворы фуллеренов в бромбензоле имеют максимумы светопоглощения в области 320–350 нм. Установлено, что хроматографическое определение фуллеренов с детектированием при длине волны 340 нм обладает наибольшей чувствительностью. Навеску порошка шунгита массой 5 г помещали в колбу вместимостью 50 мл и добавляли 30 мл бромбензола. Колбу плотно закрывали и оставляли на 2 нед. Затем отбирали около 4 мл бромбензольного экстракта, фильтровали через целлюлозно-ацетатный фильтр с размером пор 0.22 мкм и переносили в виалу с пластиковой вставкой и хроматографировали. Использовали высокоэффективный жидкостной хроматограф Varian 940-LC, включающий систему подачи растворителей (два насоса высокого давления, смеситель), секцию ввода образцов (автосемплер и ручной инжектор), хроматографическую колонку (Pursit XRs, C18 250 × 4.6 мм, размер частиц 5 мкм), спектрофотометрический детектор и компьютерную систему обработки хроматографических данных (Galaxie Chromatography Data System).
Извлечение РЗЭ из ВЭШ проводили путем осаждения при изменении pH c кислой на щелочную и отделения взвеси в делительной воронке. Минеральный состав экстрактов определяли с использованием системы капиллярного электрофореза “Капель-105М”, оснащенной спектрофотометрическим детектором, немодифицированным кварцевым капилляром внутренним диаметром 50 мкм и эффективной длиной 60 см. Определение содержания цинка, меди и железа проводили на атомно-абсорбционном спектрометре “Квант-Z.ЭТА”.
Микробиологическе методы
Для проверки воздействия водного экстракта на микроорганизмы использовали бактерии типа Pasteurela multocida и Escherichia coli. Для получения суспензии бактериальных клеток проводили посев бактерий на среду Эндо и бульон по Хоттингеру. Чашки Петри с бактериями помещали в термостат при температуре 37°С и выдерживали в течение 24 ч. После этого из чашек Петри бактерии смывали буферным раствором в стерильные флаконы. Затем бактериальные клетки осаждали при 3000 об./мин на лабораторной центрифуге ОПн-8 УХЛ 4.2.
После экспозиции в шунгитовой воде бактерии отделяли на центрифуге при 3000 об./мин в течение 20 мин. Из пробирок удаляли надосадочную жидкость, а осадки ресуспендировали в буфере STE рН 7.3–7.4 в объеме 100–200 мкл. Бактериальные препараты для электронной микроскопии наносили на угольно-парлодионовые пленки-подложки. Нанесение препаратов осуществляли методом флотации с последующим контрастированием 4% раствором фосфорно-вольфрамовой кислоты рН 6.8. Собственно электронную микроскопию проводили на электронном микроскопе JEM-100CX (Япония) при инструментальном увеличении 10 000–40 000.
Методы электронной микроскопии и кристаллоскопии
Для проверки биологического воздействия in vitro на нанобактерии из крови животных выделяли их клетки, которые отдельно суспендировали в буферном растворе, дистиллированной воде и в ВЭШ. Результаты оценивали по изменению морфологии клеток нанобактерий и по их количеству в контрольном и опытных образцах. Документирование проводили методом электронной микроскопии.
Для выявления морфологических признаков воздействия ВЭШ по вирионы получали концентрированные с помощью полиэтиленгликоля (ПЭГ) препараты вируса ящура, которые необходимо было очистить от сопутствующих белков и примесей в виде растворенного ПЭГ. Методика воздействия на вирионы вируса ящура аналогична с бактериальными клетками.
Кристаллоскопию ВЭШ проводили классическим методом, нанося его в объеме 100 мкл на обезжиренную поверхность чистого предметного стекла. Испарение и сушку пленки проводили в термостате при +37°С. После высыхания раствора, полученные кристаллограммы регистрировали с помощью тринокулярного микроскопа “Olympus” (Япония), укомплектованного цифровой камерой, подключенной к персональному компьютеру с программой “Sсopefoto”.
C целью определения присутствия РЗЭ в ВЭШ были проведены опыты по их хелатированию комплексонатом – этилендиаминтетрауксусной кислотой (ЭДТА) с визуализацией эффекта их взаимодействия методом классической кристаллоскопии. В опытах использовали ВЭШ, приготовленный в отработанном режиме с конечным значением рН 4.0.
Методы биотехнологии
При проведении исследований по бактерицидным свойствам ВЭШ были использованы музейные культуры микроорганизмов: Escherichia coli К12, Shigella sonnei 2g и Salmonella enteritidis группы D. Для опытов были задействованы питательные среды и другие растворы: среда Эндо с фуксином; дезинфицирующий 0.1% раствор “Жавель-Абсолют” для обработки лабораторной посуды; 0.9% физиологический раствор; 5% раствор основного спиртового фуксина; спирт этиловый; дистиллированная вода; водопроводная вода.
Оптимизацию процесса приготовления ВЭШ для целей очистки сыворотки крови от биологических загрязняющих агентов осуществляли прогревая щебень шунгита при температуре +200°С в течение 2.0 ч в сушильном шкафу ШСВЛ-80. Для контроля рН, электропроводности и солесодержания в ВЭШ использовали кондуктометр TDS/EC Meter. На втором этапе растворения щебень шунгита в водном растворе переносили в ультразвуковую камеру “Сапфир”, добавляли 5 мл серной кислоты и проводили ультразвуковую обработку в течение 20 мин культур. Для решения поставленной задачи использовали биоматериал в форме сыворотки крови крупного рогатого скота, которую доставляли с боенских предприятий в замороженном виде для обработки на научно-производственное предприятие НПП “БИОХИМСЕРВИС” г. Владимир.
Для визуальной оценки содержимого отделяемого биосубстрата готовили препараты для световой микроскопии (люминесцентный микроскоп “Микромед 3ЛЮМ” при 1000-кратном увеличении). Результаты контроля фиксировали с помощью “электронного окуляра” DCM300, подключенного к персональному компьютеру с программным обеспечением для обработки изображений “ScopePhoto”.
Клинические испытания двух серий сыворотки № 12 и № 13 очищенной РЗЭ были выполнены на базе ФБУН НИИ эпидемиологии и микробиологии имени Пастера (г. Санкт-Петербург) в соответствие с приказом Росзравнадзора № 7279 от 13.10.2015 года. В процессе клинических испытаний были использованы клеточные линии McCoy, Vero и HEp-2. На основании клинических испытаний исполнителями был составлен акт оценки результатов № 6/2-4-2017 от 22.09.2017 г.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фуллерены и химические элементы в водном экстракте шунгита и методы его концентрирования
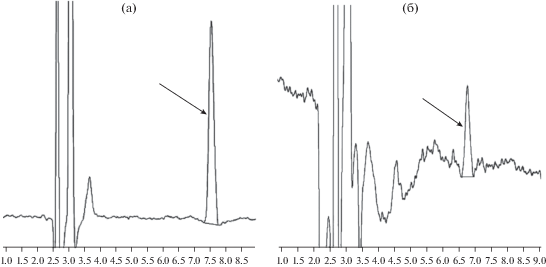
Хроматограммы бромбензола, которым проводили извлечение фуллерена из шунгита в течение двух недель и бромбензольного экстракта из воды, настоянной на шунгите, приведены на рис. 1. Установлено, что при экстракции бромбензолом из по-рошкообразного шунгита извлекается 0.008 мас. % фуллерена С60. Фуллерен С60 переходит из измельченного шунгита в воду в количестве 0.06 мкг/г, что составляет 6 × 10–6 мас. %. Фуллерен С70 в шунгите не обнаружен. Приведенные хроматограммы позволяют визуально наблюдать преимущества прямой экстракции фуллерена бромбензолом из шунгита, по сравнению с водой. Однако бромбензол является физиологически неприемлемым для использования при работе с живыми биосистемами. Поэтому, исходя из намеченных задач проводимого исследования дальнейшие работы были сосредоточена на изучении свойств именно ВЭШ.
Рис. 1.
Хроматограммы бромбензольного экстракта из шунгита (а) и бром-бензольного экстракта из воды, настоянной на шунгите (б). Стрелкой показан пик С60.
Интересной особенностью шунгита оказалась неравномерность выхода различных химических элементов в водный экстракт. В табл. 1 представлены результаты определения их процентного выхода, в зависимости от массы навески, помещенной в бидистиллированную воду. Установлено, что в процессе экстрагирования отсутствует четкая зависимость между массой шунгита и выходом химических элементов. Для некоторых элементов можно выделить 2 и более пиков наибольшей экстракции. По-видимому, данный эффект связан с гетерогенностью соединений, в составе которых в шунгите находятся разные химические элементы. Следует отметить, что в процессе экстрагирования из шунгита в водную среду переходят помимо макроэлементов, также МЭ, УМЭ, ТМ, и РЗЭ. При этом образуется ВЭШ с рН 2.8–3.5. Экспериментами было показано, что при длительной промывке шунгита водопроводной водой кислотность снижается, но может быть восстановлена при предварительной термообработке шунгита при температуре 200–300°С в течение 2 ч.
Таблица 1.
Средний выход химических элементов в водных экстракт шунгита (в %*) в зависимости от массы навески
| Элемент | Выход элемента в экстракт | |||
|---|---|---|---|---|
| 10 грамм | 20 грамм | 30 грамм | 40 грамм | |
| Макроэлементы | ||||
| Ca | 52 | 61 | 58 | 35 |
| Na | <1 | 93 | 95 | 44 |
| Mg | 200 | 475 | 65 | 41 |
| K | 8 | 44 | 46 | 53 |
| Тяжелые металлы, микро- и ультрамикроэлементы | ||||
| Fe | 195 | 1328 | 219 | 65 |
| Cu | 211 | 761 | 270 | 106 |
| Zn | 114 | 108 | 42 | 37 |
| Mn | 102 | 167 | 63 | 23 |
| Se | <1 | 22 | <1 | <1 |
| Mo | 48 | 95 | 35 | 3 |
| Co | 447 | 209 | 61 | 22 |
| Ni | 293 | 182 | 57 | 42 |
| As | 250 | 107 | 95 | 36 |
| Br | 179 | 286 | 24 | <1 |
| Pb | 167 | 259 | 306 | 260 |
| Cd | 149 | 152 | 52 | 47 |
| Sn | <1 | 83 | 3 | <1 |
| Ga | 600 | 1500 | 333 | <1 |
| Ge | 714 | 1071 | 238 | 89 |
| Te | 21 | 98 | 202 | 10 |
| Ta | 83 | 171 | 167 | 33 |
| Al | 413 | 974 | 110 | 45 |
| Rb | ˂1 | 19 | 833 | 63 |
| Ba | 102 | 99 | 83 | 63 |
| Sr | ˂1 | 58 | 11 | 21 |
| Cs | 252 | 124 | 83 | 188 |
| Zr | 247 | 332 | 85 | 42 |
| In | 248 | 252 | 583 | <1 |
| Sb | 19 | 94 | 42 | 6 |
| Hf | 335 | 334 | 112 | 25 |
| W | 375 | 313 | 104 | 94 |
| Re | <1 | <1 | 3 | 11 |
| Tl | 52 | 71 | 48 | 54 |
| Th | 1488 | 99 840 | 2504 | 50 |
| U | 451 | 480 | 33 | 88 |
| Редкоземельные элементы | ||||
| Sc | 876 | 1250 | 3 | <1 |
| Y | 370 | 306 | 123 | 37 |
| La | 375 | 769 | 208 | 63 |
| Ce | 409 | 682 | 197 | 45 |
| Pr | 502 | 625 | 167 | 38 |
| Nd | 551 | 648 | 166 | 37 |
| Sm | 499 | 583 | 166 | 42 |
| Eu | 500 | 623 | 169 | 47 |
| Gd | 198 | 409 | 133 | 50 |
| Tb | 499 | 417 | 167 | 42 |
| Dy | 375 | 313 | 126 | 31 |
| Ho | 250 | 318 | 123 | 31 |
| Er | 247 | 254 | 83 | 25 |
| Tm | 256 | 246 | 88 | 23 |
| Yb | 399 | 202 | 134 | 3 |
| Lu | 247 | 251 | 83 | 19 |
Принимая во внимание опыт предшествующих исследователей (Калинин, Ковалевский, 2013; Кротоус, 2016) были проведены исследования по выходу химических элементов в процессе кипячения щебня шунгита в родниковой воде. На рис. 2 представлены результаты масс-спектрометрического контроля ВЭШ, полученного путем кипячения ультрафильтрата родниковой воды со щебнем шунгита в соотношении 200 г на 1 литр воды. В процессе кипячения проводили последовательно отбор проб через 5, 15 и 30 мин. Результаты проведенных исследований свидетельствуют о достаточно интенсивном экстрагировании в водную среду РЗЭ из шунгитового щебня.
Рис. 2.
Экстракция редкоземельных элементов при кипячении ультрафильтрата родниковой воды со щебнем шунгита.
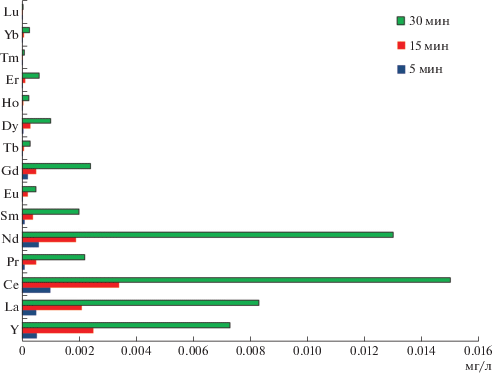
В целях получения концентрированного ВЭШ проводили выпаривание простым кипячением (объемное соотношение 1 : 10), а также с использованием вакуумного роторного испарителя типа RE-52AA с объемом колбы 2 л (1 : 40). Второй метод позволяет удалять растворитель при более низкой температуре, избегая выпадения накипи. В результате оптимизации процесса нами была достигнута следующая фактическая кратность концентрирования РЗЭ (простое кипячение/роторный испаритель): La – 7.9/36.6; Ce – 8.2/37.2; Pr – 7.5/33.5; Nd – 8.0/35.0; Sm – 8.25/37.8; Eu – 7.0/38.0; Gd – 7.2/33.3; Tb – 7.1/34.2; Dy – 7.6/37.3; Ho – 6.6/33.3; Er – (9.9/39.8; Tm – 9.8/39.7; Yb – 7.5/37.6; Lu – 8.0/39.9. Водородный показатель концентрированных растворов сохраняет значение исходных: 2.3–2.6.
Из данных литературы известно, что РЗЭ хорошо растворяются в соляной, серной и азотной кислотах (Искандаров, 2016; Искандарова и др., 2019). С целью определения оптимального режима экстракции химических элементов проводили подкисление экстрагента до рН 2.0–2.5 добавлением концентрированной HCl. Экстрагирование проводили в течение 72 ч при комнатной температуре. После этого раствор выпаривали кипячением до 1/10 от исходного объема, изменяли водородный показатель экстракта до рН 4.0–4.5 добавлением раствора щелочи. Методом центрифугирования удаляли образовавшуюся взвесь, образующуюся в процессе экстрагирования, получая тем самым конечный экстракт с рН 4.0–4.5.
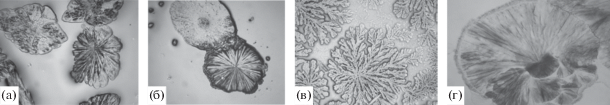
На рис. 3 видно, что процесс дегидратации жидкости сопровождается образованием фаций с характерной структурой, специфика которой определяется качественным составом исследуемой жидкости. В процессе дегидратации молекулы образуют упорядоченную структуру, например, при кристаллизации металлов и солей часто образуются древовидные кристаллы с ответвлениями – дендриты (Камакин и др., 2003). На снимках кристаллические образования представлены различной конформацией: это крупные структурно упорядоченные образования крестообразной формы различного размера и кристаллы с боковыми ответвлениями.
Рис. 3.
Морфология кристаллических образований из экстрактов, полученных с использованием соляной кислоты в качестве подкислителя. Увеличение: 200.

Cогласно намеченных задач, были проведены опыты по хелатированию РЗЭ из ВЭШ комплексонатом ЭДТА с визуализацией эффекта их взаимодействия методом классической кристаллоскопии. В опытах использовали водный экстракт шунгита приготовленный в отработанном режиме с конечным значением рН 4.0. При проведении опытов по комплексобразованию к 1 мл ВЭШ в пробирках типа Эппендорф добавляли 5% раствор ЭДТА в нарастающем объеме – 50, 100, 150 и 200 мкл. На рис. 4 представленны кристаллограммы смесей с увеличивающейся концентрацией ЭДТА, из которых следует явно выраженное изменение морфологии кристаллических образований.
Рис. 4.
Морфология кристаллических образований из смесей 1 мл ВЭШ с вариантами добавок ЭДТА: (а) – 50 мкл; (б) – 100 мкл; (в) – 150 мкл; (г) – 200 мкл. Увеличение: 200.

Процесс хелатирования и последующая дегидратация водной фазы сопро-вождается образованием кристаллов в форме “звездочек” из стержнеобразных структур исходящих из подобия центра. При этом морфология образований наиболее выражена при добавлении 150 мкл ЭДТА, что можно считать за оптимальное соотношение концентраций. При добавке 200 мкл ЭДТА на 1 мл ВЭШ кристаллограммы были представлены однородным мелкозернистым фоном при отсутствии выраженных кристаллических образований.
В следующем опыте при сохранении общей методики 1 мл ВЭШ смешивали со 150 мкл 5% раствора ЭДТА. Отличие состояло в том, что дегидратацию после нанесения смеси на предметное стекло проводили в течение 24 часов и более при комнатной температуре. Результаты исследований твердых пленок-фаций в проходящем свете тринокулярного микроскопа показали наличие кристаллов в виде концентрированных образований отличающихся по размерам и форме (рис. 5).
Отдельные кристаллы имели форму цветка, другие имели сходство с исходными кристаллами ЭДТА с выраженным стержневым строением. Из представленных кристаллограмм следует, что эффект хелатирования сопровождается включением катионов РЗЭ в состав комплексов, подтверждением чему служит полное отсутствие свободных кристаллов соли.
Влияние водного экстракта шунгита на микроорганизмы
На рис. 6 представлены электронные микрофотографии клеток E. coli из контрольного и опытного образцов. Результаты электронно-микроскопических исследований показали, что морфология интактных бактерий E. coli представлена палочковидными клетками с закругленными концами с размерами 0.4 × 0.8 × 1 × 3 мкм. Выраженные изменения в морфологии бактерий наблюдаются при воздействии ВЭШ: клетки изменяют свою форму и размеры, при идентичных условиях контрастирования с контролем становятся более прозрачными, т.е. теряют контраст. Кроме того, отмечается образование неупорядоченных агрегатов путем слияния нескольких клеток. Опыты по посеву клеток на питательные среды показали, что клетки E. coli после воздействия ВЭШ показали малый, рассредоточенный рост колоний.
Рис. 6.
Морфология бактерий E. Coli: а – контроль в буферном растворе STE; б – экспозиция в водном экстракте шунгита. Увеличение: 40000.

На рис. 7 представлены электронные микрофотографии Pasreurella multocida из контрольного и опытного образцов. Из изображении “а” видно, что интактные клетки бактерий – это полиморфные короткие палочки с закругленными концами, у которых отсутствуют жгутики. Помимо эллипсовидных палочек отмечается присутствие клеток по форме близкой к сферической с губчатой поверхностью. Воздействие ВЭШ на клетки бактерий также сопровождается изменением поверхностной структуры с потерей выраженного негативного контраста – они становятся более прозрачными, их форма явственно отличается от интактных клеток. Бактерии становятся неузнаваемыми по морфологическим признакам: форме и размерам. На микрофотографиях видоизмененные бактериальные клетки просматриваются в смеси со структурами, по-видимому, полностью разрушенных клеток.
Рис. 7.
Морфология бактерий P. multocida: а – контроль в буферном растворе STE; б – экспозиция в водном экстракте шунгита. Увеличение: 40 000.

Продолжением данных исследований послужили опыты с воздействием ВЭШ на клетки нанобактерий и на антиген вируса ящура. Методика получения клеток нанобактерий и их электронно-микроскопические исследования детально изложена ранее (Пономарев, 2011). Вегетативные формы клеток нанобактерий представляют собой палочко- и нитевидные структуры с признаками бинарного деления. Выяв-ляемые структуры при диаметре 40–50 нм имеют длину 100–150 нм (рис. 8).
Рис. 8.
Клетки нанобактерий: а – суспендированные в бидистиллированной воде, б – агрегированные нанобактерии после экспозиции в водном экстракте шунгита. Увеличение: 50 000.
У нитевидных клеток длина может достигать до 1 мкм при диаметре 40–50 нм. Второй разновидностью бесполого размножения клеток нанобактерий является почкование, когда от материнской клетки диаметром 300–500 нм отпочковываются дочерние элементарные тельца диаметром 50–60 нм. При суспендировании в бидистиллированной воде морфология клеток не изменяется по сравнению с буферным раствором. Следствием суспендирования клеток нанобактерий в ВЭШ с экспозицией в течение 24 ч явилось образование различных скоплений от небольших агрегатов до более крупных – агломератов из большого числа клеток. При этом свободных клеток не остается, практически все они включены в агрегаты. Кроме того, отмечено воздействие на их структуру, обусловленное образованием “пустых” капсул, то есть отмечается разрушение структуры интактных клеток. Наиболее вероятной гипотезой воздействия ВЭШ на клетки нанобактерий является присутствие в ее составе РЗЭ, обладающих способностью к комплексобразованию биоструктур. Это обусловлено тем, что катионы этих элементов образуют химические связи с отрицательно заряженными фосфатными остатками в составе клеточных мембран и нуклеиновых кислот (Искандаров, 2016; Пономарев, 2011). Кроме того, нарушение структуры клеток нанобактерий, которые содержат в своем составе до 50% кальция, также возможно связать с действием РЗЭ, обладающих способностью замещать Са+2, что сопровождается образованием пустых оболочек.
Оценка воздействия ВЭШ на вирионы вируса ящура осуществлялась по методике, как и с бактериальными клетками. Вирионы вируса ящура представляют из себя шарообразные частицы размером 29–30 нм и состоят только из белка и рибонуклеиновой кислоты (РНК). В наших опытах очищенные и концентрированные препараты вируса ящура экспонировали с ВЭШ в течение 24 ч при температуре +4°С. При исследовании контрольных и опытных образцов методом электронной микроскопии было установлено, что под воздействием ВЭШ из вирионов вируса ящура формируются конгломераты (рис. 9). В контрольном препарате вирионы равномерно распределены на поверхности пленки-подложки.
Рис. 9.
Вирионы вируса ящура в исходном препарате (а), увеличение: 90 000; в составе агрегатов после экспозиции водным экстрактом шунгита (б), увеличение: 70 000; после очистки с использованием водным экстрактом шунгита (в), увеличение: 120 000.

Образовавшиеся конгломераты из вирусных частиц вновь обрабатывали ВЭШ, а затем центрифугировали при 8000 об./мин в течение 20 мин на лабораторной центрифуге ОПн-8 УХЛ 4.2. Надосадочную жидкость из центрифужных пробирок удаляли, а осадки суспендировали в буфере STE рН 7.4. Последующая электронная микроскопия суспендированных образцов вируса показала отсутствие конгломератов. Произошел их распад, свидетельством чему является наличие морфологически полноценных вирионов вируса ящура. Таким образом, нами разработан способ очистки концентрированного препарата вируса ящура без использования высокоскоростных центрифуг. По нашему мнению, избирательное комплексобразование вирионов вируса ящура, обусловленное взаимодействием отрицательно заряженных фосфатных групп РНК вирионов с РЗЭ, позволяет отделить их от белковой составлящей вируссодер-жащей суспензии и перевести в осадок в условиях низкоскоростного цен-трифугирования. Все сопутствующие структуры, не содержащие нуклеинового компонента, и растворенный ПЭГ удаляются при сливе надосадочной жидкости.
Таким образом, выполненные исследования позволяют заключить, что основой бактерицидного действия ВЭШ является присутствие в нем РЗЭ, катионы которых эффективно взаимодействуют с противоположно заряженными группировками в структуре бактериальных клеток, нанобактерий и вирусов.
Использование ВЭШ в биотехнологии
Одним из недостатков сыворотки крови, как главного компонента ростовых питательных сред, применяемых в биотехнологии, является ее возможное загрязнение различными вирусами, дрожжами, грибами, L-формами бактерий, микоплазмами, нанобактериями и прионами, а также непостоянство состава. Это не только отрицательно сказывается на размножении клеток и репродукции вирусов, но и сопровождается загрязнением клеточных культур, а, следовательно, и конечного продукта, получаемого на их основе (Животная клетка.., 2009). Авторами была разработана технологии получения ВЭШ, специально предназначенного для очистки сыворотки крови от загрязнителей, включающая прогрев щебня шунгита при температуре +200°С в течение 2.0 ч в сушильном шкафу ШСВЛ-80 и двух этапное его растворение в сильно кислой среде (рН 1.3–1.5) с дополнительной ультразвуковой обработкой.
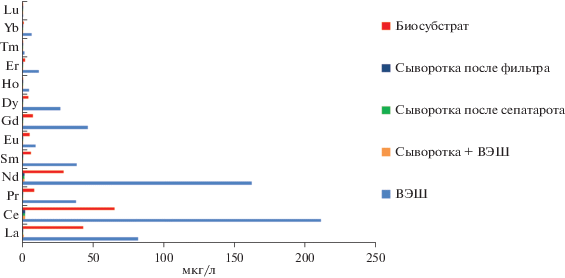
Сущность метода заключается в том, что замороженный исходный материал после оттаивания осветляли микрофильтрацией через микрофильтр с диаметром пор 450 нм. К осветленной сыворотке в полипропиленовых емкостях, заполненных по 15 л, добавляли 1% ВЭШ, с показателем солесодержания около 5000 ррм. Сыворотку оставляли при комнатной температуре на 48 ч с периодическим перемешиванием. В результате экспозиции в сыворотке образуется взвесь, размеры и концентрация которых могут различаться в отдельных партиях. Данный критерий свидетельствует об эффективности комплексообразования РЗЭ. Отделение коагулированных частиц проводили с использованием центробежного проточного сепаратора “Сокол” при скорости вращения барабана сепаратора 11 000 об./мин и производительностью 100 л/ч в несколько этапов. На каждом этапе проводили отбор проб сыворотки и коагулированного биосубстрата для контроля (рис. 11 ).
Установлено, что при фактическом 100-кратном разведении ВЭШ содержание РЗЭ в сыворотке меньше расчетного. Из всей группы исследуемых элементов содержание в образцах эрбия, иттербия, гольмия и тулия оказались ниже предела обнаружения, но они достоверно присутствовали в биосубстрате. Это можно оценить, как результат полного связывания данных РЗЭ коагулированием с последующим отделением взвеси в процессе сепарирования и микрофильтрации. По нашему мнению, это обусловлено тем, что при переходе от La к Lu ионные радиусы плавно уменьшаются (La – 1.061 Å и Lu – 0.848 Å), а ионные потенциалы и потенциалы ионизации увеличиваются, что усиливает склонность РЗЭ к комплексобразованию. При этом устойчивость комплексов также увеличивается с уменьшением радиуса от лантана к лютецию (Грошева, 2006).
По результатам микробиологических исследований сыворотки отмечено от-сутствие роста бактериальных клеток во всех питательных средах на протяжении всего срока инкубации (7 дней). Установлено, что образцы сыворотки крови нативные неспецифические без консерванта первой категории, очищенные РЗЭ, стерильны. Они также не содержат микоплазм и вирусов. По данным люминисцентной микроскопии, биосубстрат, напротив, содержит большое количество бактериальных клеток. Данный способ очистки сыворотки крови крупного рогатого скота защищен патентом РФ (Патент на изобретение № 2664729).
ВЫВОДЫ
1. В результате получения водного экстракта шунгита образуется сложный молекулярно-коллоидный раствор, содержащий фуллерен С60, макро-, микро- и ульрамикроэлементы, а также редкоземельные элементы.
2. Уровни содержания и закономерности перехода фуллерена и химических элементов из твердой фазы шунгита в водный экстракт представляют интерес в плане познания химического состава и особенностей биосферы в древнейшие геологические эпохи.
3. Открытый нами эффект термодиффузии химических элементов из глубинных слоев на поверхность является характерной особенностью шунгита, расширяющей возможности его технологического применения.
4. Образование конгломератов из бактериальных клеток, нанобактерий и вирионов вируса ящура связано с наличием в их составе одинаковых структурных составляющих органической природы, имеющих отрицательную электрическую полярность (фосфатные остатки клеточных мембран и нуклеиновых кислот). Эффект воздействия водного экстракта шунгита in vitro на микроорганизмы обусловлен физико-химическими свойствами катионов редкоземельных элементов – их способностью к комплексобразованию в биологических и биокосных системах.
5. Проведенные исследования шунгита Зажогинского месторождения открывают широкие возможности для разработки биотехнологии очистки сыворотки крови от различных бактерий, вирусов и нанобактерий.
Список литературы
Вернадский В.И. (1994) Живое вещество и биосфера / Отв. ред. Академик А.Л. Яншин. М.: Наука, 671 с.
Грошева В.И. (2006) Особенности комплексообразования тетрациклина с ионами редкоземельных металлов. Дис. … к. физ.-мат. н. Москва, 127.
Гуляев С.М. (2004) Церебропротекторное действие лантана ацетата при экспериментальной ишемии головного мозга. Автореф. … дис. к. мед. н. Улан-Удэ, 21.
Животная клетка в культуре (2009) / Под ред. Л.П. Дьяконова. М: “Спутник+” 2009, 656 с.
Иванов В.К., Щербаков А.Б., Усатенко А.В. (2009) Структурно-чувствительные свойства и биомедицинские применения нанодисперсного диоксида церия. Успехи химии. 78(9), 924-941.
Искандаров М.И. (2016) Биологические свойства препаратов на основе редкоземельных элементов. Ветеринария и кормление. (3), 13-15.
Искандарова С.С., Гулюкин М.И., Гулюкин А.М. и др. (2019) Разработка лекарственной формы препарата на основе редкоземельных металлов для защиты кожных покровов от воздействия патогенной микрофлоры и неблагоприятных факторов внешней среды // Методическое пособие. Новосибирск: ИздАНС “СибАК”, 68 с.
Калинин Ю.К., Ковалевский В.В. (2013) Шунгитовые породы: горизонты научного поиска. Наука в России. (6), 66-72.
Камакин Н.Ф., Мартусевич А.К., Кошкин А.Н. (2003) Перспективы развития кристаллографических методов исследования. Вятский медицинский вестник. (3), 6-11.
Кротоус В.А. (2016) Лечебные свойства шунгита. Изд. 6-е, испр. и доп. Петрозаводск, 39 с.
Лапо А.В. (1987) Следы былых биосфер. М.: Знание, 196 с.
Патент на изобретение № 2664729 (RU 2664729, МПК G01N 33/49) “Способ очистки сыворотки крови крупного рогатого скота от контаминирующих агентов"// Авторы: Пономарев А.П., Белик Е.В., Манин Б.Л., Коган М.М. Дата публикации: 22.08.18 г. Бюлл. № 24.
Пономарев А.П. (2011) Электронная микроскопия нанобактерий и других представителей микро- и наномира. (монография). Владимир: ИП Журавлева, 180 с.
Тремасова А.М., Ахметов Ф.Г., Коростылева В.П. (2011) Влияние шунгитов на иммунный статус телят. Проблемы ветеринарной санитарии, гигиены и экологии. (3), 72-74.
Baati T., Bourasset F., Gharbi N. et al. (2012). The prolongation of the lifespan of rats by repeated oral administration of fullerene. Biomater. 33(8), 4936-4946.
Buseck P.R., Tsipursky S.J., Hettich R. (1992) Fullerenes from the Geological Environment. Science. 257(5), 215-217.
Pol A., Barends T., Dietl A. et al. (2014) Rare earth metals are essential for methanotrophic life in volcanic mudpots. Envir. Microbial. 16(1), 255-264.
Дополнительные материалы отсутствуют.