Геохимия, 2022, T. 67, № 8, стр. 766-772
Особенности аккумулирования металлов растениями и активность почвенных ферментов в условиях металлогенических районов Северного Кавказа
В. В. Ермаков a, *, С. Ф. Тютиков a, А. П. Дегтярев a, У. А. Гуляева a, В. Н. Данилова a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: vad-ermak@yandex.ru
Поступила в редакцию 17.02.2021
После доработки 23.02.2021
Принята к публикации 31.03.2021
- EDN: SNEBXC
- DOI: 10.31857/S0016752522070020
Аннотация
Биогеохимические исследования выполнены в двух металлогенических районах Северного Кавказа, включая Унальскую котловину в бассейне реки Ардон, обогащенную Zn, Pb, Cu и Cd (республика Северная Осетия–Алания), и профиль по течению р. Баксан с повышенным уровнем W и Mo (Кабардино-Балкарская республика). Изучено аккумулирование металлов как индивидуальными растениями, так и экогруппами по высотному и латеральному профилю в бассейне р. Ардон. Установлено селективное концентрирование Zn в листьях березы Betula platyphylla Sukacz., Cd и Zn в листьях различных видов ивы и осины. Проведена оценка связи между активностью почвенных ферментов (дегидрогеназа, инвертаза, пероксидаза, каталаза) и уровнем содержания металлов в почвах полиметаллических и W-Mo биогеохимических провинций. Установлено, что увеличение суммы содержания металлов в почвах обоих районов ингибировало активность дегидрогеназы. По степени ингибирования металлами почвенные ферменты располагаются в ряд: дегидрогеназы > инвертаза > (каталаза и пероксидаза). Изменение активности почвенных ферментов в условиях техногенного загрязнения может служить дополнительным биогеохимическим индикатором при поисковых и экологических исследованиях.
ВВЕДЕНИЕ
Металлогенические районы Северного Кавказа характеризуются наличием природно-техногенных геохимических аномалий с широким спектром химических элементов, которые являются результатом воздействия горнорудной промышленности на окружающие ландшафты. Часто они идентичны по составу химических элементов рудогенным (природным), поскольку их источником является один и тот же рудный материал. Комплексное изучение природно-техногенных аномалий и потенциальных биогеохимических (БГХ) провинций представляет собой сложную методическую проблему, так как с одной стороны необходимо оценить химический элементный состав пищевых цепей, а с другой – выявить специфические биологические реакции организмов, принадлежащих к разным уровням пищевой пирамиды и систематическим группам. Особый интерес представляет использование для целей комплексного биогеохимического мониторинга почвы как биокосного тела (Вернадский, 1940). В частности – оценка возможности применения для этих целей параметров активности почвенных ферментов, таких как дегидрогеназа, каталаза, пероксидаза и инвертаза и другие (Soil microbiology…, 2012; Валова, 2015). В условиях металлогенических горнорудных регионов, где почвы существенно деградируют, подобные исследования приобретают исключительную актуальность (Конышева и др., 2011; Tabatabai et al., 1992; Garcia et al., 2015).
Данное сообщение посвящено комплексной БГХ оценке двух металлогенических районов Северного Кавказа.
МЕТОДИКА
Полевые работы проводились в июле 2020 г. в двух металлогенических районах, включая Унальскую котловину, обогащенную Zn, Pb, Cu и Cd в бассейне р. Ардон (Республика Северная Осетия-Алания), и профиль по течению р. Баксан с повышенным уровнем W и Mo (Кабардино-Балкарская Республика). Основное внимание было сосредоточено на БГХ дифференциации растений и оценке новых БГХ индикаторов – активности почвенных ферментов. В первом случае источником полиметаллической аномалии являлись дефляция пульпы Мизурского ГОКа и миграция металлов с водами и селевыми потоками, контактирующими с вскрытыми точечными Pb–Zn месторождениями. А во втором случае – вскрытие W-Mo месторождений и Тырнаузский вольфрамово-молибденовый комбинат (ТБМК). Исследования проводились по отработанной БГХ методике, включающей комплексное исследование и отбор проб почв, природных вод и растений на стационарных точках (площадках). Измерение pH, Eh, минерализации, электропроводности вод и суммарной (β + γ) радиоактивности осуществлялось на месте отбора проб.
В бассейне р. Ардон было опробовано 11, а в бассейне р. Баксан 10 площадок. На всех отбирали верхний почвенный горизонт А (0–15 см). Основные типы почв: аллювиальные, дерново-луговые, горно-степные, дерново-карбонатные, лугово-черноземные. Одновременно на экспериментальных площадках отбирали образцы листьев деревьев и укосов травянистых растений. Для исследования использовали фракцию почв ≤1 мм. При определении органического вещества пробы растирали до размера частиц ≤200 нм. В почвах оценивали активность внеклеточных почвенных ферментов, используя общепринятые методы (Хазиев, 2005) в авторской модификации. В частности, были разработаны новые способы получения реагентов (соединения титана, формазан, бензофенон). Это позволило выполнить измерение активности дегидрогеназы, пероксидазы и инвертазы. В почвах определяли содержание органического вещества, карбонатов, pH водной фазы.
После минерализации кислотами отобранных проб проводилось определение металлов методом ААС в пламенном варианте с дейтериевым (Квант-2А) и беспламенном варианте (Квант-Z.ЭТА) с зеемановским корректором фона. Точность анализа контролировали посредством анализа аттестованных образцов почв и растений (стандартные образцы КНР, Польши и РФ, включая SP-1, SP-2, SP-3 и другие). Нижний предел определения для Cu, Zn, Pb был равен 0.1 мг/кг, Cd – 0.02 мг/кг и As – 0.05 мг/кг.
При статистической обработке результатов исследований использовали программу Ms-Excel 2013.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Содержание металлов в почвах
Концентрации металлов почвах обоих металлогенических районов приведены в табл 1. Анализ почв показал высокое содержание металлов в урбоземах и техноземах (пульпе) вокруг Унальского хвострохранилища (УХХ). Содержание металлов в почвах Баксанского профиля оказалось значительно ниже, кроме молибдена.
Таблица 1.
Содержание металлов в почвах Унальской котловины и бассейна р. Баксан (мг/кг воздушно-сухого вещества)
| № п/п | Место отбора | Тип почвы | Pb | Cu | Zn | Cd | Mo | ∑Ме* |
|---|---|---|---|---|---|---|---|---|
| Унальская котловина (бассейн р. Ардон) | ||||||||
| 1 | с. Унал, у выхода штольни | Горно-луговая скелетная | 571 | 81 | 780 | 6.6 | 2.0 | 1441 |
| 2 | с. Унал, ниже штольни | Дерново-луговая на аргиллитах | 103 | 27 | 246 | 1.0 | 2.9 | 380 |
| 3 | пойма р. Ардон, 100 м от реки | Лугово-аллювиальная | 976 | 114 | 1143 | 9.3 | 2.2 | 2244 |
| 4 | с. Унал, 15 м от моста, | Дерново-луговая | 1708 | 242 | 3636 | 14.1 | 1.9 | 5602 |
| 5 | в 15 м от устья р. Уналдон | Лугово-аллювиальная | 238 | 41 | 486 | 1.4 | 2.5 | 768 |
| 6 | ниже устья р. Уналдон | Лугово-аллювиальная | 364 | 119 | 1338 | 7.2 | 2.3 | 1830 |
| 7 | с. Унал, луг за садом | Лугово-аллювиальная | 862 | 89 | 2223 | 8.7 | 3.8 | 3187 |
| 8 | с. Унал, в 10 м севернее базы МГУ | Дерново-карбонатная | 268 | 54 | 369 | 2.1 | 2.1 | 695 |
| 9 | с. Унал, в 100 м южнее базы МГУ | Дерново-карбонатная | 475 | 81 | 642 | 4.0 | 2.7 | 1205 |
| 10 | 2-я надпойменная терраса р. Ардон, за базой МГУ | Дерново-карбонатная | 703 | 92 | 723 | 5.3 | 3.1 | 1526 |
| 11 | 1-я надпойменная терраса р. Ардон, за базой МГУ | Дерново-луговая | 670 | 180 | 1680 | 12.6 | 3.1 | 2546 |
| Бассейн р. Баксан | ||||||||
| 1 | левый берег р. Малки | Лугово-черноземная | 31.1 | 13.4 | 75.6 | 0.23 | 2.3 | 123 |
| 2 | выше устья р. Баксан | Дерново-луговая | 17.9 | 3.8 | 42.6 | 0.17 | 3.3 | 68 |
| 3 | с. Баксан, луг у р. Баксан | Лугово-аллювиальная | 23.9 | 12.8 | 78.6 | 0.23 | 2.5 | 118 |
| 4 | водосброс ГЭС, р. Баксан | Дерново-луговая | 25.1 | 8.0 | 75.6 | 0.23 | 2.5 | 111 |
| 5 | с. Заюково, | Горный чернозем | 29.9 | 13.4 | 90.6 | 0.23 | 3.6 | 138 |
| 6 | с. Жанхотеко | Горно-луговая, мощная | 23.9 | 17.6 | 108.6 | 0.20 | 3.9 | 154 |
| 7 | с. Былым, луг | Горно-луговая | 19.7 | 17.6 | 90.6 | 0.32 | 5.2 | 133 |
| 8 | г. Тырныауз, 30 м западнее ГОК | Почво-грунт | 13.7 | 17.6 | 66.6 | 0.26 | 4.4 | 103 |
| 9 | в устье р. Мукулан | Почво-грунт (сель) | 35.9 | 49.4 | 153.6 | 0.98 | 32.3 | 272 |
| 10 | с. Верхний Баксан | Горно-луговая, субальпийская | 35.9 | 13.4 | 129.6 | 0.14 | 3.2 | 182 |
По сравнению с предыдущими данными (Ermakov et al., 2016), обнаруженные концентрации металлов в некоторых точках Унальской котловины заметно возросли. При этом следует отметить, что практически везде металлы преобладают в верхних горизонтах. По-видимому, это явление связано с дефляцией пульпы УХХ, эоловым рассеянием тонкодисперсной пыли и природными катастрофами (сели, оползни). По уровню содержания Pb, Zn и Cu в пульпе УХХ можно рассматривать как техногенное месторождение.
В результате анализа почв обоих районов получен градиент концентраций металлов и их суммы на обследованных участках, что необходимо для проведения исследований по биогеохимической индикации. При этом сумма металлов в почвах Унальской котловины (Cu, Pb, Zn, Cd, Mo) изменялась от 380 до 5602 мг/кг, а в почвах Баксанского профиля – от 68 до 272 мг/кг.
Металлы в растениях
Флористическое обследование экспериментальных участков в пределах УХХ показало заметное снижение числа обитаемых видов растений на техногенных площадках. Общее количество видов здесь не превышало 30, в то время как на “фоновых” точках составляло 47–56 видов на 100 м2. Снижалась также общая биомасса укоса с 1 м2.
При оценке аккумулирования металлов индивидуальными растениями и укосами на всем протяжении р. Ардон (80 км) установлены максимальные концентрации металлов в пределах Унальского хвостохранилища. Основной вклад в сумму четырех металлов вносят Zn и Pb. При этом коэффициент биологического поглощения по Zn (Кб) для березы в 6–10 раз выше, чем для укосов с тех же площадок. Но для самых загрязненных площадок это отношение сокращается до 2. Для Pb и Cu отношение (Кб березы)/(Кб укосов) колеблется не более, чем в 2 раза, как в сторону увеличения, так и в сторону уменьшения. Установлено, что укосы и береза накапливают Pb и Cu в зависимости от содержания металлов в почвах. Береза же накапливает Zn специфически. Даже в условиях фоновых территорий при низком содержании Zn в почвах его концентрация в листьях березы оказывается весьма высокой. Установлена существенная корреляционная связь (r = +0.892) между содержанием Zn цинка в листьях березы и в почвах (n = 8, критическое значение для 1% доверительного уровня r = +0.76). Связи в парах укос – почва для Zn, и в парах Pb–Cu (как в березе, так и в укосах) – почва – довольно слабые, а корреляция изменяется в диапазоне от +0.65 до +0.78.
Высокое содержание Zn характерно для листьев осины. Кб по Zn в 10 раз выше, чем Кб по Zn для укоса. Концентрации Cu и Pb в почвах и укосах связаны положительной корреляцией от +0.98 до +0.99. Связь между содержанием этих микроэлементов в почвах и листьях березы менее выражена (+0.69 и +0.73 соответственно). По Zn корреляция еще меньше (от +0.46 до +0.47). Специфичность аккумулирования Zn листьями березы нарушает эту взаимосвязь. По-видимому, свойство концентрировать металлы присуще многим видам из семейств Betulaceae и Salicaceae.
Представляют интерес данные об особенностях концентрирования химических элементов не только индивидуальными растениями, но и экогруппами. Это особенно важно при экологической оценке таксонов биосферы при использовании биогеохимических критериев и поисках месторождений полезных ископаемых. В табл. 2 приведены данные по содержанию металлов в растениях по высотному профилю р. Ардон.
Таблица 2.
Содержание металлов в ландшафтной растительности (укосы) по высотному профилю долины р. Ардон
| Высотные пояса, ландшафтная растительность | Содержание металлов в укосах, мг/кг сухого вещества | |||
|---|---|---|---|---|
| Pb | Cd | Cu | Zn | |
| Альпийский пояс, манжетковые луга, родореты | 0.4 | 0.14 | 7.3 | 25 |
| Субальпийский пояс, высокотравные луга | 0.4 | 0.08 | 5.7 | 34 |
| Высокогорные леса, сосняки, лесные травы | 0.2 | 0.03 | 5.3 | 40 |
| Высокогорные послелесные луга-сенокосы, злаково-разнотравное высокотравье |
0.82 | 0.1 | 3.5 | 50 |
| Горно-степной пояс, злаково-полынные лугостепи | 5.6 | 0.11 | 4.0 | 20 |
| Нагорно-ксерофитные группировки, трагакантники Унальской котловины | 9.1 | 0.15 | 8.5 | 32 |
| Заболоченная пойма р. Ардон рядом с хвосто- хранилищем п. Унал, полуболотное разнотравье |
26 | 0.8 | 14 | 150 |
| Унальское хвостохранилище, склоны дамбы, сорно-рудеральная флора, древесно-кустарниковые насаждения | 150 | 2.1 | 50 | 320 |
| Гусыра-Тамиск, заболоченная пойма р. Ардон ниже хвостохранилища, лугово-болотная флора | 1.2 | 0.3 | 6.3 | 50 |
| Широколиственные буковые леса Урсдон, луговые поляны, лесное разнотравье, северный макросклон Скалистого хребта вне техногенной области | 0.42 | 0.04 | 6.8 | 32 |
| Наклонная равнина Алагир-Рамоново, орошаемые сельскохозяйственные земли, пойменное разнотравье | 30 | 0.5 | 13.6 | 60 |
| Наклонная равнина, Ардон-Карджин, пойменные приречные луга низовьев р. Ардон | 3.5 | 0.3 | 10.7 | 45 |
Прослеживается интенсивное аккумулирование Pb определенными экогруппами растений. За пределами рудных районов в верхней части бассейна реки Ардон наименьшее содержание Pb отмечено в сене луговых трав (<0.1–0.8 мг/кг), его концентрация в ксерофитных колючих травах (Centaurea iberica) и древесных живых формах (ива, Salix sp.) была на порядок выше (1–2 мг/кг). Максимальное обогащение Pb обнаружено в литофитах, таких как лишайники (72.5 мг/кг). Такая же видозависимая концентрация Pb была выявлена вблизи Мизурского ГОКа. С почвами, содержащими до 366 мг/кг Pb, сено содержало Pb 7.5 мг/кг, колючие травы (C. iberica) – 38.5 мг/кг, деревья (ольха, Alnus L.) – около 7 мг/кг, а литофиты (лишайники) – 755 мг/кг.
Эфироносы (душица обыкновенная, Oríganum vulgáre) содержит относительно небольшое количество Pb (7.5 мг/кг); даже в небольших количествах Pb был найден в молочае (Euphorbia virgata) – 0.25 мг/кг. В окрестностях УХХ (терраса реки Ардон), где концентрация Pb в черноземоподобных выщелоченных почвах достигала 217 мг/кг, степные травы (проба сена) содержали Pb до 12.5 мг/кг, в то время как содержание Pb в отдельных видах значительно варьировало следующим образом: E. virgata – 5 мг/кг; C. iberica – 3.5 мг/кг и лишайники – 307 мг/кг.
Заслуживает внимания повышенная аккумуляция Pb литофитами (лишайники), мхами не только в местах загрязнения (Мизур), но и в пределах фоновых участков (верховья р. Ардон, с. Н.Зарамаг). Различия по содержанию Pb в литофитах и укосах растений исследуемого бассейна составляют 240 раз, что подтверждает избирательность данной группы организмов по отношению аккумулирования не только радионуклидов, но и ряда металлов и микроэлементов.
Используя большой фактический материал (20 видов растений, более 100 проб), установлены факты поверхностного загрязнения металлами, в особенности Cd, растений, обладающих густым войлочным опушением (мать-мачеха, Tussilago farfara), клейким железистым опушением (марь душистая, Tussilago farfara), а также жестко-щетинистым покровом (василек грузинский, C. iberica и др.).
В бассейне р. Баксан в районе бывшего ТБМК, напротив, наблюдался высокий параметр биоразнообразия луговых растений, в особенности бобовых, несмотря на аномальные концентрации Mo и W в почвах и организмах.
Так, на участке в г. Тырныауз у основания карьера на горно-коричневых почвах, сформировавшихся на коллювии продуктов выветривания коренных пород (в основном граниты) и заметно техногенно преобразованных, произрастали: горошек мышиный – Vicia crassa, люцерна серповидная – Medicago falcate, люцерна хмелевидная – Medicago lupulima, лядвенец рогатый – Lotus cormiculatus, клевер альпийский – Trifolium alpestre, клевер гибридный – Trifolium hybridum, клевер горный – Trifolium montanum, клевер ползучий - Trifolium repens, клевер седоватый – Trifolium canescens, клевер средний – Trifolium media, донник белый – Melilotus albus, донник желтый – Melilotus officinalis, вязель разноцветный – Coronilla varia и язвенник Буасье – Anthyllus Boissierii.
Активность почвенных ферментов
Проведена оценка связи между активностью почвенных ферментов (дегидрогеназы, инвертаза, пероксидаза, каталаза) и уровнем содержания металлов в почвах полиметаллических и W-Mo БГХ провинций. Установлено. что увеличение концентрации суммы металлов в почвах обоих районов ингибировало активность дегидрогеназы (рис. 1). На рис. 1 активность фермента выражена в ед./кг – мкг формазана – продукта восстановления 2,3,5-трифенилтетразолия хлорида массой почвы 1 г за 2 ч при 30°С или мг формазана – массой почвы 1 кг за 2 ч при 30°С. При этом коэффициент корреляции (r) между активностью фермента и уровнем содержания суммы металлов составлял –0.718. По степени ингибирования металлами почвенные ферменты располагаются в ряд: дегидрогеназа > инвертаза > (каталаза и пероксидаза).
Рис. 1.
Изменение содержания суммы металлов (Pb, Cu, Zn, Cd, Mo) и активности дегидрогеназы в почвах. а – Унальский профиль (полиметаллическая аномалия). б – Баксанский профиль (W-Mo аномалия). 1 – сумма металлов (мг/кг). 2 – активность дегидрогеназы (ед./кг).
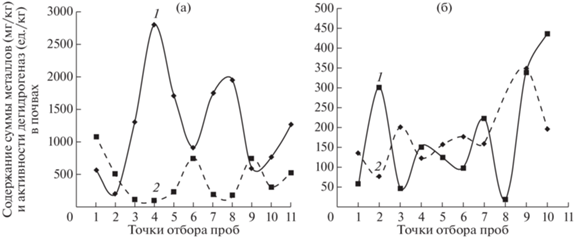
Параметры активности дегидрогеназы. каталазы и инвертазы в почвах бассейна р. Баксан слабо коррелировали между собой. В ряде случаев активность ферментов была стабильной при высоких концентрациях металлов в среде, что указывает на существование адаптивных форм энзимов.
В обоих районах в почвах с повышенным содержанием органического вещества активность дегидрогеназ, инвертазы и каталазы была более высокой, а пероксидазы – низкой (табл. 3). В Унальской котловине отмечалась тенденция связи отдельных металлов (Cu, Zn, Cd, Pb) с органическим веществом, кроме Mo. Для почв Баксанского профиля связь между концентрациями Mo, W, Cu и органическим веществом в ряде случаев была отрицательной, что косвенно указывает на стабильность техногенных форм (в основном оксидов). По степени ингибирования металлами почвенные ферменты располагаются в ряд: дегидрогеназы > инвертаза > (каталаза и пероксидаза). Необходимо отметить, что в ряде случаев активность ферментов была стабильной при высоких концентрациях металлов в среде, что указывает на адаптивные формы энзимов.
Таблица 3.
Связь между уровнем содержания металлов в почвах Баксанского и Унальского профилей, активностью ферментов и количеством органического вещества (ОВ)
| Баксанский профиль | |||
|---|---|---|---|
| Связь | R | Связь | R |
| ∑Ме*–ОВ | –0.550 | W–ОВ | –0.495 |
| ∑Ме–Инвертаза | –0.481 | W–Инвертаза | –0.255 |
| ∑Ме–Дегидрогеназа | –0.724 | W–Дегидрогеназа | –0.250 |
| ∑Ме–Пероксидаза | +0.366 | W–Пероксидаза | +0.499 |
| ∑Ме–Каталаза | –0.640 | W–Каталаза | –0.198 |
| Mo–ОВ | –0.634 | Cu–ОВ | –0.408 |
| Mo–Инвертаза | –0.426 | Cu–Инвертаза | –0.324 |
| Mo–Дегидрогеназа | –0.460 | Cu–Дегидрогеназа | –0.465 |
| Mo–Перокидаза | +0.494 | Cu–Пероксидаза | +0.457 |
| Mo–Каталаза | –0.578 | Cu–Каталаза | –0.267 |
| Унальский профиль | |||
| ∑Ме–ОВ | +0.074 | Zn–ОВ | +0.328 |
| ∑Ме–Инвертаза | –0.298 | Zn–Инвертаза | –0.377 |
| ∑Ме–Дегидрогеназа | –0.712 | Zn–Дегидрогеназа | –0.430 |
| ∑Ме–Пероксидаза | –0.269 | Zn–Пероксидаза | –0.329 |
| ∑Ме–Каталаза | +0.004 | Zn–Каталаза | +0.399 |
| Mo–ОВ | –0.587 | Cu–ОВ | +0.507 |
| Mo–Инвертаза | –0.506 | Cu–Инвертаза | –0.139 |
| Mo–Дегидрогеназа | –0.165 | Cu–Дегидрогеназа | –0.268 |
| Mo–Пероксидаза | +0.288 | Cu–Пероксидаза | –0.224 |
| Mo–Каталаза | +0.040 | Cu–Каталаза | +0.447 |
| Pb–ОВ | +0.310 | Cd–ОВ | +0.522 |
| Pb–Инвертаза | –0.425 | Cd–Инвертаза | –0.074 |
| Pb–Дегидрогеназа | –0.199 | Cd–Дегидрогеназа | –0.237 |
| Pb–Пероксмдаза | –0.132 | Cd–Пероксмдаза | –0.323 |
| Pb–Каталаза | +0.390 | Cd–Каталаза | +0.481 |
Оценивалась также связь между активностью отдельных ферментов и содержанием органического вещества (табл. 4). Четкой достоверной связи между отдельными ферментами и органическим веществом почв не выявлено. Тем не менее. наблюдалась тенденция увеличения активности всех ферментов, кроме пероксидазы, с ростом содержания органического вещества. Для пероксидазы это явление было обратным.
Таблица 4.
Взаимосвязь между активностью почвенных ферментов и органическим веществом (ОВ)
| Связь | Баксанская W-Mo аномалия | Унальская (Pb, Zn, Cu, Cd) аномалия |
|---|---|---|
| r | r | |
| ОВ–Инвертаза | +0.413 | +0.396 |
| ОВ–Дегидрогеназа | +0.403 | +0.521 |
| ОВ–Пероксидаза | –0.679 | –0.510 |
| ОВ–Каталаза | +0.479 | +0.648 |
| Инвертаза–Дегидрогеназа | +0.508 | +0.293 |
| Инвертаза–Пероксидаза | –0.284 | –0.254 |
| Инвертаза–Каталаза | +0.704 | +0.047 |
| Дегидрогеназа–Пероксидаза | –0.264 | –0.076 |
| Дегидрогеназа–Каталаза | +0.650 | +0.267 |
| Пероксидаза–Каталаза | –0.111 | –0.271 |
В Баксанском ущелье между инвертазой и каталазой, а также между дегидрогеназой и каталазой обнаружена положительная связь r = +0.704 и +0.650 соответственно. Учитывая широкое распространение внеклеточных ферментов в почвах, их селективность, участие в БГХ циклах, жизненно важных процессах и ингибирование под действием токсических уровней металлов, почвенную энзимологию можно рассматривать как одно из эффективных направлений БГХ индикации.
ЗАКЛЮЧЕНИЕ
Максимальные концентрации металлов установлены в отдельных видах, укосах и листьях древесных растений в пределах УХХ. Основной вклад в сумму четырех металлов вносят Zn и Pb. Прослеживается интенсивное аккумулирование металлов определенными экогруппами растений. Вне рудной зоны в верховьях р. Ардон зафиксировано наименьшее содержание Pb в укосах луговых трав. Наиболее обогащены металлами (в особенности, Pb) – накипные лишайники. Коэффициент концентрирования у лишайников и мхов, относительно фона в их биомассе наиболее высок по Cd и Pb (102). Аккумулирование металлов в Унальской котловине сопровождается обеднением видового состава луговых ландшафтов, а в пределах ТБМК – увеличением биоразнообразия, в особенности бобовых растений.
В целом, БГХ дифференциация фитоценозов обусловлена внешними и внутренними факторами: спецификой химического состава почв и почвообразующих пород (литологическая основа), геоморфологическими и климатическими факторами, особенностями состава и формирования природных вод, атмосферных аэрозолей, процессами техногенеза, спецификой организации и функционирования различных популяций растений, их взаимодействием с другими организмами биогеоценозов. При этом устойчивость последних определяется не только слаженным механизмом внутрипопуляционных взаимодействий, спецификой процессов миграции химических элементов в пределах конкретного таксона биосферы, но и особенностями гомеостаза организмов, включая процессы и механизмы их адаптации к экстремальным геохимическим природно-техногенным факторам, которые необходимо выяснить.
Установлено, что увеличение концентрации суммы металлов в почвах обоих субрегионов биосферы ингибировало активность дегидрогеназ. По степени ингибирования металлами почвенные ферменты располагаются в ряд: дегидрогеназы > инвертаза > (каталаза и пероксидаза). Таким образом, изменение активности почвенных ферментов в условиях техногенного загрязнения может служить дополнительным БГХ индикатором при поисковых и экологических исследованиях.
Работа выполнена по Госзаданию ГЕОХИ РАН.
Список литературы
Валова Е.Э., Цыбенов Ю.Б., Цыбикова Э.В. (2012) Влияние тяжелых металлов на ферментативную активность почв. Ученые записки ЗабГГПУ 42 (1). 63-66.
Вернадский В.И. (1940) Биогеохимические очерки (1922–1932 гг.). М.: Изд. АН СССР. 250.
Конышева Е.Н., Коротченко И.С. (2011) Влияние тяжелых металлов и их детоксикантов на ферментативную активность почв. Вестник КрасГАУ. (1). 114-119.
Хазиев Ф.Х. (2005) Методы почвенной энзимологии. М.: Наука. 252 с.
Garcia C., Hernandez T., Costa F. (2015) Potencial use of dehydrogenase activity as an index of microbial activity in degraded soils. Commun. Soil Sci. Plant Anal. 28. 123-134.
Ermakov V.V., Korobova E.M., Degtyarev A.P., Tyutikov S.F., Karpova E.A.,Petrunina N.S. (2016) Impact of natural and man-made factors on migration of heavy metals in the Ardon River basin (North Ossetia). J Soils Sediments, 16, 1253-1266.
Soil microbiology. ecology and biochemistry (4th ed.) (2015) (Eds. Paul A.) N.Y.: Dekker. 582 p.
Tabatabai M., Fung M. (1992) Extraction of enzymes from soil. Soil Biochemistry (Eds. Stotzky G., Bollag J.) 7. N.Y.: Dekker. 197-227.
Дополнительные материалы отсутствуют.


