Геохимия, 2022, T. 67, № 9, стр. 864-871
Равновесно-кинетическое моделирование поведения урана в системе подземные воды–U-содержащий алевролит в условиях активного водообмена
М. В. Мироненко a, *, Е. С. Сидкина a, **, А. И. Малов b, ***
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119991 Москва, ул. Косыгина, 19, Россия
b Федеральный исследовательский центр комплексного изучения Арктики им. академика Н.П. Лаверова УрO РАН
163000 Архангельск, Набережная Северной Двины, 23, Россия
* E-mail: mironenko@geokhi.ru
** E-mail: sidkinaes@yandex.ru
*** E-mail: malovai@yandex.ru
Поступила в редакцию 18.08.2021
После доработки 15.01.2022
Принята к публикации 27.01.2022
- EDN: WNGSRE
- DOI: 10.31857/S0016752522090035
Аннотация
В статье приведены результаты моделирования химических взаимодействий метеорных вод четвертичного горизонта с алевролитами верхней части падунской свиты венда Мезенской синеклизы (Архангельская область, Россия). Были применены равновесный и равновесно-кинетический подходы. Показано, что в условиях интенсивного водообмена и низкой температуры, вследствие малых скоростей взаимодействия с водой, окислительно-восстановительный буфер породообразующих минералов на этой стадии процесса вносит подчиненный вклад в растворение урана. Поэтому в течение достаточно длительного времени основным агентом мобилизации урана пород является растворенный в воде кислород.
ВВЕДЕНИЕ
Термодинамические свойства урановых минералов, а также U-содержащих водных частиц, включая комплексные частицы, изучены в широком диапазоне температур, давлений и окислительно-восстановительных условий (Grente et al., 2004; Guillaumont et al., 2003). Эти данные являются хорошей основой для геохимического моделирования. Для термодинамического моделирования поведения урана в окружающей среде и в геологических условиях наиболее предпочтительно использование данных (Shock et al., 1997), интегрированных в пакет SUPCRT92 (Johnson et al., 1992; Oelkers et al., 1995). Эти величины были получены на основе фундаментальных экспериментальных результатов и обработаны с использованием уравнения состояния HKF (Helgeson, Kirkham, Flowers) (Helgeson et al., 1981). Они обеспечивают возможность адекватного описания урановых равновесий в многокомпонентных гетерогенных геохимических системах в диапазоне от низкотемпературных до гидротермальных условий.
Принципиальная концепция распределения форм нахождения урана при его умеренных концентрациях (не учитывая коллоиды) в системе грунтовые воды–порода следующая: основными водными формами урана даже при относительно восстановительных условиях являются, в зависимости от кислотности и содержания растворенной CO2, различные карбонатные и гидроксидные комплексы ${\text{UO}}_{2}^{{2 + }},$ которые находятся в равновесии с более восстановленными твердыми оксидами UO2.0–UO2.25–UO2.33 в зависимости от окислительно-восстановительных условий. В современной литературе имеется довольно много публикаций по термодинамическому моделированию мобилизации урана из пород природными водами. Например, в работе (Малов и др., 2017) приведены результаты расчета форм нахождения урана в природных водах района Ломоносовского месторождения алмазов. В работе (Dutova et al., 2017) представлены результаты термодинамического моделирования системы U-содержащие гранитоиды – подземные воды, приведены расчетные оценки содержания урана в водном растворе в зависимости от общей солености воды и степени вторичного преобразования породы при различных заданных парциальных давлениях CO2 и различных Eh.
Химические равновесия в низкотемпературных природных водах вполне корректно описываются равновесной термодинамикой. Однако гетерогенные химические реакции растворения минералов при низких температурах протекают довольно медленно и с разной скоростью (Brantley, 2004). Это определяет постепенную эволюцию кислотно-основного и окислительно-восстановительного потенциалов, от которых и зависит концентрация урана в водном растворе. В настоящем исследовании нами проведено моделирование химической эволюции системы вода-урансодержащая порода с учетом скорости растворения минералов.
КРАТКОЕ ОПИСАНИЕ ОБЪЕКТА ИССЛЕДОВАНИЙ
Мезенская синеклиза расположена на севере Русской плиты, ограничена на западе Балтийским щитом, на востоке – Канинско-Тиманским складчатым поясом, на юге через Среднерусский авлакоген сочленяется с Московской синеклизой. В осадочном чехле Мезенской синеклизы присутствуют образования среднего и верхнего рифея, верхнего венда, палеозоя, мезозоя и кайнозоя. Мощность осадочного чехла значительно снижается вблизи побережья Белого моря. Здесь вендские отложения залегают на глубине от 0 до 50–300 м (Малов, 2004). В составе вендских отложений выделяют усть-пинежскую, мезенскую и падунскую свиты. Падунская свита состоит в основном из песчаников и алевролитов с прослоями аргиллитов. Отложения палеозоя, мезозоя и кайнозоя в западной части Мезенской синеклизы имеют небольшую мощность либо отсутствуют.
Источниками урана Мезенской синеклизы являются, вероятно, породы Балтийского щита. В настоящее время в пределах Карельской урановой провинции открыто 8 небольших месторождений урана, свыше 200 рудопроявлений и несколько тысяч точек урановой минерализации (Металлогения…, 1999). Высокие содержания урана отмечаются в породах и подземных водах венда падунской свиты.
В гидрогеологическом отношении изучаемая территория относится к Северо-Двинскому артезианскому бассейну (Петров, Семенчук, 2017). Рассматриваемая нами часть разреза относится к зоне активного водообмена. Время полного водообмена здесь составляет 100–1000 лет (Малов, 2004).
Изучение поведения урана в подземных водах падунской свиты венда является актуальной задачей, поскольку эти воды могут использоваться в питьевых и бальнеологических целях. Кроме этого, на изучаемой территории ведется разработка полезных ископаемых карьерным методом, которая приводит к изменению гидродинамического режима подземных вод зоны активного водообмена. Это может быть следствием откачки вод из карьеров и скважин. При вскрышных работах происходит обнажение горных пород, они становятся доступны для воздействия атмосферным осадкам и воздуху. В совокупности эти условия интенсифицируют протекание процессов взаимодействия воды и горных пород.
ИСХОДНЫЕ ДАННЫЕ
В качестве данных об исходном химическом составе воды использован состав подземных вод четвертичного водоносного горизонта изучаемого района. Подземные воды этого горизонта являются ультрапресными с величиной pH 7.8, имеют гидрокарбонатный кальциево-магниевый состав. Для целей моделирования химические концентрации растворенных частиц (Malov, 2018), включая концентрацию растворенного кислорода O2 aq (Малов и др., 2009), мы пересчитали в моляльности (табл. 1).
Таблица 1.
Химический состав воды из четвертичного водоносного горизонта изучаемой территории
| Компонент | Содержание, мг/л (Malov, 2018; Малов и др., 2009) |
Содержание, моль/кг H2O (пересчет авторов) |
|---|---|---|
| Ca2+ | 66.5 | 0.0017 |
| Mg2+ | 33.6 | 0.0014 |
| Na+ | 9.15 | 0.0004 |
| K+ | 2.28 | 0.000058 |
| HC${\text{O}}_{3}^{ - }$ | 353 | 0.006 |
| S${\text{O}}_{4}^{{2 - }}$ | 26.3 | 0.00028 |
| Cl– | 3.26 | 0.000093 |
| O2 aq | 1.8 | 0.00005625 |
За исходную вмещающую породу принят состав зеленовато-серых алевролитов падунской свиты венда. Эта свита частично состоит из алевролитов, но в нашей модели мы приняли весь состав свиты за алевролиты, поскольку целью нашей работы было изучение поведения урана, а именно условий его мобилизации из пород, форм нахождения в воде и трансформации минералов. Мы выбрали зеленовато-серый алевролит, характеризующийся более высокими, по сравнению с красноцветными алевролитами, содержаниями урана. Это, по-видимому, свидетельствует о его меньшей промытости и преобразованности.
С использованием данных рентгенофазового анализа химический состав зеленовато-серых алевролитов (Malov, Zykov, 2020) был пересчитан в минеральный (табл. 2). Содержание урана в породе определено альфа-спектрометрическим методом. Полагалось, что он находится в виде рассеянного уранинита (β-UO2cr).
Таблица 2.
Модельный минеральный состав образца зеленовато-серых алевролитов падунской свиты венда Мезенской синеклизы
| Минерал | Весовые % | Моль/кг породы |
|---|---|---|
| Кварц | 65.95 | 10.991 |
| Микроклин | 0.92 | 0.0331 |
| Альбит | 0.49 | 0.02644 |
| Мусковит | 11.38 | 0.331 |
| Каолинит | 13.39 | 0.519 |
| Флогопит | 4.65 | 0.112 |
| Гематит | 1.99 | 0.124 |
| Хлорит (дафнит) | 0.54 | 0.00821 |
| Кальцит | 0.70 | 0.0696 |
| Уранинит | 0.00035 | 0.000058 |
Для целей моделирования размер зерен всех минералов был принят равным 0.1 мм, степень доступности поверхности зерен минералов фильтрующейся подземной воде F = 0.001.
МЕТОДИКА МОДЕЛИРОВАНИЯ
В работе предпринята попытка рассчитать перераспределение урана между водным раствором и алевролитом в верхних участках разреза падунской свиты. Обычно при термодинамическом моделировании подобных систем полагается, что насыщенная концентрация урана в водном растворе определяется окислительно-восстановительным минеральным буфером вмещающих пород (в нашем случае равновесием железистый хлорит-гематит). Однако, в условиях достаточно низких температур и быстрого водообмена, химическое равновесие между подземной водой и породой, по-видимому, не успевает установиться. Поэтому помимо расчета равновесного состава системы вода–исходный алевролит, мы использовали равновесно-кинетическую модель взаимодействий, учитывающую величины скоростей растворения различных минералов, зависящие от температуры, кислотности водного раствора и степени насыщения раствора относительно этих минералов.
Примененная здесь равновесно-кинетическая модель необратимых химических взаимодействий в системе раствор-порода описана в (Мироненко, Золотов, 2012; Zolotov, Mironenko, 2007). Модель основана на принципе частичного равновесия (Helgeson et al., 1968), который сводится к следующим допущениям: (1) образование вторичных минералов осуществляется через стадию растворения первичных, (2) все компоненты раствора находятся в равновесии друг с другом, (3) осаждение вторичных минералов контролируется растворимостью минералов и происходит быстрее, чем растворение минералов, которое является лимитирующем этапом в процессе. Другими словами, состав раствора определяется скоростью растворения первичных и вторичных минералов, равновесием между растворенными веществами и равновесием между растворенными веществами и вновь осажденными твердыми веществами. Таким образом, инконгруэнтное растворение минералов описывается через конгруэнтное растворение первичных минералов и осаждение вторичных минералов. На каждом временном шаге минеральная ассоциация состоит из неизмененных первичных минералов, ранее образованных вторичных фаз и вновь выпавших минералов, находящихся в равновесии с раствором.
Моделирование заключается в последовательном расчете серии частичных равновесий в системах, валовый химический состав которых рассчитывается из состава водного раствора на предыдущем временном шаге с учетом масс и состава минералов, растворившихся в течение данного шага за время Δt. Кинетика растворения большинства минералов при постоянном рН достаточно хорошо описывается реакциями псевдо-нулевого порядка (Brantley, 2004) с соответствующим замедлением при приближении к насыщению (Lasaga, 1981). Для того, чтобы изменение рН в течение каждого шага по времени не приводило к существенным изменениям в скоростях растворения, продолжительность временного шага Δt должна быть достаточно малой, в ходе расчётов она регулируется автоматически.
Равновесно-кинетическая модель реализована на основе комплекса GEOCHEQ_M (Мироненко и др., 2008). Основу базы термодинамических данных составляет известная база SUPCRT92 (Johnson et al., 1992) с многочисленными дополнениями. Для наиболее важных силикатов, алюмосиликатов, карбонатов, оксидов, гидроксидов в ней также содержатся значения кинетических параметров для расчета скоростей конгруэнтного растворения минералов в зависимости от рН для 25°С, а также энергии активации этих реакций. Для расчета скорости растворения гематита в этой работе использованы кинетические константы гетита. Для оксидов урана и гетита были взяты кинетические уравнения конгруэнтного растворения в близнейтральных растворах из компиляции (Palandri, Kharaka, 2004):
$r = K_{{neutral}}^{{{\text{298}}{\text{.15K}}}}{{e}^{{\frac{{ - {{E}_{{neut}}}}}{{R\left( {\frac{1}{{T~~~~}}~\,\, - \,\,~~\frac{1}{{298.15}}} \right)}}}}},~$
где r – скорость растворения, mol m–2 s–1. Для оксидов урана $K_{{neutral}}^{{298.15\,{\text{K}}}}$ = –7.98, Eneut = 32.0 kJ/mol и для гетита $K_{{neutral}}^{{298.15\,{\text{K}}}}$ = –7.94, Eneut = 86.5 kJ/mol. При этом полагалось, что оксиды урана растворяются конгруэнтно, а последующее окисление или восстановление урана в растворе происходит достаточно быстро.
Кинетические данные растворения кварца взяты из (Brady, Walther, 1990), для хлорита и иллита из (Алексеев, 2007), для альбита и микроклина из (Brantley, 2004; Blum, Stillings, 1995), для мусковита и биотита аппроксимированы из (Алексеев, 2005), для каолинита из (Алексеев, 2005), для кальцита из (Покровский и др., 2009).
СХЕМА ПРОВЕДЕНИЯ РАССЧЕТОВ
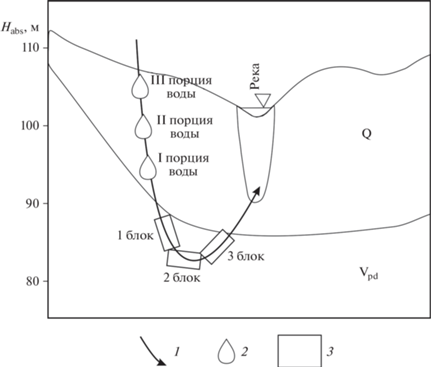
Моделирование проведено по следующему сценарию. Нисходящий поток пресных метеорных вод из четвертичного горизонта дискретными порциями поступает в падунскую свиту. Ее верхняя часть была схематично разделена на три последовательных блока. Соотношение вода/порода, исходя из значений активной пористости 10%, было принято равным 1 : 10. Рассчитывалось взаимодействие каждого блока породы с тремя последовательными порциями воды. Каждая порция находилась в каждом блоке 100 лет, химически взаимодействуя с породой, затем замещалась следующей порцией, а сама вытеснялась в следующий блок. Таким образом, продолжительность взаимодействия воды с породой в каждом блоке составляла 300 лет, или всего, отсчитывая от начала взаимодействий в первом блоке, около 500 лет. По оценке (Малов, 2004) полный водообмен в рассматриваемой зоне может происходить в пределах 1000 лет. Схема расчетов приведена на рис. 1. Моделирование проведено для пластовой температуры 4°С (Malov, 2018).
Рис. 1.
Схема проведения расчетов. Условные обозначения: 1 – направление движения воды в зоне активного водообмена, 2 – порции воды, поступающие из четвертичного горизонта, 3 – последовательные блоки породы.
В качестве возможных твердых фаз рассматривались 17 минералов: альбит, аннит, кальцит, клинохлор, дафнит, гетит, магнетит, микроклин, мусковит, флогопит, иллит, кварц, каолинит, уранинит, β-UO2.25, β-UO2.333, β-UO2.666.
В водном растворе рассматривались 69 частиц: H2O(aq), OH–, H+, H2(aq), O2(aq), ${\text{HCO}}_{3}^{ - },$ ${\text{CO}}_{3}^{{ - 2}},$ CO2(aq), CH4(aq), ${\text{SO}}_{4}^{{ - 2}},$ HS${\text{O}}_{4}^{ - }$, HS–, H2S(aq), Cl–, Ca+2, CaOH+, ${\text{CaHSiO}}_{3}^{ + },$ CaCl+, ${\text{CaHCO}}_{3}^{ + },$ Ca CO3(aq), Mg+2, ${\text{MgHCO}}_{3}^{ + },$ ${\text{MgHSiO}}_{3}^{ + },$ MgOH+, MgCl+, Na+, K+, SiO2(aq), ${\text{HSiO}}_{3}^{ - },$ Al+3, AlO+, ${\text{AlO}}_{2}^{ - },$ AlOH+2, HAlO2(aq), Fe+3, FeCl+2, FeO+, ${\text{FeO}}_{2}^{ - },$ FeOH+2, HFeO2(aq), Fe+2, FeCl+, FeCl2(aq), FeO(aq), FeOH+, ${\text{HFeO}}_{2}^{ - },$ UO2CO3(aq), ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{(C}}{{{\text{O}}}_{{\text{3}}}})_{2}^{{ - 2}},$ ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{3}^{{ - 4}},$ UO2SO4(aq), ${\text{UO}}_{2}^{{ + 2}},$ UO3(aq), ${\text{UO}}_{4}^{{ - 2}},$ ${\text{HUO}}_{4}^{ - },$ UO2OH+, ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{(OH)}}_{3}^{ - },$ ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{(OH}})_{4}^{{ - 2}},$ (UO2)2OH+3, U+4, UO+2, UO2(aq), ${\text{HUO}}_{3}^{ - },$ UOH+3, ${\text{HUO}}_{2}^{ + },$ ${\text{UO}}_{2}^{ + },$ ${\text{UO}}_{3}^{ - },$ UO2OH(aq), HUO2(aq), UOH+2.
РЕЗУЛЬТАТЫ МОДЕЛИРОВАНИЯ
Равновесное моделирование
Вначале мы рассчитали равновесный состав системы, соответствующей 1 кг исходного алевролита плюс 1 кг воды из четвертичного водоносного горизонта. Для равновесного моделирования был использован программный комплекс GEOCHEQ (Мироненко и др., 2008). Равновесия в нем рассчитываются методом минимизации свободной энергии Гиббса системы.
Рассчитанная равновесная минеральная ассоциация (табл. 3) отличается от исходного минерального состава (табл. 2).
Таблица 3.
Рассчитанный равновесный минеральный состав
| Минерал | Моли |
|---|---|
| Дафнит | 0.0082 |
| Иллит | 0.53 |
| Клинохлор | 0.051 |
| Кальцит | 0.071 |
| Каолинит | 0.35 |
| UO2.25(cr) | 0.000058 |
| Кварц | 10.9 |
| Альбит | 0.025 |
| Гетит | 0.22 |
Основные изменения следующие: иллит и клинохлор образовались вместо микроклина, мусковита и флогопита, количество каолинита уменьшилось, вместо гематита образовался гетит. Уранинит преобразовался в UO2.25(cr). Количество альбита незначительно уменьшилось.
Что касается водного раствора, то его минерализация существенно не изменилась. Несколько уменьшилось содержание кальция, возросла концентрация натрия. Концентрация урана составила 1.26 × 10–8 моль/кг H2O (3 мкг/л).
Равновесно-кинетическое моделирование
Что касается равновесно-кинетического моделирования, то вследствие очень малых скоростей взаимодействия минералов с водным раствором рассчитанный макроминеральный состав вмещающей породы практически не изменяется. Например, исходное содержание железистого хлорита дафнита в неизмененной породе составляло 0.008214 моль/кг, а его рассчитанное количество в первом блоке породы после прохождения трех порций раствора составило 0.008210 моль/кг. Количество кальцита в этом же блоке увеличилось от 0.069643 до 0.070036 моль/кг. Изменения в содержаниях таких минералов как каолинит, кварц, мусковит, альбит, микроклин, флогопит, гематит еще менее заметны. Среди новообразованных минералов следует отметить иллит в количестве 0.0000015 моль/кг. Несмотря на явно завышенную скорость растворения гематита (мы брали кинетические константы для гетита), его влияние на окисление урана меньше, чем влияние растворенного кислорода. Его количество, за счет окисления дафнита, увеличилось незначительно – от 0.124375 до 0.124450 моль/кг.
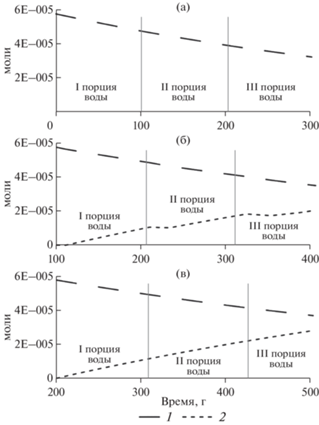
Изменение содержания урана в растворе (рис. 2) и породе (рис. 3) проявлено более заметно. Основным фактором окисления урана выступает растворенный в воде кислород (рис. 2а–2в). Рассчитанное содержание урана в водном растворе возрастало в каждой порции воды до 1.13 × 10–4 моль/кг Н2О (27 мг/л) до тех пор, пока не был израсходован растворенный кислород. В каждой новой порции воды максимальная концентрация урана достигается несколько позже, чем в предыдущей. Далее концентрация урана начинает плавно падать, но остается достаточно высокой; при этом, на фоне продолжающегося растворения уранинита, в породе появляется новый минерал урана – β-UO2.25 (рис. 3).
Рис. 2.
Рассчитанное изменение концентрации урана, растворенного кислорода, величины pH и форм нахождения урана в первой (а, г), второй (б, д) и третьей (в, е) порциях воды во времени по мере фильтрации. Условные обозначения: 1 – pH, 2 – O2(aq), 3 – ∑U(aq), 4 – ${\text{HUO}}_{4}^{ - },$ 5 – ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}_{2}^{{2 - }},$ 6 – UO3(aq), 7 – UO2CO3(aq), 8 – UO2OH–, 9 – ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{(C}}{{{\text{O}}}_{3}})_{3}^{{4 - }}.$
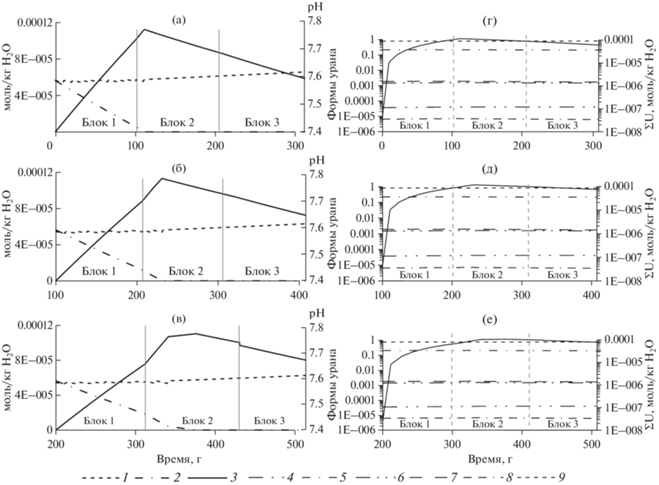
Рис. 3.
Растворение уранинита (1) и осаждение β‑UO2.25 (2) в первом (а), втором (б) и третьем (в) блоках породы во времени.
Практически весь уран в растворе находится в виде U(VI). Основными его формами являются карбонатные комплексы уранила (рис. 2г–2е). Доля ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{C}}{{{\text{O}}}_{{\text{3}}}}} \right)_{3}^{{4 - }}$ составляет около 0.79 от общего содержания урана. Доля комплекса ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{(C}}{{{\text{O}}}_{{\text{3}}}}{\text{)}}_{2}^{{2 - }}$ составляет 0.20–0.22. Комплексы UO2(CO3)aq и UO3aq составляют 0.0017–0.0019 и 0.0014–0.0016 соответственно. Другие комплексы имеют резко подчиненное значение. Распределение урана по формам практически не изменяется в ходе взаимодействий.
Макрокомпонентный состав воды изменяется слабо. Она остается гидрокарбонатной кальциево-магниевой.
ЗАКЛЮЧЕНИЕ
Проведенное равновесно-кинетическое моделирование показывает, что в условиях достаточно быстрой фильтрации холодных метеорных вод через уранинит-содержащие породы существенное накопление урана в воде происходит до тех пор, пока в растворе есть растворенный кислород. В отсутствии растворенного кислорода уранинит продолжает растворяться, хотя и в меньшей степени и частично переоткладывается в виде β-UO2.25. Равновесный расчет показал, что минеральной ассоциации гематит–дафнит парагенен β-UO2.25. Вследствие низких скоростей растворения гематита, Fe(II)-содержащих алюмосиликатов и уранинита, а также большей растворимости более окисленных оксидов урана, приближение к равновесию в отношении урана начинает заметно проявляться лишь после прекращения стадии конгруэнтного растворения уранинита и исчерпания растворенного кислорода. Сравнение результатов равновесного и равновесно-кинетического моделирования показало, что для изучаемых условий учет скорости растворения минералов является необходимым условием для адекватного описания химических взаимодействий, протекающих в далекой от равновесия системе.
Изменения гидродинамического режима, происходящие вследствие активной разработки месторождений алмазов, заключаются в ускорении водообмена в верхней зоне разреза. Иными словами, будет происходить более интенсивное промывание пород, которое будет способствовать мобилизации урана.
Работа выполнена при финансовой поддержке гранта РФФИ 20-05-00045 и Министерства образования и науки РФ (проект № AAAA-A19-119011890018-3). Работа в части пополнения базы данных GECHEQ M кинетическими константами выполнена по госзаданию лаборатории моделирования гидрогеохимических и гидротермальных процессов ГЕОХИ РАН.
Список литературы
Алексеев В.А., Букаты М.Б., Зверев В.П., Мироненко М.В., Рыженко Б.Н., Чарыкова М.В., Чудаев О.В., Шварцев С.Л. (2005) Геологическая эволюция и самоорганизация системы вода–порода. Том 1. Система вода-порода в земной коре: взаимодействие, кинетика, равновесие, моделирование. Новосибирск: изд-во СО РАН, 244 с.
Алексеев В.А. (2007) Уравнения скоростей реакций растворения монтмориллонита, иллита и хлорита. Геохимия. (8), 842-853.
Alekseyev V.A. (2007) Equations for the dissolution reaction rates of montmorillonite, illite, and chlorite. Geochem. Int. 45 (8), 770-780.
Малов А.И. (2004) Взаимодействие вода–порода в песчано-глинистых отложениях венда Мезенской синеклизы. Литология и полезные ископаемые. (4), 401-413.
Малов А.И., Киселев Г.П., Рудик Г.П., Зыков С.Б. (2009) Изотопы урана в подземных водах Мезенской синеклизы. Водные ресурсы. 36(6), 711-721.
Малов А.И., Сидкина Е.С., Рыженко Б.Н. (2017) Модель месторождения алмазов им. М.В. Ломоносова как системы “вода–порода”: формы миграции, насыщенность подземных вод относительно породообразующих и рудных минералов, экологическая оценка качества вод. Геохимия. (12), 1128-1140.
Malov A.I., Sidkina E.S., Ryzhenko B.N. (2017) Model of the Lomonosov diamond deposit as a water–rock system: Migration Species, Groundwater Saturation with Rock-Forming and Ore Minerals, and Ecological Assessment of Water Quality. Geochem. Int. 55(12), 1118-1130.
Металлогения Карелии (1999) / Под ред. С.И. Рыбакова, А.И. Голубева. Петрозаводск: изд-во КарНЦ РАН, 310.
Мироненко М.В., Мелихова Т.Ю., Золотов М.Ю., Акинфиев Н.Н. (2008) GEOCHEQ_M – комплекс для термодинамического и кинетического моделирования геохимических процессов в системе вода–порода–газ. Версия 2008. Вестник ОНЗ РАН.
Мироненко М.В., Золотов М.Ю. (2012) Равновесно-кинетическая модель взаимодействий вода-порода. Геохимия. (1), 3-9.
Mironenko M.V., Zolotov M.Y. (2012) Equilibrium-kinetic model of water-rock interaction. Geochem. Int. 50(1), 1-7.
Петров В.В., Семенчук А.А. (2017) Эколого-гидрогеохимические условия Северо-Двинского бассейна подземных вод. Региональная геология и металлогения. 71, 84-92.
Blum A.E., Stillings L.L. (1995) Feldspar dissolution kinetics. Chemical Weathering Rates of Silicate Minerals. Rev. Mineral. Geochem Ed. A.F. White and S.L. Brantley. 31, 291-351.
Brady P.V., Walther J.V. (1990) Kinetics of quartz dissolution at low temperatures. Chem. Geol. 82, 253-264.
Brantley S.L. (2003) Reaction kinetics of primary rock-forming minerals under ambient conditions. Treatise on Geochemistry. Ed. H.D. Holland. Amsterdam: Elsevier, 73-117.
Dutova E.M., Nikitenkov A.N., Pokrovskiy V.D., Banks D., Frengstad B.S., Parnachev V.P. (2017) Modelling of the dissolution and reprecipitation of uranium under oxidising conditions in the zone of shallow groundwater circulation. J. Environ. Radioact. 178, 63-76.
Grenthe I., Fuger J., Konings R.J.M., Lemire R.J., Muller A.B., Nguyen-Trung C., Wanner H. (2004). Chemical Thermodynamics of Uranium (reprint) Ed. H. Wanner and I.Forest. Paris: OECD Nucl. Energy Agency, 735.
Guillaumont R., Fanghänel T., Fuger J., Grenthe I., Neck V., Palmer D.A., Rand M.H. (2003) Update on the Chemical Thermodynamics of Uranium, Neptunium, Plutonium, Americium, and Technetium. Chemical Thermodynamics 5 Amsterdam: Elsevier, 918.
Helgeson H.C., Brown T.H., Nigrini A., Jones T.A. (1970) Calculation of mass transfer in geochemical processes involving aqueous solutions. Geochim. Cosmochim. Acta. 3, 569-592.
Helgeson H.C., Kirkham D.H., Flowers G.C. (1981) Theoretical prediction of the thermodynamic behavior of aqueous electrolytes at high pressures and temperatures: IV. Calculation of activity coefficients, osmotic coefficients, and apparent molal and standard and relative partial molal properties to 600°C. Am. J. Sci. 281, 1249-1516.
Johnson J.W., Oelkers E.H., Helgeson H.C. (1992) SUPCRT92: A software package for calculating the standard molal thermodynamic properties of minerals, gases, aqueous species, and reactions from 1 to 5000 bar and 0 to 1000°C. Computers and Geosciences. 18(7), 899-947.
Lasaga A.C. (1981) Transition state theory. Rev. Miner. 8, 135-169.
Malov A.I. (2018) Evolution of groundwater chemistry in coastal aquifers of the south-eastern White Sea area (NW Russia) using 14C and 234U–238U dating. Sci. Total Environ. 616-617, 1208–1223.
Malov A.I., Zykov S.B. (2020) Study of the Mobilization of Uranium Isotopes in a Sandstone Aquifer in Combination with Groundwater Data. Water. 12, 112.
Oelkers E.H., Helgeson H.C., Shock E.L., Sverjensky D.A., Johnson J.W., Pokrovskii V.A. (1995) Summary of the Apparent Standard Partial Molal Gibbs Free Energies of Formation of Aqueous Species, Minerals, and Gases at Pressures 1 to 5000 Bars and Temperatures 25 to 1000°C. J. Phys. Chem. Ref. Data. 24(4), 1401-1560.
Palandri J., Kharaka Y. (2004) A compilation of rate parameters of water-mineral interaction kinetics for application to geochemical modeling. U.S. Geological Survey: Menlo Park, California, 64.
Pokrovsky O.S., Golubev S. V., Schott J., Castillo A. (2009) Calcite, dolomite and magnesite dissolution kinetics in aqueous solutions at acid to circumneutral pH, 25 to 150°C and 1 to 55 atm. pCO2. Chem. Geol. 265(1), 20-32.
Shock E.L., Sassani D.C., Betz H. (1997) Uranium in geologic fluids: Estimates of standard partial molal properties, oxidation potentials, and hydrolysis constants at high temperatures and pressures. Geochim. Cosmochim. Acta. 61(20), 4245-4266.
Zolotov M.Y., Mironenko M.V. (2007) Timing of acid weathering on Mars: A kinetic-thermodynamic assessment. J. Geophys. Res.: Planets 112.
Дополнительные материалы отсутствуют.


