Геохимия, 2023, T. 68, № 10, стр. 1059-1072
Участие мелких млекопитающих в биогенном транзите микроэлементов при химическом загрязнении среды
С. В. Мухачева a, *, В. С. Безель a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: msv@ipae.uran.ru
Поступила в редакцию 06.03.2023
После доработки 08.04.2023
Принята к публикации 12.04.2023
- EDN: VBGPBQ
- DOI: 10.31857/S0016752523100096
Аннотация
Рассмотрено участие мелких млекопитающих (ММ) в миграции эссенциальных (Cu, Zn) и токсических (Cd, Pb) микроэлементов (МЭ) в лесных экосистемах в условиях сильного химического загрязнения среды (1990–2000 гг.) крупным медеплавильным комбинатом (Средний Урал, Россия) и после существенного сокращения его выбросов (2010–2019 гг.). Своеобразие транзитных пищевых потоков (ТПП) в градиенте загрязнения определялось составом и обилием животных разных трофических групп (фитофагов, миксофагов, зоофагов), а также спецификой их питания. Сокращение выбросов сопровождалось позитивными сдвигами в сообществах ММ, выражавшимися в увеличении численности и структурных перестройках отдельных трофических групп, которые привели к частичным изменениям в составе и количестве потребляемых кормов, а также содержанию в них МЭ. К концу периода наблюдений в фоновой зоне ТПП, контролируемые животными, для большинства МЭ (Cu, Zn, Cd) оставались стабильными, для Pb – 2-кратно снизился, но не в результате снижения выбросов. На загрязненных участках величина ТПП Zn не изменилась, Cd – увеличилась, Cu и Pb – снизилась. Сделан вывод, что в таежной зоне основной вклад в динамику биогенных потоков МЭ во времени и пространстве вносила группа миксофагов, доминировавшая в градиенте загрязнения.
ВВЕДЕНИЕ
В функционировании природных биогеоценозов (БГЦ) важнейшую роль играют пищевые цепи живых организмов, где происходит направленная передача вещества и энергии от источников (автотрофов) к потребителям (гетеротрофам). Отдельные звенья пищевых цепей, состоящие из сходных по типу питания организмов, объединяют в трофические уровни, каждый из которых в сложной взаимосвязанной системе выполняет свои функции (Вернадский, 1994; Ковальский, 1974; Покаржевский, 1985 и др.).
Мелкие млекопитающие (ММ) – традиционные модельные объекты разноплановых экологических исследований – объединяют представителей двух трофических уровней: консументов I-го (фитофаги) и II-го (зоофаги) порядков. Первый включает грызунов (отр. Rodentia) с широким кормовым спектром – от узкоспециализированных видов (зеленояды, семенояды) до миксофагов, использующих в пищу как растительные, так и животные объекты. Второй уровень представлен насекомоядными (отр. Eulipotyphla) и мелкими хищными (отр. Carnivora), которые питаются преимущественно животной пищей, дополняя рацион растительными кормами. Потоки химических элементов через популяции ММ являются основной формой их участия в круговороте веществ, реализуемого благодаря транзиту элементов в составе корма через желудочно-кишечный тракт, а также за счет депонирования элементов в организмах животных с последующим их отмиранием (Безель и др., 2007; Ермаков, Тютиков, 2008; Покаржевский, 1985).
В условиях длительного антропогенного воздействия на природные биогеоценозы устойчивость миграционнных потоков химических элементов нарушается, что приводит к деформациям исходных биогеохимических циклов. Результатом этих изменений является дисбаланс глобальной системы массообмена веществом и энергией между организмами и средой, которая лежит в основе существования биосферы (Ковальский, 1991).
Анализ последствий загрязнения природной среды для живых организмов зачастую ограничивается мониторингом содержания химических элементов в депонирующих средах (в почвенном и снеговом покрове, подстилке) и ограниченном наборе индикаторных видов, которые представляют различные компоненты биоты, выступающие в качестве накопителей МЭ (мхах, лишайниках, сосудистых растениях, беспозвоночных, млекопитающих). Особое значение в этих условиях приобретает положение В.В. Ковальского (1982) о биогеохимических пищевых связях в качестве приоритетного подхода к мониторингу состояния природной среды. Такой подход позволяет оценить в какой мере сохранившиеся компоненты биоты способны выполнять биоценотические функции и, прежде всего, поддерживать необходимый уровень биогенного обмена. Устойчивое функционирование природных систем определяется целостной трофической структурой БГЦ, поскольку его высшие уровни, выступающие в качестве фактора интенсификации и стабилизации биогенных циклов МЭ, часто испытывают максимальное токсическое воздействие.
Ранее (Безель и др., 2007) на примере ММ двух трофических уровней, обитающих в зоне действия крупного медеплавильного завода (Средний Урал, Россия) в период стабильно высоких выбросов, было показано, что деформация биогенных потоков, контролируемых животными, обусловлена не только повышенным поступлением МЭ с пищей, но, в значительной мере, определяется уровнем численности локальных видовых популяций и положением видов в трофической структуре БГЦ. Анализ многолетней (1990–2020 гг.) динамики сообществ ММ позволил сделать вывод, что многократное сокращение выбросов инициировало в них восстановительные процессы, при этом выраженность позитивных сдвигов у представителей разных трофических групп (ТГ) была неодинаковой и зависела от уровня загрязнения территории, который опосредованно влиял на качество местообитаний (Мухачева, 2021). Изменится ли биогеохимический обмен МЭ через популяции ММ после существенного снижения промышленных выбросов? Какова роль отдельных ТГ в транзитном потоке эссенциальных и токсических МЭ в разные периоды?
Цель работы – проанализировать динамику транзитного потока МЭ (Cu, Zn, Cd, Pb) через популяции ММ, населяющие лесные биоценозы в окрестностях крупного медеплавильного завода в периоды стабильно высоких и почти прекратившихся выбросов. Тестировали две гипотезы: 1) транзитный пищевой поток МЭ через симпатрические популяции ММ разных трофических групп неодинаков и определяется как спецификой питания, так и численностью животных; 2) постепенное восстановление компонентов биоты, начавшееся после сокращения выбросов, приведет к выравниванию количественных показателей транзитных пищевых потоков изученных МЭ через сообщества ММ на фоновых и загрязненных территориях.
МЕТОДИКА
Источник выбросов
Исследования выполнены в окрестностях Среднеуральского медеплавильного завода (СУМЗ) – крупнейшего в России предприятия по первичной выплавке меди и производству серной кислоты, расположенного в 50 км к западу от г. Екатеринбурга. За длительный (с 1940 г.) период непрерывной работы в его окрестностях сформировалась контрастная техногенная геохимическая аномалия, в почвах которой содержание тяжелых металлов превышало фоновые уровни в 10–100 раз. Характеристика СУМЗа как точечного источника эмиссии дана в публикациях (Воробейчик, Кайгородова, 2017; Kozlov et al., 2009). В 1970-е гг. валовые выбросы достигали пиковых значений, что делало предприятие одним из основных источников промышленного загрязнения в России. Начиная с 1980-х гг. объем выбросов постепенно снижался, а после модернизации производства (с 2010 г.) они не превышают 2.5–5 тыс. т/год. За последние 30 лет валовые выбросы завода сократились более, чем в 50 раз, при этом сильнее всего снизились концентрации SO2 (в 80 раз), Cu (3000 раз), Zn (15 раз) и Pb (8.5 раза). Использованные в работе годы наблюдений условно отнесены к периодам стабильно высоких (1990–2000 гг., I период) и почти прекратившихся (2010–2019 гг., II период) выбросов.
Отлов животных
Ежегодно ММ отлавливали в течение бесснежного периода (с мая по сентябрь) по единой схеме. Ловушки располагали на стационарных линиях (по 25 шт. через 5–7 м, экспозиция – 4 сут с ежедневной однократной проверкой) в елово-пихтовых лесах на разном расстоянии от завода: на импактной (1–3 км от завода, зона сильного загрязнения), буферной (4–10 км, зона умеренного загрязнения) и фоновой (20–30 км, условно чистая зона) территориях. Методика отловов и характеристика участков исследования подробно изложены ранее (Мухачева, 2021). Отработано более 70 тыс. ловушко-суток (34.5 тыс. в I период, 36.4 тыс. – во II), добыто 3287 экз. 14 видов ММ, в том числе 1231 – в фоновой зоне, 2056 – в окрестностях СУМЗ (1741 экз. – в I период, 1546 – во II). В камеральных условиях всех ММ идентифицировали до вида, определяли пол, возраст, репродуктивный статус, а также оценивали размерно-весовые параметры особей. Названия видов соответствуют современным фаунистическим сводкам по насекомоядным, полевкам (Kryštufek, Shenbrot, 2022) и мышиным (Павлинов, Хляп, 2012).
Экспериментальные животные
В зависимости от трофической специализации и таксономической принадлежности все ММ были объединены в четыре группы: миксофагов, семеноядов, зеленоядов и зоофагов. Важнейшие характеристики групп приведены в табл. 1.
Таблица 1.
Характеристика трофических групп мелких млекопитающих, населяющих территории с разным уровнем загрязнения в зоне действия СУМЗ, в периоды cтабильно выкоских (I) и почти прекратившихся (II) выбросов
| Характеристика группы | Трофическая группа | Период | Зона исследования | ||
|---|---|---|---|---|---|
| фоновая | буферная | импактная | |||
| Видовой состав трофической группы | Семенояды (G) | I, II | S_ural, A_agr |
S_ural, A_agr |
S_ural, A_agr, |
| Зеленояды (Н) |
I, II | M_arv, M_agr, A_oecon |
M_arv, M_agr, A_oecon |
M_arv, M_agr |
|
| Миксофаги (M) | I, II | Cl_glar, Cl_rut, Cr_rfc |
Cl_glar, Cl_rut, Cr_rfc |
Cl_glar, Cl_rut, Cr_rfc |
|
| Зоофаги (Z) |
I, II | S_aran, S_caec, S_isod, S_min |
S_aran, S_caec, S_isod, S_min |
S_aran, S_caec, S_isod, S_min |
|
| Абсолютная численность группы (Ni)1, экз/га | G | I/II | 2.31/3.05 | 2.28/3.44 | 2.92/2.33 |
| H | I/II | 2.33/2.00 | 1.89/1.98 | 1.83/1.91 | |
| M | I/II | 14.63/20.16 | 7.44/11.27 | 5.81/4.68 | |
| Z | I/II | 4.29/4.50 | 2.65/3.92 | 2.68/2.87 | |
| ИТОГО | I/II | 23.57/29.71 | 14.28/20.61 | 13.24/11.78 | |
| Масса тела “модельной” особи2, г | G | $\frac{{\text{I}}}{{{\text{II}}}}$ | $\frac{{18.14 \pm 0.86}}{{17.37 \pm 0.52}}$ | $\frac{{17.31 \pm 0.67}}{{17.61 \pm 0.43}}$ | $\frac{{19.07 \pm 0.55}}{{18.91 \pm 0.44}}$ |
| H | $\frac{{\text{I}}}{{{\text{II}}}}$ | $\frac{{33.59 \pm 0.93}}{{31.68 \pm 0.74}}$ | $\frac{{26.74 \pm 1.03}}{{26.60 \pm 0.75}}$ | $\frac{{26.75 \pm 1.64}}{{21.82 \pm 0.71}}$ | |
| M | $\frac{{\text{I}}}{{{\text{II}}}}$ | $\frac{{20.91 \pm 0.21}}{{20.09 \pm 0.14}}$ | $\frac{{20.48 \pm 0.23}}{{20.36 \pm 0.17}}$ | $\frac{{19.92 \pm 0.29}}{{19.83 \pm 0.23}}$ | |
| Z | $\frac{{\text{I}}}{{{\text{II}}}}$ | $\frac{{7.52 \pm 0.43}}{{7.23 \pm 0.31}}$ | $\frac{{5.80 \pm 0.39}}{{5.79 \pm 0.30}}$ | $\frac{{5.19 \pm 0.58}}{{4.75 \pm 0.40}}$ | |
| Cуточное потребление корма “модельной” особью (Mi)1, г сухой массы |
G | I/II | 2.86/2.76 | 2.80/2.83 | 2.89/2.88 |
| H | I/II | 3.97/3.67 | 3.39/3.34 | 3.49/3.13 | |
| M | I/II | 3.06/2.95 | 3.02/2.98 | 2.98/2.97 | |
| Z | I/II | 1.49/1.33 | 1.01/1.02 | 1.07/0.81 | |
| Анализируемая выборка | G | I/II | 40/62 | 66/79 | 96/47 |
| H | I/II | 34/16 | 28/21 | 11/43 | |
| M | I/II | 642/750 | 548/391 | 341/209 | |
| Z | I/II | 156/124 | 188/137 | 89/80 | |
| ИТОГО | I/II | 872/952 | 830/628 | 537/379 | |
Примечания. S_ural – малая лесная мышь, A_agr – полевая мышь, M_arv – обыкновенная полевка, M_agr – пашенная полевка, A_oecon – полевка-экономка, Cl_glar – рыжая полевка, Cl_rut – красная полевка, Cr_rfc – красно-серая полевка, S_aran – обыкновенная бурозубка, S_caec – средняя бурозубка, S_isod – равнозубая бурозубка, S_min – малая бурозубка; 1 – среднее геометрическое значение, 2 – среднее арифметическое значение и ошибка среднего.
Группа “миксофагов” (М) включала лесных полевок р. Clethrionomys (Cl. glareolus, Cl. rutilus) и р. Craseomys (Cr. rufocanus), которые доминировали во всех зонах (от 50 до 75% населения) и отличались широким кормовым спектром – от зеленых частей сосудистых растений, семян и ягод, до грибов, мхов, лишайников, беспозвоночных, изредка – позвоночных. Группа “семеноядов” (G) представлена мышами p. Sylvaemus (S. uralensis) и р. Apodemus (Ap. agrarius), доля в населении 10–20%, в годы пика в окрестностях завода – до 40%. Основные корма – семена (деревьев, кустарников, травянистых растений) и сочные плоды, реже – ягоды, грибы, беспозвоночные. Группу “зеленоядов” (H) составляли серые полевки р. Microtus (M. agrestis, M. arvalis) и р. Alexandromys (A. oeconomus), доля в населении ММ всех зон незначительна, предпочитаемые корма – зеленые части травянистых растений (побеги, листья, стебли), а также ягоды, семена, кора, беспозвоночные. Являясь консументами I-го порядка, ММ групп M, G и H играют роль биокатализаторов, пропуская через желудочно-кишечный тракт потребляемую первичную продукцию, что способствует более полному и интенсивному включению МЭ в биогенный обмен (Покаржевский, 1985).
Особое положение в сообществах ММ занимает группа “зоофагов” (Z), представленная землеройками (p. Sorex) и кротом (р. Talpa). Землеройки характеризуются широкой зоной кормодобывания и разнообразным спектром животных кормов (черви, насекомые, пукообразные, моллюски, реже – мелкие позвоночные), в экстремальных условиях они способны частично переходить на растительные корма. Во всех зонах состав группы был сходным (S. araneus, S. isodon, S. caecutiens и S. minutus), а ее доля не превышала 15–20%, в годы пика могда доходить до 40–50%.
От рассмотренных выше видов ММ кардинально отличается крот – единственый долгоживущий стенотопный вид, который питается преимущественно дождевыми червями, ведет подземный образ жизни и оказывает значительное воздействие на среду за счет роющей деятельности. Но из дальнейшего анализа вид был исключен из-за неравномерного распределения в лесных местообитаниях в целом и полном отсутствии вблизи завода.
Оценивание численности животных
В работе использованы данные по абсолютной численности животных (плотности, экз./га), расчитанные по методике А.Д. Бернштейн с соавторами (1995). Для перевода относительных показателей (экз./100 лов-сут) в абсолютные использовали предложенные авторами коэффициенты, которые корректировали в зависимости от уровня численности.
Чтобы нивелировать влияние циклических колебаний численности, характерных для большинства видов ММ зоны бореальных лесов, для каждого периода использовали результаты за 10 последовательных лет, включавших все фазы популяционной динамики. Отлов животных в течение трех туров (весна, лето, осень) позволил учесть сезонную динамику демографического состава и численности видовых популяций в течение бесснежного периода. В качестве учетной единицы использовали данные за каждый год исследований, суммированные по турам. Средние значения плотности населения ММ в градиенте загрязнения среды в разные периоды приведены в табл. 1.
Суточное потребление корма
Интенсивность потребления корма животными в летне-осенний период в значительной степени зависит от их возраста, пола и репродуктивного состояния (Кузнецов, Михайлин, 1985; Мухачева, 2005). Поэтому для каждой ТГ (с учетом зоны загрязнения и периода наблюдений) оценивали суточное потребление корма “модельной” особью, рассчитанное на основе средневзвешенных значений, отражающих долевое участие видов в ТГ, их демографическую структуру и размерно-весовые характеристики особей (табл. 1). Для грызунов (M, G, H) применяли методику, предложенную Г.В. Кузнецовым и А.П. Михайлиным (1985). Для землероек (Z) расчеты выполнены на основе литературных данных о суточном потреблении корма разными видами (Wołk, 1969) и массе тела экспериментальных особей.
Химический анализ образцов
В качестве интегрального показателя поступления МЭ в организм с пищей использовали содержимое желудка (Мухачева, 2005). Образцы для химического анализа собирали по единому протоколу в течение всего периода наблюдений. У каждой особи извлекали содержимое желудка, высушивали в сушильном шкафу при температуре 75°С до воздушно-сухой массы, упаковывали в герметичные пластиковые пакеты и хранили в до начала аналитических работ. Далее образцы гомогенизировали, взвешивали (около 0.1 г) на аналитических весах КERN-770 (с точностью до 0.0001 г), помещали в тефлоновые сосуды с 7 мл 65%-ной HNO3 (осч) и 1 мл деионизированной H2O, выдерживали в течение 30 мин и затем озоляли в микроволновой печи МWS-2 (Berghof, Германия). После озоления объем пробы доводили до 10 мл деионизированной H2O. Концентрацию Cu, Zn, Cd и Рb (мкг/г сухой массы) в образцах определяли методом атомной абсорбции на спектрометре AAS 6 Vario (Analitik Jena, Германия). Качество измерений оценивали по международному стандартному образцу СRМ 185R (бычья печень). Извлечение составило (в %): Cu – 93.2, Zn – 99.8, Cd – 114.2, Pb – 94.4, предел обнаружения (в мкг/мл): для Cu – 0.013, Zn – 0.005, Cd – 0.001, Pb – 0.013. Если концентрация элемента была ниже предела обнаружения, для статистического анализа использовали значение, равное его 1/2. Проанализировано 1217 образцов содержимого желудков (табл. 2). Пробоподготовка и химический анализ образцов выполнены в 2015–2017 гг. и 2019 г. по стандартным протоколам в лаборатории экотоксикологии популяций и сообществ ИЭРиЖ УрО РАН.
Таблица 2.
Концентрация химических элементов (мкг/г сухой массы) в содержимом желудка ММ разных трофических групп в градиенте загрязнения в периоды стабильно высоких (I) и почти прекратившихся (II) выбросов СУМЗа
| Элемент | Учетный период (годы) | |||||
|---|---|---|---|---|---|---|
| I (1990–1998) | II (2010–2019) | |||||
| Участок исследования | Участок исследования | |||||
| фоновый | буферный | импактный | фоновый | буферный | импактный | |
| Cеменояды | ||||||
| Медь | $\frac{{16.06}}{{4.47 - 103.79}}$ | $\frac{{56.95}}{{14.35 - 991.36}}$ | $\frac{{65.50}}{{2.74 - 706.50}}$ | $\frac{{16.50}}{{3.32 - 92.11}}$ | $\frac{{20.73}}{{4.78 - 122.76}}$ | $\frac{{41.30}}{{134.59 - 217.52}}$ |
| Цинк | $\frac{{71.31}}{{27.04 - 560.30}}$ | $\frac{{122.58}}{{45.23 - 614.38}}$ | $\frac{{126.00}}{{36.04 - 652.21}}$ | $\frac{{72.91}}{{24.86 - 492.31}}$ | $\frac{{78.57}}{{35.58 - 167.40}}$ | $\frac{{106.65}}{{37.99 - 311.57}}$ |
| Кадмий | $\frac{{0.29}}{{{\text{na}} - 3.68}}$ | $\frac{{1.21}}{{0.03 - 8.06}}$ | $\frac{{1.52}}{{0.33 - 18.52}}$ | $\frac{{0.31}}{{{\text{na}} - 2.60}}$ | $\frac{{0.47}}{{0.05 - 5.59}}$ | $\frac{{1.12}}{{0.05 - 5.49}}$ |
| Свинец | $\frac{{2.13}}{{{\text{na}} - 31.48}}$ | $\frac{{11.99}}{{2.55 - 254.68}}$ | $\frac{{17.75}}{{2.96 - 226.43}}$ | $\frac{{1.38}}{{{\text{na}} - 14.40}}$ | $\frac{{2.97}}{{0.29 - 29.40}}$ | $\frac{{5.33}}{{0.12 - 57.02}}$ |
| n | 25 | 18 | 35 | 44 | 55 | 28 |
| Зеленояды | ||||||
| Медь | $\frac{{29.81}}{{8.71 - 131.40}}$ | $\frac{{113.06}}{{35.28 - 752.40}}$ | $\frac{{108.79}}{{40.30 - 750.84}}$ | $\frac{{10.01}}{{3.80 - 24.36}}$ | $\frac{{27.23}}{{8.12 - 83.31}}$ | $\frac{{61.43}}{{19.93 - 229.56}}$ |
| Цинк | $\frac{{110.54}}{{27.04 - 560.30}}$ | $\frac{{192.69}}{{45.23 - 614.36}}$ | $\frac{{187.87}}{{2.74 - 736.50}}$ | $\frac{{56.30}}{{16.72 - 128.71}}$ | $\frac{{139.65}}{{35.54 - 237.03}}$ | $\frac{{162.22}}{{78.49 - 364.36}}$ |
| Кадмий | $\frac{{2.28}}{{{\text{na}} - 27.72}}$ | $\frac{{1.63}}{{0.16 - 22.78}}$ | $\frac{{1.63}}{{1.61 - 22.70}}$ | $\frac{{0.54}}{{0.09 - 4.08}}$ | $\frac{{1.06}}{{0.05 - 28.97}}$ | $\frac{{1.57}}{{0.10 - 3.47}}$ |
| Свинец | $\frac{{24.83}}{{{\text{na}} - 85.58}}$ | $\frac{{16.51}}{{6.31 - 27.20}}$ | $\frac{{16.42}}{{6.05 - 36.75}}$ | $\frac{{2.89}}{{0.36 - 15.38}}$ | $\frac{{4.79}}{{0.45 - 26.94}}$ | $\frac{{18.78}}{{2.65 - 109.91}}$ |
| n | 16 | 11 | 11 | 15 | 14 | 10 |
| Миксофаги | ||||||
| Медь | $\frac{{18.56}}{{2.29 - 223.25}}$ | $\frac{{75.29}}{{6.52 - 1048.80}}$ | $\frac{{101.09}}{{4.11 - 831.78}}$ | $\frac{{16.19}}{{3.74 - 70.76}}$ | $\frac{{41.03}}{{9.83 - 164.22}}$ | $\frac{{95.63}}{{12.76 - 699.98}}$ |
| Цинк | $\frac{{90.10}}{{18.26 - 416.30}}$ | $\frac{{139.00}}{{22.98 - 531.40}}$ | $\frac{{182.41}}{{14.43 - 810.91}}$ | $\frac{{94.12}}{{25.99 - 317.46}}$ | $\frac{{132.38}}{{7.65 - 608.05}}$ | $\frac{{193.17}}{{64.52 - 820.25}}$ |
| Кадмий | $\frac{{0.59}}{{{\text{na}} - 23.60}}$ | $\frac{{2.59}}{{{\text{na}} - 25.06}}$ | $\frac{{3.46}}{{0.35 - 88.63}}$ | $\frac{{0.86}}{{{\text{na}} - 9.23}}$ | $\frac{{2.54}}{{0.03 - 46.39}}$ | $\frac{{7.54}}{{1.52 - 56.46}}$ |
| Свинец | $\frac{{4.61}}{{{\text{na}} - 97.84}}$ | $\frac{{16.85}}{{0.16 - 207.47}}$ | $\frac{{25.92}}{{0.63 - 287.38}}$ | $\frac{{2.36}}{{{\text{na}} - 48.36}}$ | $\frac{{10.42}}{{0.06 - 78.82}}$ | $\frac{{25.76}}{{0.10 - 657.69}}$ |
| n | 238 | 152 | 131 | 157 | 93 | 62 |
| Зоофаги | ||||||
| Медь | $\frac{{19.51}}{{9.70 - 77.00}}$ | $\frac{{70.04}}{{40.70 - 145.00}}$ | $\frac{{63.37}}{{48.50 - 215.50}}$ | $\frac{{18.75}}{{8.37 - 86.64}}$ | $\frac{{61.1}}{{9.8 - 161.5}}$ | $\frac{{74.4}}{{34.2 - 442.0}}$ |
| Цинк | $\frac{{138.83}}{{57.79 - 472.40}}$ | $\frac{{159.86}}{{74.20 - 254.20}}$ | $\frac{{133.57}}{{72.74 - 259.80}}$ | $\frac{{164.18}}{{48.65 - 492.31}}$ | $\frac{{176.68}}{{104.61 - 434.86}}$ | $\frac{{155.75}}{{94.56 - 271.04}}$ |
| Кадмий | $\frac{{4.89}}{{0.80 - 19.76}}$ | $\frac{{4.68}}{{0.18 - 7.68}}$ | $\frac{{4.01}}{{1.83 - 9.39}}$ | $\frac{{4.33}}{{0.16 - 24.75}}$ | $\frac{{11.54}}{{0.42 - 79.68}}$ | $\frac{{3.09}}{{0.16 - 11.29}}$ |
| Свинец | $\frac{{10.50}}{{3.15 - 30.41}}$ | $\frac{{27.35}}{{5.54 - 115.00}}$ | $\frac{{13.97}}{{4.69 - 36.80}}$ | $\frac{{4.57}}{{{\text{na}} - 36.20}}$ | $\frac{{25.66}}{{6.42 - 233.32}}$ | $\frac{{10.81}}{{1.31 - 92.85}}$ |
| n | 17 | 12 | 9 | 37 | 19 | 24 |
Транзитный пищевой поток
Транзитный пищевой поток элементов (ТПП, мг/га сутки) через сообщества ММ представлял собой сумму ТПП через выделенные ТГ животных, рассчитанные для каждого года наблюдений с учетом уровня загрязнения (зоны) и периода наблюдений. Величину ТПП для каждой группы (i) вычисляли как произведение суточного потребления корма “модельной” особью (Mi), концентрации элемента в ее рационе (Сi) и суммарной плотности локальных видовых популяций, составляющих группу (Ni):
Статистический анализ
Распределение концентраций МЭ в большинстве случаев приближалось к логнормальному, поэтому для статистической обработки данные предварительно логарифмировали (Log10). Для показателей плотности животных, суточного потребления корма, содержания МЭ в рационе и величины ТПП рассчитывали среднее геометрическое, минимальное и максимальное значения. Различия между ТГ, зонами и периодами исследования оценивали с помощью дисперсионного анализа. В статистических тестах значимыми считали различия при p < 0.05. Расчеты выполнили в пакете JMP v.11 (Carver, 2014).
РЕЗУЛЬТАТЫ
Плотность населения ММ разных трофических групп
Суммарная плотность сообщества ММ зависела от уровня загрязнения территории (F = 8.75, p = 0.0005), снижаясь по мере приближения к заводу в 1.7–1.8 раза, тогда как период исследований и взаимодействие факторов не оказывали значимого влияния (p > 0.05) на ее динамику. Направленные изменения отмечали в группах миксофагов – в 2–4 раза (F = 10.20, p = 0.0002) и зоофагов – в 1.2–1.6 раза (F = 5.11, p = 0.009). Численность зеленоядов во всех зонах была невысокой и почти не менялась во времени, тогда как семенояды характеризовались отсутствием четких трендов, достигая максимальных значений в импактной (период I) и буферной (период II) зонах. Усиление различий в уровне численности миксофагов в импактной зоне относительно буферных (с 1.3 до 2.4 раз) и фоновых (с 2.5 до 4.3 раз) участков во II-й период обусловлено разнонаправленными тенденциями: увеличением в фоновой (на 40%) и буферной (на 50%) зонах при одновременном снижении (на 25%) в импактной зоне (табл. 1).
Суточное потребление корма особями разных трофических групп
Результаты расчетов суточного потребления корма “модельной” особью (Mi) выявили значимое влияние уровня загрязнения территории (F = = 30.61, p < 0.0001), периода исследований (F = = 28.11, p < 0.0001), принадлежности к ТГ (F = = 332.78, p < 0.0001), а также их взаимодействий (F = 4.57–23.36, p = 0.0001–0.003). В ряду Зеленояды > Миксофаги > Семенояды > Зоофаги количество потребленного корма (в расчете на 1 особь) закономерно снижалось по мере приближения к заводу от I-го периода наблюдений ко II-му (табл. 1).
Концентрации микроэлементов в корме животных разных трофических групп
Концентрации всех рассмотренных МЭ в содержимом желудка консументов I-го порядка, а также Cu и Pb – у консументов II-го порядка закономерно увеличивались по мере приближения к заводу (F = 4.59–330.17, p = 0.0001–0.014).
Cодержание эссенциальных МЭ в корме ММ всех ТГ с загрязненных участков превышало соответствующие фоновые значения в течение всего интервала наблюдений: Cu – в 2.5–5.4 раза, Zn – в 1.1–3 раза (табл. 2). Сокращение выбросов не привело к значимому снижению уровней Cu и Zn в рационах ММ в фоновой и импактной зонах, тогда как на умеренного загрязненных территориях регистрировали значимое уменьшение концентраций обоих элементов – в группе семеноядов (F = 14.21–14.69, p = 0.003), Cu – в остальных группах (F = 12.07–30.92, p = 0.0001–0.003).
Концентрации токсических МЭ в содержимом желудка разных ТГ в пространстве и времени изменялись неодинаково. Так, в корме консументов I-го порядка с загрязненных участков в течение всего интервала наблюдений содержание Pb превышало фоновые значения в 1.3–11 раз, Cd – в 1.5–8 раз (табл. 2). Исключение составляла группа зеленоядов, фоновые особи которой в течение всего I-го периода потребляли с пищей в 1.5 раза больше Pb и Cd, чем в окрестностях завода. У консументов II-го порядка динамика концентраций токсических элементов на протяжении всего временного интервала характеризовалась немонотонными изменениями с максимумом в буферной зоне, при этом во II-й период различия усилились.
Сокращение выбросов (от периода I к II) привело к значимому (F = 3.96–15.752, p = 0.0001–0.05) снижению уровней Pb в рационах семеноядов (все зоны) – в 2–4 раза, миксофагов и зеленоядов (на фоновых и буферных территориях) – в 1.5–10 раз, зоофагов (фоновая зона) – в 2 раза. Концентрации Cd в корме животных большинства ТГ не имели четко выраженных трендов за исключением семеноядов (3-кратное снижение) и зоофагов (увеличение в 3 раза) из буферной зоны, а также миксофагов – из импактной (увеличение в 2 раза).
Транзитный пищевой поток МЭ
Расчетные значения величины суммарных ТПП (мг/га) изученных элементов через сообщества ММ в градиенте загрязнения в разные периоды исследований приведены на рис. 1. Вклад отдельных ТГ в структуру ТПП отражен на рис. 2. Результаты расчетов выявили значимое влияние уровня загрязнения территории, периода исследований, а также взаимодействия факторов (табл. 3).
Рис. 1.
Суммарный транзитный пищевой поток токсических (Cd, Pb) и эссенциальных (Cu, Zn) МЭ через популяции ММ в градиенте загрязнения среды выбросами СУМЗа в периоды стабильно высоких (I) и почти прекратившихся (II) выбросов.
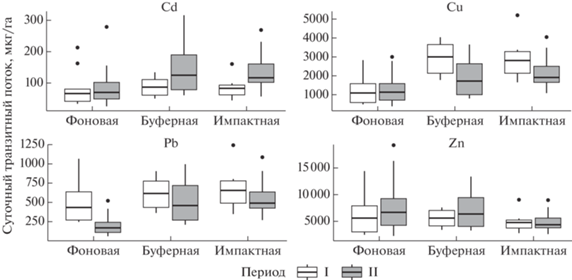
Рис. 2.
Долевое участие разных трофических групп ММ в формировании транзитного пищевого потока эссенциальных и токсических МЭ в градиенте загрязнения среды выбросами СУМЗа в периоды стабильно высоких (I) и почти прекратившихся (II) выбросов.
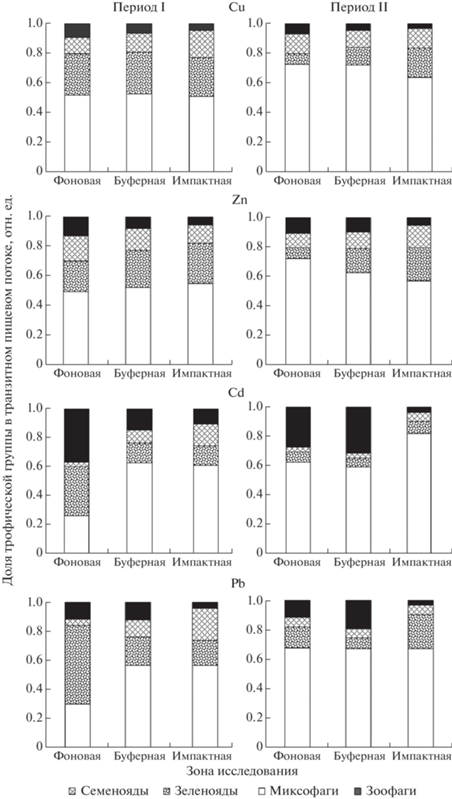
Таблица 3.
Результаты дисперсионного анализа отличий величины транзитного потока изученных элементов через популяции мелких млекопитающих разных трофических групп в градиенте загрязнения в периоды стабильно высоких и почти прекратившихся выбросов СУМЗ (F-критерий, в скобках – достигнутый уровень значимости)
| Источник изменчивости | df | Cu | Zn | Cd | Pb |
|---|---|---|---|---|---|
| Семенояды | |||||
| Зона | 2 | 60.05 (<0.0001) |
1.77 (0.180) |
108.31 (<0.0001) |
126.90 (<0.0001) |
| Период | 1 | 23.75 (<0.0001) |
1.96 (0.168) |
14.52 (0.0004) |
151.42 (<0.0001) |
| Зона × период | 2 | 9.97 (0.0002) |
6.23 (0.004) |
8.53 (0.0006) |
5.89 (0.005) |
| Зеленояды | |||||
| Зона | 2 | 116.69 (<0.0001) |
24.14 (<0.0001) |
0.86 (0.430) |
25.33 (<0.0001) |
| Период | 1 | 230.56 (<0.0001) |
36.63 (<0.0001) |
93.07 (<0.0001) |
254.61 (<0.0001) |
| Зона × период | 2 | 12.66 (<0.0001) |
9.50 (0.0003) |
46.07 (<0.0001) |
100.89 (<0.0001) |
| Миксофаги | |||||
| Зона | 2 | 7.39 (0.002) |
1.00 (0.371) |
11.51 (<0.0001) |
14.05 (<0.0001) |
| Период | 1 | 0.07 (0.797) |
3.37 (0.071) |
14.79 (0.0003) |
0.16 (0.668) |
| Зона × период | 2 | 1.20 (0.310) |
6.74 (0.486) |
0.98 (0.383) |
0.05 (0.954) |
| Зоофаги | |||||
| Зона | 2 | 1.16 (0.322) |
15.76 (<0.0001) |
26.65 (<0.0001) |
24.03 (<0.0001) |
| Период | 1 | 8.72 (0.005) |
1.17 (0.284) |
1.66 (0.203) |
5.55 0.022 |
| Зона × период | 2 | 2.04 (0.139) |
0.66 (0.529) |
10.07 (<0.0001) |
4.02 (0.024) |
| Суммарный поток (все трофические группы) | |||||
| Зона | 2 | 13.47 (<0.0001) |
1.58 (0.215) |
2.44 (0.061) |
11.23 (<0.0001) |
| Период | 1 | 3.53 (0.065) |
1.00 (0.322) |
6.74 (0.012) |
12.24 0.0009 |
| Зона × период | 2 | 1.70 (0.192) |
0.17 (0.848) |
0.89 (0.417) |
3.40 (0.041) |
Величина суммарных ТПП монотонно увеличивалась (в 1.2–3.3 раза) от фоновых участков к более загрязненным: Cu и Pb – в течение обоих периодов, Cd – в I-й период. Во II-й период суммарный ТПП Cd характеризовался нелинейными изменениями с максимумом в буферной зоне, при этом фоновые и импактные значения были сходными. Исключение составлял Zn, флуктуации ТПП которого в пространстве и времени не превышали 20%.
Анализ ТПП с учетом трофической специфики показал, что максимальный вклад в структуру потоков эссенциальных МЭ во всех зонах вносила группа миксофагов, на долю которой приходилось от 50 до 80% величины суммарного ТПП (рис. 2). Минимальный вклад (менее 25%) представители этой группы вносили в суммарные ТПП токсических элементов на фоновых территориях в I-й период. Для остальных ТГ снижение уровня загрязнения (во времени и в пространстве) сопровождалось уменьшением величины ТПП рассмотренных элементов в 2–10 раз. Максимальный вклад (20–50%) эти группы вносили в формирование ТПП токсических МЭ: семенояды и зеленояды – Pb, зоофаги – Cd.
ОБСУЖДЕНИЕ
Согласно классическим представлениям биота формирует и контролирует в биосфере потоки вещества и энергии, обеспечивая постоянство параметров окружающей среды (Вернадский, 1994). Организмы, находящиеся на разных трофических уровнях, активно участвуют в стабилизации экосистем, выступая в роли геохимических барьеров и природных депо химических элементов (Ковальский, 1974; Покаржевский, 1985; Ермаков, Тютиков, 2008). Биогенные циклы, имеющие постоянную интенсивность в естественных (не измененных антропогенным воздействием) БГЦ, можно рассматривать в качестве фактора, обеспечивающего их стабильное функционирование, а деформацию циклов в условиях загрязнения среды – как проявление дестабилизирующих процессов.
Ранее мы показали, что в период высоких выбросов СУМЗа участие животных в формировании биогенных циклов МЭ определялось уровнем загрязнения среды, составом сообществ, их численностью и биомассой (Безель и др., 2007). Располагая обширными данными, достаточно полно характеризующими вышеупомянутые факторы, попробуем выделить наиболее важные для формирования ТПП эссенциальных (Cu, Zn) и токсических (Cd, Pb) элементов при значительном снижении техногенной нагрузки.
Предполагая, что многократное сокращение промышленных выбросов завода приведет к частичному “очищению” компонентов биоты (верхних горизонтов почвы, подстилки, растительности, беспозвоночных), ожидали, что постепенное восстановление среды в окрестностях СУМЗ увеличит экологическую емкость местообитаний (в первую очередь, защитно-кормовых свойств) для представителей различных ТГ.
Динамика сообществ мелких млекопитающих
В ответ на промышленное загрязнение среды в сообществах ММ происходят структурные перестройки, величина и направление которых зависят от типа воздействия, его интенсивности и длительности, а также от специфики видов, составляющих сообщества (Лукьянова, Лукьянов, 1998; Мухачева и др., 2010; Мухачева, 2013, 2021; Катаев, 2017; Kozlov et al., 2005). Предприятия цветной металлургии оказывают на биоту сильное негативное воздействие: по мере приближения к ним видовое богатство и численность ММ уменьшаются как монотонно (Лукьянова, Лукьянов, 1998; Катаев, 2017), так и нелинейно, с максимумом в зоне умеренных нагрузок. Так, в окрестностях меде(никеле)плавильных заводов на Среднем и Южном Урале (Мухачева и др., 2010; Мухачева, 2021), Кольском полуострове (Катаев, 2017; Kozlov et al., 2005) и в Финляндии (Мухачева, 2013) различия в суммарном обилии ММ в буферных и фоновых зонах достигали 1.2–5 раз, буферных и импактных – 5–20 раз. В непосредственной близости от заводов постоянное население ММ как правило отсутствовало (Мухачева и др., 2010; Kozlov et al., 2005).
Анализ многолетней динамики сообществ ММ в зоне действия СУМЗ в показал, что за 30 лет наблюдений реакция животного населения на загрязнение принципиально не изменилась (Мухачева, 2021). В каждый из периодов увеличение загрязнения сопровождалось значимым снижением суммарного обилия и локального разнообразия сообществ, тогда как общее количество видов в фоновой и загрязненных зонах оставалось сходным (13 и 12 видов соответственно). Сокращение выбросов не оказало существенного влияния на сообщество ММ фоновой зоны: оно оставалось монодоминантным (на супердоминанта – рыжую полевку – ежегодно приходилось более 75%), флуктуации видовой структуры были незначительными, а увеличение численности животных к концу наблюдений (за счет миксофагов и семеноядов) было связано с сукцессионными изменениями растительности.
В окрестностях завода сокращение выбросов привело к структурным перестройкам (смене доминантов), а тренды изменения численности животных не совпадали в буферной (увеличение) и импактной (отсутствие изменений) зонах. Увеличение обилия всех ТГ в буферной зоне рассматривали как признак начальных стадий восстановления сообщества ММ за счет улучшения защитно-кормовых свойств местообитаний. На импактных участках позитивные сдвиги в сообществе были выражены лишь в группе зоофагов и проявлялись в увеличении долевого участия и численности доминанта – средней бурозубки (Мухачева, 2021).
Динамика содержания микроэлементов в рационах мелких млекопитающих
В природных популяциях ММ накопление МЭ характеризуется видовой специфичностью. Это значит, что при равных уровнях загрязнителей во внешней среде их неодинаковое содержание в организме животных обусловлено особенностями экологии видов и, прежде всего, питания (Мухачева, 2005, 2022; Gall et al., 2015; Pankakoski et al., 1994). B.A. Hunter с соавторами (1987) выявили существенные различия в содержании МЭ в корме ММ разных ТГ, совместно обитающих в окрестностях завода по рафинированию меди. В расчете на 1 г массы тела зоофаги потребляли больше Cu (в 3 раза) и Cd (12 раз) по сравнению с зеленоядами и семеноядами, а поступление Zn не зависело от типа питания. Основной причиной наблюдаемых различий авторы считают высокое содержание МЭ в корме зоофагов (беспозвоночных) при относительно низких уровнях в растительной пище. Известно также, что грызуны способны эффективно регулировать потребление МЭ путем селективного отбора менее загрязненного корма. Этот феномен был продемонстрирован для некоторых видов мышевидных грызунов в лабораторных (Beernaert et al., 2008) и натурных условиях (Мухачева, 2017; Ozaki et al., 2018).
Согласно нашим данным в фоновой зоне среди совместно обитающих видовых популяций ММ максимальным содержанием МЭ в корме в течение обоих периодов характеризовались зоофаги, минимальным – семенояды, а миксофаги и зеленояды занимали по шкале накопления промежуточное положение. При этом в расчете на 1 г массы тела землеройки (консументы II-го порядка) по сравнению с грызунами (консументами I-го порядка) потребляли с кормом больше МЭ: эссенциальных (Cu, Zn) – в 1.3–5 раз, токсических (Cd, Pb) – в 2.4–22 раза. Аналогичная картина наблюдалась и на умеренно загрязненных территориях, с той разницей, что для эссенциальных МЭ диапазон сузился (1.1–2.7), а для токсических, напротив, увеличился (1.7–35 раз). На сильно загрязненных участках наблюдали смену “лидера” по содержанию МЭ в корме – место зоофагов заняли миксофаги (лесные полевки). По сравнению с землеройками в организм полевок с кормом ежесуточно поступало (в расчете на 1 г массы тела) в 1.1–2.3 раз больше эссенциальных МЭ, в 1.4–6.6 раз – токсических.
В качестве возможных причин подобных изменений на загрязненных территориях мы рассматриваем, с одной стороны, частичную смену кормовых объектов в пределах группы, с другой, структурные изменения в составе ТГ. Оба предположения подтверждаются фактами.
В фоновой и буферной зонах состав кормовых объектов землероек сходен, при этом дождевые черви играют важное значение в питании группы. Однако на умеренно загрязненных участках концентрации Cd и Pb в теле дождевых червей превышают фоновые в 4–7 раз (Нестеркова и др., 2014). Кроме того их пищеварительный тракт содержит частички загрязненной почвы, что значительно увеличивает поступление токсических МЭ в организм землероек с кормом. На импактных участках, напротив, происходит своеобразное “очищение” рационов зоофагов по сравнению с буферной зоной, в результате которого средние уровни МЭ приближаются к фоновым значениям (Мухачева, 2022). Это связано с тем, что вблизи завода в питании всех видов землероек дождевые черви отсутствуют, а основу рациона составляют беспозвоночные замещающих групп (Elateridae, Staphylinidae, Carabidae) с пониженной биоаккумуляцией токсических МЭ (Безель и др., 2007; Мухачева, 2022).
Увеличение концентрации Cd в содержимом желудков миксофагов, населяющих сильно загрязненные территории, в период почти прекратившихся выбросов обусловлено общим повышением уровня элемента в кормовых объектах полевок в 1.5–4 раза вследствие интенсивной аккумуляции Cd в гумусовом горизонте и лесной подстилке (Мухачева, 2017), а также структурными перестройками в группе. Во II-й период наблюдали ротацию доминантов среди миксофагов: лидирующее положение (75% общей численности против 15% в I-й период) занимает красная полевка (Cl. rutilus), корм которой по сравнению с рыжей полевкой (Cl. glareolus) – доминантом I-го периода – содержит в 1.5 раза больше Cu и токсических МЭ.
Структурные перестройки затронули и другие ТГ, наиболее выраженными они были в группе зоофагов. Сокращение выбросов от I-го периода ко II-му сопровождалось уменьшением доли “крупных” видов (S. araneus, S. isodon) в населении землероек фоновой и импактной зон в 2–11 раз (соответственно). Именно этим фактом обусловлено снижение средней массы “модельных особей” (на 4–8%) и суточного потребления корма (на 10–24%) в пределах зон. В градиенте загрязнения общее снижение численности группы и доли крупных видов (при неизменном видовом составе) по мере приближения к заводу привело к 40–60%-ному уменьшению обсуждаемых показателей у импактных землероек по сравнению с фоновыми (табл. 1).
Таким образом, снижение техногенной нагрузки в пространстве (при удалении от завода) и времени (от I-го периода ко II-му) в большинстве случаев сопровождалось общим уменьшением концентраций МЭ (как эссенциальных, так и токсических) в корме животных и затронуло все ТГ. Однако изменения, произошедшие за 30 лет наблюдений, не эквивалентны многократному (в 50 раз) снижению объемов валовых выбросов СУМЗа и содержания в них (в 8–3000 раз) рассмотренныхМЭ (Cu, Zn, Pb).
Динамика транзитных пищевых потоков в пространстве и времени
Предполагали, что сообщества ММ в совокупности характеризуют широкий спектр пищевых предпочтений консументов I и II порядков, отражая в значительной мере состав и уровень химического загрязнения среды. С другой стороны, общий объем суточного потребления МЭ всеми видами, составляющими сообщества ММ, позволяет оценить участие животных в локальных биогеохимических циклах, а также выявить возможные изменения миграционных потоков МЭ в периоды стабильно высоких выбросов и в ходе естественной реабилитации среды после многократного их сокращения. В зависимости от сбалансированности процессов результатами совместного действия рассмотренных факторов могут быть стабилизация, интенсификация или замедление биогеохимического обмена МЭ.
Выполненные расчеты показали, что в течение бесснежного периода на каждом гектаре пихтово-еловых лесов фоновой зоны популяциями ММ за счет потребления с кормом в биогенный обмен (в зависимости от фазы популяционной динамики) ежедневно включается: Zn – от 2.2 до 19.3 мг, Cu – от 0.5 до 3.0 мг, Pb – от 0.06 до 1.1 мг, Cd – от 0.03 до 0.3 мг. В окрестностях завода значения суммарного ТПП Zn было близким к фоновому (2.6–13.3 мг/га), тогда как для остальных элементов регистрировали двукратное превышение величины ТПП: суточное поступление Cu составило от 0.8 до 5.2 мг/га, Pb – от 0.2 до 1.3 мг/г, Cd – от 0.05 до 0.3 мг/га.
Анализ обобщенных (за 10-летние интервалы) данных показал, что характер изменений пищевого транзита изученных МЭ имел много общего. В градиенте загрязнения на протяжении обоих периодов снижение нагрузки сопровождалось увеличением суммарных ТПП Zn на 20–25%, тогда как величина суммарных ТПП остальных элементов, напротив, снижалась (рис. 1). Зональные различия были максимальными для Cu (I-й период) и Pb (II-й период), ТПП которых при удалении от завода закономерно уменьшались в 2.7–3.3 раза (соответственно).
На фоновых территориях сокращение выбросов СУМЗа ожидаемо не привело к значимому снижению величины суммарных ТПП Zn, Cu и Cd. Отсутствие выраженных временны́х изменений можно рассматривать как стабилизацию биогенного обмена этих МЭ, что свидетельствует о низком уровне антропогенного воздействия (в частности, загрязнения) на БГЦ в фоновой зоне. Действительно, содержание МЭ в депонирующих средах (в снеговом покрове, почвенных горизонтах, лесной подстилке) и других компонентах биоты (сосудистые растения, дикорастущие плоды и ягоды, грибы) соответствовало уровням регионального фона (Безель и др., 2010; Воробейчик, Кайгородова, 2017; Трубина и др., 2013, 2014).
За тот же временной интервал величина фонового ТПП Pb по сравнению с исходным значением снизилась вдвое, что можно интерпретировать как замедление обменных процессов. Основной причиной изменений явилось значительное (от 2 до 10 раз) снижение концентраций Pb в корме ММ всех ТГ, обитающих на незагрязненных участках. Следует заметить, что эффект был настолько выраженным, что компенсировать его не смогло даже 40% увеличение суммарного обилия животных. Мы полагаем, что резкое снижение уровня Pb в компонентах биоты в последние два десятилетия связано, в первую очередь, с общим сокращением содержания элемента в выхлопах автотранспорта в результате перехода с этилированного бензина на другие виды топлива. Напомним, что все исследованные зоны пересекает крупная автомагистраль с интенсивным трафиком.
На загрязненных территориях сокращение выбросов (от I-го периода ко II-му) сопровождалось разнонаправленными изменениями величины ТПП: общим снижением для Cu и Pb, увеличением – для Cd, незначительными флуктуациями – для Zn (рис. 1, табл. 3). Уменьшение величины ТПП обусловлено, в первую очередь, резким (от 1.5 до 5 раз) снижением концентраций МЭ в корме консументов I-го порядка в буферной (для Cu и Pb) и импактной (только Cu) зонах. Это хорошо согласуется с информацией, что после модернизации производства в составе выбросов СУМЗа максимально снизилось содержание именно Cu и Pb (Воробейчик, Кайгородова, 2017). Основной вклад в формирование ТПП этих МЭ вносит группа миксофагов, причем в течение всего временного интервала наблюдений величина потоков, контролируемых представителями этой группы, поддерживалась на одном уровне (в абсолютном выражении), тогда как участие остальных ТГ по сравнению с исходными значениями снизилось в 1.5–3 раза, либо не изменилось (рис. 2). Таким образом, на загрязненных территориях можно констатировать как стабилизацию (Zn), так и замедление (Cu, Pb) биогеохимического обмена МЭ.
Особенности временнóй динамики ТПП Cd на загрязненных участках заключаются в интенсификации (в 1.6 раза) обменных процессов от I‑го периода ко II-му. При этом механизмы формирования потоков Cd в разных зонах неодинаковы: на умеренно загрязненнных территориях прирост обеспечивается преимущественно за счет группы зоофагов, на сильно загрязненных – миксофагов (рис. 2).
Повышенный вклад зоофагов в буферной зоне связан с совместным действием двух факторов: ростом численности группы (в 2.4 раза), с одной стороны, и эквавалентным увеличением концентраций Сd в их рационах (в 2.5 раза) за счет частичной смены кормов. Причины подобных изменений обсуждались нами выше. Заметим, что наши оценки вклада зоофагов в формирование суммарных ТПП всех изученных МЭ могут быть несколько занижены из-за особенностей использованного метода учета применительно к землеройкам. Незначительное увеличение ТПП Cd в буферной зоне за счет миксофагов обусловлено исключительно изменениями численности группы, поскольку содержание элемента в корме полевок буферной зоны в течение всего периода наблюдений не изменилось. На сильно загрязненных участках значимое увеличение ТПП Cd, напротив, связано с двукратным ростом концентраций элемента в корме животных, поскольку общая численность группы в течение II-го периода здесь даже снизилась.
Таким образом, наша гипотеза о специфике ТПП потоков через популяции ММ разных ТГ, совместно обитающих на загрязненных и фоновых территориях в периоды высоких и сократившихся выбросов, подтвердилась полностью. Предположение о выравнивании количественных показателей транзитных потоков изученных МЭ в результате многократного сокращения выбросов СУМЗа подтвердилась частично, лишь в отношении Zn и Pb, уровень геохимического обмена которых приблизился к современным (II период), либо исходным (I период) фоновым значениям (соответственно). Для Cu и Cd даже к окончанию II-го периода исходные фоновые значения ТПП в окрестностях завода были превышены в 2 раза.
ЗАКЛЮЧЕНИЕ
Нам не известны длительные исследования сообществ ММ в зоне действия точечного источника загрязнения среды, где на основе ежегодных регистраций видового состава, обилия, демографических и размерно-весовых параметров животных с привлечением данных о микроэлементном составе их рационов проводились бы прямые сравнения интенсивности биогеохимических потоков эссенциальных и токсических МЭ через популяции мышевидных грызунов (8 видов) и мелких насекомоядных (4 вида), совместно населяющих фоновые и загрязненные территории.
Проверяемая гипотеза о своеобразии биогенного обмена МЭ, обусловленного спецификой питания и численностью животных подтвердилась полностью. Показано, что величина транзитных потоков МЭ (Cu, Zn, Cd, Pb) через сообщества ММ с учетом трофической специализации (семеноядов, зеленоядов, миксо- и зоофагов) отдельных видов, совместно обитающих в зоне действия Среднеуральского медеплавильного завода определялась количеством потребляемого корма, содержанием в нем МЭ, а также численностью сравниваемых групп.
Сокращение выбросов СУМЗа сопровождалось закономерным снижением суточного потребления корма в ряду Зеленояды > Миксофаги > Семенояды > Зоофаги по мере приближения к заводу. При этом на фоновых и умеренно загрязненных территориях максимальным содержанием МЭ в корме характеризовались зоофаги, минимальным – семенояды. В непосредственной близости от завода повышеннным накоплением МЭ в рационах отличались миксофаги, минимальным – семенояды. Наблюдаемые изменения были связаны со структурной перестройкой в составе трофических групп (смена доминантов) и частичной сменой кормов. Снижение техногенной нагрузки в пространстве (при удалении от завода) и времени (1990–2019 гг.) в большинстве случаев сопровождалось общим уменьшением концентраций МЭ (как эссенциальных, так и токсических) и затронуло все ТГ. При этом, изменения, произошедшие за 30 лет наблюдений, не были эквивалентны 50-кратному снижению объемов выбросов СУМЗа за тот же период.
Наши предположения о постепенном выравнивании количественных показателей транзитных потоков изученных МЭ на загрязненных и фоновых территориях в результате снижения техногенной нагрузки подтвердились частично. Величина суммарных ТПП большинства МЭ (Cu, Zn, Cd) на фоновых территориях характеризовала стабильное функционирование системы в течение всего временного интервала, а замедление процессов биогенного обмена Pb не было связано с уровнем промышленного загрязнения. В окрестностях СУМЗ постоянной интенсивностью в пространстве и времени отличался лишь ТПП Zn, тогда как динамику ТПП других МЭ можно интерпретировать как замедление (Cu, Pb), либо интенсификацию (Cd) биогенного обмена через популяции ММ, совместно обитающих на загрязненных территориях. Основными причинами наблюдаемых деформаций обменных процессов были структурные перестройки в сообществах ММ, а также изменение концентраций МЭ в корме отдельных ТГ.
Естественная реабилитация антропогенно нарушенных территорий представляет собой сложный процесс, в котором участвует многогранный комплекс живых организмов, составляющих БГЦ – продуцентов, консументов, деструкторов. Роль сообществ ММ в процессах биогенного обмена МЭ следует рассматривать в качестве одного из звеньев, отражающих сложные процессы, происходящие в пространстве и времени.
Авторы признательны Ю.Л. Суморокову, Е.Ю. Сумороковой, С.Ю Суморокову и А.А. Герасимову за помощь в сборе и обработке полевых материалов; А.В. Щепеткину, Э.Х. Ахуновой и Ю.Н. Шаховой – за выполнение аналитических работ, научному редактору В.В. Ермакову и анонимным рецензентам – за конструктивные замечания к тексту рукописи.
Авторы заявляют об отсутствии конфликта интересов и подтверждают соблюдение применимых этических норм в работе с животными.
Анализ данных и подготовка рукописи выполнены в рамках государственного задания Института экологии растений и животных УрО РАН (№ 122021000076-9).
Список литературы
Безель В.С., Мухачева С.В., Куценогий К.П., Савченко Т.И., Чанкина О.В. (2007) Участие мелких млекопитающих в биогенных циклах химических элементов в наземных экосистемах. Проблемы биогеохимии и геохимической экологии. 4(2), 80-91.
Безель В.С., Мухачева С.В. (2020) Биогеохимия мелких млекопитающих при химическом загрязнении среды: есть ли эффект от снижения выбросов? Геохимия. 65(3), 823-832.
Bezel V.S., Mukhacheva S.V. (2020) Geochemical ecology of small mammals at industrially polluted areas: is there any effect of reduction in the emissions? Geochem. Int. 58(8), 959-967.
Безель B.С., Мухачева С.В., Трубина М.Р. (2010) Продукция природных экосистем в пищевых рационах населения Свердловской области. Аграрный вестник Урала. 72(6), 61-65.
Бернштейн А.Д., Михайлова Т.В., Апекина Н.С. (1995) Эффективность метода ловушко-линий для оценки численности и структуры популяций рыжей полевки. Зоологический журн., 74(7). 217-282.
Вернадский В.И. (1994) Живое вещество в биосфере. М.: Наука, 671 с.
Воробейчик Е.Л., Кайгородова С.Ю. (2017) Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов. Почвоведение. (8), 1009-1024.
Ермаков В.В., Тютиков С.Ф. (2008) Геохимическая экология животных. М.: Наука, 315 с.
Катаев Г.Д. (2017) Воздействие выбросов медно-никелевого предприятия на состояние популяций и сообществ мелких млекопитающих Кольского полуострова. Заповедная наука. 2(2), 19-27.
Ковальский В.В. (1974) Геохимическая экология (очерки). М.: Наука, 298 с.
Ковальский В.В. (1982) Геохимическая среда и жизнь. М.: Наука, 78 с.
Ковальский В.В. (1991) Геохимическая среда, микроэлементы, реакции организмов. Тр. биогеохим. лаб. 22. М: Наука, 5-23.
Кузнецов Г.В., Михайлин А.П. (1985) Особенности питания и динамики численности рыжей полевки в условиях широколиственного леса. Млекопитающие в наземных экосистемах. М.: Наука, 127-156.
Лукьянова Л.Е., Лукьянов О.А. (1998) Реакция сообществ и популяций мелких млекопитающих на техногенные воздействия. 1. Сообщества. Успехи современной биологии. 118(5), 613-622.
Мухачева С.В. (2005) Особенности питания рыжей полевки в условиях техногенного загрязнения среды обитания. Сибирский экологический журн. (3), 523-533.
Мухачева С.В. (2013) Изменение структуры и численности населения мелких млекопитающих в зоне действия предприятия “Норильский никель” (Харьявалта, Финляндия). Международный журн. прикладных и фундаментальных исследований. (8), 145-148.
Мухачева С.В. (2017) Многолетняя динамика концентрации тяжелых металлов в корме и организме рыжей полевки (Myodes glareolus) в период снижения выбросов медеплавильного завода. Экология. (6), 461-471.
Мухачева С.В. (2021) Многолетняя динамика сообществ мелких млекопитающих в период снижения выбросов медеплавильного завода. 1. Состав, обилие и разнообразие. Экология. (1), 66-76.
Мухачева С.В. (2022) Многолетняя динамика концентрации тяжелых металлов в организме землероек р. Sorex в период снижения выбросов медеплавильного завода. Экология.(5), 370-384.
Мухачева С.В., Давыдова Ю.А., Кшнясев И.А. (2010) Реакция населения мелких млекопитающих на загрязнение среды выбросами медеплавильного производства. Экология. (6), 452-458.
Нестеркова Д.В., Воробейчик Е.Л., Резниченко И.С. (2014) Тяжелые металлы в пищевой цепи “почва – дождевые черви – европейский крот” в условиях загрязнения среды выбросами медеплавильного завода. Сибирский экологический журн. (5), 777-788.
Павлинов И.Я., Хляп Л.А. (2012) Отряд Rodentia. Млекопитающие России: систематико-географический справочник. 52. М.: Т-во научн. изданий КМК. С. 144-308.
Покаржевский А.Д. (1985) Геохимическая экология наземных животных. М.: Наука. 429 с.
Трубина М.Р., Воробейчик Е.Л. (2013) Содержание тяжелых металлов в лекарственных растениях в зоне действия Среднеуральского медеплавильного завода. Растительные ресурсы. 49(2), 203-222.
Трубина М.Р., Мухачева С.В., Безель В.С., Воробейчик Е.Л. (2014) Содержание тяжелых металлов в плодах дикорастущих растений в зоне аэротехногенного воздействия Среднеуральского медеплавильного завода (Свердловская область). Растительные ресурсы. 50(1), 67-83.
Beernaert J., Scheirs J., Van Den Brande G., et al. (2008). Do wood mice (Apodemus sylvaticus L.) use food selection as a means to reduce heavy metal intake? Environ. Pollut. 151, 599-607.
Carver R. (2014) Practical data analysis with JMP. Cary, NC: SAS Institute, 232 p.
Gall J.E., Boyd R.S., Rajakaruna N. (2015) Transfer of heavy metals through terrestrial food webs: a review. Environ. Monit. Asses. 187(4), 1-21.
Hunter B.A., Johnson M.S., Thompson D.J. (1987) Ecotoxicology of copper and cadmium in a contaminated grassland ecosystem. III Small mammals. J. Appl. Ecol. 24(2), 601-614.
Kozlov M.V., Zvereva E.L., Gilyazov A.S., Kataev G.D. (2005) Contaminated zone around a nickel-copper smelter: a death trap for birds and mammals? Trend in biodiversity research. N.Y.: Nova Science, 81-101.
Kozlov M.V., Zvereva E.L., Zverev V.E. (2009) Impact of point polluters on terrestrial biota. Comparative analysis of 18 contaminated areas. Springer. 500 p.
Kryštufek B., Shenbrot G.I. (2022). Voles and lemmings (Arvicolinae) of the Palaearctic region. Maribor: University Press. 437 p.
Ozaki S., Fritsch C., Valot B. et al. (2018) Does pollution influence small mammal diet in the field? A metabarcoding approach in a generalist consumer. Molec. Ecol. 1-14.
Pankakoski E., Koivisto I., Hyvärinen H. (1994) Shrews as indicators of heavy metal pollution. Advances in the biology of Shrews. Carnegie Museum of Natural History Special Publication. 137-149.
Wołk E. (1969) Body weight and daily food intake in captive shrews. Acta Theriol. 14(4), 35-47.
Дополнительные материалы отсутствуют.


