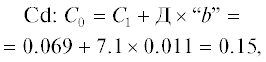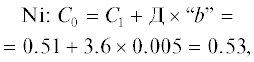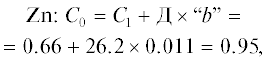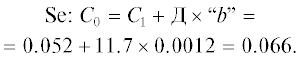Геохимия, 2023, T. 68, № 10, стр. 1045-1058
Локальные биогеохимические циклы микроэлементов в агроэкосистемах Западной Сибири
А. В. Синдирева *
Тюменский государственный университет
625003 Тюмень, ул. Володарского, 6, Россия
* E-mail: sindireva72@mail.ru
Поступила в редакцию 19.03.2023
После доработки 11.05.2023
Принята к публикации 12.05.2023
- EDN: QOZPET
- DOI: 10.31857/S0016752523100126
Аннотация
В статье приведены результаты многолетних полевых опытов (2005–2022 гг.) по изучению распределения и миграции микроэлементов в системе почва–растение–животное на примере агроценозов южной лесостепи Западной Сибири. Дана биогеохимическая оценка содержания микроэлементов (Pb, Cu, Zn, Ni, Cd, Cr, Se) в трофических цепях в определенных агроэкологических условиях. Проведен анализ геохимических факторов, влияющих на аккумуляцию микроэлементов в различных типах почв и произрастающих на них растениях. Установлены нормативные количественные характеристики действия микроэлементов на химический состав почвы, продуктивность и качество растений зерновых, кормовых и овощных культур. Показано взаимоотношение макро- и микроэлементов при поступлении их в растения в зависимости от уровня и соотношения химических элементов в почве, физиологической потребности растительного организма на разных стадиях онтогенеза. Установлены параметры поступления микроэлементов в организм животных с растительной пищей в условиях модельных опытов. Проанализированы структурные и функциональные изменения в органах животных при кормлении растениеводческой продукцией, выращенной при различном содержании микроэлементов.
ВВЕДЕНИЕ
На протяжении многих десятилетий агроэкосистемы подвергаются мощному антропогенному воздействию. Человек, активно осваивая земли сельскохозяйственного назначения, существенно изменяет направленность природных биогеохимических циклов химических элементов. Интенсивная механическая обработка почвы, техногенное загрязнение агроценозов за счет переноса токсических элементов от промышленных предприятий, транспорта, применение пестицидов, минеральных удобрений, а также вынос химических элементов с урожаем сельскохозяйственной продукции, приводят к тому, что нарушается естественно сложившийся баланс химических элементов. Помимо нарушения биогеохимических циклов макроэлементов, особой проблемой является и наличие дисбаланса содержания микроэлементов в системе почва–растение–животное.
В различных экосистемах в результате техногенного воздействия возникают территории с избытком таких элементов как Cd, Ni, Pb, Zn, Cu, As, Cr, Hg и других. В то же время особую тревогу вызывает и отмечаемое по результатам агроэкологического мониторинга постоянное снижение в почвах содержания микроэлементов. Так, для почв черноземного ряда юга Западной Сибири отмечен недостаток Cu, Zn, Mo, Mn, Se, I (Ермохин, 2019; Красницкий, 2002; Сысо, 2007). Помимо природных факторов, значительный вклад в дисбаланс элементов вносит и постоянное снижение содержания гумуса, возрастание площадей почв с повышенной кислотностью, развитие эрозионных процессов, угнетение активности почвенной биоты и другие негативные явления, связанные с деградацией почв.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
В условиях возрастающей антропогенной нагрузки все большую актуальность приобретают вопросы биогеохимии, сформированные В.И. Вернадским и его последователями. Изучение локальных биогеохимических циклов микроэлементов в конкретных агроэкологических условиях решает ряд как теоретических, так и прикладных задач (Ermakov, Jovanović, 2023). Так, результаты изучения микроэлементного статуса агроландшафтов и факторов, влияющих на аккумуляцию и распространение микроэлементов в отдельных компонентах экосистемы, могут быть использованы при разработке научно-обоснованной системы критериев оценки современного состояния окружающей среды. Осуществление всестороннего анализа природной среды при оценке факторов, влияющих на биогеохимические циклы микроэлементов – задача сложная и практически невыполнимая (Baker, 1975; He et al., 2005; Chizzola R., 2003; Yamin, Andrew, 2009). В данной работе рассматривается один из аспектов данного вопроса – закономерности поступления и действия отдельных микроэлементов в системе почва–растение–животное, выявленные в конкретных агроэкологических условиях. Разработанные на основе комплексного биогеохимического подхода нормативы содержания химических элементов в трофических цепях позволят оптимизировать их поступление в растения и тем самым управлять продукционным процессом в агроэкосистеме, предотвращать негативные последствия избыточного поступления ряда химических элементов в почву и растения и, как следствие, в организм животных и человека. В то же время системный биогеохимический подход позволяет прогнозировать эффективность мероприятий по коррекции недостатка микроэлементов (применение микроудобрений в системе почва-растение, пищевые добавки в рацион животных, обогащение ими продуктов питания и т.д.) (Голубкина, 2006; Ягодин, 1989; Baker, 1975; Brenneisen, 2005; Fairweather-Tait, 2011).
Кроме того, полученные сведения по биогеохимии микроэлементов с учетом сложившихся природных и антропогенных факторов вносят определенный вклад в решение актуальной на сегодняшний день проблемы экологического нормирования. Большинство исследователей приходит к мнению, что разрабатываемые нормативы (в частности, предельно-допустимые концентрации (ПДК) химических элементов не в полной мере способны оценить состояние окружающей среды с целью обеспечения экологической безопасности живых организмов, обитающих в ней (Красницкий, 2002; Сысо, 2007; Синдирева, 2012). Так, современные ПДК не учитывают комплекс экологических условий исследуемой территории, вид организма, эффект взаимодействия химических элементов друг с другом при поступлении в живой организм, явления биотрансформации при миграции по пищевым цепям. Решением этой проблемы, по-видимому, является поиск интегральных показателей нормирования, разработанных с использованием методов математического моделирования закономерностей действия химических элементов в трофических цепях с учетом биогеохимической ситуации конкретной экосистемы. Полученные нормативы действия химических элементов в трофических цепях позволяют управлять процессом минерального питания растений и животных, а также диагностировать и предотвращать негативные процессы, вызванные избытком, недостатком или дисбалансом микроэлементов в объектах окружающей среды.
Цель данной работы – разработка количественных параметров, характеризующих биогеохимические циклы микроэлементов в агроэкосистемах, с учетом принципов интегрального подхода к оценке их действия в системе почва–растение–животное.
МЕТОДЫ ИССЛЕДОВАНИЙ
В статье представлены отдельные результаты многолетних полевых и лабораторно-вегетационных опытов (2005–2022 гг.) по оценке распределения, миграции и действия микроэлементов в системе почва–растение–животное на примере агроценозов юга Западной Сибири.
Объектами исследований являлись: лугово-черноземная почва южной лесостепи Западной Сибири, растения кормовых, овощных и зерновых культур, лабораторные животные – крысы породы Wistar.
Полевые опыты с микроэлементами проводили на опытном поле ФГБОУ ВО ОмГАУ им П.А. Столыпина на лугово-черноземной маломощной среднегумусовой тяжелосуглинистой почве (Синдирева, 2012, 2017). Поскольку лугово-черноземные почвы имеют большое распространение в условиях южной лесостепи Западной Сибири, они и послужили объектом исследования.
Содержание гумуса в пахотном слое почв составляет 5.5–6.5% и с глубиной снижается. Карбонаты залегают с глубины 57 см, оглеение в виде ржавых и сизых пятен с 153 см, емкость поглощения составляет 25.2–28.2 мг экв/100 г. В составе почвенно-поглощающего комплекса преобладает кальций (19.8–23.3 мг экв/100 г). Реакция среды в пахотном слое близка к нейтральной, а с глубиной идет подщелачивание. В среднем перед посевом культурных растений содержание в почве нитратного азота было недостаточное (8–23 мг/кг), подвижного фосфора – в зависимости от года исследования изменялось от низких до оптимальных значений (34–73 мг/кг), содержание обменного калия превышало оптимальное значение (85–169 мг/кг) (Синдирева, 2012, 2017).
Содержание Pb, Cu, Zn, Ni, Cd, Cr, Se в слое 0–30 см без дополнительного их внесения значительно не изменялось по годам исследования и не превышало установленных ПДК (табл. 1).
Таблица 1.
Содержание исследуемых микроэлементов в лугово-черноземной почве в слое 0–30 см (средние данные 2005–2022 гг.)
| Форма соединения | Содержание микроэлементов, мг/кг почвы $\bar {Х}$ ± Sd/lim |
|||||
|---|---|---|---|---|---|---|
| Se | Cd | Ni | Zn | Pb | Cr | |
| Подвижная форма (ААБ 4.8) |
$\frac{{0.05 \pm 0.02}}{{0.03 - 0.08{\text{*}}}}$ | $\frac{{0.074 \pm 0.01}}{{0.04 - 0.08}}$ | $\frac{{0.71 \pm 0.12}}{{0.55 - 0.84}}$ | $\frac{{0.31 \pm 0.05}}{{0.23 - 0.37}}$ | $\frac{{0.76 \pm 0.14}}{{0.5 - 1.5}}$ | $\frac{{0.84 \pm 0.3}}{{0.49 - 1.25}}$ |
| Валовое содержание |
$\frac{{0.33 \pm 0.09}}{{0.22 - 0.46}}$ | $\frac{{0.49 \pm 0.08}}{{0.35 - 0.65}}$ | $\frac{{34.1 \pm 3.30}}{{27.2 - 39.0}}$ | $\frac{{58.3 \pm 6.28}}{{50.4 - 68.2}}$ | $\frac{{17 \pm 1.4}}{{11.0 - 20.5}}$ | $\frac{{39 \pm 3.5}}{{20.0 - 56.0}}$ |
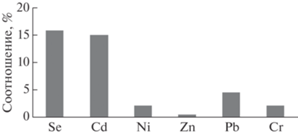
Установлено, что соотношение подвижных форм и валового содержания микроэлементов в лугово-черноземной почве значительно отличается (рис. 1). Это свидетельствует о различной доступности микроэлементов для растений.
Например, среди изученных химических элементов наименьшая доля подвижных форм отмечена для цинка, что объясняет его недостаток в растениях. О недостатке цинка в системе почва-растение на лугово-черноземных почвах южной лесостепи Западной Сибири свидетельствуют и данные агрохимической службы (Красницкий, 2002).
На основе моделирования антропогенного поступления в почву кадмия, никеля, цинка, хрома, свинца, селена проведена оценка их влияния на химический состав почвы и растений, величину и качество урожая овощных (столовая свекла (Beta vulgaris) сорт Бордо 237, столовая морковь (Daucus sativus) сорт Витаминная 6), кормовых (рапс яровой (Brassica napus) сорт Золотонивский) и зерновых культур (яровая мягкая пшеница (Triticum aestivum) сорт Памяти Азиева). Установлены биогеохимические нормативные количественные характеристики потребности растений в Pb, Cu, Zn, Ni, Cd, Cr, Se и интенсивность их действия на химический состав почвы и растений. Pb, Cu, Zn, Ni, Cd, Cr вносили в почву в виде сухих ацетатных солей, Se в виде селенита натрия, до посева. Дозы (в кг/га) внесения свинца, хрома (7, 14, 28) кадмия (3.5; 7.1; 14.3), никеля (3.6; 8.4; 18), цинка (26.2; 53.3; 109), селена (11.7; 23.7; 47.7), рассчитаны на слой почвы 0–30 см с учетом установленных ПДК (СанПиН 1.2.3685-21), по селену – литературные данные (Ильин, 1991) и фактического содержания элементов в почве; соответствуют 0.5; 1; 2 ПДК. Затем проводился посев выше указанных сельскохозяйственных культур.
Закладку опытов с микроэлементами, все учеты, наблюдения, отбор, химический анализ растительных и почвенных образцов проводили по общепринятым методикам согласно утвержденным нормативам: ГОСТ 26261-84 Почвы, ГОСТ 26213-91 Почвы, ГОСТ 26483-85 Почвы, МУ по определению подвижных соединений никеля в почвах атомно-абсорбционным методом, М., МСХ РФ (ЦИНАО) 26.02.1993, РД 52.18.191-89, ГОСТ 30178-96, ГОСТ Р 51301-99, ГОСТ 13496.4-93, ГОСТ 26657-97, ГОСТ 30504-97. Аналитические исследования проводили в ФГБУ “Центр агрохимической службы Омский”; Федеральный научный центр овощеводства, в лаборатории кафедр агрохимии, экологии, природопользования и биологии ФГБУ ВО ОмГАУ, лаборатории Экологического мониторинга ФГАУ ВО ТюмГУ.
Численность микроорганизмов и ферментативную активность лугово-черноземной почвы определяли в естественных полевых условиях и лабораторным методом в ФГБНУ “Омский аграрный научный центр”.
Уборку сельскохозяйственных культур в полевом опыте производили сплошным способом с учетной площадки при достижении физиологической спелости растений.
После уборки урожая, полученные корма вводили в рацион лабораторных животных крыс породы Wistar согласно вариантам полевого опыта (Синдирева, 2012, 2017, 2020). Выбор в качестве опытных животных крыс обусловлен тем, что лабораторная крыса имеет ряд преимуществ перед другими традиционными лабораторными животными. Организм крыс характеризуется приспособляемостью и устойчивостью к интеркуррентным инфекциям. Крысы менее требовательны в отношении пищевого рациона. Широкий диапазон их существования, особенности питания и деятельность органов пищеварения сходны с таковыми у человека. Кроме того, в пищевой рацион данных животных вполне включаются используемые в нашем исследовании сельскохозяйственные растения, тем самым соблюдается биогеохимическая цепочка “почва–растение–животное”. Животные, в зависимости от варианта, получали корма в течение 4 месяцев. По окончании проводили биохимические, гистологические исследования органов и тканей животных. В данной статье приводятся данные о содержании микроэлементов в печени. В органах животных определяли содержание Сu, Zn, Cd, Pb, Ni, Cr атомно-абсорбционным, Se – флуорометрическим методами.
Полученные данные подвергали статистической обработке. Оценку опытных данных и выявление взаимосвязей содержания и распределения микроэлементов производили методами дисперсионного, регрессионного и корреляционного анализов. Математическая обработка результатов осуществлялась стандартными статистическими методами с использованием компьютерного пакета программ STATISTIKA, EXCEL.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Основным звеном оценки биогеохимических циклов микроэлементов в агроценозах является почва. Микроэлементы в агроэкосистеме либо наследуются из исходных почвообразующих пород, либо поступают в результате деятельности человека. Многократное использование химикатов, обогащенных металлами, удобрений и органических добавок, таких как осадок сточных вод, а также сточные воды, может привести к загрязнению в больших масштабах (Сысо, 2007; He et al., 2005). При этом должно проводиться определение показателей, характеризующих их аккумуляцию и распределение в почвенном покрове. Согласно ряду исследований, оценка этих параметров в почве должна исходить из функциональной многозначности почвы (почва – природное тело, компонент биогеоценоза, почва – средство и объект сельскохозяйственного использования, почва – среда обитания) (Ильин, 1991). При этом необходимо учитывать два параметра: гигиенический (содержание микроэлементов, поглощенных из почвы в растительный организм, а затем их дальнейшее продвижение с растительной пищей в организм животных и человека) и агрономический (связь продуктивности растений с исходным содержанием в почве подвижной формы химических элементов) (Синдирева, 2012).
С учетом этих двух положений в условиях полевых опытов установлено среднее содержание в пахотном слое почвы (0–30 см) подвижной формы микроэлементов при внесении установленных доз Cd, Ni, Zn, Pb, Cr и Se. Путем статистического анализа рассчитано содержание подвижных форм исследуемых химических элементов (в мг/кг), поступивших с единицей внесенного элемента (в дозе 1 кг/га) – коэффициент “b” (табл. 2). Данный коэффициент показывает, насколько изменяется величина одного признака (у, в данном случае содержание подвижных форм микроэлементов, мг/кг) при изменении другого (х, в данном случае доза химического элемента, кг/га) и устанавливается путем расчета уравнения линейной регрессии:
Таблица 2.
Коэффициент “b” интенсивности действия Pb, Cu, Zn, Ni, Cd, Cr, Se на химический состав почвы и пример расчета дозы микроэлементов для достижения ПДК подвижной формы
| Химические элементы, вносимые в почву | Коэффициент “b”, в мг/кг | С фактическое (исходное содержание в почве, мг/кг | ПДК, мг/кг | Доза расчетная для достижения ПДК, кг/га |
|---|---|---|---|---|
| Cd | 0.011 | 0.06 | 0.5 | 40.0 |
| Ni | 0.005 | 0.51 | 4.0 | 698.0 |
| Zn | 0.011 | 0.60 | 23 | 2036.4 |
| Cr | 0.0311 | 0.84 | 6 | 165.9 |
| Pb | 0.0265 | 0.76 | 6 | 197.7 |
| Se | 0.0012 | 0.46 | 10 | 21.7 |
С помощью установленных коэффициентов “b” можно прогнозировать изменение подвижных форм элементов при антропогенном поступлении или определить дозировку внесенного элемента, при которой количество его в почве достигнет предельно-допустимой концентрации. Для этого можно использовать предложенные нами формулы расчета (Драсч) содержания микроэлементов в почвах с учетом ПДК и региональных особенностей “сопротивляемости” почв к загрязнению (формула 2, табл. 2).
(2)
${{{\text{Д}}}_{{{\text{расч}}}}} = \left( {{\text{ПДК}} - {{{\text{С}}}_{{{\text{факт}}}}}} \right)/b.$Таким образом, с помощью установленного норматива можно прогнозировать накопление химического элемента в почве в случае его антропогенного поступления или, напротив, рассчитать дозу внесения химического элемента, необходимую для достижения оптимальной или токсичной концентрации. Однако такой критерий зависит от многих факторов, в том числе и свойств почвы и должен быть дифференцирован для определенного ее типа (Ильин, 1991; Baker, 1975).
Как показали исследования (рис. 1, табл. 2), только незначительное количество внесенных в почву микроэлементов является доступными для растений. Этим объясняется довольно низкий нормативный установленный показатель – коэффициент “b”. С позиции экологической безопасности это является довольно положительным фактором – требуются достаточно высокие дозировки, чтобы достичь установленных ПДК. Однако даже незначительное изменение химического состава почвы вследствие антропогенного поступления микроэлементов может существенно сказаться на экологическом состоянии почвенного покрова. При этом необходимо использовать более чувствительные биоиндикационные методы, в частности, микробиологические (Ehrlich, 2015; Ojuederie, 2017; Valls, 2002). Установление оптимальных и критических уровней влияния микроэлементов на почвенную микрофлору вносит определенный вклад в понимание геохимических особенностей их миграции для различных экосистем. Почвенные микроорганизмы являются первыми живыми организмами, подвергшимися воздействию загрязнения, например, металлами. Будучи отзывчивыми и чувствительными, изменения в микробной биомассе, активности и структуре сообщества в результате увеличения концентрации металлов в почве могут использоваться в качестве индикаторов загрязнения почвы или качества окружающей среды (He et al., 2005).
Роль микроорганизмов в геохимических циклах макроэлементов хорошо изучена на глобальном уровне. После того, как стало ясно, что микробиологические трансформации соединений этих микроэлементов могут в ряде случаев приводить к повышению плодородия почв, а в других – к процессам загрязнения или очищения среды, участие микроорганизмов в циклах микроэлементов стало изучаться более интенсивно (Илялетдинов, 1984; Ehrlich, 2015). С другой стороны, микроэлементы, поглощенные микроорганизмами из естественной среды обитания, могут входить в состав ферментов, витаминов и других жизненно необходимых биологически активных соединений, участвовать в их синтезе, влиять на скорость и характер различных биохимических процессов, определяющих функцию организмов или их суммы – живого вещества в биосфере (Ковальский, 1974).
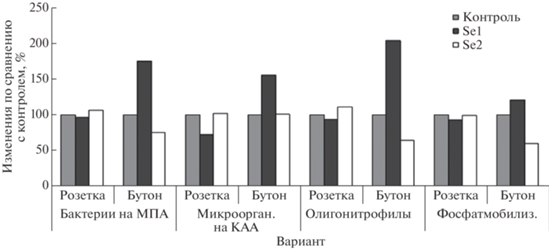
На примере селена изучены зависимости между дозой вносимого микроэлемента (1 и 2ПДК) и содержанием агрономически важных микроорганизмов почвы при выращивании рапса ярового. Необходимо отметить, что влияние Se зависит от фазы развития культуры (рис. 2).
Рис. 2.
Изменение численности разных групп микроорганизмов в лугово-черноземной почве по сравнению с контролем при внесении селена в дозах 1,2 ПДК.
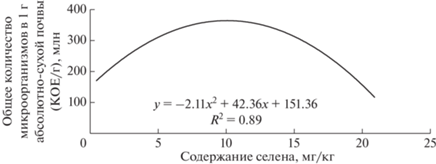
Установлена зависимость между валовым содержанием селена и общей численностью микроорганизмов (рис. 3). Согласно данным рис. 3, можно выделить “зону оптимума” содержания селена в почве по отношению к численности микроорганизмов, а также уровни микроэлемента, при которых этот показатель снижается. Наши исследования были проведены на лугово-черноземной почве, обладающей сравнительно высоким содержанием органического вещества, общей поглотительной способностью. Обычно “сопротивляемость” данной почвы к высоким концентрациям микроэлементов в несколько раз выше, чем, например, у легкой песчаной кислой почвы. Поэтому исследуемая почва может накапливать большие количества микроэлементов с меньшей степенью риска для среды. В связи с этим установлены довольно высокиe уровни селена, которые способствуют активизации микробиологических процессов в почве.
Рис. 3.
Зависимость между валовым содержанием селена и общей численностью микроорганизмов в лугово-черноземной почве.
Изменение естественного баланса химических элементов в почве сказывается на всех процессах, происходящих в ней. За счет реакции микрофлоры, а также химических взаимодействий, происходящих в почвенно-поглощающем комплексе, изменяются интенсивность и направленность процессов трансформации биогенных элементов и органического вещества в почве (Ojuederie, 2017; Valls, 2002). В данной статье для анализа микробиологических превращений в почве в зависимости от уровня поступления селена, представлены коэффициенты минерализации и иммобилизации по соотношению групп микроорганизмов, ответственных за превращение азотсодержащих соединений (КАА/МПА и МПА/КАА), а также коэффициент трансформации органического вещества по формуле (3) (табл. 3):
Таблица 3.
Влияние селена на показатели минерализации, иммобилизации и трансформации органического вещества
| Содержание селена в почве | Микроорганизмы, КОЕ/г абсолютно-сухой почвы | Коэффициенты | |||
|---|---|---|---|---|---|
| минерализации | иммобилизации | трансформации органического вещества, Пм | |||
| на МПА, млн | на КАА, млн | ||||
| 0.46 ± 0.05 | 25.65 | 19.60 | 0.76 | 1.31 | 59.3 |
| 16.3 ± 1.5 | 44.80 | 30.60 | 0.68 | 1.46 | 110.1 |
| 20.9 ± 1.9 | 19.50 | 19.80 | 1.01 | 0.99 | 38.9 |
В условиях применения селена процессы иммобилизации веществ, как правило, преобладают над минерализацией растительных остатков. Полученные экспериментальные данные позволили определить содержание микроэлемента в почве, при котором фиксируется стимулирующее и угнетающие действие на микробиологическую активность почвы.
Таким образом, используя полученные зависимости, можно составить прогноз изменения экологического состояния почвы в условиях обогащения почв микроэлементами (Синдирева, 2012). Данные микробиологических тестов необходимо сопоставлять с результатами, полученными при изучении реакции других организмов трофических цепей, в частности, продуцентов.
Пороговые и оптимальные концентрации микроэлементов в почве можно устанавливать, исходя из предельных концентраций в растениях, произрастающих на данных почвах и употребляемых в дальнейшем в пищу животными и человеком. Однако сложности установления единых нормативов обеспеченности почв микроэлементами заключаются в широком спектре потребностей культурных растений в тех или иных микроэлементах.
Методология нормирования действия микроэлементов в системе почва-растение была разработана с учетом положений о наличии тесной взаимосвязи между внешними условиями питания и внутренними процессами обмена веществ в растениях, о зависимости продуктивности фитоценозов и поступления элементов питания в растения не только от абсолютного содержания, но и соотношения этих химических элементов между собой. Перераспределение микроэлементов в системе почва–растение зависит от многих факторов в т. ч. биологические особенности культуры, продуктивность растений, тип почвы, климатические условия и многие другие факторы (Yamin, Andrew, 2009).
В результате многолетних исследований оценено влияние кадмия, никеля, цинка, хрома и свинца на химический состав столовой свеклы, моркови и рапса ярового, селена – на химический состав рапса и яровой мягкой пшеницы (Синдирева, 2012, 2017, 2020). В количественном и качественном элементном составе растений находят отражение ряд факторов: геохимический, функциональный, генетического контроля, экологический (Ермохин, Синдирева, 2011). По силе своего действия факторы, влияющие на поступление микроэлементов в растение, располагаются в следующем порядке: сельскохозяйственная культура, концентрация элементов в почве, содержание в ней органического вещества, емкость поглощения катионов и другие (Ильин, 1991; Каббата-Пендиас,1989; Bernal, 2007; Marschner H., 2012). В целом внесение соединений Cd, Ni, Zn, Cr, Pb, Se в почву способствовало изменению химического состава исследуемых культур (табл. 4).
Таблица 4.
Содержание микроэлементов в сельскохозяйственных культурах при их внесении в почву в дозе 2ПДК на период физиологической зрелости растений
| Химический элемент | Содержание микроэлементов, мг/кг сухого вещества | |||
|---|---|---|---|---|
| столовая свекла Beta vulgaris |
столовая морковь Daucus sativus |
яровой рапс Brassica napus |
яровая мягкая пшеница Triticum aestivum |
|
| корнеплод | надземная масса | зерно | ||
| Cd | $\frac{{0.18 \pm 0.02}}{{0.23 \pm 0.01{\text{**}}}}$ | $\frac{{0.15 \pm 0.01}}{{0.23 \pm 0.02{\text{**}}}}$ | $\frac{{0.59 \pm 0.02}}{{0.98 \pm 0.03{\text{**}}}}$ | ̶ * |
| Ni | $\frac{{0.62 \pm 0.03}}{{1.06 \pm 0.04{\text{**}}}}$ | $\frac{{0.84 \pm 0.05}}{{1.52 \pm 0.0{\text{7**}}}}$ | $\frac{{4.42 \pm 0.2}}{{5.63 \pm 0.4{\text{**}}}}$ | – |
| Zn | $\frac{{12.6 \pm 0.9}}{{17.4 \pm 0.5{\text{**}}}}$ | $\frac{{19.7 \pm 1.2}}{{22.5 \pm 0.9{\text{**}}}}$ | $\frac{{32.77 \pm 1.34}}{{39.18 \pm 1.17{\text{**}}}}$ | – |
| Cr | $\frac{{0.50 \pm 0.12}}{{0.82 \pm 0.09{\text{**}}}}$ | $\frac{{0.41 \pm 0.07}}{{0.92 \pm 0.0{\text{8**}}}}$ | – | – |
| Pb | $\frac{{0.46 \pm 0.05}}{{0.88 \pm 0.07{\text{**}}}}$ | $\frac{{0.43 \pm 0.03}}{{0.92 \pm 0.08{\text{**}}}}$ | – | – |
| Se | – | – | $\frac{{0.128 \pm 0.06}}{{5.430 \pm 0.7{\text{**}}}}$ | $\frac{{0.45 \pm 0.06}}{{4.9 \pm 0.4{\text{**}}}}$ |
Проведенные полевые исследования позволили рассчитать нормативные коэффициенты “b” интенсивности действия поступивших в лугово-черноземную почву кадмия, никеля, цинка, хрома, свинца на изменение содержания этих химических элементов в корнеплодах столовой свеклы, моркови, в зеленой массе рапса ярового, зерне яровой мягкой пшеницы (табл. 5).
Таблица 5.
Коэффициенты интенсивности действия “b” Cd, Ni, Zn,Cr, Pb, Sе на химический состав растений (содержание микроэлементов в мг/кг сухого вещества)
| Химический элемент | Коэффициенты интенсивности действия “b” в растениях | |||
|---|---|---|---|---|
| столовая свекла Beta vulgaris |
столовая морковь Daucus sativus |
яровой рапс Brassica napus |
яровая мягкая пшеница Triticum aestivum |
|
| корнеплод | надземная масса | зерно | ||
| Cd | 0.0067 | 0.0019 | 0.027 | –* |
| Ni | 0.12 | 0.03 | 0.06 | – |
| Zn | 0.13 | 0.079 | 0.34 | – |
| Cr | 0.0116 | 0.0157 | – | – |
| Pb | 0.013 | 0.0151 | – | – |
| Se | – | – | 0.11 | 0.4 |
Установленные нормативы могут использоваться при расчете оптимальных доз микроэлемента, оценке его накопления в сельскохозяйственных культурах, а также для анализа химического состава и качества растениеводческой продукции. Например, полученные количественные характеристики параметра “b” растений позволяют прогнозировать химический состав столовой свеклы, моркови, рапса, пшеницы при антропогенном поступлении Cd, Ni, Zn, Cr, Pb, Sе в почву по формуле (4):
где J – содержание Cd, Ni, Zn, Cr, Pb, Sе в растении, мг/кг сухого вещества;Сф – исходное содержание Cd, Ni, Zn, Cr, Pb, Sе в растении, мг/кг сухого вещества;
D – доза поступившего элемента в почву, кг/га;
b – коэффициент интенсивности действия единицы поступившего элемента в растение, мг/кг.
В целом, проведенные многолетние исследования в условиях моделирования антропогенного поступления Cd, Ni, Zn,Cr, Pb, Sе под сельскохозяйственные культуры позволили выявить следующие основные закономерности:
– дополнительное поступление исследуемых химических элементов в почву способствует увеличению его содержания, как в органах запасания ассимилятов, так и в генеративных органах растений;
– исходя из рассчитанных коэффициентов интенсивности действия, поглощение микроэлементов убывает в ряду: рапс яровой > столовая свекла > морковь;
– по абсолютному содержанию в растениях изучаемые элементы можно расположить в следующей убывающей последовательности: Zn > Ni > > Cr, Pb > Cd, что связано с их химическими свойствами и биологической ролью.
При оценке влияния микроэлементов на химический состав растений особое внимание уделялось взаимодействию ионов при их поступлении. Степень проявления антагонистических и синергетических отношений между химическими элементами в процессе поступления их в растения определяется преимущественно уровнем отклонения концентрации взаимодействующих химических элементов в почве и растениях от оптимума, биологическими особенностями и фазой развития растений (Prasad, 2016; Aref, 2011). Это способствовало изменению внутреннего химического баланса в растительном организме. Данные исследования позволили установить схемы взаимодействия ряда элементов друг с другом в условиях поступления соединений Cd, Ni, Zn, Pb, Cr, Se (табл. 6).
Таблица 6.
Характер взаимодействия отдельных химических элементов при поступлении их в растения
| Химический эемент |
Микроэлементы | ||
|---|---|---|---|
| синергизм | синергизм-антагонизм | антагонизм | |
| Столовая свеклаBeta vulgaris Корнеплод (в период уборки) | |||
| Cd | Ni, Cu, N, P | Zn, Pb, К | –* |
| Ni | Cu, N, P | Zn, Pb, К | – |
| Zn | Pb, N, P | Cu | – |
| Cu | – | Pb, К | – |
| Pb | – | N | К |
| Столовая морковьDaucus sativus Корнеплод (в период уборки) | |||
| Cd | Ni, Zn, N,P | – | Cu, Pb |
| Ni | P | Cu, Pb, Zn, N | – |
| Zn | P, N | – | Cu, Pb |
| Cu | P, Pb, К | N | – |
| Pb | P, N, К | – | – |
| Рапс яровойBrassica napus(надземная масса) | |||
| Cd | Ni, Zn | Cu, Pb | – |
| Ni | Cu, Pb, Zn | – | – |
| Zn | – | Pb | – |
| Cu | – | Zn, Pb | – |
| Se | – | Cd | P, К, N, Zn |
Проведенные исследования подтверждают тот факт, что алгоритм минерального питания растений можно разработать на основе двух главных принципов – это изучение механизма поступления элементов минерального питания и количественный учет постоянно изменяющихся потребностей в питательных веществах возделываемых культур за счет внесения минеральных удобрений. При этом в обязательном порядке необходимо учитывать не только содержание микроэлементов в почве, но и, с учетом явлений антагонизма и синергизма ионов, влияние одних элементов питания на содержание других (Ермохин, Синдирева, 2011). Полученные данные можно использовать с учетом установленных оптимальных показателей соотношения макро- и микроэлементов в сельскохозяйственных растениях, например, с позиции продуктивности культур.
Влияние микроэлементов на процессы роста и развития растений в течение вегетации находит отражение в изменении продуктивности фитоценозов. Исследования показали, что действие Pb, Cu, Zn, Ni, Cd, Cr, Se на урожайность зависело от метеорологических условий года, вносимого элемента, его концентрации в почве и культуры. В частности, кадмий, никель, цинк в определенных дозировках стимулируют продуктивность сельскохозяйственных культур. Однако при увеличении доз кадмия свыше 1 ПДК, а никеля и цинка свыше 0.5 ПДК отмечается тенденция к снижению урожайности культуры (Синдирева, 2012). Считается, что кадмий не входит в число необходимых для жизнедеятельности микроэлементов (Ильин, 1991). В то же время доказано, что определенные концентрации Cd могут оказывать стимулирующее действие на растительный организм (Мельничук, 1990). Стимулирующее действие Cd на прорастание и рост растений обнаружено в работах ряда ученых (Шеуджен, 2003). Существует предположение, что Cd на определенном этапе развития семени, способен интенсифицировать биосинтез белков, ДНК, РНК (Ягодин и др., 1989). В ряде опытов с различными культурами установлено положительное влияние различных концентраций Cd на активность и биосинтез дегидрогеназ, фенилаланинаммонийлиазы, хроматина, цистина, цистеина, метионина, а также аскорбиновой кислоты (Шеуджен, 2003). В то же время при высоких концентрациях кадмий вызывает многочисленные и разнообразные изменения метаболических процессов. Многие исследователи, изучающие симптомы проявления токсичности тяжелых металлов на сельскохозяйственных растениях, отмечают, что Cd в 2–20 раз токсичнее других металлов (Griling, Peterson, 1981). В литературе имеются множественные противоречивые данные о необходимости для нормальных процессов метаболизма растений других металлов, описываемых в данной статье. Однако во многих работах показано, что они выполняют ряд жизненно важных функций в организме (Каббата-Пендиас, 1989; Шеуджен, 2003; Marschner,2012).
До сих пор не существует однозначного мнения по поводу необходимости селена для растительного организма, и, по мнению многих авторов, эссенциальность его для высших растений не доказана. Однако проведено множество исследований с различными культурами (зерновыми, овощными, кормовыми), показывающими достоверную прибавку в росте и развитии от применения данного микроэлемента. В то же время Se обладает узким интервалом между токсичностью и необходимостью для растений, вследствие этого повышенные дозировки микроэлемента отрицательно сказываются на урожайности культур, снижая ее на 10–50% (Голубкина, 2006; Синдирева, 2012; Arvy, 1993; Brenneisen et al., 2005; Fairweather-Tait et al.,2011; Girling, 1984). Действие селена в системе почва-растение значительно зависит от способов его поступления, а также форм его соединений (селенаты, селениты, органический селен и т.д.).
С помощью закономерностей, установленных в полевых опытах, представляется возможным диагностировать потребность растений в Pb, Cu, Zn, Ni, Cd, Cr, Se для получения запланированных урожаев на почвах определенного типа. С учетом наилучших доз микроэлементов на основе полученных экспериментальных данных можно сделать вывод об их оптимальном содержании в почве для питания культур (${{С}_{0}}$, мг/кг), например, для рапса ярового по формулам:
Для формирования высокого урожая в количественном и качественном отношении необходимо знать кроме оптимальных уровней содержания микроэлементов в почве, их сбалансированное сочетание при питании растений. В области оптимальных дозировок микроудобрений на основе изученной связи химического состава растений и урожайности сельскохозяйственных культур рассчитаны коэффициенты интенсивности действия (“b”) единицы ряда исследуемых элементов, содержащихся в растениях (в мг/кг) на формирование величины (в т/га) урожая сельскохозяйственных культур (табл. 7). В данном случае коэффициент “b”, т.е. показатель взаимосвязи между величиной урожая (у) и содержанием микроэлементов (х), указывает, на сколько изменяется величина одного признака (у, урожайность, т/га) при изменении другого (х, содержание микроэлемента, мг/кг).
Таблица 7.
Коэффициенты интенсивности действия (“b”) единицы Ni, Zn, Se, содержащихся в растениях (в мг/кг) на формирование величины урожая сельскохозяйственных культур в т/га
| Культура | Коэффициенты интенсивности действия (“b”) | ||
|---|---|---|---|
| Ni | Zn | Se | |
| Корнеплоды | |||
| Свекла Beta vulgaris | 13.6 | 1.8 | –* |
| Морковь Daucus sativus | 18.2 | 4.64 | – |
| Зеленая масса | |||
| Рапс Brassica napus | 6.42 | 0.34 | 1.1 |
На основе полученных данных об урожайности установлены оптимальные уровни содержания макро- и микроэлементов в растениях, соответствующие максимальной продуктивности культур (табл. 8). Исследования показали, что с дополнительным поступлением химического элемента в окружающую среду изменяется весь химический состав растительного организма вследствие проявления антагонизма-синергизма между ионами как в почве, так и внутри растительного организма. Полученные соотношения позволяют нормировать химический состав растений с целью создания оптимальной по продуктивности и качеству растениеводческой продукции. В табл. 8 представлены оптимальные соотношения макро- и микроэлементов в растениях овощных и кормовых культур. Следует отметить, что биологическая роль каждого минерального элемента в животном организме специфична, и его наличие определяется пороговой концентрацией. Например, такие химические элементы, как Cd и Pb, роль которых до конца не раскрыта и в литературе в основном говорится об их токсичности, тоже выполняют определенные функции в живом организме, поэтому также имеют свой оптимум содержания. О роли кадмия говорилось выше. Касаясь биохимической роли свинца, А. Кабата-Пендиас и X. Пендиас (1989) отмечают: “Хотя нет данных, свидетельствующих о том, что свинец жизненно необходим для роста каких-либо видов растений, имеется много сообщений о стимулирующем действии на рост последних некоторых солей свинца при низких концентрациях. Более того, описаны эффекты торможения метаболизма растений, возникающие из-за низких уровней содержания свинца”.
Таблица 8.
Оптимальное содержание и соотношение макро- и микроэлементов в сельскохозяйственных растениях с позиции их продуктивности
| Культура | Оптимальное содержание | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| макроэлементы, % | микроэлементы, мг/кг | ||||||||
| N | P | K | Se | Cd | Ni | Zn | Cu | Pb | |
| Надземная масса | |||||||||
| Рапс Brassica napus |
3.7 | 0.6 | 3.3 | 1.2 | 0.9 | 5.1 | 44.0 | 3.6 | 3.5 |
| N ≈ 6.2P ≈ 1.1K | Zn ≈ 48Cd ≈ 8.6Ni ≈ 12Cu ≈ 12.6Pb ≈ 36.7Se | ||||||||
| Свекла Beta vulgaris |
1.8 | 0.5 | 2.5 | –* | 0.6 | 3.2 | 26.9 | 6.9 | 3.8 |
| N ≈ 3.4P ≈ 0.7K | Zn ≈ 45Cd ≈ 8.3Ni ≈ 3.9Cu ≈ 7Pb | ||||||||
| Морковь Daucus sativus |
1.9 | 0.4 | 2.6 | – | 0.4 | 2.0 | 17.3 | 4.4 | 3.6 |
| N ≈ 4.2P ≈ 0.7K | Zn ≈ 42Cd ≈ 8.1Ni ≈ 4.4Cu ≈ 5Pb | ||||||||
| Корнеплод | |||||||||
| Свекла Beta vulgaris |
1.4 | 0.5 | 1.9 | – | 0.3 | 1.1 | 17.3 | 5.6 | 2.6 |
| N ≈ 2.9P ≈ 0.7K | Zn ≈ 56Cd ≈ 8.3Ni ≈ 3.4Cu ≈ 7Pb | ||||||||
| Морковь Daucus sativus |
1.0 | 0.6 | 2.4 | – | 0.2 | 1.0 | 22.5 | 3.7 | 1.3 |
| N ≈ 1.9P ≈ 0.4K | Zn ≈ 52Cd ≈ 8.3Ni ≈ 2.7Cu ≈ 6Pb | ||||||||
Таким образом, строгое нормирование содержания и соотношения основных макроэлементов (N, Р, К) и ряда микроэлементов (Cd, Ni, Zn, Se, Cu, Pb) в растениях позволит прогнозировать биогеохимическую ситуацию, связанную с химической нагрузкой в системе “почва–растение”.
З.И. Журбицкий и В.М. Лавриченко (1977) отмечают, что в одинаковых почвенно-климатических условиях растения одного вида расходуют одинаковое количество каждого химического элемента на формирование единицы урожая. В то же время нарушение естественных биогеохимических циклов элементов, в том числе, вследствие загрязнения окружающей среды, значительно влияет на вынос химических элементов.
Имея информацию о выносе химических элементов, можно определить их расход для формирования единицы растениеводческой продукции, а также установить способность растений к усвоению поступивших из почвы химических элементов. Данная информация представляется необходимой в целях установления нормативов действия микроэлементов в агрохимических и экологических целях. Например, в табл. 9 представлена доля выноса химических элементов с растениями от количества их поступления в почву.
Как видно из табл. 9, растения способны усваивать лишь незначительную часть от поступившего в почву количества микроэлементов. Необходимо отметить, что при данном балансе Cd, Ni, Zn, Se в условиях поступления их в дозах 0.5–2 ПДК может возникнуть экологическая проблема, связанная с избыточным накоплением данных элементов в почве. Среди изученных культур наибольший вынос по большинству элементов отмечается у рапса, что объясняется особенностями поступления элементов в растения, в т. ч. биологическими особенностями культуры. Исследования показали, что исходя из рассчитанных коэффициентов интенсивности действия элементов на химический состав растений (табл. 5), поглощение, в частности, Cd, убывает в ряду: рапс яровой > столовая свекла > морковь.
Дополнительное поступление микроэлементов в растения агроценозов в оптимальных количествах способствует оптимизации элементного состава и устранению их дефицита, который объясняется естественным содержанием их в системе почва-растение, а также влиянием антропогенной деятельности (Marschner, 2012). В то же время несбалансированное, избыточное поступление элементов в растения вызывает тревогу с позиции экологической безопасности продукции. В проведенных нами исследованиях с овощными, кормовыми и зерновыми культурами наблюдается изменение содержания химических элементов по сравнению с контролем. Причем за счет явлений антагонизма-синергизма изменяется весь химический состав растений. Поэтому можно предположить, что содержание микроэлементов, даже не превышающее установленные нормативы ПДК, но выше фоновых естественных концентраций в растении, представляет определенную опасность при введении данной продукции в пищу животных и человека за счет явления биомагнификации. Известно, что большинство микроэлементов попадает в организм животных с кормами (Kaledin, Stepanova, 2023). В связи с вышесказанным, в исследованиях по агроэкологической оценке мы особое внимание уделили третьему звену – влиянию микроэлементов почвы, дозированных от 0.5 до 2 ПДК применением микроудобрений на химический состав растениеводческой продукции и метаболизм животных, потреблявших ее. При этом экологическая оценка предусматривала использование морфологических и биохимических методов исследований.
Преимущественно микроэлементы (в частности, металлы) аккумулируются в высоких концентрациях и долго остаются в почках и печени, что объясняется высоким содержанием в почечной и печеночной ткани особого белка металлотионина, богатого тиоловыми группами (Bustueva et al., 1994; Swiergosz-Kowalewska, 2001). В связи с этим для оценки экологического статуса Cd, Zn, Cr, Pb и Se были поставлены опыты на лабораторных животных и определены концентрации микроэлементов в печени крыс линии Wistar, потребляющих корма в течение 4 месяцев, обогащенные соединениями данных химических элементов при антропогенном поступлении в почву (табл. 10).
Таблица 10.
Содержание микроэлементов в печени крыс
| Группа животных | Содержание микроэлементов в печени животных, мг/кг |
|---|---|
| Содержание свинца | |
| Контроль | 1.02 ± 0.06 |
| Опытная Pb 2 ПДК | 1.6 ± 0.07* |
| Содержание хрома | |
| Контроль | 0.175 ± 0.021 |
| Опытная Cr 2 ПДК | 5.27 ± 0.53* |
| Содержание кадмия | |
| Контроль | 0.02 ± 0.001 |
| Опытная Cd 2ПДК | 0.07 ± 0.002* |
| Содержание цинка | |
| Контроль | 37.0 ± 2.0 |
| Опытная Zn 2 ПДК | 50.0 ± 2.0* |
| Содержание селена | |
| Контроль | 1.5 ± 0.35 |
| Опытная Se 2 ПДК | 5.5 ± 0.20* |
Полученные данные позволяют найти критические уровни их содержания, оказывающие токсическое действие на организм животных.
Данные табл. 10 показывают, что микроэлементы с разной интенсивностью накапливаются в печени (по возрастанию содержания их можно расположить в следующий ряд Cd–Cr–Pb–Se–Zn), что объясняется физиологическим действием химического элемента. Ионы исследуемых металлов вступают в соединения с карбоксильными, аминными и сульфгидрильными группами, имеющимися в молекулах белков, и таким путем задерживаются в организме. Они являются кумулятивными ядами, могут аккумулироваться и оставаться годами в печени, почках, селезенке и поджелудочной железе. При этом нарушается белковый, фосфорно-кальциевый и другие виды обмена. Повышенное поступление является причиной развития окислительного стресса в организме и, как следствие, активации процессов перекисного окисления липидов (Yang, 1983). Являясь для многих химических элементов основным органом детоксикации, печень является также мишенью токсического действия, причем для некоторых микроэлементов этот орган служит одним из критических для развития интоксикации в целом. Исследованиями (Синдирева, 2012, Синдирева, Зайко, 2020) проведен анализ структурно-функциональных преобразований органов опытных животных. Установлено, что корма, выращенные с применением всех исследуемых микроэлементов в дозе 2 ПДК, оказывают выраженное гепатотоксическое действие, что связано с нарушением структуры и целостности мембран клеток печени, развившимися метаболическими нарушениями в этих органах и, как следствие, в организме в целом. Степень выраженности структурных изменений в органах животных зависит от вида элемента, дозы, продолжительности интоксикационного периода.
ЗАКЛЮЧЕНИЕ
Таким образом, на примере ряда микроэлементов (Cd, Zn, Ni, Cr, Pb, Se), изучены биогеохимические циклы в условиях аграрных экосистем на примере южной лесостепи Западной Сибири. Показано их распределение, трансформация и действие на различных трофических уровнях живых организмов. В условиях многолетних полевых опытов доказано, что антропогенное дополнительное поступление Cd, Zn, Ni, Cr, Pb, Se способствует изменению естественных биогеохимических циклов микроэлементов, что может послужить причиной развития микроэлементозов – патологических состояний, вызванных дефицитом, избытком или дисбалансом химических элементов в живом организме. Представленные данные об интегральных критериях прогноза и оценки их действия в системе почва–растение–животное с учетом определенных биогеохимических условий могут послужить основой для оценки и предотвращения риска указанных нарушений путем оптимизации минерального питания организмов в условиях усиливающегося техногенеза биосферы.
ВЫВОДЫ
1. В условиях полевых многолетних опытов установлено среднее содержание в пахотном слое лугово-черноземной почвы (0-30см) подвижной формы Cd, Zn, Ni, Cr, Pb, Se при внесении установленных доз соединений этих микроэлементов в почву. Разработан нормативный коэффициент “b” с помощью которого можно прогнозировать накопление химического элемента в почве в случае его антропогенного поступления или, напротив, рассчитать дозировку внесения микроэлемента, необходимую для достижения оптимальной или токсичной концентрации.
2. В результате многолетних исследований изучено влияние Cd, Zn, Ni, Cr, Pb на химический состав столовой свеклы, моркови и рапса ярового, Se – на химический состав рапса и яровой мягкой пшеницы, что позволило выявить следующие основные закономерности:
– дополнительное поступление исследуемых химических элементов в почву способствует увеличению его содержания, как в органах запасания ассимилятов, так и в генеративных органах растений;
– исходя из рассчитанных коэффициентов интенсивности действия, поглощение микроэлементов убывает в ряду: рапс яровой > столовая свекла > морковь;
– по абсолютному содержанию в растениях микроэлементы можно расположить в следующей убывающей последовательности: Zn > Ni > Cr, Pb, Se > Cd, что связано с их химическими свойствами и биологической ролью.
3. С помощью закономерностей, установленных в полевых опытах, представляется возможным диагностировать потребность растений в Pb, Cu, Zn, Ni, Cd, Cr, Se для получения запланированных урожаев на почвах определенного типа (в данном случае, лугово-черноземных почвах южной лесостепи Западной Сибири). На основе полученных экспериментальных данных рассчитано оптимальное содержание изученных химических элементов и их соотношение в почве и растительном организме с учетом продуктивности культур.
4. Проведена оценка содержания Cd, Zn, Cr, Pb и Se в печени крыс линии Wistar, потребляющих корма, обогащенные данными химическими элементами при антропогенном поступлении в почву. Полученные данные позволили найти критические уровни их содержания, оказывающие токсическое действие на организм животных.
5. Разработаны количественные параметры, характеризующие биогеохимические циклы микроэлементов в агроэкосистемах, с учетом принципов интегрального подхода к оценке их действия в системе почва–растение–животное.
Автор выражает глубокую признательность научному редактору статьи доктору биологических наук В.В. Ермакову, а также рецензентам статьи за ценные замечания, позволившие улучшить ее качество.
Исследование выполнено по Государственному заданию в рамках темы (АААА-А17-117032210022-7) “Экологическая оценка действия микроэлементов и экотоксикантов в системе почва–растение–животное в условиях Западной Сибири”.
Список литературы
Александровская Е.Ю., Синдирева А.В., Иеронова В.В. (2020) Экологическая оценка действия селена в системе почва-растение в условиях Западной Сибири. Вестник Нижневартовского государственного университета. (1), 104-110.
Голубкина Н.А., Папазян Т.Т. (2006) Селен в питании. Растения, животные, человек. М.: Печатный город, 269 с.
Ермохин Ю.И., Башкатова Л.Н., Синдирева А.В., Трубина Н.К., Гиндемит А.М. (2019) Влияние кадмия, никеля, цинка на баланс химических элементов в почве. Вестник Омского государственного аграрного университета. 4(36), 12-19.
Ермохин Ю.И., Синдирева А.В. (2011) Взаимосвязи в питании растений. Омск: Вариант-Омск, 208 с.
Журбицкий З.И., Лавриченко В.М. (1977) Определение потребности растений в питании методом растительной диагностики. Агрохимия. (9), 127-133.
Ильин В.Б. (1991) Тяжелые металлы в системе почва-растение. Новосибирск: Наука, 151 с.
Илялетдинов А.Н. (1984) Микробиологическое превращение металлов. Алма-Ата: Наука, 268 с.
Каббата-Пендиас А., Пендиас Х. (1989) Микроэлементы в почвах и растениях. М.: Мир, 429 с.
Ковальский В.В. (1974) Геохимическая экология. М.: Наука, 298 с.
Красницкий В.М. (2002) Агрохимическая и экологическая характеристики почв Западной Сибири. Омск: ОмГАУ, 144 с.
Мельничук Ю.П. (1990) Влияние ионов кадмия на клеточное деление и рост растений. Киев: Наукова думка, 148 с.
Синдирева А.В. (2012) Критерии и параметры действия микроэлементов в системе почва-растение-животное. Дис. докт. биол. наук. Тюмень: Тюменская сельскохозяйственная академия, 420 с.
Синдирева А.В., Голубкина Н.А., Майданюк Г.А., Седокова Н.В. (2017) Экологическая оценка действия хрома, свинца, селена в трофических цепях. Сборник научных докладов XX Международной научно-практической конференции “Аграрная наука – сельскохозяйственному производству Сибири, Казахстана, Монголии, Беларуси и Болгарии”. Краснообск: Сибирский федеральный научный центр агробиотехнологий РАН. 1, 462-466.
Синдирева А.В., Зайко О.А. (2020) Моделирование поступления микроэлементов в организм животных и распределения их по органам. Сборник материалов ХI Национальной научно-практической конференции (с международным участием) “Экологические чтения – 2020”. Омск: Омский государственный аграрный университет имени П.А. Столыпина, 523-529.
Cысо А.И. (2007) Закономерности распределения химических элементов в почвообразующих породах и почвах Западной Сибири. Новосибирск: Изд-во СО РАН, 277 с.
Ягодин Б.А., Виноградова С.Б., Говорина В.В. (1989) Кадмий в системе почва–удобрение–растения–животные организмы и человек. Агрохимия. (5), 118-130.
Шеуджен А.Х. (2003) Биогеохимия. Майкоп: ГУРИПП “Адыгея”, 1028 с.
Aref F. (2011) Concentration of zinc and boron in corn leaf as affected by zinc sulfate and boric acid fertilizers in a deficient soil. Life Science J. 8, 26-31
Arvy M.P. (1993) Selenate and selenite uptake and translocation in bean plants (Phaseolus vulgaris). Exp. Bot. 44(263), 1083-1087.
Baker D. E., Chensin L. (1975) Chemical monitoring of soil for environmental quality animal and health. Advances in agronomy. 27, 306-366.
Bernal M., Cases R., Picorel R., Yruela I. (2007) Foliar and root Cu supply affect differently Fe and Zn uptake and photosynthetic activity in soybean plants. Environmental and Experimental Botany. 60. 145-150.
Brenneisen P., Steinbrenner H., Sies H. (2005) Selenium, oxidative stress and health aspects. Mol. Aspects Med. 26(4–5), 256-267.
Bustueva K. A., Revich B. A., Bezpalko L. E (1994) Cadmium in the environment of three Russian cities and in human hair and urine. Arch Environ Health. 49(4), 284-288.
Chizzola R., Michitsch H., Franz Ch. (2003) Monitoring metallic micronutrients and heavy metals in herbs, spices and medicinal plants from Austria. European Food Research and Technology.216, 407-411.
Diaconu D., Nastase V., Nanau M.M., Nechifor O., Nechifor E. (2009) Assessment of some heavy metals in soils, drinking water, medicinal plants and other liquid extracts. Environment Engineering Management J. 8, 569-573.
Ermakov V., Jovanović L. (2023) Chapter 1. The importance of biogeochemistry in environmental protection and green growth. In Technogenesis, Green economy and Sustainable development. (Eds. Jovanović L.N., Ermakov V.V., Ostroumov S.A.) Belgrade: Academic editions / Akademska izdanja, Zemun, 1-29.
Fairweather-Tait S.J., Bao Y., Broadley M.R., Collings R. et al. (2011) Selenium in human health and disease. Antioxid. Redox Signal. 14(7), 1337-1383.
Ehrlich H.L., Newman D.K., Kappler A. (2015) Geomicrobiology. Sixth Edition. CRC Press, 668 p.
Girling C.A. (1984) Selenium in agriculture the environment. Revew. Agr. Ecosystems and environment. 11(1), 37-65.
Griling C.A., Peterson P.J. (1981) The Significance of the Cadmium Species in Uptake and Metabolism of Cadmium in Crop Plants. Plant Nutr. 3, 703-720.
He Z.L., Yang X.E., Stoffella P.J. (2005) Trace elements in agroecosystems and impacts on the environment. Trace Elem Med Biol. 19 (2-3), 125-40.
Kaledin A.P., Stepanova M.V. (2023) Bioaccumulation of trace elements in vegetables grown in various anthropogenic conditions. Foods and Raw Materials. 11(1), 10-16
Marschner H. (2012) Mineral Nutrition of Higher Plants. London: Academic Press. 649 p.
Ojuederie O.B., Babalola O.O. (2017) Microbial and plant-assisted bioremediation of heavy metal polluted environments: a review. Int. J. Environ. Res. Public Health. 14, 1504.
Valls M., Lorenzo V. (2002). Exploiting the genetic and biochemical capacities of bacteria for the remediation of heavy metal pollution. Fems Microbiol. Rev. 26, 327-338.
Yamin Ma., Andrew W. Rate (2009) Formation of trace element biogeochemical anomalies in surface soils: the role of biota. Geochemistry Exploration Environment Analysis. 9, 353-367.
Yang G.Q. (1983) Endemic selenium intixication of human in China. Am. J. Clin. Nutr. 37, 872-881.
Дополнительные материалы отсутствуют.