Геохимия, 2023, T. 68, № 2, стр. 187-196
Биогеохимия природных органических веществ в водах суши: распределение и изменчивость при потеплении климата
Т. И. Моисеенко a, М. И. Дину a, *
a Институт геохимии и аналитической химии им. В.И. Вернадского
119991 Москва, Косыгина, 19, Россия
* E-mail: marinadinu999@gmail.com
Поступила в редакцию 06.06.2022
После доработки 08.08.2022
Принята к публикации 08.08.2022
- EDN: CLVOCI
- DOI: 10.31857/S0016752523020061
Аннотация
Рассмотрены особенности распространения и формирования органических веществ природных вод на Европейской территории России (ЕТР) и Западной Сибири (ЗС) в широтной географической зональности. Показано влияние условий водосборов и климата на содержания автохтонных и аллохтонных органических веществ, рассчитаны и проанализированы условные коэффициенты соотношения этих форм. Многомерными статистическими методами анализа установлено влияние температурного фактора на содержание автохтонных органических веществ вод южных территорий ЕТР и ЗС. Найдены закономерности распределения липидов, белков и углеводов автохтонных и аллохтонных органических веществ. Показан механизм биогеохимического преобразования связанных углеводов аллохтонных органических веществ в свободные автохтонные за счет микробного разложения, что характерно в большей степени для вод южных регионов ЗС. Рассмотрено влияние природно-климатических условий на особенности изменения количества органических веществ вод озер и их структурных характеристик (содержания ароматических и алифатических фрагментов).
ВВЕДЕНИЕ
Биогеохимический цикл углерода в водных системах суши является важным компонентом его глобального круговорота в биосфере. В водных системах природные органические вещества представляют собой стохастическую смесь веществ с различной молекулярной массой и функциональными характеристиками, которые претерпевают сложные достаточно специфические превращения в системе: водосбор–водный объект. По своему происхождению органические вещества природных вод подразделяют на две большие группы:
1). Автохтонные органические вещества, которые образуется внутри водоема вследствие продуктов биохимического распада остатков организмов, населяющих водоем (главным образом, планктон), а также прижизненных выделений метаболитов живыми организмами. Природные воды содержат органические вещества автохтонного происхождения в сравнительно невысоких концентрациях. Эта группа органических веществ включает липиды, белки, фенолы, азотсодержащие соединения, углеводы, которые характеризуется невысокой молекулярной массой и не обладают окрашенным цветом. Средняя концентрация органического углерода в речных и озерных водах редко превышает 20 мг/л. Содержание азотных групп колеблется в пределах 20–340, 2–25 и 6–200 мкг азота на 1 л соответственно (Liu, 2020). В крупных озерных системах (Ладога, Онега, Байкал, Великих Американский озерах) преобладают автохтонные органические вещества, это олиготрофные озера с низкой продуктивностью (Ладожское озеро…, 2002).
2). Аллохтонные природные органические вещества поступают в водоемы вследствие вымывания из почв, торфяников и лесных подстилок водосбора атмосферными осадками. Значительную часть органического вещества природных вод составляют гумусовые вещества: гуминовые кислоты и фульвокислоты. Особенно богаты гумусовыми веществами воды северных регионов, где концентрация их часто составляет единицы и десятки миллиграммов на 1 литр воды (Rantala et al., 2016; Crapart et al., 2021). Преобладание таких органических веществ характерно для малых озер гумидных территорий – это озера лесных и заболоченных водосборов (Henricsen et al., 1988: Finstad et al., 2016).
В последние годы на количество и состав органических веществ в водах суши огромное влияние вносит антропогенный фактор в виде хозяйственно бытовых сточных вод, диффузных стоков с урбанизированных территорий или сельскохозяйственных угодий (Williams et al., 2016). Климатический фактор также оказывает существенное влияние на содержания органических веществ через активацию биогеохимических циклов и изменения гидрологических условий на водосборе и в водоеме, которые определяют формирование органических соединений.
При потеплении климата активизируются продукционные процессы, что приводит с одной стороны к дополнительному образованию внутриводоемных органических веществ (автохтонной природы). Но с другой стороны, в более теплом климате усиливается микробиологическая активность на водосборе, что приведет к интенсивному разложению детрита (опада и подстилки), и, как следствие, усилию притока аллохтонных органических веществ с водосборов в водные системы. В более теплом климате может происходить, с одной стороны, более активное разложение детрита, с другой – активизация потребления органических веществ в продукционных процессах.
Процессы образования и разрушения органических веществ в водоемах тесно связаны с круговоротом других элементов и веществ, а также преимущественными формами их нахождения за счет конкурентного комплексообразования с неорганическими и органическими веществами (Лозовик и др., 2007; Bade et al., 2017; Лозовик и др., 2015; Волкова, 2015; Ефремова и др., 2019).
Органические вещества природных вод характеризуются различной степенью дисперсности, могут находиться в состоянии истинных растворов, коллоидов и взвешенных грубых частиц (суспензий). Коллоидная форма миграции (высокомолекулярная) наиболее характерна для природных вод, богатых крупноразмерными гумусовыми веществами. Все органические гумусовые вещества (фульвокислоты и гуминовые кислоты) и их комплексы с ионами железа обусловливают цветность вод (Priscu et al., 2008). Рядом исследователей указывается также миграция органического вещества в виде взвесей, например, детрита, состоящего из мельчайших органических и неорганических остатков, образующихся при распаде погибших организмов (Hansell, 2002; Kim et al., 2006).
В России более 70% территории относится к гумидным регионам, где широко развиты озерные системы, в которых преобладают органические вещества аллохтонной природы, т.е. поступающие с водосбора. Однако более точные данные о содержаниях и тенденциях изменения органических веществ в литературе ограничены.
Целью данной работы было оценить распределение органических веществ различного генезиса в озерных системах в зависимости от природно-климатической зоны (от тундры к степным регионам); на основе литературных и экспериментальных данных выявить особенности изменения содержания аллохтонных и автохтонных органических веществ вод в зависимости от природно-климатических условий формирования вод; проанализировать особенности химического состава аллохтонных и автохтонных органических веществ в зависимости от температурных условий региона.
ОБЪЕКТЫ И МЕТОДЫ
Объектами исследований являлись природные воды малых озер, расположенные на Европейской территории России (ЕТР) и в Западной Сибири (ЗС) вдоль климатического градиента: от тундры до степных зон. В исследования включались озера, не подверженные каким-либо прямым источником загрязнения, площадь водного зеркала которых не более 20 км2. Для минимизирования влияния межгодовых и сезонных вариаций отбор проб проводился в сжатый временной интервал позднего осеннего охлаждения, когда вегетационные процессы незначительны, устанавливается гомотермия и отсутствует стратификация. Соблюдение методологии анализа рекомендовано в проектах “Survey lakes” (NIVA, ICP-Water). Аналитическая программа включала определения: pH, электропроводность, содержание органического вещества ${\text{SO}}_{4}^{{2 - }},$ Cl–, ${\text{PO}}_{4}^{{3 - }}$(P), ${\text{NO}}_{3}^{ - },$ ${\text{NO}}_{2}^{ - },$ ${\text{NH}}_{4}^{ + },$ Ntot, ионы щелочных, щелочноземельных металлов, ионы Al, Fe и ионы ряд других переходных металлов.
Определение химического состава вод выполняли по единым методикам в соответствии с рекомендациями (Elton) в лабораториях Института проблем промышленной экологии Севера КНЦ РАН и Института водных проблем РАН, а также в Институте Химии Тюменского Университета и Института геохимии и аналитической химии им. Вернадского. Катионо-анионный состав определялся хроматографическими методами, общие параметры потенциометрическими методами.
Содержание органических веществ в водах ЕТР определялось методом перманганатной окисляемости, затем рассчитывалось общее содержание углерода (ТОС) по полученным зависимостям для вод Кольского п-ова: ТОС = 0.764 × × СODMn + 1.55. Для вод озер ЗС были определены содержания органических веществ двумя методами: методом перманганатной окисляемости и измерено содержание ТОС с помощью анализатора углерода ELEMENTAR (Vario TOC cube). Верификация аналитических методов и результатов определения химического состава вод осуществлялась по единой системе стандартных растворов при постоянном жестком внутрилабораторном контроле. Оценка среднегодовых температур (Т – температурный фактор) в регионах исследования для периода “открытой воды” производились через интернет ресурсы Росгидромет, Тюменский центр по гидрометеорологии и мониторингу окружающей среды и в сотрудничестве с Валдайским филиалом ГГИ.
Соотношение аллохтонных и автохтонных органических веществ в водах озер, расположенных на европейской территории России (ЕТР) и в Западной Сибири (ЗС) получены на основе найденных в литературе коэффициентов, приуроченных к конкретным зональным территориям (Волкова, 2015) и на основе собственных экспериментальных данных.
Экспериментальное исследование изменения количества и качества аллохтонных и автохтонных органических веществ в зависимости от ряда параметров (температурный фактор, зональные характеристики вод) были выполнены для 2 территорий: озера Кольского полуострова (35 озер, 2014 г., 2018 г.) и для вод озер Новгородской области (2 озера, 2015–2021 гг.). В последнем случае проведено более детальное изучение содержаний аллохтонных и автохтонных органических веществ. Разделение аллохтонных и автохтонных органических веществ (Linniketal, 2013; Chupalovetal, 2017) проводили на целлюлозе (ДЭЦЛ). Идентификацию качественных особенностей проводили спектральными методами анализа (Matilainenetal, 2012; Shimotorietal, 2012) SUVA как отношение оптических плотностей при различных длинах волн (Е254/Е436 и Е470/Е655). Содержание липидов, белков и углеводов определяли на хромато-масс-спектрометре Thermo (ТюмГУ, МПГУ). Измерение размеров и молекулярных масс каждого типа органических веществ проводили методами хроматографии (газовый хроматограф Agilent, ТюмГУ), на дзета-сайзер анализаторе Malvern Zetasizer Nan-o ZS (МПГУ), также были оценены некоторые структурные особенности органических веществ (ИК-спектрометр Nicolet6700, МПГУ).
Статистический анализ данных содержаний органических веществ гумусовой и не гумусовой природы проводился методами многомерного анализа (PСCA, RDA, Discriminant, ClusterAnalyses) в программе Statistica 13. В ходе многомерного PCCA/RDA анализа были выбраны зависимые и независимые переменные и установлена статистически достоверная связь между ними.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Зональные особенности распределения органических веществ вод
Для оценки влияния физико-химических условий формирования вод на содержание органических веществ в воде, нами была проведена классификация показателей химического состава вод ЗС и ЕТР в зависимости от приуроченности водного объекта к природно-климатическим зонам.
Согласно нашим и литературным данным, прослеживается закономерное увеличение содержания органических веществ любого генезиса по мере продвижения к более южным регионам. Закономерное увеличение от северных к южным широтам происходит также общей минерализации вод и содержаний микроэлементов, что отмечено в работах (Алекин, 1995; Моисеенко и др., 2006; Паничева, Кремлева, 2018). Это указывает на синхронно повышающуюся биологическую продуктивность водоемов.
В зонах тундры и тайги ЗС и ЕТР воды озер характеризуются более высокими показателями цветности, которые обусловлены поступлением органических веществ аллохтонного происхождения с заболоченных и лесных водосборов, что закономерно приводит к более низким величинам рН вод. Согласно полученным данным (табл. 1), несмотря на большие в целом количества органических веществ в условиях зоны тундры ЗС, эти воды характеризуются большим количеством озер с рН < 6 по сравнению с таковыми в ЕТР, и как следствие, их обогащение органическими веществами аллохтонной природы несколько выше. Следует отметить наличие в этих зонах дистрофных озер с очень высокой цветностью (более 100 Pl–Co шкалы) и значениями рН менее 4. Дистрофные озера можно встретить и в зоне тундры ЕТР. В южных лесах и степях изменение цветности вод озер связано с процессами притока биогенных элементов (азота и фосфора), которые стимулируют повышение продуктивности водоемов и образование автохтонных органических веществ.
Таблица 1.
Средние концентрации основных показателей химического состава вод озер на территориях ЕТР и ЗС (2014–2015 гг.) в зависимости от значений рН
| Параметр | Европейская территория России | Западная Сибирь | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Тундра, лесотундра | Северная тайга | Средняя тайга | Смешанные леса | Лесостепь, степь | Тундра | Северная тайга | Средняя тайга | Южная тайга | Лесостепь, степь | |||||||||||
| рН | <6 | 6–8 | <6 | 6–8 | <6 | 6–8 | <6 | 6–8 | >8 | 6–8 | >8 | <6 | 6–8 | <6 | 6–8 | <6 | 6–8 | 6–8 | 6–8 | >8 |
| n | 5 | 29 | 10 | 60 | 5 | 77 | 6 | 55 | 6 | 15 | 9 | 15 | 24 | 13 | 13 | 22 | 14 | 16 | 8 | 3 |
| Цветность, Cr/Co; Pt/Co | 169 65–270 | 29 8–130 | 90 2–300 | 45 0–350 | 101 4–250 | 54 15–200 | 36 20–70 | 58 8–100 | 11 10–20 | 68 10–150 | 28 10–75 | 8 1–21 | 78 11–180 | 62 6–180 | 69 4–135 | 74 15–160 | 64 7–110 | 54 4–170 | 43 35–90 | 26 20–33 |
| Сорг, мг С/л | 13 8–20 | 5.2 3.0–15 | 9.2 4–25 | 6.5 2–25 | 13 3–25 | 8.2 2–20 | 5.6 1–16 | 9.2 2–18 | 12 4–20 | 9 4–15 | 23 7–30 | 5 2.1–9.8 | 6 1.3–16 | 10 4–25 | 10 2–20 | 12 5–22 | 11 1–14 | 12 7–18 | 30 26–40 | 22 18–26 |
| Аллохтонная органика, мг С/л | 11 3–17 | 19 1–70 | 5.3 0.5–20 | 3.1 0.6–22 | 7 2–30 | 4 2–8 | 2.5 1–5 | 4.2 1–10 | 2 5–30 | 3 1–10 | 4 3–5 | 0.3 0.1–1.2 | 3.0 2.0–4.2 | 6.3 0.5–18 | 6.4 1.0–13 | 7.5 2–15 | 6 1–11 | 6.6 1–20 | 4.2 3.0–9.0 | 2.6 2.0–2.9 |
| Автохтонная органика, мг С/л | 2.0 0.5–6 | 3.3 1–7.7 | 3.9 1.5–5 | 5.1 2–6 | 6.3 2–9 | 5.8 2.0–13 | 3.5 1–10 | 5.5 0.2–18 | 10.0 3–20 | 5.9 2–15 | 19 3–60 | 4.3 2.0–5.6 | 3.1 0.5–9.0 | 3.7 1–8 | 3.6 1–5 | 4.5 1–11 | 4 0.5–10 | 8.4 1–15 | 24.8 18–35 | 19.4 16–25 |
| Ptot, мкг Р/л | 18.4 9–50 | 4.8 1–10 | 7 2–15 | 7.9 2–60 | 8.3 4–15 | 26 5–90 | 38 5–60 | 52 10–200 | 14 8–30 | 58 15–70 | 45 10–100 | 42 90–200 | 48 10–700 | 42 20–200 | 42 10–100 | 30 10–160 | 52 5–130 | 68 5–146 | 30 10–50 | 15 10–25 |
| Ntot, мкг N/л | 284 150–400 | 138 70–300 | 218 50–450 | 204 50–500 | 246 100–350 | 308 100–1200 | 1121 200–3000 | 1280 200–3000 | 621 200–1500 | 2008 500–2600 | 1600 900–2500 | 820 50–1510 | 514 220–1260 | 900 70–1300 | 410 200–1100 | 800 200–1200 | 840 400–2200 | 2180 400–4100 | 2700 15000–3500 | 1940 150–2500 |
| Nорг, мкг N/л | 270 150–380 | 134 70–300 | 208 40–400 | 154 15–27 | 227 115–300 | 305 100–560 | 871 30–2500 | 658 50–2500 | 340 5–800 | 820 80–1200 | 947 60–1200 | 256 50–750 | 198 2.5–950 | 358 40–720 | 251 6–919 | 260 60–700 | 400 30–800 | 761 300–1400 | 2297 1530–3400 | 1169 700–1720 |
| Цветность/ Сорг | 11.5 7–17 | 5 1–14 | 5.1 1–16 | 5.2 2–16 | 6.2 2–10 | 5.9 2–12 | 36 2–50 | 52 2–40 | 11 1–40 | 3.2 2–25 | 2 1–5 | 4.64 0.5–5 | 10.2 1.5–15 | 6 5–25 | 6 2–8 | 6 1–9 | 8.5 1–12 | 3 1–10 | 1.5 1–3 | 1.2 0.5–1.5 |
| С/N | 49 30–80 | 47 20–80 | 44 10–100 | 44 16–50 | 53 20–80 | 33 10–64 | 29 1–60 | 28 7–70 | 18 1–80 | 11 10–70 | 12 6–100 | 31 5–90 | 48 10–210 | 39 10–200 | 130 2–350 | 56 10–250 | 54 3–200 | 29 10–40 | 14 10–26 | 18 15–30 |
Аллохтонные и автохтонные органические вещества
Согласно данным авторов (Hansell et al., 2002; Лозовик и др., 2007; Волкова, 2015; Моисеенко и др., 2005, 2006, 2017) органические вещества автохтонного и аллохтонного происхождения можно различить с использованием соотношения органических углерода и азота – этот коэффициент позволяет характеризовать преимущественный тип органических веществ. Если соотношение меньше или близко к 12, то органическое вещество является автохтонным и преобладают низкомолекулярные соединения, обогащенные азотными формами; если 47 и более – доминируют органические вещества аллохтонного типа с высоким содержанием углеводородных соединений. Наши расчеты на основе модельных экспериментов, так же как принятые оценки в литературе соотношений, позволили достоверно вычислить содержания обоих типов органических веществ (табл. 1). Анализ данных показывает закономерно более высокие значения соотношения C/N в северных регионах, что объясняется более низкой продуктивностью водоемов в холодных широтах.
Однако это правило не всегда распространяется и зависит от характеристик конкретного водосбора озера.
Несмотря на то, что в северных районах ЗС характерна низкая продуктивность озер, особенно находящихся в зоне вечной мерзлоты и здесь преобладает органическое вещество аллохтонной природы, есть исключения. В исследованных водных объектах тундровой зоны ЗС с возможным техногенным влиянием (влияние нефтяных углеводородов) встречаются озера с преобладанием автохтонных органических веществ (до 90% от общего органического углерода), возможно за счет микробиологической активности нефтеперерабатывающих микроорганизмов или поступления азота на водосборы в результате сжигания попутного газа на нефтяных промыслах (Волкова, 2015; Паничева, Кремлева, 2018). Кроме того, подобные примеры известны в работах, полученных авторами для озер Карелии и зарубежными коллегами в озерах Скандинавии (Kortelainen, 1993; Yamashita et al., 2021). Рассматриваемые озера приурочены к геологической структуре с гранитными обнажениями горных пород на водосборе, на которых растительность слабо развита. В лесостепных и степных озерах это соотношение демонстрирует более высокое содержание органического вещества автохтонное природы, что объясняется более высокой продуктивностью за счет повышенной среднегодовой температуры.
Для промежуточных территорий тайги и лесов выявлено достаточно синхронное снижение коэффициента С/N, что можно объяснить зональным потеплением климата и увеличением средней температуры. Исключение составляют территории северной тайги ЗС, в которых коэффициент С/N смещен в сторону доминирования аллохтонного органического вещества.
Рассматривая диапазоны выбранных нами величин рН для оценки изменения баланса органических веществ, стоит отметить, что озера с рН < 6 распространены в зонах от тундры до тайги/лесов обеих территорий. Соотношение C/N в таких озерах (c pH < 6) изменяется менее синхронно с повышением температуры. Озера в диапазоне рН более 8 расположены в южных регионах ЗС и ЕТР, характеризуются естественно повышенным содержанием автохтонной органики, что подтверждается невысокими величинами цветности и рассматриваемыми коэффициентами.
Другим важным коэффициентом, применяемым для оценки баланса автохтонных и аллохтонных органических веществ, является отношение Цв/Сорг (Prokushkin et al., 2011; Волкова, 2015; Wilkinson et al., 2017). Аллохтонная органика дает цвет (“темные гумус”), в отличие от автохтонной органики (“светлый гумус”), чем выше данный коэффициент, тем больше органических веществ гумусовой природы в водах. Ориентировочные величины изменения данного соотношения для различных типов вод от 1 до 110–150 (Agren et al., 2007; Лозовик и др., 2007). Полученные нами результаты указывают на следующие границы варьирования: для ЗС от 0.5 до 10, для ЕТР от 1 до 60. Несмотря на активное применение этого показателя, в литературе отражены ограничения в его использовании за счет окраски вод другими компонентами, например, присутствия в воде соединений железа или синтетических органических веществ (Kim et al., 2006).
Можно отметить, что при сравнении вод северных и южных районов исследованных территорий соотношение Цв/Сорг снижается значительно: для ЕТР от 12 до 2, для ЗС от 10 до 1, что означает увеличение доли автохтонной органики в водах суши по направлению к южным зонам. Для рассматриваемых регионов коэффициент Цв/Сорг подтверждает тенденцию рассмотренного выше соотношения C/N. Соотношения Цв/Сорг, полученные для вод средних широт (зоны тайги, лесов) свидетельствуют об отсутствии таковой тенденции, что может быть объяснено вкладом других окрашенных соединений. Например, в водах ЗС вклад окрашенных нефтепродуктов (природный и техногенный вклад) может значительно изменять цветность вод (Agren, 2007; Волкова, 2015).
Можно заключить, что продвигаясь от северных районов к южным, в водах ЗС и ЕТР становятся более распространены озера, в водах которых увеличивается автохтонная составляющая, как следствие синхронного повышения температурных условий и биологической продуктивности озер. Все указанные факторы способствуют не только притоку органических веществ с водосбора, но и продуцированию органических веществ в водоеме, их включению в биохимические процессы, что согласуется с распространенными литературными данными (Koehler et al., 2012).
Статистическая обработка данных: температурный фактор и соотношение форм органических веществ
Для оценки вклада в зональную специфику формирования органических веществ, как указанных коэффициентов, так и полученных нами на основе экспериментальных данных содержаний аллохтонного и автохтонного органических веществ был проведен дискриминантный анализ с канонической визуализацией (рис. 1).
Рис. 1.
Каноническая визуализация дискриминантного метода анализа главных компонентов: (а) ЕТР, (б) ЗС. Исходя из рассчитанных коэффициентов С/N (он составляет от 12 до 47 для вод озер исследованных территорий), только в исключительных случаях возможно сделать заключение о преобладании органического вещества гумусной или эвтрофной природы. В большинстве озер в водах присутствует смесь органических веществ различного генезиса.
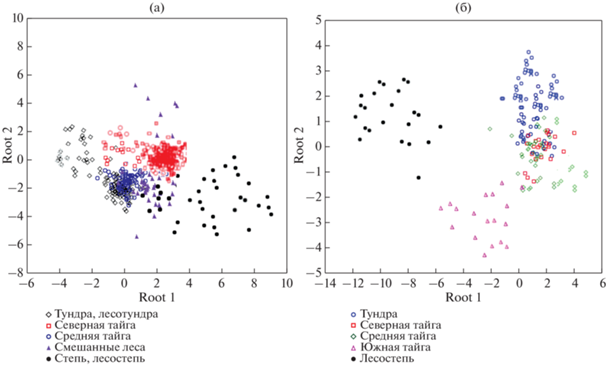
Статистически анализ, выполненный для вод различных зон ЗС, показал значимые различия (обособление канонических функций) для “степной + лесостепной” зон и зоны южной тайги в ЗС и менее явная дискриминация характерна для вод региона тундры. Указанные наблюдения подтверждаются (табл. 2) значимостью величины F-критерия. Для вод ЗС наибольший вклад в различия вод озер вносят содержания автохтонной и аллохтонной составляющей органических веществ и температурный фактор.
Таблица 2.
Параметры статистической достоверности дискриминантного анализа
| Параметр | Европейская территория России | Западная Сибирь | ||||
|---|---|---|---|---|---|---|
| Критерий Увилкса |
F- критерий |
p-уровень значимос |
Критерий Увилкса |
F- критерий |
p-уровень значимос |
|
| Залесенность | 0.229149 | 10.7417 | 0.000000 | 0.082670 | 0.516597 | 0.000763 |
| Заболоченность | 0.414337 | 7.33665 | 0.000000 | 0.048567 | 0.879342 | 0.000000 |
| C/N | 0.268667 | 6.85149 | 0.000392 | 0.044459 | 4.23116 | 0.000000 |
| Color/C | 0.206387 | 1.89932 | 0.000000 | 0.049996 | 5.12036 | 0.000756 |
| С аллохт | 0.258509 | 5.82149 | 0.002592 | 0.060402 | 12.43053 | 0.000000 |
| С автохт | 0.222583 | 13.9147 | 0.001853 | 0.117669 | 12.65811 | 0.000000 |
| Темпер. фактор | 0.261613 | 15.8975 | 0.000181 | 0.048567 | 14.11642 | 0.003676 |
| Робщ | 0.018525 | 1.95265 | 0.000000 | 0.060400 | 0.43324 | 0.000000 |
Для ЕТР проявляется не такое явное разделение канонических функций как для ЗС, что может быть связано с многообразием ландшафтной структуры территории (Моисеенко и др., 2017). Нами также выявлены обособления канонической функции для “степи + лесостепи” и менее явные дискриминации для “тундры + лесотундры”. Параметрами различия относительно F-критерия являются залесенность и заболоченность (Моисеенко и др., 2006) территорий, температурный градиент. Соотношения С/N также вносят значимый вклад в дискриминацию зон.
Для озер обеих территорий ЗС и ЕТР в целом характерны смешения канонических функций для вод зон тайги и области лесов за счет неявного доминирования как аллохтонной, так и автохтонной органики без особого отражения в средних содержаниях (табл. 1).
Влияние температуры на формирование органических веществ в водах суши
Согласно результатам статистической обработки данных, для вод исследованных территорий, выявлено влияние повышения температуры (Т фактора), которое приводит к увеличению содержание Сорг в водах озер от северных к южным зонам. Для оценки влияния температуры в период открытой воды (Моисеенко и др., 2017; Паничева, Кремлева, 2018), был проведен многомерный анализ методом главных компонент (рис. 2). Были обоснованы ключевые параметры, которые влияют на химический состав вод. В качестве основных были выбраны: показатель температуры и особенности ландшафта (залесенность, заболоченность), в качестве зависимых переменных – рН, содержания органических веществ различного генезиса, биогенных элементов и ионов металлов.
Рис. 2.
Многомерное шкалирование RDA-анализ сродства независимых (залесенность, заболоченность, Т – температура) и зависимых (Аллохт органика, Автохтон органка, Nобщ, ${\text{NH}}_{4}^{ + },$ ${\text{NO}}_{3}^{ - },$ Fe, Al, Cond, Si) переменных: (а) ЕТР, (б) ЗС.
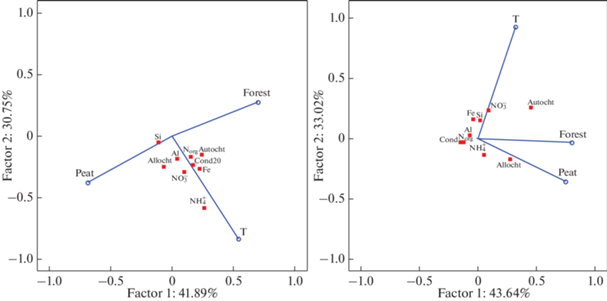
Результаты показали высокое сродство автохтонного органического вещества и биогенных элементов к температурному фактору, что закономерно. Показатель залесенности водосбора, аллохтонной органики имеет сродство к показателям заболоченности водосборов и рН вод. Для вод ЕТР выявлено большее сродство большинства переменных к температурному фактору. В то же время, аллохтонное органическое вещество в водах проявляет сродство к параметру заболоченности водосборов, что закономерно. Для вод ЗС несмотря на сильное влияние температурного фактора, показатели содержаний в водах биогенных элементов ближе располагаются к оси, характеризующей заболоченность водосборов.
Для получения численного представления о роли температуры, как возможного инициатора образования органических веществ различного генезиса, проведена оценка связи содержаний автохтонных органических веществ с аллохтонными в воде через показатель температуры в регионе (табл. 3). В качестве изменяемых параметров были выбраны аллохтонные органические вещества (которые фиксируются окисляемостью) и средний показатель температуры в рассматриваемой зоне. Автохтонные органические вещества, как было указано в методике, получены на основе экспериментальных и теоретически рассчитанных величин.
Таблица 3.
Многопараметрические уравнения изменения автохтонных органических веществ в водах озер в зависимости от ряда изменяемых параметров
| Природная зона | Европейская территория России | Западная Сибирь |
|---|---|---|
| Тундра/лесотундра | Автохт = 0.68 × T – 0.37 × Аллохт – 0.12, r = 0.65 | Автохт = 0.60 × T – 0.28 × Аллохт – 0.10, r = 0.75 |
| Тайга | Автохт = 1.8 × T – 0.51 × Аллохт – 0.20 r = 0.88 |
Автохт = 2.9 × T – 0.30 × Аллохт – 0.12 r = 0.65 |
| Леса | Автохт = 2.51 × T – 0.80 × Аллохт – 0.35 r = 0.95 |
Автохт = 3.2 × T + 0.75 × Аллохт – 0.17 r = 0.69 |
| Лесостепь/степь | Автохт = 6.75 × T + 0.80 × Аллохт + 1.68 r = 0.66 |
Автохт = 8.91 × T + 0.90 × Аллохт + 1.88 r = 69 |
Полученные нами параметрические уравнения для зон ЕТР и ЗС показали значимое влияние температурного фактора на образование автохтонного органического вещества в водах зон лесов. Автохтонные органические вещества в южных регионах образуются вследствие притока гумуса, который может являться субстратом для развития микрофлоры и вовлечения вещества в трофическую структуру водоема. Наиболее явно это прослеживается в водах лесостепных и степных зон. Можно также предположить протекание реакций между аллохтонной и автохтонной органикой через биогеохимические процессы, которые по мере продвижения в югу интенсифицируются.
Компонентная составляющая органических веществ вод
Степень активности взаимодействия автохтонных и аллохтонных органических веществ за счет поглощения последних в биохимических процессах может быть оценена путем статистического анализа достоверных связей между компонентами органических веществ: липиды, связанные и свободные углеводы, белки. Оценка содержаний аллохтонных и автохтонных веществ по литературным и экспериментальных данным показала, что в северных районах свободные и связанные углеводы поступают в водоемы преимущественно с гумусом водосбора и в меньшей степени формируются внутри водоемов. В южных районах свободные углеводы, в большей степени, образуются за счет автохтонных органических веществ, вступают в реакции с компонентами (связанными и свободными) гумусовой органики, приводя к изменениям молекулярных масс последней (о чем свидетельствую и наши экспериментальные данные). Соответственно, в зонах смешенных лесов и южных районов содержание белков и липидов превышает таковые в северных регионах и степень биохимического взаимодействия гумусовой органики со свободными углеводами, липидами и белками автохтонных органических веществ выше (Wilkinson et al., 1997; Amon et al., 1997; Kim et al., 2006).
Полученные результаты кластерного анализа для территорий ЗС и ЕТР (рис. 3) показали высокое взаимодействие между белками и липидами двух типов органического вещества в южных регионах вследствие влияния высоких температур: для вод ЗС (макс. % дистанции 20) для вод ЕТР еще выше (макс. % дистанции 100). Выявлена значимая статистическая связь и, как можно предположить, максимальное биохимическое взаимодействие между белками и липидами. В ряде работ (Amon et al., 1997; Kim et al., 2006) отмечается, что в особенности для вод теплых широт отдельные типы микроорганизмов рода Enterococcus активно участвуют в преобразовании связанных углеводов в свободные углеводы, а также способствуют разложению белков и липидов до компонентов, которые могут быть поглощены в биотических процессах с последующим образованием автохтонных органических веществ.
Рис. 3.
Кластерный анализ компонентов органических веществ аллохтонного и автохтонного типа: * – компоненты, содержащиеся в автохтонном органическом веществе; без * – компоненты, содержащиеся в аллохтонных органических веществах.
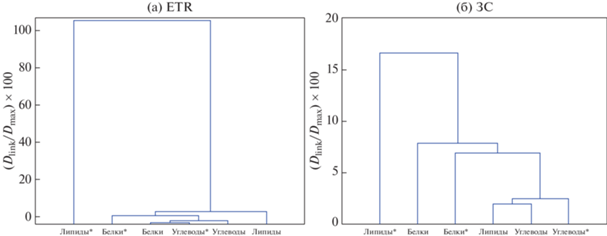
Можно заключить, что температура и содержание аллохтонных органических веществ вод являются необходимыми условиями для образования автохтонных органических веществ. Биохимический состав гумусовых веществ в водах суши вследствие сложных ферментативных процессов преобразуется и определяет состав и количество автохтонной органики в водных системах, в особенности в южных районах. Для зон ЗС влияние микробного преобразования аллохтонной органики на состав и свойства автохтонных органических веществ наиболее явно прослеживается как возможный результат деятельности нефтеперерабатывающих микроорганизмов.
ЗАКЛЮЧЕНИЕ
Баланс аллохтонных и автохтонных органических веществ в водах озер ЕТР и ЗС является адекватным параметром оценки биогеохимического статуса природных вод (трофности водоема). Использованные коэффициенты оценки соотношений аллохтонных и автохтонных органических веществ не полностью отражают преимущественный генезис образования органических веществ водоема, но демонстрируют влияние ряда ландшафтных и климатических параметров на биогеохимические процессы в водоемах, в частности, на образование органического вещества.
Для вод озер средних широт обоих регионов (преимущественно для территорий ЗС) трудно выявить доминирующий тип органических веществ, обусловливающих цветность вод, поскольку другие соединения также способствуют их окрашиванию. Наиболее достоверную значимость относительно измеренных соотношений аллохтонных и автохтонных органических веществ имеют коэффициенты, рассчитанные для южных и северных зон ЗС и ЕТР.
Доказано, что увеличение содержаний автохтонного вещества в водах суши южных регионов обусловлено более интенсивным вовлечением гумусовой органики в биогеохимические процессы, как на водосборе, так и в водоеме, что в итоге приводит к возрастанию образования автохтонных органических веществ. Установлено, что северные регионы ЗС и ЕТР характеризуются доминированием аллохтонной органики, тем не менее, существуют исключения – это воды озер, подверженных влиянию локальных геохимических и антропогенных факторов.
В водах южных территорий, особенно в ЗС, установлена высокая активность взаимодействий компонентов органических веществ разного генезиса, таких как липиды, белки, свободные и связанные углеводы, которые активно вовлекаются в биохимические процессы. Исходя из полученных данных, можно предположить, что потепление климата приведет к изменениям в соотношениях аллохтонного и автохтонного органического вещества в водных системах в пользу последних.
Работа выполнена при финансовой поддержке РНФ, проект № 22-17-00061.
Список литературы
Алекин О.А. (1995) Основы гидрохимии. Гидрометеорологическое издательство. Л., 1953, 296 с.
Волкова С.С. (2015) Физико-химические особенности формирования состава органического вещества и карбонатной системы в малых озерах Западной Сибири: автор. дисс. кхн. Тюмень, 19 с.
Ефремова Т.А., Зобкова М.В. (2019) Содержание, распределение и соотношение основных компонентов органического вещества в воде Онежского озера Труды Карельского научного центра РАН. (9), 60-75.
Ладожское озеро: Past, present and future: Прошлое, настоящее, будущее (2002) / Под ред. Румянцева В.А., Драбковой В.Г. СПб. Наука, 326 с.
Лозовик П.А., Морозов А.К., Зобков М.Б., Духовичева Т.А., Осипова Л.А. (2007) Аллохтонное и автохтонное органическое вещество в поверхностныхводах Карелии Водные ресурсы. 34(2), 225-237.
Лозовик П.А., Мусатова М.В. (2013) Методика разделения органического вещества природных вод адсорбцией на диэтиламиноэтилцеллюлозе на автохтонную и аллохтонную составляющие. Вестник МГОУ. Сер. Естественные науки. (3), 63-68.
Моисеенко Т.И., Гашкина Н.А. (2005) Факторы формирования химического состава вод малых озер. ДАН. 401(6), 802-807.
Моисеенко Т.И., Гашкина Н.А., Дину М.И., Хорошавин В.Ю., Кремлева Т.А. (2017) Влияние природных и антропогенных факторов на процессы закисления вод в гумидных региона. Геохимия. (1), 41-56.
Moiseenko T.I., Gashkina N.A., Dinu M.I., Khoroshavin V.Y., Kremleva T.A. (2017) Influence of natural and anthropogenic factors on water acidification in humid regions. Geochem. Int. 55(1), 84-97.
Моисеенко Т.И., Гашкина Н.А., Кудрявцева Л.П. (2006) Формирование химического состава вод озер в условиях изменения окружающей среды. Водные ресурсы. 33(2), 163-180
Паничева, Л.П., Кремлева Т.А., Волкова С.С. (2018) Биохимическая трансформация нефтяных углеводородов в водах Западной Сибири. Вести Тюменского Государственного Университета. (5), 6-22
Agren A., Buffam I., Jansson M., Laudon H. (2007) Importance of seasonality and small streams for the landscape regulation of dissolved organic carbon export. J. Geophys. Res. 112.
Algesten G., Sobek S., Bergstro A.K., Agren A., Tranvik L.J., Jansson M. (2003) Role of lakes for organic carbon cycling in the boreal zone. Global Change Biol. (10), 141-147.
Amon R.M.W., Benner R. (1996) Bacterial utilization of different size classes of dissolved organic matter. Limnol. Oceanogr. (41), 41-51.
Bade D.L., Carpenter S.R., Cole J.J., Pace M.L., Kritzberg E., Van de Bogert M.C., Cory R.M., McKnight D.M. (2007) Sources and fates of dissolved organic carbon isotope additions. Biogeochemistry. 84. 115-129.
Chupakov A., Chupakova A., Moreva O, Shirokova L., Zabelina S.A., Vorobieva Y, Klimov S., Brovko O.S., Pokrovsky O.S. (2017) Allochthonous and autochthonous carbon in deep, organicrich and organicpoor lakes of the European Russian subarctic. Boreal Environment research. (22), 213-230
Cory R.M., McKnight D.M., Chin Y.P., Miller P., Jaros C.L. (2007) Chemical characteristics of fulvic acids from Arctic surface waters: microbial contributions and photochemical transformations. J. Geophys. Res. Biogeosci. 112.
Crapart C., Andersen T., Hessen D.O., Valiente N., Vogt R.D. (2021) Factors governing biodegradability of dissolved natural organic matter in Lake. Water. (13), 2210.
Denfeld B.A., Wallin M.B., Sahlée E., Sobek S., Kokic J.,Chmiel H.E., Weyhenmeyer G.A. (2015) Temporal andspatial carbon dioxide concentration patterns in a smallboreal lake in relation to icecover dynamics. Boreal Env. Res. (20), 679-692.
Finstad A., Andersen T., Larsen S., Tominaga K., Blumentrath S., de Wit H.A., Tømmervik H., Hessen D.O. (2016) From greening to browning: Catchment vegetation development and reduced S-deposition promote organic carbon load on decadal time scales in Nordic lakes. Scient. Repor. 6(1), 31944
Hansell D.A., Carlson C.A., Suzuki Y. (2002) Dissolved organic carbon export with North Pacific Intermediate Water formation. Glob. Biogeochem. Cycle (16), 1007.
Henriksen K., Kemp W.M. (1988) Nitrification in estuarine and coastal marine sediments In: Blackburn T.H., Sorensen J. (eds) Nitrogen cycling in coastal marine environments. Wiley & Sons, Chichester, 207-240
Kellerman A.M., Kothawala D.N., Dittmar T., Tranvik L.J. (2015) Persistence of dissolved organic matter in lakesrelated to its molecular characteristics. Nature Geoscience. (8), 454-457.
Kim S., Kaplan L.A., Hatcher P.G. (2006) Biodegradable dissolved organic matter in a temperate and a tropical stream determined from ultra-high resolution mass spectrometry. Limnol. Oceanogr. (51), 1054-1063.
Koehler B., von Wachenfeldt E., Kothawala D., Tranvik L.J. (2012) Reactivity continuum of dissolved organic carbon decomposition in lake water. J. Geophys. Res. 117.
Kortelainen P. (1993) Content of total organic carbon in Finnishlakes and its relationship to catchment characteristics. Can. J. Fish. Aquat. Sci. (50), 1477-1483.
Linnik P.N., Ivanechko Ya.S., Linnik R.P., Zhezherya V.A. (2013) Humic substances in surface waters of the Ukraine. Russ. J. Gen. Chem. 83(13), 2715-2730.
Liu F. (2020) Dissolved organic carbon concentration and biodegradability across the global rivers: A meta-analysis Sci. of The Tot. Env. 818, 151828
Matilainen A., Gjessing E.T., Lahtinen T., Hed L., Bhatnagar A., Sillanpaa M. (2011) An overview of the methods used in the characterization of natural organic matter (NOM) in relation to drinking water treatment. Chemosphere. 83. 1431-1442.
Priscu J., Foreman C.M. (2008) Encyclopedia of Inland Waters.
Prokushkin A.S., Pokrovsky O.S., Shirokova L.S., Korets M.A., Viers J., Prokushkin S.G., Amon R.M.W., Guggenberger G., McDowell W.H. (2011) Sources and the fl ux pattern of dissolved carbon in rivers of the Yenisey basin draining the Central Siberian Plateau Environ. Res. Lett. (6), 45212-45225.
Rantala M.V., Nevalainen L., Rautio M., Galkin A., Luoto T.P. (2016) Sources and controls of organic carbon in lakes across the subarctic treeline. Biogeochem. (129), 235-253.
Shimotori K., Watanabe K., Hama T. (2012) Fluorescence characteristics of humic-likefluorescent dissolved organic matter produced by various taxa of marine bacteria. Aquat. Microb. Ecol. (65), 249-260.
Town R.M., Filella M.A. (2000) comprehensive systematic compilation of complexation parameters reported for trace metals in natural waters. Aquat. Sci. 62(3), 252-295.
Wauthy M., Rautio M., Christoffersen K.S., Forsström L., Laurion I., Mariash H.L., Peura S., Vincent W.F. (2018) Increasing dominance of terrigenous organic matter in circumpolar freshwaters due to permafrost thaw. Limnology and Oceanography Letters. 3(3), 186-198.
Wilkinson K.J., Joz-Roland A., Buffl J. (1997) Different roles of pedogenic fulvic acids and aquagenic biopolymers on colloid aggregation and stability in freshwaters Limnol. Oceanogr. 42(8), 1714-1724
Yamashita Y., Tosaka T., Bamba R., Kamezak R.,Goto S., Nishioka J., Yasuda I., Hirawake T., Oide J., Obata H., Ogawa H. (2021)Widespread distribution of allochthonous fluorescent dissolved organic matter in the intermediate water of the North Pacific Progress in Oceanography. 191.
Дополнительные материалы отсутствуют.


