Геохимия, 2023, T. 68, № 2, стр. 197-216
Органические соединения и металлы в осадках отделяющихся водоемов Кандалакшского залива Белого моря
Д. Ф. Будько a, *, И. А. Немировская a, **
a Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Нахимовский просп., 36, Россия
* E-mail: dmitry.b-1990@yandex.ru
** E-mail: nemir44@mail.ru
Поступила в редакцию 26.04.2022
После доработки 19.08.2022
Принята к публикации 19.08.2022
- EDN: CKVJRW
- DOI: 10.31857/S0016752523020024
Аннотация
Изучение донных осадков отделяющихся водоемов Кандалакшского залива Белого моря показало, что, несмотря на субарктическое положение, в них образуется большое количество органических соединений, автохтонной и аллохтонной природы. Средние концентрации Сорг, Nобщ, Sобщ, алифатических углеводородов и полициклических ароматических углеводородов в донных осадках соответственно составили 5.33, 0.78, 0.53%, 817 мкг/г и 261 нг/г, что значительно выше по сравнению с открытыми районами Белого моря. Эвтрофирование этих водоемов зависит от их связи с морем. Установлено обогащение восстановленных пелитовых осадков отделяющихся водоемов Cu, Cd, Mo, Hg и U по сравнению с осадками открытых морских бухт Кандалакшского залива. При этом содержание Hg и Mo в 2 и 14 раза превышает нормативное значение (0.3 и 3 мкг/г, соответственно). Положительная корреляция с общей серой (r > 0.8) указывает на преимущественное нахождение данных металлов в форме слаборастворимых сульфидов.
Отделяющиеся водоемы (меромиктические) – важная составляющая беломорской гидрологической системы (Краснова, 2021а). Для приливного Кандалакшского залива с сильно изрезанной береговой линией и котловинами характерно образование таких водоемов. Это бывшие участки морской акватории, отделившиеся от открытой части моря при изостатическом поднятии берега. На стадии отделения, когда морская вода уже не может проникнуть в водоем, на поверхности начинает накапливаться пресная вода. При этом в отделяющихся водоемах развивается меромиксия, т.е. расслоение вертикальной структуры водной массы по физико-химическим параметрам. В результате в водоеме образуется двух или трехслойная структура, состоящая из верхнего опресненного слоя толщиной, как правило, несколько метров и подстилающего более плотного соленого слоя (Краснова, 2013; Саввичев и др., 2019). Недостаточное количество кислорода, лимитирующее окисление органического вещества (ОВ), приводит к образованию придонного аноксигенного слоя, обогащенного сероводородом (Лисицын и др., 2013; Краснова, 2021а). Поэтому беломорские водоемы могут служить моделью для изучения геохимических циклов, протекающих как в пресноводных, так и соленых аэробных и анаэробных условиях.
Постепенная изолированность водоемов и замедление водообмена с морем выражаются в эвтрофикации, изменении температуры, солености, pH и окислительно-восстановительного потенциала (Eh) среды (Краснова и др., 2013; Краснова и др., 2021а; Немировская, 2017). Трансформация данных параметров может привести к перераспределению форм нахождения химических элементов, и их миграции между водной средой и твердой фракцией осадочного материала. При этом микроэлементы, как правило, не образуют собственных минеральных фаз, а находятся в ассоциации с различными подвижными и инертными компонентами матрицы осадка (карбонаты, Fe и Mn оксигидроксиды, ОВ, сульфиды, глинистые и обломочные минералы). Поэтому содержание химических элементов является показательным инструментом в получении информации об изменениях окружающей среды в водных объектах.
Ежегодно на отделяющихся водоемах Белого моря проводятся комплексные исследования, затрагивающие преимущественно биологическую среду, а также гидрологическую и гидрохимическую структуры водной толщи (Шапоренко и др., 2005; Краснова и др., 2013; Краснова и др., 2021а).
С целью изучения особенностей концентрирования органических соединений (Сорг, углеводородов, в том числе алифатических – АУВ и полициклических ароматических углеводородов – ПАУ) и металлов в сопоставлении с Nобщ и Sобщ в донных осадках, летом 2020 г. был проведен отбор проб в отделяющихся водоемах Кандалакшского залива Белого моря. Все эти водоемы могут быть отнесены к меромиктическим, в которых слоистая структура вод возникает из-за перекрытия остаточной морской воды слоем с меньшей соленостью, разбавленным или совсем пресным стоком с водосбора (Краснова, 2021а). В задачи исследования входят: получение качественных и количественных оценок распределения органических соединений в осадках отделяющихся водоемов Белого моря; определение основных механизмов аккумуляции широкого спектра металлов и нескольких металлоидов в исследуемых осадках; оценка загрязненности углеводородами и тяжелыми металлами этих водоемов.
МЕТОДИКА ИССЛЕДОВАНИЙ
Отбор проб
Пробы поверхностного слоя (0–5 см) донного осадка отбирали с помощью дночерпателя Экмана–Берджа в исследуемых водоемах в сентябре 2020 г., от уреза воды до глубоководной части, затрагивая различные участки меромектической структуры водоемов. Также в качестве мест отбора проб рассматривались области с повышенной соленостью в районе перемычки, отделяющей водоем от открытой части моря, и опресненные участки в районе впадения пресноводных ручьев. Единичные пробы были отобраны на открытых участках губы Круглой и бухты Биофильтров (табл. 1).
Таблица 1.
Литолого-геохимические характеристики осадков отделяющихся водоемов Белого моря
|
Стан-ция |
Координаты |
Описание осадка |
Глубина, м |
Песок, % |
Алеврит, % |
Пелит, % |
Сорг, % |
Собщ, % |
N, % |
S, % |
АУВ, мкг/г |
% АУВ от Сорг |
Влаж-ность, % |
ПАУ, нг/г |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Оз. Кисло-Сладкое | ||||||||||||||
| KC-1 | N66.54903333 E33.13398333 |
Пелитовый ил зелено-коричневого цвета |
0.4 | 4.6 | 8.0 | 87.4 | 7.4 | 11.5 | 1.23 | 0.57 | 1611 | 1.86 | 86.04 | 288 |
| KC-2 | N66.54823333 E33.13720000 |
Алевро-пелитовый ил с примесью крупного песка темно-зелено-коричневого цвета |
0.3 | 10.1 | 2.4 | 85.3 | 3.2 | 8.4 | 0.95 | 0.58 | 1085 | 2.89 | 56.40 | 141 |
| KC-3 | N66.54775000 E33.13548333 |
Песок заиленный серо-сизого цвета |
0.2 | 59.2 | 27.3 | 13.3 | 0.7 | 1.4 | 0.15 | 0.12 | 167 | 2.05 | 37.90 | 29 |
| KC-4 | N66.54850000 E33.13461667 |
Алевро-пелитовый ил с примесью крупного песка темно-зелено-коричневого цвета |
2 | 11.0 | 22.3 | 64.4 | 3.6 | 4.8 | 0.53 | 0.31 | 418 | 1.00 | 65.87 | 166 |
| KC-5 | N66.54850000 E33.13486667 |
Алевро-пелитовый ил зелено-бежевого цвета |
2.5 |
н.д.* |
н.д. |
н.д. |
3.3 | 4.9 | 0.55 | 0.30 | 549 | 1.42 |
н.д. |
0 |
| KC-6 | N66.54840000 E33.13530000 |
Пелитовый ил черного цвета с тонкой прослойкой темно-бурого цвета, запах H2S |
3.7 |
н.д. |
н.д. |
н.д. |
9.8 | 17.9 | 2.23 | 1.17 | 1245 | 1.09 |
н.д. |
0 |
| Лагуна Зеленого мыса | ||||||||||||||
| ЗМ-1 | N66.53161667 E33.09598333 |
Песок плохо сортированный, заиленный, темно-серого цвета, верхний тонкий слой бежево-зеленого цвета |
0.3 | 31.8 | 6.6 | 60.2 | 1.0 | 2.0 | 0.27 | 0 | 131 | 1.16 | 34.68 | 0 |
| ЗМ-2 | N66.52971667 E33.09370000 |
Песок плохо сортированный, заиленный, серого цвета |
0.2 | 27.5 | 10.1 | 61.6 | 0.7 | 1.6 | 0.17 | 0 | 109 | 1.38 | 42.50 | 62 |
| ЗМ-3 | N66.52968333 E33.09591667 |
Песок плохо сортированный, заиленный |
0.3 | 38 | 31.9 | 29.4 | 1.4 | 2.6 | 0.32 | 0.13 | 151 | 0.94 | 68.95 | 0 |
| ЗМ-4 | N66.53060000 E33.95166667 |
Алевро-пелитовый ил с мелким песком бежево-зеленого цвета светлого оттенка |
3.0 | 27.2 | 15.0 | 56.9 | 3.8 | 5.8 | 0.67 | 0.38 | 199 | 0.45 | 62.60 | 0 |
| ЗМ-5 | N66.53022000 E33.09466667 |
Пелитовый ил черного цвета, запах H2S |
6.2 | 2.9 | 3.9 | 93.2 | 8.6 | 12.6 | 1.47 | 1.06 | 3519 | 3.52 | 91.15 | 0 |
| Бухта Биофильтров | ||||||||||||||
| ББ | N66.54066667 E33.16496667 |
Песок | 0.3 | 61.0 | 7.8 | 17.5 | 0.02 | 0.3 | 0.04 | 0 | 34 | 14.41 | 10.08 | 116 |
|
Оз. Большие Хрусломены |
||||||||||||||
| БХ-1 | N66.71798333 E32.85085000 |
Алевро-пелитовый ил с примесью мелкого песка бежево-зеленого цвета с включением черных пятен и запахом H2S |
0.9 | 9.1 | 11.1 | 79.8 | 6.1 | 8.9 | 0.83 | 0.53 | 531 | 0.75 | 64.32 | 439 |
| БХ-2 | N66.71771667 E32.85240000 |
Пелитовый ил болотного цвета, с включением черных пятен и запахом H2S |
3.2 | 2.4 | 0.9 | 96.6 | 23.3 | 22.7 | 2.25 | 1.48 | 1500 | 0.55 | 86.28 | 1617 |
| БХ-3 | N66.71683333 E32.85701667 |
Пелитовый ил с темно-болотными вкраплениями, студневидный, с сильным запахом H2S |
12.5 | 0.7 | 1.0 | 98.3 | 14.6 | 18.4 | 1.72 | 1.91 | 747 | 0.44 | 93.80 | 135 |
|
Бухта Лобаниха |
||||||||||||||
| БЛ-1 | N66.55615000 E33.23388333 |
Крупный и средний песок зелено-бежевого цвета с ракушняком заиленный, с запахом H2S |
0.1 | 57.5 | 25.1 | 16.5 | 0.2 | 0.4 | 0.05 | 0 | 81 | 4.12 | 21.40 | 239 |
| БЛ-3 | N66.55477000 E33.24561667 |
Алевро-пелитовый ил с примесью песка, светло-бежевого цвета |
2.5 | 24.3 | 33.3 | 42.4 | 1.8 | 2.5 | 0.29 | 0.09 | 125 | 0.59 | 48.80 | 408 |
| БЛ-4 | N66.55663333 E33.23578333 |
Алевро-пелитовый ил с примесью мелкого песка, бежево-бурого цвета, с включением черных линз и запахом H2S |
9.5 | 9.0 | 13.8 | 77.2 | 4.6 | 6.7 | 0.76 | 0.37 | 347 | 0.65 | 65.70 | 599 |
| Озеро Трехцветное | ||||||||||||||
| Т-1 | N66.59325000 E32.97688333 |
Пелитовый ил светло-бежевого цвета с включениями темно-зеленых и черных прослоев с нитями макрофитов, |
1.3 | 1.3 | 5.8 | 92.9 | 8.5 | 11.0 | 1.25 | 0.55 | 2392 | 2.41 | 85.98 | 6807 |
| Т-2 | N66.59275000 E32.97800000 |
Пелитовый ил обводненный черного цвета с пятнами светло-черного цвета, с сильным запахом H2S |
3.5 | 0.00 | 1.4 | 98.6 | 8.7 | 9.6 | 0.98 | 1.11 | 1798 | 1.77 | 83.18 | 0 |
| Т-2 | N66.59275000 E32.97800000 |
Пелитовый ил обводненный черного цвета с пятнами черного цвета, с сильным запахом H2S |
3.5 | 0.00 | 1.4 | 98.6 | 8.7 | 9.6 | 0.98 | 1.11 | 1798 | 1.77 | 83.18 | 0 |
| Т-3 | N66.59242000 E32.97807000 |
Пелитовый ил обводненный черного цвета с пятнами черного цвета, сильный запах H2S |
6.0 | 0.00 | 1.1 | 98.9 | 10.6 | 13.8 | 1.52 | 1.65 | 2182 | 1.78 | 83.08 | 0 |
| Губа Круглая | ||||||||||||||
| KГ-1 | N66.53661666 E33.09300000 |
Мелкозернистый песок с примесью алевро-пелитовой фракции, с черные вкрапления органического детрита и ракуши |
0.2 | 69.4 | 19.3 | 10.7 | 0.2 | 0.3 | 0.044 | 0 | 64 | 2.21 | 20.97 | 270 |
На месте отбора проб выполнялось измерение окислительно-восстановительного потенциала (Eh) донных отложений с помощью портативного иономера Анион 7050 (РФ). Далее образцы замораживали (–18°C) для дальнейшей транспортировки в лабораторию. Всего было отобрано 23 пробы осадков.
Район исследования
Каждый из исследуемых водоемов имел различную степень изоляции от Кандалакшского залива Белого моря.
Озеро Трехцветное – типичный меромиктический водоем с глубиной около 6 м, полностью отделившийся от моря. Его трехслойная структура водной толщи включает верхний слой пресной воды, промежуточный аэробный слой соленой воды и придонный анаэробный слой, с содержанием сероводорода 600–900 мг/л, что превышает его концентрации во многих известных водоемах с анаэробными условиями (Лосюк и др., 2021).
Озеро Кисло-Сладкое – небольшой по площади водоем с максимальной глубиной около 4 м, отделенный от Белого моря широкой каменистой насыпью. В отличие от оз. Трехцветного, в оз. Кисло-Сладкое поступает морская вода во время сизигийных приливов и сильных ветровых нагонов, тогда как пресноводный сток в озеро мал. В результате в озере формируются поверхностные воды с пониженной соленостью (10-15 PSU), а на глубинах ниже 2 м залегают воды с соленостью, превышающей морскую (24 PSU) (Краснова, 2008).
Большие Хрусломены – самый крупный из известных отделяющихся озер Кандалакшского залива с максимальной глубиной около 18 м, который соединяется с открытой частью Белого моря только через каменистую насыпь. Озеро расположено на острове Оленьем в Ковдском заливе, и характеризуется четко выраженной стратификацией, наличием хемо- и галоклина на глубине 2–4 м (Саввичев и др., 2019). Важная особенность озера – постоянное поступление морских вод через проницаемые породы, обогащенные сульфатами (Краснова, 2021а). Поэтому ниже хемоклина происходит значительное нарастание солености (до 24 PSU в придонных горизонтах).
Лагуна Зеленого мыса находится на более ранней стадии отделения, и относится к постоянно связанным с морем водоемам (Краснова, 2021а). Приливные уровни колебания воды в лагуне оцениваются примерно в 10 см. Аноксигенные условия развиваются только в придонных горизонтах самой глубокой части лагуны (5–6 м). Максимальное содержание сероводорода, зафиксированное в лагуне Зеленого мыса, также как в оз. Кисло-Cладком, составляет 120 мг/л (Лосюк и др., 2021).
Ковшовая губа Лобаниха, расположенная на о. Великом, с максимальной глубиной 13.5 м, соединяется с морем узким мелководным проливом. Аноксийная зона появилась в этом водоеме только летом 2020 г. (Краснова, 2021б).
Методы исследования
Общий и органический углерод (Cобщ, Сорг), а также Nобщ и Sобщ, в донных осадках определяли на CHNS-О анализаторе EuroEA300 производства EuroVektor SPA (Италия).
УВ из осадков экстрагировали метиленхлоридом на ультразвуковой бане “Сапфир” (РФ). Все растворители имели квалификацию о.с.ч. Отдельные фракции УВ (АУВ и ПАУ) разделяли гексаном с помощью колоночной хроматографии на силикагеле. Концентрации АУВ определяли методом ИК-спектроскопии на приборе IR Affinity 1 (Shimadzu, Япония). В качестве стандарта использовали смесь изооктана, гексадекана и бензола в соотношении 37.5, 37.5 и 25 об. %, соответственно (Качество…, 2020; Немировская, 2013), чувствительность метода – 3 мкг/мл экстракта (Немировская, 2013). Для расчета доли АУВ в общем содержании Сорг использовали коэффициент 0.86 (Методы…, 1980).
Анализ алканов проводили на хроматографе Кристалл-Люкс 4000-М (РФ), оснащенным пламенно-ионизационным детектором, с капиллярной колонкой 30 м × 0.22 мм фирмы “Supelco” (Merck, Германия), с фазой: 5% фенила и 95% поликсилана, при программировании температуры от 60 до 300°С со скоростью 8°/мин, газ-носитель – гелий (скорость прохождения газа 1.5 л/мин). Для калибровки прибора и определения времени выхода идентифицируемых алканов, использовали смесь калибровочных стандартов н-С10–C40 фирмы “Supelco”, а в качестве внутреннего стандарта – сквалан, фирмы “Sigma Aldrich” (США).
Суммарную концентрацию ПАУ определяли флуоресцентным методом на приборе (“Trilogy”, США), относительно стандарта нефтепродукта в гексане (ГСО 7950) (Справочники…, 1984), а их состав – на жидкостном хроматографе “Lab Alliance” (“Shimadzu”, Япония) методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с флуоресцентным детектором RF 20A, и колонкой Envirosep PP при температуре термостата 40°C в е в условиях градиента по объему ацетонитрила в воде от 50 до 90%; скорость элюирования – 1 см3/мин. В качестве стандарта использовали индивидуальные ПАУ и их смеси производства “Supelco” (Merck, Германия). Расчеты выполнены с помощью программы LC Solution. В результате были определены индивидуальные полиарены, рекомендованные Агентством по охране окружающей среды – EPA, USA (Monitoring, 2011): нафталин (НАФ), 1-метилнафталин (1‑МеНАФ), 2-метилнафталин (2-МеНАФ), аценафтен (АЦНФ), флуорен (ФЛР), фенантрен (ФЕН), антрацен (АНТР), флуорантен (ФЛТ), пирен (ПР), бенз(а)антрацен (БаА), хризен (ХР), бенз(е)пирен (БеП), бенз(a)пирен (БаП), бенз(k)флуоратен (БkФ), бенз(b)флуоратен (БkФ), дибенз(а,h)антрацен (ДБаА), бенз(g,h,i)перилен (БПЛ), индено(1,2,3-c,d)пирен (ИНП), перилен (ПРЛ).
Для определения валового содержания металлов и некоторых металлоидов разложение проб проводили в смеси концентрированных кислот 1.5 мл HF : HNO3 в соотношении 5 : 1 с добавлением 0.5 мл HCl, в виалах из PFA (Savillex, США) по методике (Николаева и др., 2019) в микроволновой системе MWS Speed Wave (Berghof Products, Германия) в следующем режиме: 5 мин при интенсивности излучения 800 W и температуре 170°С и 40 мин при интенсивности излучения 200 W и температуре 170°С. Для этого использовали специализированную для аналитических работ азотную кислоту ультрачистого качества (Premium-Grade, ISO, Merck), тогда как фторводородная и соляная кислоты (х.ч.) проходили предварительную двойную дистилляцию через систему очистки кислот Berghof BSB-939-IR (Berghof Products, Германия). После окончания разложения, виалы помещались на нагревательную поверхность и выпаривались при температуре 70°С трижды с добавлением 1 мл HCl для растворения фторидов, образующихся при разложении проб HF. Если в осадке содержалось большое количество ОВ, его разлагали добавлением 0.5 мл HClO4 (Suprapure, Merck) на второй и, по необходимости, на третьей стадиях выпаривания. Остаток растворяли добавлением 1 мл HCl и доводили до конечного объема 3% HNO3.
Содержание Li, Be, Al, Sc, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ga, As, Rb, Sr, Y, Zr, Nb, Mo, Ag, Cd, Sb, Cs, Ba, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Hf, Tl, Pb, Bi, Th и U определяли методом масс-спектрометрии с индуктивно-связанной плазмой на спектрометре Agilent 7500а (Agilent Technologies, США) с использованием внутреннего стандарта In, а Fe – методом атомно-абсорбционной спектрометрии на спектрометре “КВАНТ-2А” (Кортек, РФ) в лаборатории физико-геологических исследований им. А.П. Лисицына ИО РАН. Ртуть определяли на анализаторе РА-915+ с пиролитической приставкой ПИРО-915+ (Люмэкс, РФ) методом атомно-абсорбционной спектрометрии в аналитической лаборатории Института биологии внутренних вод РАН. Анализ ртути выполняли в трёхкратной повторности.
Точность результатов анализа контролировалась использованием стандартного образца Национального института стандартов и технологий (США) NIST 2702 (неорганические соединения в морских отложениях). Элементы с ошибкой измерения стандартного образца более чем на 50% от паспортного значения (Sc, Cs, Hf, Tl) исключались из дальнейшей обработки данных. Воспроизводимость метода ИСП-МС оценивалась на основе трех повторных измерений одного образца. Хорошая воспроизводимость в пределах 10% была получена для большинства элементов, за исключением Ag, Cd, Cs, Ho, Er, Yb, Lu, W и Bi, воспроизводимость которых изменялась в пределах 10–25%.
Статистическая обработка результатов
Статистическую обработку данных осуществляли с использованием компьютерного программного обеспечения Statistica 10.0. Предварительно данные проверяли на соответствие нормальному распределению с помощью тестов Колмогорова–Смирнова (K–S test) с поправкой Лиллиефорса (Lilliefors test) и Шапиро–Уилка (W test).
Для определения зависимости между распределением химических элементов, органических соединений, гранулометрическим составом осадка и глубиной станций отбора проб применяли корреляционный анализ Пирсона.
Для группировки данных по содержанию 41 металла, As и Sb в отдельные геохимические ассоциации проводили иерархический кластерный анализ по методу Варда. Тем же методом выполнялась кластеризация исследуемых станций по схожести химического состава донных отложений. На основе выделенных кластеров проводили однофакторный дисперсионный анализ (one-way ANOVA) для оценки различия в содержании элементов в осадках между установленными группами станций. Оценка связей между исследуемыми геохимическими параметрами с выявление основных векторов их изменчивости (факторов) осуществлялась с помощью факторного анализа. Типом факторного анализа был выбран метод главных компонент c чередованием факторов “варимакс”.
РЕЗУЛЬТАТЫ
Органические соединения
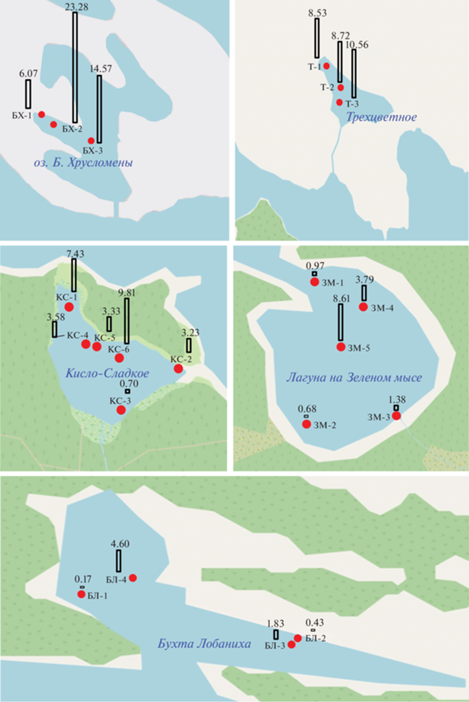
Основное литологическое описание осадков приведено в табл. 1. Мелководные морские осадки из губы Круглой и бухты Биофильтров были представлены мелким песком пятнистой структуры бежево-зеленых и серых оттенков. На мелководных станциях отделяющихся водоемов (лагуна Зеленого мыса и оз. Кисло-Сладкое) чаще всего встречался мелкий заиленный песок зелено-коричневых оттенков. В глубоководных частях данных водоемов, а также в озерах Трехцветном и Больших Хрусломенах, наблюдались илистые осадки (доля пелитовой фракции более 93%) черного цвета с запахом сероводорода. В большинстве осадков величина Eh колебалось в интервале отрицательных значений от –12 до –406 мВ, кроме станций на урезе воды в бухте Лобаниха (БЛ-1) и в губе Круглой (КГ-1), где значения Eh достигали +36 и +96 мВ соответственно. В глубоководной части озер Трехцветное (ст. Т-2, Т-3), Кисло-Сладкое (ст. КС-6), Большие Хрусломены (ст. БХ-3), лагуны Зеленого мыса (ст. ЗМ-5) и бухты Лобаниха (ст. БЛ-4) были обнаружены аноксигенные условия (Eh < 0) также в придонных слоях толщи воды.
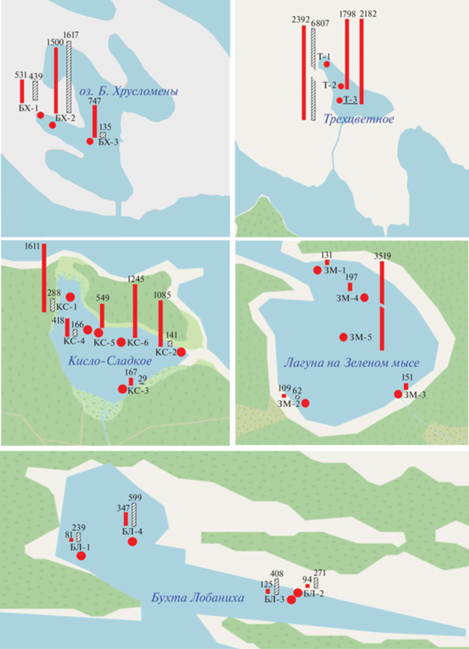
Содержание Сорг изменялось в интервале 0.02–23.28%, в среднем составляя 5.33%. В отдельных прибрежных песчанистых осадках концентрации Сорг понижалось до 0.17–0.70% (рис. 1). Интервал величин был столь велик, что стандартное отклонение (σ = 5.52%) превысило среднюю величину. Минимальная концентрация установлена в песчанистом осадке бухты Биофильтров (ст. ББ), а максимальная – в пелитовом иле оз. Большие Хрусломены (ст. БХ-2 – 23.28%), а повышенные – на ст. БХ-3 (14.57%), а также в осадках Трехцветного оз. (8.52–10.56%), и в оз. Кисло-Сладкое на ст. КС-6 (9.81%). При этом среднее содержание Сорг для заиленных осадков составило 7.37%, значение σ было также высоким – 5.19%.
Содержание Nобщ изменялось от 0.044% в песчанистых осадках губы Круглой до 10.35% в пелитовом иле с запахом сероводорода на ст. БХ-2 в оз. Большие Хрусломены, где было установлено также максимальное содержание Сорг. Распределение концентраций Сорг и Nобщ совпадало (r = 0.92). Отношение C/N является определяющим критерием для идентификации источника ОВ. Для изученных осадков отношение Cобщ/Nобщ изменялось от 0.57 для песчанистого осадка в бухте Биофильтров до 10.35 в алевро-пелитовом иле с запахом сероводорода в осадке БХ-1 оз. Большие Хрусломены. Однако в большинстве осадков это отношение изменялось в диапазоне 4–6, что характерно для морских осадков (Jafarbadi et al., 2018).
Между распределением концентраций Сорг и Sобщ также установлена связь: r = 0.89. Отношение Cорг/Sобщ (были исключены осадки, в которых не было обнаружено Sобщ) изменялось в интервале 5.62–20.3. Последнее отражает формирование осадков в бескислородных условиях придонной воды. В случае осаждения ОВ в морских условиях отношение Cорг/Sобщ обычно не превышает 2.8 (Resmiet al., 2016).
Содержание АУВ в донных осадках также было высоким, и изменялось в интервале 34–3519 мкг/г (рис. 2), в среднем 829 (σ = 373) мкг/г.
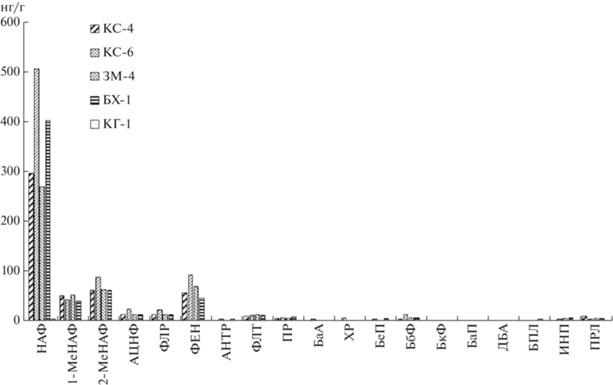
Рис. 2.
Содержание алифатических (мкг/г) (темные столбцы) и полициклических ароматических углеводородов (нг/г) (заштрихованные столбцы) в верхнем слое исследуемых донных осадков.
Между концентрациями Сорг и АУВ установлены высокие коэффициенты корреляции, которые для отдельных водоемов колебались в интервале от 0.80 (Кисло-Сладкое оз.) до 0.99 (бухта Лобаниха). Последнее может указывать на одинаковую природу органических соединений. На мелководье установлено повышенное содержание АУВ в составе Сорг, максимальное – 14.4% в бухте Биофильтров.
Во всех пробах в составе алканов доминировали высокомолекулярные гомологи, что характерно для морских осадков и, в частности, Белого моря (Немировская, 2009). Отношение низко- к высокомолекулярным соединениям (L/H) изменялось в интервале 0.31–0.73, с максимумом в осадке ст. Т-1 (табл. 2). При этом индекс нечетности CPI (отношение нечетных к четным гомологам в высокомолекулярной области) не превышал величины 2.01, что может указывать на низкую степень трансформации АУВ, так как в составе алканов в большей степени разлагаются низкомолекулярные и четные высокомолекулярные гомологи. Последнее подтверждают также пики при н-С16, характерные для АУВ, подвергавшиеся микробиальному разложению (Nishumura, Baker, 1986). Минимальная величина пика н-С16 установлена в осадках лагуны Зеленого мыса, а максимальная – в осадках станций Т-1 и Т-2, расположенных в кутовой части оз. Трехцветного (рис. 3). Значение отношения С17/С25, которое в среднем составило 0.14, может указывать на незначительное влияние планктоногенных алканов. Низкие значения коэффициента изопреноидности (Ki = ∑i-C19 + + i‑C20/∑C17 + C18), которые изменялись в интервале 0.30–0.79, также подтверждают слабую трансформацию алканов.
Таблица 2.
Распределение маркеров в составе алканов донных осадков. Жирным шрифтом выделен нефтяной генезис
| Станция | АУВ, мкг/г | Маркеры | |||||
|---|---|---|---|---|---|---|---|
| С17/С25 | L/H* | Paq | i-C19/i-C20 | CPI** | Ki*** | ||
|
КС-1 |
1611 | 0.14 | 0.41 | 0.46 | 1.44 | 2.87 | 0.70 |
|
КС-3 |
167 | 0.06 | 0.35 | 0.45 | 1.45 | 1.61 | 0.79 |
|
КС-4 |
418 | 0.10 | 0.34 | 0.46 | 0.88 | 1.49 | 0.30 |
|
КС-6 |
1245 | 0.03 | 0.35 | 0.55 | 0.43 | 1.24 | 0.56 |
|
ЗМ-3 |
151 | 0.12 | 0.31 | 0.39 | 0.82 | 2.57 | 0.46 |
|
ЗМ-4 |
197 | 0.03 | 0.38 | 0.54 | 0.94 | 1.21 | 0.56 |
|
ЗМ-5 |
3519 | 0.02 | 0.37 | 0.59 | 0.53 | 1.02 | 0.65 |
|
Т-1 |
2392 | 0.47 | 0.73 | 0.45 | 1.15 | 2.01 | 0.48 |
|
Т-2 |
1798 | 0.41 | 0.63 | 0.51 | 1.25 | 1.93 | 0.38 |
|
Т-3 |
2182 | 0.06 | 0.33 | 0.55 | 0.60 | 1.19 | 0.47 |
В отдельных осадках наблюдалось плавное распределение алканов в высокомолекулярной области, и значения CPI были близки к 1 (пробы: КС-6 – 1.24, ЗМ-4 – 1.21, ЗМ-5 – 1.02, Т-3 – 1.19), что характерно для нефтяных алканов (Немировская, 2013). При этом на ст. КС-6 и ЗМ-5 фитан доминировал над пристаном, что также может свидетельствовать в пользу нефтяного происхождения АУВ, а на станциях Т-1 и Т-2 наоборот пристан доминировал над фитаном, так как их отношение >1 (1.15, 1.25).
Концентрации ПАУ в донных осадках изменялись от значения предела обнаружения до 1617 нг/г, с максимумом в пелитовом иле на ст. Т-1, оз. Трехцветного. Между распределением АУВ и ПАУ наблюдалась значимая корреляция (r = 0.75, n = 14), тогда как связь между распределением Сорг и ПАУ слабее (r = 0.32). В составе ПАУ (метод ВЭЖХ) доминирует нафталин (рис. 4), что является довольно неожиданным, так как в процессе седиментации этот арен наиболее легко разлагается (Tolosa et al., 2004). Видимо нафталины образуются непосредственно в осадках, что подтверждают более низкое содержание метилированных гомологов и довольно низкая концентрация фенантрена – основного полиарена в природных объектах (Ровинский и др., 1988). Высокомолекулярные полиарены в осадках практически отсутствовали.
Микроэлементы
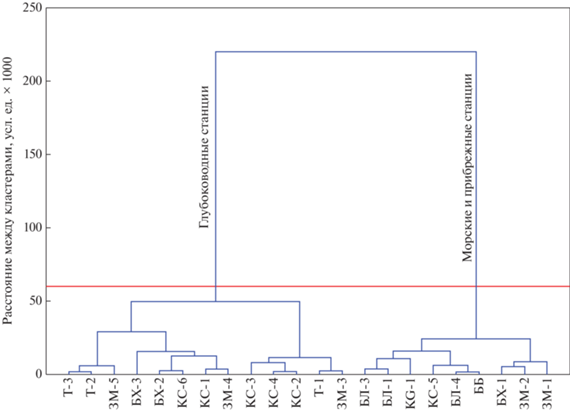
Содержание 41 металлов и 2 металлоидов (As и Sb) в осадках отделяющихся водоемов Белого моря представлено в табл. 3 . С помощью корреляционного и кластерного анализов выделено две основные геохимические ассоциации, объединенные схожими признаками распределения в осадках отделяющихся водоемов Белого моря (рис. 5; табл. 1S). К особенностям первого кластера относится положительная достоверная связь с глубиной станций и долей пелитового материала в осадке. Эта группа элементов подразделяется на три подгруппы. В одной из подгрупп (1.2) объединяются Cu, Hg, Mo, Cd, и U, которые обладают наиболее сильной корреляционной зависимостью (как правило r > 0.8, при р < 0.01) с Sобщ, Cорг, Nобщ и АУВ.
Таблица 3.
Содержание Al, Ti, Fe (%) и микроэлементов (мкг/г) в осадках отделяющихся водоемов Белого моря
|
Эле-мент |
Станция |
|||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
ЗМ-1 |
ЗМ-2 |
ЗМ-3 |
ЗМ-4 |
ЗМ-5 |
ББ |
КГ-1 |
БЛ-1 |
БЛ-3 |
БЛ-4 |
КС-1 |
КС-2 |
КС-3 |
КС-4 |
КС-5 |
КС-6 |
Т-1 |
Т-2 |
Т-3 |
БХ-1 |
БХ-2 |
БХ-3 |
|
|
Лагуна Зеленого мыса |
Бухта Лобаниха |
Оз. Кисло-Сладкое |
Оз. Трехцветное |
Оз. Б. Хрусломены |
||||||||||||||||||
| Li | 8.2 | 10.5 | 8.1 | 8.8 | 18.2 | 6.4 | 8.8 | 9.3 | 12.9 | 23.7 | 10.9 | 9.3 | 7.4 | 10.1 | 19.2 | 10.4 | 20.0 | 17.3 | 16.8 | 16.0 | 7.8 | 7.4 |
| Be | 0.95 | 1.14 | 0.66 | 0.75 | 0.62 | 0.93 | 1.03 | 0.71 | 1.16 | 1.56 | 0.60 | 0.66 | 0.85 | 0.81 | 0.84 | 0.42 | 0.71 | 0.58 | 1.11 | 0.94 | 0.54 | 0.22 |
| Al | 5.5 | 6.0 | 4.0 | 3.4 | 3.5 | 6.4 | 7.5 | 7.2 | 6.8 | 6.3 | 3.4 | 4.5 | 4.7 | 4.4 | 6.8 | 2.7 | 4.1 | 3.1 | 3.2 | 6.1 | 2.7 | 2.1 |
| Ti | 0.32 | 0.39 | 0.32 | 0.28 | 0.23 | 0.45 | 0.50 | 0.28 | 0.26 | 0.39 | 0.19 | 0.18 | 0.41 | 0.24 | 0.33 | 0.14 | 0.21 | 0.18 | 0.18 | 0.23 | 0.10 | 0.09 |
| V | 47 | 62 | 52 | 53 | 63 | 69 | 61 | 43 | 27 | 54 | 96 | 46 | 44 | 65 | 54 | 73 | 40 | 57 | 54 | 51 | 50 | 34 |
| Cr | 66 | 88 | 68 | 70 | 68 | 98 | 93 | 71 | 75 | 125 | 56 | 58 | 90 | 70 | 94 | 46 | 67 | 71 | 51 | 83 | 48 | 67 |
| Mn | 340 | 386 | 275 | 191 | 248 | 643 | 649 | 390 | 342 | 420 | 200 | 258 | 386 | 240 | 422 | 178 | 268 | 259 | 221 | 323 | 166 | 215 |
| Fe | 1.7 | 2.4 | 2.1 | 1.8 | 2.8 | 2.6 | 2.6 | 1.9 | 1.9 | 2.7 | 1.5 | 1.5 | 2.2 | 1.7 | 2.4 | 1.4 | 2.2 | 2.4 | 2.6 | 1.9 | 1.2 | 2.1 |
| Co | 9.3 | 10.9 | 8.7 | 8.1 | 8.2 | 11.8 | 11.2 | 8.2 | 8.7 | 13.6 | 8.3 | 7.9 | 10.1 | 8.2 | 11.7 | 6.1 | 11.0 | 11.1 | 12.8 | 9.4 | 5.9 | 5.7 |
| Ni | 31 | 37 | 32 | 33 | 37 | 37 | 31 | 27 | 31 | 55 | 40 | 32 | 32 | 33 | 45 | 31 | 50 | 38 | 39 | 44 | 46 | 34 |
| Cu | 14.2 | 6.3 | 5.2 | 16.0 | 27.3 | 5.3 | 1.2 | 7.7 | 9.0 | 31.3 | 27.6 | 19.5 | 5.1 | 22.1 | 28.5 | 27.0 | 25.6 | 28.4 | 30.0 | 18.2 | 27.9 | 24.5 |
| Zn | 97 | 101 | 41 | 45 | 112 | 93 | 120 | 126 | 108 | 126 | 79 | 79 | 81 | 80 | 140 | 90 | 100 | 95 | 94 | 105 | 89 | 90 |
| Ga | 13.2 | 16.0 | 13.0 | 11.3 | 9.7 | 14.5 | 16.8 | 14.8 | 14.2 | 17.8 | 8.7 | 10.3 | 13.1 | 10.6 | 15.1 | 6.6 | 10.1 | 8.6 | 7.9 | 13.3 | 6.3 | 5.5 |
| As | 2.4 | 3.5 | 4.1 | 8.1 | 4.8 | 0.7 | 1.8 | 2.0 | 5.7 | 20.3 | 5.0 | 4.5 | 1.1 | 4.2 | 5.7 | 9.0 | 4.1 | 4.1 | 3.4 | 3.2 | 4.8 | 4.6 |
| Rb | 19 | 18 | 23 | 16 | 39 | 19 | 27 | 26 | 5.7 | 34 | 34 | 22 | 14 | 17 | 25 | 49 | 22 | 38 | 35 | 34 | 3 | 16 |
| Sr | 324 | 297 | 208 | 153 | 181 | 248 | 380 | 292 | 279 | 212 | 145 | 178 | 180 | 155 | 268 | 158 | 115 | 123 | 119 | 225 | 139 | 152 |
| Y | 8.4 | 15.0 | 11.7 | 8.4 | 12.4 | 16.9 | 21.3 | 10.8 | 10.0 | 14.4 | 9.9 | 8.3 | 17.3 | 8.6 | 13.5 | 10.8 | 17.5 | 10.8 | 12.5 | 13.0 | 11.3 | 12.0 |
| Zr | 77 | 159 | 72 | 88 | 46 | 302 | 239 | 152 | 82 | 98 | 49 | 39 | 164 | 76 | 89 | 30 | 44 | 31 | 33 | 69 | 31 | 22 |
| Nb | 6.3 | 7.4 | 6.6 | 5.4 | 4.7 | 8.6 | 10.3 | 4.9 | 4.8 | 8.0 | 3.9 | 3.0 | 18.8 | 5.0 | 6.6 | 2.9 | 4.6 | 4.0 | 4.2 | 4.3 | 2.1 | 1.8 |
| Mo | 0.7 | 1.7 | 1.5 | 1.6 | 36.4 | 0.5 | 0.6 | 0.6 | 0.7 | 2.6 | 15.5 | 4.1 | 2.2 | 9.3 | 11.5 | 42.6 | 3.6 | 10.6 | 10.0 | 2.8 | 11.7 | 26.7 |
| Ag | 0.06 | 0.11 | 0.10 | 0.18 | 0.14 | 0.20 | 0.10 | 0.10 | 0.13 | 0.34 | 0.16 | 0.05 | 0.08 | 0.12 | 0.07 | 0.16 | 0.10 | 0.08 | 0.12 | 0.01 | 0.05 | 0.06 |
| Cd | 0.16 | 0.27 | 0.23 | 0.22 | 0.81 | 0.26 | 0.21 | 0.11 | 0.17 | 0.42 | 0.76 | 0.33 | 0.25 | 0.37 | 0.39 | 0.68 | 0.31 | 0.33 | 0.35 | 0.20 | 0.43 | 0.44 |
| Sb | 0.12 | 0.12 | 0.14 | 0.21 | 0.08 | 0.00 | 0.06 | 0.07 | 0.15 | 0.18 | 0.23 | 0.06 | 0.05 | 0.18 | 0.21 | 0.15 | 0.28 | 0.05 | 0.02 | 0.15 | 0.19 | 0.09 |
| Ba | 490 | 551 | 330 | 269 | 391 | 361 | 571 | 477 | 476 | 439 | 230 | 293 | 292 | 308 | 530 | 212 | 254 | 194 | 197 | 363 | 140 | 115 |
| La | 20 | 31 | 27 | 17 | 34 | 11 | 38 | 20 | 20 | 28 | 23 | 13 | 16 | 17 | 30 | 28 | 37 | 26 | 27 | 29 | 30 | 48 |
| Ce | 41 | 65 | 59 | 37 | 68 | 25 | 85 | 38 | 41 | 50 | 48 | 23 | 35 | 34 | 63 | 58 | 77 | 57 | 60 | 58 | 61 | 97 |
| Pr | 5.5 | 8.9 | 7.1 | 4.7 | 8.5 | 3.5 | 10.8 | 4.9 | 5.2 | 7.3 | 6.1 | 3.7 | 4.9 | 4.1 | 7.6 | 7.6 | 10.0 | 6.9 | 7.3 | 7.6 | 8.1 | 12.2 |
| Nd | 22 | 37 | 29 | 19 | 34 | 15 | 45 | 20 | 22 | 29 | 25 | 15 | 21 | 17 | 30 | 31 | 40 | 27 | 27 | 30 | 34 | 49 |
| Sm | 3.17 | 5.13 | 5.30 | 3.64 | 5.32 | 3.07 | 7.33 | 3.21 | 3.47 | 4.99 | 3.65 | 2.70 | 4.30 | 2.69 | 4.98 | 4.47 | 5.71 | 4.25 | 4.55 | 4.79 | 4.59 | 7.35 |
| Eu | 0.89 | 1.56 | 1.18 | 0.69 | 1.24 | 0.95 | 2.04 | 0.96 | 0.87 | 1.15 | 0.76 | 0.52 | 1.06 | 0.68 | 1.01 | 0.77 | 1.31 | 0.77 | 0.83 | 1.09 | 1.00 | 1.34 |
| Gd | 2.81 | 5.08 | 3.85 | 2.38 | 4.18 | 3.18 | 6.27 | 2.93 | 2.77 | 4.02 | 3.69 | 2.28 | 4.22 | 2.77 | 3.59 | 3.70 | 5.90 | 3.57 | 3.23 | 3.95 | 4.17 | 5.35 |
| Tb | 0.31 | 0.54 | 0.42 | 0.31 | 0.45 | 0.52 | 0.82 | 0.38 | 0.43 | 0.57 | 0.33 | 0.27 | 0.48 | 0.28 | 0.48 | 0.40 | 0.62 | 0.44 | 0.44 | 0.50 | 0.45 | 0.50 |
| Dy | 1.75 | 3.19 | 2.50 | 1.50 | 2.06 | 3.52 | 4.71 | 2.04 | 2.09 | 2.75 | 1.88 | 1.45 | 3.17 | 1.62 | 2.61 | 2.10 | 2.96 | 2.02 | 2.22 | 2.59 | 2.23 | 2.68 |
| Ho | 0.36 | 0.52 | 0.41 | 0.31 | 0.47 | 0.59 | 0.78 | 0.41 | 0.43 | 0.50 | 0.33 | 0.28 | 0.62 | 0.29 | 0.45 | 0.41 | 0.52 | 0.36 | 0.39 | 0.40 | 0.36 | 0.46 |
| Er | 1.02 | 1.46 | 1.14 | 1.12 | 1.20 | 1.80 | 2.61 | 1.28 | 1.09 | 1.64 | 1.15 | 0.99 | 2.00 | 1.04 | 1.61 | 1.03 | 2.07 | 1.19 | 1.08 | 1.52 | 1.17 | 1.16 |
| Tm | 0.10 | 0.20 | 0.14 | 0.14 | 0.15 | 0.28 | 0.36 | 0.14 | 0.15 | 0.21 | 0.15 | 0.10 | 0.26 | 0.15 | 0.18 | 0.12 | 0.24 | 0.14 | 0.17 | 0.20 | 0.12 | 0.14 |
| Yb | 0.65 | 1.15 | 1.19 | 0.77 | 0.97 | 1.90 | 2.25 | 1.17 | 0.93 | 1.57 | 0.73 | 0.78 | 2.03 | 0.83 | 1.18 | 0.67 | 1.51 | 0.97 | 0.97 | 1.34 | 1.00 | 0.92 |
| Lu | 0.11 | 0.18 | 0.12 | 0.10 | 0.09 | 0.28 | 0.33 | 0.16 | 0.11 | 0.19 | 0.11 | 0.10 | 0.21 | 0.09 | 0.14 | 0.08 | 0.18 | 0.11 | 0.11 | 0.17 | 0.10 | 0.08 |
| Hg | 0.02 | 0.03 | 0.05 | 0.07 | 0.59 | 0.02 | 0.02 | 0.01 | 0.03 | 0.12 | 0.12 | 0.08 | 0.02 | 0.07 | 0.11 | 0.18 | 0.23 | 0.39 | 0.44 | 0.13 | 0.13 | 0.14 |
| Pb | 9.1 | 10.3 | 7.8 | 6.7 | 7.4 | 6.0 | 10.0 | 8.0 | 9.3 | 13.3 | 11.4 | 6.9 | 7.8 | 6.6 | 9.5 | 9.0 | 10.3 | 10.2 | 13.2 | 10.5 | 15.6 | 18.6 |
| Bi | 0.02 | 0.07 | 0.09 | 0.06 | 0.07 | 0.09 | 0.12 | 0.02 | 0.07 | 0.16 | 0.10 | 0.05 | 0.12 | 0.07 | 0.07 | 0.07 | 0.04 | 0.10 | 0.09 | 0.03 | 0.12 | 0.17 |
| Th | 2.66 | 4.06 | 3.56 | 3.56 | 6.75 | 1.88 | 3.98 | 2.49 | 3.70 | 6.73 | 4.10 | 2.36 | 2.79 | 3.62 | 6.28 | 4.88 | 7.31 | 5.56 | 5.76 | 5.66 | 6.27 | 7.71 |
| U | 0.96 | 1.46 | 1.50 | 1.87 | 4.80 | 1.17 | 1.51 | 0.80 | 1.29 | 4.17 | 6.42 | 2.81 | 1.49 | 3.63 | 6.05 | 8.07 | 5.37 | 2.36 | 2.10 | 3.53 | 5.83 | 3.23 |
Рис. 5.
Группировка химических элементов и органических соединений (Cорг, Sобщ, Nобщ, АУВ и ПАУ) в донных осадках отделяющихся водоемов Белого моря.
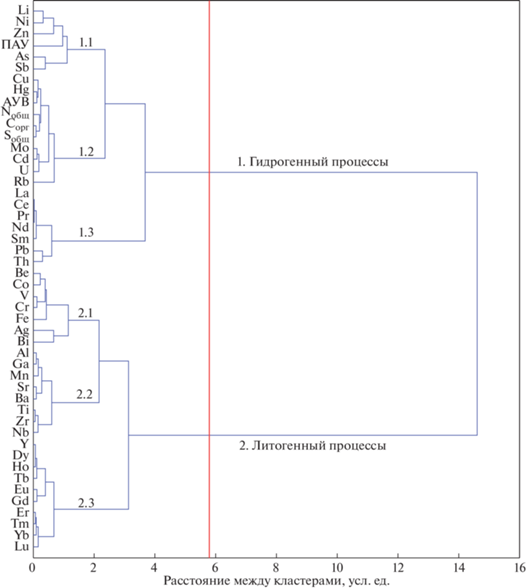
Другая подгруппа (1.1.) (Li, Ni, Zn, As, Sb, и ΣПАУ) характеризуется в основном умеренной корреляцией (0.3 < r < 0.7, при p < 0.01) с Sобщ, Cорг, Nобщ и гранулометрическим составом осадка. Исключение представляет Zn, который, несмотря на проявление корреляционной связи с элементами данного кластера, не показывает корреляционную связь с распределением биогенных компонентов и гранулометрическим составов осадка. Более того, для Zn существует зависимость с некоторыми элементами литофильного типа, например с Al (r = 0.6, при p < 0.01). Обособленную ветвь кластерного анализа занимает Rb, который показывает только умеренную корреляционную связь с перечисленными выше элементами (как правило, r = 0.3-0.5, при p < 0.01).
Третья подгруппа элементов (1.3) объединяет в себе La и некоторые легкие редкоземельные элементы (Ce, Pr, Nd, Sm), а также Pb и Th, которые характеризуются парной корреляционной связью друг с другом. Эти металлы также обладают умеренной и сильной корреляционной связью с глубиной станций, долей пелитового материала в осадке, содержанием биогенных компонентов (табл. 1S).
Во втором кластере объединяются преимущественно элементы с выраженными литофильными свойствами, которые также подразделяется на три подгруппы. Одна из подгрупп (2.2) объединяет Al, Ti, Mn, Ga, Sr, Zr, Nb Ba, т.е. представлена наиболее литофильными металлами, которые отличаются умеренной и сильной положительной корреляционной связью с содержанием алевритового и песчаного материала (табл. 1S).
Другая подгруппа (2.3) данного кластера включает Y и редкоземельные элементы Eu, Gd Tb, Dy, Ho, Er, Tm, Yb и Lu, для которых связь с гранулометрическым составом осадка прослеживается слабо (r < 0.5, при р < 0.01). Еще одна подгруппа (2.1) включает металлы, связанные с Fe (Be, Cr, V, Co и более обособленно Ag и Bi). При этом для Fe и Ag не наблюдаются зависимости от гранулометрического состава осадка (–0.3 < r < 0.3, при р < 0.01).
С помощью факторного анализа выделено шесть групп, объясняющих 88.5% общей изменчивости исследуемых параметров. Первый фактор (39.6% дисперсии данных) показывает влияние положительной факторной нагрузки на Cорг, Sобщ, долю пелитовой фракции, и микроэлементы Ni, Cu, Mo, Cd, Hg, Th и U (рис. 6). Также выделяется воздействие сильной отрицательной нагрузки данного фактора на Sr, долю песчаной фракции и умеренной нагрузки на Al, Ti, Mn, Ga, Zr, Nb и Ba. Антагонизм распределения факторной нагрузки между элементами, связанными с пелитовыми осадками, обогащенными серой и углеродом, и литофильными элементами и песчаной долей осадка показывает сильное влияние гранулометрического состава на изменчивость химических элементов в исследуемых осадках.
Рис. 6.
Распределение факторной нагрузки, воздействующей на исследуемые переменные для шести факторов. Прямой линией выделена значимая факторная нагрузка (больше 0.7).
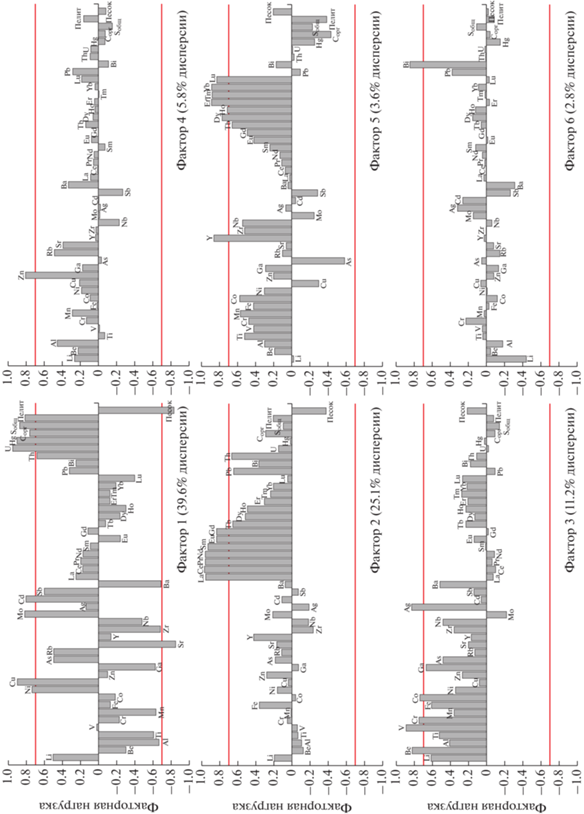
Значительная доля общей дисперсии данных (25.1%) связана с распределением легкой подгруппы РЗЭ, Pb и Th (фактор 2). Третий фактор (11.2%) оказывает сильное воздействие на содержание Be, V, Cr, Fe, Co, Ga и Ag, т.е. данный фактор влияет на вариативность литофильных элементов, в меньшей степени зависящих от гранулометрического состава осадка. Оставшиеся три компоненты (4, 5 и 6), описывающие общую дисперсию данных от 3 до 6%, связанны с распределением Zn, Y с РЗЭ тяжелой подгруппы и Bi, соответственно.
Для выделения особенностей пространственного распределения микроэлементов в исследуемых водоемах весь массив станций также был упрощен методом кластерного анализа (рис. 7). В итоге исследуемые станции образовали два основных кластера. Первый кластер объединяет все станции озер Трехцветное и Кисло-Сладкое (за исключение ст. КС-5), которые считаются полностью или практически полностью отделившимися от Белого моря, а также глубоководные станции оз. Большие Хрусломены (БХ-2, БХ-3) и лагуны Зеленого мыса (ЗМ-3, ЗМ-4, ЗМ-5).
Второй кластер включает станции морских бухт, за исключением ст. КС-5, взятой в соленой аэробной зоне на глубине 2.5 м в оз. Кисло-Сладком, и прибрежные неглубоководные станции отделяющихся водоемов ЗМ-1, ЗМ-2, БХ-1.
После разделения исследуемых станций на два кластера был проведен однофакторный дисперсионный анализ (one-way ANOVA), позволивший определить различия в содержании химических элементов между мористыми участками (станциями) и водоемами, отделившимися от Белого моря (табл. 4). В результате было установлено, что распределение Li, V, Fe, Ni, As, Rb, Y, Nb, Ag, Sb, La и всех РЗЭ, кроме Lu, а также Pb, Bi и Th в донных осадках не имеют достоверных различий между двумя категориями исследуемых водоемов. Осадки отделившихся озер (Трехцветное, Кисло-Сладкое), и других глубоководных участков водоемов (кластер 1) отличаются от осадков мористых районов (кластер 2) статистически значимой обогащенностью биогенными компонентами (Sобщ, Cорг, Nобщ) и рядом микроэлементов – Cu, Mo, Cd, Hg и U. Напротив, осадки морских бухт и прибрежных станций некоторых отделяющихся водоемов характеризуются обогащением Be, Al, Ti, Cr, Mn, Co, Zn, Ga, Sr, Zr, Ba и Lu.
Таблица 4.
Результаты однофакторного дисперсионного анализа (one-way ANOVA), показывающие различия в содержании химических элементов в осадках между глубоководными станциями отделяющихся водоемов и морскими/прибрежными станциями. Жирным шрифтом показаны достоверные различия
| Элемент | Отношение дисперсий (F) | Вероятность (p) | Элемент | Отношение дисперсий (F) | Вероятность (p) |
|---|---|---|---|---|---|
| Li | 0.14 | 0.709 | Ba | 46.2 | 0.000001 |
| Be | 14.1 | 0.0013 | La | 0.09 | 0.77 |
| Al | 87.7 | 0.00000001 | Ce | 0.13 | 0.72 |
| Sc | 18.7 | 0.0003 | Pr | 0.04 | 0.84 |
| Ti | 12.2 | 0.0023 | Nd | 0.02 | 0.88 |
| Cr | 14.9 | 0.0010 | Sm | 0.01 | 0.94 |
| Mn | 33.0 | 0.00001 | Eu | 2.83 | 0.11 |
| Fe | 2.0 | 0.178 | Gd | 0.01 | 0.91 |
| Co | 4.8 | 0.041 | Tb | 3.00 | 0.10 |
| Ni | 0.01 | 0.910 | Dy | 4.03 | 0.06 |
| Cu | 4.4 | 0.048 | Ho | 4.07 | 0.06 |
| Zn | 14.1 | 0.0012 | Er | 3.51 | 0.08 |
| Ga | 39.6 | 0.000004 | Tm | 2.99 | 0.10 |
| As | 0.84 | 0.370 | Yb | 3.26 | 0.09 |
| Rb | 0.86 | 0.366 | Lu | 11.10 | 0.00 |
| Sr | 56.3 | 0.0000003 | Tl | 2.07 | 0.17 |
| Y | 2.0 | 0.171 | Pb | 0.03 | 0.87 |
| Zr | 16.4 | 0.001 | Bi | 0.80 | 0.38 |
| Nb | 4.2 | 0.054 | Th | 1.06 | 0.32 |
| Mo | 14.3 | 0.001 | U | 4.66 | 0.04 |
| Ag | 0.30 | 0.593 | Hg | 9.93 | 0.01 |
| Cd | 8.8 | 0.008 | Stot | 21.13 | 0.0002 |
| Sb | 0.66 | 0.427 | Corg | 11.11 | 0.003 |
| Cs | 0.02 | 0.881 | Ntot | 12.42 | 0.002 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на низкие арктические температуры в отделяющихся озерах образуется большое количество органических соединений. При этом наблюдаются связи в их распределении с высокими коэффициентами корреляции. Эвтрофирование вод озер в значительной степени обусловлено естественными природными процессами и прежде всего их взаимодействием с морем. Полученные нами данные по содержанию Сорг и УВ оказались близкими к результатам 2015, когда в отделяющихся озерах губы Ругозерской (Верхнем Ершовском и Кисло-Сладском) концентрации Сорг в осадках изменялись от 4.95 до 8.70%, а АУВ – достигали 151 мкг/г (Немировская, 2017). Необходимо отметить, что в открытых районах Кандалакшского залива концентрации Сорг были гораздо ниже и в среднем составляли около 2% (Беляев, 2015), а в открытых районах Белого моря редко превышали 1.5% (Немировская, 2009).
Исследование донных осадков губы Ругозерской Кандалакшского залива ранее показало, что состав н-алканов также имел бимодальное распределение гомологов (Беляев, 2015). В низкомолекулярной области доминировали автохтонные в основном микробиальные алканы (н-С14–С18), вклад планктоногенных (н-С17) был значительно меньше. В высокомолекулярной области повышена концентрация нечетных аллохтонных гомологов – н-С25–С31, тогда как значения CPI колебались в интервале 9.6–11.9, и были значительно выше, чем в исследуемых нами озерах (максимальное значение СPI = 2.87, табл. 2). Все это может указывать на более высокую степень трансформации АУВ в осадках губы Ругозерской (Беляев, 2015) по сравнению с исследуемыми нами осадками отделяющихся озер.
Аномальный нефтяной состав высокомолекулярных алканов в отдельных пробах требует дополнительных исследований. Возможно, он обусловлен авариями на Беломорской нефтебазе, когда пострадала территория Кандалакшского государственного природного заповедника (о. Олений). Авария произошла из-за прорыва в море грунтовых вод, перемешанных с нефтепродуктами. Они скопились под землей за много лет эксплуатации первой сливной эстакады, не оборудованной сооружениями, защищающими почву от попадания топлива (http://www.bellona.ru). Пробуренные скважины так и не смогли обнаружить подземную линзу, из которой сочилась нефть. Возможный приток вод под дном этих озер (Краснова, 2021б) видимо может приводить к поступлению нефти в осадки.
Необходимо отметить, что и в суровых климатических условиях Антарктиды в прибрежных районах также происходит образование меромиктических озер с высокими концентрациями Сорг и УВ (Немировская, 2017). Проводимые нами многолетние исследования на меромектическом оз. Степпед, расположенном между китайской станцией Зонг-Шан и российской станцией Прогресс, показали, что экологическое состояние озера зависит от заплеска соленых вод из залива Прюдс. Осадки озера, также состоящие из детрита и остатков водорослей, имели черный цвет, пахли сероводородом и содержали большое количество органических соединений: Сорг – 18.2%, УВ – 265 мкг/г сухого веса, а ПАУ – всего 48 нг/г, так как полиарены в морской среде образуются в меньшей степени по сравнению с АУВ. В составе алканов осадков преобладали легкие гомологи источником формирования которых были продукты разложения отмерших водорослей, скапливающихся на дне.
Антропогенным источником металлов в данной части Кандалакшского залива может считаться атмосферный перенос из металлургических предприятий Кольского полуострова (Shevchenko et al., 2003). В частицах аэрозольного материала, собранного над территорией Кандалакшского залива, ранее наблюдалось обогащение Cu, Ni, Cd, Sb, W, Bi, Pb и U (Стародымова и др., 2016).
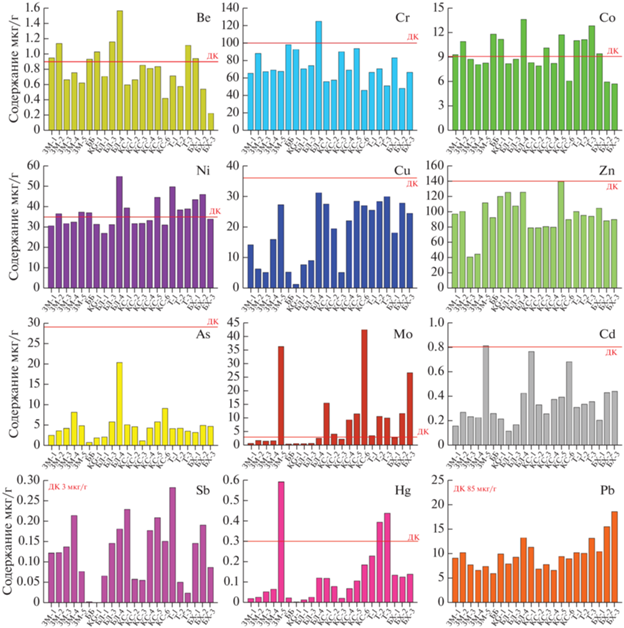
Для оценки уровней загрязненности донных осадков исследуемых водоемов тяжелыми металлами и As, их концентрации сравнили с нормативными допустимыми концентрациями (ДК), приведенными в “голландских листах” (Warmer, van Dokkum, 2001). Содержание Cu, Zn, As, Cd, Sb и Pb на всех станциях в исследуемых водоемах оказалось ниже значения ДК (рис. 8). На глубоководной станции бухты Лобаниха (БЛ-4) обнаружено превышение ДК по Be, Cr, Co и Ni в 1.7, 1.3, 1.5 и 1.6 раз соответственно. В целом для Be, Co и Ni в большинстве случаев содержание в осадках соответствует или немного превышает уровень ДК. На глубоководных станциях лагуны Зеленого мыса (ЗМ-5) и оз. Трехцветного (Т-2, Т-3) найдено высокое содержание Hg, превышающее до 2 раз уровень ДК. Тогда как содержание Mo в осадках, формирующихся в анаэробных частях водоемов (станции ЗМ-5, БЛ-4, КС-6, Т-2, Т-3, БХ-3) превышает уровень ДК в 3–14 раз.
Рис. 8.
Распределение Be, Cr, Co, Ni, Cu, Zn, As, Mo, Cd, Sb, Hg и Pb в поверхностном слое донных отложений отделяющихся водоемов Белого моря. Линией показан уровень допустимой концентраций для данных элементов согласно (Warmer, van Dokkum, 2001).
Повышение содержаний тяжелых металлов (в первую очередь, халькофильных) в донных отложениях при анаэробных условиях связано с образованием и осаждением нерастворимых сульфидов этих металлов. При этом сульфид-анион образуется в результате биохимической реакции восстановления сульфатной серы (анион ${\text{SO}}_{4}^{{2 - }}$) сульфат-редуцирующими бактериями, которые таким образом извлекают кислород для своей жизнедеятельности. Резкое уменьшение скорости деструкции (окисления) ОВ в восстановительных условиях приводит к накоплению Сорг в анаэробной зоне донных осадков (Папина, 2004).
Отдельного обсуждения заслуживает обнаружение аномально высоких уровней содержания Hg и Mo: до 0.52 мкг/г на глубоководной ст. 3М-5 лагуны Зеленого мыса и 42.6 мкг/г на ст. КС-6 оз. Кисло-Сладкого соответственно. На этих станциях также обнаружен аномальный состав алканов. Необходимо отметить, что донные отложения Белого моря характеризуются невысоким содержанием ртути: 0.006–0.095 мкг/г (Федоров и др., 2013). Даже для осадков устьевой части Северной Двины, где в качестве источника антропогенной ртути выступают предприятия Архангельска, в том числе целлюлозно-бумажный комбинат, содержание ртути немного ниже (0.02–0.4 мкг/г) (Федоров и др., 2011), чем в исследуемых водоемах. При этом максимальные значения также зафиксированы в пелитовых осадках, характеризующихся ростом ОВ и общего сероводорода. Содержание Mo в поверхностных осадках различных районов Белого моря изменялось в пределах от 0.18 до 7.78 мкг/г (Маслов и др., 2014).
В глубоководных осадках отделяющихся водоемов Белого моря нахождение Hg и Mo может быть связано с природным процессом выпадения этих металлов в сульфидной форме при реакции с H2S. Поэтому между распределением Sобщ, Hg и Mo наблюдались связи с высокими значениями коэффициентов корреляции: ${{r}_{{{{{\text{S}}}_{{{\text{общ - Hg}}}}}}}}$ = 0.84, ${{r}_{{{{{\text{S}}}_{{{\text{общ - Mo}}}}}}}}$ = 0.83, при p < 0.01). По данным (Morse, Luther, 1999) наибольшая степень реакционной способности к взаимодействию с пиритом в восстановленных осадках отмечается для Hg и Mo, которые возглавляют ряд среди микроэлементов: Hg > As = = Mo > Cu > Co > Ni ≥ Mn > Zn > Cr > Pb = Cd. Поэтому только для Hg и Mo выявлено большее обогащение (в сравнении с ДК) в исследуемых осадках.
Корреляционная зависимость с распределением биогенных компонентов, макроэлементов-индикаторов литогенного вещества (Al и Ti) и гранулометрических фракций осадка определяет механизмы аккумуляции металлов в исследуемых отложениях, которые связаны либо с гидрогенными, либо с литогенными процессами (рис. 5).
Песчанистые осадки водоемов, находящихся на начальной стадии отделения от Кандалакшского залива, обогащены преимущественно литофильными металлами Be, Al, Ti, Cr, Mn, Co, Zn, Ga, Sr, Zr, Ba и Lu. Тогда как заиленные осадки полностью или практически полностью отделившихся водоемов (оз. Трехцветное, Кисло-Сладкое) характеризуются обогащением Cu, Cd, Mo, Hg и U. Известно, что в аноксигенных условиях катионы Cu2+, Cd2+ и Hg2+ взаимодействуют с сероводородом (H2S) или пиритом (FeS), образуя слаборастворимые сульфиды (Morse, Luther, 1999; Папина, 2001). Повышенное содержание Cu и Cd в анаэробной части исследуемых водоемов, богатых ОВ, также может контролироваться их взаимодействием с гуминовыми веществами и фульвокислотами, или осаждением с планктонным детритом (Martin, Knauer, 1973; Piotrowicz et al., 1984; Shaw et al., 1990).
Окси-анионы молибдена $\left( {{\text{MoO}}_{4}^{{2 - }}} \right)$ в присутствии сероводорода сначала восстанавливаются до тиомолибдатов, которые затем сорбируются на сульфидах и органических частицах (Helz et al., 2011; Scott, Lyons, 2012). Аккумуляция урана в восстановленной среде связана со сменой степени окисления и переходом из растворенной формы U6+ в U4+, выпадающей в твердой фазе (Chase et al., 2001).
Для сравнения, в осадках открытых участков Белого моря изменчивость микроэлементов, в первую очередь, контролируется содержанием литогенного материала и аутигенным образованием Fe-Mn окси-гидроксидов, тогда как влияние ОВ снижено (Budko et al., 2021). В целом, поведение многих тяжелых металлов (Cu, Co, Mo, Ni, Cd) в окисленных осадках арктических морей определяется их сорбцией на окси-гидроксидах Mn (Marz et al., 2011; Розанов, 2015; Поляков и др., 2019). В восстановленных условиях отделяющихся водоемов, Mn находится в ассоциации с группой литофильных элементов, и не оказывает существенного влияния на поведение других металлов. В такой среде, основной пул Cu, Mo, Ni и Cd ассоциирован с ОВ и/или сульфидами, тогда как Co проявляет сильную корреляционную связь с распределением элементов литогенного типа (r > 0.8 со Sc, Ti и Cr). По данным кластерного анализа, к сульфидной ассоциации элементов в исследуемых осадках относятся также Li, Zn, As и Sb, для которых (за исключением Li) также хорошо известно формирование сульфидных минералов (Morse, Luther, 1999).
Свинец, а также Bi, и легкая подгруппа РЗЭ проявляют корреляционную связь только с Сорг, выделяясь в отдельный кластер. Максимальное содержание этих элементов обнаружено в осадках оз. Большие Хрусломены, где также максимально содержание Сорг (до 23.3%). Необходимо заметить, что помимо Co, в ассоциацию с литофильными металлами включается Fe. По-видимому, изменчивость Fe в осадках отделяющихся водоемов контролируется содержанием литогенного вещества, несмотря на то, что значительная масса Fe в восстановленных осадках должна быть представлена сульфидными формами (Canfield, 1989). Было установлено (Кукина и др., 2010), что в осадках отделяющихся водоемов Кандалакшского залива доля минеральной прочносвязанной формы Fe составляет 92–94% от его валового содержания.
В заключение необходимо подчеркнуть, что в анаэробной среде при увеличении содержания сульфидов наблюдается рост метилированной формы ртути предположительно под влиянием сульфаторедуцирующих бактерий, которая становится наиболее биодоступной и токсичной формой Hg для морских организмов (Sunderland et al., 2006). Также стоит учитывать возможные негативные последствия, связанные с резким заходом больших масс морских вод в частично изолированные от Кандалакшского залива озера (например, лагуна Зеленого мыса), и с их перемешиванием. В результате может произойти загрязнение водной среды водоема ртутью и другими тяжелыми металлами при их поступлении из донных отложений при окислении сульфидов.
ЗАКЛЮЧЕНИЕ
В отделяющихся озерах высокоширотных районов, несмотря на низкие температуры, происходит образование большого количества органических соединений, которые аккумулируются донными осадками. В зависимости от связи водоемов с морем их концентрации изменялись в широком диапазоне: Сорг – 0.02–23.28%, в среднем 5.33%, АУВ – 34–3519 мкг/г, в среднем 817 мкг/г, что превышает фоновые значения в осадках Белого моря для Сорг < 2%, а АУВ < 50 мкг/г. Деструкция органических соединений приводит к образованию сероводорода и эвтрофированию вод этих водоемов.
Существующие связи в распределении Cорг, Nобщ, Sобщ и АУВ с высокими коэффициентами корреляции (r = 0.80–0.99) могут указывать на одинаковую природу этих соединений. Отношение Cобщ/Nобщ, которое в большинстве проб изменялось в диапазоне 4–6, характерно для морских осадков. Напротив, отношение Cорг/Sобщ, которое изменялось в диапазоне 5.62–20.3, отражает формирование осадков в бескислородных условиях.
Молекулярный состав АУВ и ПАУ, отражающий доминирующие источники ОВ, указывает в основном на их природное происхождение. Большая устойчивость УВ, по сравнению с другими органическими соединениями приводит к повышенной их доли в составе ОВ, в частности в песчанистом осадке бухты Биофильтров доля АУВ в составе Сорг достигала 14.41%.
Комплекс многомерных статистических анализов показал, что гранулометрический состав – основной фактор определяющий распределение химических элементов в осадках отделяющихся водоемов Белого моря. В морских бухтах и прибрежных участках отделяющихся водоемов, где накапливаются песчаные заиленные осадки, происходит обогащение элементами, поведение которых определяется литогенным материалом (Be, Al, Sc, Ti, Cr, Mn, Co, Zn, Ga, Sr, Zr, Ba и Lu). В илистых осадках анаэробной части отделяющихся водоемов установлена аккумуляция Cu, Cd, Mo, Hg и U, которые обладают сильной корреляционной зависимостью с серой. Соответственно, аккумуляция данных металлов контролируется формированием слаборастворимых сульфидов при взаимодействии с сероводородом и пиритом. Обогащение осадков этими металлами показывает усиление эвтрофикации и, соответственно, развитие сульфатредукции в анаэробных условиях.
В противоположность УВ в большинстве осадков определен низкий уровень содержания исследуемых металлов и As по сравнению с допустимыми концентрациями. Только для ртути и молибдена обнаружены осадки с превышением уровня ДК в 2 и 14 раз, особенно, в анаэробной среде лагуны Зеленого мыса, озер Трехцветного и Кисло-сладкого, что связано с их активным участием в процессе пиритизации.
Авторы выражают искреннюю благодарность руководству и сотрудникам Беломорской биологической станции им. Н.А. Перцова и лично Е.Д. Красновой за предоставление возможности в проведении полевых работ и отбору проб в отделяющихся водоемах Белого моря. Авторы признательны всем коллегам, оказавшим поддержку в проведении аналитических работ: Т.Н. Алексеевой (гранулометрический состав), Е.А. Кудрявцевой (СNHS-анализ), Д.П. Стародымовой (ICP-MS), А.В. Храмцовой (в проведении анализов УВ и графической обработке данных).
Работа выполнена в соответствии с Госзаданием Министерства науки и высшего образования РФ (тема FMWE-2022-0003) при финансовой поддержке РНФ (проект № 19-17-00234-П).
Список литературы
Беляев Н.А. (2015) Органическое вещество и углеводородные маркеры Белого моря. Автореферат диссертации на соискание ученой степени кандидата геолого-минералогических наук / Институт океанологии им. П.П. Ширшова РАН. М., 24 с.
Качество морских вод по гидрохимическим показателям. Ежегодник 2019 г. (2020) Под ред. А.Н. Коршенко. М.: Наука, 281 с.
Краснова Е.Д. (2008) Озеро Кисло-Сладкое. В сб.: Путешествия по Киндо-мысу. Тула: Гриф и К, 144 с.
Краснова Е.Д., Пантюлин А.Н., Белевич Т.А., Воронов Д.А., Демиденко Н.А., Житина Н.С., Ильяш Л.В., Кокрятская Н.М., Лунина О.Н., Мардашова М.В., Прудковский А.А., Саввичев А.С., Филиппов А.С., Шевченко В.П. (2013) Комплексные исследования отделяющихся водоемов на разных стадиях изоляции от Белого моря в марте 2012 г. Океанология. 53(5), 714-717.
Краснова Е.Д. (2021а) Экология меромиктических озер России. 1. Прибрежные морские водоемы. Водные ресурсы. 48(3), 322-333.
Краснова Е.Д. (2021б) Беломорские отделяющиеся от моря водоемы: к вопросу о природе меромиксии. Геология океанов и морей: Материалы XXIV Международной Научной конференции (Школы) по морской геологии. Т. II. М.: ГЕОС, 234-238.
Кукина С.Е., Корнеева Г.А., Бек Т.А. (2010) Формы металлов в донных отложениях малых губ Кандалакшского залива Белого моря. Океанология. 50(6), 926-932.
Лосюк Г.Н., Кокрятская Н.М., Краснова Е.Д. (2021) Сероводородное заражение прибрежных озер на разных стадиях изоляции от Белого моря. Океанология. 61(3), 401-412.
Лисицын А.П., Васильчук Ю.К., Шевченко В.П., Буданцева Н.А., Краснова Е.Д., Пантюлин А.Н., Филиппов А.С., Чижова Ю.Н. (2013) Изотопно-кислородный состав воды и снежно-ледяного покрова отделяющихся водоемов на разных стадиях изоляции от Белого моря. ДАН. 449(4), 467-473.
Маслов А.В., Шевченко В.П., Подковыров В.Н., Ронкин Ю.Л., Лепихина О.П., Новигатский А.Н., Филиппов А.С., Шевченко Н.В. (2014) Особенности распределения элементов примесей и редкоземельных элементов в современных донных осадках нижнего течения р. Северной Двины и Белого моря. Литология и полезные ископаемые. 6, 463-492.
Методы исследования органического вещества в океане (1980) Под ред. Е.А. Романкевича. М.: Наука, 343 с.
Немировская И.А. (2009) Углеводороды в воде, взвесях, сестоне и донных осадках Белого моря в конце летнего периода. Водные ресурсы. 36(1). 68-79.
Немировская И.А. (2013) Нефть в океане (загрязнение и природные потоки). М.: Научный мир, 432 с.
Немировская И.А. (2017) Содержание и состав органических соединений в отделяющихся озерах в Антарктике и Арктике. Проблемы Арктики и Антарктики. (4,114). 76-85.
Николаева И.Ю., Фяйзуллина Р.В., Бычкова Я.В., Бычков А.Ю., Бычков Д.А. (2019) Методы геохимических исследований: учебное пособие. М.: Изд. Книга-Мемуар, 94 с.
Папина Т.С. (2001) Транспорт и особенности распределения тяжелых металлов в ряду: вода – взвешенное вещество – донные отложения речных экосистем. Аналитический обзор. Новосибирск: Изд. ГПНТБ СО РАН, 58 с.
Папина Т.С. (2004) Эколого-аналитическое исследование распределения тяжелых металлов в водных экосистемах бассейна р. Обь. Диссертация на соискание ученой степени доктора химических наук / Российский университет дружбы народов. М., 259 с.
Поляков Д.М., Марьяш А.А., Можеровский А.В. (2019) Накопление тяжелых металлов осадками Амурского залива (Японское море). Водные ресурсы. 46(2), 172-177.
Ровинский Ф.Я., Теплицкая Т.А., Алексеева Т.А. (1988) Фоновый мониторинг полициклических ароматических углеводородов. Л.: Гидрометеоиздат, 224 с.
Розанов А.Г. (2015) Геохимические особенности глубоководных донных отложений Карского моря (Новоземельская впадина, желоб Святой Анны). Океанология. 55(4), 709-722.
Саввичев А.С., Кадников В.В., Каллистова А.Ю., Русанов И.И., Воронов Д.А., Краснова Е.Д., Равин Н.В., Пименов Н.В. (2019) Фотозависимое окисление метана – важнейший процесс цикла метана в водной толще полярного озера Большие Хрусломены. Микробиология. 88(3), 367-371
Справочники и руководства. МОК/ВМО (1984) Париж. Юнеско, № 13, 34 с.
Стародымова Д.П., Шевченко В.П., Боев А.Г. (2016) Вещественный и элементный состав нерастворимых частиц в снеге северо-западного побережья Кандалакшского залива Белого моря. Успехи современного естествознания. 16, 449-453.
Федоров Ю.А., Овсепян А.Э., Лисицын А.П., Доценко И.В., Новигатский А.Н., Шевченко В.П. (2011) Закономерности распределения ртути в донных отложениях по разрезу река Северная Двина – Белое море. ДАН. 436(1), 99-102.
Федоров Ю.А., Овсепян А.Э., Савицкий В.А., Лисицын А.П., Шевченко В.П., Новигатский А.Н. (2019) Ртуть в донных отложениях Белого моря: распределение, источники и хронология захоронения. Океанология. 59(1), 153-162.
Шапоренко С.И., Корнеева Г.А., Пантюлин А.Н., Перцова Н.М. (2005) Особенности экосистем отшурфовывающихся водоемов Кандалакшского залива Белого моря. Водные ресурсы. 32(5), 517-532.
Budko D.F., Demina L.L., Lisitzin A.P. (2021) The heavy metal partitioning in the particle flux of the subarctic White Sea (Northwestern Russia). Estuarine, Coastal and Shelf Science. 249, 107063.
Canfield D.E. (1989) Reactive iron in marine sediments. Geochim. Cosmochim. Acta. 53, 619-632.
Chase Z., Anderson R.F., Fleisher M.Q. (2001) Evidence from authigenic uranium for increased productivity of the glacial subantarctic ocean. Paleoceanography. 16, 468-478.
Jafarabadi A.R., Bakhtiari A.R., Aliabadian M., Toosi A.S. (2017). Spatial distribution and composition of aliphatic hydrocarbons, polycyclic aromatic hydrocarbons and hopanes in superficial sediments of the coral reefs of the Persian Gulf, Iran. Environmental Pollution. 224, 195-223.
Helz G.R., Bura-Nakic E., Mikac N., Ciglenečki I. (2011) New model for molybdenum behavior in euxinic waters. Chemical Geology. 284, 323-332.
Martin J.H., Knauer G.A. (1973) The elemental composition of plankton. Geochim. Cosmochim. Acta. 37, 1639-1653.
Marz C., Stratmann A., Matthiessen J., Meinhardt A.-K., Eckert S., Schnetger B., Vogt C., Stein R., Brumsack H.-J. (2011) Manganese-rich brown layers in Arctic Ocean sediments: Composition, formation mechanisms, and diagenetic overprint. Geochim. Cosmochim. Acta. 75, 7668-7687.
Monitoring of hazardous substances in the White Sea and Pechora Sea: harmonisation with OSPAR’s Coordinated Environ. Monitoring Program. (CEMP) (2011) Tromsø: Akvaplan-niva. 71 p.
Morse J.W., Luther G.W. (2006) Chemical influences on trace metal-sulfide interactions in anoxic sediments. Marine Chemistry. 102, 111-123.
Nishumura M., Baker E.W. (1986) Possible origin of n-alkanes with remarkable even-to-odd predominance in recent marine sediments. Geochim. Cosmochim. Acta. 50(2), 299-305.
Piotrowicz S.R., Harvey G.R., Boran D.A., Weisel C.P., Springer-Young M. (1984) Cadmium, copper, and zinc interactions with marine humus as a function of ligand structure. Marine Chemistry. 14, 333-346.
Resmi P.,Manju M.N.,Gireeshkumar T.R., Ratheesh C.S., Chandramohanakumar N. (2016) Source characterisation of Sedimentary organic matter in mangrove ecosystems of northern Kerala, India: Inferences from bulk characterisation and hydrocarbon biomarkers. Regional Studies in Marine Science. 7, 43-54.
Scott C., Lyons T.W. (2012) Contrasting molybdenum cycling and isotopic properties in euxinic versus non-euxinic sediments and sedimentary rocks: refining the paleoproxies. Chemical Geology. 324, 19-27.
Shaw T.J., Gieskes J.M., Jahnke R.A. (1990) Early diagenesis in differing depositional environments: the response of transition metals in pore water. Geochim. Cosmochim. Acta. 54, 1233-1246.
Shevchenko V., Lisitzin A., Vinogradova A., Stein R. (2003) Heavy metals in aerosols over the seas of the Russian Arctic. The Science of the Total Environment. 306(1–3), 11-25.
Sunderland E.M., Gobas F.A.P.C., Branfireun B.A., Heyes A. (2006) Environmental controls on the speciation and distribution of mercury in coastal sediments. Marine Chemistry. 102, 111-123.
Tolosa I., Mora S., Sheikholeslami M.R., Villeneuve M.R., Bartocci J., Cattini C. (2004) Aliphatic and Aromatic Hydrocarbons in coastal Caspian Sea sediments. Mar. Poll. Bull. 48, 44-60.
Warmer H., van Dokkum R. (2002) Water Pollution Control in the Netherlands. Policy and Practice 2001. RIZA, Lelystad, Netherlands, p. 77.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S1 . Корреляционная матрица (p < 0.01) между содержанием химических элементов (мкг/г), органических соединений, долей гранулометрических фракций, и глубиной станций отбора проб.