Геология рудных месторождений, 2022, T. 64, № 6, стр. 634-656
Золото в пирите: природные руды и эксперимент (на примере месторождений Дарасунского рудного поля, Восточное Забайкалье, Россия)
В. Ю. Прокофьев a, *, Б. Р. Тагиров a, В. Д. Бровченко a, В. Л. Реуков a, О. Н. Филимонова a, Л. Д. Зорина b, В. Д. Абрамова a, Е. В. Ковальчук a, А. А. Межуева a, И. Ю. Николаева c, М. Е. Тарнопольская c, Н. Н. Акинфиев a, А. Н. Краснов d, В. Б. Комаров a, Н. С. Бортников a
a Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
119017 Москва, Старомонетный пер., 35, Россия
b Институт геохимии СО РАН
664033 Иркутск, ул. Фаворского, 1а, Россия
c МГУ им. М.В. Ломоносова, геологический факультет
119991 Москва, Ленинские горы, д. 1, Россия
d Центральный научно-исследовательский геологоразведочный институт цветных и благородных металлов
117549 Москва, Варшавское шоссе, д. 129, корп. 1, Россия
* E-mail: vpr2004@rambler.ru
Поступила в редакцию 07.07.2022
После доработки 22.07.2022
Принята к публикации 30.07.2022
- EDN: FGGOJD
- DOI: 10.31857/S0016777022060053
Аннотация
Методом лазерной абляции в сочетании с масс-спектрометрией с ионизацией вещества индуктивно связанной плазмой изучены концентрации золота в природном пирите богатых золотом сульфидных руд месторождений Дарасунского рудного поля и в синтетическом пирите, выращенном из насыщенного по золоту раствора. Параметры и состав флюида в опытах по синтезу были выбраны согласно данным изучения условий формирования пирита. Опыты выполнены при 350°С/1000 бар и 490°С/1000 бар, прекурсором (исходной фазой) служили синтетический троилит FeS или гидротроилит FeOHHS. Концентрация NaCl составляла 0, 15 и 35 мас. %. В ряде опытов в систему вводился As. Установлено, что основными факторами, определяющими растворимость Au в пирите, являются температура, соленость флюида и концентрация As. Рост температуры приводит к снижению содержания Au, а рост концентрации хлоридов – к его увеличению. При невысоких концентрациях As в пирите (C(As) < ~200 ppm) As не влияет на содержание Au: в среднем C(Au) растет от первых ppm до ~100 ppm при снижении температуры от 490 до 350°С. Высокие концентрации As (C(As) > > n100 ppm) вызывают рост растворимости Au в пирите. При C(As) ~0.6 мас. % концентрация Au достигает 400 ppm. Гидротермальная перекристаллизация и укрупнение зерен пирита приводят к снижению содержания Au и As в новообразованном пирите по сравнению с пиритом, образовавшимся непосредственно по прекурсору. Золото обогащает пирротин по сравнению с сосуществующим пиритом, по мере роста температуры его содержание в пирротине достигает 10 ppm при 490°С, распределение близко к равномерному. Сравнение исследованных образцов природного и синтетического пирита позволяет в качестве основных факторов, обусловивших поведение Au в золотоносном пирите месторождений Дарасунского рудного поля, рассматривать: i) кристаллизацию из ненасыщенных по Au флюидов, ii) перекристаллизацию и укрупнение первичного пирита с высвобождением Au в виде металла и iii) разницу в температуре и содержании растворенных хлоридов.
ВВЕДЕНИЕ
Золото является важным стратегическим металлом, и изучение условий накопления золота в гидротермальных системах многие годы не теряет своей актуальности. Во многих месторождениях с высоким содержанием сульфидов не все золото присутствует в виде зерен самородного золота. Значительная его часть может находиться в сульфидных минералах, прежде всего в пирите и арсенопирите как химически связанный металл, в виде наночастиц или коллоидальных частиц самородного золота или других минералов золота (Cabri et al., 1989, 1991; Cathelineau et al., 1989; Genkin et al., 1998; Large, Maslennikov, 2020). Для крупных месторождений с низким содержанием золота в рудах (<2 г/т: месторождения типа Карлин и орогенного типа) интенсивно ведется изучение распределения золота и сопутствующих ему элементов в сульфидах (Large, Maslennikov, 2020 и др.). При этом следует отметить, что и месторождения с высокими содержаниями золота, богатые сульфидами, тоже заслуживают таких исследований хотя бы для оценки величины возможных потерь золота при переработке таких руд. Именно с целью выявления возможных корреляций содержания золота в сульфидах с условиями их образования нами было предпринято изучение богатых золото-сульфидных руд месторождений Дарасунского рудного поля, которые относят к типу “intrusion related” (Prokofiev et al., 2010).
Одной из главных характерных черт поведения золота в гидротермальных рудах является его постоянная связь с сульфидами железа, прежде всего пиритом. Концентрация золота в пирите изменяется от следов до высоких концентраций, которые могут превышать 300 ppm (Deditius et al., 2014 и др.). Установлено также, что максимальная концентрация золота в пирите увеличивается с уменьшением температуры кристаллизации пирита. Такая картина наблюдается как для природного гидротермального пирита (Deditius et al., 2014, и др.), так и для синтетического, выращенного гидротермальным способом (Trigub et al., 2017a, и др.). Исходя из общих соображений, на содержание золота в пирите должны влиять физико-химические параметры и химический состав системы, в которой он образуется, т.е. в нашем случае в первую очередь температура, соленость, содержание As, а также концентрация золота и состав его доминирующих комплексов в водном растворе.
Наиболее высокий химический потенциал золота можно ожидать в насыщенном по золоту гидротермальном флюиде, из которого происходит кристаллизация самородного золота, образующего собственную фазу. Пирит, кристаллизующийся из насыщенного по золоту флюида, при прочих одинаковых параметрах должен содержать максимальные концентрации примесного золота. При концентрации золота во флюиде меньше величины насыщения золото не может кристаллизоваться в виде отдельной фазы, но может соосаждаться вместе с сульфидными минералами в виде так называемого “невидимого золота” (Simon et al., 1999; Бортников и др., 2003 и др.). Это рассеянное золото в дальнейшем может при благоприятных условиях образовать собственную фазу самородного золота в процессе перекристаллизации сульфидных руд (Reich et al. 2006; Trigub et al., 2017a и др.).
Поэтому важной задачей является изучение концентрации золота в пирите природных руд, для которых имеются данные о параметрах кристаллизации пирита и составе флюида, и сравнение результатов с составом пирита, синтезированного при тех же условиях. Если при гидротермальном синтезе пирита задавать максимальную химическую активность золота путем добавления металлического золота в автоклав, то можно изучать влияние других компонентов флюида на предельную концентрацию золота в пирите, кристаллизующемся из гидротермального флюида в ассоциации с самородным золотом. Сравнение содержаний золота в природном и синтетическом пирите позволит обоснованно предполагать, кристаллизовался ли пирит в природных рудах вместе с самородным золотом или золото обособилось в отдельную фазу при перекристаллизации пирита.
В качестве природных минералов для изучения нами были взяты высокотемпературный пирит из прожилково-вкрапленных сульфидных руд месторождения Талатуй и среднетемпературный пирит из жильных золотых руд месторождения Дарасун, находящиеся в срастании с самородным золотом. Условия проведения экспериментов были выбраны, исходя из средних параметров минералообразующего флюида, определенных для продуктивного кварца этих месторождений.
Данная работа является попыткой комплексного подхода к изучению процессов формирования природных месторождений золота, включающего изучение природных руд, гидротермальный эксперимент и термодинамическое моделирование.
ГЕОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА МЕСТОРОЖДЕНИЙ
Дарасунское рудное поле включает в себя известное с конца 19 века крупное месторождение золота Дарасун и открытые в 70-е годы двадцатого века среднее по масштабу месторождение золота Талатуй, мелкое месторождение Теремки и несколько рудопроявлений. Месторождения золота Дарасунского рудного поля образовались в результате деятельности единой магматогенно-флюидной минеральной системы юрского возраста, связанной с внедрением гранодиорит-порфиров Амуджикано-Сретенского комплекса (Тимофеевский, 1972; Прокофьев и др., 2000). Месторождения золота расположены среди палеозойских магматических пород на разном расстоянии (фиг. 1) от интрузивного тела гранитоидов Амуджикано-Сретенского комплекса возраста 160.5 ± 0.4 млн лет (Чернышов и др., 2014).
Фиг. 1.
Геологическая схема Дарасунского рудного поля и его окружения (Геологическое…, 1997).
1 – (Q) четвертичные отложения; 2 – (K1tr2) Тургинская подсерия: верхняя – песчаники, алевролиты, аргиллиты, конгломераты, андезибазальты, трахибазальты, риолиты, туфы, туфогенно-осадочные породы, каменные угли; 3 – (J3nr) Нерчинская серия: нерасчлененная – латиты, кварцевые латиты, трахиандезибазальты, трахибазальты, трахиандезиты, трахириодациты, риолиты, трахириолиты, туфы, конгломераты, песчаники, алевролиты, туфогенно-осадочные породы; 4 – (γJ3d) Дотулурский комплекс: лейкограниты, пегматоидные граниты, амазонитовые граниты; 5–7 (qξ2J3as) Амуджикано-Сретенский комплекс: 5 – II фаза – кварцевые сиениты; 6 – II фаза – гранодиорит-порфиры, 7 – II фаза – гранит-порфиры; 8–10 – (γ2J2-3a) Амананский комплекс: 8 – II фаза – граниты (γ), аплитовидные граниты; 9 – I фаза (γδ1J2-3a) – кварцевые сиениты (qξJ2-3a); 10 – I фаза (γδ1J2-3a) – граниты; 11 – (γ3P2b) Бичурский комплекс III фаза – лейкограниты, граниты, гранит-порфиры, кварцевые сиениты; 12 – (γPZ1o) Олекминский комплекс – граниты; 13 – (γδPZ1kr) Крестовский комплекс – гранодиориты, кварцевые диориты, диориты, кварцевые сиениты, тоналиты, плагиограниты, граниты, гранодиориты, кварцевые сиениты, граниты; 14, 15 – (νδ1PZ1k) Кручининский комплекс: 14 – габбро; 15 – габбродиориты; 16 – (γδ2PR1ps) Позднестановой комплекс: гранодиориты; 17 – (δPR1o) Олошкинский комплекс: диориты; 18 – (qPR1t) Тунгирский комплекс: гнейсы, мигматиты. Кружки – месторождения золота: 1 – Талатуй, 2 – Дарасун.

Месторождение прожилково-вкрапленных руд золота Талатуй локализовано среди габброидов Кручининского комплекса и расположено ближе всего к интрузивному телу гранитоидов Амуджикано-Сретенского комплекса, а жильное месторождение золота Дарасун – в 12 км к юго-востоку, на контакте габброидов Кручининского комплекса и гранитоидов Крестовского комплекса. На карте хорошо видно разное удаление изученных месторождений от массива гранитоидов Амуджикано-Сретенского комплекса.
Руды месторождений золота Дарасунского рудного поля формировались в три стадии (раннюю, продуктивную и позднюю), причем основное количество золота связано со второй – продуктивной – стадией (Тимофеевский, 1972; Сахарова, 1972; Ляхов, 1975). Наблюдаются как сходство минерального состава руд месторождений Дарасунского рудного поля (основные минералы руд – кварц, пирит, пирротин, турмалин, минералы висмута, самородное золото и др.), так и различия в минеральном составе (наличие большого количества арсенопирита, сульфосолей сурьмы, висмута, теллуридов и различных редких минералов в рудах месторождения Дарасун). Отмечаются различия в морфологии рудных тел, текстурах руд, минеральном составе руд и метасоматитов, которые можно связать с изменением физико-химических условий рудоотложения (Прокофьев и др., 2007; Prokofiev et al., 2010 и др.). Пробность самородного золота месторождений также несколько отличается. Наиболее высокопробное самородное золото встречается в прожилково-вкрапленных рудах месторождения Талатуй (997–777‰), а самородное золото рудных жил месторождения Дарасун содержит относительно большее количество серебра (896–590‰). В продуктивной стадии нередко встречаются срастания самородного золота и пирита (фиг. 2), которые обычно интерпретируются как одновременное образование (Тимофеевский, 1972 и др.).
Изучение флюидных включений (Прокофьев и др., 2000, 2007; Prokofiev et al., 2010) показало (табл. 1), что жилы месторождения Дарасун начали отлагаться в среднетемпературных условиях (максимальные температуры формирования руд не превышали 430°С), а прожилково-вкрапленные руды месторождения Талатуй формировались при более высокой температуре (температуры начала кристаллизации минералов руд достигали 610°С). Исследование стабильных изотопов кислорода и углерода показало магматическую природу рудообразующих флюидов месторождения Дарасун (Прокофьев и др., 2010), что согласуется с представлениями о единой гидротермальной флюидно-магматической минералообразующей системе, объединяющей процесс формирования месторождений Дарасун и Талатуй (Prokofiev et al., 2009). Установлено расширение температурного интервала рудоотложения и увеличение температуры начала процесса с приближением к магматическому очагу, а также изменение состава рудообразующего флюида при переходе от высокотемпературных прожилково-вкрапленных руд месторождения Талатуй к среднетемпературным жильным рудам месторождения Дарасун. Также наблюдается обогащение минералообразующего флюида высокотемпературных прожилково-вкрапленных руд слабо летучими компонентами (Cl, ${\text{SO}}_{4}^{{2 - }}$, Ca, Br, Sr и др.), а флюида среднетемпературных жильных руд – более подвижными и летучими компонентами (CO2, CH4, ${\text{HCO}}_{3}^{ - }$, As, Hg, Te, Se, Li и др.) (Prokofiev, Selector, 2014).
Таблица 1.
Параметры минералообразующего флюида, формировавшего руды месторождений золота Талатуй и Дарасун (Прокофьев и др., 2000, 2007; Prokofiev et al., 2010)
| Стадия | n* | Температура, °С | С, мас. % | d, г/см3 |
|---|---|---|---|---|
| Месторождение Талатуй | ||||
| Ранняя | 64 | 402–611 (490) | 0.7–56.3 | 0.02–1.25 |
| Продуктивная | 242 | 269–438 (350) | 1.4–48.4 | 0.03–1.21 |
| Поздняя | 37 | 133–251 (200) | 0.7–5.4 | 0.83–1.03 |
| Месторождение Дарасун | ||||
| Ранняя | 563 | 230–429 (350) | 0.7–44.8 | 0.20–1.08 |
| Продуктивная | 342 | 160–383 (280) | 0.7–22.0 | 0.66–0.98 |
| Поздняя | 57 | 124–223 (170) | 2.2–17.0 | 0.90–1.04 |
Изменение химического состава рудообразующих флюидов Дарасунского рудного поля тесно связано с изменением условий рудоотложения в зависимости от удаленности от интрузивного тела гранитоидов и с физическими свойствами флюида, прежде всего температурой. Флюид вблизи магматического очага вскипает, разделяется на “рассол” и менее плотную фазу, которая мигрирует на более далекие от источника флюида и рудных компонентов уровни. Поэтому в удаленных от центра системы областях флюид обогащается относительно летучими компонентами. Высокотемпературная область системы вблизи магматического очага обогащена менее подвижными летучими компонентами. Таким образом, изменение состава флюидов в процессе рудоотложения на месторождении Дарасун объясняется наличием единой гидротермальной системы, которая определяет геохимические особенности руд и минералов в разных частях этой системы. Можно было ожидать заметные различия концентраций золота в пирите этих двух месторождений.
ПОСТАНОВКА ЗАДАЧИ В ОПЫТАХ ПО СИНТЕЗУ
Исходя из данных по минеральному и химическому составу руд месторождений Дарасунского рудного поля и условиям их образования, были поставлены следующие задачи экспериментальной работы: определить влияние температуры T, концентрации хлоридов С(NaCl), летучести серы f(S2), окислительного потенциала системы f(O2) и содержания мышьяка в системе C(As) на концентрацию Au в пирите и характер распределения примесей в синтезированных кристаллах. Кроме того, ставилась задача установить коэффициенты распределения Au между гидротермальным флюидом и пиритом (KD(AuFl/Py) = = C(Au)fl/C(Au)Py), пиритом и пирротином (KD(AuPy/Po) = C(Au)Py/C(Au)Po). Опыты по синтезу золотосодержащих пиритов выполнялись гидротермальным методом при 350 и 490°С, 1 кбар. Содержание серы варьировало от равновесного с жидкой серой до равновесия пирит–пирротин. При этом окислительно-восстановительный потенциал менялся от окислительного, заданного реакциями растворения и диспропорционирования элементарной серы (H2S(р-р) и SO2(р-р) присутствуют в сопоставимых количествах) до восстановительного (H2S преобладает). Концентрация NaCl менялась от 0 до 9m [моль(кг H2O)–1] (0, 15 и 35 мас. % NaCl). В ряде опытов к исходной твердой фазе – прекурсору для образования пирита – добавлялся As. Активность золота определялась присутствием металлического Au, в одном опыте Au вводилось в систему в виде HAuCl4.
МЕТОДЫ ИССЛЕДОВАНИЯ
Гидротермальный синтез золотоносного пирита
Опыты проводились с использованием титановых автоклавов (сплав ВТ-8) объемом около 20 см3. На дно автоклавов загружался реактив элементарной серы, количество которой рассчитывалось с учетом реакции с прекурсором при образовании пирита. В случае, когда система содержала NaCl, в автоклав загружалась необходимая навеска соли (реактив квалификации “ос.ч.”), затем заливалась дистиллированная вода. Коэффициент заполнения автоклава (плотность флюида) рассчитывалась по PVT-данным воды или системы NaCl–H2O (Driesner, 2007). В верхней части автоклавов в Ti-контейнер помещалась исходная фаза для получения пирита (прекурсор) – троилит FeS, полученный методом сухого синтеза в кварцевых ампулах из стехиометрической смеси карбонильного железа, прокаленного в вакууме, и реактива элементарной серы. Рядом с контейнером подвешивалась полоска золотой фольги. В опытах при 490°С золото находилось на Тi-перегородке непосредственно над контейнером с прекурсором, при 350°С – помещалось на Ti-проволочке под контейнером для того, чтобы прекурсор реагировал с раствором, в котором уже содержалось Au. Один опыт выполнен с использованием другого прекурсора – порошка синтетического гидротроилита FeOHHS, содержащего 80 ppm Au. Метод синтеза описан в работе (Filimonova et al., 2020). Перед загрузкой прекурсоры перетирались в агатовой ступке. Масса прекурсора составляла 0.35–0.5 г. В нескольких опытах к прекурсору добавлялся либо As2O3, либо элементарный As в количестве от 3 до 10% от массы прекурсора, затем смесь перемешивалась и перетиралась. Один опыт выполнен в системе без металлического Au, золото вводилось в виде раствора HAuCl4, C(Au) = 100 ppm. Закрытые автоклавы ставились в безградиентные печи, заранее разогретые до необходимой температуры. Температура измерялась термопарами нихросил–нисил (производство OOO “Обнинская термоэлектрическая компания”), откалиброванными на предприятии относительно эталонной термопары. Точность измерения и поддержания температуры ±1.5°С, погрешность определения давления по степени заполнения автоклава ±10%. Длительность опытов при 490°С составила 3 и 21 сут, при 350°С – 17 сут.
По завершении опыта автоклавы закаливались в проточной холодной воде и из них извлекался конденсат. Пустые автоклавы заполнялись царской водкой и выдерживались при небольшом нагреве в течение часа, для растворения отложенного при закалке на стенках Au. Смывы объединялись с конденсатами, и в полученных пробах определялось содержание Au и As. Твердые фазы промывались водой, этиловым спиртом и высушивались в эксикаторе над силикагелем. Пирит отделялся от пирротина. Полученные пробы делились на несколько частей и подготавливались к анализам в соответствии с требованиями аналитических методов.
Аналитические методы
Определение концентраций Au и As в пробах экспериментальных растворов выполнялось методом ИСП МС на кафедре геохимии геологического факультета МГУ им. М.В. Ломоносова, прибор Element-2, Thermo Scientific. Непосредственно перед анализом пробы разбавлялись 2 M HCl в соответствии с ожидаемыми содержаниями анализируемых элементов. Воспроизводимость анализа ±10% (включая погрешность, связанную с пробоподготовкой), измеренные концентрации превышали предел обнаружения по меньшей мере в 100 раз.
Морфология поверхности синтезированных фаз изучалась методом сканирующей электронной микроскопии с помощью прибора JEOL JCM-7000. Этим же методом, на качественном уровне, определяли состав поверхности. Рентгенофазовый анализ порошков синтезированных сульфидов выполнялся на настольном рентгеновском дифрактометре AXRD (Proto Manufacturing), оснащенном рентгеновской трубкой с Co-анодом, диапазон углов сканирования 2θ 5°–75°, шаг сканирования 0.05°.
Химический состав сульфидов определялся в полированных шлифах методом рентгеноспектрального микроанализа (РСМА) на электронно-зондовом микроанализаторе JXA-8200 фирмы JEOL, методика анализов детально описана в (Ковальчук и др., 2019). Этот метод использовался для определения основных компонентов – Fe, S, As (при высоких содержаниях).
Содержание и характер распределения примесей (Au, As, Sb, Pt, Ag, Te, Bi) изучались методом масс-спектрометрии с индуктивно-связанной плазмой и лазерным пробоотбором (ЛА ИСП МС) с использованием квадрупольного масс-спектрометра Thermo XSeries2 и лазерной приставки New Wave 213. Параметры лазера: диаметр пучка 40–60 мкм, энергия 7–8 Дж/см2, частота 10 Гц. Пробоперенос осуществлялся потоком He (0.6 л/мин) с добавлением 6% H2. На входе МС He смешивался с Ar (0.8 л/мин). Абляция проводилась в течение 30–60 сек, которым предшествовало 20 сек измерения фона. Скорость сканирования при анализе вдоль линии составляла 5 мкм/с. В качестве внешнего стандарта использованы: Sulfide reference material MASS-1 (Wilson et al., 2002) и изготовленный в нашей лаборатории синтетический пирротин Fe0.9S, содержащий 18 ppm Au и 20 ppm Pt (метод синтеза описан в (Wohlgemuth et al., 2007)). Изотопы 57Fe и 33S использовались в качестве внутреннего стандарта. Усредненные пределы обнаружения (2σ) составили (ppm): Au – 0.06, As – 3, Sb – 0.4, Pt – 0.05, Ag – 0.1, Te – 2, Bi – 0.03.
РЕЗУЛЬТАТЫ
Золото в природном пирите
Для изучения золотоносности природного пирита были взяты образцы богатых руд золота месторождений Талатуй и Дарасун, в которых под микроскопом было обнаружено самородное золото в пирите (фиг. 2). Изучено 7 образцов высокотемпературных прожилково-вкрапленных руд месторождения Талатуй (температура формирования 400–600°С) и 7 образцов жильных среднетемпературных руд месторождения Дарасун (температура формирования 200–430°С). Всего выполнено около 250 определений концентраций золота в природном пирите методом ЛА ИСП МС. Значения концентрации Au в высокотемпературном пирите месторождения Талатуй изменялись от 0.13 до 6.78 ppm, а в среднетемпературном пирите месторождения Дарасун – от 0.1 до 22 ppm (табл. 2). Максимальные и средние значения концентраций As, Ag, Te и Bi в пирите месторождения Дарасун также выше, чем в пирите месторождения Талатуй (табл. 2). На ЛА ИСП МС-спектрах пирита месторождения Талатуй отчетливо прослеживаются пики микровключений Au, тогда как пирит Дарасуна не содержит видимых микровключений (фиг. 3). Обогащенные Au части зерен пирита месторождения Дарасун, вероятно, представляют собой зоны размером до 150 мкм, которые также демонстрируют прямую корреляцию с содержаниями As (а также Ag, Te и Bi, фиг. 4).
Фиг. 2.
Срастания пирита и самородного золота в рудах месторождений Талатуй (а, б) и Дарасун (в, г). Au – самородное золото, Py – пирит, Asp – арсенопирит, Chp – халькопирит, Mt – магнетит.

Таблица 2.
Концентрации примесей в пирите промышленных руд месторождений Дарасунского рудного поля (Восточное Забайкалье)
| Месторож-дение | Образец | n | Au, ppm $\frac{{{\text{мин}}{\kern 1pt} - {\kern 1pt} {\text{макс}}}}{{n{\text{*}}}}$ |
Ag $\frac{{{\text{мин}}{\kern 1pt} - {\kern 1pt} {\text{макс}}}}{{n{\text{*}}}}$ |
As, ppm $\frac{{{\text{мин}}{\kern 1pt} - {\kern 1pt} {\text{макс}}}}{{n{\text{*}}}}$ |
Sb $\frac{{{\text{мин}}{\kern 1pt} - {\kern 1pt} {\text{макс}}}}{{n{\text{*}}}}$ |
Te $\frac{{{\text{мин}}{\kern 1pt} - {\kern 1pt} {\text{макс}}}}{{n{\text{*}}}}$ |
Bi $\frac{{{\text{мин}}{\kern 1pt} - {\kern 1pt} {\text{макс}}}}{{n{\text{*}}}}$ |
|---|---|---|---|---|---|---|---|---|
| Талатуй | 55/07 | 36 | $\frac{{ < 0.06 - 0.67}}{1}$ | $\frac{{ < 0.1 - 15.22}}{{33}}$ | $\frac{{27.45 - 993.2}}{{36}}$ | $\frac{{ < 0.4 - 36.85}}{2}$ | – | $\frac{{ < 0.03 - 45.92}}{{33}}$ |
| « | 143/05 | 4 | – | $\frac{{ < 0.1 - 2.04}}{1}$ | $\frac{{10.84 - 16.02}}{4}$ | – | $\frac{{4.01 - 44.38}}{4}$ | $\frac{{ < 0.03 - 1}}{3}$ |
| « | 4208 | 37 | $\frac{{ < 0.06 - 0.49}}{3}$ | $\frac{{ < 0.1 - 6.68}}{{31}}$ | $\frac{{8.28 - 1324}}{{37}}$ | $\frac{{ < 0.4 - 34.71}}{{17}}$ | – | $\frac{{ < 0.03 - 5.34}}{{32}}$ |
| « | 54/07 | 8 | – | – | $\frac{{147.4 - 607.7}}{8}$ | – | – | – |
| « | 44/07 | 4 | – | – | $\frac{{ < 1.5 - 16.82}}{3}$ | – | – | $\frac{{ < 0.03 - 0.39}}{2}$ |
| « | 4211Т | 49 | $\frac{{ < 0.06 - 6.78}}{{11}}$ | $\frac{{ < 0.1 - 46.46}}{3}$ | $\frac{{70.49 - 7636}}{{49}}$ | $\frac{{ < 0.4 - 1.74}}{4}$ | $\frac{{ < 2 - 15.17}}{{10}}$ | $\frac{{ < 0.03 - 79.03}}{{22}}$ |
| « | 50/01 | 14 | $\frac{{ < 0.06 - 1.52}}{4}$ | – | $\frac{{97.19 - 1324}}{{14}}$ | $\frac{{ < 0.4 - 0.93}}{1}$ | $\frac{{ < 2 - 16.34}}{3}$ | $\frac{{ < 0.03 - 20.29}}{{11}}$ |
| Итого | 152 | |||||||
| Медиана | 0.87 | 3.76 | 204 | 0.95 | 8.86 | 1.85 | ||
| Дарасун | 20vd89 | 39 | $\frac{{ < 0.06 - 0.27}}{4}$ | $\frac{{ < 0.1 - 304.4}}{{35}}$ | $\frac{{ < 3 - 8170}}{{38}}$ | $\frac{{ < 0.4 - 9.56}}{{26}}$ | $\frac{{ < 2 - 50.2}}{9}$ | $\frac{{ < 0.03 - 822.4}}{{33}}$ |
| « | sh71 | 21 | – | $\frac{{ < 0.1 - 187.4}}{{17}}$ | $\frac{{13.62 - 7636}}{{21}}$ | $\frac{{ < 0.4 - 26.17}}{{10}}$ | $\frac{{ < 2 - 6.41}}{6}$ | $\frac{{ < 0.03 - 2350}}{{16}}$ |
| « | 92Dr85 | 9 | $\frac{{ < 0.06 - 4.86}}{7}$ | $\frac{{ < 0.1 - 25.37}}{6}$ | $\frac{{224.8 - 5703}}{9}$ | $\frac{{ < 0.4 - 2.78}}{5}$ | – | $\frac{{ < 0.03 - 78.5}}{3}$ |
| « | 490Dr85 | 2 | – | $\frac{{20.61 - 95.05}}{2}$ | $\frac{{0.61 - 744.9}}{2}$ | $\frac{{1.87 - 9.56}}{2}$ | – | $\frac{{2.32 - 9.35}}{2}$ |
| « | 224Dr85 | 14 | $\frac{{ < 0.06 - 21.95}}{{10}}$ | $\frac{{ < 0.1 - 304.4}}{7}$ | $\frac{{284.6 - 927}}{{14}}$ | $\frac{{ < 0.4 - 9.88}}{5}$ | $\frac{{ < 2 - 26.17}}{8}$ | $\frac{{ < 0.03 - 849.1}}{8}$ |
| « | 6Vd89 | 10 | $\frac{{ < 0.06 - 8.76}}{6}$ | $\frac{{ < 0.1 - 154.3}}{9}$ | $\frac{{194.4 - 10\,360}}{{10}}$ | $\frac{{ < 0.4 - 12.23}}{8}$ | $\frac{{ < 2 - 21.63}}{4}$ | $\frac{{ < 0.03 - 448.6}}{8}$ |
| « | 90/05 | 10 | $\frac{{ < 0.06 - 5.77}}{2}$ | $\frac{{ < 0.1 - 48.06}}{3}$ | $\frac{{303.8 - 2537}}{{10}}$ | $\frac{{ < 0.4 - 15.38}}{2}$ | $\frac{{ < 2 - 22.27}}{3}$ | $\frac{{ < 0.03 - 107.3}}{3}$ |
| Итого | 105 | |||||||
| Медиана | 0.87 | 3.14 | 735.6 | 2.02 | 7.48 | 6.73 |
Фиг. 3.
Профили лазерной абляции в пирите месторождений Талатуй (а) и Дарасун (б) и типичные спектры лазерной абляции пирита месторождений Талатуй (в) и Дарасун (г).

Фиг. 4.
Зависимость между содержаниями Au с As (а), Ag (б), Te (в) и Bi (г) для пирита месторождений Талатуй (1) и Дарасун (2). Линии на диаграмме (а) проведены условно и отвечают максимальным содержаниям Au на месторождениях.

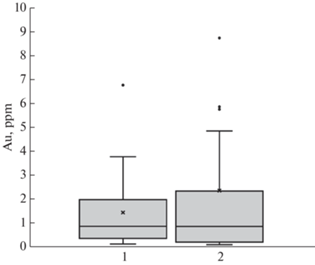
Представляется важным проследить связь содержаний рассеянного Au с мышьяковистостью пирита. Как отмечено выше, в целом пирит месторождения Дарасун более мышьяковистый по сравнению с месторождением Талатуй (фиг. 4а). Концентрации As в пирите варьируют от ~10 ppm до 0.3 мас. % (Талатуй) и от ~200 ppm до 1 мас. % (Дарасун). Для пирита месторождения Дарасун во всей области концентрации As наблюдается отчетливая положительная корреляционная связь Au–As. При этом в координатах диаграммы lg C(Au)–lg C(As) (фиг. 4а) можно определить прямую линию, отвечающую максимальным концентрациям Au. Возможно, эта линия соответствует растворимости Au в мышьяковистом пирите при параметрах рудообразования (Reich et al., 2005). Для пирита месторождения Талатуй можно выделить две области. При высоких содержаниях As (С(As) > n100 ppm), подобно месторождению Дарасун, содержание Au прямо коррелирует с As. Положительная корреляционная связь Au–As в пирите обоих месторождений подтверждается профилями ЛА ИСП МС (фиг. 3). При низких концентрациях As (С(As) < n100 ppm) на месторождении Талатуй содержание Au перестает зависеть от мышьяковистости пирита и составляет немногим менее 1 ppm.
Для сравнения содержаний Au при сильно варьирующих данных из выборки были исключены значения концентраций, которые были меньше удвоенного значения предела обнаружения Au, а для оставшихся значений были построены диаграммы размаха (boxplot diagrams), позволяющие разделить выбросы и основную массу данных о концентрациях Au в пирите. Как видно из фиг. 5, для обоих месторождений средние значения содержания Au близки к 0.9 ppm, причем диапазон содержаний Au в пирите месторождения Дарасун шире.
Результаты опытов по синтезу
Флюидная фаза. Отметим, что задачей опытов не являлось изучение состояния золота в гидротермальных флюидах. Простая химическая и экспериментальная система, использованная в опытах, позволяла только создать условия для гидротермального синтеза пирита, моделирующие его образование на природных месторождениях, и выявить характер влияния состава флюида и физико-химических параметров на коэффициенты распределения Au между флюидом и минералами. В настоящем разделе будет выполнено сравнение результатов опытов с литературными данными, чтобы установить формы нахождения золота в экспериментальных флюидах. В качестве базы термодинамических данных для комплексов Au использован обзор (Акинфиев, Зотов, 2010), методика термодинамических расчетов приведена в дополнительных материалах (Приложение 1 ).
Результаты и условия опытов по синтезу пирита представлены в табл. 3. В нескольких опытах содержание Au определено двумя методами: путем анализа растворов с помощью ИСП МС и по потере веса. Исходя из данных двух опытов при 490°С с наименьшим загрязнением Au-фольги, результаты разных методов определения концентрации Au согласуются в пределах ±20%, что позволяет говорить о надежности определения содержаний растворенного Au методом ИСП МС.
Таблица 3.
Условия и результаты опытов по гидротермальному синтезу золотоносного пирита
| Загруженные компоненты | Флюид | Пирите | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| концентрации, моль кг Н2О–1 | основной комплекс Au | Au, эксп./расч. | C(Au), ppm | KD(AuFl/Py)ppmж | |||||||||
| эксперимент | расчетд | ||||||||||||
| Au | Fe | Asa | m Sб |
m NaClв |
lg m Au | lg m Asг | pHT | S | lg m Au |
||||
| Эксперимент Pr#1, 490°C, 1000 бар, длительность опыта 21 сут | |||||||||||||
| Au(к) | FeS(к) | нет | 0.50 | 0.0 | – | п.о. | 3.4 | 0.50 | –5.2 | AuHS(р–р) | Не опред. | 10 ± 7 | – |
| Au(к) | FeS(к) | нет | 0.50 | 3.0 | –3.39 | п.о | 4.5 | 0.50 | –4.5 | AuCl$_{2}^{ - }$ | 12 | 20 ± 21 | 3.3 |
| Au(к) | FeS(к) | нет | 0.50 | 9.2 | –2.96 | п.о | 4.7 | 0.50 | –4.1 | AuCl$_{2}^{ - }$ | 15 | 5 ± 8 | 20 |
| Au(к) | FeS(к) | нет | Py/Po | 3.0 | –4.39 | п.о | 6.1 | 0.025 | –6.0 | AuHS(р–р)/Au(HS)$_{2}^{ - }$ | 41 | 2 ± 1 | 3.4 |
| Au(к) | FeS(к) | нет | Py/Po | 9.2 | –4.11 | п.о | 6.2 | 0.031 | –5.6 | Au(HS)$_{2}^{ - }$/AuCl$_{2}^{ - }$ | 31 | 10 ± 9 | 0.71 |
| Раствор 100 ppm Au | FeS(к) | нет | 0.50 | 9.2 | –3.09 | п.о | 4.0 | 0.50 | – | AuCl$_{2}^{ - }$ | – | п.о | – |
| Эксперимент Pr#2, 490°C, 1000 бар, длительность опыта 3 сут | |||||||||||||
| Au(к) | FeS(к) | нет | 0.52 | 0.0 | –5.63 | п.о | 3.4 | 0.52 | –5.2 | AuHS(р–р) | 0.4 | 15 ± 10 | 0.03 |
| Au(к) | FeS(к) | нет | 0.51 | 3.0 | –3.36 | п.о | 4.5 | 0.51 | –4.5 | AuCl$_{2}^{ - }$ | 14 | п.о | – |
| Au(к) | FeS(к) | нет | 0.50 | 9.2 | –3.33 | п.о | 4.7 | 0.50 | –4.14 | AuCl$_{2}^{ - }$ | 6 | 3.5 ± 3.3 | – |
| Au(к) | FeS(к) | нет | Py/Po | 3.0 | –3.71 | п.о | 6.1 | 0.025 | –6.0 | AuHS(р–р)/Au(HS)$_{2}^{ - }$ | 200 | 0.1 ± 0.1 | – |
| Au(к) | FeS(к) | нет | Py/Po | 9.2 | –3.95 | п.о | 6.1 | 0.031 | –5.6 | Au(HS)$_{2}^{ - }$/AuCl$_{2}^{ - }$ | 44 | 0.5 ± 0.4 | – |
| Au(к) | FeS(к) | As2O3, 5 мас. % | 0.50 | 9.2 | –3.07 | –1.84 | 4.7 | 0.50 | –4.13 | AuCl$_{2}^{ - }$ | 11 | 40 ± 6 | – |
| Эксперимент Pr#3, 350°C, 1000 бар, длительность опыта 17 сут | |||||||||||||
| Au(к) | FeS(к) | нет | +S(ж) | 0 | –5.36 | –4.72 | 2.1 | 0.16 | –4.9 | AuHS(р–р) | 0.35 | 8 ± 3 | 0.11 |
| Au(к) | FeS(к) | нет | +S(ж) | 3.0 | –3.75 | –5.13 | 2.6 | 0.2 | –4.7 | AuHS(р–р) | 9 | 3 ± 3 | 9.5 |
| Au(к) | FeS(к) | нет | +S(ж) | 9.3 | –2.95 | –5.51 | 2.8 | 0.22 | –4.5 | AuHS(р–р) | 39 | 15 ± 15 | 6.6 |
| Au(к) | FeS(к) | нет | Py/Po | 3.0 | –4.16 | –5.98 | 6.0 | 8E–04 | –7.3 | AuHS/Au(HS)$_{2}^{ - }$ | 1400 | 30 ± 60 | 0.37 |
| Au(к) | FeS(к) | нет | Py/Po | 9.2 | –3.24 | –5.91 | 6.1 | 1E–03 | –7.2 | AuHS/Au(HS)$_{2}^{ - }$ | 9100 | 160 ± 45 | 0.33 |
| Au(к) | FeOH HS | As2O3, 5 мас. % | +S(ж) | 3.0 | –2.89 | –2.10 | 2.6 | 0.2 | –4.7 | AuHS | 66 | 300 ± 100 | 0.70 |
| Au(к) | FeS(к) | As, 3 мас. % | +S(ж) | 3.0 | –3.56 | –2.34 | 2.6 | 0.2 | –4.7 | AuHS | 14 | 320 ± 230 | 0.11 |
| Au(к) | FeS(к) | As, 10 мас. % | +S(ж) | 9.2 | –3.07 | –1.54 | 2.8 | 0.22 | –4.5 | AuHS | 29 | 400 ± 60 | 0.19 |
Примечание. а содержание As приведено в % от массы прекурсора; б Py/Po – активность серы контролируется равновесием пирит–пирротин, +S(ж) – флюид находится в равновесии с жидкой серой; в 3.0 m NaCl отвечает 15 мас. %, 9.2 m NaCl – 35 мас. %; г п.о. – предел обнаружения; д рассчитано с использованием термодинамических свойств комплексов Au по (Акинфиев, Зотов, 2010); е данные заимствованы из табл. 4; ж коэффициент распределения Au между флюидом и пиритом, рассчитан как C(Au)fl, ppm/C(Au)Py, ppm.
В каждой серии один опыт был поставлен без добавления NaCl. В опытах, где единственным продуктом синтеза является пирит, активность форм серы, pH и окислительный потенциал определяется реакциями растворения, гидролиза и диспропорционирования S:
(1)
${{{\text{S}}}_{{\text{(}}}}_{{{\text{ж)}}}} = {\text{S}}_{{\left( {{\text{р - р}}} \right)}}^{^\circ }.$(2)
${\text{3S}}_{{\left( {{\text{р - р}}} \right)}}^{^\circ } + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{(}}}}_{{{\text{ж)}}}} = {\text{2}}{{{\text{H}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{(}}}}_{{{\text{р - р)}}}} + {\text{S}}{{{\text{O}}}_{{{\text{2(}}}}}_{{{\text{р - р)}}}}.$(3)
${\text{4S}}_{{\left( {{\text{р - р}}} \right)}}^{^\circ } + {\text{4}}{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{(}}}}_{{{\text{ж)}}}} = {\text{3}}{{{\text{H}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{(}}}}_{{{\text{р - р)}}}} + {\text{SO}}_{4}^{{2 - }} + {\text{2}}{{{\text{H}}}^{{\text{ + }}}}{\text{.}}$В простейшей системе, где NaCl и As отсутствуют, а благодаря кислому pHT = 2−3 основными формами S являются нейтральные частицы H2S(р-р) и SO2(р-р), pH не влияет на растворимость Au. Кроме того, благодаря простой химии S в этой области (минимум частиц, преобладают нейтральные частицы), окислительный потенциал системы рассчитывается достаточно точно согласно уравнению реакции:
(4)
${{{\text{H}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{(}}}}_{{{\text{р - р)}}}} + {\text{1}}{\text{.5}}{{{\text{О}}}_{{{\text{2(р - р)}}}}} = {\text{S}}{{{\text{O}}}_{{{\text{2(}}}}}_{{{\text{р - р)}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{(}}}}_{{{\text{ж)}}}}{\text{.}}$При этом растворение Au описывается реакцией (Trigub et al., 2017b)
(5)
${\text{A}}{{{\text{u}}}_{{\text{(}}}}_{{{\text{к)}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{S }} = {\text{AuH}}{{{\text{S}}}_{{\text{(}}}}_{{{\text{р - р)}}}} + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2(p - p)}}}}},$(6)
${\text{A}}{{{\text{u}}}_{{({\text{к}})}}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}} + {\text{0}}{\text{.25}}{{{\text{О}}}_{{{\text{2(р - р)}}}}} = {\text{AuH}}{{{\text{S}}}_{{({\text{р - р}})}}} + {\text{0}}{\text{.5}}{{{\text{H}}}_{{\text{2}}}}{\text{О}}{\text{.}}$Для двух серий опытов – при 350 и 490°С – в кислой области наблюдается удовлетворительное согласие эксперимента с расчетом (табл. 3). По сравнению с рассчитанными значениями, измеренные концентрации Au занижены в 3 раза, что можно объяснить погрешностью в определении окислительно-восстановительного потенциала системы и соотношения концентраций разных форм S.
Введение в систему NaCl существенно увеличивает расхождение между экспериментом и расчетом. В хлоридных растворах при 490°С основной формой нахождения Au является ${\text{AuCl}}_{2}^{ - }$, а растворение металла отвечает реакции:
(7)
${\text{A}}{{{\text{u}}}_{{{\text{(к)}}}}} + {\text{HC}}{{{\text{l}}}_{{{\text{(р - р)}}}}} + {\text{C}}{{{\text{l}}}^{ - }} = {\text{AuCl}}_{2}^{ - } + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2(p - p)}}}}}{\text{.}}$В данном случае растворимость зависит не только от окислительного потенциала (mH2), но и сильно возрастает при росте кислотности. Вероятно, погрешность рассчитанных значений концентрации кислоты HCl(р-р) вызывает рост расхождения измеренных и рассчитанных концентраций Au в хлоридных растворах. Для пары пирит–пирротин, помимо неопределенности в расчете физико-химических параметров и состава системы, к причинам расхождений добавляется кинетический фактор: время, необходимое для установления равновесия в системе, содержащей минеральный буфер, существенно возрастает по сравнению с системой без минерального буфера f(S2). Вместе с тем, на соотношение форм нахождения Au этот фактор не влияет. Поскольку pH флюида близок к нейтральному, в системе с буфером пирит–пирротин роль хлоридных комплексов снижается по сравнению с кислыми растворами, и растет вклад аниона ${\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - }$, образующегося согласно реакции:
(8)
${\text{A}}{{{\text{u}}}_{{\text{(}}}}_{{{\text{к)}}}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{(}}}}_{{{\text{р - р)}}}} + {\text{H}}{{{\text{S}}}^{ - }} = {\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - } + {\text{0}}{\text{.5}}{{{\text{H}}}_{{{\text{2(p - p)}}}}}{\text{.}}$Основными комплексами Au, согласно расчету, при 490°С и близнейтральном рН (в присутствии пары пирит–пирротин) являются AuHS и ${\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - }$ (15 мас. % NaCl) и AuHS и ${\text{AuСl}}_{2}^{ - }$ (35 мас. % NaCl), концентрации сопряженных комплексов близки и различаются менее чем в 2 раза. При 350°С преобладают гидросульфидные комплексы AuHS и ${\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - }$ независимо от концентрации соли.
Кроме того, из полученных данных следует, что мышьяк не образует устойчивых комплексов с Au в кислой области рН (As(OH)3(р-р) – основная форма нахождения As), поскольку содержания Au в системе без As близки к концентрациям, измеренным при добавке As.
Таким образом, из данных по составу флюидной фазы (табл. 3) можно сделать следующие выводы.
1) В системе без NaCl AuHS(р-р) является основной формой нахождения Au при 350/1000 бар и 490°С/1000 бар.
2) В хлоридных флюидах основной формой нахождения Au при 490°С/1000 бар является комплекс ${\text{AuСl}}_{2}^{ - }$, который сосуществует с гидросульфидными комплексами в близнейтральной области pH. При этом в близнейтральных флюидах общая концентрация растворенного Au снижается по сравнению с кислыми флюидами.
3) Основной формой нахождения Au в хлоридных флюидах при 350°С/1000 бар является комплекс AuHS(р-р). В близнейтральной области pH он сосуществует с комплексом ${\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - }$.
4) В окисленной сульфидной системе без добавок NaCl измеренные концентрации Au удовлетворительно согласуются с рассчитанными по надежным литературным данным. Добавление NaCl приводит к существенному отклонению измеренных значений относительно рассчитанных в сторону завышения концентраций Au, расхождение растет при снижении температуры.
5) В кислой области pH As не образует устойчивых комплексов с Au.
Твердые фазы. Данные по химическому составу синтезированных сульфидов сведены в табл. 4. На фиг. 6 показаны снимки синтезированных фаз, полученные методом СЭМ. Некоторые профили ЛА ИСП МС по зернам сульфидов и их агрегатам показаны на фиг. 7–10.
Таблица 4.
Результаты анализа твердых фаз – продуктов опытов по гидротермальному синтезу золотоносного пирита (LA ICP MS – Au, As)
| Состав раствора | Проба №а | Результаты анализа твердых фаз | |||||
|---|---|---|---|---|---|---|---|
| Au (2 линии и точка), ppmб | As (2 линии и точка), ppmб | ||||||
| min ± 2SE | max ± 2SE | средн. ± SD | min ± 2SE | max ± 2SE | средн. ± SD | ||
| Эксперимент Pr#1, 490°C, 1000 бар, длительность опыта 21 сут | |||||||
| 0.5m S | 2Py | 4.9 ± 0.4 | 17 ± 1 | 10 ± 7 | 5 ± 1 | 17 ± 1 | 10 ± 6 |
| 0.5m S + 15 мас. % NaCl | 3Py | 0.7 ± 0.1 | 40 ± 8 | 20 ± 21 | 15 ± 1 | 120 ± 6 | 55 ± 60 |
| 0.5m S + 35 мас. % NaCl | 4Py | 0.1 ± 0.1 | 20 ± 2 | 5 ± 8 | 140 ± 7 | 190 ± 12 | 160 ± 17 |
| 4н-Py | п.о. | 0.1 ± 0.1 | – | 150 ± 4 | 170 ± 6 | 160 ± 11 | |
| Py/Po + 15 мас. % NaCl | 5Py | 0.8 ± 0.1 | 3.2 ± 0.3 | 2 ± 1 | 20 ± 1 | 30 ± 2 | 20 ± 6 |
| 5Po | 3.0 ± 0.3 | 15 ± 4 | 10 ± 5 | 5 ± 2 | 20 ± 2 | 15 ± 5 | |
| Py/Po + 35 мас. % NaCl | 6Py | 4.8 ± 0.3 | 20 ± 2 | 10 ± 9 | 25 ± 2 | 120 ± 15 | 70 ± 70 |
| 0.5m S + 35 мас. % NaCl | 7Py | п.о. | 0.4 ± 0.1 | – | 158 ± 6 | 160 ± 8 | 160 ± 2 |
| Эксперимент Pr#2, 490°C, 1000 бар, длительность опыта 3 сут | |||||||
| Au (3 линии), ppmб | As (3 линии), ppmб | ||||||
| min ± 2SE | max ± 2SE | средн. ± SD | min ± 2SE | max ± 2SE | средн. ± SD | ||
| 0.5m S | 2Py | 6 ± 1 | 30 ± 5 | 15 ± 10 | 3 ± 2 | 50 ± 6 | 12 ± 15 |
| 0.5m S + 15 мас. % NaCl | 3Py | п.о. | 0.1 ± 0.1 | – | 70 ± 3 | 75 ± 6 | 70 ± 5 |
| 3н-Py | п.о. | 3 ± 1 | 0.8 ± 1.3 | 65 ± 5 | 75 ± 3 | 70 ± 4 | |
| 0.5m S + 35 мас. % NaCl | 4Py | п.о. | 8 ± 2 | 3.5 ± 3.3 | 60 ± 10 | 80 ± 15 | 70 ± 5 |
| 4н-Py | п.о. | 0.1 ± 0.1 | – | 65 ± 2 | 65 ± 2 | 65 ± 1 | |
| Py/Po + 15 мас. % NaCl | 5Py | п.о. | 0.1 ± 0.1 | 0.1 ± 0.1 | 60 ± 4 | 70 ± 3 | 65 ± 4 |
| 5Po | 4 ± 1 | 20 ± 2 | 10 ± 5 | 10 ± 5 | 50 ± 20 | 25 ± 10 | |
| Py/Po + 35 мас. % NaCl | 6Py | п.о. | 0.8 ± 0.3 | 0.5 ± 0.4 | 65 ± 10 | 70 ± 6 | 65 ± 1 |
| 6Po | 9 ± 1 | 25 ± 5 | 15 ± 5 | bdl | 40 ± 20 | 20 ± 10 | |
| Py/Po + 35 мас. % NaCl | 7Py | 35 ± 3 | 46 ± 2 | 40 ± 6 | 7900 ± 200 | 8800 ± 200 | 8000 ± 500 |
| 7н-Py | п.о. | 0.4 ± 0.1 | 0.2 ± 0.1 | 80 ± 5 | 1250 ± 70 | 320 ± 330 | |
| Au (3 линии), ppmб | As (3 линии), ppmб | ||||||
| min ± 2SE | max ± 2SE | средн. ± SD | min ± 2SE | max ± 2SE | средн. ± SD | ||
| Эксперимент Pr#3, 350°C, 1000 бар, длительность опыта 17 сут | |||||||
| +S(ж) | 0Py | 3.7 ± 0.4 | 12 ± 1 | 8 ± 3 | 6 ± 2 | 20 ± 3 | 15 ± 5 |
| +S(ж) + 15 мас. % NaCl | 1Py | 0.5 ± 0.1 | 7 ± 2 | 3 ± 3 | 4 ± 2 | 10 ± 2 | 7 ± 2 |
| +S(ж) + 35 мас. % NaCl | 2Py | bdl | 35 ± 10 | 15 ± 15 | 6 ± 3 | 15 ± 4 | 10 ± 3 |
| 3Py | bdl | 170 ± 90 | 30 ± 60 | 10 ± 3 | 25 ± 6 | 15 ± 4 | |
| Py/Po + 15 мас. % NaCl | 3а-Py | 1.2 ± 0.3 | 4.4 ± 1.2 | 2 ± 1 | 30 ± 3 | 70 ± 6 | 40 ± 20 |
| 3Po | 5 ± 1 | 110 ± 10 | 30 ± 30 | 30 ± 3 | 30 ± 4 | 30 ± 1 | |
| Py/Po + 35 мас. % NaCl | 4Py | 120 ± 5 | 210 ± 10 | 160 ± 45 | 5 ± 1 | 14 ± 2 | 10 ± 4 |
| 4Po | 1.9 ± 0.3 | 2.7 ± 0.3 | 2.2 ± 0.5 | 20 ± 3 | 90 ± 4 | 50 ± 40 | |
| +S(ж) + 15 мас. % NaCl | 5Py | 170 ± 5 | 400 ± 60 | 300 ± 100 | 160 ± 20 | 1100 ± 110 | 600 ± 300 |
| +S(ж) + 15 мас. % NaCl | 6Py | 140 ± 5 | 800 ± 300 | 320 ± 230 | 700 ± 40 | 3800 ± 90 | 1300 ± 1200 |
| +S(ж) + 35 мас .% NaCl | 7Py | 390 ± 10 | 470 ± 30 | 400 ± 60 | 4700 ± 150 | 6300 ± 250 | 5500 ± 1200 |
Примечание. а Py – пирит; н-Py – переотложенный пирит, кристаллизовавшийся на наружной стенке концейнера; a-Py – пирит со дна автоклава; Po – пирротин; б пределы обнаружения: Au LOD = 0.06 ppm, As LOD = 2.5 ppm; SE = среднеквадратичное отклонение отдельного измерения σ, SD = среднеквадратичное отклонение среднего σ × n–0.5; в включение золота: max 800 ± 230 ppm.
Фиг. 6.
СЭМ-изображения продуктов нескольких опытов по гидротермальному синтезу.
(a) Эксперимент Pr#1, обр. 2Py, 490°С/1000 бар, состав флюида 0.5m S; (б) Эксперимент Pr#1, обр. 3Py, 490°С/1000 бар, состав флюида 0.5m S + 15 мас. % NaCl; (в) Эксперимент Pr#1, обр. 4Py, 490°С/1000 бар, состав флюида 0.5m S + 35 мас. % NaCl. Слева – кристаллы из контейнера (обр. 4Ру), справа – кристаллы, отложившиеся из раствора на внешней стенке контейнера (обр. 4н-Ру); (г) Эксперимент Pr#1, смесь обр. 6Py и 6Po (смесь пирита и пирротина), 490°С/1000 бар, состав флюида 35 мас. % NaCl. Крупные кристаллы – пирит, мелкие – пирротин; (д) Эксперимент Pr#3, обр. 7Py, 350°С/1000 бар, состав флюида 0.2m S (+S(ж)) + 35 мас. % NaCl + As. Крупные кристаллы – пирит, мелкие – сера с примесью As.

По результатам рентгенофазового анализа фазовый состав сульфидов железа отвечает равновесному. В автоклавах, в которые загружалась элементарная сера в избытке по отношению к прекурсору, образовался пирит. При недостатке серы вместе с новообразованным пиритом присутствует пирротин. В одном опыте (опыт Pr#3, 350°С, образец 7Py) наряду с пиритом обнаружен марказит (~ 15% от общего количества твердой фазы). Присутствие пирита и пирротина подтверждено данными СЭМ и РСМА.
В системах без NaCl (первый автоклав в каждой серии опытов) порошок пирита – тонкозернистый, размер зерен от десятых долей до нескольких мкм (фиг. 6). Среднее содержание Au в пирите близко к 10 ppm и не зависит от условий синтеза. Характер распределения Au равномерный (фиг. 7), хотя в пределах зерен встречаются зоны, обогащенные и обедненные Au. Пробы содержат следы As, однако при таких невысоких (до 10 ppm в среднем) содержаниях As не влияет на структурно-химическое состояние и содержание Au (Filimonova et al., 2020).
Фиг. 7.
Профили лазерной абляции для синтетического пирита и пирротина. Серия Pr#1, 490°C/1000 бар, длительность 21 сут. Синтез в окисленной системе (H2S(р-р) и SO2(р-р) присутствуют в сопоставимых количествах). Номер образца отвечает номеру в табл. 4 и Приложении 2 (см. Дополнительные материалы). Py – пирит, 4н-Py – зерна пирита образовались на внешней стенке контейнера.

Добавка NaCl принципиальным образом меняет характер распределения Au, которое становится неравномерным (ср. профили лазерной абляции, фиг. 7, обр. 3Ру, 4Ру). Как следует из данных табл. 4, неравномерность распределения сказывается на увеличении разброса измеренных содержаний Au: среднеквадратичное отклонение превышает измеренные значения, причем разброс содержаний Au увеличивается по мере роста концентрации соли. Появляются “спайки” – резкие пики на временных развертках сигнала ЛА ИСП МС, которые могут быть связаны с присутствием субмикронных включений металлического Au. Уменьшение длительности опыта (опыт Pr#2 по сравнению с опытом Pr#1, 490°С) в системах с NaCl приводит к снижению среднего содержания Au и увеличивает разброс концентраций. Можно полагать, что длительность серии Pr#2 (3 сут.) недостаточна для достижения стационарных содержаний Au в пирите в присутствии NaCl.
Интересное наблюдение можно сделать из данных для зерен пирита, переотложенных гидротермальным флюидом на внешних стенках контейнера. В табл. 4 и на фиг. 7 эти образцы маркированы буквой н – наружный по отношению к положению прекурсора в контейнере (обр. 3н-Ру, 4н-Ру, 7н-Ру). Из раствора кристаллизуются крупные (~0.5 мм) хорошо ограненные зерна пирита (СЭМ-изображение на фиг. 6в). Во всех переотложенных зернах обнаружены лишь следы Au. Таким образом, в результате перекристаллизации, которая приводит к росту структурного порядка и снижению количества дефектов, образуется свободный от примесного Au пирит даже в присутствии металла.
В окисленной сульфидной системе (пирротин отсутствует), в которой окислительный потенциал контролируется реакцией (4) диспропорционирования серы, среднее содержание Au практически не зависит от температуры и солености, и составляет от единиц до 20 ppm (при резко неравномерном распределении в присутствии NaCl) (фиг. 11а). В присутствии пирротина, когда pH растет до близнейтральных значений, а окислительный потенциал снижается и контролируется парой пирит-пирротин, распределение Au в пирите приближается к равномерному. Одновременно существенно растет концентрация Au в пирите, выращенном при средней температуре 350°С (30–160 ppm) по сравнению с концентрацией Au в пирите, выращенном при высокой температуре 490°С (2–10 ppm). При этом в обеих сериях опытов, при 350 и 490°С, содержание Au в пирите растет пропорционально содержанию NaCl в растворе (фиг. 11б).
Фиг. 8.
Профили лазерной абляции для синтетического пирита и пирротина. Серия Pr#1, 490°C/1000 бар, длительность 21 сут. Синтез в восстановительных условиях (сульфидная сера преобладает, буфер пирит–пирротин). Номер образца отвечает номеру в табл. 4 и в Приложении 2 (см. Дополнительные материалы). Py – пирит, Pо – пирротин.
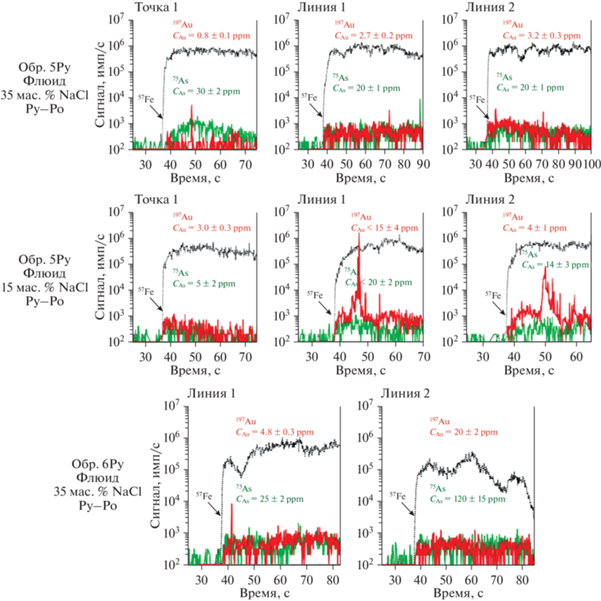
Фиг. 9.
Выборочные профили лазерной абляции для синтетического пирита. Серия Pr#3, 350°C/1000 бар, длительность17 сут. Синтез в восстановительных условиях (сульфидная сера преобладает, буфер пирит–пирротин). Номер образца отвечает номеру в табл. 4 и Приложении 2 . Py – пирит, Pо – пирротин.

Фиг. 10.
Выборочные профили лазерной абляции для синтетического пирита, к прекурсору добавлен As. Серия Pr#3, 350°C/1000 бар, длительность17 сут. Синтез в восстановительных условиях (сульфидная сера преобладает, буфер пирит–пирротин). Номер образца отвечает номеру в табл. 4 и Приложении 2 . Py – пирит.

Фиг. 11.
Концентрации золота в пирите при разных температурах опыта в зависимости от концентрации NaCl. (а) – активность форм серы контролируется реакциями диспропорционирования элементарной серы; (б) – активность форм серы задает пара пирит-пирротин.

Мышьяк влияет на содержание и распределение Au при его концентрации от нескольких сотен ppm и выше. При низких содержаниях As (~150 ppm и ниже) присутствие этой примеси не влияет на поведение Au в пирите. В присутствии нескольких сотен ppm As распределение Au становится существенно более равномерным, а концентрации Au и As в большинстве случаев прямо коррелируют (см. профили ЛА ИСП МС на фиг. 10). При 350°С концентрация Au в пирите достигает 400 ppm для С(As) ~ 0.6 мас. %. При добавлении нескольких мас. % As к прекурсору в продуктах синтеза появляется As–S фаза. Следует отметить, что и в системе с As переотложенный флюидом пирит содержит существенно меньше примесей – As и Au – по сравнению с пиритом, образовавшимся непосредственно по пирротину. В опыте Pr#2 образцы 7Py и 7н-Py отвечают соответственно первичному и переотложенному пириту. Содержания As и Au (табл. 4) в первичном пирите составляют 8000 ± 500 (As)/40 ± 6 ppm (Au), а в переотложенном на внешней стенке контейнера 320 ± 330 (As)/0.2 ± 0.1 ppm (Au). Из этих данных видно, что перекристаллизация влияет и на характер распределения As и Au, которое становится неравномерным.
Ряд проб пирита, помимо Au и As, содержит Sb и Pt (дополнительные материалы, Приложение 2 ). Содержание Sb составляет первые ppm и может достигать 200 ppm в пробах с высоким содержанием As. Содержание Pt составляет от десятых ppm до 15 ppm. Эти элементы были внесены в систему из-за загрязнения контейнеров и автоклавов продуктами предыдущих серий опытов, или вместе с As. Отметим, что пирит месторождений золота Дарасунского рудного поля также содержит первые десятки ppm Sb. Равномерный в большинстве случаев характер распределения Sb и Pt по зернам пирита свидетельствует об образовании твердого раствора, что согласуется с полученными нами ранее данными о состоянии примесей этих элементов в пирите (Filimonova et al., 2020). Присутствие этих элементов не сказывается на поведении Au в пирите.
Поведение Au в пирротине имеет обратный характер по сравнению с поведением Au в пирите. Рост температуры приводит к увеличению содержания Au в пирротине (до 10 ppm при 490°С) и к более равномерному распределению Au по зернам пирротина и их агрегатам. Коэффициент распределения KD(AuPy/Po) снижается с 70 при 350°С до 0.2 при 490°С, т.е. золото обогащает пирротин относительно пирита по мере роста температуры.
Таким образом, можно отметить следующие черты поведения Au и As в изученных системах:
1) При параметрах опытов (350–490°С/1000 бар) содержание Au в пирите в системе без NaCl составляет ~8–15 ppm при характере распределения, близком к равномерному.
2) В окисленной сульфидной системе (сульфидная H2S и сульфитная SO2 формы серы присутствуют в сопоставимых концентрациях) введение в систему NaCl приводит к неравномерному характеру распределения Au по зернам пирита, разброс содержаний Au увеличивается по мере роста концентрации соли. Средние содержания Au составляют от единиц до 20 ppm.
3) В присутствии буфера пирит–пирротин (сульфидная сера доминирует, рН близнейтральный) распределение Au по зернам пирита близко к равномерному, содержание Au возрастает от первых ppm до ~ 100 ppm при снижении температуры от 490 до 350°С. Содержание Au в пирите возрастает пропорционально увеличению концентрации NaCl в растворе.
4) Присутствие высоких концентраций As в пирите (>~n × 100 ppm) приводит к росту содержания Au при равномерном характере распределения обоих элементов, содержание Au составляет до 400 ppm при содержании As около 0.6 мас. %.
5) Гидротермальная перекристаллизация и укрупнение зерен пирита приводят к снижению содержаний Au и As в новообразованном пирите по сравнению с пиритом, образовавшимся непосредственно по прекурсору – троилиту.
6) Золото обогащает пирротин по сравнению с сосуществующим пиритом по мере роста температуры, его содержание в пирротине достигает 10 ppm при 490°С при распределении, близком к равномерному.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эксперименты по синтезу пирита и пирротина
Полученные данные и их сопоставление с результатами, опубликованными ранее, позволяют существенно продвинуться в понимании поведения Au в процессах пиритообразования. Ранее было показано, что Au в пирите способно образовывать твердый раствор с замещением атома железа (Trigub et al., 2017а; Filimonova et al., 2018, 2020; Merkulova et al., 2019). При этом Au находится в октаэдрическом окружении атомов S. Образование твердого раствора по этой схеме установлено в системе без As и при содержаниях As <~ 0.5–1 мас. %. Максимальное содержание Au в пирите, установленное в работах (Trigub et al., 2017а; Filimonova et al., 2020) для параметров наших опытов (350–490°С) составляет от десятков до ~100 ppm, зависимость содержания Au от температуры – ретроградная.
Порошки тонкозернистого пирита, синтезированные в настоящей работе в системе без NaCl, содержат около 10 ppm Au, что удовлетворительно согласуется с предсказанными содержаниями. Отсутствие зависимости растворимости Au в пирите от температуры может быть связано с разницей в содержании S: при 350°С флюид содержал в 2.5 раза меньше серы, чем при 490°С (0.2m и 0.5m, соответственно).
Настоящая работа дополняет полученные ранее данные для сульфидной системы, позволяя проследить влияние хлоридов на состояние Au в пирите. В окисленной системе, где растворенная S присутствует в виде H2S(р-р) и SO2(р-р) в сопоставимых концентрациях, характер распределения Au по зернам пирита меняется на сильно неравномерное при добавке NaCl. Это может быть связано с двумя факторами.
Первый определяется более совершенным характером зерен пирита по сравнению с системой без NaCl (ср. фиг. 6а, б). Из результатов анализа минералов природных руд и экспериментальных данных (например, Deditius et al., 2014; Trigub et al., 2017а) известно, что крупнокристаллический пирит содержит существенно меньше Au по сравнению с тонкозернистым пиритом, который не подвергался метаморфизму и перекристаллизации. В наших опытах в кислых растворах NaCl, благодаря возросшей концентрации железа из-за образования хлоридных комплексов, существенно возрастает скорость гидротермальной перекристаллизации пирита. Образуются более крупные кристаллы по сравнению с опытами без NaCl. Самые крупные кристаллы с крайне неравномерным распределением Au при низких его содержаниях отлагаются из раствора на внешних стенках контейнеров с твердой фазой. Наиболее сильно влияние перекристаллизации выражено в образце 7н-Py серии Pr#2, в котором переотложенный на внешней стенке контейнера пирит содержит в 200 раз меньше Au по сравнению с пиритом из контейнера 7Py, образовавшимся непосредственно по троилиту (0.2 ± 0.1 ppm (7н-Py) против 40 ± 6 ppm (7Py)). Отметим, что этот опыт был выполнен с введением в систему As, содержание которого при перекристаллизации также снизилось. Вполне вероятно, что при перекристаллизации снижается количество дефектов (например, ОH– и HS– групп; Фадеев, Козеренко, 1999), необходимых для компенсации заряда при образовании золотоносного пирита, что обуславливает неравномерное распределение и низкие содержания Au. Таким образом, перекристаллизация с образованием зерен пирита с более совершенной структурой может объяснить наблюдаемое изменение состояния и снижение содержания Au в пирите.
Этими же факторами – кинетикой образования зерен “совершенного” пирита без примесей и изменением состава комплексов водного раствора – можно объяснить и состояние Au в пирите в восстановительных условиях, когда пирит сосуществует с пирротином. Ранее было установлено, что скорость образования пирита максимальна в окислительных условиях и существенно снижается в восстановительной среде (Зотов, Русинов, 1969). С этим может быть связан более равномерный по сравнению с пиритом окисленной системы (пирротин отсутствует) характер распределения Au и его повышенные содержания – скорость образования “совершенного” пирита в равновесии с пирротином ниже, чем в окисленной системе без пирротина. Следовательно, большее количество дефектов структуры пирита, сосуществующего с пирротином, может приводить к его обогащению Au по сравнению с более “совершенным” пиритом окисленной системы. Отметим, что пирит в присутствии пирротина более тонкозернистый, что согласуется с нашим предположением. Температура тоже влияет на скорость химических реакций. В наших опытах в восстановительных условиях (пирит + пирротин) концентрация Au в пирите снижается при увеличении температуры (фиг. 11б). Поскольку скорости реакций, включая реакции пиритообразования, растут с увеличением температуры, пирит при 490°С более “совершенный” и содержит меньше Au по сравнению с 350°С. Другой фактор может быть связан с формами нахождения Au в растворе. При 350°С основная форма нахождения Au – нейтральный комплекс AuHS(р-р), а при 490°С – отрицательно заряженные комплексы (табл. 3). Известно, что в гидротермальных растворах поверхность пирита заряжена отрицательно (Widler, Seward, 2002). Следовательно, адсорбция нейтрального комплекса AuHS(р-р) предпочтительна по сравнению с адсорбцией анионов ${\text{AuCl}}_{2}^{ - }$ и ${\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - }$. Как показано в работе (Widler, Seward, 2002), 100% Au адсорбировалось на пирите в области преобладания AuHS(р-р), и только 30% – в области преобладания отрицательно заряженного ${\text{Au}}\left( {{\text{HS}}} \right)_{2}^{ - }$. Преимущественной адсорбцией нейтральных частиц на отрицательно заряженной поверхности можно объяснить существенный рост содержания Au в среднетемпературном (350°С) пирите относительно высокотемпературного (490°С).
В наших опытах As начинает влиять на содержание и характер распределения Au в пирите при С(As) ~ 500 ppm. Мы полагаем, что это связано с образованием доменов леллингито- или арсенопиритоподобных структур в матрице пирита при высоких С(As) (Filimonova et al., 2020). При более низких содержаниях As его примесь не влияет на состояние Au и положительной корреляции С(Au)–С(As) не наблюдается. Согласно литературным данным, рост концентрации Au в пирите месторождений типа Карлин и золото-сульфидного типа происходит при С(As) > ~1 мас. % (напр., Ковальчук и др., 2020). Возможно, на начало появления корреляционной связи содержаний As и Au влияет высокая концентрация хлоридов во флюидной фазе, и рост солености смещает начало появления связи Au–As в область пониженных концентраций As.
Высокое содержание Au в пирротине, сосуществующем с пиритом при 490°С, можно связать с образованием твердого раствора, в котором Au замещает Fe. Опубликованные данные по Pt предполагают, что в пирротине компенсация заряда может осуществляться путем образования вакансий в катионной подрешетке, количество которых растет при увеличении температуры и летучести серы (Filimonova et al., 2021). Такой механизм образования твердого раствора Au–Fe1 – xS, в отличие от пирита, не требует замещений атомов серы на однозарядные анионы OH– и HS–. Соответственно, рост температуры приводит к расширению поля устойчивости твердого раствора и росту содержания Au в пирротине, сосуществующем с пиритом.
Распределение Au между флюидом и пиритом
Полученные данные позволяют сделать следующие выводы о зависимости коэффициента распределения Au между гидротермальным флюидом и пиритом (KD(AuFl/Py), последняя колонка в табл. 3) от состава и РТ-параметров системы.
1) В системе без добавки соли KD(AuFl/Py) составляет от 0.03 (490°С, эксперимент Pr#2) до 0.1 (350°С, эксперимент Pr#3), то есть Au обогащает пирит по сравнению с флюидом.
2) В системе с NaCl в окислительных условиях (S присутствует в виде H2S(p-p) и SO2(p-p), пирротин отсутствует) пирит теряет Au и KD(AuFl/Py) растет, находясь в пределах от 3 до 20. Сильно неравномерное распределение Au по зернам пирита не позволяет оценить влияние температуры и солености флюида. Можно говорить о том, что в среднем KD(AuFl/Py) ~ 10, то есть в окисленной системе флюид на порядок обогащен Au по сравнению с пиритом.
3) В окислительных условиях при С(As) > > n100 ppm, за счет роста содержания Au в пирите при высоких содержаниях As, KD(AuFl/Py) снижается до 0.1–0.2. Таким образом, при содержании As в пирите 0.1–0.6 мас. % содержание Au в пирите на порядок выше его содержания в сосуществующем флюиде.
4) В восстановительных условиях (пара пирит–пирротин) значение KD(AuFl/Py) составляет от 0.3–0.4 (350°С) до 1–3 (490°С) и отвечает тенденции к снижению растворимости золота в пирите при росте температуры (фиг. 11б). Эти данные позволяют предположить, что в восстановительной обстановке Au обогащает пирит по отношению к флюиду по мере снижения температуры. Однако, из-за небольшого числа опытов и большого разброса данных по растворимости Au во флюидной фазе, к этому предположению следует относиться осторожно. Поскольку в минеральных ассоциациях месторождений золота Дарасунского рудного поля присутствует ассоциация пирит–пирротин, в качестве грубой оценки можно считать, что в этих условиях KD(AuFl/Py) меняется от первых сотых (Дарасун) до единицы (Талатуй).
Сравнение результатов эксперимента и природных данных
Низкие C(As). При невысоких содержаниях As до ~200 ppm высокотемпературный природный пирит месторождения Талатуй содержит 0.1–1 ppm Au, причем Au и As ведут себя независимо. В пирите месторождения Дарасун (фиг. 4а) низким содержаниям As отвечает только одна точка при С(As) ~200 ppm, в которой содержание Au значительно ниже общего тренда. В наших опытах при С(As) < ~200 ppm концентрация Au в пирите, сосуществующем с пирротином, также не зависит от С(As) и при 490°С составляет 2–10 ppm. Таким образом, максимальные концентрации Au в природном пирите (~1 ppm) в 2–10 раз ниже определенных в синтетических пробах. Можно полагать, что эта относительно небольшая разница между природным и синтетическим пиритом – результат перекристаллизации природного пирита и/или его кристаллизации из ненасыщенного по Au флюида. Кроме того, согласно экспериментальным данным, содержание Au сильно зависит от солености флюида (фиг. 11б). Разница концентраций NaCl в природном и экспериментальном флюидах также может быть причиной разной золотоносности пирита. Отметим, что область концентраций As, для которой отсутствует корреляционная связь Au–As, по экспериментальным данным совпадает с данными для пирита месторождения Талатуй и не превышает первых сотен ppm As (фиг. 4а).
Отсутствие положительной корреляционной связи Au–As при низкой концентрации As, вероятно, определяется формами нахождения этих элементов в пирите. Согласно результатам изучения золотоносного пирита методом рентгеновской спектроскопии поглощения (XAS), при низкой концентрации As (<0.5–1 мас. %) при замещении Fe→Au состав первой координационной сферы катиона не меняется – это октаэдр из атомов S (Filimonova et al., 2020). Мышьяк при этом замещает S, но отсутствует в ближайших координационных сферах Au. Кроме изоморфного твердого раствора, другой формой нахождения Au в пирите могут быть кластеры состава, близкого к Au2S, образование которых также не связано с мышьяковистостью пирита. Поэтому при низких концентрациях мышьяка в пирите Au и As ведут себя независимо.
Высокие C(As). Относительно высокие содержания As в пирите, синтезированном как при 350°С (эксперимент Pr#3), так и при 490°С (эксперимент Pr#2), привели к росту содержания Au. Результаты опытов позволяют грубо оценить концентрацию As, при которой присутствие этого элемента начинает сказываться на поведении Au в пирите, в первые сотни ppm. Эта оценка совпадает с появлением положительной корреляционной связи Au–As в пирите месторождения Талатуй. Вместе с тем, содержания Au, определенные в синтетическом пирите, значительно превышают золотоносность пирита природных руд. Например, в природном пирите обоих месторождений при С(As) ~ 1000 ppm максимальное содержание Au находится в пределах 1–10 ppm (фиг. 4а). В синтетическом пирите при такой концентрации As растворимость Au при 350°С составляет ~300 ррm (табл. 4). Можно предположить, что причины этих расхождений – перекристаллизация природного золотоносного пирита с выделением Au в виде металла. Этому процессу отвечает мышьяковистый пирит образца 7н-Py опыта Pr#2, кристаллизовавшийся из гидротермального флюида на внешней стенке контейнера с исходной фазой. Перекристаллизация из раствора привела к ~200-кратному снижению содержания Au по отношению к первичному пириту (обр. 7Py).
При равных концентрациях As содержание Au в пирите месторождения Талатуй существенно выше, чем на месторождении Дарасун (фиг. 4а, табл. 2). По результатам изучения флюидных включений, температура рудообразования и соленость гидротермального флюида на месторождении Талатуй выше, чем на месторождении Дарасун. Таким образом, природный пирит, образовавшийся при более высокой температуре и солености флюида (Талатуй), содержит больше Au по сравнению со среднетемпературным пиритом (Дарасун). Как следует из результатов опытов, рост температуры и солености рудоносного флюида по-разному сказывается на золотоностности пирита. Рост температуры приводит к снижению содержания Au, а рост концентрации хлоридов – к его увеличению (фиг. 11б). Можно предположить, что разнонаправленное действие этих двух факторов сказалось на поведении золота в пирите природных руд. Концентрация хлоридов во флюидах основной продуктивной стадии (стадия 2, табл. 1) месторождения Талатуй (T ~ ~ 269–438°C) в среднем более чем в два раза выше, чем на месторождении Дарасун (T ~ 160–383°C). Поэтому снижение золотоносности пирита при росте температуры может компенсироваться ростом концентрации Au за счет увеличения солености флюида.
B качестве основных факторов, которые обуславливают поведение Au в золотоносном пирите месторождений Талатуй и Дарасун, могут рассматриваться i) кристаллизация из ненасыщенных по Au флюидов, ii) перекристаллизация и укрупнение первичного пирита с высвобождением Au в виде металла и iii) разница в содержании растворенных хлоридов.
ВЫВОДЫ
В настоящем исследовании сделана попытка интерпретировать поведение Au при образовании золоторудных месторождений Талатуй и Дарасун (Восточное Забайкалье) путем сравнения результатов изучения месторождений с данными опытов по синтезу золотоносного пирита. Опыты по гидротермальному синтезу выполнены при температуре 350 и 490°С и давлении 1000 бар. Концентрация NaCl составляла 0, 15 и 35 мас. %. В ряде опытов в систему вводился As. В результате получены образцы пирита, содержание Au в котором менялось от предела обнаружения методом ЛА ИСП МС (в среднем 0.06 ppm) до 400 ppm. Концентрация As в синтезированном пирите варьировала от 10 до 8000 ppm, что отвечает составу природного пирита. В восстановительных условиях, в присутствии буфера пирит–пирротин (сульфидная сера доминирует) распределение Au по зернам пирита близко к равномерному, а содержание Au возрастает в среднем от первых ppm до ~100 ppm при снижении температуры от 490 до 350°С. Рост концентрации хлоридов приводит к увеличению концентрации Au. Таким образом, падение содержания Au в пирите при росте температуры может компенсироваться увеличением золотоносности пирита с ростом концентрации хлоридов. При высоких концентрациях As, C(As) > > n × 100 ppm, происходит рост содержания Au при равномерном характере распределения обоих элементов, содержание Au составляет до 400 ppm при содержании As на уровне ~0.6 мас. %. Гидротермальная перекристаллизация и укрупнение зерен пирита приводят к снижению содержания Au и As в новообразованном пирите по сравнению с пиритом, образовавшимся непосредственно по прекурсору – троилиту.
В целом содержание Au в синтетическом пирите превышает концентрации металла в пирите природных руд. Это может быть обусловлено кристаллизацией из ненасыщенных по Au флюидов, а также перекристаллизацией и укрупнением природного пирита. Природный пирит, образовавшийся при более высокой температуре и солености флюида (Талатуй), при одинаковой мышьяковистости, содержит больше Au по сравнению со среднетемпературным (Дарасун). Согласно результатам опытов, высокие содержания NaCl в высокотемпературных рудах месторождения Талатуй стабилизируют “невидимое” Au и могут привести к росту содержания Au по сравнению с пиритом среднетемпературного месторождения Дарасун с пониженным содержанием хлоридов во флюиде. В области низких концентраций As, менее первых сотен ppm, в пирите месторождения Талатуй содержание Au не зависит от C(As) и составляет от десятых долей до 1 ppm, а при C(As) > n × 100 ppm содержания Au и As прямо коррелируют. В пирите месторождения Дарасун содержания Аu и As коррелируют во всей области концентраций As, от первых сотен ppm до 1 мас. %. Такое поведение Au согласуется с результатами опытов: положительная корреляционная связь Au–As появляется, начиная с первых сотен ppm As.
Список литературы
Акинфиев Н.Н., Зотов А.В. Термодинамическое описание водных компонентов системы Cu–Ag–Cu–S–O–H в диапазоне температур 0–600°С и 1–3000 бар // Геохимия. 2010. № 7. С. 761–767.
Бортников Н.С., Кабри Л., Викентьев И.В., Тагиров Б.Р., Мак Мэйхон Г., Богданов Ю.А., Ставрова О.О. Невидимое золото в сульфидах субмаринных колчеданных построек // Геология руд. месторождений. 2003. Т. 45. № 3. С. 228–240.
Геологическое строение Читинской области. Объяснительная записка к геологической карте масштаба 1 : 500 000. Ответственные редакторы И.Г. Рутштейн, Н.Н. Чабан. Комитет по геологии и использованию недр Читинской области. Чита, 1997. 239 с.
Зотов А.В., Русинов В.Л. Влияние кинетических факторов на условия образования пирита и марказита // Очерки физико-химической петрологии. Ред. В.А. Жариков, А.А. Маракушев, Л.Л. Перчук. Т. 1. М.: Наука, 1969. С. 54−61.
Ковальчук E.B., Тагиров Б.Р., Викентьев И.В., Чареев Д.А., Тюкова Е.Э., Никольский М.С., Борисовский С.Е., Бортников Н.С. “Невидимое” золото в синтетических и природных кристаллах арсенопирита (Воронцовское месторождение, Северный Урал) // Геология руд. месторождений. 2019. Т. 61. №. 5. С. 62–83.
Ковальчук Е.В., Тюкова Е.Э., Борисовский С.Е., Викентьев И.В., Аристов В.В., Сидорова Н.В., Абрамова В.Д., Тагиров Б.Р. “Невидимое” золото в пирите месторождений Воронцовское (Урал) и Павлик (Колыма) // В сб. “Породо-, минерало- и рудообразование: достижения и перспективы исследований. Труды к 90-летию ИГЕМ РАН”. Электронный ресурс. М.: ИГЕМ РАН, 2020. С. 144−147.
Ляхов Ю. В. Температурная зональность Дарасунского месторождения // Геология руд. месторождений. 1975. № 2. С. 28−36.
Прокофьев В.Ю., Бортников Н.С., Зорина Л.Д., Куликова З.И., Матель Н.Л., Колпакова Н.Н., Ильина Г.Ф. Генетические особенности золото-сульфидного месторождения Дарасун (Восточное Забайкалье, Россия) // Геология руд. месторождений. 2000. Т. 42. № 6. С. 526–548.
Прокофьев В.Ю., Бортников Н.С., Коваленкер В.А., Винокуров С.Ф., Зорина Л.Д., Чернова А.Д., Кряжев С.Г., Краснов А.Н., Горбачева С.А. Золоторудное месторождение Дарасун (Восточное Забайкалье, Россия): химический состав, распределение редких земель, изучение стабильных изотопов углерода и кислорода в карбонатах рудных жил // Геология руд. месторождений. 2010. № 2. С. 91–125.
Прокофьев В. Ю., Зорина Л. Д., Коваленкер В. А., Акинфиев Н. Н., Бакшеев И. А., Краснов А. Н., Юргенсон Г. А., Трубкин Н. В. Состав, условия формирования руд и генезис месторождения золота Талатуй (Восточное Забайкалье, Россия) // Геология руд. месторождений. 2007. Т. 49. № 1. С. 37–76.
Сахарова М. С. Стадийность процессов рудообразования и вопрос зональности на Дарасунском золоторудном месторождении // Рудообразование и его связь с магматизмом. Отв. ред. Ивенсен Ю. П. М.: Наука. 1972. С. 213−222.
Тимофеевский Д. А. Геология и минералогия Дарасунского золоторудного региона. Труды ЦНИГРИ, вып. 98. М. 1972. 260с.
Фадеев В.В., Козеренко С.В. Золото в процессах пиритообразования. Сообщение 1. Концентрирование золота в процессах пиритообразования // Геохимия. 1999. № 12. С. 1313−1322.
Чернышев И. В., Прокофьев В.Ю., Бортников Н.С., Чугаев А.В., Гольцман Ю.В., Лебедев В.А., Ларионова Ю.О., Зорина Л.Д. Возраст гранодиорит-порфиров и березитов Дарасунского золоторудного поля (Восточное Забайкалье, Россия) // Геология руд. месторождений. 2014. Т. 56. № 1. С. 3–18.
Cabri L.J., Chryssoulis, S.L., De Villiers J.P.R., Laflamme J.H.G., Buseck P.R. The 'nature of “invisible” gold in arsenopyrite // Can. Mineral. 1989. V. 27. P. 3−362.
Cabri L.J., Chryssoulis S.L., Campbell J.L., and Teesdale W.J. Comparison of in-situ gold analyses in arsenian pyrite // J. Applied Geochemistry. 1991. V. 6. P. 225−230.
Cathelineau M., Boiron M.C., Holiger P., et al. Gold arsenopyrite: crystal_chemistry, location and state, physical and chemical conditions of deposition // Econ. Geol. Mon. 6. 1989. P. 328–341.
Deditius A.P., Reich M., Kesler S.E., Utsunomiya S., Chryssoulis C.L., Walshe J., Ewing R.C. The coupled geochemistry of Au and As in pyrite from hydrothermal ore deposits // Geochim. Cosmochim. Acta. 2014. 140. P. 644–670.
Driesner T. The system H2O–NaCl. II. Correlations for molar volume, enthalpy, and isobaric heat capacity from 0 to 1000°C, 1 to 5000 bar, and 0 to 1 XNaCl // Geochim. Cosmochim. Acta. 2007. 71. 4902−4919.
Filimonova O., Trigub A., Nickolsky M., Kovalchuk E., Rovezzi M., Belogub E., Tagirov B. X-ray absorption spectroscopy study of the chemistry of As and Au in arsenian pyrites // Proc. of the 16th International Conference on “Experimental Mineralogy, Petrology and Geochemistry” EMPG XVI. June 17–21. 2018. Clermond-Ferrand, France. P. 63.
Filimonova O.N., Tagirov B.R., Trigub A.L., Nickolsky M.S., Rovezzi M, Belogub E.V., Reukov V.L., Vikentyev I.V. The state of Au and As in pyrite studied by X-ray absorption spectroscopy of natural minerals and synthetic phases // Ore Geol. Rev. 2020. 121. 103475. (doi:).https://doi.org/10.1016/j.oregeorev.2020.103475
Filimonova O.N., Trigub A.L., Nickolsky M.S., Chareev D.A., Kvashnina K.O., Kovalchuk E.V., Vikentyev I.V., Reukov V.L., Tagirov B.R. The state of platinum in pyrrhotite: X-ray absorption spectroscopy study and implications for the role of Fe sulphides as platinum carriers // Mineral. Mag. 2021. V. 85. P. 846–861.
Genkin A.D., Bortnikov N.S., Cabri L. et al. A multidisciplinary study of invisible gold in arsenopyrite from four mesothermal gold deposits in Siberia, Russian Federation // Econ. Geol. 1998. V. 93. P. 463–487.
Large R.R., Maslennikov V.V. Invisible Gold Paragenesis and Geochemistry in Pyrite from Orogenic and Sediment-Hosted Gold Deposits // Minerals. 2020. 10 (4). 339. https://doi.org/10.3390/min10040339
Prokofiev V.Y., Bortnikov N.S., Kovalenker V.A., Zorina L.D., Baksheev I.A., Grichuk D.V., Krasnov A.N., Selector S.L. Vertical mineralogical-geochemical zoning of Mesozoic Transbaikalia fluid-magmatic gold systems // Large igneos Provinces of Asia, Mantle Plumes and Metallogeny. Abstracts of the international symposium. Novosibirsk, 2009. P. 251–254.
Prokofiev V.Yu., Garofalo P.S., Bortnikov N.S., Kovalenker V.A., Zorina L.D., Grichuk D.V., Selektor S.L. Fluid Inclusion Constraints on the Genesis of Gold in the Darasun District (Eastern Transbaikalia), Russia // Econ. Geol. 2010. V. 105. № 2. P. 395–416.
Prokofiev V.Yu., Selector S.L. Fluid inclusion evidence for barbotage and its role in gold deposition at the Darasun goldfield (eastern Transbaykalia, Russia) // Cent. Eur. J. Geosci. 2014. V. 6. № 2. P. 131–138.
Reich M., Utsunomiya S., Kesler S., Wang L., Ewing R.C., and Becker U. Thermal behavior of metal nanoparticles in geologic materials // Geology. 2006. 34. P. 1033–1036.
Simon G., Kesler S.E., Chryssoulis S. Geochemistry and textures of gold-bearing arsenian pyrite, Twin Creeks, Nevada: Implications for deposition of gold in Carlin-Type deposits // Econ. Geol. 1999. V. 94. P. 405−422.
Trigub A.L., Tagirov B.R., Kvashnina K.O., Chareev D.A., Nickolsky M.S., Shiryaev A.A., Baranova N.N., Kovalchuk E.V. and Mokhov A.V. X-ray spectroscopy study of the chemical state of “invisible” Au in synthetic minerals in the Fe–As–S system // Am. Mineral. 2017a. V. 102. P. 1057–1065.
Trigub A.L., Tagirov B.R., Kvashnina K.O., Lafuerza S., Filimonova O.N., Nickolsky M.S. Experimental determination of gold speciation in sulfide-rich hydrothermal fluids under a wide range of redox conditions // Chemical Geology. 2017b. 471. P. 52–64.
Widler A.M., Seward T.M. The adsorption of gold(I) hydrosulphide complexes by iron sulphide surfaces // Geochim. Cosmochim. Acta. 2002. 66. P. 383–402.
Wilson S.A., Ridley W.I., Koenig A.E. Development of sulfide calibration standards for the laser ablation inductively-coupled plasma mass spectrometry technique // J. Anal. Atom. Spectrom. 2002. T. 17. № 4. C. 406–409.
Wohlgemuth-Ueberwasser C.C., Ballhaus C., Berndt J., Stotter née Paliulionyte V., Meisel T. Synthesis of PGE sulfide standards for laser ablation inductively coupled plasma mass spectrometry (LA-ICP-MS) // Contrib. Mineral Petrol. 2007. 154. P. 607–617.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Геология рудных месторождений