Вопросы ихтиологии, 2019, T. 59, № 1, стр. 28-32
Обыкновенная малоротая корюшка Hypomesus olidus (Osmeridae) – новый вид для фауны Баренцева моря
А. П. Новоселов 1, 2, *, А. В. Кондаков 2, 3, М. Ю. Гофаров 2, 3, И. Н. Болотов 2, 3
1 Северный филиал Полярного научно-исследовательского института рыбного хозяйства и океанографии − СевПИНРО
Архангельск, Россия
2 Федеральный исследовательский центр комплексного изучения Арктики РАН − ФИЦКИА
Архангельск, Россия
3 Северный (Арктический) федеральный университет − САФУ
Архангельск, Россия
* E-mail: alexander.novoselov@rambler.ru
Поступила в редакцию 01.08.2017
После доработки 03.08.2017
Принята к публикации 12.10.2017
Аннотация
Приводятся данные об обнаружении многочисленной популяции малоротой колюшки Hypomesus olidus вне общепринятых границ естественного ареала – к западу от Уральских гор, на юго-востоке Баренцева моря. На основе молекулярно-генетического анализа гена Сyt b установлено, что европейские особи идентичны или близки к таковым из тихоокеанских популяций Камчатки. Это свидетельствует о значительных способностях вида к широкому расселению и его недавней (послеледниковой) экспансии в Европу вдоль побережья Северного Ледовитого океана.
Интерес к вопросу о распространении обыкновенной малоротой корюшки Hypomesus olidus и границах её естественного ареала возник в связи с формированием списка редких и малочисленных видов рыб, занесённых в Красную книгу Ненецкого автономного округа (Новоселов, 2006). В литературе было единственное упоминание о нахождении этого вида в бассейне р. Кара в материалах Карской экспедиции 1945–1946 гг. (Иванова, 1952). На этом основании она была внесена в региональный краснокнижный список с категорией 3 (R) как редкий вид – реликт межледникового периода (Кудерский, 1987) с естественно низкой численностью, обитающий на краю ареала (Новоселов, 2006).
Современные биогеографические модели показывают, что род Hypomesus возник в северо-западной части Тихого океана, а его ранняя диверсификация, скорее всего, происходила под влиянием сильных климатических перестроек в кайнозое (Ilves, Taylor, 2008). В границах естественного распространения обыкновенная малоротая корюшка населяет опреснённые участки Северного Ледовитого и северной части Тихого океанов. В водоёмах Дальнего Востока России она распространена в бассейнах рек от Алазеи до Камчатки, в речках Магаданской области, Приморья и зал. Петра Великого, в оз. Хасан и реках Сахалина (Дрягин, 1933; Берг, 1948; Клюканов, 1966; Черешнев и др., 1999, 2001; Дорофеева, 2010; Скурихина и др., 2010, 2012; Skurikhina et al., 2013; Парин и др., 2014). Недавно резидентная популяция была обнаружена на о-ве Беринга, Командорские о-ва (Малютина др., 2017). В нижнем и среднем течении Амура образует жилую форму, не уходящую в море, жилые изолированные популяции отмечены также в озёрах. На юг ареал малоротой корюшки простирается по азиатскому побережью до севера Японии, Китая и п-ова Корея (Дорофеева, 2010). В западной части ареала, после его значительного пространственного разрыва (свыше 3000 км), была единично отмечена в пойменных озёрах бассейнов р. Кара на Полярном Урале (Иванова, 1952) и в р. Байдарата на Ямале (Богданов и др., 2004; Рыжановский, Богданов, 2013). Ареал вида в Северной Америке не столь обширен, здесь он встречается на западном побережье Аляски, в нижнем течении и дельте р. Маккензи, а также в водоёмах п-ова Тактояктук (Клюканов, 1970, 1975; Degraaf, 1986). Как и в случае с Евразией, в Северной Америке наблюдается протяжённый разрыв ареала (свыше 1000 км) между популяциями корюшки на западе Аляски и в дельте Маккензи (Degraaf, 1986).
Филогеография и филогенетическое положение дальневосточных популяций малоротой корюшки рассмотрены в серии статей, основанных на обширном материале, собранном из разных популяций от Камчатки до Сахалина и бассейна Амура (Скурихина и др., 2010, 2012; Skurikhina et al., 2013). В этих работах показано, что для H. olidus характерна сглаженная филогеографическая структура (дивергентные линии отсутствуют), что свидетельствует об интенсивных потоках генов между популяциями в прошлые периоды, когда палеогеографическая обстановка была благоприятной для расселения вида.
Вид имеет проходные, а также озёрно-речные и жилые озёрные формы (Дорофеева, 2010; Скурихина и др., 2010, 2012). Встречается в опреснённых участках морей, но большинство стад постоянно живут в пресной воде. Максимальная длина по Смитту (FL) малоротой корюшки в р. Анадырь составляет 22 см, но обычно до 12 см, на Колыме – 10.0−10.5 см (Черешнев, 1996; Дорофеева, 2010). Средняя длина экземпляров в 1947 г. в тундровом пресном озере близ Карской губы составляла 7.4 см, наибольшая – 9.1 см (Иванова, 1952). В пределах ареала вид имеет местное промысловое значение.
В 2016 г. в ходе экспедиционных работ в юго-восточной части Баренцева моря малоротая корюшка была обнаружена на разных участках Варандейской губы.
Цель работы – уставить видовую принадлежность баренцевоморских особей и на основе молекулярно-генетического анализа выявить их филогенетическое положение относительно тихоокеанских популяций малоротой корюшки п-ова Камчатка.
МАТЕРИАЛ И МЕТОДИКА
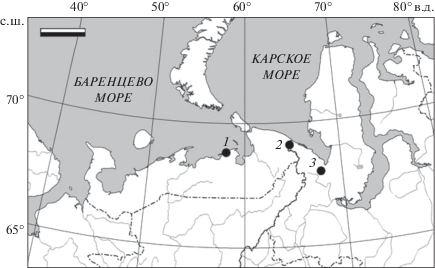
Рыб отловили 10−30.08.2016 г. на разных участках Варандейской губы и в районе выхода к морю протоки оз. Песчанка-То на юго-востоке Баренцева моря (рис. 1). Отлов проводили активными орудиями лова – мелкоячейным тягловым неводом длиной 50 м с ячеёй в крыльях и в кутке 20 и 5 мм.
Рис. 1.
Места находок (⚫) обыкновенной малоротой корюшки Hypomesus olidus в западной части ареала: 1 – Варандей, Большеземельская тундра, юго-восток Баренцева моря (наши данные); 2 – р. Кара, Полярный Урал, Карское море (Иванова, 1952); 3 – р. Байдарата, Ямал, Карское море (Богданов и др., 2004; Рыжановский, Богданов, 2013).
Тотальную ДНК выделили из образцов ткани, взятых у 2 экз. малоротой корюшки (зафиксированных в 96%-ном этаноле), с использованием коммерческого набора реагентов NucleoSpin® Tissue Kit (“Machereye Nagel GmbH & Co. KG”, Германия). Мы использовали праймеры и условия амплификации гена цитохрома b (Сyt b) в соответствии с ранее опубликованной работой (Bohlen et al., 2006). Выбран тот же маркер, который был использован ранее в работах Скурихиной с соавторами (2010, 2012), это позволило провести сравнение наших данных с материалами, полученными при изучении тихоокеанских популяций. Выравнивание полученных нами и взятых из Генбанка нуклеотидных последовательностей гена Сyt b малоротой корюшки проведено в программе BioEdit ver. 7.2.5 (Hall, 1999) с применением алгоритма ClustalW (Thompson et al., 1994). Филогеографический анализ выполнен методом построения медианной сети гаплотипов на основе массива из 89 нуклеотидных последовательностей гена Сyt b длиной 1096 пар нуклеотидов с использованием программы Network ver. 4.6.1.3 (Bandelt et al., 1999).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В общей сложности за три притонения на двух участках Варандейской губы и в районе выхода к морю протоки оз. Песчанка-То на юго-востоке Баренцева моря поймано 128 экз. малоротой корюшки (рис. 2). Величина уловов свидетельствует о том, что в районе Варандея обитает многочисленная популяция этого вида.
Рис. 2.
Обыкновенная малоротая корюшка Hypomesus olidus из юго-восточной части Баренцева моря (фото Ю.С. Колосовой). Масштаб: 1 см.

Ранее наиболее западная популяция была обнаружена в оз. Круглое бассейна р. Кара (Иванова, 1952). Кроме того, малоротая корюшка была встречена в пробе из желудка щуки Esox lucius, выловленной в пойменном озере в низовьях р. Байдарата (Богданов и др., 2004; Рыжановский, Богданов, 2013), сравнительно недалеко от р. Кара (рис. 1). Видимо, данные о встречах в озёрах Ямала без конкретной географической привязки (Дорофеева, 2010) основаны на этой находке. Учитывая, что реки Кара и Байдарата впадают в Карское море, наша находка H. olidus вблизи Варандея – первое достоверное свидетельство об обитании вида к западу от Уральских гор. Таким образом, малоротая корюшка может рассматриваться как новый вид для фауны Баренцева моря.
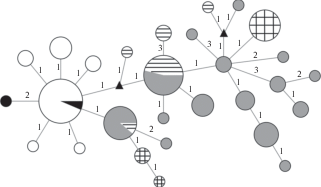
Молекулярно-генетический анализ показал, что две особи корюшки из Варандея имеют разные гаплотипы гена Сyt b (рис. 3; таблица). Первый из них (Hap01) – наиболее часто встречающийся гаплотип в популяции оз. Азабачье (Камчатка), где на его долю приходится 60% исследованных особей (таблица) (Скурихина и др., 2010, 2012). Второй гаплотип из европейской популяции (Hap02), хотя и является уникальным, также принадлежит к группе близкородственных гаплотипов, выявленных на Камчатке (рис. 3). Географическая дистанция между популяциями Камчатки и северо-востока Европы составляет около 5000 км. Таким образом, новые данные свидетельствуют о значительных способностях вида к дальнему расселению и его недавней (послеледниковой) экспансии в Европу вдоль побережья Северного Ледовитого океана. Можно предполагать, что другие популяции малоротой корюшки, обитающие в арктических реках Евразии, также являются выходцами с крайнего северо-востока континента и будут генетически близки камчатским особям, хотя эта гипотеза требует проверки с привлечением дополнительных материалов.
Рис. 3.
Медианная сеть гаплотипов гена Сyt b обыкновенной малоротой корюшки Hypomesus olidus: ( ) – Ненецкий автономный округ (Варандей), (
) – Ненецкий автономный округ (Варандей), ( ) – Камчатка, (
) – Камчатка, ( ) – Магаданская область, (
) – Магаданская область, ( ) – Сахалин, (
) – Сахалин, ( ) – Приморье; (
) – Приморье; ( ) – гипотетические анцестральные гаплотипы; значения у ветвей – число нуклеотидных
замен между гаплотипами; величина круга пропорциональна числу проанализированных особей.
Исходные данные представлены в таблице.
) – гипотетические анцестральные гаплотипы; значения у ветвей – число нуклеотидных
замен между гаплотипами; величина круга пропорциональна числу проанализированных особей.
Исходные данные представлены в таблице.
Встречаемость гаплотипов гена Сyt b в разных популяциях обыкновенной малоротой корюшки Hypomesus olidus на территории России
| Район сбора | n, экз. | Номера сиквенсов в Генбанке | Гаплотипы и их встречаемость (число особей, экз.) | Источник информации |
|---|---|---|---|---|
| Ненецкий автономный округ, Варандейская губа | 2 | MF448544−MF448545 | Hap01 (1), Hap02 (1) | Наши данные |
| Приморский край, Тернейский район, р. Самарга | 8 | HQ115264−HQ115271 | Hap03 (6), Hap04 (2) | Скурихина и др., 2012 |
| Сахалинская область, р. Погиби |
15 | HQ115249−HQ115263 | Hap03 (7), Hap05 (4), Hap06 (1), Hap07 (1), Hap08 (1), Hap09 (1) | То же |
| Сахалинская область, Набильский залив | 9 | HQ115240−HQ115248 | Hap07 (2), Hap08 (1), Hap09 (1), Hap10 (1), Hap11 (2), Hap12 (1), Hap13 (1) | » |
| Сахалинская область, устье р. Канделаква, оз. Карасевое |
16 | HQ115224−HQ115239 | Hap07 (5), Hap09 (1), Hap14 (1), Hap15 (1), Hap16 (5), Hap17 (2), Hap18 (1) | » |
| Магаданская область, оз. Глухое |
11 | HQ115212−HQ115221, HQ115223 | Hap19 (8), Hap20 (2), Hap21 (1) | » |
| Камчатский край, оз. Азабачье |
25 | HQ115190−HQ115211, FJ010869-FJ010871 | Hap01 (15), Hap22 (4), Hap23 (2), Hap24 (2), Hap25 (1), Hap26 (1) | Скурихина и др., 2010, 2012 |
| Приморский край, р. Амур | 3 | HQ115187−HQ115189 | Hap07 (1), Hap27 (1), Hap28 (1) | Скурихина и др., 2012 |
Предположение о том, что западные популяции малоротой корюшки могли пережить оледенение в каком-то местном рефугиуме, объясняющее таким образом огромный разрыв ареала между северо-востоком Азии и Полярным Уралом (Degraaf, 1986; Кудерский, 1987), не подтверждается нашими данными. Если бы популяция корюшки сохранялась здесь длительное время в древнем доледниковом рефугиуме, то её особи имели бы уникальные гаплотипы мтДНК, значительно отличающиеся от таковых в других регионах. Однако мы выявили, что европейские гаплотипы идентичны или близки к камчатским, что позволяет говорить о послеледниковом расселении. С другой стороны, наши выводы согласуются с представлениями о том, что заселение пресных вод Европы происходило из нескольких ледниковых рефугиумов, в том числе и из рефугиума на северо-востоке Азии (Махров, Болотов, 2006). Ранее некоторые исследователи предполагали, что ареал малоротой корюшки может отражать расселение из Берингийского рефугиума (Degraaf, 1986), что в целом подтверждается молекулярными данными. Кроме того, полученные нами результаты соответствуют выводам о сглаженной внутривидовой филогеографической структуре H. olidus из-за интенсивных потоков генов между популяциями в прошлом, сделанным на примере Дальнего Востока (Скурихина и др., 2010, 2012; Skurikhina et al., 2013).
Тем не менее, протяжённые разрывы ареала в Евразии и Северной Америке – по-прежнему загадочное явление, поскольку при послеледниковом расселении вдоль побережий вид должен был сформировать сплошной ареал от Аляски до дельты Маккензи (Degraaf, 1986) и от Чукотки до юго-запада Берингова моря. В первом приближении разрывы могут быть связаны с какими-то экологическими причинами (неподходящие местообитания) или же с недостаточной изученностью многих бассейнов (арктические регионы труднодоступны, мелкоячейные орудия лова применяются редко). Этот вопрос требует дальнейших детальных исследований.
Наши результаты в целом подтверждают ранее высказанное предположение (Дорофеева, 2010) о том, что выделение сахалинского и колымского подвидов малоротой корюшки, основанное на немногих морфолого-анатомических и размерных признаках (Таранец, 1937), не имеет достаточных оснований. В частности, на медианной сети гаплотипов (рис. 3) не выделяются обособленные филогеографические группы, соответствующие конкретным регионам, что свидетельствует об отсутствии географической и репродуктивной изоляции между популяциями вида. Соответственно, подвиды H. olidus bergi Taranetz, 1937 и H. olidus drjagini Taranetz, 1937 следует считать младшими субъективными синонимами таксона H. olidus (Pallas, 1814). Сомнения в статусе этих форм высказывались довольно давно (Hamada, 1961). В целом малоротая корюшка отличается высокой внутривидовой морфологической изменчивостью, особенно при сравнении популяций, обитающих в контрастных условиях среды (Романов, 2017), несмотря на низкий уровень генетической дивергенции между ними (Скурихина и др., 2010, 2012; Skurikhina et al., 2013).
ЗАКЛЮЧЕНИЕ
Малоротая корюшка имеет обширный ареал в пределах Дальнего Востока России от р. Алазея на севере до р. Туманная на юге. Наиболее западные изоляты вида отмечены в бассейнах рек Кара и Байдарата, впадающих в Карское море. Однако мы обнаружили многочисленную популяцию малоротой колюшки к западу от Уральских гор, в районе Варандея на юго-востоке Баренцева моря. Видовая идентификация собранных особей подтверждена молекулярно-генетическим методом на основе гена Сyt b. При этом европейские особи по данному генетическому маркеру идентичны или близки к таковым из популяций Камчатки (дистанция около 5000 км), что свидетельствует о значительных способностях вида к дальнему расселению и его недавней (послеледниковой) экспансии в Европу вдоль побережья Северного Ледовитого океана. Полученные результаты подтверждают представления о том, что заселение пресных вод Европы могло происходить из нескольких ледниковых рефугиумов (Махров, Болотов, 2006), а также расширяют современные представления о распространении вида в западной части ареала и происхождении западных (европейских) популяций.
БЛАГОДАРНОСТИ
Авторы искренне признательны А.А. Махрову (ИПЭЭ РАН) за ценные советы и неоценимую помощь при работе с литературой при подготовке рукописи.
Исследования выполнены при поддержке программы ФАНО (проект №0410-2014-0028), Министерства образования и науки (проект № 6.2343.2017/ПЧ) и РФФИ (гранты № 16-05-00854, 17-45-290066).
Список литературы
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Т. 1. М.; Л.: Изд-во АН СССР, 468 с.
Богданов В.Д., Богданова Е.Н., Гаврилов А.Л. и др. 2004. Биоресурсы водных экосистем Полярного Урала. Екатеринбург: Изд-во УрО РАН, 167 с.
Дорофеева Е.А. 2010. Hypomesus olidus (Pallas, 1814) – обыкновенная малоротая корюшка // Рыбы в заповедниках России. Т. 1. Пресноводные рыбы / Под редакцией Решетникова Ю.С. М.: Т-во науч. изд. КМК. С. 310–313.
Дрягин П.А. 1933. Рыбные ресурсы Якутии // Тр. Совета по изучению производит. сил АН СССР. № 5. С. 1–94.
Иванова Е.И. 1952. О нахождении малоротой корюшки на Европейском Севере // Тр. ВГБО. № 4. С. 252–259.
Клюканов В.А. 1966. Новые данные о распространении малоротых корюшек в водах СССР // Докл. АН СССР. Т. 166. № 4. С. 990–991.
Клюканов В.А. 1970. Морфологические основы систематики корюшек рода Hypomesus (Osmeridae) // Зоол. журн. Т. 49. № 10. С. 1534–1541.
Клюканов В.А. 1975. Систематика и родственные отношения корюшек родов Osmerus и Hypomesus (Osmeridae) и их расселение // Там же. Т. 54. № 4. С. 590–595.
Кудерский Л.А. 1987. Пути формирования северных элементов ихтиофауны Севера Европейской территории СССР // Сб. науч. тр. ГосНИОРХ. Вып. 258. Проблемы теории и практики рыбохозяйственной науки. С. 102–121.
Малютина А.М., Пичугин М.Ю., Поляков М.П., Кузищин К.В. 2017. Малоротая корюшка Hypomesus olidus – новый вид в ихтиофауне Командорских островов // Вопр. ихтиологии. Т. 57. № 1. С. 49–58.
Махров А.А., Болотов И.Н. 2006. Пути расселения и видовая принадлежность пресноводных животных севера Европы (обзор молекулярно-генетических исследований) // Генетика. Т. 42. № 10. С. 1319–1334.
Новоселов А.П. 2006. Малоротая корюшка Hypomesus olidus (Pallas, 1814) // Красная книга Ненецкого автономного округа. Нарьян-Мар: Изд-во ГУП НАО НИАЦ. С. 287–288.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с.
Романов Н.С. 2017. Морфологическая изменчивость обыкновенной малоротой корюшки Hypomesus olidus (Osmeridae) из некоторых водоёмов Дальнего Востока // Вопр. ихтиологии. Т. 57. № 1. С. 15–23.
Рыжановский В.Н., Богданов В.Д. 2013. Каталог позвоночных животных горно-равнинной страны Урал: аннотированный список и региональное распределение. Екатеринбург: Изд-во ИЭРиЖ УрО РАН, 172 с.
Скурихина Л.А., Кухлевский А.Д., Олейник А.Г., Ковпак Н.Е. 2010. Анализ филогенетических отношений корюшковых рыб (Osmeridae) по данным изменчивости гена цитохрома b // Генетика. Т. 46. № 1. С. 79–91.
Скурихина Л.А., Кухлевский А.Д., Железнова К.О., Ковалев М.Ю. 2012. Анализ изменчивости митохондриальной ДНК обыкновенной малоротой корюшки Hypomesus olidus (Osmeridae) // Там же. Т. 48. № 7. С. 844–854.
Таранец А. Я. 1937. Материалы к познанию ихтиофауны советского Сахалина // Изв. ТИНРО. Т. 12. С. 5–50.
Черешнев И.А. 1996. Биологическое разнообразие пресноводной ихтиофауны Северо-Востока России. Владивосток: Дальнаука, 197 с.
Черешнев И.А., Шестаков А.В., Скопец М.Б. 1999. О распространении малоротых корюшек рода Hypomesus (Osmeridae) в северной части Охотского моря // Вопр. ихтиологии. Т. 39. № 4. С. 486–491.
Черешнев И.А., Шестаков А.В., Фролов С.В. 2001. К систематике малоротых корюшек рода Hypomesus (Osmeridae) залива Петра Великого Японского моря // Биология моря. Т. 27. № 5. С. 340–346.
Bandelt H.J., Forster P., Röhl A. 1999. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. V. 16. № 1. P. 37–48.
Bohlen J., Šlechtová V., Bogutskaya N., Freyhof J. 2006. Across Siberia and over Europe: phylogenetic relationships of the freshwater fish genus Rhodeus in Europe and the phylogenetic position of R. sericeus from the River Amur // Mol. Phylogen. Evol. V. 40. № 3. P. 856–865.
Degraaf D.A. 1986. Aspects of the life history of the pond smelt (Hypomesus olidus) in the Yukon and Northwest Territories // Arctic. V. 39. № 3. P. 260–263.
Hall T.A. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucleic Acids Symposium Series. V. 41. P. 95–98.
Hamada K. 1961. Taxonomic and ecological studies of genus Hypomesus of Japan // Mem. Fac. Fish. Hokkaido Univ. V. 9.№ 1. P. 1–56.
Ilves K.L., Taylor E.B. 2008. Evolutionary and biogeographical patterns within the smelt genus Hypomesus in the North Pacific Ocean // J. Biogeography. V. 35. № 1. P. 48–64.
Skurikhina L.A., Kukhlevsky A.D., Kovpak N.E. 2013. Relationships of osmerid fishes (Osmeridae) of Russia: divergence of nucleotide sequences of mitochondrial and nuclear genes // Genes Genom. V. 35. № 4. P. 529–539.
Thompson J.D., Higgins D.G., Gibson T.J. 1994. Clustal W – Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice // Nucleic Acids Res. V. 22. P. 4673–4680.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


