Вопросы ихтиологии, 2019, T. 59, № 5, стр. 606-611
Воздействие тиомочевины на миграционную активность анабаса Anabas testudineus и потребление им корма
Е. Д. Павлов 1, *, А. О. Звездин 1, Д. С. Павлов 1
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 04.03.2019
После доработки 04.03.2019
Принята к публикации 07.03.2019
Аннотация
Исследовано влияние тиомочевины (экспозиция в 0.05%-ном растворе) на миграционную активность анабаса Anabas testudineus. Установлено, что тиомочевина одновременно влияет на две компоненты миграционного поведения анабаса – реореакцию и частоту прыжков из воды. Тиомочевина усиливает (на 27%) движение особей против течения и увеличивает (на 31%) частоту их прыжков из воды. Действие вещества проявляется на 5-е сут. экспозиции, а на 12-е сут. особи практически полностью прекращают питаться. В механизме влияния тиомочевины на миграционную активность анабаса инициированное веществом голодание может играть одну из ведущих ролей.
Миграционная активность рыб во многом связана с факторами среды, в том числе и с растворёнными в воде веществами, которые могут влиять не только на поведение рыб в потоке, но и на совершаемую ими миграцию (Scholz et al., 2000; Binder et al., 2011). Тиомочевина (ТМ) является одним из таких веществ (Павлов и др., 2018), она хорошо растворяется в воде и при загрязнении водоёма может оказывать также токсическое действие на гидробионтов (Перечень …, 1999; Ziegler-Skylakakis et al., 2003).
Анабас Anabas testudineus – один из немногих видов рыб, которые совершают миграции не только в водной среде, но и по суше (Das, 1927; Smith, 1945; Davenport, Matin, 1990). Этот вид может обитать в воде с высоким уровнем загрязнения, в том числе токсического (пестициды) (Nordin et al., 2015), что позволило многим исследователям использовать его для оценки влияния широкого спектра веществ на гидробионтов (Binoy et al., 2004; Nordin et al., 2015; Velmurugan et al., 2018). Ранее мы установили (Павлов и др., 2018), что выдерживание анабаса в течение 20 сут. в 0.05%-ном растворе ТМ меняет его реореакцию: стимулирует особей на движение преимущественно вверх против течения. Реореакция ‒ одна из компонент миграционного поведения, имеющая врождённый характер (Pavlov et al., 2010). ТМ модифицирует и число прыжков рыб ‒ вторую важную компоненту миграционной активности анабаса. Анабас, находящийся в потоке воды, как правило, сочетает реореакцию с частыми прыжками из воды, которые связывают с его выходом на сушу (Liem, 1987; Павлов и др., 2018).
Одним из важных факторов для проявления миграционной активности рыб, в том числе и анабаса, является голодание (Pavlov et al., 2010; Павлов и др., 2018). Наши предварительные наблюдения показали, что ТМ заметно снижает потребление анабасом корма, что может являться стимулом к совершению миграции. Не исключено, что одним из механизмов влияния ТМ на миграционное поведение анабаса может быть снижение пищевой мотивации, приводящее к недоеданию или полному голоданию.
Цель данной работы – выяснить влияние длительности экспозиции в растворе тиомочевины на проявление реореакции и потребление корма у анабаса.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в декабре 2017–январе 2018 г. в Приморском отделении Российско-вьетнамского тропического научно-исследовательского и технологического центра (СРВ, провинция Кханьхоа, г. Нячанг). Объект исследования ‒ половозрелые особи анабаса (средняя длина 98 ± 6.8 мм, масса 17 ± 4.5 г), которых отловили в прудах, входящих в систему рисовых полей, около г. Ниньхоа (12°31′ с.ш. 109°10′ в.д., провинция Кханьхоа). Средняя глубина прудов составляла 70 см, средняя температура воды – 26°C, прозрачность – 20–30 см; течение в прудах отсутствовало. В лаборатории рыб содержали при температуре воды 28–29°C в четырёх аквариумах объёмом 100 л (по 25 экз. в каждом). Аквариумы практически до самого верха (оставляли около 2 см воздушной прослойки) заполняли водой и накрывали пластиковыми перфорированными крышками с грузом, чтобы исключить попытки анабаса выпрыгнуть за пределы ёмкости. Воду дополнительно очищали при помощи фильтров замкнутого обмена мощностью 10 Вт. После акклимации (1 сут.) и на протяжении всего периода наблюдений полную смену воды осуществляли один раз в 2 сут. единовременно во всех аквариумах. Рыб кормили ежедневно сухим гранулированным кормом Humpy Head (“Yi Hu Fish Farm Traiding”, Сингапур) с диаметром гранул ~3 мм и средней массой 10 мг из расчёта 15% средней массы тела особи (корм давали в избытке).
Тип реореакции рыб определяли в установке “рыбоход” (Pavlov et al., 2010; Павлов и др., 2018), которая представляет собой лоток (196 × 50 см), разделённый на 11 отсеков (50 × 16 см каждый); ширина прохода между отсеками – 10 см. По нашим наблюдениям, максимальная высота прыжка анабаса составляет 50 см; во избежание выпрыгивания особей за пределы установки высота её стенок по периметру достигала 60 см. Через установку с помощью погружного насоса мощностью 1 кВт создавали проток воды; скорость течения в проходах между отсеками составляла 30 см/с. Уровень освещённости над “рыбоходом” во время проведения эксперимента был ~300 лк.
Рыб (по 10 экз.) помещали в средний отсек (6-й отсек установки, который является стартовым), закрытый с обеих сторон решётками. После 20-минутной акклимации особей к условиям эксперимента открывали решётки стартового отсека, а затем через 20 мин регистрировали число рыб в каждом отсеке “рыбохода”. Особей, поднявшихся против течения в отсеки 1–4, считали показавшими положительный тип реореакции (ПТР), оставшихся в 6-м (стартовом) отсеке – компенсаторный тип реореакции (КТР), а сместившихся в нижние по течению отсеки – отрицательный тип реореакции (ОТР) (Pavlov et al., 2010). В ходе каждого эксперимента вели видеосъёмку перемещений рыб в установке (GoPro HERO3). При анализе видеозаписей подсчитывали число особей, выпрыгнувших из стартового отсека во время акклимации (20 мин), и общее число прыжков, которое совершали рыбы за 40 мин наблюдений – за время акклимации и опыта.
Для оценки степени мотивации рыб к миграции в определённом направлении рассчитывали индекс контранатантности (Ik), который показывает, в каком направлении относительно течения в среднем сместились рыбы за время эксперимента. Он изменяется от 1 (все рыбы переместились из стартового отсека в верхний по течению отсек № 1) до –1 (все рыбы переместились в нижний отсек № 11). Рассчитывали индекс по формуле: Ik = = Σ(ni(Ns – i))/(Ns – 1)Σni, где ni – число рыб в i-том отсеке установки, экз.; Ns и i – номер стартового и i-того отсека установки.
Эксперимент проводили через 6 сут. после отлова рыб, он был условно разделён на три этапа. На первом этапе у анабаса определяли соотношение типов реореакции до добавления ТМ. После завершения этапа рыб в новом порядке по 25 экз. рассадили в те же четыре аквариума. На втором этапе особей в двух случайно выбранных аквариумах подвергали действию 0.05%-ного раствора ТМ (опытные рыбы), в двух других аквариумах рыб по-прежнему содержали в чистой воде (контрольные рыбы). При каждой смене воды (один раз в 2 сут.) в аквариумы с опытными рыбами добавляли расчётное количество ТМ, достаточное для поддержания требуемой концентрации (0.05%). Для снижения манипуляционного стресса опыты проводили с перерывом на 2–3 сут. – на 2, 5, 8 и 12-е сут. после добавления ТМ; определяли соотношение типов реореакции у рыб сравниваемых групп, число выпрыгнувших из стартового отсека за время акклимации особей и число прыжков за время акклимации и опыта (анабасов, выпрыгнувших из стартового отсека “рыбохода” в соседние, обратно не возвращали). После опыта рыб возвращали в тот же аквариум. На третьем этапе эксперимента (13‒14-е сут. экспозиции в ТМ) для оценки потребления корма 30 контрольных и 30 опытных особей рассаживали по аквариумам (40 л) по шесть в каждый. Анабасу свойствен групповой образ жизни (Binoy, Thomas, 2004), при пребывании в группе он испытывает меньший стресс и лучше питается, чем при одиночном содержании (Зворыкин, 2018). При оценке потребления анабасами корма их кормили из расчёта 25 гранул/сут. на каждую особь. Через 10 мин после внесения корма подсчитывали число несъеденных гранул. Всего было выполнено 39 опытов в экспериментальной установке рыбоход и четыре повторности опыта с потреблением корма.
Статистическую обработку материала проводили с использованием t-критерия Стьюдента, критерия Стьюдента для долей и многофакторного дисперсионного анализа.
РЕЗУЛЬТАТЫ
В первое время после посадки в аквариумы анабасы часто совершали попытки выпрыгнуть из ёмкости, чему препятствовала перфорированная крышка. По прошествии 1 сут. содержания в новых условиях число таких попыток заметно снижалось. Бóльшая часть рыб перешла на гранулированный корм в течение первых 3 сут, что можно считать достаточным периодом для акклимации анабаса к условиям содержания. В аквариумах рыбы в течение всего периода работ держались группами (чаще 1–2 группы), в составе которых активно перемещались как по аквариуму, так и по установке “рыбоход”. Рыбы не избегали течения: в аквариуме они часто держались в потоке воды, создаваемом аквариумным фильтром, часть времени проводили у дна. В “рыбоходе” анабасы предпочитали участки с быстрым течением (рядом с проходами между отсеками). На протяжении всего периода эксперимента гибели рыб не было.
Реореакция. Трёхфакторный дисперсионный анализ показал, что распределение рыб по отсекам экспериментальной установки зависело от принадлежности особей к контрольной или опытной группе, от длительности опыта и совместного влияния этих факторов (p < 0.05). То есть динамика соотношения типов реореакции различалась у контрольных и опытных особей.
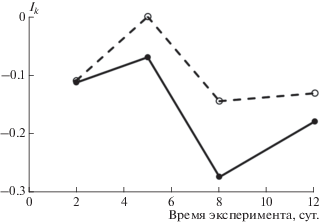
На первом этапе эксперимента у анабаса, содержащегося в чистой воде, преобладал ОТР (53%), доли ПТР и КТР были заметно ниже (рис. 1). Значение Ik составляло –0.13. На 2-е сут. экспозиции в ТМ реореакция рыб практически не изменялась, но на 5-е сут. у опытных рыб значение Ik повышалось (рис. 2) в результате достоверного увеличения вероятности ПТР (критерий Стьюдента для долей, р < 0.05). В дальнейшем различие по Ik у контрольных и опытных особей сохранялось примерно на одном уровне. Это происходило за счёт того, что с 5-х по 12-е сут. у опытных особей по сравнению с контрольными увеличивался ПТР (на 27%) и снижался ОТР (на 7%).
Рис. 1.
Соотношение типов реореакции у анабаса Anabas testudineus до добавления тиомочевины: ПТР – положительный, КТР – компенсаторный, ОТР – отрицательный типы реореакции.
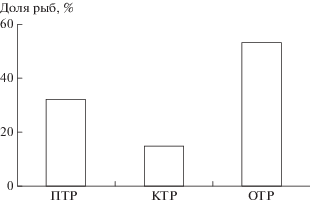
Рис. 2.
Динамика индекса контранатантности (Ik) у контрольной (—) и опытной (– –) групп анабаса Anabas testudineus.
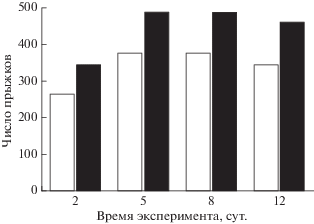
Прыжки анабаса в “рыбоходе” были направлены преимущественно перпендикулярно вверх, реже – вбок (некоторые особи перепрыгивали в соседних отсеки установки). Прыжки достигали 50 см в высоту, но чаще из-за течения в “рыбоходе” не превышали 15 см. Несколько большее число прыжков рыбы совершали в период акклимации, когда все 10 особей находились в стартовом отсеке.
Многофакторный дисперсионный анализ показал, что число прыжков зависело (p < 0.05) как от длительности опыта, так и от принадлежности рыб к контрольной или опытной группе. У опытных и контрольных рыб число прыжков росло с 5-х сут. В период с 5-х по 12-е сут. воздействия ТМ бóльшее число прыжков (на 31%) из воды совершили опытные особи по сравнению с контрольными (рис. 3). В течение второго этапа поведенческих наблюдений во время акклимации опытные особи выпрыгивали из стартового отсека чаще, чем контрольные, – соответственно 80.0 и 68.7%. Различия достоверны (p < 0.05, здесь и далее по t-критерию Стьюдента) на 5-е сут. экспозиции в ТМ.
Потребление корма. В ходе выполнения экспериментов было замечено, что анабас вечером интенсивнее потребляет корм (примерно в 1.5 раза), чем утром. Рыбы опытной группы с 4-х сут. содержания в ТМ потребляли заметно меньше корма, чем контрольные. На 13-е и 14-е сут. эксперимента рыбы контрольной группы (6 экз.) съедали соответственно 104.8 (23.1)11 и 86.8 (34.8), или ~64% из предложенных 150 гранул, а особи опытной группы (6 экз.) практически корм не потребляли – 1.6 (2.6) и 2.8 (2.4), т.е. съедали < 1.5% гранул (p < 0.05).
ОБСУЖДЕНИЕ
Анабас в отличие от большинства других рыб совершает миграции не только в воде, но и по суше. Он чрезвычайно пластичен – хорошо адаптируется к значительным изменениям среды обитания (Poulsen, Valbo-Jørgensen, 2000), но при этом имеет широкие возможности поиска новых биотопов за счёт возможности мигрировать по суше (Davenport, Matin, 1990).
Наш эксперимент был проведён в начале сухого сезона в Южном Вьетнаме. У анабаса (как в контроле, так и в опыте) наблюдается преобладание динамических типов реореакции – ПТР и ОТР. Это может свидетельствовать о нахождении рыб в миграционном состоянии (Павлов и др., 2010; Звездин, 2016). Полученные результаты подтверждают ранее отмеченные наблюдения (Halls et al., 1998) о том, что в отличие от многих других тропических рыб анабас может совершать миграции в воде круглый год – не только в период дождей, но и в сухой сезон. Есть информация (Smith, 1945), что и по суше анабас может передвигаться в период засухи.
Воздействие ТМ на две компоненты миграционного поведения (реореакцию и число прыжков) анабаса проявляется на 5-е сут. С 5-х по 12-е сут. воздействия ТМ в опытной группе по сравнению с контрольной более высокий индекс контранатантности, что свидетельствует о снижении у опытных особей мотивации к совершению денатантной миграции. Это соответствует ранее полученным данным (Павлов и др., 2018) по реореакции анабаса при его более длительном выдерживании (в течение 20 сут.) в растворе ТМ.
Одним из возможных действий тиомочевины на организм рыб может быть её токсическое действие. Влияние другого токсического вещества ‒ акарицида контактного действия дикофола (хлорэтанола) ‒ на поведение анабаса также проявлялось на 5-е сут. содержания в растворе (0.25‒4.0 мг/л) (Binoy et al., 2004). Токсический эффект от добавления в воду дикофола у анабаса проявлялся в снижении интенсивности дыхания, длительности движения против течения в гидродинамической установке, потребления корма. Известно также (Касумян, 2001), что снижение потребления корма является неспецифической реакцией рыб на токсическое поражение. Этот факт и одинаковые сроки (5-е сут.) проявления влияния дикофола и ТМ на поведение анабаса в потоке воды позволяют предположить о проявлении токсического эффекта последней. С другой стороны, ТМ в отличие от дикофола стимулирует анабаса на движение преимущественно против течения, что, вероятно, обусловлено гормональным эффектом за счёт влияния на щитовидную железу и изменения синтеза тиреоидных гормонов (Mackay, 1973; Моисеева, 1989; Tagawa, Hirano, 1991). То есть эффект ТМ на анабаса может быть комбинированным – токсическим и эндокринным одновременно.
Направленное перемещение рыб относительно течения трактуется как проявление их миграционного поведения в водной среде (Pavlov et al., 2010; Звездин, 2016). Прыжки анабаса, по-видимому, отражают склонность рыб к миграции по суше (Liem, 1987, Павлов и др., 2018). Поэтому синхронный рост на 5-е сут. доли рыб с ПТР и числа прыжков могут указывать на усиление миграционной активности у анабаса.
Рассмотренные изменения двух компонент миграционного поведения (реореакция и прыжки) происходили с анабасом, находившимся под воздействием ТМ 12 сут. По данным Моисеевой (1989), при экспозиции в этом веществе до 20 сут. повышается синтез тиреоидных гормонов, которые служат индикаторами миграционной активности у рыб (Woodhead, 1975; Høgåsen, Prunet, 1997; Павлов и др., 2014). Ранее (Павлов и др., 2018) мы показали, что как у контрольных, так и у опытных анабасов (с 20-х по 32-е сут. содержания в ТМ) растёт число прыжков при продолжительном голодании (12 сут.). В настоящей работе на 5-е сут. воздействия ТМ у рыб опытной группы повышается число прыжков. По-видимому, это изменение у анабаса может быть обусловлено как модификацией синтеза тиреоидных гормонов, так и голоданием, вызванным действием ТМ. Так, при голодании, связанном с увеличением пищевой конкуренции, анабас чаще выходит из воды на сушу (Liem, 1987). Отметим, что анабас способен длительное время (до 2 мес.) существовать без доступа к пище (Godavarthy et al., 2012), что, по всей видимости, позволяет ему совершать по суше миграции большой протяжённости (при достаточной влажности воздуха) в поисках новых водоёмов с лучшими условиями питания.
Таким образом, уже на 5-е сут. ТМ оказывает влияние на две компоненты миграционного поведения анабаса – реореакцию и число прыжков из воды. В растворе ТМ у анабаса снижается мотивация к денатантной миграции. Это вещество подавляет потребление корма анабасом, а на 13–14-е сут. выдерживания в растворе особи практически полностью прекращают питаться. В механизме влияния ТМ на миграционную активность анабаса голодание может играть одну из ведущих ролей.
Список литературы
Звездин А.О. 2016. Реореакция ранней молоди нерки Oncorhynchus nerka (Walb.) в период расселения с нерестилищ: Автореф. дис. … канд. биол. наук. М.: ИПЭЭ РАН, 28 с.
Зворыкин Д.Д. 2018. Освоение нового корма анабасом Anabas testudineus при одиночном и групповом содержании // Вопр. ихтиологии. Т. 58. № 2. С. 235–239. https://doi.org/10.7868/S0042875218020133
Касумян А.О. 2001. Воздействие химических загрязнителей на пищевое поведение и чувствительность рыб к пищевым стимулам // Там же. Т. 41. № 1. С. 82–95.
Моисеева Е.Б. 1989. Дифференцировка тиреотропных клеток и гипофизарно-тиреоидные отношения у молоди кефали Liza saliens // Биология моря. № 1. С. 32‒39.
Павлов Д.С., Костин В.В., Пономарева В.Ю. 2010. Поведенческая дифференциация сеголеток черноморской кумжи Salmo trutta labrax: реореакция в год, предшествующий смолтификации // Вопр. ихтиологии. Т. 50. № 2. С. 251–261.
Павлов Д.С., Павлов Е.Д., Ганжа Е.В. и др. 2014. Цитологическое состояние гонад и уровень тиреоидных и половых стероидных гормонов у двух фенотипических форм молоди черноморской кумжи Salmo trutta labrax // Там же. Т. 54. № 4. С. 470–478. https://doi.org/10.7868/S0042875214030114
Павлов Е.Д., Павлов Д.С., Ганжа Е.В. и др. 2018. Влияние тиомочевины на поведение анабаса Anabas testudineus в потоке воды // Там же. Т. 58. № 5. С. 584–588. https://doi.org/10.1134/S0042875218050181
Перечень рыбохозяйственных нормативов: предельно допустимые концентрации (ПДК) и ориентировочно безопасные уровни воздействия (ОБУВ) вредных веществ для воды водных объектов, имеющих рыбохозяйственное значение. 1999. М.: Изд-во ВНИРО, 304 с.
Binder T.R., Cooke S.J., Hinch S.G. 2011. The biology of fish migration // Encyclopedia of fish physiology: from genome to environment. V. 3 / Ed. Farrell A.P. San Diego: Acad. Press. P. 1921–1927. https://doi.org/10.1016/B978-0-1237-4553-8.00085-X
Binoy V.V., Thomas K.J. 2004. The climbing perch (Anabas testudineus Bloch), a freshwater fish, prefers larger unfamiliar shoals to smaller familiar shoals // Current Sci. V. 86. № 1. P. 207–211.
Binoy V.V., Job N., Thomas K.J. 2004. Influence of dicofol on the behaviour of the climbing perch, Anabas testudineus // Indian J. Fish. V. 51. № 3. P. 345‒351.
Das B.K. 1927. The bionomics of certain air-breathing fishes of India, together with an account of the development of their air-breathing organs // Phil. Trans. V. 216. P. 183–216. https://doi.org/10.1098/rstb.1928.0003
Davenport J., Matin A.K.M.A. 1990. Terrestrial locomotion in the climbing perch, Anabas testudineus (Bloch) (Anabantidea, Pisces) // J. Fish Biol. V. 37. P. 175–184. https://doi.org/10.1111/j.1095-8649.1990.tb05938.x
Godavarthy P., Sunila Kumari Y.S., Bikshapathy E. 2012. Starvation induced cholesterogenesis in hepatic and extra hepatic tissues of climbing perch, Anabas testudineus (Bloch) // Saudi J. Biol. Sci. V. 19. P. 489–494. https://doi.org/10.1016/j.sjbs.2012.07.004
Halls A.S., Hoggarth D.D., Debnath K. 1998. Impact of flood control schemes on river fish migrations and species assemblages in Bangladesh // J. Fish Biol. V. 53. Suppl. A. P. 358–380. https://doi.org/10.1111/j.1095-8649.1998.tb01037.x
Høgåsen H.R., Prunet P. 1997. Plasma levels of thyroxine, prolactin, and cortisol in migrating and resident wild Arctic charr, Salvelinus alpinus // Can. J. Fish. Aquat. Sci. V. 54. P. 2947–2954. https://doi.org/10.1139/f97-233
Liem K.F. 1987. Functional design of the air ventilation apparatus and overland excursions by teleosts // Fieldiana Zool. № 37. P. 1–29.
Mackay N. 1973. The effects of methallibure (I.C.I.33,828) and thiourea on gametogenesis in the firetail gudgeon, Hypseleotris galii // Gen. Comp. Endocrinol. V. 20. P. 221–235. https://doi.org/10.1016/0016-6480(73)90175-5
Nordin I.L., Ibrahim N., Hamidin N. et al. 2015. Acute toxicity of endosulfan to Anabas testudineus // Adv. Environ. Biol. V. 9. № 27. P. 341‒345.
Pavlov D.S., Kostin V.V., Zvezdin A.O., Ponomareva V.Yu. 2010. On methods of determination of the rheoreaction type in fish // J. Ichthyol. V. 50. № 11. P. 977–984. https://doi.org/10.1134/S0032945210110020
Poulsen A.F., Valbo-Jørgensen J. (eds.). 2000. Fish migrations and spawning habits in the Mekong mainstream: a survey using local knowledge (Basinwide) // AMFC Tech. Rept. Mekong River Commis. 150 p.
Scholz N.L., Truelove N.K., French B.L. et al. 2000. Diazinon disrupts antipredator and homing behaviors in Chinook salmon (Oncorhynchus tshawytscha) // Can. J. Fish. Aquat. Sci. V. 57. P. 1911–1918. https://doi.org/10.1139/f00-147
Smith H.M. 1945. The freshwater fishes of Siam, or Thailand // Bull. US Nat. Mus. V. 188. 622 p. https://doi.org/10.5479/si.03629236.188.1
Tagawa M., Hirano T. 1991. Effects of thyroid hormone deficiency in eggs on early development of the medaka, Oryzias latipes // J. Exp. Zool. V. 257. № 3. P. 360–366. https://doi.org/10.1002/jez.1402570309
Velmurugan B., Cengiz E.I., Yolcu M. et al. 2018. Cytological and histological effects of pesticide chlorpyriphos in the gills of Anabas testudineus // Drug. Chem. Toxicol. P. 1–6. https://doi.org/10.1080/01480545.2018.1497052
Woodhead A.D. 1975. Endocrine physiology of fish migration // Oceanogr. Mar. Biol. Ann. Rev. V. 13. P. 287–382. https://doi.org/10.1093/icb/31.1.217
Ziegler-Skylakakis K., Kielhorn J., Könnecker G., Koppenhöfer J. et al. 2003. Concise international chemical assessment document 49. Thiourea. Geneva: World Health Organization, 43 p.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии