Вопросы ихтиологии, 2020, T. 60, № 1, стр. 40-51
Видовой состав и структура ихтиопланктона северной части Японского моря в летний период 2017 г.
В. А. Шелехов 1, *, И. В. Епур 1, А. А. Баланов 1
1 Национальный научный центр морской биологии Дальневосточного отделения РАН − ННЦМБ ДВО РАН
Владивосток, Россия
* E-mail: shelekhov@mail.ru
Поступила в редакцию 20.02.2019
После доработки 15.03.2019
Принята к публикации 15.03.2019
Аннотация
Исследован ихтиопланктон верхней эпипелагиали (0–50 м) в северной части Японского моря в июле–августе 2017 г. У побережья Приморья отмечена икра семи видов и личинки пяти видов рыб из пяти семейств; в Татарском проливе − икра шести видов из пяти семейств и личинки 12 видов из семи семейств. Повсеместно преобладали икра и личинки четырёх видов семейства Pleuronectidae (Limanda punctatissima, Glyptocephalus stelleri, Cleisthenes herzensteini и Acanthopsetta nadeshnyi). У побережья Приморья доминировала C. herzensteini, а в Татарском проливе – L. punctatissima. В сравнении с результатами Курило-Сахалинской экспедиции конца 1940-х гг. икра пелагических видов рыб, таких как Engraulis japonicus, Cololabis saira и Scomber japonicus, встречалась в незначительных количествах и только в приповерхностном слое. Результаты исследования позволяют говорить о слабых изменениях видового состава относительно середины прошлого века, с одной стороны, и о значительных изменениях доминирующих видов – с другой.
История изучения ихтиопланктона в северной части Японского моря берёт начало с Курило-Сахалинской экспедиции (КСЭ), проведённой в 1940-х гг., по материалам которой были описаны размножение и развитие большинства массовых видов − представителей семейства Pleuronectidae, S. japonicus, Liza haematochila и других (Дехник, 1950, 1959а, 1959б; Казанова, 1959; Расс, 1959). Кроме того, было установлено значительно более северное, чем предполагалось ранее, распространение нерестовых скоплений ряда теплолюбивых видов (E. japonicus, C. saira, S. japonicus и др.) (Казанова, 1959).
Перестройка в ихтиоценах дальневосточных морей, вызванная сменой климато-океанологических периодов во второй половине ХХ в. (Шунтов и др., 1997), затронула не только промысловые биоресурсы, приведя к смене доминирующих видов в ихтиоцене Японского моря (Новиков, Свирский, 1987), но должна была отразиться и на ихтиопланктоне северной части Японского моря. Исследования СахНИРО, проведённые в начале XXI в. (Moukhametova, 2002, 2012, 2014; Мухаметова, 2012; Мухаметова, Мухаметов, 2013), показали отсутствие в летнем ихтиопланктоне ряда теплолюбивых видов-мигрантов, обычных для этого района в середине прошлого века, и смену доминирующих видов в ихтиопланктоне. Однако эти работы проводились на ограниченной акватории северной части Японского моря с использованием, как правило, только вертикальных ловов сетью ИКС-80, что сильно влияет на сравнимость полученных результатов с более ранними данными, когда использовались и горизонтальные ловы сетями разных конструкций (Расс, 1959).
Цель нашей работы – изучить современное состояние ихтиопланктона верхней эпипелагиали северной части Японского моря в летний период и дать оценку происходящих изменений в видовом составе.
МАТЕРИАЛ И МЕТОДИКА
Ихтиопланктонные пробы собирали в июле–августе 2017 г. в северной части Японского моря во время научно-исследовательской экспедиции ННЦМБ ДВО РАН на НИС “Проф. Гагаринский” (Баланов, Лысенко, 2018). Сетка станций охватывала акваторию от зал. Ольги до о-ва Монерон между изобатами 50 и 200 м (рис. 1). В северной мелководной части Татарского пролива часть ловов была сделана над меньшими глубинами – от 16 м. По техническим причинам не удалось охватить съёмкой лишь участок шельфа между м. Золотой и б. Императорская гавань. Всего выполнено 58 станций, из них 25 − у побережья Приморья (23.07–01.08.2017 г.), 33 − в Татарском проливе (02.08–18.08.2017 г.).
Рис. 1.
Схема ихтиопланктонных станций (⚫) в летний период 2017 г.; (——) – разрезы 1−6, на которых на рис. 3 показана вертикальная структура водной толщи.

Пробы собирали с борта судна икорной сетью ИКС-80, изготовленной в соответствии с рекомендациями Расса и Казановой (1966). Ихтиопланктон отбирали в поверхностном горизонте на циркуляции судна со скоростью 2.5 узла в течение 10 мин, а затем вертикальным ловом, с 50 м до поверхности воды, с помощью судовой лебёдки (Соколовская, Беляев, 1987). При вертикальном лове сеть дополнительно оснащали автономным гидрологическим зондом-профилографом CastAway CTD, позволяющим получать данные о температуре и солёности воды в исследуемой толще с шагом 1 с, или в среднем через 0.3 м.
Всего за период работ собрано и обработано 116 проб (в 16 уловах ихтиопланктон отсутствовал). Пробы фиксировали 4%-ным раствором формальдегида и затем обрабатывали в лабораторных условиях. Идентификацию икринок, измерения личинок и мальков проводили в соответствии с разработанными ранее методами и рекомендациями (Перцева-Остроумова, 1961; Ahlstrom et al., 1976; Соколовская, Беляев, 1987; An atlas …, 1988; Matarese et al., 1989; Соколовский, Соколовская, 2008). Общую длину (TL) личинок и мальков и диаметр икринок измеряли с точностью до 0.1 мм при помощи окуляр-микрометра на микроскопе “Olympus”, Япония. Систематическое положение таксонов приводится в соответствии с каталогом Эшмайера (Fricke et al., 2019). Плотность распределения икры и личинок при горизонтальных и вертикальных ловах приводится в пересчёте на 1 м3 для удобства сопоставления с ранее опубликованным данными.
РЕЗУЛЬТАТЫ
Гидрология района исследований в июле–августе 2017 г.
Воды Татарского пролива и у побережья Приморья в летний период имеют сложную структуру, которая в разные годы может претерпевать существенные изменения, связанные с развитием и взаимодействием Цусимского, Приморского, Западно-Сахалинского течений и течения Шренка. Для тёплых лет, как правило, характерна система струйных вторжений и спиралевидных структур в условиях плотной “упаковки” вихрей. Такие вихревые дорожки, а именно вдоль 134° и 137° в.д., обеспечивают быструю адвекцию тёплых вод в восточной части моря (между 42° и 44° с.ш.) – перенос субтропических вод к западу от о-ва Хоккайдо в сторону средней части Приморья (43°–45° с.ш.). Поступление тёплых вод отмечается с востока к зал. Ольги, м. Сосунова и м. Золотой, что обеспечивает длительную тёплую осень (Никитин и др., 2009). Северная ветвь Цусимского течения, входящая в Татарский пролив, генетически связана с Приморским течением (Пищальник и др., 2010). В период максимального притока субтропических вод в Татарском проливе отмечается кратковременное образование вихревой цепочки с юга на север в центральной части пролива, состоящей из четырёх–пяти мелких вихрей (Никитин, Юрасов, 2008).
В Татарском проливе по вертикали чётко выделяются два слоя, имеющие противоположную направленность циркуляции вод. Граница между слоями в северной части пролива расположена на глубине 30–50 м, в южной – 150–300 м. В приповерхностном слое и на глубине >50 м направления течений могут сильно различаться (Дьяков, 2006). Западно-Сахалинское течение, выделяемое некоторыми исследователями вдоль западного побережья Сахалина (от м. Ламанон до м. Крильон), в виде единого потока не существует. Оно проявляется на отдельных его участках в разные месяцы в результате формирования достаточно устойчивых мезомасштабных вихрей либо в виде компенсационных потоков, отчётливо прослеживаемых южнее мысов Ламанон и Слепиковского (Дьяков, 2006).
В конце июля 2017 г. у побережья Приморья наблюдалось несколько затоков тёплых более солёных вод с вихрями, образованными на периферии Цусимского течения, к югу от зал. Рында и в районе рек Малая Кема и Единка; затоки разделены пятнами более холодных и менее солёных вод прибрежного Приморского течения (рис. 2).
Рис. 2.
Распределение температуры (а) и солёности (б) поверхностного слоя воды вдоль восточного побережья Приморья и в Татарском проливе в июле–августе 2017 г.

Развитие затока тёплых вод в Татарском проливе в августе 2017 г. происходило по аналогии с ситуацией 1973 г., характеризовавшейся значительными положительными аномалиями температуры воды в поверхностном слое (Погодин, Шатилина, 1998). Севернее 50° с.ш. в придонном слое на глубине ~ 50 м в западной и центральной частях присутствовала линза холодной воды с температурой ниже 0°С. В этом районе заток тёплых вод отклонялся в сторону о-ва Сахалин и севернее г. Александровск-Сахалинский шёл непосредственно вдоль побережья, что видно как на картах распределения температуры и солёности воды у поверхности (рис. 2), так и на графиках вертикальной структуры вод на шести разрезах к северу от 49° с.ш. (рис. 3).
Рис. 3.
Вертикальное распределение температуры воды в верхней эпипелагиали по шести широтным разрезам в Татарском проливе к северу от 49° с.ш.: а – разрез 1 (51°27′ с.ш.), б − разрез 2 (51°0′ с.ш.), в − разрез 3 (50°42′ с.ш.), г − разрез 4 (50°12′ с.ш.), д − разрез 5 (49°36′ с.ш.), е − разрез 6 (49°0′ с.ш.); обозначения разрезов см. на рис. 1.

В районе м. Кузнецова у южной оконечности Сахалина, напротив, наблюдался подъём к поверхности холодных вод Западно-Сахалинского течения (Дьяков, 2006). На этом участке акватории между м. Кузнецова и о-вом Манерон наблюдался наибольший градиент температуры воды в поверхностном слое.
Видовой состав ихтиопланктона
У побережья Приморья в ихтиопланктоне отмечена икра семи видов и личинки пяти видов рыб из пяти семейств (таблица). Видовой состав ихтиопланктона в горизонтальных и вертикальных уловах несколько различался. В горизонтальных уловах в среднем по району на долю видов семейства Pleuronectidae приходилось 86.9% икры (четыре вида рыб) и 78.0% личинок (один вид). Икра E. japonicus составляла 12.9% улова, а икра C. saira и S. japonicus − <0.1%. В ихтиопланктоне была высока доля личинок рыб рода Sebastes (17.6%) и S. japonicus (4.4%). В вертикальных уловах доля икры представителей семейства Pleuronectidae была несколько меньше (84.1%, четыре вида рыб), а личинок больше (82.4%, 2 вида), чем в горизонтальных. Больше была доля икры E. japonicus (15.9%) и личинок S. japonicus (3.3%). Доля личинок представителей семейства Scorpaenidae была существенно ниже (6.5 против 17.6% в горизонтальных ловах).
Состав видов и относительная численность их икры и личинок в ихтиопланктоне у побережья Приморья и в Татарском проливе в июле−августе 2017 г., по данным горизонтального и вертикального лова, %
| Семейство, вид | Приморское побережье | Татарский пролив | ||||||
|---|---|---|---|---|---|---|---|---|
| Горизонтальный лов | Вертикальный лов | Горизонтальный лов | Вертикальный лов | |||||
| Икра | Личинки | Икра | Личинки | Икра | Личинки | Икра | Личинки | |
| Engraulidae | 12.9 | – | 15.9 | – | – | – | – | – |
| Engraulis japonicus | 12.9 | – | 15.9 | – | – | – | – | – |
| Osmeridae | – | – | – | – | – | – | – | 0.7 |
| Mallotus villosus | – | – | – | – | – | – | – | 0.7 |
| Scomberesocidae | 0.1 | – | – | – | 0.2 | – | – | – |
| Cololabis saira | 0.1 | – | – | – | 0.2 | – | – | – |
| Ammodytidae | – | – | – | – | – | 0.1 | – | – |
| Ammodytes hexapterus | – | – | – | – | – | 0.1 | – | – |
| Gasterosteidae | – | – | – | – | – | 0.6 | – | – |
| Gasterosteus aculeatus | – | – | – | – | – | 0.6 | – | – |
| Scorpaenidae | – | 17.6 | – | 6.5 | – | 8.3 | – | 9.6 |
| Sebastes minor | – | 13.2 | – | 3.3 | – | 2.8 | – | 5.1 |
| S. taczanovskii | – | 3.3 | – | 3.2 | – | 5.1 | – | 4.5 |
| S. trivitatus | – | 1.1 | – | – | – | 0.4 | – | – |
| Liparidae | – | – | – | 7.8 | – | – | – | – |
| Liparis tesselatus | – | – | – | 7.8 | – | – | – | – |
| Stichaeidae | – | – | – | – | – | 5.7 | – | 5.3 |
| Stichaeus fuscus | – | – | – | – | – | 5.7 | – | 5.3 |
| Scombridae | 0.1 | 4.4 | – | 3.3 | <0.1 | 0.2 | – | 0.7 |
| Scomber japonicus | 0.1 | 4.4 | – | 3.3 | <0.1 | 0.2 | – | 0.7 |
| Pleuronectidae | 86.9 | 78.0 | 84.1 | 82.4 | 99.8 | 85.1 | 100 | 83.7 |
| Glyptocephalus stelleri | 0.3 | – | 14.0 | 24.2 | 1.5 | 10.8 | 5.4 | 5.0 |
| Cleisthenes herzensteini | 59.2 | 78.0 | 43.2 | 58.2 | 26.9 | 30.9 | 13.3 | 6.8 |
| Limanda aspera | – | – | – | – | 0.5 | – | – | – |
| L. punctatissima | 26.0 | – | 26.9 | – | 49.8 | 30.3 | 62.1 | 26.9 |
| Acanthopsetta nadeshnyi | 1.4 | – | – | – | 21.1 | 13.1 | 19.2 | 45.0 |
| Средний улов, экз/м3 | 0.119 | 0.002 | 0.146 | 0.047 | 0.095 | 0.009 | 0.262 | 0.174 |
Уловы в Татарском проливе отличались большим обилием и многообразием видов рыб: в ихтиопланктоне присутствовала икра шести видов рыб из пяти семейств и личинки 12 видов из семи семейств (таблица). В горизонтальных ловах на долю видов семейства Pleuronectidae приходилось 99.8% икры (пять видов) и 85.1% личинок (четыре вида). Доля икры C. saira была в два раза больше (0.2%), а доля личинок представителей рода Sebastes (8.3%, три вида) и S. japonicus (0.2%) − несколько меньше, чем у приморского побережья. В уловах появились в заметном количестве личинки Stichaeus fuscus (5.8%). В вертикальных уловах икра и личинки представителей семейства Pleuronectidae (четыре вида) составляли соответственно 100 и 83.7%. На долю личинок S. japonicus, двух видов рода Sebastes и S. fuscus пришлось соответственно 0.7, 9.6 и 5.3%.
Пространственное распределение икры и личинок рыб
L. punctatissima – обычный вид в зал. Петра Великого, Татарском проливе, зал. Анива и у южных Курильских о-вов, где составляет заметную долю биомассы камбал (Моисеев, 1953; Борец, 1990; Колпаков, 2005; Епур, Баланов, 2015). Икра этого вида диаметром 0.71–0.85 мм находилась на I–IV стадии развития и встречалась в уловах при температуре 13.5–21.5°С и солёности 26.0–33.8‰, в массе – в диапазоне 15.0–18.0°С и 31.0–33.0‰ над глубинами < 40 м. У побережья Приморья в уловах встречалась только икра, а в Татарском проливе − икра и личинки этого вида. Личинки концентрировались в более холодных водах. Наиболее высокие их концентрации наблюдались от м. Сюркум до зал. Чихачева по материковому побережью и севернее Александровска-Сахалинского по побережью Сахалина (рис. 4а). Концентрация икры L. punctatissima была примерно одинаковая по всей облавливаемой толще воды: данные горизонтальных и вертикальных ловов давали близкие значения в пересчёте на 1 м3 Концентрация личинок была на порядок выше по данным вертикальных ловов, чем горизонтальных. Размерный ряд личинок варьировал от 2.5 до 10.0 мм. Отсутствие личинок в уловах у Приморского побережья, а также снижение количества икры при одновременном постепенным увеличением размеров личинок в уловах к Южному Сахалину могут свидетельствовать о том, что у побережья Приморья мы захватили в конце июля 2017 г. более ранний период нереста, чем у Сахалина, у южной оконечности которого нерест L. punctatissima во II декаде августа уже практически завершился.
Рис. 4.
Распределение икры и личинок семейства Pleuronectidae и размерный состав (TL) личинок в северной части Японского моря летом 2017 г., по данным вертикальных (△, ◻) и горизонтальных ловов (⚪, ◆): а – Limanda punctatissima, б – Glyptocephalus stelleri, в – Cleisthenes herzensteini, г – Acanthopsetta nadeshnyi; (——) − изотермы.

Икра и личинки G. stelleri встречались по всему району исследований в диапазоне температуры 13.4−18.9°С и солёности 29.6–33.6‰ (рис. 4б). Уловы отмечались от 16 м в северной части Татарского пролива до наиболее глубоководных станций в южной части исследованной акватории, над глубинами 200–260 м. Основная часть как личинок, так и икры встречалась над глубинами >35 м и преимущественно в вертикальных ловах. Их концентрация при горизонтальных ловах, как правило, была на один–два порядка меньше, чем при вертикальных, но при концентрации <0.03 экз/м3 они встречались только при горизонтальных ловах, что может быть связано с большим объёмом процеживаемой воды (Шелехов, Епур, 2017а). Несмотря на широкое распространение G. stelleri, численность икры и личинок этой камбалы была существенно ниже, чем других видов семейства Pleuronectidae. Присутствие в уловах как мелких (TL 3.0–4.0 мм), так и крупных личинок (TL > > 15.0 мм) указывает на продолжающийся уже достаточно давно нерест этого вида.
C. herzensteini доминировала в уловах у побережья Приморья по икре и личинкам и была на втором месте по обилию после L. punctatissima в Татарском проливе (таблица). Этот вид встречался при температуре воды 13.0−20.0°С и солёности 28.0−34.0‰, но бóльшая часть уловов икры пришлась на диапазон 14.0–19.0°С и 30.0–34.0‰ над глубинами >50 м. Уловы личинок также увеличивались над глубинами >40 м при температуре 15.0−19.5°С и солёности 31.5–34.0‰. Икра C. herzensteini диаметром 0.89–1.2 мм находилась на I–IV стадии развития. Плотность в расчёте на 1 м3, по данным горизонтальных и вертикальных ловов, была близка. Личинки хотя и встречались в горизонтальных уловах значительно чаще, но их концентрация в вертикальных уловах была на один–два порядка выше, что говорит о постепенном перераспределении личинок после вылупления по водной толще. Размеры личинок C. herzensteini несколько увеличивались вдоль побережья Сахалина (рис. 4в), однако ввиду более поздних (на две недели) сроков проведения съёмки в этом районе нельзя с уверенностью говорить о более раннем прохождении здесь нереста данного вида. Вероятно, и у материкового, и у сахалинского побережья Татарского пролива сроки нереста C. herzensteini примерно сходны, с пиком в конце июля–начале августа.
Икра A. nadeshnyi сходна по размерам и близка по пигментации с икрой C. herzensteini, однако личинки этих видов хорошо различаются по пропорциям и окраске (Перцева-Остроумова, 1961). Икра A. nadeshnyi встречалась как у Приморского побережья, так и в Татарском проливе, в то время как личинки − только к северу от 49° с.ш. (рис. 4г). Диапазон встречаемости по температуре составлял 13.5–19.0°С, а по солёности – 30.0–34.0‰. Практически все уловы приходились на станции над изобатами > 35 м. За исключением двух ловов икра встречалась непосредственно у поверхности, а личинки тяготели к нижележащим слоям водной толщи. Концентрация личинок была соизмерима в горизонтальных и вертикальных ловах лишь у материкового побережья в холодном пятне, к югу от зал. Чихачева. Наибольшие уловы икры зарегистрированы к северу от 50° с.ш. у сахалинского побережья, а личинок – вдоль обоих побережий.
Икра L. aspera диаметром 0.74–0.82 мм (IV стадии развития) отмечена в уловах лишь однажды − у зал. Императорская гавань при температуре 15.6°С и солёности воды 31.2‰.
Икра E. japonicus к северу от 47° с.ш. не облавливалась (рис. 5а). Икра C. saira и S. japonicas в июле–августе отмечалась в уловах на периферии тёплых затоков как у приморского побережья, так и в Татарском проливе. Икра C. saira отмечена только в горизонтальных ловах вплоть до 51°30′ с.ш.; икра S. japonicus − в горизонтальных и вертикальных ловах до 48°30′ с.ш., а личинки до 46°30′ с.ш. Подавляющая часть уловов икры и личинок этих видов пришлась на температурный диапазон 16.0–19.5°С и диапазон солёности 30.5–33.0‰. Тем не менее икра C. saira, была отмечена даже при температуре менее 14.0°С, в зоне конвергенции с большим количеством плавающего мусора у м. Сюркум (49°51′58 с.ш. 140°35′30 в.д.).
Рис. 5.
Распределение икры Engraulis japonicus (а) и личинок Stichaeus fuscus (б) в северной части Японского моря летом 2017 г., по данным вертикальных и горизонтальных ловов; обозначения см. на рис. 4.

Личинки S. trivitatus отмечены в двух уловах в южной части района исследований − у зал. Ольги и у м. Кузнецова при температуре соответственно 14.9 и 16.3°С. Личинки S. taczanovskii встречались у приморского побережья к югу от зал. Рында, а у Сахалина – к югу от м. Леманон при 15.0–19.5°С и 31.2–34.0‰. Наиболее массовый в планктоне представитель семейства Scorpaenidae − S. minor – отмечен в сходном диапазоне температуры и солёности, но его личинки встречались практически по всему району исследований вплоть до 50°45′ с.ш.
Единственная личинка L. tesselatus (TL 4.5 мм) была отмечена в б. Ольга в вертикальном лове с глубины 20.8 м. Остальные виды, личинки которых в небольшом количестве присутствовали в планктоне, встречались только в Татарском проливе. Так, личинки M. villosus были пойманы на одной прибрежной станции к югу от зал. Чихачева (15.8°С, 31.5‰). Личинки и мальки G. aculeatus (TL 3–40 мм) встречались в горизонтальных уловах на двух станциях у побережья Сахалина между 48°30′ и 50° с.ш. на достаточно большом удалении от берега над глубинами ~ 50 м.
Интересным было обнаружение в летнем ихиопланктоне личинок S. fuscus (Баланов и др., 2018). По материковому побережью они встречались от зал. Императорская гавань вплоть до 51°30′ с.ш., а по сахалинскому – до м. Кузнецова (рис. 5б). Личинки TL 4.2–7.0 мм были распространены по всей акватории пролива: как на самых мелководных (от 16 м), так и на наиболее глубоководных станциях в диапазоне температуры 13.5−18.9°С и солёности 31.4−33.6‰.
ОБСУЖДЕНИЕ
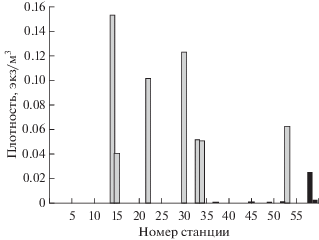
Отмеченное нами разное соотношение видов рыб в вертикальных и горизонтальных уловах говорит об особенностях распределения икры и личинок разных видов. Это отмечалось и в немногочисленных ранних исследованиях (Перцева-Остроумова, 1961; Булатов, 1982; Дубинина, Андреева, 2008). Из-за неравномерного распространения икры и личинок разных видов по глубине вертикальные уловы должны давать, несомненно, более адекватную оценку их соотношения в планктоне (Шелехов, Епур, 2017а). Тем не менее в них зачастую отсутствует часть видов из-за относительно низкой численности, в то время как при горизонтальных ловах эти виды присутствовали в заметных количествах, особенно при их распределении исключительно у поверхности, тем более что и объём воды процеживается значительно больший (примерно в 100 раз), и наоборот. Например, демерсальная икра C. saira на плавающем мусоре встречалась только в горизонтальных уловах, в то время как личинки G. stelleri встречались за редким исключением только в вертикальных уловах, т.е. к поверхности они практически не всплывают. Две станции (№ 56, 57), где личинки обнаружены в горизонтальных ловах и отсутствовали в вертикальных (рис. 6), находились в районе апвеллинга у м. Кузнецова. Видимо, здесь произошёл их принудительный вынос к поверхности, а при вертикальном облове вследствие малой численности они не попали в сеть.
Рис. 6.
Плотность распределения личинок Glyptocephalus stelleri в северной части Японского моря летом 2017 г., по данным вертикальных ( ) и горизонтальных (◼) ловов.
) и горизонтальных (◼) ловов.
В июле–августе 1999 и 2008−2013 гг. икра L. aspera доминировала в уловах (Moukhametova, 2002, 2012, 2014; Мухаметова, 2012). Однако в наших пробах присутствовали только личинки L. punctatissima, в правильности определения которых мы уверены (Шелехов, Епур, 2017б). Следует также отметить, что икра L. aspera и L. punctatissima очень схожа по размерам и пигментации (Перцева-Остроумова, 1961). В сборах Мухаметовой (Moukhametova, 2002, 2012, 2014) при существенной численности икры L. aspera в Татарском проливе полностью отсутствовали личинки этого вида, как и других видов семейства Pleuronectidae, что сильно снижает надёжность идентификации икры. Кроме того, Дехник (1959б) в работе по материалам КСЭ 1947–1949 гг. указывала, что в августе в Татарском проливе при горизонтальных ловах уловы икринок L. aspera были на порядок меньше, чем L. punctatissima, что согласуется с нашими данными.
Результаты недавней донной траловой съёмки в этом районе показали существенный рост численности L. punctatissima (Калчугин и др., 2016): её биомасса у западного побережья Сахалина в Японском море в 2015 г. была оценена почти в четыре раза выше, чем биомасса L. aspera. Следует учесть, что в летний период L. punctatissima держится, как правило, на меньших глубинах, чем L. aspera, зачастую вне акватории доступной для работы донным тралом.
Ранее Давыдов (1975) и Тихонов (1984) отмечали значительные колебания урожайности поколений L. aspera Западной Камчатки и объясняли их изменениями температурных условий обитания на ранних этапах онтогенеза, а также активностью Солнца. Тарасюк (1994) отмечал, что численность поколений L. aspera Западного Сахалина и зал. Терпения зависит от численности родительского стада, и высказал предположение о том, что колебания урожайности этого вида тесно связаны с выживаемостью генераций на ранних этапах онтогенеза. В наших сборах икра этой камбалы встречалась крайне редко, что, возможно, связано со снижением численности этого вида.
Численность E. japonicus в последние годы постепенно снижается в связи с глобальными изменениями в ихтиоценозе пелагиали Северной Пацифики и ростом численности Sardinops melanostictus, долгопериодические колебания которой находятся в противофазе с E. japonicus (Новиков, Свирский, 1987). Ещё 5–15 лет назад икра E. japonicus в августе составляла до 85% численности ихтиопланктона, плотность её распределения в Татарском проливе достигала 3.5 экз/м3, южнее − значительно больше (Moukhametova, 2002; 2012; 2014; Мухаметова, Mухаметов, 2013). В наших сборах в первой половине августа 2017 г. икра E. japonicus отсутствовала; при этом температура воды поверхностного слоя в центральной и восточной части Татарского пролива была вполне комфортна для его нереста (до 20°С), а на световых станциях у Южного Сахалина встречались взрослые особи этого вида. У приморского побережья в конце июля 2017 г. концентрации её икры были на порядок ниже отмеченных ранее (Moukhametova, 2014), а личинки не встречались совсем (рис. 5а).
По данным Расса (1959), в 1947–1949 гг. интенсивность нереста C. saira в Татарском проливе была также крайне низкая, однако в горизонтальных уловах встречались личинки этого вида, что могло быть обусловлено использованием более широкого набора орудий лова (в частности, малькового бимтрала Расса и конической сети Дерюгина с диаметром входного отверстия 100 см). Отсутствие икры C. saira в сборах 2000−2015 гг. (Moukhametova, 2002, 2012, 2014) также можно объяснить использованием вертикальных ловов и отчасти более ограниченной акваторией исследований.
По данным Дехник (1959а), S. japonicus в июле–августе 1947–1949 гг. был одним из доминирующих видов в ихтиопланктоне северной части Японского моря. Количество икры этого вида в уловах было несоизмеримо больше наблюдавшегося в 2017 г.: до 12400 против до 4 экз/10 мин траления при горизонтальном лове и до 294 против до 4 экз/м2 при вертикальном лове. Кроме того, в ходе ихтиопланктонных исследований СахНИРО 2000–2015 гг. S. japonicus у западного побережья Сахалина не отмечалась вовсе.
Эти изменения в структуре ихтиоценоза Японского моря, несомненно, связаны с климатическими перестройками и долгопериодическими колебаниями численности массовых видов: E. japonicus, S. melanostictus и S. japonicus.
Личинки семейства Stichaeidae в августе 1999 и 2008−2013 гг. в Татарском проливе не встречались (Moukhametova, 2002; 2012; 2014), тогда как в 1947–1949 гг. они присутствовали в уловах с III декады августа по октябрь (Казанова, 1959; Расс, 1959). Приведённый Казановой (1959) рисунок личинки Stichaeus sp. сходен с нашими экземплярами личинок S. fuscus – относительно недавно выделенного вида семейства Stichaeidae, биология которого пока изучена недостаточно. В настоящее время уже известно, что представители большинства видов рода Stichaeus нерестятся в зимне-весенний период, поэтому поимка нами личинок этого вида свидетельствует о том, что вид относится к немногочисленной группе стихеевых с летним нерестом (Баланов и др., 2018).
Таким образом, результаты нашего исследования позволяют говорить о слабых изменениях видового состава относительно середины прошлого века, с одной стороны, и о смене доминирующих видов – с другой. По-прежнему наиболее массовыми видами являются представители семейства Pleuronectidae, однако на смену L. aspera и Pseudopleuronectes herzensteini, которые доминировали в 1940-х гг. (Расс, 1959; Перцева Остроумова, 1961), пришли L. punctatissima, C. herzensteini и A. nadeshnyi – менее ценные промысловые виды рыб. Увеличение доли A. nadeshnyi в уловах в северной части Японского моря отмечалось с конца 1970-х гг., когда его биомасса среди представителей семейства Pleuronectidae превышала 44% (Милованкин, 2017). Значительно, даже в сравнении с исследованиями 5–10-летней давности, в Татарском проливе в августе снизилась нерестовая активность E. japonicus. Численность S. japonicus – ценного промыслового объекта у побережий Сахалина и Приморья в середине прошлого века − уже на протяжении нескольких десятилетий продолжает находиться в Японском море на очень низком уровне.
Список литературы
Баланов А.А., Лысенко В.Н. 2018. Исследования ихтиофауны севера Японского моря и донных сообществ в заливе Петра Великого (ННЦМБ ДВО РАН) // Тез. конф. “Итоги экспедиционных исследований на научных судах ФАНО России”. Севастополь: Изд-во МГИ РАН. С. 220–234.
Баланов А.А., Шелехов В.А., Земнухов В.В. 2018. Идентификация и распределение личинок Stichaeus fuscus Miki et Maruyama, 1986 (Merciformes: Mtichaeidae) // Биология моря. Т. 44. №. 6. С. 414–417.
Борец Л.А. 1990. Состав и биомасса донных рыб на шельфе северной части Японского моря // Биология шельфовых и проходных рыб. Владивосток: Изд-во ДВО РАН СССР. С. 59–65.
Булатов О.А. 1982. Сравнительный анализ результатов поверхностных и вертикальных обловов ихтиопланктонной сетью ИКС-80 // Биология моря. Вып. 6. С. 46–49.
Давыдов И.В. 1975. Режим вод западнокамчатского шельфа и некоторые особенности поведения и воспроизводства промысловых рыб // Изв. ТИНРО. Т. 97. С. 63–81.
Дехник Т.В. 1950. Материалы по размножению и развитию рыб дальневосточных морей: Автореф. дис. … канд. биол. наук. Л.: ЗИН АН СССР, 12 с.
Дехник Т.В. 1959а. Размножение и развитие японской скумбрии Pneumatophorus japonicas (Houttuyn) у берегов южного Сахалина // Исследования дальневосточных морей СССР. Вып. VI. М.: Изд-во АН СССР. С. 97–108.
Дехник Т.В. 1959б. Материалы по размножению и развитию некоторых видов дальневосточных камбал // Там же. Вып. VI. С. 109–131.
Дубинина А.Ю., Андреева Е.Н. 2008. Сравнение видового состава и распределения ихтиопланктона в восточной части Охотского моря в осенний период // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 10. Петропавловск-Камчатский: Изд-во КоНИРО. С. 49–56.
Дьяков Б.С. 2006. Межгодовая изменчивость циркуляции вод в Татарском проливе в летнее время // Изв. ТИНРО. Т. 144. С. 281–299.
Епур И.В., Баланов А.А. 2015. Видовой состав и сезонная динамика ихтиопланктона прибрежной зоны западной части залива Петра Великого Японского моря в 2007–2010 гг. // Вопр. ихтиологии. Т. 55. № 4. С. 397–410. https://doi.org/10.7868/S0042875215030030
Казанова И.И. 1959. Материалы по размножению и развитию некоторых видов рыб из вод южного Сахалина и южных Курильских островов // Исследования дальневосточных морей СССР. Вып. VI. М.: Изд-во АН СССР. С. 132–140.
Калчугин П.В., Бойко М.И., Соломатов С.Ф., Черниченко Э.П. 2016. Современное состояние ресурсов донных и придонных видов рыб в российских водах Японского моря // Изв. ТИНРО. Т. 184. С. 54–69. https://doi.org/10.26428/1606-9919-2016-184-54-69
Колпаков Н.В. 2005. Биология длиннорылой камбалы Limanda punctatissima (Pleuronectidae) прибрежных вод северного Приморья // Там же. Т. 143. С. 108–118.
Милованкин П.Г. 2017. Видовой состав и биомасса видов рыб по данным донных тралений в северо-западной части Японского моря в 1978–1990 гг. // Там же. Т. 189. С. 74–87. https://doi.org/10.26428/1606-9919-2017-189-47-51
Моисеев П.А. 1953. Треска и камбалы дальневосточных морей // Там же. Т. 40. С. 21–118.
Мухаметова О.Н. 2012. Исследования ихтиопланктона в лаборатории гидробиологии // Тр. СахНИРО. Т. 13. С. 118–133.
Мухаметова O.Н., Мухаметов И.Н. 2013. Ихтиопланктон прибрежной зоны залива Анива // Там же. Т. 14. С. 185–202.
Никитин А.А., Юрасов Г.И. 2008. Синоптические вихри японского моря по спутниковым данным // Исследование Земли из космоса. Т. 5. С. 42–57.
Никитин А.А., Данченко М.А., Лобанов В.Б., Юрасов Г.И. 2009 Новая схема поверхностной циркуляции Японского моря с учетом синоптических вихрей // Изв. ТИНРО. Т. 157. С. 158–167.
Новиков Ю.В., Свирский В.Г. 1987. Долгопериодические изменения численности основных промысловых рыб северо-западной части Тихого океана // Биологические ресурсы открытого океана. М.: Наука. С. 189–214.
Перцева-Остроумова Т.А. 1961. Размножение и развитие дальневосточных камбал. М.: Изд-во АН СССР, 484 с.
Пищальник Н.М., Архипкин В.С., Леонов А.В. 2010. О циркуляции вод в Татарском проливе // Вод. ресурсы. Т. 37. № 6. С. 657–670.
Погодин А.Г., Шатилина Т.А. 1998. Особенности термического режима вод и нерест эвфаузид в северной части Японского моря // Изв. ТИНРО. Т. 123. С. 168–184.
Расс Т.С. 1959. Исследования ихтиопланктона, произведенные Курило-Сахалинской экспедицией. Вып. VI // Исследования дальневосточных морей СССР. М.: Изд-во АН СССР. С. 78–96.
Расс Т.С., Казанова Н.Н. 1966. Методическое руководство по сбору икринок, личинок и мальков рыб. М.: Пищ. пром-сть, 35 с.
Соколовская Т.Г., Беляев В.А. 1987. Рекомендации по сбору и обработке ихтиопланктона зоны течения Куросио. Владивосток: Изд-во ТИНРО, 69 с.
Соколовский А.С., Соколовская Т.Г. 2008. Атлас икры, личинок и мальков рыб российских вод Японского моря. Владивосток: Дальнаука, 223 с.
Тарасюк С.Н. 1994. О возможных причинах, обуславливающих урожайность поколений желтоперой камбалы // Рыбохозяйственные исследования в Сахалино-Курильском районе и сопредельных акваториях. Южно-Сахалинск: Сах. обл. книж. изд-во. С. 23–32.
Тихонов В.И. 1984. Численность поколений желтоперой лиманды Limanda aspera (Pallas) (Pleuronectidae) // Вопр. ихтиологии. Т. 24. Вып. 2. С. 198–203.
Шелехов В.А., Епур И.В. 2017а. Особенности вертикального распределения пелагических икры и личинок различных видов рыб по анализу уловов вертикальных и горизонтальных тралений ИКС-80 // Матер. I нац. заоч. науч.-техн. конф. “Инновационное развитие рыбной отрасли в контексте обеспечения продовольственной безопасности Российской Федерации”. Владивосток: Изд-во Дальрыбвтуз. С. 117–123.
Шелехов В.А., Епур И.В. 2017б. Смена доминирующих видов рыб в летнем ихтиопланктоне Татарского пролива Японского моря в 2017 году // Там же. С. 124–130.
Шунтов В.П., Дулепова Е.П., Темных О.С. 1997. Современный статус и тенденция многолетней динамики биологических ресурсов дальневосточных морей // Тез. докл. I конгресса ихтиологов России. М.: Изд-во ВНИРО. С. 97–98.
Ahlstrom E.H., Butler J.L., Sumida Y. 1976. Pelagic stromateoid fishes (Pisces, Perciformes) of the eastern Pacific: kinds, distributions and early life histories and observations on five of these from the northwest Atlantic // Bull. Mar. Sci. V. 26. № 3. P. 285–402.
An atlas of the early stage fishes in Japan. 1988 / Ed. Okiyama M. Tokyo: Tokai Univ. Press, 1154 p.
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2019. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/ catalog/fishcatmain.asp. Version 02/2019)
Matarese A.C., Kendall A.W., Blood D.M., Vinter B.M. 1989. Laboratory guide to early life history stages of northeast Pacific fishes // US Dept. Comm. NOAA Tech. Rept. NMFS. № 80. 653 p.
Moukhametova O.N. 2002. Some peculiarities of fish eggs and larvae distribution in northern Japan Sea // Abstract 11-th Annual Meet. N. Pac. Mar. Sci. Org. Qingdao. P. 51–52.
Moukhametova O.N. 2012. Ichthyoplankton as an indicator of fish reproduction in Tatarskiy Strait (Japan Sea) // Proc. 27-th Int. Symp. Okhotsk Sea and Sea Ice. Hokkaido: Monbetsu. P. 133–136.
Moukhametova O.N. 2014. Reproductive and nursery potential of near shore area in the East of Tatarskyi Strait // Proc. 29-th Int. Symp. Okhotsk Sea and Sea Ice. Hokkaido: Monbetsu. P. 288–291.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


