Вопросы ихтиологии, 2020, T. 60, № 2, стр. 229-234
Изменение реореакции и содержания тиреоидных гормонов в крови молоди радужной форели Oncorhynchus mykiss при голодании
Д. С. Павлов 1, Е. Д. Павлов 1, *, Е. В. Ганжа 1, В. В. Костин 1
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 12.08.2019
После доработки 19.08.2019
Принята к публикации 20.09.2019
Аннотация
Изучены реореакция и содержание тиреоидных гормонов в крови молоди радужной форели Oncorhynchus mykiss при голодании (в течение 12 сут). Установлено, что голодание стимулирует рыб к перемещению преимущественно вниз по течению и приводит к снижению концентрации общего трийодтиронина в крови. У рыб, двигающихся преимущественно вверх против течения, концентрация общего трийодтиронина снижается в меньшей степени. Концентрация свободного трийодтиронина и общего тироксина на протяжении голодания не меняется. Показано, что уровень общего трийодтиронина в крови рыб является индикатором их миграционной активности.
Реореакция – отношение рыб к течению – сложное явление, которое выражается в направленном по отношению к вектору течения движении (перемещении) рыб в потоке (Павлов, 1979; Pavlov et al., 2010). Рыбы проявляют три типа реореакции ‒ положительный (ПТР), отрицательный (ОТР) и компенсаторный (КТР). Соотношение этих типов (показатель мотивационной компоненты реореакции) отражает наличие и направленность миграционной активности рыб (миграций или кочёвок) (Pavlov et al., 2010). Реореакция зависит как от внешних (среда обитания), так и от внутренних (физиологическое состояние организма) факторов.
Одним из важнейших факторов, который определяет физиологическое состояние и поведение рыб, является голодание. В зависимости от его длительности оно стимулирует молодь лососёвых (Salmonidae) к денатантной или контранатантной миграции (Павлов и др., 2010). Многие исследователи (Flood, Eales, 1982; Eales, 1988; Farbridge et al., 1992; MacKenzie et al., 1993; Gaylord et al., 2001; Arslan et al., 2015) отмечали, что голодание влияет на функционирование щитовидной железы: модифицируя синтез тиреоидных гормонов в организме, снижает их концентрацию в крови.
Тиреоидные гормоны играют важную роль в миграции рыб, принимают непосредственное участие в преадаптации молоди к новым условиям среды при совершении покатной миграции (Iwata, 1995; Ojima, Iwata, 2010; Arjona et al., 2011; Campinho, 2019). Адаптивная роль тиреоидных гормонов может быть связана с изменением двигательной активности рыб при совершении миграции за счёт модификации метаболизма (Youngson, 1989; Youngson, Webb, 1993). Нам не удалось найти работ, в которых оценивали влияние голодания на реореакцию одновременно с регистрацией происходящих у голодающих рыб изменений в гормональном статусе.
Цель работы – оценить изменения реореакции и концентрации тиреоидных гормонов у молоди радужной форели Oncorhynchus mykiss при голодании.
МАТЕРИАЛ И МЕТОДИКА
Эксперимент проведён 14−26.09.2018 г. в аквариальной ИПЭЭ РАН на молоди радужной форели, привезённой в возрасте 1.5 мес. из Племенного форелеводческого завода “Адлер”, Краснодарский край. Полученную молодь содержали в бассейне размером 3.0 × 0.6 × 0.6 м при уровне воды 0.5 м и плотности посадки ~300 экз/м3. Водообмен составлял ~1/3 объёма в сутки; температура воды − 14–16°C, концентрация кислорода в воде ~9 мг/л, освещённость круглосуточно поддерживали на уровне ~ 100 лк. Рыб до возраста 3 мес. кормили стартовым кормом “Biomar” (Дания) с размером гранул 0.8 мм, а далее − кормом “Coppens” (ФРГ) с гранулами 3 и 4 мм. Рацион составлял 3% (корм давали с избытком) массы тела молоди в сутки.
Для экспериментов использовали молодь, достигшую возраста 6 мес. со средней длиной тела 13 см и массой 25 г. Тип реореакции определяли в установке “рыбоход” (Pavlov et al., 2010; Павлов и др., 2018), которая представляет собой 2-метровый лоток шириной 60 см, разделённый на 9 отсеков поперечными неполными перегородками длиной 53 см; ширина прохода между отсеками – 7 см. Через установку с помощью погружного насоса мощностью 0.5 кВт создавали проток воды; скорость течения в проходах между отсеками составляла 20–30 см/с.
Рыб (по 10 экз.) помещали в средний отсек (5-й отсек установки, который является стартовым), закрытый с обеих сторон съёмными решётками. После 30-минутной акклимации особей к условиям эксперимента решётки стартового отсека убирали, а затем через 30 мин регистрировали число рыб в каждом отсеке “рыбохода”. Доля особей от их общего числа в опыте, поднявшихся против течения в отсеки 1–4, принята за вероятность проявления ПТР, оставшихся в 5-м (стартовом) отсеке – КТР, а сместившихся в нижние по течению отсеки – ОТР (Pavlov et al., 2010). Реореакцию оценивали у молоди после 0, 2 и 12 сут голодания (0 сут – рыбы в обычном состоянии накормленности). Как показали наши предыдущие исследования, на 2-е сут голодания начинаются изменения реореакции, на 10–12-е сут эти изменения стабилизируются или ослабевают (Павлов и др., 2010, 2018; Павлов Е.Д. и др., 2016). На каждом из трёх этапов эксперимента (0-е, 2-е и 12 сут) реореакцию оценивали по результатам четырёх‒шести опытов.
На основании полученных данных рассчитывали индекс контранатантности (Ik), указывающий, в каком направлении относительно течения в среднем сместились рыбы в группе опытов. Он изменяется от +1 (все рыбы переместились из стартовой камеры в верхний отсек № 1) до –1 (все рыбы переместились из стартовой камеры в нижний отсек № 9). Рассчитывали индекс по формуле: Ik = Σ(ni(Ns – i))/(Ns – 1)Σni, где ni – число рыб в i-том отсеке установки, экз.; Ns, i – номер стартового и i-того отсека установки.
Рыб разделяли на три группы по их положению в установке на момент завершения каждого опыта: особи из отсеков № 1–4 (ПТР) − группа 1, из отсека № 5 (КТР) – 2, № 6–9 (ОТР) – группа 3. Затем, не позднее 40 мин после завершения опыта, у рыб прижизненно шприцем отбирали кровь (50–150 мкл) из хвостовой вены за анальным плавником, измеряли длину по Смитту (FL) и массу тела, определяли пол по морфологическому строению половых желёз. Гонады молоди радужной форели в этом возрасте находились на II стадии зрелости. Яичники имели желтоватый цвет, утолщение в краниальной и медиальной частях. Семенники имели вид тонких прозрачных тяжей без утолщений.
Кровь отстаивали в пробирке объёмом 2 мл в течение 40 мин, затем центрифугировали при 5000 об/мин, полученную плазму переливали в чистые пробирки и замораживали при ‒20°C. Методом иммуноферментного анализа с использованием тест-наборов DRG (“DRG lnstruments”, ФРГ) на приборе Mindray MR 96A (КНР) в плазме определяли концентрации общего тироксина (Т4), общего (Т3) и свободного трийодтиронина (FT3), не связанного с белками плазмы крови. Бóльшая часть Т3 в крови связана с белками плазмы, а оставшаяся доля (<1%), т.е. FT3, является биологически активной фракцией гормона (Comeau, Campana, 2006.). Рассчитывали долю FT3 относительно T3 и отношение T4/T3 для оценки дейодирования – превращения Т4 в Т3. При измерении концентрации FT3 плазму крови разбавляли фосфатным буфером (рН 7.4) в 10 раз. Каждую пробу исследовали на содержание гормонов в двух–трёх повторностях.
Статистическая обработка материала выполнена с использованием t-критерия Стьюдента, критерия Стьюдента для долей, H-критерия Краскела–Уоллиса, U-критерия Манна–Уитни, кластерного анализа и коэффициента корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ
Длина и масса исследованных самок радужной форели составляла в среднем 13.1 ± 0.17 (9.0–16.4) см и 25.6 ± 1.07 (6.9–58.0) г, самцов − 12.8 ± 0.19 (9.3–17.1) см и 23.6 ± 1.04 (8.1–50.8) г. Достоверных различий между самками и самцами не обнаружено (t-критерий Стьюдента: р > 0.05).
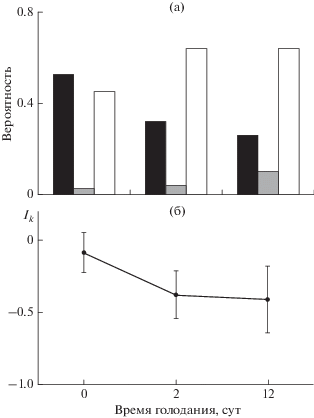
Реореакция. H-критерий Краскела−Уоллиса показал, что соотношение типов реореакции достоверно изменяется в процессе голодания (p = = 0.0009). При попарном сравнении с помощью менее мощного критерия Стьюдента для долей установлено, что от сытых рыб достоверно отличаются голодающие особи на 2-е сут по проявлению ОТР (р = 0.04), а на 12-е сут – по ПТР (р = 0.03).
За всё время эксперимента достоверно (критерий Стьюдента для долей: р ⪡ 0.001) наименее выраженным был КТР (рис. 1а), в основном особи проявляли динамические типы реореакции (ПТР и ОТР). В обычном состоянии накормленности (0-е сут) различий между этими типами реореакции не было (р = 0.50). На 2-е сут голодания соотношение типов реореакции резко изменилось: стал преобладать ОТР (р = 0.64) и возникли достоверные различия между ПТР и ОТР (р = 0.001). В результате снизился Ik (рис. 1б). От 2-х к 12-м сут голодания изменения соотношения типов реореакции были гораздо слабее. При этом снижался не только ПТР, но и ОТР, а КТР увеличивался. Различия в степени выраженности динамических типов оставались достоверными (р = 0.006). Соответственно, и значения Ik практически не изменились у особей на 2-е и 12-е сут голодания (рис. 1б).
Рис. 1.
Соотношение вероятностей проявления типов реореакции (а) и динамика индекса контранатантности
(Ik) (б) у молоди радужной форели Oncorhynchus mykiss при голодании. Типы реореакции: (◼) – положительный, ПТР, ( ) – компенсаторный, КТР, (◻) – отрицательный, ОТР; (│) – ошибка средней.
) – компенсаторный, КТР, (◻) – отрицательный, ОТР; (│) – ошибка средней.
Концентрация тиреоидных гормонов. H-критерий Краскела‒Уоллиса показал, что концентрация T3 зависит от двух факторов: от голодания (p < 0.001) и от того, какой тип реореакции у рыб преобладал (ПТР или ОТР) (p < 0.05). А изменения концентрации FT3 и Т4 не зависят ни от голодания, ни от того, какой тип реореакции преимущественно проявляла особь. Содержание тиреоидных гормонов в крови не зависит от длины, массы и пола рыб.
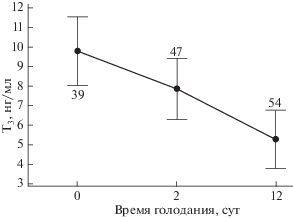
Совместное влияние исследованных факторов на концентрацию тиреоидных гормонов оказалось недостоверным, что требует проведения анализа влияния этих факторов независимо друг от друга. Концентрация Т3 в крови снижалась при голодании (рис. 2). У всех рыб с преобладанием ПТР в эксперименте (0-е, 2-е и 12-е сут) концентрация этого гормона достоверно выше (U-критерий: p < 0.05), чем у всех особей с ОТР – 8.9 (6.45, 0.4–25.3)11 против 6.4 (5.03, 0.1–23.6) нг/мл. У рыб, преимущественно проявляющих КТР, концентрации T3 (8.1 (6.99, 1.9–20.6) нг/мл) достоверно не отличались (p > 0.05) от особей, чаще проявляющих другие типы реореакции. Это может быть обусловлено малой численностью рыб, преимущественно проявляющих КТР в проведённых опытах.
Рис. 2.
Динамика концентрации общего трийодтиронина (Т3) в крови молоди радужной форели Oncorhynchus mykiss при голодании: цифрами на графике обозначено число исследованных рыб; ост. обозначения см. на рис. 1.
На всём протяжении голодания не выявлено заметной динамики содержания T4 в крови. Концентрация T4 и FT3 незначительно снижалась на 2-е сут голодания (таблица).
Концентрация тиреоидных гормонов в крови молоди радужной форели Oncorhynchus mykiss при голодании
| Время голодания, сут | Общий тироксин (T4), нг/мл | Свободный трийодтиронин (FT3), пг/мл | ||||||
|---|---|---|---|---|---|---|---|---|
| min−max | M | SD | n, экз. | min−max | M | SD | n, экз. | |
| 0 | 12.9‒19.6 | 16.3 | 9.77 | 35 | 5.0‒6.6 | 5.8 | 1.74 | 19 |
| 2 | 11.9‒18.2 | 15.1 | 9.86 | 40 | 4.0‒5.5 | 4.8 | 1.68 | 20 |
| 12 | 14.2‒19.5 | 16.8 | 10.43 | 56 | 4.8‒6.3 | 5.6 | 1.73 | 20 |
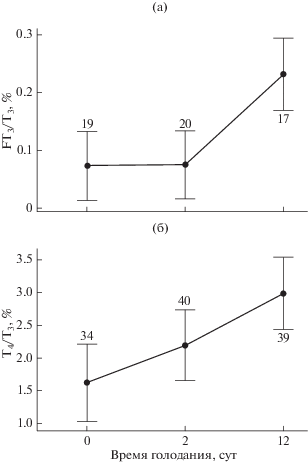
Доля FT3 от T3 в крови не различалась у сытых рыб и голодающих в течение 2 сут особей, а к 12-м сут голодания достоверно возрастала (U-критерий: p < 0.05) (рис. 3а). Показатель T4/T3 зависит от голодания рыб (H-критерий: p < 0.05), вызывающего его повышение (рис. 3б). Концентрация T3 в крови коррелирует с содержанием FT3 (rs = 0.35, p < 0.01), T4 (rs = 0.35, p < 0.001) и продолжительностью голодания (rs = –0.47, p < 0.001). FT3 положительно коррелирует (rs = 0.45, p < 0.001) с содержанием T4 в крови.
Рис. 3.
Динамика соотношений свободного трийодтиронина к общему (FT3/T3) (а) и общего тироксина к общему трийодтиронину (T4/T3) (б) при голодании молоди радужной форели Oncorhynchus mykiss; обозначения см. на рис. 1, 2.
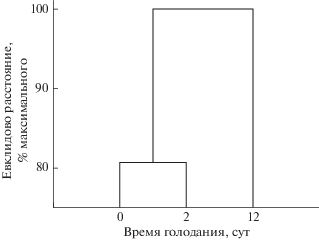
Кластерный анализ показал, что по концентрациям исследованных гормонов голодавшие в течение 12 сут особи максимально (100%) отстоят от других рыб (рис. 4). На уровне 81% различаются сытые и голодающие в течение 2 сут особи.
ОБСУЖДЕНИЕ
Голодание – мощный фактор, стимулирующий рыб на поиск пищи, что, в частности, выражается в повышении их миграционной активности (Olsson et al., 2006; Павлов, Савваитова, 2008; Flecker et al., 2010; Павлов и др., 2010; Ferguson et al., 2019). Результаты нашей работы показали, что уже на 2-е сут голодания у молоди радужной форели отношение к течению (соотношении типов реореакции) значительно изменяется. Особи, которые в обычном состоянии накормленности примерно в равной степени двигались как против течения, так и по течению, ко 2-м сут голодания стремились двигаться преимущественно по течению. К 12-м сут мотивация рыб к движению по течению несколько ослабевала за счёт повышения доли особей, проявляющих преимущественно КТР. Сходная динамика соотношения типов реореакции при голодании была отмечена у молоди лососёвых и ранее (Павлов и др., 2010, 2016, 2018; Павлов Е.Д. и др., 2016). Как правило, до 5-х сут голодания идёт повышение мотивации к миграции вниз по течению, при этом начальный индекс контранатантности (в обычном состоянии накормленности рыб – 0-е сут) может находиться на разных уровнях. При дальнейшем голодании рыб возможны два варианта проявления ими реореакции – сохранение преобладания ската особей (чаще проявляют ОТР) или увеличение движения рыб против течения (чаще проявляют ПТР). В настоящей работе динамика соотношения типов реореакции соответствовала первому из указанных вариантов.
Концентрация T3 заметно снижалась у рыб при голодании: на 12-е сут его концентрация в крови примерно в два раза ниже, чем у особей на 0-е сут (в обычном состоянии накормленности). Кроме того, содержание гормона отражает и миграционное состояние рыб, что показано при сравнительном анализе молоди лососёвых, выбирающих резидентную или проходную стратегию (Павлов и др., 2014). Результаты нашей работы показали, что концентрация трийодтиронина в крови может быть связана и с направлением миграции: у рыб, которые преимущественно двигались против течения, содержание T3 в крови было выше, чем у особей, чаще двигающихся по течению; т.е. у первых снижение этого гормона происходит, но не столь существенно, как у вторых. Это хорошо согласуется с данными о том, что при увеличении скорости течения у атлантического лосося Salmo salar повышается концентрация тиреоидных гормонов (Youngson, 1989; Youngson, Webb, 1992). Как было отмечено нами ранее (Павлов и др., 2014), именно содержание T3 следует рассматривать в качестве индикатора изменений в миграционном состоянии рыб.
Голодание в меньшей степени влияет на концентрацию T4 в крови рыб, отмечена лишь тенденция: небольшое снижение на 2-е сут голодания по сравнению с таковой у особей в обычном состоянии накормленности и возвращение к исходному уровню на 12-е сут. Такие изменения могут быть связаны со стрессом, вызванным отсутствием пищи, и последующей перестройкой синтеза тиреоидных гормонов. Известно (Peter, 2011), что тиреоидные гормоны могут изменять характер и степень ответа рыб на стресс за счёт модификации своего эффекта в организме либо действия гормонов стресса – кортизола и адреналина. О такой перестройке свидетельствует изменение дейодирования (процесса преобразования Т4 в Т3) у радужной форели при голодании – значение T4/T3 заметно возрастало, т.е. снижалась скорость превращения T4 в T3. На фоне снижения T3 концентрация FT3 в крови на протяжении голодания не менялась. Но при этом сохранялась скорость образования свободной фракции трийодтиронина из фракции связанного гормона, что стабилизирует его функциональную роль в организме.
Полученные результаты по зависимости содержания тиреоидных гормонов в крови рыб от голодания согласуются с данными литературы. Есть сведения (Flood, Eales, 1982), что T3 и T4 имеют тенденцию к снижению при голодании радужной форели, достоверное снижение содержания T3 отмечено на 6-е сут голодания. Снижение концентраций этих гормонов при голодании рыб выявлено и в более поздних работах на примере радужной форели (Farbridge et al., 1992) и канального сомика Ictalurus punctatus (изменения отмечены на 3-и сут голодания) (Gaylord et al., 2001). При возобновлении кормления сомика после голодания концентрации как T4, так и T3 возвращались к исходным значениям, что свидетельствовало о восстановлении работы дейодирования в организме. Уменьшение потребления пищи молодью красного горбыля Sciaenops ocellatus приводило к снижению T3 на фоне сохранения концентрации T4 в крови (MacKenzie et al., 1993). Это соответствует полученным нами данным на молоди радужной форели. Известно (Eales, 1988), что голодание ингибирует превращение T4 в T3, но дейодирование у рыб может восстановиться примерно через 3 сут после завершения длительного голодания.
Кластерный анализ показал, что по содержанию исследованных гормонов в крови 12-е сут голодания максимально отстоят от 0-х и 2-х сут. Это свидетельствует о том, что влияние голодания на уровень исследованных тиреоидных гормонов в организме к этому времени усиливается.
Таким образом, голодание молоди радужной форели вызывает уменьшение концентрации T3 в крови за счёт снижения скорости дейодирования. На фоне снижения уровня гормона происходит повышение движения рыб вниз по течению, что указывает на связь этих двух процессов. Учитывая стабильность концентрации T4 и FT3 у рыб в течение эксперимента, характер связи концентрации тиреоидных гормонов и реореакции может быть не причинно-следственным, а корреляционным. Наряду с этим нельзя не отметить предположение Янгсона (Youngson, 1989) о том, что изменение миграционной активности рыб может являться причиной, а не следствием модификации тиреоидной оси.
ВЫВОДЫ
1. Голодание вызывает перемещение молоди радужной форели преимущественно по течению и сопровождается снижением содержания общего трийодтиронина в крови. У рыб, двигающихся преимущественно против течения, концентрация этого гормона снижается в меньшей степени.
2. Концентрация общего тироксина и свободного трийодтиронина не меняется на протяжении голодания. По мере увеличения продолжительности голодания (к 12-м сут) наблюдается повышение доли свободного трийодтиронина относительно уровня общего трийодтиронина.
3. При голодании у рыб модифицируется процесс дейодирования – снижается интенсивность образования трийодтиронина из тироксина, что приводит к снижению фракции связанного трийодтиронина в крови.
Список литературы
Павлов Д.С. 1979. Биологические основы управления поведением рыб в потоке воды. М.: Наука, 319 с.
Павлов Д.С., Савваитова К.А. 2008. К проблеме соотношения анадромии и резидентности у лососевых рыб (Salmonidae) // Вопр. ихтиологии. Т. 48. № 6. С. 810–824.
Павлов Д.С., Костин В.В., Пономарева В.Ю. 2010. Поведенческая дифференциация сеголеток черноморской кумжи Salmo trutta labrax: реореакция в год, предшествующий смолтификации // Там же. Т. 50. № 2. С. 251–261. https://doi.org/10.1134/S0032945210030070
Павлов Д.С., Павлов Е.Д., Ганжа Е.В. и др. 2014. Цитологическое состояние гонад и уровень тиреоидных и половых стероидных гормонов у двух фенотипических форм молоди черноморской кумжи Salmo trutta labrax // Там же. Т. 54. № 4. С. 470–478. https://doi.org/10.7868/S0042875214030114
Павлов Д.С., Павлов Е.Д., Костин В.В., Ганжа Е.В. 2016. Реореакция молоди радужной форели при воздействии сурфагона // Онтогенез. Т. 47. № 2. С 110–116. https://doi.org/10.7868/S0475145016020075
Павлов Д.С., Павлов Е.Д., Ганжа Е.В. и др. 2018. Влияние сурфагона на реореакцию молоди кумжи Salmo trutta // Вопр. ихтиологии. Т. 58. № 6. С. 740‒744. https://doi.org/10.1134/S004287521806019X
Павлов Е.Д., Ганжа Е.В., Пономарева В.Ю. и др. 2016. Влияние метилтестостерона на физиологическое состояние и реореакцию радужной форели Parasalmo mykiss (= Oncorhynchus mykiss) при неблагоприятных условиях содержания // Там же. Т. 56. № 6. С. 740–752. https://doi.org/10.7868/S0042875216060072
Arjona F.J., Vargas-Chacoff L., del Río M.P. et al. 2011. Effects of cortisol and thyroid hormone on peripheral outer ring deiodination and osmoregulatory parameters in the senegalese sole (Solea senegalensis) // J. Endocrinol. V. 208. P. 323–330. https://doi.org/10.1530/JOE-10-0416
Arslan G., Sahin T., Hisar O., Hisar S.A. 2015. Effects of low temperature and starvation on plasma cortisol, triiodothyronine, thyroxine, thyroid-stimulating hormone and prolactin levels of juvenile common carp (Cyprinus carpio) // Mar. Sci. Tech. Bull. V. 4. № 2. P. 5–9.
Campinho M.A. 2019. Teleost metamorphosis: the role of thyroid hormone // Front. Endocrinol. V. 10. P. 1–12. https://doi.org/10.3389/fendo.2019.00383
Comeau L.A., Campana S.E. 2006. Correlations between thyroidal and reproductive endocrine status in wild Atlantic cod // Can. Tech. Rept. Fish. Aquat. Sci. № 2682. 14 p.
Eales J.G. 1988. The influence of nutritional state on thyroid function in various vertebrates // Amer. Zool. V. 28. P. 351–362.
Farbridge K.J., Flett P.A., Leatherland J.F. 1992. Temporal effects of restricted diet and compensatory increased dietary intake on thyroid function, plasma growth hormone levels and tissue lipid reserves of rainbow trout Oncorhynchus mykiss // Aquaculture. V. 104. P. 157–174. https://doi.org/10.1016/0044-8486(92)90146-C
Ferguson A., Reed T.E., Cross T.F. et al. 2019. Anadromy, potamodromy and residency in brown trout Salmo trutta: the role of genes and the environment // J. Fish Biol. V. 95. № 3. 27 p. https://doi.org/10.1111/jfb.14005
Flecker A.S., McIntyre P.B., MooreShow J.W. et al. 2010. Migratory fishes as material and process subsidies in riverine ecosystems // Amer. Fish. Soc. Symp. V. 73. P. 559–592.
Flood C.G., Eales J.G. 1982. Effects of starvation and refeeding on plasma T4 and T3 levels and T4 deiodination in rainbow trout, Salmo gairdneri // Can. J. Zool. V. 61. P. 1949–1953. https://doi.org/10.1139/z83-255
Gaylord T.G., MacKenzie D.S., Gatlin D.M. 2001. Growth performance, body composition and plasma thyroid hormone status of channel catfish (Ictalurus punctatus) in response to short-term // Fish Physiol. Biochem. V. 24. P. 73–79.
Iwata M. 1995. Downstream migratory behavior of salmonids and its relationship with cortisol and thyroid hormones: a review // Aquaculture. V. 135. P. 131–139. https://doi.org/10.1016/0044-8486(95)01000-9
MacKenzie D.S., Moon H.Y., Gatlin D.M., Perez L.R. 1993. Dietary effects on thyroid hormones in the red drum, Sciaenops ocellatus // Fish Physiol. Biochem. V. 11. P. 329–335. https://doi.org/10.1007/BF00004582
Ojima D., Iwata M. 2010. Central administration of growth hormone-releasing hormone and corticotropin-releasing hormone stimulate downstream movement and thyroxine secretion in fall-smolting coho salmon (Oncorhynchus kisutch) // Gen. Comp. Endocrinol. V. 168. № 1. P. 82–87. https://doi.org/10.1016/j.ygcen.2010.04.007
Olsson I.C., Greenberg L.A., Bergman E., Wysujack K. 2006. Environmentally induced migration: the importance of food // Ecol. Letters. V. 9. P. 645–651. https://doi.org/10.1111/j.1461-0248.2006.00909.x
Pavlov D.S., Kostin V.V., Zvezdin A.O., Ponomareva V.Yu. 2010. On methods of determination of the rheoreaction type in fish // J. Ichthyol. V. 50. № 11. P. 977–984. https://doi.org/10.1134/S0032945210110020
Peter M.C. 2011. The role of thyroid hormones in stress response of fish // Gen. Comp. Endocrinol. V. 172. P. 198–210. https://doi.org/10.1016/j.ygcen.2011.02.023
Youngson A.F. 1989. Thyroid hormones in migrating Atlantic salmon // Aquaculture. V. 82. P. 319–327. https://doi.org/10.1016/0044-8486(89)90418-3
Youngson A.F., Webb J.H. 1992. The relationship between stream or river discharge and thyroid hormone levels in wild adult Atlantic salmon (Salmo salar L.) // Can. J. Zool. V. 70. № 1. P. 140–144. https://doi.org/10.1139/z92-021
Youngson A.F., Webb J.H. 1993. Thyroid hormone levels in Atlantic salmon (Salmo salar) during the return migration from the ocean to spawn // J. Fish Biol. V. 42. P. 293–300. https://doi.org/10.1111/j.1095-8649.1993.tb00329.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии