Вопросы ихтиологии, 2020, T. 60, № 3, стр. 271-281
Описание пелагических личинок Chirolophis japonicus и Ch. saitone (Stichaeidae) из вод залива Петра Великого (Японское море)
А. А. Баланов 1, *, И. В. Епур 1, В. А. Шелехов 1
1 Национальный научный центр морской биологии Дальневосточного отделения РАН − ННЦМБ ДВО РАН
Владивосток, Россия
* E-mail: abalanov@imb.dvo.ru
Поступила в редакцию 23.04.2019
После доработки 29.04.2019
Принята к публикации 14.05.2019
Аннотация
Приводится описание развития от стадии желточного мешка до оседания на дно личинок Chirolophis japonicus и Ch. saitone из вод зал. Петра Великого (Японское море). Впервые формализована схема размещения меланиновой пигментации на теле личинок этих видов рода Chirolophis. Она состоит из шести рядов, верхнеголовного скопления и нескольких отдельных меланофоров. Несмотря на сходство видов, каждому из них свойственны специфичные черты. В основном это выражается в разном числе элементов осевого скелета (общее число позвонков, число лучей в спинном и анальном плавниках). Показано, что надёжным диагностическим признаком для идентификации личинок Ch. japonicus и Ch. saitone в период их развития от вылупления до оседания может служить число меланофоров у основания лучей анального плавника.
В Японском море отмечено присутствие трёх видов рода Chirolophis (Nakabo, 2002), два из которых – Ch. japonicus и Ch. saitone − встречаются в зал. Петра Великого. Первый вид известен от Пусана до зал. Петра Великого, вдоль япономорского и тихоокеанского берегов о-вов Хонсю и Хоккайдо (Линдберг, Красюкова, 1975). Второй вид ранее был известен по редким поимкам преимущественно в водах Японии (побережье северной части о-ва Хонсю и на тихоокеанском побережье о-ва Хоккайдо (Masuda et al., 1984; Amaoka et al., 1989, 1995)); в водах зал. Петра Великого впервые отмечен в 2000 г. (Маркевич, 2002). В последующие годы было выяснено, что в водах зал. Петра Великого Ch. saitone является резидентным видом, и в весенне-летний период здесь встречаются его личинки и мальки (Соколовский и др., 2004; Соколовская и др., 2010; Епур, Баланов, 2015).
В настоящее время биология обоих видов рода Chirolophis из северной части Японского моря очень слабо изучена (Соколовский и др., 2011; Епур, Баланов, 2015). Все наиболее полные данные о строении и развитии личинок Ch. japonicus и Ch. saitone известны из работ японских ихтиологов (Shiogaki, 1983a, 1983b; Okiyama, 1988). В отечественных публикациях имеется информация о том, что в зал. Петра Великого размеры, пропорции и пигментация личинок этих видов очень похожи и пелагическая стадия развития у них протекает в сходные сроки (Соколовский, Соколовская, 2008; Баланов и др., 2010). Надёжных диагностических признаков, позволяющих различать личинок, практически нет. Всё это сильно затрудняет идентификацию обоих видов в планктоне.
Цель статьи – выполнить морфологическое описание и выявить диагностически значимые признаки пелагических личинок Ch. japonicus и Ch. saitone в водах зал. Петра Великого Японского моря.
МАТЕРИАЛ И МЕТОДИКА
Материалом для настоящего сообщения служили личинки Ch. japonicus (17 экз.) и Ch. saitone (15 экз.), собранные в апреле–мае 2017 г., в марте–мае и в ноябре–декабре 2018 г. в прибрежных водах б. Жидкова (43°01′25′′ с.ш. 131°55′66′′ в.д.) зал. Петра Великого. Личинок собирали на световых станциях с наступлением вечерних сумерек до 01.00. Источником света служила светодиодная лампа дневного света (мощностью 20 Вт), которую подвешивали на расстоянии 0.5–0.7 м от поверхности моря. В месте выполнения световых станций у пирса глубина составляла 6–8 м. Привлечённых в освещённую зону рыб облавливали сачками из газа через 1 ч после включения света (Соколовский, Соколовская, 2008; Баланов и др., 2010; Соколовская и др., 2010). Личинок фиксировали 4%-ным раствором формальдегида либо 96%-ным этиловым спиртом. Полную (TL) и стандартную (SL) длину и пластические признаки измеряли на фиксированном материале.
Общепринятое обозначение элементов меланиновой пигментации у личинок стихеевых рыб (Stichaeidae) отсутствует. Предложена оригинальная схема размещения пигментной окраски для обоих видов рода Chirolophis (рис. 1). Элементы окраски на этой схеме обозначены по аналогии с ранее опубликованными данными по стихеевым и другим группам рыб (Расс, 1949; Горбунова, 1962; Григорьев, 1991). Для анализа меристических признаков и меланиновой пигментации по 14 экз. каждого вида окрасили ализариновым красным, а затем просветлили в глицерине (Якубовски, 1970). У просветлённых личинок (по 7 экз. каждого вида: Ch. japonicus – TL 26.0–34.5 мм, Ch. saitone – TL 24.5–35.5 мм), чьи кости хорошо прокрашивались ализарином, подсчитали общее число позвонков (vert.) и лучей в грудном, спинном, анальном и хвостовом плавниках (P, D, A и C). Дополнительно число лучей в D и A подсчитали у неокрашенных личинок Ch. japonicus TL 28.5–31.0 мм (3 экз.) и Ch. saitone TL 30.5 мм (1 экз.). Счётные и пластические признаки анализировали в разных размерных группах личинок для выявления морфологических изменений в процессе их развития (табл. 1).
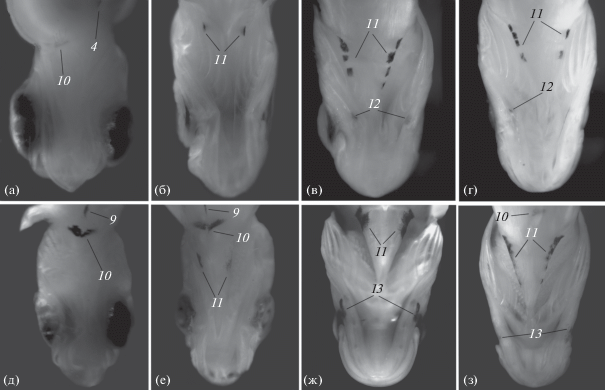
Рис. 1.
Общая схема размещения пигмента на теле пелагических личинок Chirolophis japonicus и Ch. saitone: 1 – верхнеголовное скопление, 2 – меланофор в верхней части praeoperculum, 3 – глубинный ряд, 4 – надкишечный ряд, 5 – спинной ряд, 6 – хвостовой ряд, 7 – меланофоры в нижней части хвостового стебля, 8 – анальный ряд, 9 – брюшной ряд, 10 – пигмент под основанием брюшных плавников, 11 – ряды по бокам isthmus, 12 – меланофор в нижней части praeoperculum, 13 – подглазничная полоса, 14 – окологлазничная кайма.
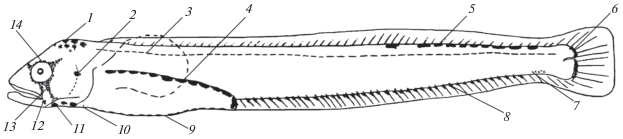
Таблица 1.
Состав проанализированных размерных групп личинок Chirolophis japonicus и Ch. saitone
| Размерная группа (TL), мм | Ch. japonicus (17 экз.) | Ch. saitone (15 экз.) | ||
|---|---|---|---|---|
| TL, мм | Дата поимки | TL, мм | Дата поимки | |
| <10.0 | 9.5 | 07.11.2018 | ||
| 10.0–15.0 | 12.5, 12.5 | 14.12.2018 | 12.5, 13.5, 14.5 | 20.12.2018 |
| 15.1–20.0 | 15.2, 15.2 15.5 |
12.03.2018 29.11.2018 |
19.0 | 20.12.2018 |
| 20.1–25.0 | 23.5 24.0 |
14.04.2017 20.04.2018 |
24.0 24.5 |
14.04.2017 27.04.2017 |
| 25.1–30.0 | 26.0 28.0 (28.5, 29.5) 30.0 |
21.04.2017 20.04.2018 12.05.2017 |
26.0 28.0, 30.0 |
21.04.2017 27.04.2018 |
| >30.0 | 32.0, 32.5, 33.0, 34.5 (31.0) | 12.05.2017 | 32.5 (30.5) 33.0, 34.0, 35.5 |
01.04.2017 21.04.2017 |
Измерения десяти пластических признаков (с точностью до 0.1 мм под микроскопом Olympus, Япония) проводили у всех пойманных личинок в соответствии с общепринятыми методиками (Ланге, Дмитриева, 1981; Powles, Markle, 1984; Matarese et al., 1989). TL измеряли от кончика рыла до конца средних лучей хвостового плавника. Исследованы следующие признаки (в % SL): длина головы (c), длина рыла (ao), диаметр глаза (o), высота тела на уровне заднего края ануса (h), антеанальное расстояние (аA), длина верхней челюсти (lmx), длина грудного плавника (lP), длина хвоста (cd).
Мы рассчитали аллометрические коэффициенты каждого признака у каждой личинки по методике, предложенной ранее Савельевым с соавторами (2011): Iij = ln(Pij/Pj), где Iij – индекс j-того признака i-той рыбы, Pji – фактическое относительное значение j-того признака i-той рыбы, Pj – расчётное значение j-того признака для всей совокупности особей. Для сравнения нормированных таким образом значений пластических признаков использовали более мощный параметрический тест Колмогорова–Смирнова.
При описании личинок выделяли особей с желточным мешком и особей на трёх стадиях развития, различающихся по степени изгиба хорды в процессе формирования скелета хвостового плавника (Kendall et al., 1984): preflexion (личинки с прямой хордой), flexion (формирование лучей в хвостовом плавнике и изгиба хорды) и postflexion (личинки с завершённым процессом изгиба хорды и сформированными лучами в плавниках).
Фотографии выполнены с использованием стереомикроскопа Stereo Discovery V 12, (“К. Zeiss”, Германия). Исследованные особи хранятся в коллекции лаборатории ихтиологии ННЦМБ ДВО РАН (г. Владивосток).
РЕЗУЛЬТАТЫ
Общая характеристика окраски Ch. japonicus и Ch. saitone
При жизни личинки представителей рода Chirolophis прозрачные, но после фиксации прозрачность тканей существенно уменьшается. Для Ch. japonicus и Ch. saitone из зал. Петра Великого характерна общая модель размещения пигмента на теле (рис. 1). Верхнеголовное скопление меланофоров состоит из крупных округлых пигментных пятен, число и интенсивность окраски которых варьируют у обоих видов (рис. 2–4). У верхнего и нижнего края предкрышечной кости находятся одиночные меланофоры. Глубинный ряд непарный, выглядит как пунктирная линия. Меланофоры этого ряда проходят через верхнюю часть позвонков вдоль всего позвоночного столба (рис. 2, 3). Надкишечное скопление меланофоров многорядное; оно образовано отдельно лежащими меланофорами разного размера и разной формы (от округлой с боковыми выступами до прямоугольной). Спинной поверхностный ряд парный, проходит вдоль основания лучей D в задней трети тела справа и слева. По краю гипуральных пластин (с узким разрывом между верхней и нижней пластинами) располагается хвостовой ряд меланофоров. Анальный поверхностный ряд парный, проходит вдоль основания лучей A (кроме первого и последнего лучей) справа и слева, образован меланофорами преимущественно треугольной формы. За ним, в нижней части хвостового стебля, располагаются от одного до пяти небольших поверхностных меланофоров. Брюшной ряд непарный, проходит по средней линии брюха. Он имеет вид узкой прерывистой (состоящей из мелких поверхностных меланофоров) или сплошной линии. При полном развитии начинается от основания V и заканчивается, не доходя до ануса 1/3 расстояния от V до ануса. За тазовыми костями просматривается внутренняя пигментация задней стенки сердечной сумки в виде V-образного меланофора. У живых личинок она хорошо выражена (рис. 5), в то время как у фиксированных и у личинок по мере развития (TL ≥ 20.0 мм) просматриваются крайне слабо. По бокам isthmus расположены симметричные ряды поверхностных меланофоров разного размера (рис. 1, 5). По наружному краю глаза имеется окологлазничная кайма в виде пунктирной линии и радиальной исчерченности (рис. 3д, 3е).
Рис. 2.
Личинки Chirolophis japonicus разной длины (TL), мм: а – 12.5, б – 15.2, в – 23.5, г – 28.0, д – 32.5.
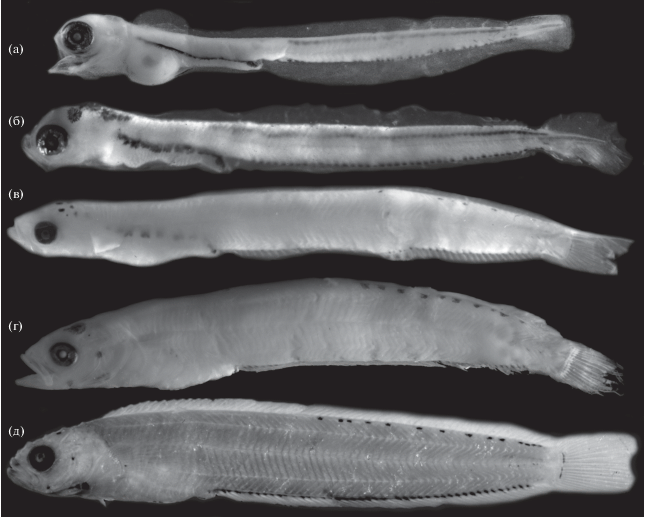
Рис. 3.
Личинки (а–д) и осевший малёк (е) Chirolophis saitone разной длины (TL), мм: а – 9.5, б – 13.5, в – 24.0, г – 28.0, д – 32.5, е – 32.5.
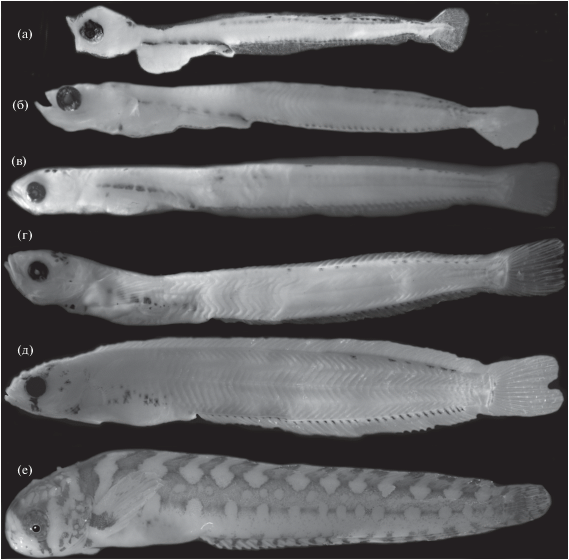
Рис. 4.
Размещение меланиновой пигментации сверху на голове личинок Chirolophis japonicus (а–г) и Ch. saitone (д–з) разной длины (TL), мм: а – 12.5, б – 23.5, в – 32.0, г – 32.5, д – 12.5, е – 24.0, ж – 32.5, з – 33.0; обозначения см. на рис. 1.
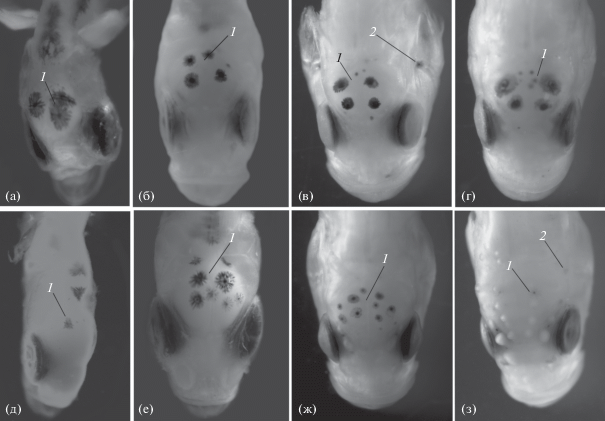
Рис. 5.
Голова личинки Chirolophis japonicus (а–г) и Ch. saitone (д–з) разной длины (TL, мм), вид снизу: а – 12.5, б – 23.5, в – 31.0, г – 32.5, д – 13.5, е – 24.0, ж – 30.0, з – 32.5; обозначения см. на рис. 1.
Chirolophis japonicus Herzenstein, 1890
Описание. D 61–62, A I 44–46, n = 10; P 13–15, C 6 + 7 + 8, vert. 65–67, n = 7.
При TL 10.0–15.0 мм у личинок ещё сохраняются остатки желточного мешка (рис. 2а). Хорда прямая; D, A и C в виде плавниковой каймы. Ализарином прокрашиваются челюсти и три–шесть элементов гипурального комплекса. Остальные элементы скелета не окрашиваются. Число меланофоров в спинном ряду сильно варьирует. Этот ряд может быть представлен как одним поверхностным меланофором, расположенным в конце хвостового стебля, так и практически соответствовать длине анального ряда (не более 15 меланофоров), модальная группа – 7–9. В дальнейшем с ростом личинок изменений этого признака не происходит. Анальный ряд не доходит до ануса и состоит из 41–43 меланофоров. Глубинный ряд ещё полностью не сформирован: имеется разрыв над задней половиной брюшного отдела. Надкишечное скопление состоит из одного ряда плотно расположенных тёмных меланофоров. Сбоку этот ряд выглядит как сплошная линия, однако при осмотре снизу видно, что он состоит из отдельных прямоугольных меланофоров, число которых варьирует от 9 до 11, наиболее часто встречаемая комбинация – 10. Верхнеголовное скопление состоит из одного–трёх крупных меланофоров (рис. 4а). Низ головы не пигментирован. Просматривается внутренняя пигментация задней стенки сердечной сумки (рис. 5а). В нижней части хвостового стебля находятся три–шесть поверхностных меланофоров (рис. 2а).
При TL 15.1–20.0 мм у окрашенных и просветлённых экземпляров просматриваются челюсти и в скелете хвостового плавника восемь–девять элементов гипурального комплекса. На стадии preflexion при TL 15.1–15.4 мм постличинки имеют прямую хорду. Хвостовой плавник в этот период округлой формы, его лучи расположены снизу от хорды. При TL ≥ 15.5 мм постличинки переходят в стадию flexion. У них загибается хорда и образуется уростиль, хвостовой плавник приобретает трапециевидную форму с небольшой выемкой в середине его задней части. Анальный ряд достигает ануса и содержит полный набор элементов – 44–45 поверхностных меланофоров. При дальнейшем увеличении размеров постличинок этот признак не изменяется (рис. 2б). Глубинный ряд всё ещё формируется, его разрыв начинается от вертикали окончания грудных плавников и заканчивается в начале задней трети кишечной трубки. Надкишечный ряд образован из близко расположенных друг к другу плоских меланофоров, число которых варьирует от 9 до 12, чаще – 12. При TL 15.1 мм у постличинок появляется брюшной ряд меланофоров. В нижней части хвостового стебля есть один–два небольших меланофора. С увеличением размеров постличинок оба признака не меняются.
При TL 20.1–25.0 мм постличинки находятся на стадии postflexion, и они уже практически полностью сформированы (рис. 2в). D и A не сливаются с C. У постличинок ализарином окрашиваются челюсти, кончики лучей D, A, С и центральные области тел позвонков в виде узких полосок. Надо отметить, что степень прокраски ализарином элементов скелета осенних постличинок (05.12.2018 г. TL 23.5 мм) такая же, как и весенних (22.04.2018 г. TL 24.0 мм). Глубинный ряд не имеет разрывов и полностью сформирован. У фиксированных постличинок в предорсальной области этот ряд практически не просматривается из-за утолщения тканей. Над кишкой расположены два ряда округлых меланофоров разного размера. Их число варьирует от 12 до 17, модальная группа – 13–15. На просветлённых постличинках надкишечный ряд ярко выражен, в то время как у фиксированных заметны лишь единичные округлые вкрапления пигмента. Верхнеголовное скопление состоит из трёх–пяти меланофоров разного размера. В каждом ряду по бокам isthmus один–четыре (чаще 3) меланофора. При увеличении размеров постличинок данный признак не меняется (рис. 5б). У этой размерной группы по краю гипуральных пластин начинает формироваться хвостовой ряд меланофоров (рис. 2в).
При TL 25.1–30.0 мм постличинки находятся на стадии postflexion. Кости у них уже сформированы и хорошо прокрашиваются ализарином. Надкишечный ряд образован одним–тремя рядами отдельно лежащих друг от друга округлых меланофоров. Число меланофоров варьирует от 14 до 28, модальная группа – 16–20 (рис. 2г). Верхнеголовное скопление образовано поверхностными меланофорами с крупными ядрами внутри, которые занимают до 60–80% площади пятна. Число этих меланофоров варьирует от четырёх до 16, модальная группа – 5–8. При дальнейшем развитии и росте постличинок изменений этого признака не происходит. Крупный меланофор присутствует на верхнем крае предкрышки у 92.9% постличинок этой размерной группы; практически всегда имеется меланофор в нижнем углу предкрышки.
При TL > 30.0 мм у постличинок на голове присутствуют многочисленные мелкие бугорки (рис. 4в, 4г). Хвостовой ряд меланофоров полностью сформирован. У постличинок этой размерной группы не обнаружен переход к мальковому типу окраски (рис. 2д).
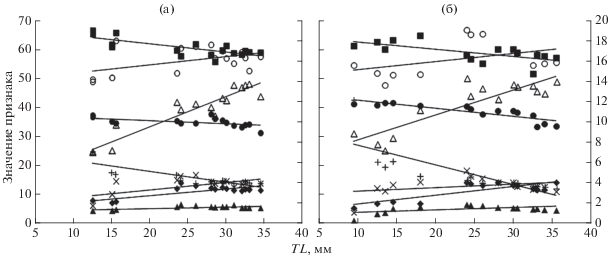
Изменения пластических признаков по мере роста и развития личинок Ch. japonicus представлены на рис. 6а.
Рис. 6.
Зависимость относительных значений (% SL) некоторых пластических признаков от длины (TL) личинок Chirolophis japonicus (а) и Ch. saitone (б). По оси ординат слева: (⚫) – антеанальная длина, (▲) – длина верхней челюсти, (◆) – длина грудного плавника, (◼) – длина хвоста; по оси ординат справа: (△) – высота тела на уровне заднего края ануса, (⚪) – длина головы, (+) – диаметр глаза, (×) – длина рыла.
Chirolophis saitone (Jordan et Snyder, 1903)
Описание. D 53–55, A I 37–39, n = 8; P 13–15, C (5–6) + 6 + (7–8) + (2–3), vert. 58–60, n = 7.
При TL < 10.0 мм личинки находятся на стадии preflexion. Желточный мешок практически полностью резорбирован (рис. 3а). Хорда прямая; D, A и C в виде плавниковой каймы. Ализарином прокрашиваются нижняя челюсть и один элемент гипурального комплекса. Остальные элементы скелета на личинках не окрашиваются. Число меланофоров в спинном ряду сильно варьирует: от одного поверхностного меланофора в конце хвостового стебля до 15 (модальная группа – 7–9), когда этот ряд практически соответствует длине анального ряда. В дальнейшем с ростом личинок изменений этого признака не происходит. Анальный ряд не доходит до ануса и состоит из 28 меланофоров. Глубинный ряд ещё полностью не сформирован: имеется разрыв над анусом, а затем он вновь просматривается на уровне грудных плавников. Надкишечный ряд образован из одного ряда расположенных близко друг к другу девяти плоских меланофоров. Брюшной ряд полностью сформирован, его форма не меняется при дальнейшем развитии личинок. Верхнеголовное скопление состоит из одного крупного меланофора. Низ головы не пигментирован. Просматривается внутренняя пигментация задней стенки сердечной сумки, чуть позади тазовых костей, в виде V-образного меланофора.
При TL 10.1–15.0 мм у окрашенных и просветлённых постличинок просматриваются челюсти, кончики лучей P и в скелете C шесть–девять элементов гипурального комплекса. Хорда прямая. Хвостовой плавник округлой формы, расположен внизу хорды. Анальный ряд ещё полностью не сформирован и содержит от 32 до 33 поверхностных меланофоров (рис. 3б). Глубинный ряд всё ещё формируется, его разрыв начинается от вертикали окончания грудных плавников и заканчивается в начале задней трети кишечной трубки. Надкишечный ряд образован из близко расположенных друг к другу плоских 10−11 меланофоров. Верхнеголовное скопление состоит из двух−четырёх поверхностных меланофоров разного размера (рис. 4д). В нижней части хвостового стебля располагаются один–три небольших меланофора. С увеличением размеров постличинок данный признак не изменяется (рис. 3б).
При TL 15.1–20.0 мм исследованная постличинка находилась на стадии postflexion. У окрашенного и просветлённого экземпляра просматриваются челюсти, лучи P, в скелете C восемь–девять элементов гипурального комплекса и частично центральные области тел позвонков в виде узких полосок. Хорда загнута. Хвостовой плавник приобретает трапециевидную форму с небольшой выемкой в середине его задней части. Анальный ряд достигает ануса и содержит полный набор элементов – 34−38 поверхностных меланофоров. С увеличением размеров постличинок данный признак не изменяется. Глубинный ряд не имеет разрывов и полностью сформирован. У фиксированных постличинок в предорсальной области этот ряд практически не просматривается из-за утолщения тканей. При дальнейшем росте и развитии постличинки эти признаки не изменяются. Над кишкой расположены два ряда отдельно лежащих друг от друга 12 округлых меланофоров разного размера. Верхнеголовное скопление состоит из шести меланофоров разного размера. В каждом ряду по бокам isthmus расположено по одному крупному меланофору.
При TL 20.1–25.0 мм постличинки находятся на стадии postflexion и уже практически полностью сформированы. D и A не сливаются с C. Ализарином прокрашиваются челюсти, кончики лучей D, A, C и центральные области тел позвонков в виде узких полосок. Надкишечный ряд образован одним–четырьмя рядами лежащих отдельно друг от друга округлых меланофоров. Их число варьирует от 13 до 35, модальная группа – 22–26 (рис. 3в). При дальнейшем росте и развитии постличинок выраженность данного ряда остаётся неизменной. Верхнеголовное скопление образовано неяркими поверхностными меланофорами с мелкими тёмными ядрами внутри, которые занимают до 30–50% площади пятна. Число этих меланофоров варьирует от 3 до 18, модальная группа – 7–8 (рис. 3в, 4е). При дальнейшем увеличении размеров постличинок изменений этого признака не происходит. В каждом ряду по бокам isthmus один–пять (чаще два) меланофоров. Изменений в положении меланофоров в этой области не отмечено (рис. 5е–5з). У постличинок этой размерной группы начинает формироваться хвостовой ряд меланофоров по краю гипуральных пластин.
При TL 25.1–30.0 мм постличинки находятся на стадии postflexion. Кости у них полностью сформированы и хорошо прокрашиваются ализарином. На голове просматриваются многочисленные небольшие бугорки (рис. 4ж). При TL ≥ ≥ 28.1 мм у постличинок отмечены первые появления вкраплений пигмента под глазом, поскольку начинает формироваться подглазничная полоса. Хвостовой ряд всё ещё формируется, с каждого края гипуральных пластин располагается по одному небольшому меланофору.
При TL > 30.0 мм на голове постличинок присутствуют хорошо выраженные многочисленные бугорки разного размера (рис. 4з). При TL ≥ 32.0 мм пигментная полоса под глазом полностью сформирована (рис. 3д, 3е). Также отмечается появление по наружному краю глаза окологлазничной каймы в виде пунктирной линии и радиальной исчерченности. У 78.6% особей на верхнем крае предкрышки присутствует крупный меланофор. Также практически всегда есть меланофор в нижнем углу предкрышки. Хвостовой ряд меланофоров полностью сформирован. У осевших постличинок этой группы (TL ≥ 32.0 мм) присутствует мальковая окраска (рис. 3е).
Изменения пластических признаков по мере роста и развития личинок Ch. saitone представлены на рис. 6б.
ОБСУЖДЕНИЕ
Развитие личинок рыб рода Chirolophis очень плохо освещено в литературе. Единственной работой, где исследовано развитие личинок Ch. japonicus, является труд Шиогаки (Shiogaki, 1983a). Материал для его работы был собран из прибрежных вод зал. Муцу северной части о-ва Хоккайдо (Япония). В этой работе описывается развитие оплодотворённой икры и личинок Ch. japonicus (TL 12.2–24.2 мм), полученных в аквариальных условиях, и приводится описание “диких” личинок этого вида (TL 29.2–34.0 мм) из сборов на световых станциях. При сравнении наших данных с приведёнными в этой работе обнаружены некоторые различия в признаках: у экземпляра TL 13.1 мм отсутствуют (или не видны) спинной ряд и меланофоры в нижней части хвостового стебля, тогда как у всех наших экземпляров сходной длины они есть (рис. 2а, 2б). Верхнеголовное скопление у личинок TL 16.0–22.8 мм представлено единым большим пятном, расположенном на затылке, а у наших экземпляров TL 10.0–20.0 мм это скопление представлено одним–тремя крупными отдельно лежащими меланофорами (рис. 4а).
По другому виду рода Chirolophis из Японского моря – Ch. saitone – опубликованы только изображения четырёх личинок и указана их длина (Okiyama, 1988). При анализе этих рисунков не выявлено принципиальных отличий от личинок этого вида из вод зал. Петра Великого. Можно отметить, что, по данным Окияамы (Okiyama, 1988), у личинки TL 9.2 мм пигмент на голове полностью отсутствует, а у нашего экземпляра TL 9.5 мм верхнеголовное скопление было представлено одним крупным меланофором (рис. 4д).
Нельзя однозначно сказать, чем вызваны эти различия в пигментации личинок рода Chirolophis из двух районов. Нам кажется, что наиболее вероятна ошибка художника при зарисовке личинок для работы Шиогаки (Shiogaki, 1983a): они показаны только сбоку, вид головы сверху не приведён, и сами рисунки небольшие по размеру. Для объективного сравнения и оценки важности обнаруженных различий нужен свежий материал по личинкам обоих видов из вод Приморья и Северной Японии.
При сравнении одноразмерных личинок Ch. japonicus и Ch. saitone мы установили, что общий характер размещения пигмента у этих видов является схожим. Мы описали и впервые формализовали схему размещения меланиновой пигментации на теле личинок обоих видов рода Chirolophis (рис. 1). До получения данных о других видах этого рода можно предварительно считать, что такая схема размещения меланиновой пигментации на теле, вероятно, характерна и для других видов рода Chirolophis. Опубликованных данных по ранним стадиям развития мохоголовых собачек, как и для подавляющего большинства видов Stichaeidae, ещё очень мало для сравнительных исследований (Расс, 1949; Shiogaki, 1983a, 1983b; Okiyama, 1988; Matarese et al., 1989; Григорьев, 1991; Соколовский и др., 2011).
Некоторые особенности в развитии обоих видов отличают их друг от друга. При сходных размерах личинки Ch. japonicus менее развиты в сравнении с личинками Ch. saitone. Так, по нашим данным, личинка Ch. saitone TL 9.5 мм уже не имеет желточного мешка, в то время как у Ch. japonicus он ещё сохраняется при TL 12.5 мм. Это же подтверждается и данными литературы (Shiogaki, 1983a; Okiyama, 1988). Личинка Ch. saitone TL 9.5 мм уже имеет полностью сформированный брюшной ряд меланофоров, в то время как у личинок Ch. japonicus этот ряд формируется значительно позже (TL ≥ 15.1 мм). Глубинный ряд у личинок Ch. saitone полностью сформирован уже при TL 15.1–20.0 мм, а у Ch. japonicus этот признак наблюдается только при достижении личинкой TL 20.1–25.0 мм. Также у Ch. saitone раньше (TL 10.1–15.0 мм), чем у Ch. japonicus (TL 15.1–20.0 мм), появляются меланофоры в нижней части хвостового стебля. У Ch. saitone TL 9.5 мм надкишечный ряд меланофоров выглядит сбоку как цепочка отдельно лежащих друг от друга плоских меланофоров, а у личинок Ch. japonicus TL 12.5 мм этот ряд просматривается в виде одной сплошной линии и только при дальнейшем развитии личинки (TL ≥ 15.1 мм) меланофоры надкишечного ряда разделяются в отдельно лежащие друг от друга элементы.
Также следуют отметить, что элементы скелета Ch. saitone начинают окрашиваться при меньшей длине личинки, чем у Ch. japonicus. Так, при TL 15.1–20.0 мм у отдельных личинок Ch. saitone уже прокрашиваются челюсти, лучи P, C, в скелете C четыре элемента гипурального комплекса и частично центральные области тел позвонков. У Ch. japonicus в этом размерном диапазоне окрашиваются лишь челюсти и в скелете C восемь–девять элементов гипурального комплекса. Наряду с этим у личинок Ch. saitone и Ch. japonicus при сходных размерах завершается формирование скелета (TL > 25.0 мм) и происходит загиб хорды (TL 15.1–20.0 мм).
Интересно, что при схожих размерах постличинки Ch. saitone и Ch. japonicus имеют разную интенсивность окраски и выраженность бугров (будущих мочек) на верху головы. В наших сборах отмечены пелагические постличинки Ch. saitone (TL 28.1–31.5 мм) с хорошо выраженными многочисленными разноразмерными бугорками и элементами окраски (подглазничная полоса, окраска краёв глазного яблока, пятна на теле). При тех же размерах (TL 32.0–32.5 мм) и в те же сроки у постличинок Ch. japonicus бугорки на голове менее развиты и сходные элементы окраски отсутствуют (рис. 2д). Учитывая, что личинки Ch. saitone появляются в планктоне раньше, чем личинки Ch. japonicus, и являются более развитыми по сравнению с личинками Ch. japonicus сходных размеров, можно предположить, что нерест и оседание на дно у Ch. saitone проходит раньше, чем у Ch. japonicus.
По восьми пластическим признакам Ch. saitone и Ch. japonicus обнаружена аллометрия в процессе роста личинок. У обоих видов изменения в скорости роста отдельных частей тела происходили почти синхронно и однонаправленно: увеличились относительные значения (в % SL) длины головы и тела, длины рыла и грудных плавников и в наименьшей степени – значения длины верхней челюсти, а относительные значения длины хвоста, антеанального расстояния и диаметра глаза, напротив, уменьшились (рис. 6). Тест Колмогорова–Смирнова для нормированных с помощью логарифмирования признаков показал, что постличинки этих двух видов достоверно различаются (p < 0.05) по трём пластическим признакам – аА, h и lP (в % SL). При сходных размерах значения всех трёх признаков у Ch. saitone в среднем больше, чем у Ch. japonicus.
Необходимо отметить, что данные литературы по меристическим признакам Ch. saitone (Shiogaki, 1981; Маркевич, 2002; Соколовский и др., 2011) и Ch. japonicus (Макушок, 1958; Shiogaki, 1983a, 1983b; Okiyama, 1988) несколько расходятся с нашими (табл. 2). Если различия между личинками этих видов из заливов Петра Великого и Муцу (северная часть о-ва Хонсю, Япония) однонаправленные (у наших экземпляров позвонков и лучей в D и A немного больше, чем у особей из вод Японских о-вов) и могут быть объяснены разными условиями обитания, то противоречивые данные в работах Маркевича (2002) и Макушка (1958) требуют проведения более детального исследования меристических признаков Ch. saitone и Ch. japonicus в северной части Японского моря и на всём ареале.
Таблица 2.
Меристические признаки Chirolophis japonicus и Ch. saitone в водах Приморья и в прибрежье о-вов Хонсю и Хоккайдо (Япония)
| Район | Ch. japonicus | Ch. saitone | Источник информации | ||||||
|---|---|---|---|---|---|---|---|---|---|
| D | A | vert. | n | D | A | vert. | n | ||
| Приморье | 61–62 | I 44–46 | 65–67 | 10/7 | 53–55 | I 37–39 | 58–60 | 8/7 | Наши данные |
| 51–56 | I 36–38 | 6 | Маркевич, 2002 | ||||||
| 60–63 | I 45–47 | 63–65 | 10 | Макушок, 1958 | |||||
| Прибрежье о-вов Хонсю и Хоккайдо | 59–62 | I 43–46 | 63–67 | 10 | 50–54 | I 36–38 | 55–57 | 9 | Shiogaki, 1981, 1983b |
Все предыдущие исследователи указывали счётные признаки, связанные с осевым скелетом (vert., D и A), как наиболее надёжные для разделения обоих исследованных видов (Shiogaki, 1983a; Okiyama, 1988; Соколовский, Соколовская, 2008). Мы полностью согласны с этим утверждением, поскольку (невзирая на вышеизложенные различия в данных) по этим признакам Ch. saitone и Ch. japonicus хорошо отличаются друг от друга, их значения не перекрываются ни в одном из рассмотренных районов (табл. 2). Проблемы возникают, когда нужно отличить личинок TL ≤ 15.0 мм, поскольку у обоих видов этого размера позвонки ещё не сформированы, а лучи плохо заметны.
Надо отметить, что оба представителя рода Chirolophis при TL ≤ 15.0 мм внешне плохо различимы, однако можно выделить признак, помогающий надёжно идентифицировать их в ихтиопланктоне при любой длине личинки. Этим признаком является число меланофоров у основания лучей A. Данный признак хорошо выражен как у живых личинок, так и после их фиксации спиртом или раствором формальдегида. У Ch. saitone в водах зал. Петра Великого число меланофоров у основания лучей A варьирует в пределах 28–38 (28–34 у личинок TL < 15.0 мм и 34–38 при TL > > 15.0 мм); у Ch. japonicus − 41–45 (соответственно 41–43 и 44–45). Меланофоры у основания лучей A хорошо заметны, легко считаются и поэтому являются надёжным диагностическим признаком определения видовой принадлежности личинок Ch. japonicus и Ch. saitone.
Для более крупных экземпляров (TL ≥ 20.1 мм) отличительной особенностью можно назвать форму и размеры поверхностных меланофоров верхнеголовного скопления. У Ch. saitone они неяркие, с мелкими тёмными ядрами внутри, занимающими до 30–50% площади пятна (рис. 3в, 4е). У Ch. japonicus, наоборот, меланофоры на затылке явно выражены и содержат крупные ядра, которые занимают до 60–80% площади пятна (рис. 4б). Поздние личинки Ch. saitone (TL > 28.0 мм) можно легко опознать по наличию подглазничной полосы и более плотной модели размещения бугорков на верху головы (Shiogaki, 1983a; наши данные).
Основываясь на описании, данном Шиогаки (Shiogaki, 1981), мы предполагали, что наличие у личинок Ch. japonicus меланофора в верхнем углу предкрышки является отличительным признаком для достоверного определения этого вида. Однако оказалось, что у 7.1% исследованных экземпляров Ch. japonicus поверхностный меланофор на предкрышке отсутствует, в то время как у 78.6% экземпляров Ch. saitone он имеется хотя бы с одной стороны головы (рис. 3д, 3е). Следовательно, наличие у постличинок и мальков рыб рода Chirolophis меланофора в верхнем углу предкрышки не является диагностическим признаком. Этот признак вариабелен и характерен для обоих видов рода Chirolophis.
Таким образом, Ch. japonicus и Ch. saitone имеют общий характер размещения пигмента и его развития в процессе онтогенеза. Нами описана и впервые формализована схема размещения меланиновой пигментации на теле личинок обоих видов рода Chirolophis. Она состоит из шести рядов, верхнеголовного скопления и нескольких отдельных меланофоров (рис. 1). Несмотря на сходство видов, каждому из них свойственны специфичные черты. В основном это выражается в разном числе элементов осевого скелета (общее число позвонков, число лучей в D и A). Личинки Ch. saitone появляются в планктоне раньше и являются более развитыми в сравнении с личинками Ch. japonicus сходных размеров, из чего следует, что нерест и оседание на дно молоди первого вида проходит раньше, чем второго. Здесь хотелось бы заметить, что оседание обоих видов на всём ареале происходит при одинаковых размерах (TL 30–40 мм), хотя максимальный размер взрослых особей Ch. japonicus существенно превышает таковой Ch. saitone – TL 550 против 100 мм (Соколовский и др., 2011). Надёжным диагностическим признаком для идентификации личинок Ch. japonicus и Ch. saitone в период развития от вылупления до оседания является число меланофоров у основания лучей A. В водах зал. Петра Великого у Ch. saitone этот признак варьирует в пределах 28–38 меланофоров (у личинок TL < 15.0 мм − 28–34, TL > 15.0 мм − 34–38); у Ch. japonicus − 41–45 (соответственно 41–43 и 44–45).
Список литературы
Баланов А.А., Епур И.В., Земнухов В.В., Маркевич А.И. 2010. Состав и сезонная динамика видового разнообразия ихтиоцена бухты Средняя (зал. Петра Великого, Японское море) // Изв. ТИНРО. Т. 163. С. 69–81.
Горбунова Н.Н. 1962. Размножение и развитие рыб семейства терпуговых (Hexagrammidae) // Тр. ИО АН СССР. Т. 59. С. 118–182.
Григорьев С.С. 1991. Личинки мохнатоголовой собачки Снайдера Chirolophis snyderi (Stichaeidae) из прикамчатских вод // Вопр. ихтиологии. Т. 31. Вып. 6. С. 1025–1028.
Епур И.В., Баланов А.А. 2015. Видовой состав и сезонная динамика ихтиопланктона прибрежной зоны западной части залива Петра Великого Японского моря в 2007–2010 гг. // Вопр. ихтиологии. Т. 55. № 4. С. 397–410. https://doi.org/10.7868/S0042875215030030
Ланге Н.О., Дмитриева Е.Н. 1981. Методика эколого-морфологических исследований развития молоди рыб // Исследование размножения и развития рыб. М.: Наука. С. 67–88.
Линдберг Г.У., Красюкова З.В. 1975. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 4. Л.: Наука, 464 с.
Макушок В.Н. 1958. Морфологические основы системы стихеевых и близких к ним семейств рыб (Stichaeoidae, Blennioidei, Pisces) // Тр. ЗИН АН СССР. Вып. XXV. 129 с.
Маркевич А.И. 2002. Мохнатоголовая собачка Chirolophis saitone (Stichaeidae) – новый вид в ихтиофауне залива Петра Великого Японского моря // Вопр. ихтиологии. Т. 42. № 5. С. 701–703.
Расс T.C. 1949. Икринки и личинки рыб Баренцева моря // Тр. ВНИРО. Т. 17. С. 37–38.
Савельев П.А., Баланов А.А., Паренский В.А. 2011 Аллометрическая изменчивость признаков у Lycodes yamatoi // Биология моря. Т. 37. № 1. С. 31−38.
Соколовская Т.Г., Соколовский А.С., Епур И.В. 2010. Видовой состав и сезонная изменчивость ихтиопланктона прибрежной зоны залива Восток (залив Петра Великого, Японское море), собранного на световых станциях // Там же. Т. 36. № 2. С. 124–131.
Соколовский А.С., Соколовская Т.Г. 2008. Атлас икры, личинок и мальков рыб Российских вод Японского моря. Владивосток: Дальнаука, 223 с.
Соколовский А.С., Соколовская Т.Г., Епур И.В., Азарова И.А. 2004. Вековые изменения в составе и числе рыб – южных мигрантов в ихтиофауне северо-западной части Японского моря // Изв. ТИНРО. Т. 136. С. 41–57.
Соколовский А.С., Соколовская Т.Г., Яковлев Ю.М. 2011. Рыбы залива Петра Великого. Владивосток: Дальнаука, 431 с.
Якубовски М. 1970. Методы выявления и окраски системы каналов боковой линии и костных образований у рыб in toto // Зоол. журн. Т. 49. Вып. 9. С. 1398–1401.
Amaoka K., Nakaya K., Yabe M. 1989. Fishes of Usujiri and Adjacent Waters in Southern Hokkaido, Japan // Bull. Fac. Fish. Hokkaido Univ. V. 40. № 4. P. 254–277.
Amaoka K., Nakaya K., Yabe M. 1995. The fishes of Northern Japan. Sapporo: Kita-Nihon Kaijo Center Co. Ltd., 391 p.
Kendall A.W. Jr., Ahlstrom E.H., Moser H.G. 1984. Early life history stages of fishes and their characters // Ontogeny and systematics of fishes / Eds. Moser H.G. et al. Amer. Soc. Ichthyol. Herpetol. Spec. Publ. № 1. P. 11–22.
Masuda H., Amaoka K., Araga S. et al. 1984. The fishes of Japanese Archipelago. Tokyo: Tokai Univ. Press, 378 p.
Matarese A.C., Kendall A.W., Blood D.M., Vinter B.M. 1989. Laboratory guide to early life history stages of northeast Pacific fishes // US Dept. Commer. NOAA Tech. Rept. NMFS. № 80. 653 p.
Nakabo T. (ed.). 2002. Fishes of Japan with pictorial keys to the species. V. 1–2. Tokyo: Tokai Univ. Press., 1748 p.
Okiyama M. (ed.). 1988. An atlas of early stage fishes in Japan. Tokyo: Tokai Univ. Press, 1160 p.
Powles H., Markle D.F. 1984. Identification of larvae // Ontogeny and systematics of fishes / Eds. Moser H.G. et al. Amer. Soc. Ichthyol. Herpetol. Spec. Publ. № 1. P. 31–33.
Shiogaki M. 1981. Redesciption of the Stichaeidae fish Chirolophis saitone // Jpn. J. Ichthyol. V. 28. № 2. C. 129–134.
Shiogaki M. 1983a. On the life history of the stichaeid fish Chirolophis japonicus // Ibid. V. 29. № 4. C. 446–455.
Shiogaki M. 1983b. A stichaeid fish Chirolophis otohime, a junior synonym of Chirolophis japonicus // Ibid. V. 30. № 2. C. 191–194.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


