Вопросы ихтиологии, 2020, T. 60, № 3, стр. 318-327
Некоторые данные о репродуктивной биологии Inimicus sinensis (Synanceiidae)
Н. Г. Емельянова 1, Д. А. Павлов 1, *
1 Московский государственный университет
Москва, Россия
* E-mail: dimi-pavlov@yandex.ru
Поступила в редакцию 04.06.2019
После доработки 11.07.2019
Принята к публикации 17.07.2019
Аннотация
Строение гонад, цитологическое состояние ооцитов, ультраструктуру оболочки ооцитов и морфологию сперматозоидов исследовали у особей Inimicus sinensis длиной 120–230 мм с гонадами преимущественно IV стадии зрелости. Самцы имеют гипертрофированный мочевой пузырь. Судя по распределению ооцитов в яичниках, тип оогенеза непрерывный и икрометание порционное. Ооциты периода созревания имеют диаметр более 600–700 мкм. Порционная плодовитость составила в среднем 15380 ооцитов. Лучистая оболочка (zona radiatа) завершивших рост ооцитов имеет толщину в среднем 10.2 мкм и состоит из двух слоёв. Узкий поверхностный слой толщиной около 0.34 мкм, очевидно, является хорионом. Ультраструктура сперматозоидов I. sinensis существенно не отличается от таковой у других Scorpaenoidei с внешним осеменением. Центриолярный комплекс характеризуется ортогональным расположением центриолей. По строению яичников представители рода Inimicus сближаются с подавляющим большинством костистых рыб и живородящих видов родов Sebastes и Sebastiscus, в то время как многие представители подотряда Scorpaenoidei имеют уникальное строение яичников с центральной яйценосной стромой, окружённой ооцитами и прикреплённой к передней части гонады. В соответствии с существующими филогенетическими схемами такой тип яичников появился параллельно и независимо в нескольких эволюционных линиях.
Скорпеновидные рыбы (подотряд Scorpaenoidei) включают около 500 видов, распространённых преимущественно в Индо-Пацифике (Fricke et al., 2019). Почти все виды тропической зоны имеют ядовитые плавниковые лучи, но обладают ценными вкусовыми качествами и являются объектами местного промысла или спортивного рыболовства. Ярко окрашенные виды (Scorpaena brasiliensis, Taenianotus triacanthus, Scorpaenopsis macrochir, Rhinopias frondosa, Rh. eschmeyeri) широко используются в аквариумном бизнесе. Яд некоторых видов используется в медицине (Santhanam, 2019). Скорпеновидные рыбы являются важным компонентом трофической цепи, а во многих экосистемах – её конечным звеном. Тропические виды обитают преимущественно на мелководьях прибрежной зоны и поэтому особенно уязвимы к глобальному изменению климата и антропогенному воздействию, включая загрязнение акватории и неконтролируемый вылов. Охрана и восстановление популяций скорпеновидных рыб невозможны без сведений об их жизненных циклах, но биология большинства видов остаётся неисследованной (Kwik, 2011). Филогенетические отношения и таксономия видов подотряда Scorpaenoidei являются предметом интенсивных исследований (Smith, Wheeler, 2004; Smith et al., 2018).
Род Inimicus (японские бородавчатки), включающий 10 видов, относится к подсемейству Choridactylinae семейства Synanceiidae (Froese, Pauly, 2019). Все представители рода обладают двумя свободными передними (нижними) лучами грудного плавника, которые используются для перемещения по дну. Кроме этого, свободные лучи служат опорой для атак на добычу, проплывающую над рыбой. Подобные свободные лучи грудного плавника, которые, по-видимому, не несут сенсорную функцию, а применяются для “хождения” по дну, имеются у некоторых других представителей отряда Scorpaeniformes: Choridactylus (Synanceiidae: Choridactylinae), Minous (Synanceiidae: Minoinae), Prionotus, Trigla (Triglidae), Apistus (Apistidae) (Gosline, 1994). Представители рода Inimicus – хищники-засадчики, ведут ночной образ жизни и частично зарываются в грунт в светлое время суток. При зарывании глаза, расположенные в верхней части головы, остаются на поверхности, а грудные плавники расправлены, что позволяет совершать быстрый бросок на добычу. Насколько известно, этих рыб не поедают другие животные. При возникновении опасности рыба поднимает колючие лучи спинного плавника, расправляет грудные плавники, демонстрируя их контрастно окрашенную внутреннюю поверхность, и совершает веерные движения ярко окрашенным хвостовым плавником. Колючие лучи спинного плавника особенно ядовиты. Укол чрезвычайно болезненный, а боль, сопровождающаяся опухолью поражённой конечности, может длиться в течение нескольких часов или даже суток. Рыбы могут содержаться в сравнительно небольших (~135 л) аквариумах, но поодиночке во избежание агрессии (Scott, 2001). В отличие от большинства скорпеновидных рыб, являющихся живородящими или с икрой, которая развивается в кладках, заключённых в желеобразную массу, представители рода Inimicus вымётывают одиночные пелагические яйца. Такой способ размножения рассматривается как наиболее генерализованный в подотряде Scorpaenoidei (Wourms, 1991; Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2013).
Японская бородавчатка I. japonicus – перспективный объект культивирования в прибрежных регионах Китая и Японии (Liu, Quan, 2005). Использование этого вида в полноцикловой аквакультуре связано как с высокими вкусовыми качествами рыб, так и с крупными личинками (TL 4.0 мм при вылуплении и 4.9 мм при переходе на экзогенное питание), способными потреблять сравнительно крупный стартовый корм (коловраток) (Wang et al., 2013). Исследовали следующие особенности жизненного цикла I. japonicus: динамику размножения в природе (Nozaki et al., 2003), потребление кислорода взрослыми особями в течение суток (Hirata et al., 2001), оогенез в естественных и искусственных условиях (Watanabe, 2006), сперматогенез в условиях культивирования (Watanabe, 2012), развитие эмбрионов, личинок и ювенильных особей и устойчивость молоди к солёности (Wang et al., 2013).
Объект данного исследования – I. sinensis. Этот вид обитает в прибрежной зоне Южного Китая и Вьетнама, южнее от Явы и Бали до залива Шарк в Западной Австралии; находки вида известны на западном побережье о-ва Лусон, а также у Шри-Ланки и южного побережья Индии. Часто попадается в тралы на мягких и песчаных грунтах (Carpenter, Niem, 1999). Рыбы распространены в прибрежных регионах тропических океанов в лагунах и на коралловых рифах на глубине от 5 до 90 м. Максимальная длина (TL) составляет 260 мм (Froese, Pauly, 2019). Как и I. japonicus, I. sinensis может рассматриваться как потенциальный объект аквакультуры в Юго-Восточной Азии, но его репродуктивные характеристики до настоящего времени остаются неизвестными.
Цель работы – изучить некоторые особенности биологии размножения I. sinensis, включая строение гонад и морфологию половых клеток.
МАТЕРИАЛ И МЕТОДИКА
Свежевыловленные особи I. sinensis приобретены на рыбных рынках г. Нячанг (южная часть Центрального Вьетнама) в 2015–2017 гг. Первичную обработку и фиксацию материала проводили на базе Приморского отделения Российско-вьетнамского тропического научно-исследовательского и технологического центра (Нячанг). Биологический анализ включал определение стандартной длины (SL) до конца чешуйного покрова, полной длины (TL) до заднего края хвостового плавника, массы тела (W), массы тела без внутренностей (w) и массы гонад (g). Гонадосоматический индекс (ГСИ) рассчитывали по формуле: ГСИ = g/w × 100. Соотношение между массой (W, г) и длиной (TL, см) рыб определяли, используя уравнение степенной зависимости (Sparre, Venema, 1998): W = aTLb. Порционную плодовитость самок с гонадами IV стадии зрелости определяли весовым методом, подсчитывая число ооцитов диаметром >600 мкм во фрагменте гонады массой 0.04–0.10 г.
Для анализа размерного состава ооцитов использовали фрагменты гонад, помещённые в физиологический раствор. Изображения клеток получали с помощью микроскопа Nikon Eclipse E-200 (Япония) и видеокамеры. Измерения диаметра ооцитов (>50 мкм) проведены с использованием программы ImageJ.
Половозрелые самцы ряда видов рыб подотряда Scorpaenoidei обладают гипертрофированным мочевым пузырём. Предполагается, что содержимое мочевого пузыря используется в процессе размножения (Павлов, Емельянова, 2007, 2013; Pavlov, Emel’yanova, 2010). Длину (K) и ширину (k) наполненного мочевого пузыря измеряли с помощью электронного штангенциркуля. Объём мочевого пузыря (V) рассчитывали по формуле для сплюснутого сфероида: V = π/6 × K2 × k.
Для световой микроскопии фрагменты яичников фиксировали в жидкости Буэна; дальнейшая гистологическая обработка проведена общепринятыми методами (Роскин, Левинсон, 1957). Для сканирующей (СЭМ) и трансмиссионной электронной микроскопии (ТЭМ) половых клеток фиксировали фрагменты яичников и семенников половозрелых особей и единичные овулировавшие ооциты, обнаруженные при вскрытии одной из самок. Фиксатором служила смесь 2.5%-ного раствора глутарового альдегида и 2%-ного параформальдегида на фосфатном буфере pH 7.4 с добавлением хлористого натрия (2.5%) и сахарозы (1.5%). Постфиксацию осуществляли в 1%-ном растворе четырёхокиси осмия. Дальнейшую обработку для СЭМ и ТЭМ проводили по общепринятым методам (Уикли, 1975). Объекты для СЭМ напыляли сплавом золота с палладием и исследовали в сканирующем электронном микроскопе CamScan S-4 (“Cambridge Instruments”, Ирландия) при ускоряющем напряжении 20 кВ. Ультратонкие срезы просматривали в трансмиссионном электронном микроскопе JEM-1011 (“Jeol”, Япония) при ускоряющем напряжении 80 кВ. Для получения изображений использовали цифровую камеру ES-500W (“Gatan”, США) и компьютерную программу Digital Micrograph.
Статистический анализ данных проведён с помощью программы GraphPad Prism 5.03.
РЕЗУЛЬТАТЫ
Размер рыб и строение внутренних органов
Биологические показатели рыб с гонадами IV стадии зрелости приведены в таблице. Длина тела (TL) самок и самцов имеет нормальное распределение, но распределение значений массы тела самок (W) и массы тела без внутренностей (w) отличается от нормального (тест Д’Агостино−Пирсона). По длине тела самки статистически значимо крупнее самцов (t-тест: p = 0.028). Масса тела самок и самцов (W и w) статистически значимо не различается (критерий Манна–Уитни: p = 0.06 и p = 0.11 соответственно). Соотношение длина (см) – масса тела (г) для рыб обоих полов аппроксимировано следующим уравнением: W = 0.0183TL2.9556, R2 = 0.927.
Таблица 1.
Биологические показатели особей Inimicus sinensis с гонадами IV стадии зрелости
| Пол (число рыб, экз.) | Длина, мм | Масса, г | ГСИ, % | |||
|---|---|---|---|---|---|---|
| TL | SL | W | w | g | ||
| Самки (22) | $\frac{{120{\kern 1pt} --{\kern 1pt} 230}}{{184\,\,\left( {33} \right)}}$ | $\frac{{96{\kern 1pt} --{\kern 1pt} 195}}{{157\,\,\left( {28} \right)}}$ | $\frac{{32{\kern 1pt} --{\kern 1pt} 193}}{{111\,\,\left( {55} \right)}}$ | $\frac{{24{\kern 1pt} --{\kern 1pt} 156}}{{95\,\,\left( {45} \right)}}$ | $\frac{{0.85{\kern 1pt} --{\kern 1pt} 19.88}}{{7.23\,\,\left( {5.91} \right)}}$ | $\frac{{2.65{\kern 1pt} --{\kern 1pt} 13.17}}{{7.03\,\,\left( {3.22} \right)}}$ |
| Самцы (16) | $\frac{{130{\kern 1pt} --{\kern 1pt} 183}}{{163\,\,\left( {15} \right)}}$ | $\frac{{110{\kern 1pt} --{\kern 1pt} 158}}{{137\,\,\left( {10} \right)}}$ | $\frac{{32{\kern 1pt} --{\kern 1pt} 117}}{{71\,\,\left( {20} \right)}}$ | $\frac{{31{\kern 1pt} --{\kern 1pt} 107}}{{66\,\,\left( {18} \right)}}$ | $\frac{{0.06{\kern 1pt} --{\kern 1pt} 0.32}}{{0.17\,\,\left( {0.08} \right)}}$ | $\frac{{0.08{\kern 1pt} --{\kern 1pt} 0.41}}{{0.25\,\,\left( {0.09} \right)}}$ |
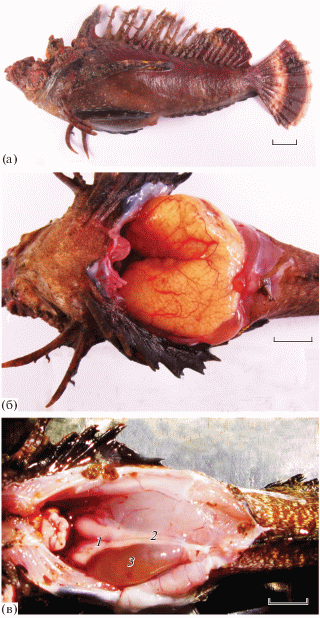
Яичники половозрелой самки парные на протяжении 2/3 длины, а их каудальные части сливаются (рис. 1а, 1б). У половозрелых самцов семенники разделены на всём протяжении, а семяпроводы сливаются непосредственно перед генитальным отверстием (рис. 1в). Гипертрофированный мочевой пузырь занимает значительную часть полости тела, располагаясь в её ростральной, средней и каудальной части. Семяпроводы прилегают к поверхности мочевого пузыря. У самца TL 176 мм (ГСИ 0.30%) длина семенников и семяпроводов составляет соответственно 17.8 и 23.7 мм, длина и наибольшая ширина мочевого пузыря – 22.0 и 9.0 мм, а его объём – 2.28 мл. Размер мочевого пузыря самок значительно меньше: у самки такой же длины (TL 176 мм) параметры мочевого пузыря составляют соответственно 12.0 и 6.0 мм и 0.45 мл. У самцов TL 140–183 мм (n = 6) длина мочевого пузыря варьирует в пределах 11.4–23.6 (в среднем 18.4) мм, наибольшая ширина – 6.5–9.0 (7.8) мм, объём − 0.45–2.50 (1.53) мл.
Размерный состав ооцитов и плодовитость самок
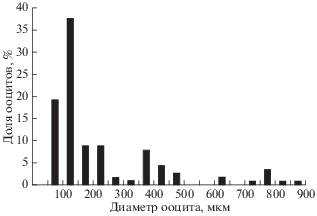
Распределение ооцитов по диаметру у половозрелых самок свидетельствует о численном преобладании клеток меньшего размера и наличии клеток промежуточного размера между превителлогенными ооцитами и клетками, завершающими период вителлогенеза. К последним, очевидно, относятся ооциты диаметром ≤500 мкм (рис. 2). Между этими ооцитами и клетками, вступающими в период созревания, имеется хиатус. Ооциты периода созревания диаметром >600–700 мкм развиваются асинхронно и находятся в разных фазах этого периода. В наиболее крупных клетках диаметром ~900 мкм начинается процесс оводнения цитоплазмы; по наблюдениям in vivo, они имеют сравнительно прозрачный узкий слой периферической цитоплазмы.
Рис. 2.
Распределение ооцитов (n = 114) по диаметру у самки Inimicus sinensis TL 171 мм, стадия зрелости гонад IV, гонадосоматический индекс 5.2%.
Порционная плодовитость самок (F), рассчитанная по числу клеток диаметром >600 мкм, составляет 4233–50 080 (15 380) ооцитов (n = 15). Зависимость этого показателя от длины тела (TL, мм) может быть аппроксимирована линейным уравнением: F = 249.47TL – 30539; R2 = 0.38.
Цитологическое состояние ооцитов
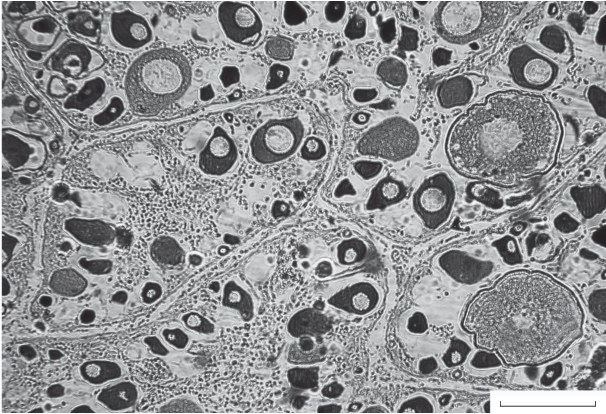
Половые клетки расположены в хорошо развитых яйценосных пластинках. В гонадах единственной самки II−III стадии зрелости бóльшая часть ооцитов представлена клетками разного размера периода превителлогенеза, достигающими максимального диаметра 150 мкм, и лишь незначительная часть клеток вступает в период вителлогенеза. Такие ооциты имеют диаметр ~200 мкм; по периферии хорошо выражен один ряд вакуолей – предшественников кортикальных альвеол (рис. 3). В периферической цитоплазме появляются мелкие гранулы желтка.
Рис. 3.
Морфология ооцитов самки Inimicus sinensis TL 145 мм, стадия зрелости гонад II–III, гонадосоматический индекс 2.0%. Масштаб: 200 мкм.
В гонадах IV стадии зрелости в завершивших рост ооцитах гранулы желтка заполняют всю цитоплазму, имеют округлую форму и диаметр 1–10 мкм. Слой кортикальных альвеол достигает ширины 9 мкм. Кортикальные альвеолы располагаются в периферической цитоплазме в один, чаще в два или три ряда (в зависимости от их диаметра) и локализуются в непосредственной близости друг от друга. Размер кортикальных альвеол значительно варьирует, их максимальный диаметр – 8 мкм. Липидные капли отсутствуют.
Ультраструктура оболочки ооцита
Поверхность ооцита равномерно прободена округлыми порами, образовавшимися после сокращения микро- и макроворсинок в процессе завершающих фаз созревания (рис. 4а). Диаметр пор составляет 0.11–0.25 (М ± σ – 0.19 ± 0.13) мкм (n = 54). Расстояние между порами варьирует в пределах 0.47–0.97 (0.75 ± 0.03) мкм (n = 64). Поверхность ооцита сравнительно гладкая. На ней иногда встречаются частицы разной формы и размера, по-видимому, являющиеся инородными образованиями.
Рис. 4.
Ультраструктура оболочки ооцита Inimicus sinensis: а – поверхность овулировавшего ооцита, б – оболочка заполненного желтком ооцита с частью периферической цитоплазмы, в – фрагмент периферической цитоплазмы заполненного желтком ооцита; 1 – внутренний слой zona radiata, 2 – наружный слой zona radiata, 3 – узкий слой яйцевой оболочки, расположенный над наружным (хорион), 4 – кортикальные альвеолы, 5 – митохондрия, 6 – фрагмент гранулы желтка, (→) – везикулы эндоплазматической сети. Масштаб: 1 мкм.

Лучистая оболочка (zona radiatа) завершивших рост ооцитов толщиной 9.25–11.37 (10.19) мкм (n = 6) состоит из двух слоёв, представленных веществом средней электронной плотности (рис. 4б). Наиболее широкий внутренний слой оболочки имеет гомогенную структуру, в которой заметны мелкие полости. Ширина его варьирует в пределах 5.95−7.50 (6.65) мкм. Наружный слой толщиной 2.45–5.10 (3.19) мкм полностью гомогенный, несколько более электроноплотный, чем внутренний. Над ним лежит очень узкий слой толщиной 0.31–0.37 (0.34) мкм, очевидно, являющийся хорионом. Этот слой представлен тонкими волоконцами, ориентированными в разных направлениях и ограниченными сверху тонкой электроноплотной полоской. В оболочке видны канальцы, в которых расположены микро- и макроворсинки. В цитоплазматическом слое ооцита локализованы многочисленные округлые митохондрии со светлым матриксом, везикулы агранулярной эндоплазматической сети, а также кортикальные альвеолы (рис. 4в).
Ультраструктура сперматозоидов
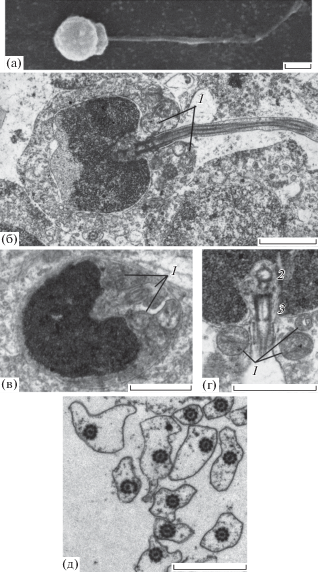
Сперматозоиды имеют округлую головку, чётко выраженную среднюю часть и жгутик (рис. 5а). Размер головки, средней части жгутика и его длина составляют соответственно 1.53 × 1.63, 0.43 × 1.19 и 21.4 мкм. Хроматиновый материал головки плотно упакован, иногда в нём встречаются небольшие полости. Углубление в основании головки, в цитоплазме которого находится центриолярный комплекс, составляет ~ 1/3–1/4 диаметра головки. Оно расположено в центре основания ядра, реже – слегка эксцентрично (рис. 5б, 5в). Проксимальная центриоль ориентирована ортогонально по отношению к дистальной (базальному тельцу) (рис. 5г). В цитоплазме средней части четыре–семь сечений митохондрий. Митохондрии имеют округлую форму и матрикс средней плотности. Аксонема жгутика построена по классической схеме и состоит из девяти дуплетов периферических микротрубочек и двух центральных: (9 × 2) + 2. Все микротрубочки электронопрозрачны. Аксонема окружена цитоплазматическим чехлом, имеющим неодинаковую ширину в разных участках жгутика (рис. 5д).
Рис. 5.
Ультраструктура сперматозоидов Inimicus sinensis: а – общий вид сперматозоида, б – продольный срез сперматиды, в – продольный срез головки и средней части сперматозоида, г – часть головки сперматозоида с центриолярным комплексом, д – поперечные срезы жгутиков; 1 – митохондрия, 2 – проксимальная центриоль, 3 – дистальная центриоль. Масштаб: 1 мкм.
ОБСУЖДЕНИЕ
Почти все особи I. sinensis, отловленные в зал. Нячанг в марте и апреле, имели гонады IV стадии зрелости, что предполагает интенсивное размножение на протяжении весеннего сезона. В Японии нерест I. japonicus в прибрежной зоне префектуры Ниигата наблюдается с июня по август с пиком в июле (Watanabe, 2006), а в более южном регионе (зал. Симабара) – с мая по август с пиком в мае–июне (Nozaki et al., 2003). Минимальная длина (TL) половозрелых самок I. sinensis с яичниками IV стадии зрелости составила 120 мм. Самка TL 145 мм имела яичники II–III стадии зрелости и, по-видимому, являлась впервые созревающей, что предполагает вариабельность размера рыб по достижении полового созревания. Минимальная длина (TL), при которой отмечены участвующие в размножении самки I. japonicus, составила 190 мм; эти рыбы имели возраст 3 года (Watanabe, 2006).
Как и многие другие представители подотряда Scorpenoidei с внешним осеменением, половозрелые самцы I. sinensis имеют гипертрофированный мочевой пузырь. Впервые половой диморфизм по размеру мочевого пузыря обнаружен у самцов нескольких видов байкальских широколобок (Scorpaeniformes: Cottoidei: Cottocomephoridae) в период подготовки к нересту, во время нереста и охраны донной кладки икры (Черняев, 1977, 1979). В частности, Черняев (1979. С. 1054) сообщает, что у самки большеголовой широколобки Batrachocottus baicalensis “мочевой пузырь нормального наполнения, а у самца вся полость тела была заполнена им, и для зарисовки мочеполовой системы пришлось его проколоть и выпустить содержимое”. У черноморской скорпены Scorpaena porcus (Scorpaenidae) мочевой пузырь самца также существенно больше, чем у самки (Соин, Чепурнов, 1986). Впоследствии гипертрофированный мочевой пузырь обнаружен у самцов других представителей семейства Scorpaenidae: Scorpaenopsis possi, Sebastapistes cyanostigma (Павлов, Емельянова, 2007), Dendrochirus zebra (Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2019). Имеется он и у самцов Synanceia horrida (Synanceiidae) (наши наблюдения). Наибольшего размера мочевой пузырь достигает у половозрелых рыб: отмечена положительная аллометрия линейного роста этого органа по отношению к длине тела самцов D. zebra (Павлов, Емельянова, 2019). В жидкости мочевого пузыря обычно присутствуют сперматозоиды, а их концентрация может быть близка к таковой в эякуляте рыб с внутренним осеменением. При активации морской водой сперматозоиды из мочевого пузыря сохраняют поступательные движения дольше, чем сперматозоиды, взятые из семенников (Павлов, Емельянова, 2007; Pavlov, Emel’yanova, 2010). Первоначальные предположения о наличии непосредственной связи мочевой и половой систем у самцов скорпеновидных рыб, имеющих гипертрофированный мочевой пузырь (Павлов, Емельянова, 2007, 2013; Pavlov, Emel’yanova, 2010), не подтвердились. Несмотря на то что удлинённые семяпроводы лежат на поверхности мочевого пузыря, какие-либо протоки, соединяющие эти органы, не обнаружены, а генитальная пора находится на вершине мочеполовой папиллы в непосредственной близости от мочевого отверстия, но обособлена от последнего (наши наблюдения). Аналогичное строение выводных протоков описано у живородящего вида Sebastodes paucispinis (= Sebastes paucispinis), причём размеры мочевого пузыря самца и самки не различаются (Moser, 1967). Таким образом, путь проникновения сперматозоидов в гипертрофированный мочевой пузырь самца остаётся неясным. По предположению Черняева (1977, 1979), выделения гипертрофированного мочевого пузыря самцов байкальских широколобок, содержащие сперму, выполняют функцию аттрактантов для самок и репеллентов для беспозвоночных. Мы полагаем, что мочевой пузырь опорожняется в процессе осеменения ооцитов, а заключённые в нём сперматозоиды могут участвовать в оплодотворении (Павлов, Емельянова, 2007, 2013; Pavlov, Emel’yanova, 2010).
Несмотря на то что нерест I. japonicus индуцирован (под действием инъекции аналога гонадотропин-рилизинг гормона и хорионического гонадотропина) в условиях культивирования (Wang et al., 2013), процесс икрометания и осеменения ооцитов не прослежен. Максимальное значение ГСИ самцов I. sinensis составило 0.4%, самцов I. japonicus, культивируемых в искусственных условиях, – примерно 1.0% (Watanabe, 2012). Близкое максимальное значение ГСИ (0.7%) отмечено у самцов D. zebra (Павлов, Емельянова, 2019). Размножение этого вида включает близкий контакт самца и самки, а сперма вымётывается внутрь кладки ооцитов, заключённых в желеобразную массу (Fishelson, 1975; Moyer, Zaiser, 1981). Размножение представителей рода Inimicus, по-видимому, также осуществляется парами, а порция ооцитов вымётывается в виде компактной кладки, которая окружается спермой и лишь после оплодотворения распадается на отдельные яйца.
Судя по распределению ооцитов в яичниках половозрелых самок I. sinensis, этому виду свойствен непрерывный тип оогенеза, при котором наблюдается порционное икрометание. Тем не менее следует отметить сравнительно высокие значения ГСИ, достигающие 13.17%. Максимальные значения ГСИ самок I. japonicus из природы и в условиях культивирования составили соответственно 23.28 и 26.97% (Watanabe, 2006). Эти особи, очевидно, находились в преднерестовом состоянии. Высокие значения ГСИ половозрелых самок представителей рода Inimicus, возможно, связаны с крупными зрелыми ооцитами и сравнительно высокой порционной плодовитостью. Представители семейства Scorpaenidae Sc. possi и S. cyanostigma, имеющие непрерывный тип оогенеза и многопорционный нерест, характеризуются крайне низкими значениями ГСИ самок в период размножения, составляющими в среднем соответственно 0.97 и 1.49% (Павлов, Емельянова, 2007). Среднее значение ГСИ самок D. zebra составляет 4.45% (Шадрин, Емельянова, 2019), но максимальное значение может превышать 8% (Павлов, Емельянова, 2019). Сезонность размножения I. sinensis остаётся неизвестной, а интервалы между икрометаниями, по-видимому, значительно больше, чем у других скорпеновидных рыб тропической зоны с более мелкими зрелыми ооцитами.
Краткое описание оогенеза, включая морфологию ооцитов конца вителлогенеза с мигрирующим ядром, а также завершающих фаз созревания, приведены для I. japonicus (Watanabe, 2006). К сожалению, размеры овулировавших ооцитов не указаны. Средний диаметр яйца I. japonicus на начальных стадиях развития равен 1.40 мм (Wang et al., 2013). Перивителлиное пространство очень узкое (Wang et al., 2013. Fig. 2), в связи с чем диаметр овулировавших ооцитов и яиц в начале эмбриогенеза, очевидно, не различается. Диаметр яйца I. sinensis с эмбрионом за 12 ч до вылупления составляет 1.25 мм (Шадрин и др., 2003).
Несмотря на то что I. sinensis – пелагофил, толщина его лучистой оболочки, составляющая в среднем 10.2 мкм, существенно превышает таковую других скорпеновидных рыб, икра которых также развивается в толще воды: Sc. possi (1.4 мкм), S. cyanostigma (0.7 мкм) (Павлов, Емельянова, 2007; Pavlov, Emel’yanova, 2010) и D. zebra (0.6–0.9 мкм) (Павлов, Емельянова, 2019). Значительная толщина лучистой оболочки I. sinensis, по-видимому, связана с защитной функцией крупных яиц, развивающихся в толще воды и не окружённых желеобразной массой. Лучистая оболочка I. sinensis двухслойная, в отличие от однослойной у Sc. possi и S. cyanostigma (Павлов, Емельянова, 2007; Pavlov, Emel’yanova, 2010) и трёхслойной у D. zebra (Павлов, Емельянова, 2019). Внешний узкий слой оболочки (по-видимому, хорион) I. sinensis отмечен помимо скорпеновидных рыб у некоторых других морских рыб с пелагической икрой (Emel’yanova, Pavlov, 2012; Емельянова, Павлов, 2014). Средний диаметр пор на поверхности оболочки и расстояния между ними существенно не различаются у скорпеновидных рыб с разным размером овулировавших ооцитов: I. sinensis – 0.19 и 0.75 мкм, S. cyanostigma – 0.17 и 1.04 мкм (наши наблюдения), D. zebra – 0.14 и 0.99 мкм (Павлов, Емельянова, 2019).
Анализ ультраструктуры сперматозоидов I. sinensis не выявил каких-либо специфических особенностей, не свойственных другим скорпеновидным рыбам с внешним осеменением. Головка сперматозоида I. sinensis шаровидной формы, её ширина несколько превышает длину, что описано и у других скорпеновидных рыб (Павлов, Емельянова, 2018). Центриолярный комплекс характеризуется ортогональным расположением центриолей, аналогичным таковому у D. zebra (Павлов, Емельянова, 2018). Следует отметить, что у S. horrida наблюдается разное расположение центриолей в сперматозоидах: ортогональное или латеральное смещение проксимальной центриоли и её локализация под острым углом к дистальной (Павлов, Емельянова, 2018). Не исключено, что эта изменчивость может быть связана с разной степенью завершённости формирования сперматозоидов из сперматид. Сходные изменения во взаимной локализации центриолей в центриолярном комплексе отмечены у Helicolenus dactylopterus (Sebastidae) (Vila et al., 2010): в процессе завершения спермиогенеза расположение проксимальной и дистальной центриолей по отношению друг к другу становится более ортогональным. У I. sinensis углубление в основании головки, в цитоплазме которого находится центриолярный комплекс, выражено в большей степени, чем у S. horrida.
Дуплеты микротрубочек аксонемы жгутиков у I. sinensis электронопрозрачны, как и у многих других видов рыб. Тем не менее у ряда представителей семейств Clupeidae, Engraulidae, Alepocephalidae, Searcidae и некоторых других наблюдается наличие электроноплотных фибрилл, расположенных в отдельных микротрубочках, что может играть определённую роль в обеспечении подвижности сперматозоидов (Mattei, 1991). По длине жгутика I. sinensis существенно не отличается от других скорпеновидных рыб, сближаясь с D. zebra, имеющим наиболее короткий жгутик (Павлов, Емельянова, 2018).
По строению яичников представители рода Inimicus не отличаются от подавляющего большинства костистых рыб: ооциты развиваются в яйценосных пластинках на дорсальной стороне яичника, а овулирующие ооциты концентрируются в овариальной полости в вентральной части гонады (Watanabe, 2006; наша работа). Такое строение гонад обозначено как цистовариальный тип II-1 (Takano, 1989, цит. по: Koya, Muñoz, 2007). Многие другие представители подотряда Scorpaenoidei, яйца которых вымётываются группами, заключёнными в желеобразную массу, имеют уникальное строение яичников. Яйценосная строма, окружённая ооцитами, находится в центре гонады и прикреплена к стенке яичника только в его передней части; внутренняя стенка яичника и яйценосные ткани выстланы секреторными клетками, вырабатывающими желеобразную массу; ооциты развиваются на стебельках, а после овуляции заключаются в желеобразную массу (McMillan, 2007). Данное строение гонад обозначено как цистовариальный тип II-3 (Takano, 1989, цит. по: Koya, Muñoz, 2007). Кладки этих рыб представляют собой полые структуры с яйцами, расположенными на периферии; они имеют двухлопастную форму или икра вымётывается одновременно двумя кладками (Wourms, 1991; Павлов, Емельянова, 2013). Аналогичное продуцирование желеобразной массы описано и у других видов костистых рыб, например у Hexagrammos octogrammus (Scorpaeniformes: Hexagrammidae) (Koya et al., 1993) и Lophiomus setigerus (Lophiiformes: Lophiidae) (Yoneda et al., 1998), но эти рыбы имеют яичники типа II-1.
Для объяснения изменчивости репродуктивной системы скорпеновидных рыб выдвинута гипотеза о том, что живородящие виды родов Sebastes и Sebastiscus сохранили исходный тип яичников (II-1), в то время как тип II-3, свойственный остальным представителям подотряда, является более продвинутым (Koya, Muñoz, 2007), что соответствует одной из филогенетических схем (Imamura, 2004). Наличие яичников типа II-1, по крайней мере у представителей рода Inimicus, нарушает стройность этой гипотезы. Согласно одной из последних филогенетических схем Scorpaeniformes, построенной на основе комбинации большого числа морфологических и молекулярных признаков, живородящие виды родов Sebastes и Sebastiscus рассматриваются как наиболее продвинутые (Smith et al., 2018), что соответствует традиционным представлениям об эволюции живорождения (Wourms, 1991; Pavlov, Emel’yanova, 2010; Павлов, Емельянова, 2013). Согласно этой схеме (Smith et al., 2018. Fig. 3), Synanceiidae и Scorpaenidae + Sebastidae в прежней интерпретации этих семейств (Smith, Wheeler, 2004) составляют две большие клады, причём вторая клада интерпретируется как семейство Scorpaenidae. В пределах клады Synanceiidae Inimicus характеризуется яичниками типа II-1, в то время как представители рода Synanceia вымётывают донную кладку, окружённую желеобразной массой (Fewings, Squire, 1999) и имеют яичники типа II-3 (наши наблюдения). В кладе Scorpaenidae большинство родов имеют яичники типа II-3, но Helicolenus (тип II-3), Sebastiscus и Sebastes (тип II-1) составляют одну субкладу. При этом представители рода Helicolenus вымётывают оплодотворённые яйца на ранних стадиях развития после копуляции и внутреннего оплодотворения (способ размножения, получивший название zygoparity, или embryoparity) (Wourms, 1991; Koya, Muñoz, 2007). Таким образом, данная филогенетическая схема (Smith et al., 2018) предполагает параллельное и независимое возникновение (гомоплазию) уникального для рыб типа яичников II-3. Возможность такого эволюционного преобразования остаётся под вопросом, и ни одна из существующих филогенетических схем не даёт на него ответа.
Список литературы
Емельянова Н.Г., Павлов Д.А. 2014. Ультраструктура гамет двух видов рода Upeneus (Mullidae) Южно-Китайского моря // Вопр. ихтиологии. Т. 54. № 3. С. 352–358. https://doi.org/10.7868/S0042875214030023
Павлов Д.А., Емельянова Н.Г. 2007. Особенности биологии размножения двух видов тропических рыб семейста Scorpaenidae // Там же. Т. 47. № 3. С. 347–360.
Павлов Д.А., Емельянова Н.Г. 2013. Переход к живорождению в отряде Scorpaeniformes: краткий обзор // Там же. Т. 53. № 1. С. 69–86. https://doi.org/10.7868/S0042875213010116
Павлов Д.А., Емельянова Н.Г. 2018. Сравнительный анализ морфологии сперматозоидов у трёх видов рыб подотряда Scorpaenoidei // Там же. Т. 58. № 2. С. 201–214. https://doi.org/10.7868/S0042875218020091
Павлов Д.А., Емельянова Н.Г. 2019. Биологическая характеристика Dendrochirus zebra (Cuvier, 1829) (Scorpaeniformes: Scorpaenidae) из залива Нячанг Южно-Китайского моря // Биология моря. Т. 45. № 2. С. 75–85. https://doi.org/10.1134/S0134347519020104
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. М.: Сов. наука, 467 с.
Соин С.Г., Чепурнов В.А. 1986. Особенности строения придаточных образований мочеполовой системы некоторых морских рыб // Вопр. ихтиологии. Т. 26. Вып. 5. С. 726–733.
Уикли Б. 1975. Электронная микроскопия для начинающих. М.: Мир, 324 с.
Черняев Ж.А. 1977. Морфоэкологические особенности размножения и развития песчаной широколобки оз. Байкал Paracottus (Leocottus) kessleri (Dyb.) // Вопр. ихтиологии. Т. 17. Вып. 6 (107). С. 1055–1069.
Черняев Ж.А. 1979. Размножение и развитие большеголовой широколобки Batrachocottus baicalensis (Dyb.) оз. Байкал // Там же. Т. 19. Вып. 6 (119). С. 1053–1067.
Шадрин А.М., Емельянова Н.Г. 2019. Эмбрионально-личиночное развитие и некоторые особенности репродуктивной биологии Dendrochirus zebra (Scorpaenidae) // Там же. Т. 59. № 1. С. 39–53. https://doi.org/10.1134/S0042875219010168
Шадрин А.М., Павлов Д.С., Астахов Д.А., Новиков Г.Г. 2003. Атлас икры и личинок рыб прибрежных вод Южного Вьетнама. М.: ГЕОС, 264 с.
Carpenter K.E., Niem V.H. (eds.). 1999. FAO species identification guide for fishery purposes. The living marine resources of the Western Central Pacific. V. 4. Bony fishes. Pt. 2 (Mugilidae to Carangidae). Rome: FAO. P. 2069–2790.
Emel’yanova N.G., Pavlov D.A. 2012. From oocyte to larva: hormonal induction of oocyte maturation and initial development of coral reef fishes. Moscow: KMK Sci. Press, 170 p.
Fewings D.G., Squire L.C. 1999. Notes on the reproduction in estuarine stonefish Synanceia horrida // SPC Live Reef Fish Info. Bull. 5. P. 31–33.
Fishelson L. 1975. Ethology and reproduction of pteroid fishes found in the Gulf of Aqaba (Red Sea), especially Dendrochirus brachypterus (Cuvier), (Pteroidae, Teleostei) // Publ. Staz. Zool. Napoli. V. 39. P. 635–656.
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). 2019. Eschmeyer’s catalog of fishes: genera, species, references. (http://researcharchive.calacademy.org/research/ichthyology/catalog/ fishcatmain. asp. Version 05/2019)
Froese R., Pauly D. (eds.). 2019. FishBase. (http://www. fishbase.org. Version 04/2019)
Gosline W.A. 1994. Function and structure in the paired fins of scorpaenifom fishes // Environ. Biol. Fish. V. 40. P. 219–226.
Hirata H., Niiro M., Ishibashi Y. et al. 2001. Diurnal changes of oxygen consumption in devil stinger Inimicus japonicus // Suisanzoshoku. V. 49. № 4. P. 469–474.
Imamura H. 2004. Phylogenetic relationships and new classification of the superfamily Scorpaenoidea (Actinopterygii: Perciformes) // Species Divers. V. 9. P. 1–36.
Koya Y., Muñoz M. 2007. Comparative study on ovarian structures in scorpaenids: possible evolutional process of reproductive mode // Ichthyol. Res. V. 54. P. 221–230.
Koya Y., Munehara H., Takano K. 1993. Secretion abilities of epithelia of ovarian wall and ovigerous lamella lining theovarian cavity of masked greenling Hexagrammos octogrammus // Jpn. J. Ichtyol. V. 40. P. 199–208.
Kwik J.T.B. 2011. The biology and ecology of small tropical scorpaenoids inhabiting shallow coastal habitats in Singapore: Ph.D. Thesis. Nat. Univ. Singapore, 219 p. (http://scholarbank.nus.sg/handle/10635/31654)
Liu Z.Y., Quan H.F. 2005. Research on the technique for artificial breeding of Inimicus japonicus // J. Shanghai Fish. Univ. V. 14. P. 30–34.
Mattei X. 1991. Spermatozoon ultrastructure and its systematic implication in fishes // Can. J. Zool. V. 69. P. 3038–3055.
McMillan D.B. 2007. Fish histology. Female reproductive system. Dordrecht: Springer, 598 p.
Moser H.G. 1967. Reproduction and development of Sebastodes paucispinis and comparison with other rock fishes of Southern California // Copeia. № 4. P. 773–797.
Moyer J.T., Zaiser M.J. 1981. Social organization and spawning behavior of the Pteroine fish Dendrochirus zebra at Miyake-Jima, Japan // Jpn. J. Ichthyol. V. 28. P. 52–69.
Nozaki R., Takushima M., Mizuno K. et al. 2003. Reproductive cycle of devil stinger, Inimicus japonicus // Fish Physiol. Biochem. V. 28. P. 217–218.
Pavlov D.A., Emel’yanova N.G. 2010. Reproductive biology of species from the family Scorpaenidae and transition from oviparity to viviparity in the southern and northern Percomorpha // Viviparous fishes II / Eds. Uribe M.C., Grier H.J. Homestead: New Life Publ. P. 89–105.
Santhanam R. 2019. Biology and ecology of venomous marine scorpionfishes. London: Acad. Press, 312 p.
Scott M. 2001. Speak of the devil: fish of the genus Inimicus // SeaScope. V. 18. P. 1, 3.
Smith W.L., Wheeler W.C. 2004. Polyphyly of the mail-cheeked fishes (Teleostei: Scorpaeniformes): evidence from mitochondrial and nuclear sequence data // Mol. Phylogen. Evol. V. 32. P. 627–646.
Smith W.L., Everman E., Richardson C. 2018. Phylogeny and taxonomy of flatheads, scorpionfishes, sea robins, and stonefishes (Percomorpha: Scorpaeniformes) and the evolution of the lachrymal saber // Copeia. V. 106. № 1. P. 94–119. https://doi.org/10.1643/CG-17-669
Sparre P., Venema C.S. 1998. Introduction to tropical fish stock assessment. Pt. I: Manual // FAO Fish. Tech. Pap. Rev. № 306/1. Rev. 2. Rome: FAO, 407 p.
Vila S., Sàbat M., Muñoz M., Casadevall M. 2010. Spermiogenesis particularities of a sperm storage species: Helicolenus dactylopterus (Teleostei: Scorpaenidae) // Sci. Mar. V. 74. № 4. P. 687–704. https://doi.org/10.3989/scimar.2010.74n4697
Wang Y., Li L., Cui G., Lu W. 2013. Ontogenesis from embryo to juvenile and salinity tolerance of Japanese devil stinger Inimicus japonicus during early life stage // SpringerPlus. V. 2. № 289. P. 1–13.
Watanabe K. 2006. Maturation of wild and reared female devil stinger, Inimicus japonicus // Aquacult. Sci. V. 54. № 4. P. 495–503.
Watanabe K. 2012. Maturation of reared male devil stinger Inimicus japonicus // Ibid. V. 60. № 2. P. 227–232.
Wourms J.P. 1991. Reproduction and development of Sebastes in the context of the evolution of piscine viviparity // Environ. Biol. Fish. V. 30. P. 111–126.
Yoneda M., Tokimura M., Fujita H. et al. 1998. Ovarian structure and batch fecundity in Lophiomus setigerus // J. Fish Biol. V. 52. P. 94–106.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии