Вопросы ихтиологии, 2020, T. 60, № 5, стр. 515-543
Пересмотр родовой классификации “длиннотелых” опистопроктовых рыб (Opisthoproctidae) с описанием новых таксонов и новых находок
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
2 Институт океанологии РАН – ИО РАН
Москва, Россия
* E-mail: prokartster@gmail.com
Поступила в редакцию 20.02.2020
После доработки 27.02.2020
Принята к публикации 27.02.2020
Аннотация
Ревизованы роды “длиннотелых” опистопроктид – Bathylychnops, Ioichthys, Dolichopteryx, Dolichopteroides и впервые описываемый Duolentops gen. nov. (типовой вид – D. minuscula). Приведен обзор диагностически значимых признаков и составлены новые диагнозы родов. Уточнены характеристики ряда видов (I. kashkini, D. minuscula, D. andriashevi, D. longipes, D. parini, D. pseudolongipes, D. trunovi и D. vityazi). D. pseudolongipes впервые обнаружен в западной части Тихого океана. Описан новый вид Dolichopteryx nigripes sp. nov. из южной части Тихого океана. Составлена новая таблица для определения родов и видов “длиннотелых” опистопроктид.
Представители семейства Opisthoproctidae являются одними из наиболее гротескных современных рыб и традиционно фигурируют в популярной литературе при описании причудливых обитателей морских глубин. Действительно, облик этих рыб, населяющих мезо- и отчасти батипелагиаль от бореальных широт Атлантики и Пацифики до Субантарктики, весьма своеобразен. Они характеризуются исключительной специализацией органов зрения, варианты которой в пределах семейства весьма разнообразны (Partridge et al., 2014), и глубокими редуктивными преобразованиями скелета (Cohen, 1964). Роды опистопроктовых рыб можно с определенной долей условности разделить на две группы – “длиннотелые” и “короткотелые”, характеризующиеся соответственно 40–85 и 30–40 позвонками. К первой группе относятся роды Bathylychnops Cohen, 1958, Dolichopteryx Brauer, 1901, Dolichopteroides Parin et al., 2009 и Ioichthys Parin, 2004; ко второй – Macropinna Chapman, 1939, Opisthoproctus Vaillant, 1888 (включая Monacoa Whitley, 1943), Rhynchohyalus Barnard, 1925 и Winteria Brauer, 1901. Условность такого разделения объясняется тем, что род Winteria, по-видимому, морфологически наиболее близок к общему предку всех опистопроктовых рыб, а род Rhynchohyalus представляет собой морфологически промежуточную форму между “длиннотелыми” и “короткотелыми” опистопроктидами. Вместе с тем “длиннотелые” роды опистопроктид, вероятнее всего, представляют собой монофилетическую группу, общей чертой которой является тенденция к увеличению числа позвонков, смещению в каудальном направлении вертикальных плавников и удлинению туловища.
Несмотря на наличие недавней ревизии (Parin et al., 2009), систематика “длиннотелых” опистопроктид остается слабо разработанной, что объясняется редкостью этих рыб в коллекциях и их чрезвычайно слабой конституцией, из-за чего они обычно попадают в руки исследователей сильно повреждёнными. Ряд видов рода Dolichopteryx остаются известными только по молоди, с другой стороны, имеются виды, для которых, напротив, не описаны ранние стадии развития. Ряд признаков, используемых в родовой и видовой диагностике, подвержены онтогенетической изменчивости либо присутствуют только на определённых онтогенетических стадиях, что сильно затрудняет идентификацию видов. Парин с соавторами (Parin et al., 2009) признали в составе четырёх родов “длиннотелых” опистопроктид 16 валидных видов, помимо которых ещё две формы были указаны ими в открытой номенклатуре. За последние десять лет мною были обнаружены в различных музейных собраниях несколько новых экземпляров из этой группы рыб, работа с которыми позволила выявить ряд неточностей в описаниях и/или интерпретациях предыдущих авторов, а также ряд ошибок в определительной таблице в последней ревизии группы Парина с соавторами (Parin et al., 2009), делающих затруднительным определение видов. Как следствие, мною было предпринято переизучение всех доступных экземпляров по этой группе и имеющихся литературных данных, результаты которого доложены в настоящей статье.
МАТЕРИАЛ И МЕТОДИКА
Перечень и этикеточные данные изученных экземпляров приведены в описательной части работы. Методика измерений и подсчётов стандартная (Hubbs, Lagler, 1958) со следующими дополнениями: горизонтальный диаметр глазного яблока измеряли по крайним точкам переднего и заднего краёв глазного яблока, горизонтальную длину костной орбиты – от заднего края латероэтмоида до максимально отдаленного от него заднего костного края орбиты. Подсчёт жаберных тычинок проводили либо на полностью экстрагированных дугах, либо после подрезки окружающих тканей, позволяющей полностью визуализировать жаберную дугу. Для лучшей визуализации тычинок экстрагированные дуги подкрашивали ализарином красным S. Номенклатура структур глаза взята из опубликованной ранее работы (Pearcy et al., 1965) и адаптирована к русскому языку; субсклеральными линзами называются утолщения, сформированные под роговицей глаза; “зеркальцем” (Wagner et al., 2009) – отражательный слой из кристаллосодержащих клеток в дне шаровидного тела. Использованы следующие сокращения: SL – стандартная длина; D, A, P, V, C – соответственно спинной, анальный, грудные, брюшные и хвостовой плавники; r. br, sp. br – число жаберных лучей и жаберных тычинок в наружном ряду на первой дуге; p. c – число пилорических придатков, n – число исследованных особей; б/№ – некаталогизированные экземпляры; НИС, НПС – соответственно научно-исследовательское и научно-промысловое судна; РТАК – разноглубинный трал Айзекса–Кидда, ХКС – хамсеросная коническая сеть, ст. – океанографическая станция; ИО РАН – Институт океанологии РАН, Москва; ЗИН – Зоологический институт РАН, Санкт-Петербург; ЗММУ – Зоологический музей Московского государственного университета; MNHN – Национальный музей естественной истории, Париж (Франция).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Обзор признаков, используемых для родовой диагностики “длиннотелых” опистопроктид
Строение глаз (рис. 1). Глаза у всех опистопроктовых рыб претерпевают существенные морфологические преобразования, вместе с другими структурными модификациями определяющие исключительно своеобразный облик этих рыб. Для “длиннотелых” опистопроктид характерны два типа строения глазного яблока – пузыревидный (в англоязычной литературе “pouchlike” (Fukui, Kitagawa, 2006a, 2006b; Fukui et al., 2008)) (рис. 1а–1в, 1и) и бокаловидный, или телескопический (рис. 1г–1з). Пузыревидные глаза свойственны видам из родов Bathylychnops, Ioichthys и Duolentops gen. nov., телескопические – Dolichopteryx и Dolichopteroides. Указание на наличие пузыревидных (Fukui, Kitagawa, 2006b; Fukui et al., 2008) или слабо телескопических, направленных косо вверх (Parin et al., 2009) глаз у D. parini, по-видимому, объясняется неточным их изображением в первоописании этого вида (Кобылянский, Федоров, 2001. С. 125, рисунок), так как своего материала по этому виду перечисленные выше авторы не имели. Между тем в тексте первоописания чётко указано, что глаза у D. parini “телескопические” (Кобылянский, Федоров, 2001. С. 126), и их строение у исследованного мною экземпляра этого вида ничем не отличается от такового у других представителей рода Dolichopteryx sensu novo (рис. 1г, 1ж).
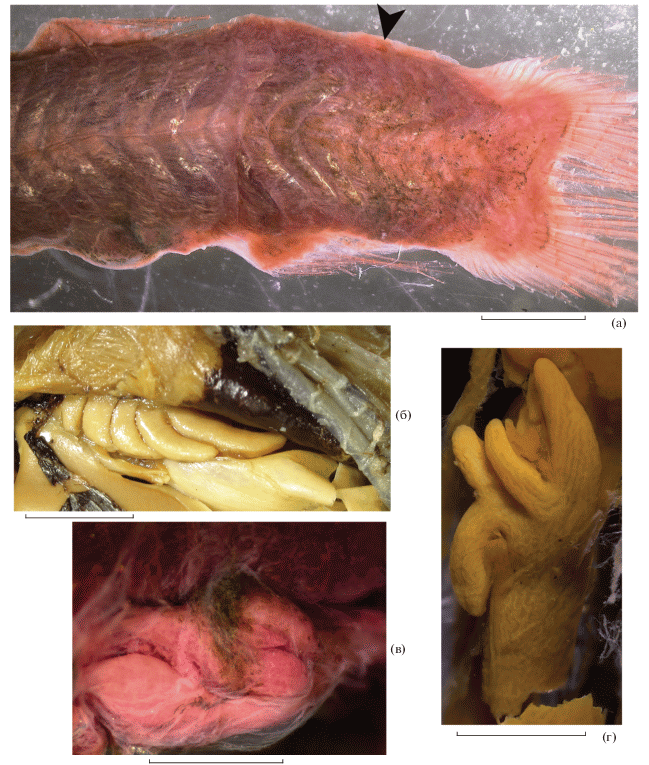
Рис. 1.
Глазное яблоко Ioichthys kashkini, паратип SL 66.3 мм (а, б); Duolentops minuscula, экз. SL 30 мм (в); Dolichopteryx parini, экз. SL 170 мм (г, ж); D. andriashevi, паратип SL 41.4 мм (д, е); Dolichopteroides binocularis, экз. SL 55 мм (з); Bathylychnops exilis, экз. SL 420 мм (и) (а–д, з, и – латерально; е, ж – вентролатерально). Условные обозначения: ap – апертура шаровидного тела, проницаемая для света; apk – афокальная зона, c.g – шаровидное тело (передний вырост роговицы), cor – корнеальные линзы (“дополнительные” хрусталики); dsc, vsc – соответственно верхняя и нижняя субсклеральные линзы; myo – срединная дорсальная миосепта, pce – задний вырост роговицы, rd – ретинальный дивертикулум, scl – склеротизированное стяжение роговицы, so – подглазничное скопление меланофоров, ta – белая (светящаяся?) ткань у нижнего края глаза. Масштаб, мм: а – 2; б, ж – 4; в, д–е, з – 1; г, и – 8.
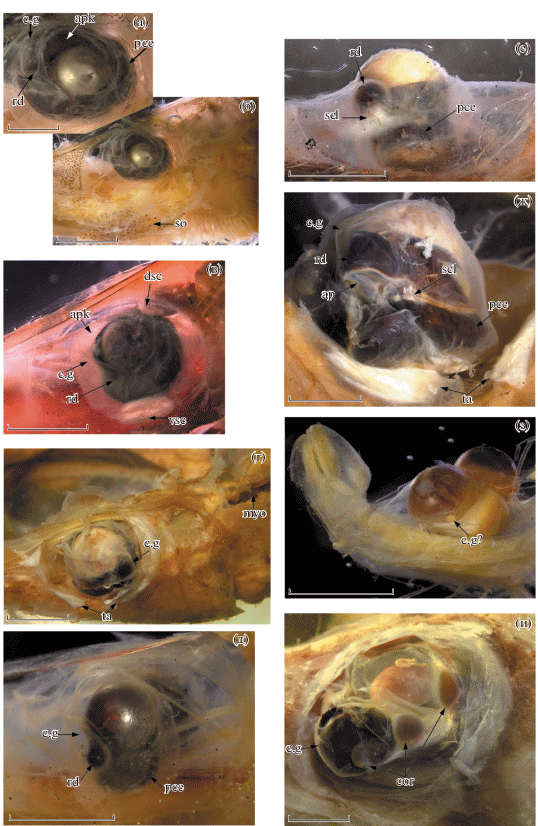
Глазное яблоко у всех видов “длиннотелых” опистопроктовых рыб имеет выросты роговицы, строение которых у представителей разных родов существенно отличается. Наиболее просто они устроены у Ioichthys, глаз которого практически лишён участков дополнительной склеротизации роговицы. Передний вырост роговицы у Ioichthys крупный, бобовидной формы, расположен у переднего края хрусталика глаза и занимает около половины его вертикального диаметра. Его передний и верхний отделы прозрачные, а в задненижнем отделе расположен ретинальный дивертикулум, окружённый пигментной оболочкой (рис. 1а). Отверстие зрачка обрамляет светлая, вероятно, несколько склеротизированная кайма (наиболее развитая вдоль заднего края переднего выроста роговицы), нижнюю часть которой Парин (2004. С. 438), по-видимому, называл “кожным веком”. Задний вырост является простым утолщением роговицы, он хорошо выражен у голотипа SL 232 мм, но едва намечен у паратипа SL 66 мм. Хотя Парин (2004) указывает, что задний вырост крупнее переднего, это не так, поскольку он, по-видимому, не учитывал непигментированный отдел в передней и верхней частях переднего выроста, вместе с которым длина этого выроста составляет более двух третей вертикального диаметра хрусталика глаза.
У Duolentops gen. nov. строение переднего выроста роговицы сходно с описанным выше для Ioichthys; ретинальный дивертикулум имеет вид вертикально вытянутого тяжа вдоль переднего края хрусталика глаза с хорошо сформированным светлым линзовидным утолщением в нижней части (рис. 1в), по-видимому, выполняющим функцию дополнительного хрусталика либо гомологичным “зеркальцу” Dolichopteryx. Ioichthys и Duolentops gen. nov. отличаются от всех прочих родов “длиннотелых” опистопроктид наличием в глазу афокального пространства перед передневерхним краем хрусталика (у Bathylychnops и родов с телескопическими глазами оно не развито), наиболее выражено оно у Ioichthys. Выросты роговицы у этих родов ещё не формируют обособленного шаровидного тела на глазном яблоке (“secondary globe” – по терминологии Пирси с соавторами (Pearcy et al., 1965)).
В нижней части глазного яблока под хрусталиком у Duolentops gen. nov. имеется плотное, овальное, чётко отграниченное светлое линзовидное субсклеральное утолщение, с глубоким вдавлением на наружной поверхности (рис. 1в). Оно изображено и на рисунках в первоописаниях обоих видов (Fukui, Kitagawa, 2006a, 2006b). Структурно сходное линзовидное образование имеется у исследованного мною экземпляра D. minuscula и в верхнезадней части орбиты (при взгляде сбоку оно частично прикрыто костями черепа) (рис. 1в). В работах Фукуи и Китагавы (Fukui, Kitagawa, 2006a, 2006b) такая структура не описана. Задний вырост роговицы у Duolentops gen. nov. не развит.
У Dolichopteryx передний вырост роговицы тонкий, у молоди абсолютно прозрачный, в его нижнезадней части расположен ретинальный дивертикулум, вместе они образуют обособленное шаровидное тело, смещённое на латеральную поверхность хрусталика глаза. Участок передней стенки шаровидного тела прозрачный, а в дне дивертикулума наблюдается светлое утолщение (рис. 1д). По данным Вагнера и др. (Wagner et al., 2009), эта структура, названная ими “зеркальцем”, обеспечивает отражение световых лучей, проникающих через прозрачную часть роговицы, на светочувствительные клетки ретинального дивертикулума. Вторичная линза, фокусирующая свет, у Dolichopteryx отсутствует (Brauer, 1908; Pearcy et al., 1965; Frederiksen, 1973; Wagner et al., 2009). Под передним выростом располагается задний вырост роговицы, у Dolichopteryx хорошо выраженный и представляющий бобовидное или овальное выпячивание роговицы, охваченное разрастанием пигментной оболочки глаза. Вентральное положение заднего выроста относительно переднего объясняется телескопической формой глаз и их ориентацией вверх в естественном положении. Между передним и задним выростами образуется стяжение склеры, из-за чего они имеют форму “песочных часов” (рис. 1е, 1ж).
В онтогенезе у Dolichopteryx наблюдается усложнение строения роговичных выростов и сопутствующих им образований. При SL 30–60 мм шаровидное тело уже полностью сформировано, но нижний вырост роговицы ещё слабо развит; склера между верхним и нижним выростами утолщена и определяется по участку молочно-белого цвета с серебристым отливом в косом свете (рис. 1е), но ещё не образует стяжения, которое появляется у взрослых рыб SL 170 мм (рис. 1ж). У взрослых рыб ретинальный дивертикулум занимает весь объём шаровидного тела. У всех исследованных мальков шаровидное тело расположено в передней половине боковой поверхности глаза, тогда как у крупного экземпляра D. parini – в задней. Неясно, имеет ли место смещение шаровидного тела в каудальном направлении с ростом или это видоспецифические особенности.
У D. anascopa и D. parini по нижнему краю глаза развит овальный (D. anascopa) или полулунный (D. parini) участок молочно-белой несклеротизированной, поверхностно расположенной ткани (рис. 1г, 1ж). Функциональное значение этого образования не выяснено.
К сожалению, исследованный мною материал по Dolichopteroides характеризуется очень плохой сохранностью глаз. У малька SL 55 мм оболочки глаза утрачены, на уровне середины хрусталика (на его нижней половине) с латеральной стороны имеется маленькое шаровидное образование (рис. 1з). Из двух взрослых рыб остатки левого глаза сохранились у экземпляра с Китового хребта: хрусталик выдавлен, какие-либо склеротизированные образования на оболочках глаза не определяются, наличие и характер роговичных выростов определить не представляется возможным. Парин с соавторами (Parin et al., 2009) указывают для Dolichopteroides наличие дополнительного хрусталика.
Наиболее сложное строение имеют глаза Bathylychnops, которые характеризуются максимальным развитием линзовидных склеротизированных образований, не имеющим аналогов среди других позвоночных животных (рис. 1и). Глаз взрослого Bathylychnops имеет крупное, хорошо обособленное шаровидное тело, расположенное антеровентральнее хрусталика глаза и полностью покрытое пигментной оболочкой, в передненижней части которой имеется прозрачное “окно”, пропускающее свет. Позади этого “окна” на латеральной поверхности шаровидного тела у его нижнего края на середине длины последнего расположено крупное шаровидное корнеальное склеротизированное образование, представляющее собой дополнительный хрусталик (Pearcy et al., 1965). У заднего края шаровидного тела роговица образует ещё одно, примерно в полтора раза более крупное линзовидное образование (корнеальную линзу), а у заднего края хрусталика глаза – третье, соизмеримое со вторым, но более вытянутое по вертикальной оси. Второе линзовидное образование соединено с третьим утолщённой склеральной перемычкой, от его передневерхнего и передненижнего углов также отходят тяжи склеротизированной ткани, охватывающие сзади шаровидное тело; ещё один тяж проходит дорсальнее второй корнеальной линзы от склеротизированной перемычки между второй и третьей линзами к переднему краю глазного яблока. Третья корнеальная линза образует склеральные утолщения у своего переднего края и у верхнего конца. Вместе эти склеральные утолщения соединяют корнеальные линзы наподобие скелета, возможно, принимающего участие в аккомодации корнеальных линз.
Межвидовой изменчивости в строении глаз у Bathylychnops не выявлено. Хотя более мелкие экземпляры B. brachyrhynchus, имеющиеся в моем распоряжении, имеют менее развитые склеротизированные образования, чем очень крупный экземпляр B. exilis, это, по-видимому, отражает онтогенетическую изменчивость. Я не располагаю мальковыми экземплярами представителей этого рода, но, по литературным данным (Pearcy et al., 1965; Badcock, 1988), у молоди Bathylychnops корнеальные линзы ещё не развиты. Коэн (Cohen, 1958) отмечает, что все три корнеальные линзы развиты у рыб крупнее SL 112 мм, но у двух экземпляров SL 107 и 110 мм, изученных Пирси с соавторами (Pearcy et al., 1965), второе и третье образования ещё не были сформированы.
Формирование роговичных выростов и преобразование переднего из них в шаровидное тело, заключающее ретинальный дивертикулум, который содержит фоторецепторные клетки, является общей специализацией “длиннотелых” опистопроктид. Из наименее специализированного плана строения, наблюдаемого у Ioichthys, могут быть выведены все остальные варианты преобразования указанных структур, наблюдаемые у других родов. В то же время нельзя сказать, что варианты строения, характерные для разных родов, демонстрируют однонаправленную специализацию и прогрессирующее усложнение различных структур глаза. Шаровидное тело наиболее сложно устроено у Bathylychnops, однако глазное яблоко у этого рода сохраняет примитивное пузыревидное строение. Пирси с соавторами (Pearcy et al., 1965) рассматривают специализации в строении глаз Bathylychnops в качестве независимой от других опистопроктид специализации к стереоскопическому зрению. По их предположению, у Dolichopteryx стереоскопия обеспечивается телескопическими, направленными вверх глазами, в то время как шаровидное тело у этого рода устроено более примитивно и лишено дополнительных склеротизаций. Как показали Брауэр (Brauer, 1908) и Вагнер с соавторами (Wagner et al., 2009), свет, проникающий в шаровидное тело у Dolichopteryx, попадает не прямо на сетчатку, а отражается от “зеркальца”, т.е. наблюдается уникальная для позвоночных ситуация, когда изображение получается не путем рефракции, а путем отражения. По аналогии с двураздельными глазами некоторых пелагических ракообразных, предполагается, что бокаловидное глазное яблоко Dolichopteryx обеспечивает преимущественно визуализацию объектов солнечными лучами, проникающими в мезофотическую зону, тогда как шаровидное тело ответственно за визуализацию биолюминесцирующих источников (Land, 2000; Wagner et al., 2009). В таком случае различное строение глаз у Bathylychnops и Dolichopteryx связано не с достижением одной и той же функции разными путями, как предполагали Пирси с соавторами (Pearcy et al., 1965), а с разнонаправленными специализациями зрения у разных родов. Отсутствие сведений о микроскопическом строении структур глаза у Duolentops gen. nov. не позволяет высказаться о возможных функциональных специализациях зрения у данного рода, однако развитие у него субсклеральных линз, очевидно, также обеспечивает расширение поля зрения при сохранении пузыревидных глаз. Субсклеральные линзы у Duolentops gen. nov. развиты гораздо лучше слабо обособленного шаровидного тела, что кардинальным образом отличает этот род от Bathylychnops.
Озубление сошника. Зубы на сошнике имеются у всех опистопроктовых рыб, за исключением Ioichthys; утрата их у последнего рассматривается в качестве специализации этого рода (Парин, 2004). У Bathylychnops зубы на сошнике расположены в один ряд, а не в несколько рядов, как у остальных родов. Таким образом, имеет место следующая эволюционная тенденция в развитии этого признака: (Dolichopteryx + Dolichopteroides + + Duolentops gen. nov.) → Bathylychnops → Ioichthys.
Строение жаберных тычинок (рис. 2, 3). Жаберные тычинки имеются на всех дугах, но в диагностических целях используется только первая дуга. Тычинки последующих дуг у разных видов характеризуются в общем теми же чертами, что и тычинки первой дуги, но на каждой последующей дуге они становятся всё более мелкими, их число уменьшается, а черты морфологической специализации сглаживаются. Ранее было показано, что число тычинок наружного ряда является важным видовым признаком (Parin et al., 2009), однако на различия в морфологии тычинок до сих пор не обращали должного внимания. У представителей всех родов “длиннотелых” опистопроктид жаберные тычинки расположены в два ряда на каждой дуге; тычинки в наружном ряду всегда развиты лучше, чем во внутреннем. Наружный и внутренний ряды тычинок широко разобщены; передняя поверхность жаберной дуги, располагающаяся между ними, очень широкая; основания тычинок соединены плотным тяжом соединительной ткани; скелетные элементы жаберной дуги покрыты толстым, легко отделяющимся эпителием (вероятно, с развитым студенистым слоем под ним). Жаберные тычинки очень слабо или совсем не оссифицированные даже у самых крупных рыб. У изученных мною мальков Ioichthys и Dolichopteryx жаберные тычинки наружного ряда уплощенные, но довольно узкие и удлинённые (ресницевидные), расставленные (рис. 2а, 2в); у взрослых представителей этих родов тычинки становятся короткими и широкими (язычковидными) и соприкасаются краями (рис. 2д). Тычинки внутреннего ряда редуцированные (у Ioichthys – в меньшей степени), ресницевидные или сосочковидные (рис. 2б, 2г, 2е), более или менее расставленные. У взрослых Bathylychnops (мальки в этом отношении не изучены) жаберные тычинки наружного ряда остаются ресницевидными, они уже и длиннее, чем у мальков вышеуказанных родов; тычинки внутреннего ряда также развиты лучше, в обоих рядах противолежащие тычинки изогнуты так, что формируют как бы стенки канала, дно которого образовано передней поверхностью жаберной дуги (рис. 2ж, 2з). Напротив, у Dolichopteroides наблюдается максимальная степень укороченности и расширенности жаберных тычинок, формирующаяся уже на ранних стадиях онтогенеза (рис. 2и, 2к). Тычинки внутреннего ряда у Dolichopteroides редуцированы в наибольшей степени по сравнению с другими родами. Покровная ткань внутренней поверхности epi- и ceratobranchiale-1 у взрослых особей D. binocularis образует верхнюю и нижнюю килевидные складки (рис. 2л, 2м), у представителей других родов не обнаруженные. Совершенно уникальная специализация в строении жаберных тычинок наблюдается у Duolentops gen. nov.: тычинки наружного ряда у этого рода резко гипертрофированы и подразделены на два ряда. Наружный ряд образован 14 длинными толстыми слабо уплощёнными тычинками (последняя очень мала), расположенными на cerato- и hypobranchiale-1 и направленными, как и у большинства других костистых рыб, вперед (рис. 3а). Кнутри и несколько выше тычинок этого ряда сидят ещё две крупные тычинки (рис. 3б, 3в), располагающиеся позади цератобранхиального ряда и ориентированные параллельно поверхности ceratobranchiale-1: одна из них прикрепляется к месту сочленения epi- и ceratobranchiale, а вторая – к epibranchiale-1 чуть выше этого сочленения. Тычинки внутреннего ряда у Duolentops gen. nov., толстые и пальцевидные по форме (рис. 3б), остаются сравнительно хорошо развитыми.
Рис. 2.
Строение жаберных тычинок наружного (а, в, д, ж, и, к) и внутреннего (б, г, е, з, л, м) ряда первой жаберной дуги Ioichthys kashkini, паратип SL 66.3 мм (а, б); Dolichopteryx vityazi, экз. SL 57.5 мм (в, г); D. parini, экз. SL 170 мм (д, е); Bathylychnops brachyrhynchus, экз. SL 308 мм (ж, з); Dolichopteroides binocularis, экз. SL 55 (и), 233 (к, л), 210 (м) мм; pd, pv – соответственно верхняя и нижняя килевидные складки. Масштаб, мм: а, б – 1.5; в, г, и – 1; д, е, к–м – 2.5; ж, з – 3.
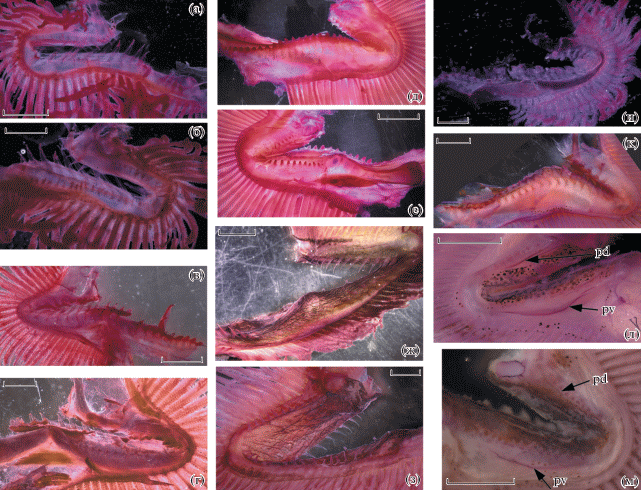
Рис. 3.
Первая жаберная дуга Duolentops minuscula, экз. SL 30 мм (а – снаружи; б, в – изнутри); (▶) – тычинки, расположенные между наружным и внутренним рядами. Масштаб, мм: а, б – 1 (линейка общая); в – 0.5.
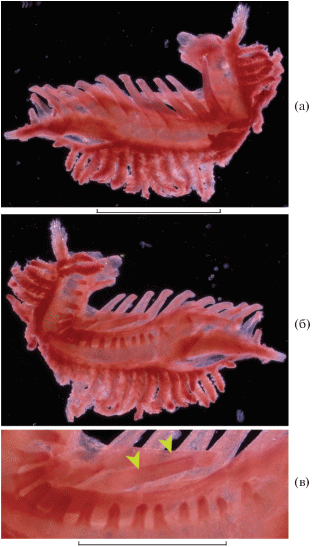
Различия в строении жаберных тычинок у разных родов и/или разных онтогенетических стадий, очевидно, отражают различия в питании и/или особенностях манипуляций с пищевыми объектами. Слабая мускулатура, маленький рот и очень слабые челюсти дают основания предполагать питание мелкими ракообразными и кишечнополостными – в пищевом тракте B. exilis и Dolichopteryx spp. отмечались копеподы, эвфаузииды и сифонофоры (Cohen, 1964; Fitch, Lavenberg, 1968; Stein, Bond, 1985). Уже высказывалось предположение о том, что частицы раздавливаемых языком пищевых объектов либо отдельные мелкие животные задерживаются тычинками и далее направляются в круменальный орган, который образован эпибранхиальными скелетными элементами четвертой и пятой жаберных дуг и разросшимися мягкими тканями, продуцирующими большое количество слизи. Роль круменального органа (или одна из ролей) заключается в формировании плотного пищевого комка, который рыба затем проглатывает (Greenwood, Rosen, 1971; Stein, Bond, 1985). Возможно, роль тонких и удлинённых тычинок сводится главным образом к удержанию достаточно крупных пищевых частиц, тогда как широкие и тесно сближенные тычинки, будучи покрытыми при жизни слоем слизи, способствуют удержанию и перемещению к круменальному органу очень мелких объектов. Функциональное значение своеобразной модификации тычинок наружного ряда первой дуги у Duolentops gen. nov. не вполне понятно, но, возможно, также связано с транспортом пищевых объектов к круменальному органу.
Число позвонков (миомеров). По числу позвонков роды “длиннотелых” опистопроктид распределяются на три группы: многопозвонковые (Bathylychnops), относительно малопозвонковые (Dolichopteryx, Duolentops gen. nov.) и с промежуточным числом позвонков (Dolichopteroides, Ioichthys). У видов Bathylychnops число позвонков варьирует от 67 до 85 и является видоспецифичным. У Dolichopteroides число позвонков составляет 58–60, а у Ioichthys 53–58. У видов Dolichopteryx число позвонков колеблется в пределах 41–48, у Duolentops gen. nov. – 40–46 (Parin et al., 2009). Увеличение числа позвонков находится в прямой корреляции со степенью удлинённости тела. Многопозвонковость (более 67), безусловно, следует считать продвинутым состоянием. У батилаговых и микростомовых рыб число позвонков варьирует в пределах от 35 до 52, у аргентиновых их число несколько выше: 48–67 (43 у карликового монотипного подрода Prosoarchus) (Cohen, 1964; Kawaguchi, Butler, 1984; Кобылянский, 1990, 2006; Hatooka, 2002). “Короткотелые” роды опистопроктид имеют 30–40 позвонков (больше всего их у Rhynchohyalus, наиболее сходного с Dolichopteryx по форме тела), у морфологически наименее модифицированного рода Winteria их 33–36 (Haedrich, Craddock, 1968; Aizawa, 2002). Если опистопроктовые ведут своё происхождение от каких-то малоспециализированных малопозвонковых микростомовых рыб (вроде Nansenia), то можно предположить следующую эволюционную тенденцию: Winteria → Rhynchohyalus → (Dolichopteryx + Duolentops gen. nov.) → → Ioichthys → Dolichopteroides → Bathylychnops.
Длина Р. Лучи плавников у коллекционных экземпляров, как правило, обломаны, поэтому данный признак может быть оценён лишь у отдельных особей. У Bathylychnops и, по-видимому, у Ioichthys лучи и Р, и V сравнительно короткие; у Duolentops gen. nov. и у большинства видов Dolichopteryx (кроме D. anascopa и D. parini) V заметно длиннее Р, последние не заходят за основание V. У D. anascopa и D. parini лучи Р и V примерно одинаковой длины, концы Р заходят за вертикаль начала D. Наконец, у Dolichopteroides лучи Р значительно удлинены, намного длиннее лучей V, при заметно большей, чем у Dolichopteryx, удлинённости туловищного отдела заходят за основание А или даже за основание С (Roule, Angel, 1930; Beebe, 1933; Трунов, 1997). По пропорциям парных плавников Dolichopteroides резко выделяется среди прочих родов опистопроктид.
Положение D и V. Парин с соавторами (Parin et al., 2009) выделили род Dolichopteroides на основании сильно смещённых кзади V и большего антедорсального расстояния (более 75 против 70% SL или менее). Валидность этого рода на основании данных признаков впоследствии оспаривалась (Stewart, 2015). Действительно, с учётом заметной изменчивости взаиморасположения D и V у видов рода Dolichopteryx (начало V расположено у разных видов на расстоянии 3–9 миомеров от вертикали начала D) отличие Dolichopteroides от Dolichopteryx по этому признаку не кажется значительным. Кроме того, различия по величине антедорсального расстояния, приводимые Париным с соавторами (Parin et al., 2009), несостоятельны уже исходя из описаний видов в данной статье – у одного из паратипов D. andriashevi оно достигает 79.4% SL (Parin et al., 2009. P. 844). По моим наблюдениям и данным, опубликованным разными авторами (Cohen, 1964; Трунов, 1997; Fukui, Kitagawa, 2006a, 2006b; Fukui et al., 2008; Parin et al., 2009; Stewart, 2015; Mizusawa et al., 2015), никаких различий между Dolichopteroides и Dolichopteryx по относительной величине антедорсального расстояния (соответственно 78–82 и 70–82% SL) на уровне рода нет. Однако эти роды различаются взаиморасположением оснований D, A и V (у Dolichopteroides основания V и А хотя бы частично расположены под основанием D, чего никогда не наблюдается у Dolichopteryx (только основание А может частично быть под основанием D)). Кроме того, каудальное смещение D и V у Dolichopteroides коррелирует со значительно бóльшим, чем у любых видов Dolichopteryx, удлинением тела и увеличением числа позвонков (по этим признакам Dolichopteroides уступает только видам рода Bathylychnops). Поэтому эта особенность вполне обоснованно может считаться независимо возникающей специализацией рода Dolichopteroides.
Число краевых лучей С. У Ioichthys число краевых лучей С (5 или 6) меньше наблюдаемого у других представителей “длиннотелых” опистопроктид (7–14, менее 9 лучей отмечено только у Bathylychnops chilensis: Parin et al., 2009).
Неотения. Размеры половозрелых рыб у большинства родов “длиннотелых” опистопроктид, по-видимому, превышают 100 мм, хотя такие рыбы ловятся очень редко. Взрослые особи Dolichopteryx и Dolichopteroides достигают длины более 200 мм, Ioichthys – 232–253 мм, Bathylychnops – до 580 мм SL. Напротив, максимальные известные размеры видов Duolentops gen. nov. не превышают 66.2 мм SL, рыбы SL около 50 мм имеют зрелую икру (Fukui, Kitagawa, 2006a, 2006b). Внешний облик видов Duolentops gen. nov. сходен с таковым у особей Dolichopteryx постларвальных мальковых стадий, также у них сохраняется мальковая меланофорная пигментация (оба вида) и могут иметься перитонеальные пятна (D. minuscula). Очевидно, что виды Duolentops gen. nov. представляют собой неотенические формы.
Пигментация (рис. 1б, 4–7). До сих пор использованию особенностей пигментации для целей систематики опистопроктовых рыб уделялось недостаточно внимания. Для “длиннотелых” опистопроктид характерны существенные различия в пигментации ювенильных и взрослых форм. По моим наблюдениям, особенности ювенильной пигментации специфичны для каждого рода и часто могут быть использованы и для видовой диагностики.
Наименее специализированный по строению глаз род Ioichthys обладает, по-видимому, и ювенильной пигментацией, наиболее близкой к таковой у предполагаемого предка группы. У малька I. kashkini SL 66.3 мм (рис. 1б, 4а) меланофорная пигментация на голове распределена практически повсеместно, исключая участок в области подвеска в промежутке между передним краем орбиты и задним краем нижней челюсти (но её распределение в заглазничной части головы недостаточно выяснено из-за плохой сохранности здесь кожных покровов: рис. 1б). На туловище меланофоры вначале группируются по краям миомеров, а к середине его длины переходят на их поверхность, образуя широкую продольную полосу, на хвостовом стебле охватывающую всю его площадь (рис. 4б). Вентральная поверхность тела сплошь пигментирована крупными, густо расположенными меланофорами, имеются парные перитонеальные пятна между Р и анусом.
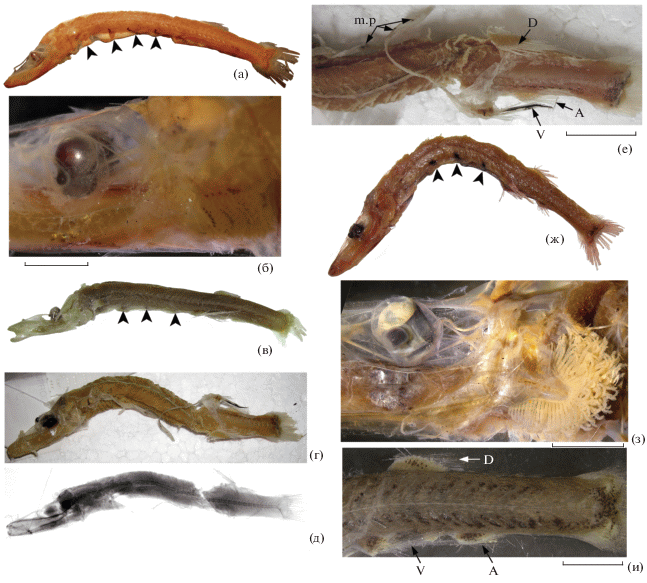
Рис. 4.
Особенности пигментации Ioichthys kashkini, паратип SL 66.3 мм (а, б); Dolichopteryx andriashevi, паратипы SL 41.4 (в, г, е, и) и 52.4 (д) мм; D. vityazi, экз. SL 51 (ж, м, н) и 31 (к, л) мм; D. trunovi, голотип SL ~80 мм (з): а – вентральная поверхность рыла; б, д–ж – задняя половина тела латерально; в, г – подглазничное скопление меланофоров (◀) в косом свете (показан серебристый отлив участка эпидермиса под глазом) (в) и в прямом свете (г); з – пигментное пятно в передней части желудка (◀), и – пигментация жаберных дуг; к–н – параректальная пигментация (к, м – вид сбоку; л, н – вид снизу); an – анус. Масштаб, мм: а – 10, б – 5; в, г, и, к, л – 1; д–ж – 4, з – 2; м, н – 1.5.
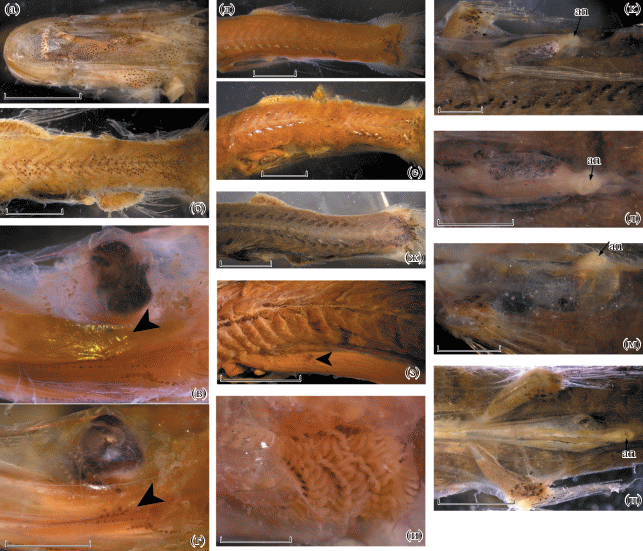
Имеющиеся описания ювенильных стадий Bathylychnops (Badcock, 1988; Parin et al., 2009) (собственным материалом я не располагаю) указывают на большое сходство в пигментации мальков у этого рода и Ioichthys, за исключением присутствия у Bathylychnops непарного дорсального ряда пигментных пятен, располагающихся по средней линии (Badcock, 1988. Fig. 1). Наличие дорсального ряда пятен, не отмеченных ни у каких других опистопроктид, по-видимому, представляет аутапоморфию Bathylychnops. У мальков Bathylychnops имеются парные перитонеальные пятна, а пигментация миомеров и миосепт, судя по рисунку Бэдкока (Badcock, 1988. Fig. 2), сходна с таковой у Ioichthys (распределение меланофоров на голове у мальков Bathylychnops в литературе не описано и не изображено).
У мальков Dolichopteryx меланофорная пигментация на голове образует небольшие чётко отграниченные участки (на дорсальной поверхности рыла, у верхней и нижней челюстей, на вентральной поверхности головы и под глазом). Её общая площадь гораздо меньше площади непигментированных участков. Следует отметить заплатковидное скопление меланофоров в подглазничной области, которое имеется, по-видимому, у молоди всех “длиннотелых” опистопроктид (неизвестно для Bathylychnops, но есть у Ioichthys) и, возможно, функционально связано с адаптациями зрения, так как только в этой области головы эпидермис имеет выраженный блестящий серебристый отлив (рис. 4в, 4г). Пигментация туловища у мальков Dolichopteryx (рис. 4д–4ж, 6и) имеет свои специфические особенности. Дорсальных пигментных пятен у мальков этого рода нет и, по-видимому, совершенно отсутствует пигментация дорсальной срединной миосепты, расположенной между затылком и основанием D (но во взрослом состоянии она имеет тёмную пигментацию у D. parini (рис. 1г), молодь которого не известна). На хвостовом стебле у основания С имеется более или менее оформленное базикаудальное скопление меланофоров, от которого вперёд выше и ниже срединно-боковой линии отходят дорсальная и вентральная пигментные полосы, состоящие из одного или нескольких рядов точечных меланофоров и/или оконтуренных меланофорной пигментацией интенсивно-серебристых пятнышек. Протяжённость и степень развития дорсальной и вентральной пигментных полос подвержены межвидовой изменчивости, иногда дорсальная полоса очень слабо выражена, но на хвостовом стебле имеется всегда. Наличие пятен серебристого пигмента в составе этих полос, вероятно, является аутапоморфией, но эти пятна выражены не у всех видов рода (рис. 7г). Меланофорная пигментация вентральной поверхности туловища развита у разных видов по-разному, перитонеальные пятна у разных видов имеются или отсутствуют, также могут иметься пигментные пятна на желудке и/или кишечнике (рис. 4з), число и расположение которых видоспецифично. Также диагностично наличие или отсутствие меланофорной пигментации на жаберных дугах (рис. 4и, 6б, 6з).
В литературе нередко встречаются указания на наличие у Dolichopteryx светящихся органов на брюхе. Ранее за них нередко принимали перитонеальные пятна (Parr, 1937) или инфракаринальные мыщцы и окружающие ткани вдоль срединно-брюшной линии (Beebe, 1932; Stein, Bond, 1985). Однако никаких бесспорных морфологических доказательств наличия светящегося органа или хотя бы присутствия бактерий в тяже по средне-вентральной линии до сих пор представлено не было (Stein, Bond, 1985). У голотипа D. andriashevi “на нижней поверхности брюха под кожей имеется крупное пятно молочно-белого цвета неправильной Г-образной формы” (Parin et al., 2009. P. 844. Fig. 5c), трактуемое как светящийся орган, однако у других особей этого вида оно не найдено. Тем не менее, основания предполагать возможность биолюминесценции особей хотя бы на отдельных онтогенетических стадиях всё же имеются. У всех изученных мною мальков Dolichopteryx SL 30–68.5 мм вокруг терминального отдела кишки сразу перед анусом имеется парная складка брюшины белесой окраски с выраженным серебристым отливом и густой меланофорной пигментацией, представленной очень мелкими черточковидными меланофорами. У одних рыб хроматоциты, по-видимому, зафиксированы более или менее расправленными, за счёт чего меланофорная пигментация выглядит сплошной (рис. 4к, 4л); у других они сократились, и меланофоры выглядят очень мелкими и разрозненными (рис. 4м, 4н), но чётко оформлено пигментное пятно у верхнезаднего конца складки (рис. 4м). Кишка в области этой складки явственно утолщена. У малька D. pseudolongipes SL 100 мм перитонеум интенсивно-чёрный, но его параректальный участок молочно-белого цвета, без меланорфорной пигментации (рис. 7б). С большой долей вероятности данная структура у молоди Dolichopteryx может быть связана с биолюминесценцией. У Duolentops gen. nov. и малька Ioichthys параректально расположены скопления меланофоров, но молочно-белой окраски брюшины не наблюдается (у мальков Bathylychnops этот признак не изучен). У взрослых рыб никаких следов этой структуры не обнаружено.
Рис. 5.
Пигментация каудального отдела тела Duolentops minuscula, экз. SL 30 мм (а) ((▶) – положение жирового плавника, прижатого к боковой поверхности тела и плохо различимого на фотографии) и строение пилорических придатков: б – Dolichopteryx parini, экз. SL 170 мм; в – Duolentops minuscula, экз. SL 30 мм; г – D. trunovi, голотип SL ~80 мм. Масштаб, мм: а – 1.5, б – 5; в, г – 1.
Сохранность имеющегося у меня малька Dolichopteroides не позволяет установить у него какие-либо особенности пигментации за исключением отсутствия меланофоров на жаберных дужках и дорсальной срединной миосепте. Мальки D. binocularis были описаны ранее (Roule, Angel, 1930; Beebe, 1933): у них имеется хорошо развитая полоса меланофоров ниже срединно-боковой линии, протягивающаяся от хвостового стебля почти до основания Р, и короткая полоса выше этой линии, вперёд лишь едва заходящая за конец основания D. У малька SL 58 мм, изображенного Рулем и Энжелом (Roule, Angel, 1930. Pl. IV, fig. 94 ), вентральная поверхность имеет густую точечную меланофорную пигментацию, но обособленных перитонеальных пятен нет. Однако они показаны на рисунке Биба (Beebe, 1933. Fig. 16 ) и описаны для D. binocularis Парром (Parr, 1937. P. 34), который приводит их как “five glandular luminous bodies in midventral series in advance of ventral fins” (пять железистых светящихся телец в срединно-брюшном ряду перед V). Возможно, такие разночтения обусловлены присутствием в составе Dolichopteroides более чем одного вида. В любом случае особенности пигментации D. binocularis полностью укладываются в пределы варьирования, известные для видов Dolichopteryx.
Во взрослом состоянии представители всех вышеперечисленных родов имеют, по-видимому, тёмную окраску. У коллекционных экземпляров кожные покровы, как правило, сорваны, и сохраняются только обрывки эпидермиса, имеющего тёмную окраску (Stein, Bond, 1985), или остатки темноокрашенных чешуйных карманов (Кобылянский, Федоров, 2001). У взрослых Ioichthys вся голова и чешуйные карманы чёрные, брюшная поверхность с серебристым отливом (Парин, 2004). У изученных мною экземпляров B. brachyrhynchus из вод Западной Африки и с хребта Наска наблюдаются некоторые различия в пигментации, возможно, связанные с тем, что экземпляр с хребта Наска имеет более крупные размеры (308 против 192 мм). У рыб из вод Западной Африки вся голова в сплошном меланофорном крапе, отдельные меланофоры более крупные и разрозненные на боковой и вентральной поверхности головы; кожа туловища с разлитой меланофорной пигментацией, представленной множественными очень мелкими буроватыми меланофорами. У экземпляра с хребта Наска вся дорсальная поверхность головы и боковые стороны рыла сплошь в разлитой буроватой пигментации, на вентральной поверхности меланофорной пигментации нет, но в абдоминальной области сохраняется разлитая подкожная меланофорная пигментация; кожа на туловище сорвана. Дорсальная срединная миосепта у экземпляра с хребта Наска с рассеянным меланофорным крапом, тогда как у рыб из вод Западной Африки меланофорная пигментация сливается в сплошную тёмно-бурую окраску. Лучи всех плавников у рыбы с хребта Наска не пигментированы, тогда как у экземпляра из вод Западной Африки точечные меланофоры есть на лучах всех плавников (неясно для Р, лучи которых обломаны до основания). Крупный экземпляр B. exilis полностью лишён кожи, на голове сплошная темная пигментация развита только на дорсальной поверхности рыла и вокруг глаз; лучи всех плавников не окрашены; срединная дорсальная миосепта не пигментирована. Общей чертой всех исследованных мною особей Bathylychnops является сплошная чёрная окраска ротожаберной полости и сплошная тёмная пигментация передней поверхности жаберных дуг (остальная часть жаберных дуг не пигментирована).
У двух исследованных мною особей Dolichopteroides с Китового хребта и из Индийского океана кожа полностью утрачена, но у экземпляра из Индийского океана сохранились её небольшие обрывки у оснований D и А (кожа чёрная). У обоих экземпляров в задней половине хвостового стебля присутствует разлитая точечная подкожная меланофорная пигментация, подразделённая на дорсальную и вентральную (выше и ниже миокоммы), а более крупные и разрозненные подкожные меланофоры – в основаниях вертикальных плавников (в области их птеригиофоров). На голове резко выделяется чёрная окраска вершины рыла (вокруг рта). Ротожаберная полость чёрная, точечная меланофорная пигментация имеется на жаберных дугах в основаниях жаберных тычинок. Две мои рыбы резко различаются между собой пигментацией дорсальной срединной миосепты, которая не окрашена у экземпляра с Китового хребта, но сплошь пигментирована у рыбы из Индийского океана. Кроме того, у рыбы с Китового хребта лучи всех плавников не окрашены, а у рыбы из Индийского океана лучи V затемнены. Эти различия в пигментации, возможно, свидетельствуют в поддержку предположения о сборной природе вида D. binocularis в его нынешнем понимании (Parin et al., 2009).
К сожалению, я располагаю единственным экземпляром взрослого Dolichopteryx, принадлежащим к виду D. parini, который, по-видимому, существенно отличается по окраске от других видов рода. Для него характерна чёрная окраска парных плавников. По аналогии с ситуацией, наблюдаемой в других группах мезопелагических рыб, следует ожидать, что пигментация плавников формируется уже на ранних постларвальных стадиях и сохраняется у взрослых рыб. Среди других видов Dolichopteryx чёрная окраска V отмечена еще только для D. pseudolongipes и D. nigripes sp. nov. (известных только по молоди), у всех прочих видов рода все плавники не окрашены. Имеющиеся в литературе описания (Beebe, 1933; Parr, 1937; Cohen, 1964; Fukui, Kitagawa, 2006a, 2006b; Fukui et al., 2008; Parin et al., 2009; Mizusawa et al., 2015), по-видимому, относятся только к мальковым стадиям. Хотя Коэн (Cohen, 1964. Р. 58) указывает, что наибольший из имеющихся в его распоряжении экземпляров D. longipes “между 85 и 95 мм SL” имел “хорошо развитую” икру, приводимое им описание пигментации D. longipes соответствует ювенильным особям этого вида. Поэтому оценить пределы внутри- и межвидовой изменчивости в пигментации взрослых Dolichopteryx в настоящее время не представляется возможным. Нельзя исключать, что такие черты D. parini, как сплошь пигментированная дорсальная срединная миосепта, светлая ротовая полость и относительно слабая пигментация жаберной полости (испод жаберной крышки с тёмной меланофорной пигментацией), являются видовой особенностью.
У всех представителей “длиннотелых” опистопроктид перитонеум во взрослом состоянии интенсивно-чёрный и просвечивает через стенку брюшной полости по средне-вентральной линии. Наружная поверхность перитонеума имеет выраженный радужно-серебристый отлив. Вдоль средневентральной линии под кожей от истмуса до А протягиваются тонкие парные тяжи молочно-белого цвета (при жизни заключенные в прозрачный студенистый чехол (Stein, Bond, 1985), который у изученных мною рыб растворился), представляющие собой инфракаринальные мышцы (рис. 5б). Штейн и Бонд (Stein, Bond, 1985) не исключают способности этих структур к биолюминесценции.
Отдельно следует остановиться на особенностях пигментации представителей рода Duolentops gen. nov., известных по экземплярам SL 28.0–66.2 мм (Fukui, Kitagawa, 2006a, 2006b; Parin et al., 2009). Эти рыбы половозрелы при SL около 5–6 см (Fukui, Kitagawa, 2006a, 2006b), но наименьшие экземпляры, указанные в работе Парина с соавторами (Parin et al., 2009), возможно, ещё не достигли половой зрелости (состояние гонад исследованного мною экземпляра D. minuscula SL 30 мм не было установлено из-за его плохой сохранности и риска разрушения). Однако пигментация экземпляра Duolentops rostrata SL 35.8 мм при всей схематичности рисунка (Parin et al., 2009. Fig. 3) соответствует пигментации голотипа этого вида SL 66.2 мм (Fukui, Kitagawa, 2006a. Fig. 1). В отличие от всех прочих родов, пигментация видов Duolentops gen. nov. во взрослом состоянии сохраняет ювенильные черты, что обусловлено неотенической природой этих видов. Общий характер пигментации головы и туловища Duolentops gen. nov. во многом сходен с таковым у особей Dolichopteryx постларвальных стадий развития, однако на хвостовом стебле вместо базикаудального скопления пигмента с отходящими от него дорсальной и вентральной пигментными полосами, которые состоят из точечных меланофоров и пятнышек серебристой ткани, окаймлённых меланофорной пигментацией, наблюдается разлитая меланофорная пигментация, занимающая всю или бóльшую часть площади хвостового стебля и сочетающаяся с выраженным серебристым отливом отдельных участков эпидермиса (вместо мелких, чётко отграниченных блестящих пятнышек) (рис. 5а). Далее вперёд почти до основания Р протягиваются дорсальная и вентральная пигментные полосы (в работе Парина с соавторами (Parin et al., 2009. Fig. 3) для D. rostrata SL 35.8 мм показана только вентральная полоса), помимо которых на туловище могут иметься отдельные звёздчатые меланофоры. У изученного мною экземпляра D. minuscula SL 30 мм эти полосы состоят из отдельных точечных меланофоров, а эпидермис по ходу этих полос имеет участки серебристого отлива, но нет обособленных или сливающихся в полоску пятнышек серебристого пигмента. Перитонеальные пятна имеются (D. minuscula) или отсутствуют (D. rostrata), дорсальный ряд пятен и пигментация дорсальной срединной миосепты отсутствуют. Пятновидное скопление меланофоров под глазом у Duolentops gen. nov. в отличие от Dolichopteryx более или менее протягивается вперёд от вертикали переднего края орбиты. Это может быть диагностичной особенностью, но нужно заметить, что у D. minuscula степень выраженности этого скопления подвержена заметной индивидуальной изменчивости. Ранее наличие “полосы под глазом” как черты сходства с видами Duolentops gen. nov. постулировалось для D. parini (Fukui, Kitagawa, 2006a, 2006b; Parin et al., 2009), однако у Duolentops gen. nov. эта полоса представляет собой особенность ювенильной пигментации, утрачиваемой во взрослом состоянии (ювенильные экземпляры D. parini не известны). У взрослых особей D. parini на боковых сторонах рыла действительно развита разлитая буроватая меланофорная пигментация (такая же, как и на дорсальной поверхности рыла), но она не гомологична подглазничному скоплению меланофоров у ювенильных особей Dolichopteryx и Duolentops gen. nov.
Характеризуя различия в ювенильной пигментации “длиннотелых” опистопроктид с филогенетических позиций, можно предположить, что пигментация Ioichthys наиболее близка к таковой у предполагаемой предковой формы, и из неё могут быть выведены все остальные варианты. У Bathylychnops как апоморфия формируется дорсальный ряд пигментных пятен, очевидно, путем концентрации рассеянной меланофорной пигментации срединной дорсальной миосепты, наблюдаемой у Ioichthys. Напротив, у Dolichopteryx, Duolentops gen. nov. и, вероятно, Dolichopteroides такая пигментация утрачивается, но взамен более или менее рассеянной меланофорной пигментации миомеров формируются дорсальная и вентральная пигментные полосы, в состав которых (по крайней мере, у Dolichopteryx) помимо собственно меланофоров входят пятнышки ярко-серебристого пигмента, наличие которых, вероятно, является апоморфией. Положение Duolentops gen. nov. на основании особенностей пигментации не вполне понятно. Специфические черты пигментации этого рода можно рассматривать как морфологически промежуточное состояние между наблюдаемым у мальков Ioichthys и Dolichopteryx. Однако нельзя исключать, что пигментация Duolentops gen. nov. соответствует промежуточному состоянию между ювенильной и взрослой пигментацией Dolichopteryx. Подобные рыбы в моём материале отсутствуют, а в литературе специально не описаны. Поэтому в качестве аутапоморфной черты в пигментации Duolentops gen. nov. в настоящее время можно предполагать лишь лучшее развитие у видов этого рода подглазничного скопления меланофоров, более или менее заходящего на боковую поверхность рыла. Однако филогенетическая релевантность этого признака, учитывая его меж- и внутривидовую изменчивость, очевидно, очень невысока.
Во взрослом состоянии пигментация всех представителей “длиннотелых” опистопроктид (исключая неотенический род Duolentops gen. nov.) сходная, диагностическое значение (по-видимому, только на видовом уровне) могут иметь различия в пигментации ротожаберной полости, плавников и, возможно, срединной дорсальной миосепты и жаберных дуг.
Пилорические придатки у опистопроктовых рыб числом 3–6, короткие и толстые. У большинства таксонов они примерно одинаковой величины, расположены в ряд и ориентированы в одном направлении (рис. 5б). Исключение представляет Duolentops gen. nov., имеющий разноразмерные придатки (рис. 5в), и D. trunovi, у которого один из придатков направлен в противоположную сторону (рис. 5г). Вероятно, эти отклонения от общего плана строения следует считать апоморфиями данных таксонов.
Подытоживая сказанное, можно отметить, что по проанализированным признакам наиболее генерализованным родом представляется Ioichthys, наиболее близкий к предполагаемой предковой форме по строению глаз и признакам ювенильной пигментации. Однако этот род уже демонстрирует некоторые черты специализации относительно других родов “длиннотелых” опистопроктид (утрата сошникового озубления, редукция числа краевых лучей С, некоторое удлинение тела). Bathylychnops, по-видимому, представляет собой рано обособившуюся независимую линию развития, характеризующуюся максимальным удлинением тела, наличием у ювенильных стадий дорсальных пигментных пятен и исключительным развитием дополнительных структур глаза при сохранении примитивного пузыревидного строения глазного яблока. Нельзя исключить возможность сестринских отношений Ioichthys и Bathylychnops. Другую линию развития представляет Dolichopteryx, характеризующийся сравнительно небольшим числом позвонков, специфической ювенильной пигментацией, которая включает участки ярко-серебристой ткани, телескопическими глазами и хорошо развитым шаровидным телом, но лишённый корнеальных склеротизаций. Неотенический Duolentops gen. nov. по признакам пигментации более сходен с молодью Dolichopteryx, чем с любым другим родом, но более примитивен по строению глазного яблока (пузыревидное) и шаровидного тела (слабо обособлено); уникальными чертами данного рода является развитие субсклеральных линзовидных структур (рис. 1в) и специфическое строение наружного ряда тычинок первой жаберной дуги (рис. 3). Doli-chopteroides близок к Dolichopteryx, отличаясь от представителей последнего рода бóльшим удлинением туловищного отдела, сближенным положением оснований D, V и А и сильно удлинёнными Р. Более детальное изучение морфологии “длиннотелых” опистопроктид, включая остеологию и миологию, в настоящее время невозможное из-за ограниченности и недостаточной сохранности доступного мне материала, вероятно, позволит существенно скорректировать высказанные здесь предположения.
Ioichthys Parin, 2004
Типовой вид – Ioichthys kashkini Parin, 2004.
Диагноз. Рыбы с умеренно удлинённым телом, позвонков 53–58. Глаза пузыревидные, с выраженной афокальной зоной перед хрусталиком (рис. 1а); роговица с двумя выростами бобовидной формы (задний едва намечен у молоди), без участков склеротизации. Сошник без зубов. Жаберные тычинки в два ряда на epi- и ceratobranchiale первой дуги; в наружном ряду удлинённые у молоди и короткие у взрослых рыб, не гипертрофированы; во внутреннем ряду хорошо развиты. V прикрепляются впереди вертикали начала D; антедорсальное расстояние составляет 70.9–72.5% SL; начало А расположено позади вертикали конца D. Краевых лучей С 5–6. Малёк SL 66.3 мм с перитонеальными, но без дорсальных пигментных пятен, с рассеянной меланофорной пигментацией сначала вдоль границ миомеров, а в задней половине тела – по всей поверхности; у взрослых рыб кожа и перитонеум чёрные. Максимальная известная SL ~ 253 мм.
Состав и распространение. В составе рода описан единственный вид из тропической зоны Индийского океана (Парин, 2004). К этому же роду должен быть отнесён малёк из вод Калифорнии, указанный Мозером (Moser, 1996) как B. brachyrhynchus (Parin et al., 2009), и два взрослых экземпляра, пойманных в водах Перу и описанных как Opisthoproctidae gen. et sp. indet. (Shinohara, 2009). Бóльшее число позвонков у восточнотихоокеанских рыб по сравнению с экземплярами типовой серии I. kashkini (56–58 против 53–55) позволяет предполагать, что они принадлежат к отдельному виду.
Ioichthys kashkini Parin, 2004
Ioichthys kashkini: Парин, 2004. С. 438. Рисунок (первоописание); Parin et al., 2009. P. 841. Fig. 2 (дополнение к описанию паратипа).
Материал. ИО РАН № 2565, паратип SL 66.3 мм, 12°00′ с.ш. 64°58′ в.д., НИС “Витязь”, рейс 40, буй С, ХКС-180, 4075–0 м, проба № 133, 24.03.1967 г. Голотип этого вида (ЗИН № 53071, взрослый экз. SL 232 мм) был кратко обследован мною в 2005 г. во время передачи его в ЗИН РАН по просьбе Н.В. Парина.
Описание. Вид достаточно подробно охарактеризован в первоописании, поэтому здесь приводится только описание пигментации малька SL 66.3 мм, для которого ранее было указано лишь наличие и число перитонеальных пятен (Parin et al., 2009).
Верхняя и верхнебоковые стороны рыла испещрены разноразмерными разреженными меланофорами, сгущающимися перед орбитой; поверхность frontalia между и позади орбит также покрыта многочисленными, но разрозненными меланофорами; менингеальная пигментация представлена редкими разноразмерными меланофорами. Верхняя челюсть густо пигментирована сливающимися в сплошную полоску коричневатыми меланофорами. Под глазом расположено обширное скопление довольно крупных разрозненных меланофоров, переходящее на нижнюю поверхность головы (рис. 1б, 4а); эпидермис под глазом с выраженным серебристым отливом; боковая сторона рыла между задним краем нижней челюсти и вертикалью переднего края орбиты, по-видимому, без меланофорной пигментации. В заглазничной части головы меланофорная пигментация прослеживается, но из-за того, что кожа здесь большей частью сорвана, её распределение не выяснено (есть точечные меланофоры вдоль заднего края орбиты). Имеются редкие точечные меланофоры на жаберных дужках в основании жаберных лепестков. Нижняя поверхность головы в густой меланофорной пигментации, наиболее развитой в гулярной области, очень мелкой у симфизного края нижней челюсти (рис. 4а), сильно разреженной на бранхиостегальной мембране. Вентральная поверхность тела от истмуса до начала А в сплошной густой меланофорной пигментации, отдельные меланофоры здесь большей частью крупные, никогда не сливающиеся. В промежутке между основаниями Р и V расположены три пары тёмных перитонеальных пятен, еще одна пара имеется непосредственно между основаниями V и две пары – в промежутке между V и А. На боках тела имеются отдельные меланофоры, группирующиеся по ходу границ между миомерами и вдоль срединной миокоммы. К середине туловища (перед началом V) они становятся более многочисленными и переходят на поверхность миомеров, образуя срединную продольную полосу, а на хвостовом стебле сплошь покрывают его поверхность (рис. 4б). Имеется вертикальная полоска из разрозненных меланофоров по ходу cleithrum. В основаниях Р, D и А развиты скопления буроватых меланофоров; лучи всех плавников не пигментированы. Дорсальная срединная миосепта между затылком и D покрыта меланофорами, сливающимися по её верхнему краю в продольную полоску; по направлению к позвоночнику пигментация миосепты становится равномерно буроватой.
Bathylychnops Cohen, 1958
Типовой вид – Bathylychnops exilis Cohen, 1958.
Диагноз. Рыбы с сильно удлинённым телом; позвонков 67–85. Глаза пузыревидные; передний вырост роговицы образует крупное обособленное шаровидное тело со сферическим дополнительным хрусталиком; в нижней и задней частях глазного яблока позади шаровидного тела имеются ещё две корнеальные линзы (не развиты у молоди) (рис. 1и). Хрусталик эксцентрический (глаз полутелескопический); афокальное пространство отсутствует. Сошник с одним рядом зубов. Жаберные тычинки тонкие, ресницевидные, в два ряда на epi- и ceratobranchiale первой дуги, в наружном ряду не гипертрофированы, во внутреннем – хорошо развиты. V прикрепляются впереди вертикали начала D; антедорсальное расстояние составляет 72.4–76.6(80.2)% SL; начало А расположено позади вертикали конца D. Краевых лучей С 7–12. Постларвальная пигментация представлена непарным срединным дорсальным рядом пигментных пятен и парными перитонеальными пятнами вдоль средневентральной линии; параллельные пигментные полосы на боках тела, состоящие из меланофоров и пятнышек серебристой ткани, отсутствуют (Cohen, 1960; Badcock, 1988; Parin et al., 2009); взрослые рыбы с однотонно-тёмной пигментацией кожных покровов, перитонеум чёрный; SL до 580 мм (Парин и др., 1995).
Состав и распространение. Три вида – помимо типового, B. brachyrhynchus (Parr, 1937) и B. chilensis Parin, Belyanina et Evseenko, 2009. B. exilis известен из переходных вод северной части Тихого океана (Stein, Bond, 1985; Fujii, 1985; Парин и др., 1995; Aizawa, 2002), указания на нахождение этого вида в Атлантике (Harrisson, 1967; Aizawa, 2002; Parin et al., 2009) относятся к B. brachyrhynchus (Badcock, 1988). Последний, по-видимому, имеет широкотропический ареал во всех океанах (Badcock, 1988; Parin et al., 2009). B. chilensis известен только из юго-восточной части Тихого океана под 33°–34° ю.ш. (Parin et al., 2009).
Замечания. Парин с соавторами (Parin et al., 2009) приводят в качестве отличий B. chilensis от B. exilis число лучей D и A (соответственно 12–13 и 11–12 против 14–16 и 13–14). У изученного мною экземпляра B. exilis D 13, A 12. По данным Штейна и Бонда (Stein, Bond, 1985), число лучей D и А у B. exilis составляет соответственно 13–16 (в среднем 14, n = 16) и 10–14 (в среднем 12, n = 15). Таким образом, оснований для различения видов по числу лучей в вертикальных плавниках нет.
Материал. B. exilis, 1 экз. SL 420 мм, 47°09′ с.ш. 153°52′ в.д., глубина 420–460 м, НПС “Млечный путь”, трал № 61, 17.03.1990 г. B. brachyrhynchus, 1 экз., SL 308 мм, хребет Наска, НПС “Профессор Месяцев”, рейс 13, трал 94, 10.11.1983 г., сборщик А.Н. Котляр; 2 экз., SL 192 мм (длина головы 40 мм) и отчленённая голова длиной 33 мм, Западная Африка, НИС “Профессор Водяницкий”, рейс 5, трал № 11.
Duolentops Prokofiev, gen. nov.
Типовой вид – Dolichopteryx minuscula Fukui et Kitagawa, 2006.
Диагноз. Рыбы с относительно коротким телом и высоким хвостовым стеблем; позвонков 40–46. Глаза пузыревидные; передний вырост роговицы бобовидной формы, вытянут вдоль переднего края хрусталика и расширен вентрально, со светлым (склеротизированным?) утолщением в нижней части; перед хрусталиком имеется афокальная зона (рис. 1в); задний вырост роговицы не развит. В нижней части глазного яблока под хрусталиком имеется крупное линзовидное образование, макроскопически отграниченное от оболочек глаза (рис. 1в). Сошник с несколькими рядами зубов. Жаберные тычинки на первой дуге утолщённые, пальцевидные, в наружном ряду сильно гипертрофированы; две верхние тычинки наружного ряда прикреплены медиальнее линии, соединяющей основания последующих тычинок на ceratobranchiale-1, и наклонены вниз параллельно продольной оси ceratobranchiale-1, лежа позади наружного ряда цератобранхиальных тычинок (рис. 3). Тычинки внутреннего ряда хорошо развиты. V прикрепляются заметно впереди вертикали начала D; антедорсальное расстояние составляет 72.3–83.2% SL; начало А расположено позади вертикали конца D, реже на одной вертикали. Длина хвостового стебля равна его высоте. Краевых лучей С 9–11. Хвостовой стебель с разлитой меланофорной пигментацией и рефлектирующими участками серебристой ткани; точечные ряды меланофоров протягиваются вперед выше и ниже миокоммы; участок меланофорной пигментации под глазом в большей или меньшей степени продолжается вперед по боковым сторонам рыла; перитонеальные пятна имеются или отсутствуют. Карликовые неотенические формы, максимальная известная SL 66.2 мм.
Этимология. Название рода образовано от латинских слов “duo” (двойной), “lens” (чечевица, в современной морфологической терминологии – хрусталик) и “ops” (глаз) и отражает характерный признак рода – наличие линзовидного субсклерального утолщения под хрусталиком глаза.
Состав и распространение. Кроме типового вида из Индо-Вест-Пацифики к новому роду следует отнести атлантический вид Dolichopteryx rostrata Fukui et Kitagawa, 2006. Я не имел возможности непосредственно изучить экземпляры данного вида, однако такие его признаки, отмеченные в тексте первоописания и/или отображённые на оригинальном рисунке (Fukui, Kitagawa, 2006b. Fig. 1), как пузыревидные глаза с линзовидной структурой под хрусталиком, карликовые размеры голотипа, имеющего зрелые икринки (SL 66.2 мм), и характерная пигментация хвостовой части тела, позволяют отнести этот вид к описываемому роду.
Duolentops minuscula (Fukui et Kitagawa, 2006)
Dolichopteryx minuscula: Fukui, Kitagawa, 2006a. P. 114. Figs. 1–3 (первоописание).
Dolichopteryx sp. cf. longipes: Прокофьев, 2014. С. 379.
Материал. 1 экз. SL 30 мм, 23°34′ с.ш. 128°35′ в.д., НИС “Витязь”, рейс 57, ст. 7175, РТАК № 11, проба 21, горизонт лова 500 м, длина троса 1600 м, время лова 22.00–23.05, 08.02.1975 г.
Описание. D 10, A 8, P 12, V 9, C x + 10 + 9 + x; r. br 2, sp. br 0 + 14 (1 + 1 + 0) (две верхние тычинки смещены медиально и образуют дополнительный ряд кнутри от наружного ряда цератобранхиальных тычинок (рис. 3)), тычинок во внутреннем ряду на первой дуге 4 + 1 + 11 = 26; миомеров около 45; p. c 3, из них средний придаток значительно меньше краевых (рис. 5в). Концы Р и V обломаны. Между вертикалями начал V и D 9 миомеров. Начало А расположено позади конца D. Жировой плавник имеется, расположен над концом А.
Некоторые измерения, в % SL: длина головы 27.1, максимальная и минимальная высота тела соответственно 11.9 и 10.2, длина хвостового стебля 10.2; антедорсальное, антевентральное и антеанальное расстояния соответственно 74.6, 59.3 и 84.75; длина рыла 11.2, горизонтальный диаметр глазного яблока 3.7, длина линзовидного образования под хрусталиком 2.5, горизонтальная длина костной орбиты 5.9, длина нижней челюсти 5.9.
Пигментация. Ранее экземпляр был подкрашен ализариновым красным S, из-за чего поверхностная пигментация в настоящее время плохо различима, однако сохраняются следы продольных тёмных полос на дорсальной и боковой поверхностях рыла. Дорсальная поверхность вершины рыла с единичными субдермальными меланофорами. Непосредственно под глазом имеется продольный ряд довольно крупных субдермальных меланофоров, подлегающих под поверхностной пигментацией, ниже которого располагается ряд таких же меланофоров, протягивающийся вперед до квадратно-нижнечелюстного сочленения; ещё один короткий ряд субдермальных меланофоров расположен перед лучами бранхиостегальной перепонки. Эпидермис под орбитой имеет интенсивный серебристо-радужный отлив. Менингеальная пигментация представлена разрозненными довольно крупными меланофорами. Жаберные дуги не пигментированы. В основаниях парных и вертикальных плавников единичные точечные меланофоры. Хвостовой стебель несёт разлитую поверхностную буроватую пигментацию и отдельные разрозненные точечные меланофоры; эпидермис на боках тела в области оснований вертикальных плавников и на хвостовом стебле с выраженным серебристым отливом (рис. 5а), далее вперед ниже миокоммы и до основания Р тянется продольная серебристая полоска, окаймлённая буроватыми меланофорами. Вентральная поверхность в разрозненных точечных меланофорах, с четырьмя полосковидными перитонеальными пятнами в промежутке между основаниями Р и V и с пятым пятном, расположенным по обеим сторонам от ануса. Срединная дорсальная миосепта между затылком и D и лучи всех плавников не пигментированы.
Замечания. Ранее описанный экземпляр упоминался мною (Прокофьев, 2014) как форма комплекса “D. longipes” на основании сходных значений меристических признаков и предполагавшегося отсутствия у данного экземпляра жирового плавника, хотя были отмечены нетелескопические глаза и необычная формула жаберных тычинок в наружном ряду на первой дуге, исключающие отождествление данного экземпляра с D. longipes. Однако в действительности жировой плавник у этого экземпляра имеется, но он примят и подсох к верхнему краю хвостового стебля, из-за чего обнаруживается с трудом (рис. 5а). По всем доступным для сравнения признакам описанный экземпляр полностью соответствует первоописанию D. minuscula, за исключением строения первой жаберной дуги. В первоописании (Fukui, Kitagawa, 2006a) для этого вида указано 5–6 + 1 + 10–11 тычинок в наружном ряду на первой дуге и не упомянуто о каком-либо своеобразии в их строении. Поскольку другие признаки, характеризующие D. minuscula, также достаточно своеобразны, а существование в том же районе ещё одного вида, отличающегося только строением первой жаберной дуги, представляется несерьёзным, я полагаю, что вероятнее всего Фукуи и Китагава (Fukui, Kitagawa, 2006a, 2006b) ошибочно указали в качестве наружных тычинки внутреннего ряда, число которых у изученного мною экземпляра соответствует приводимому цитируемыми авторами.
Описанный экземпляр является четвёртым нахождением этого редкого вида, ранее известного только по трём экземплярам типовой серии (Fukui, Kitagawa, 2006a; Parin et al., 2009), пойманным в тихоокеанских водах Японии между 29° и 39° с.ш. и 143°–150° в.д. и в Индийском океане к югу от о. Св. Маврикия. Место лова моего экземпляра, происходящего из вод между о-вами Рюкю и Филиппинами, лежит в пределах предполагаемого ареала вида.
Dolichopteroides Parin, Belyanina et Evseenko, 2009
Типовой вид – Dolichopteryx binocularis Beebe, 1932.
Диагноз. Рыбы с заметно удлинённым телом; позвонков 58–60. Глаза бокаловидные, телескопические; указывается наличие дополнительного хрусталика (Parin et al., 2009), другие корнеальные склеротизации, по-видимому, отсутствуют. Сошник с многорядными зубами. Жаберные тычинки короткие, уплощённые, язычковидные на всех возрастных стадиях; в два ряда на epi- и ceratobranchiale первой дуги, в наружном ряду не гипертрофированы, во внутреннем сильно редуцированы. Лучи Р сильно удлинены, заходят за конец основания А. D, V и A сильно смещены каудально, антедорсальное расстояние составляет 78.2–82.0% SL; V прикрепляются близ вертикали начала D или позади неё; начало А расположено под серединой–задней третью основания D. Краевых лучей С 11–13. Постларвальная пигментация представлена двумя пигментными полосами, протягивающимися вперед от основания С выше и ниже миокоммы, из них верхняя полоса очень короткая, нижняя – протяжённая, имеются перитонеальные пятна; взрослые рыбы, по-видимому, однотонно-тёмной окраски, перитонеум чёрный. Максимальная известная SL 266 мм (Stewart, 2015).
Состав и распространение. Монотипический род с циркумглобальным широкотропическим ареалом; Парин с соавторами (Parin et al., 2009) не исключают сборной природы единственного известного вида.
Материал. ИО РАН б/№ – 1 экз. SL 233 мм, Китовый хребет, 36°21′ ю.ш. 07°38′ з.д., глубина 1150–1200 м, НПС “Эврика”, трал № 17, 14.10.1975 г., сборщик И.А. Трунова; 1 экз. SL 210 мм, 01°12′ с.ш. 56°28′ в.д., НИС “Рифт”, ст. 27, донный трал, глубина места 800–810 м, горизонт лова – дно, время лова 07.25–07.57, проба № 40, 06.03.1983 г.; ЗММУ № 22700 – 1 экз. SL 55 мм (центральная Восточная Атлантика, 00°35′ с.ш. 07°02′ в.д., глубина 340–350 м, НПС “Фиолент”, рейс ФАО-1, трал № 11, 05.01.1976 г.
Dolichopteryx Brauer, 1901
Типовой вид – Dolichopteryx anascopa Brauer, 1901.
Диагноз. Рыбы с умеренно удлинённым телом; позвонков 41–48. Глаза бокаловидные, телескопические; передний вырост роговицы образует хорошо обособленное шаровидное тело без дополнительного хрусталика, задний вырост расположен под передним; дополнительных корнеальных линз нет (рис. 1г–1ж). Сошник с многорядными зубами. Жаберные тычинки уплощённые, у молоди удлинённые и более расставленные, у взрослых рыб короткие, язычковидные, в два ряда на epi- и ceratobranchiale первой дуги, в наружном ряду не гипертрофированы (рис. 2в–2е). V прикрепляются впереди вертикали начала D (на 3–9 миомеров); антедорсальное расстояние составляет 70.6–82.1% SL (обычно 72–77%); начало А расположено под концом D или позади него. Краевых лучей С 9–14. Постларвальная пигментация представлена двумя пигментными полосами, протягивающимися вперёд от основания С выше и ниже миокоммы (рис. 4д–4ж); перитонеальные пятна имеются или отсутствуют, могут присутствовать участки пигментации на желудке и/или кишечнике; дорсальные пигментные пятна отсутствуют. Взрослые рыбы с тёмно-пигментированными чешуйными карманами, перитонеум чёрный, также может быть пигментирована срединная дорсальная миосепта между затылком и D. Максимальная известная SL 217 мм (D. parini: Mecklenburg et al., 2002).
Состав и распространение. В составе рода описано восемь видов, один из которых известен из Атлантического океана (D. longipes (Vaillant, 1888)), два – из Индо-Вест-Пацифики (D. anascopa Brauer, 1901 и D. vityazi Parin, Belyanina et Evseenko, 2009) и четыре – только из Тихого океана (D. andriashevi Parin, Belyanina et Evseenko, 2009, D. nigripes Prokofiev, sp. nov., D. parini Kobyliansky et Fedorov, 2001; D. pseudolongipes Fukui, Kitagawa et Parin, 2008); D. trunovi Parin, 2005, по-видимому, имеет циркумглобальный ареал в умеренно-высоких водах Южного полушария (между 41° и 53° ю.ш.) (Парин, 2005); по меньшей мере ещё один неописанный вид известен из зоны Калифорнийского течения в Восточной Пацифике (Moser, 1996; Parin et al., 2009). Все виды известны по единичным находкам, в связи с чем границы их ареалов не могут быть установлены. Большинство видов (кроме D. parini и D. trunovi) связано с тропическими и субтропическими водами; ареал D. parini, по-видимому, приурочен к переходной зоне северотихоокеанских вод.
Замечания. D. anascopa и D. parini заметно отличаются от других видов рода сильно удлинёнными Р, заходящими за начало D, более передним положением А (под серединой основания D, тогда как у других видов – под его концом или чаще позади него) и наличием участка молочно-белой ткани у нижнего края глаза. Необходимы более детальные морфологические исследования для выяснения родственных отношений указанных видов и степени их таксономической обособленности от других представителей рода.
(рис. 6а)
Рис. 6.
Dolichopteryx andriashevi, паратип SL 41.4 мм (а, б); D. longipes, голотип SL 46 мм (в); D. nigripes sp. nov., голотип SL 120 мм (г–е) и D. vityazi, голотип SL 61 мм (ж) и экз. SL 51 мм (з, и): а, в, г, ж – общий вид, латерально; б, з – ориентация глаз; д – рентгенограмма; е, и – пигментация плавников и боков тела в его задней половине, вид сбоку; (▶) – положение перитонеальных пятен в промежутке P–V; D, A, V – соответственно спинной, анальный и брюшной плавники; m.p – остатки перитонеальных пятен. Масштаб, мм: б, з – 1; е – 14, и – 3.5.
Dolichopteryx andriashevi: Parin et al., 2009. P. 843. Fig. 5 (первоописание).
Dolichopteryx cf. longipes № 2: Parin et al., 2009. P. 845. Fig. 6.
Материал. Помимо пяти оригинальных экземпляров, перечисленных в работе Парина с соавторами (Parin et al., 2009. P. 843, 845), изучен 1 экз. SL 37 мм, 01°07′ с.ш. 187°00 в.д., НИС “Витязь”, рейс 26, ст. 3798, глубина места 5620–5600 м, ХКС-160, 1000–0 м (угол 65°, трос 2100 м), время лова 08.50–11.10, проба № 86, 30.11.1957 г.
В первоописании Парин с соавторами (Parin et al., 2009. P. 843) формально обозначили только голотип (ЗММУ № 22214 SL 56.5 мм, ст. 4490). Статус трёх других рыб из сборов НИС “Витязь” (ст. 3721, SL 52.4 мм; ст. 4490, SL 41.4 мм; ст. 5040, SL 68.5 мм) в первоописании прямо не указан. Диагноз нового вида был составлен по всем 4 экз., таким образом, их всех следует включать в типовую серию, что в устном сообщении подтвердил один из авторов вида (С.А. Евсеенко). Экземпляр SL 39.5 мм со ст. 3835, описанный в работе Парина с соавторами (Parin et al., 2009. P. 845) как D. cf. longipes № 2, не является типовым.
Описание. D 10–12, A 8–10, P 12–13, V 9, C x–xii + 10 + 9 + x–xii; r. br 2, sp. br 5–10 + 14–18 = = 20–25; позвонков (миомеров) 45–47; p. c 5–6 (расположены в ряд). Глаза телескопические, направлены вертикально вверх (рис. 6б). Р явственно короче V, у мальков SL ~ 50 мм концы лучей P лишь едва заходят за первую пару перитонеальных пятен в промежутке Р–V; концы лучей V достигают или почти достигают основания С. Между вертикалями начал V и D три–четыре миомера. Начало А расположено под концом D. Жирового плавника нет.
Некоторые измерения, в % SL: длина головы 24.8–29.6, максимальная и минимальная высота тела соответственно 7.6–10.3 и 6.1–7.1, длина хвостового стебля (9.5)12.0–13.1; антедорсальное, антевентральное и антеанальное расстояния соответственно 73.6–79.4, 66.3–69.5 и 78.1–84.5; длина рыла 10.6–14.5, горизонтальный диаметр глазного яблока 3.3–3.9, горизонтальная длина костной орбиты 6.3–7.6(9.5), длина нижней челюсти 5.1–6.7(7.7).
Пигментация. По верхнему краю рыла от вершины к орбитам, немного не доходя до последних, протягивается широкая продольная полоса, состоящая из мелких коричневатых меланофоров. У симфизного конца нижней челюсти с каждой стороны полосковидное скопление меланофоров. Имеется продольный ряд (шириной в один меланофор) меланофоров от квадратно-нижнечелюстного сочленения к узкому заплатковидному скоплению меланофоров непосредственно под глазом и короткая полоска из более крупных меланофоров перед лучами бранхиостегальной перепонки. Эпидермис под орбитой имеет интенсивный серебристо-радужный отлив (рис. 4в). Менингеальная пигментация слабо выражена. Жаберные дуги пигментированы интенсивно-чёрными меланофорами (рис. 4и). Основание Р густо испещрено коричневатыми меланофорами. Пятновидные скопления меланофоров имеются в основании V. Основания D и А в мелких немногочисленных разрозненных меланофорах. От базикаудального скопления меланофоров и участков серебристой ткани вперёд отходят пигментные полосы выше и ниже миокоммы. Нижняя пигментная полоса, состоящая из черточковидных, оконтуренных меланофорами пятнышек серебристой ткани, более крупных на хвостовом стебле, которые кпереди от V сливаются в сплошную серебристую полоску с подлежащими под ней меланофорами, расположенными в ряд, доходит вперёд до основания Р. Верхняя латеральная пигментная полоса состоит только из точечных меланофоров; у части рыб она очень короткая, состоит всего из нескольких меланофоров, не заходящих кпереди от дополнительных лучей С (рис. 4д). У экземпляров со ст. 3721 и 3798 верхняя полоса выражена намного лучше и достигает кпереди вертикали начала V (рис. 4е). Имеется три хорошо выраженных поперечно вытянутых парных перитонеальных пятна в промежутке между основаниями Р и V и ещё одно менее резкое, округлое парное перитонеальное пятно между основаниями Р (рис. 6а); брюшная поверхность несёт крупные, редко расположенные меланофоры, более многочисленные кпереди от третьего перитонеального пятна. Кишка перед анусом охвачена двумя белесыми складками брюшины, несущими густую меланофорную пигментацию (рис. 4к–4н); у голотипа участок молочно-белой ткани неправильной Г-образной формы имеется также перед основаниями V. Дорсальная срединная миосепта между затылком и D и лучи всех плавников не пигментированы.
Замечания. Описанного Париным с соавторами (Parin et al., 2009) в открытой номенклатуре D. cf. longipes № 2, якобы отличающегося от атлантического D. longipes бóльшим, а от D. andriashevi – меньшим числом жаберных тычинок (соответственно 20 против около 18 и 23–25), следует рассматривать в составе D. andriashevi. Разница в числе жаберных тычинок, подсчитанных Париным и др. для этого экземпляра (в настоящее время обе первые жаберные дуги у него утрачены), и для типовой серии D. andriashevi вполне укладывается в пределы изменчивости, установленные у близких видов (D. longipes, D. vityazi). Экземпляр со ст. 3835 обладает всеми характерными признаками D. andriashevi (четыре перитонеальных пятна в промежутке P–V; имеется меланофорная пигментация на жаберных дугах; начало А расположено под концом D) и без сомнения может быть отождествлён с данным видом.
(рис. 6в)
Материал. MNHN № 1887-0136, голотип SL 46 мм, Марокко, 29°01′59″ с.ш. 12°28′59″ в. д., 1163 м, НИС “Талисман”, ст. 47, 1883 г.
Описание. D ~ 9, A ?, P ~ 13–14, V ~ 9; миомеров ~ 48; r. br 2, sp. br 6 + 16 = 22; p. c. 6. Глаза телескопические, направлены вертикально вверх. Между вертикалями начал V и D три миомера. Начало А расположено позади конца D, промежуток между вертикалями конца и начала А соизмерим c промежутком между вертикалями начал V и D. Жирового плавника нет.
Некоторые измерения, в % SL: длина головы 30.4, длина рыла 15.2, максимальная и минимальная высота тела соответственно 9.8 и 6.0; антедорсальное, антеанальное и антевентральное расстояния соответственно 71.7, 80.4 и 63.0.
Пигментация сильно выцвела, но в основании С вполне различимо поперечное базикаудальное скопление меланофоров, от которого вперед отходят параллельные друг другу продольные пигментные полосы (выше и ниже миокоммы). Верхняя пигментная полоса выражена значительно слабее нижней, исчезает под основанием D; нижняя протягивается вперёд почти до начала туловища. На брюхе в промежутке между основаниями Р и V три крупных поперечных перитонеальных пятна, первое из них расположено на уровне пилорических придатков, между основаниями Р пятна нет. Лучи всех плавников и остатки перепонки между ними не пигментированы. На голове и жаберных дугах пигментации не выявлено.
Замечания. Я согласен с мнением (Parin et al., 2009), что ареал D. longipes должен быть ограничен Атлантическим океаном, однако из приводимых этими авторами отличий между атлантическими и индо-тихоокеанскими рыбами в числе лучей D и sp. br (в обоих случаях меньшее у атлантических рыб) и относительному положению D и А реальным является только последнее. По данным Коэна (Cohen, 1964), у атлантических D. longipes 10–11 (в среднем 11, n = 6) лучей; таким образом, их число у D. longipes и D. andriashevi перекрывается (соответственно 9–11 и 10–12), а различия по средним значениям (каковые можно было бы предполагать, исходя из материала, исследованного Париным с соавторами и мною) сомнительны. Число жаберных тычинок на первой дуге у голотипа D. longipes (22) существенно больше приводимого для этого вида Париным и др. (18); таким образом, этот признак у сравниваемых видов также широко перекрывается (18–22 против 20–25 у D. andriashevi). Тем не менее D. longipes хорошо отличается от D. andriashevi меньшим числом перитонеальных пятен в промежутке Р–V (три против четырёх, нет пятна между основаниями Р), отсутствием меланофорной пигментации жаберных дуг и более задним положением А (заметно позади конца D, а не под его концом, как у D. andriashevi).
(рис. 6г–6е)
Dolichopteryx longipes (non Vaillant): Wagner et al., 2009. P. 109, 113. Fig. 1 (24°00′ ю.ш., 175°30′ з.д., 600–800 м).
Материал. MNHN № 2000-0446, голотип SL 120 мм, Новая Каледония, 25°40′59″ ю.ш. 167°10′59″ в.д., 1030–1320 м, 15.11.1996 г.
Диагноз. Вид рода Dolichopteryx без жирового плавника, с тремя перитонеальными пятнами в промежутке между основаниями Р и V, началом А, расположенным перед концом D, с чёрной пигментацией V.
Описание. D 11, A 8, P 12, V 10, C xiv + 10 + 9 + + x; миомеров ~ 45, позвонков (по рентгенограмме) 45 (рис. 6д); r. br 2, sp. br ~ 7 + ~ 16(18) = ~ 23(25) (жаберные дужки голотипа сильно повреждены нитью для крепления коллекционного номера, пропущенной через них, из-за чего несколько самых верхних и самых нижних тычинок могли быть недоучтены). Глаза телескопические, направлены вверх. Стенка брюшной полости вырвана, из-за чего положение начала V у голотипа точно установить нельзя, но, по-видимому, они прикреплялись немного впереди вертикали начала D; внутренние органы большей частью утрачены. У экземпляра, изображенного Вагером с соавторами (Wagner et al., 2009. Fig. 1A), основание V на три миомера впереди начала D. Начало А расположено под задней третью основания D. Жирового плавника нет. Судя по экземпляру Вагнера с соавторами (Wagner et al., 2009. Fig. 1A), Р короче V, не заходят своими концами за вторую пару перитонеальных пятен; концы V незначительно заходят за основание С.
Некоторые измерения, в % SL: длина головы 29.2, максимальная и минимальная высота тела соответственно 10.0 и 7.1, длина хвостового стебля 11.7, антедорсальное и антеанальное расстояния соответственно 77.5 и 81.2; длина рыла 12.5, горизонтальный диаметр глазного яблока 3.9, горизонтальная длина костной орбиты 6.7, длина нижней челюсти 8.2.
Пигментация. Вершина рыла, челюсти и нижняя поверхность головы не пигментированы; под глазом имеется несколько редких мелких меланофоров, эпидермис здесь с выраженным серебристым отливом; пигментация менингеальных оболочек разлитая, буроватая, с отдельными более крупными точечными меланофорами. В основании С широкое поперечное базикаудальное пятно, в верхней части образующее лишь короткий выступ кпереди, а в нижней протягивающееся в виде полоски из точечных меланофоров и пятнышек серебристой ткани вперед, по меньшей мере, до уровня начала V (рис. 6е). Вентральная стенка брюшной полости сохранилась в промежутке между основаниями P и V в виде ленты ткани, на ней видны остатки трёх перитонеальных пятен (рис. 6е). У экземпляра, изображенного Вагером с соавторами (Wagner et al., 2009. Fig. 1A), три перитонеальных пятна, из которых первое в 1.4 раза ближе ко второму, чем к основанию Р, второе и третье расположены на равном расстоянии друг от друга и соответственно от первого пятна и от начала основания V; нет пятна между основаниями Р. В промежутке между началами V и А перитонеальных пятен, по-видимому, нет. Перепонка между лучами V с третьего по седьмой интенсивно-чёрная (кроме самого основания); в основании лучей V имеется плотное скопление тёмного меланофорного крапа (рис. 6е). Остальные плавники не окрашены (при увеличении на средних лучах Р прослеживается плохо заметный меланофорный крап).
Этимология. Видовой эпитет образован от латинских слов “niger” (чёрный) и “pes” (нога) и отражает характерный признак вида (чёрную пигментацию V); несклоняемое существительное.
Сравнение. Новый вид, несомненно, близок к D. longipes и D. andriashevi, но хорошо отличается от обоих видов чёрной окраской V. Помимо этого от атлантического D. longipes он хорошо отличается более передним положением начала А (немного впереди вертикали конца D против заметно позади неё) и, возможно, несколько меньшим числом позвонков (миомеров) (45 против 46–48), а от D. andriashevi – тремя (против четырёх) перитонеальными пятнами в промежутке Р–V, отсутствием меланофорной пигментации жаберных дуг и, возможно, очень слабым развитием меланофорной пигментации на рыле и под глазом. От всех остальных видов рода новый вид может быть легко отличён по отсутствию жирового плавника и комбинации других признаков (короткие и светлые Р, чёрные V, sp. br порядка 23–25, есть перитонеальные пятна при SL до 120 мм).
(рис. 6ж)
Материал. ЗММУ № 22215, голотип SL 61 мм, 07°35′ с.ш. 162°01′ в.д., 1000–0 м. Нетиповой материал (описывается впервые): 4 экз. SL 31–57.5 мм, Аравийское море, 09°06′ с.ш., 64°00′ в.д., НИС “Петр Лебедев”, рейс 7, проба 7–25, трал Айзекса–Кидда, горизонт лова 232–252 м, время лова 12.36–13.36, 09.04.1969 г.; 1 экз. SL 50 мм, 09°18′ с.ш. 63°37′ в.д., НИС “Петр Лебедев”, рейс 7, проба 7–33, трал Айзекса–Кидда, горизонт лова 280–330 м, время лова 11.55–12.55, 10.04.1969 г.
Описание. D 11–12, A 9–11, P 13–15, V 9–10, C ix–x + 10 + 9 + ix–x; r. br 2, sp. br 5–10 + 17–20 = = 23–28; позвонков (миомеров) 44–48; p. c 6. Глаза телескопические, направлены вверх и немного вперед (рис. 6з). Р, по-видимому, много короче V, концы лучей P незначительно заходят за первую пару перитонеальных пятен в промежутке Р–V; концы лучей V у всех исследованных рыб обломаны, достигают по меньшей мере конца основания А. Между вертикалями начал V и D три миомера. Начало А расположено под концом D или позади него. Жировой плавник имеется, расположен позади вертикали конца А.
Некоторые измерения, в % SL: длина головы 30.6–32.3, максимальная и минимальная высота тела соответственно 8.7–9.9 и 5.8–7.4, длина хвостового стебля 13.9–16.1; антедорсальное, антевентральное и антеанальное расстояния соответственно 72.6–76.5, 69.4–72.6 и 79.7–82.7; длина рыла 12.9–14.5, горизонтальный диаметр глазного яблока 3.2–4.3, горизонтальная длина костной орбиты 8.1–8.8, длина нижней челюсти 7.8–8.7.
Пигментация. Дорсальная поверхность рыла с овальным пятном мелких коричневатых меланофоров, назад не заходящих за вертикаль нижнечелюстного сустава. В области верхней челюсти и по оральному краю нижней челюсти полоска полностью или частично сливающихся меланофоров. Под глазом расположено небольшое заплатковидное скопление крупных субдермальных меланофоров; эпидермис над ними имеет интенсивный серебристо-радужный отлив. У более крупных рыб близ квадратно-нижнечелюстного сочленения присутствует лишь ряд из нескольких очень мелких меланофоров; нижний край заднего отростка quadratum и symplecticum оконтурен узкой прерывистой полоской тёмного пигмента, но короткий ряд из более крупных меланофоров перед лучами бранхиостегальной перепонки хорошо развит. У наименьшего из исследованных экземпляров имеется короткая полоска из мелких точечных меланофоров перед нижнечелюстным суставом, далее назад продолжающаяся по нижнему краю подвеска рядом сначала очень мелких, но постепенно увеличивающихся в каудальном направлении меланофоров, соединяющихся с рядом меланофоров перед бранхиостегальными лучами. Менингеальная пигментация у более крупных рыб сплошная, при виде сверху образует тёмный контур вокруг мозга, но у наименьшего экземпляра меланофоры здесь частично не слиты. Жаберные дуги не пигментированы. В основании Р имеется лишь небольшое коричневатое пятнышко поверхностной пигментации; в основании V хорошо развито пятновидное скопление разноразмерных меланофоров. Основания D и А в мелких немногочисленных разрозненных меланофорах и с разлитым буроватым пигментом. От базикаудального скопления меланофоров и участков серебристой ткани выше и ниже миокоммы вперёд до жаберного отверстия отходят пигментные полосы, состоящие из пятнышек серебристой ткани, оконтуренных буроватыми меланофорами. Верхняя и нижняя пигментные полосы одинаковой длины, но пятнышки в нижней полосе (в каудальной половине) заметно крупнее, чем в верхней полосе, сильно вытянуты продольно, и серебристая ткань в них гораздо лучше выражена, чем в мелких округлых пятнышках верхней полосы (рис. 4ж, 6и). Кпереди от третьего перитонеального пятна пятнышки нижней полосы сливаются в сплошную линию, в верхней полосе они обособлены до её переднего окончания (у supracleithrum). Имеется три хорошо выраженных перитонеальных пятна в промежутке между основаниями Р и V; между основаниями Р у более крупных рыб пятна нет. У наименьшего из исследованных экземпляров между основаниями Р имеются разрозненные довольно крупные точечные меланофоры, с обеих сторон сливающиеся в верхнебоковом направлении в небольшие пятнышки. Участок кишки перед анусом охвачен листками молочно-белой ткани со струйчатой структурой и очень мелкой меланофорной пигментацией (но у наименьшего экземпляра заметно более густой) и небольшим чёрным пигментным пятном близ верхнезаднего края (рис. 4к–4н). Мелкие меланофоры присутствуют в основаниях лучей V, лучи остальных плавников совершенно непигментированы (рис. 6и). Дорсальная срединная миосепта между затылком и D не пигментирована.
Замечания. Вид был ранее известен только по голотипу, пойманному в Тихом океане к востоку от Каролинских о-вов. Новый материал происходит из Аравийского моря, из чего следует, что этот вид широко распространён в тропической Индо-Вест-Пацифике. Хотя индоокеанский материал демонстрирует заметную изменчивость по ряду морфологических признаков, он вполне соответствует диагнозу данного вида (Parin et al., 2009). Следует отметить постоянство различия в ориентации глаз в изученном материале по D. vityazi и D. andriashevi. У первого вида они ориентированы вверх, но умеренно наклонены вперёд (рис. 2з), тогда как у второго направлены строго вверх (рис. 2б). Известно, что глаза опистопроктовых рыб могут разворачиваться на 90° из положения “вверх” в положение “вперед” (Robison, Reisenbichler, 2008). Однако у фиксированных рыб они всегда занимают строго определённое положение, что свидетельствует о возможном существовании позиции “по умолчанию”, к которой глаза приводятся в том числе после гибели рыбы. Возможно, что различия в позиции «по умолчанию» имеют некоторое таксономическое значение – из обследованных мною 6 экз. D. andriashevi и 6 экз. D. vityazi только у 1 экз. D. vityazi SL 51 мм наблюдались различия в степени наклона правого и левого глаза, тогда как у всех остальных рыб их ориентация была совершенно одинакова (как показано на рис. 2б и 2з).
(рис. 7)
Материал. MNHN № 1970-0038 – 1 экз. SL 100 мм, 00°07′ с.ш. 152°40′ в.д., 510 м, НИС “Кориолис”, 01.03.1969 г., ИО РАН б/№ – 2 экз. SL 85 и 111.5 мм, 00°17′ с.ш. 89°29´ з.д. (у Галапагосских о-вов), 500−0 м, НИС “Академик Курчатов”, рейс 4, ст. 313. Экземпляры из коллекции ИО РАН в настоящее время полностью высохли (их краткое описание см.: Parin et al., 2009. P. 845). Описание составлено по экз. MNHN № 1970-0038.
Описание. D ~ 10, A 8, P 15, V 11, C xii + 10 + + 9 + x; миомеров ~ 42–44, позвонков (по рентгенограмме) 43 (рис. 7в); r. br 2, sp. br 10 + 25 = 35. Глаза телескопические, направлены вверх. Между началами оснований V и D три позвонка. Начало А расположено под задней третью D. По дорсальному краю тела от затылка до начала D и между концом D и основанием С протягивается узкая непигментированная кожная складка (у исследованного экземпляра местами повреждённая). Жировой плавник (повреждён) расположен в толще этой складки, примерно в 1.5 и в 2.0 раза ближе к первому дополнительному лучу C, чем к концу А и D соответственно (рис. 7г).
Рис. 7.
Dolichopteryx pseudolongipes, экз. SL 100 мм: а, б – общий вид (а – латерально, б – вентрально, (▶) – параректальный участок брюшины); в – рентгенограмма; г – пигментация каудальной половины тела, (▶) – положение основания жирового плавника. Масштаб: 5 мм.
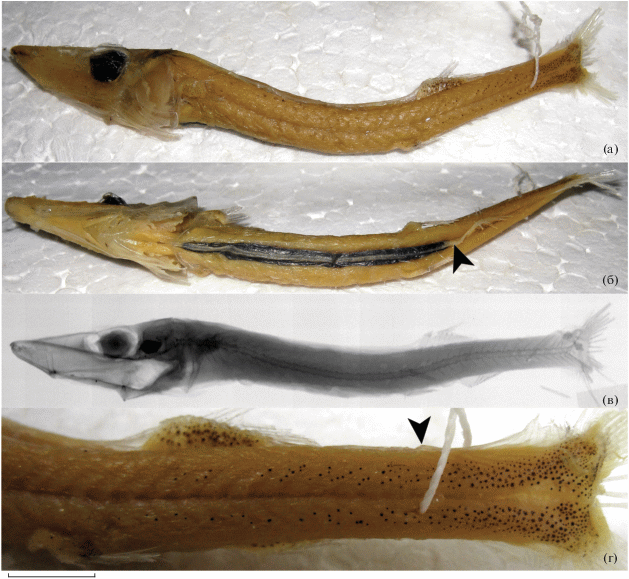
Некоторые измерения, в % SL: длина головы 34.0, максимальная и минимальная высота тела соответственно 9.0 и 5.5, длина хвостового стебля 15.0; антедорсальное, антевентральное и антеанальное расстояния соответственно 71.0, 68.0 и 78.0; длина рыла 15.5, горизонтальная длина костной орбиты и глазного яблока соответственно 8.3 и 7.0, длина нижней челюсти 6.1.
Пигментация. Верхняя поверхность рыла с рассеянной коричневатой меланофорной пигментацией, верхняя челюсть черноватая. Под глазом имеется сильно рассеянное скопление редких точечных меланофоров. Узкая полоска меланофоров протягивается по нижнему краю подвеска от квадратно-нижнечелюстного сустава. Яркая тёмная метка имеется перед основанием жаберных лучей. Менингеальные оболочки тёмно-пигментированные. Рассеянное скопление точечных меланофоров имеется в основании Р. Лучи плавников не пигментированы, за исключением V, в основаниях лучей которых развит густой меланофорный крап, переходящий и на кожу близ оснований лучей. Дистальнее него лучи и межлучевая перепонка V не окрашены. Основание D с плотным скоплением довольно крупных меланофоров, в основании А – редкие точечные меланофоры. От основания С вперёд до уровня промежутка D–V протягиваются две продольные пигментные полосы, состоящие из точечных меланофоров (рис. 7г). В задней половине хвостового стебля они очень широкие, достигают максимальной ширины близ основания С, где почти сливаются друг с другом; кпереди от вертикали основания жирового плавника меланофоры становятся гораздо более редкими и малочисленными, под основанием D они образуют всего один продольный ряд. Верхняя и нижняя пигментные полосы одинаково развиты, не содержат пятнышек ярко-серебристой ткани. Перитонеум интенсивно-чёрный, просвечивает через вентральную стенку брюшной полости; участок, охватывающий ректальный конец кишки, молочно-белого цвета с отдельными точечными меланофорами (рис. 7б); перитонеальных пятен и меланофорной пигментации на вентральной поверхности брюшной стенки нет.
Развитие и распределение меланофорной пигментации у высохших рыб из сборов НИС “Академик Курчатов” соответствует описанному выше для новокаледонского экземпляра.
Замечания. Данный вид ранее был известен только из вод Восточной Пацифики (от Калифорнии и Галапагосских о-вов) (Grey, 1952; Fitch, Lavenberg, 1968, Fukui et al., 2008; Parin et al., 2009). Его нахождение в водах Новой Каледонии несколько неожиданно и существенно меняет представления об ареале вида. Однако, хотя для восточно-тихоокеанской мезобатипелагической ихтиофауны в целом характерен выраженный эндемизм, известны случаи, когда виды, считавшиеся восточно-тихоокеанскими эндемиками, впоследствии были обнаружены и в западно-тихоокеанских водах (Prokofiev, Pietsch, 2019). Никаких значимых различий между новокаледонским и восточно-тихоокеанскими экземплярами не найдено. Новокаледонский экземпляр имеет немногим большее число жаберных тычинок (35 против 31–33), однако разница лежит в пределах внутривидовой изменчивости у других видов рода. Вместе с тем нужно отметить отличия между экземплярами типовой серии из вод Калифорнии и рыбами от Новой Каледонии и Галапагосских о-вов по пигментации V. Фукуи с соавторами (Fukui et al., 2008. P. 269) описывают V как “blackish, except proximally at approximately one-fourth length of longest ray” (черноватые, кроме проксимальной части примерно на четветь длины наибольшего луча). Однако, судя по фотографии голотипа (Fukui et al., 2008. Fig. 2a), у него имеется тёмная пигментация в основании V примерно на 1/6 его длины, далее проксимальная половина V светлая, дистальная половина V чёрная (неясно, целиком или только по наружному лучу или нескольким лучам). Это отличается от ситуации, наблюдаемой у новокаледонского экземпляра и у рыб от Галапагосских о-вов, у которых имеется скопление изолированных точечных меланофоров в основании лучей V, а в остальном эти плавники целиком светлые. Грей (Grey, 1952), описавшая экземпляр также от Галапагосов, тоже указывает хроматофорный крап лишь в проксимальной части лучей V. Возможно, имеются морфологические различия между рыбами из Калифорнийского переходного района и из экваториальных вод Тихого океана, однако насколько они значимы, не ясно. Пигментные полосы, характерная форма которых отличает D. pseudolongipes от всех других видов рода (не выяснено для D. parini, молодь которого не известна), одинаково развиты у изученных мною новокаледонских и галапагосских рыб и, судя по первоописанию, у рыб типовой серии.
Dolichopteryx parini Kobyliansky et Fedorov, 2001
Материал. ИО РАН б/№, 1 экз. SL ~ 170 мм, океанская сторона Курил, 47°09′ с.ш. 153°52′ в.д., глубина 420–460 м, НПС “Млечный путь”, трал № 61, время лова 06.00–07.00, 17.03.1990 г.
Описание. D 10, A 10, P 14, V 11, C x + 10 + 9 + + ix; r. br 2, sp. br 8 + 23 = 31 (рис. 2д); позвонков (миомеров) 46; p. c 5, расположены в ряд, направлены вершинами назад (рис. 5б). Во внутреннем ряду на первой жаберной дуге 11 + 13 тычинок (рис. 2е); есть щель за четвёртой жаберной дугой. Ложножабра хорошо развита, состоит из 18 элементов. Глаза телескопические, направлены вертикально вверх. Концы Р достигают конца основания А, концы V заходят за основание С. Восемь миомеров в промежутке между вертикалями начал V и D. Начало А расположено под серединой основания D, жировой плавник прикрепляется сразу за концом основания А.
Некоторые измерения, в % SL: длина головы 30.1, максимальная и минимальная высота тела соответственно 12.1 и 6.6, длина хвостового стебля 13.3; антедорсальное, антевентральное и антеанальное расстояния соответственно 76.5, 63.3 и 81.3; преадипозная длина 89.2, длина рыла 12.65, горизонтальная длина костной орбиты и глазного яблока соответственно 9.0 и 6.0, длина нижней челюсти ~ 6.0.
Пигментация. Верхняя и боковая поверхности рыла с разлитой буроватой пигментацией, имеющий вид широких продольных полос; характерные для ювенильных стадий скопления меланофоров под глазом и на вентральной стороне головы отсутствуют. Следы чёрных чешуйных карманов сохранились на брюхе и местами на боках тела; кроме них, кожа светлая; срединная дорсальная миосепта целиком чёрная. Обрывки кожи в заглазничной части головы с разлитой меланофорной пигментацией. Лучи D тёмные, А и С – светлые; лучи парных плавников тёмные до чёрных (их окраска, вероятно, несколько выцвела). Жировой плавник в базальной половине буроватый, дистально – светлый. Ротовая полость светлая, испод жаберной крышки с тёмной меланофорной пигментацией. Точечные меланофоры имеются на жаберных тычинках и на передней поверхности дуг близ оснований тычинок. Перитонеум чёрный, на наружной поверхности с радужным отливом, просвечивает через брюшную стенку.
Замечания. Изученный экземпляр пойман в пределах известного ареала вида и в целом хорошо согласуется с первоописанием, за исключением заметно большего числа sp. br (31 против 26–28). Нельзя, впрочем, исключить, что несколько самых нижних тычинок не были учтены Кобылянским и Федоровым (2001), так как их точный подсчёт требует подрезки жаберной перепонки и отводящей гиогиоидной мышцы, о выполнении которой в цитируемой работе не упоминается. У экземпляра из вод Японии (Mizusawa, Fukui, 2009) sp. br 29 (7 + 22). В любом случае их число у изученного экземпляра нивелирует хиатус по данному признаку между D. parini и D. pseudolongipes. Учитывая, что первый вид известен только по половозрелым рыбам, а второй – только по молоди, целесообразно обсудить вопрос о возможной конспецифичности этих видов. Для D. parini характерны сильно удлинённые и тёмно-пигментированные парные плавники, тогда как у D. pseudolongipes, по крайней мере Р, целиком светлые. У всех исследованных мною особей последнего вида концы Р и V обломаны. Длина Р (c правой стороны) у голотипа составляет 10.3%, а длина V – 22% SL (Fukui et al., 2008); длина Р и V у экземпляра, изученного Грей (Grey, 1952), составляет соответственно 15.1 и 18.3% SL. Это существенно меньше наблюдаемого у D. parini (соответственно 38.0–46.4 и 37.5–42.3% SL). Поскольку существует ещё один длинноплавничный вид рода (D. anascopa), известный только по молоди, имеются основания полагать, что длина парных плавников (прежде всего Р, поскольку V удлинены и у молоди других видов (Roule, Angel, 1930; Cohen, 1964)) у Dolichopteryx не связана с ростом. Наконец, V у D. parini занимают более переднее положение, чем у D. pseudolongipes (на восемь позвонков впереди начала D против всего трёх у сравниваемого вида). С учётом вышесказанного я рассматриваю оба вида в качестве валидных.
Dolichopteryx trunovi Parin, 2005
Материал. ЗИН № 36600, голотип SL ~ 80 мм, 53°01′ ю.ш. 109°30′ з.д., НИС “Обь”, орудие лова – РДТ (4200 м ваера), 28.04.1958 г., сборщики А.П. Андрияшев, Ю.Е. Пермитин.
Описание. D 11, A 10, P 14, V 9, C x + 10 + 9 + + ix; r. br 2, sp. br 4 + 11 = 15 (короткие и широкие, уплощённые, почти треугольной формы: рис. 8а), тычинок во внутреннем ряду на первой дуге 3 + 7 (такой же длины, как во внутреннем, но несколько более узкие: рис. 8б), на второй дуге в наружном и внутреннем ряду – соответственно 5 + 8 и 3 + 6; миомеров 48; p. c 4 (три передних расположены в поперечном ряду, последний придаток направлен назад параллельно продольной оси желудка: рис. 5г). Голова раздавлена, глаза утрачены; лучи всех плавников дистально обломаны. Между вертикалями начал V и D 9 миомеров. Начало А расположено позади конца D. Жировой плавник имеется, его основание расположено позади вертикали конца А.
Рис. 8.
Первая жаберная дуга Dolichopteryx trunovi, голотип SL ~80 мм (а – снаружи, б – изнутри); 1*–4*, 1–11 – соответственно эпибранхиальные и цератобранхиальные тычинки наружного ряда. Масштаб: 1.5 мм.
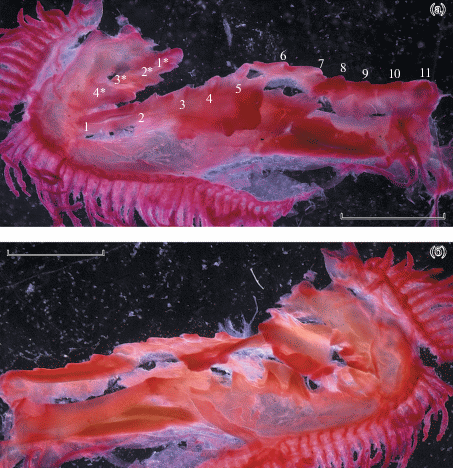
Некоторые измерения, в % SL: длина головы ~25, максимальная и минимальная высота тела соответственно 8.75 и 5.6, длина хвостового стебля 11.25; антедорсальное, антевентральное и антеанальное расстояния соответственно 72.5, 58.75 и 85.0; длина рыла 11.25, горизонтальная длина костной орбиты ~5.9, длина нижней челюсти 8.1.
Пигментация. Экземпляр лишён кожи и полностью депигментирован. На голове сохранились следы полоски коричневатого пигмента вдоль верхней челюсти, небольшое скопление мелких меланофоров в области quadratum над нижнечелюстным суставом и узкая полоска пигмента по нижнему краю подвеска. Менингеальная пигментация очень слабая, из нескольких сравнительно крупных меланофоров по бокам от полушарий мозга. С правой стороны хвостового стебля кожа сохранилась, но пигментация сильно выцвела, хотя прослеживаются единичные мелкие пятнышки горизонтальных полос выше и ниже миокоммы. В основаниях V сохранились пятновидные скопления меланофоров. Единичные очень мелкие меланофоры имеются на кишке и желудке; на боковых сторонах желудка на уровне 12-го туловищного миомера имеется небольшое рыхлое пятновидное скопление, состоящее из более крупных меланофоров (рис. 4з). Нижняя часть брюшной стенки утрачена и о наличии/отсутствии перитонеальных пятен судить сложно. Перитонеум в крупных густых буроватых пятнышках, сливающихся паравертебрально. Дорсальная срединная миосепта между затылком и D не пигментирована.
Замечания. В первоописании (Парин, 2005. С. 140) для голотипа было указано 4 + 7 = 11 жаберных тычинок (где именно, не было сказано, но, согласно методике изучения, принятой для рода, их подсчёт должен был вестись в наружном ряду на первой дуге). Жаберные дуги голотипа сильно повреждены, эпидермис на ceratobranchiale первой дуги частично отстал от кости, тем не менее не вызывает сомнений, что в наружном ряду на ceratobranchiale-1 тычинок в действительности больше (11, а не 7) (рис. 8а). Это несколько больше значений, указываемых Труновым (1997) для южноатлантических рыб (4 + 7–8 = 11–12). Кроме того, голотип из юго-восточной части Тихого океана отличается от южноатлантических рыб более смещённым назад А (его начало расположено позади конца D, а не на одной с ним вертикали). Таксономическая значимость этих различий, скорее всего, несущественна; изменчивость по последнему признаку отмечена мною у D. vityazi.
Dolichopteryx sp. indet. (prope anascopa Brauer, 1901)
Материал. ИО РАН б/№, 1 экз. SL ~ 90+ мм (сильно повреждён, фрагментирован), 07°26′ с.ш. 87°16′ в.д., 427 м, НИС “Петр Лебедев”, рейс 7, проба 7–14, трал Айзекса–Кидда, время лова 13.25–14.25, 23.03.1969 г.
Описание. Длина головы ~ 27 мм. Рыло на всём протяжении высокое. Продольная длина костной орбиты в 1.4 раза короче рыла, длина которого 2.5 раза содержится в длине головы. Зубы на сошнике многорядные, на нижней челюсти отсутствуют. Sp. br 10 + 20 = 30, уплощённые и немного удлинённые. Жаберные лепестки очень тонкие, длинные. Верхняя челюсть и оральный край нижней челюсти черноватые. Под орбитой имеется очень маленькое скопление меланофоров. Менингеальные оболочки с разлитой буроватой пигментацией. Хорда по всей длине пигментирована сливающимися в продольную полосу буроватыми хроматофорами. Сохранился обрывок кишки, в начальной части которого имеется пятновидное скопление буроватых меланофоров. На кишке остались обрывки чёрной пленчатой ткани, вероятно, остатки перитонеума.
Замечания. Этот экземпляр имеет исключительно плохую сохранность и его уверенное определение невозможно, так как большинство признаков у него утрачено. Тем не менее он отличается от всех изученных мною представителей рода необычно тонкими и длинными жаберными лепестками. Короткое и высокое рыло, число жаберных тычинок и скопление меланофоров на сохранившемся участке кишки позволяют предполагать принадлежность данного экземпляра к D. anascopa, однако для полной убеждённости в таком определении перечисленных признаков недостаточно.
Таблица для определения родов и видов “длиннотелых” опистопроктид
1(2) Глаза пузыревидные, без обособленного шаровидного тела и дополнительного хрусталика; афокальная зона имеется (рис. 1а–1в)…………….... 3
2(1) Глаза телескопические (рис. 1г–з), а если пузыревидные, то с крупным шаровидным телом, содержащим дополнительный хрусталик (рис. 1и); афокальной зоны нет …….…….............................. 9
3(6) Позвонков 53–58, субсклеральное линзовидное уплотнение под хрусталиком отсутствует, сошник без зубов, краевых лучей С 5–6; SL до 253 мм … (Ioichthys) …………................................... 4
4(5) Позвонков 53–55; Индийский океан ......................................................................I. kashkini
5(4) Позвонков 56–58; Восточная Пацифика…………………………..……………........... Ioichthys sp.
6(3) Позвонков 40–46, имеется чётко отграниченное субсклеральное линзовидное уплотнение под хрусталиком (рис. 1в), передний край сошника с многорядными зубами, краевых лучей С 9–11, неотенические формы, максимальная известная SL 66.2 мм … (Duolentops gen. nov.) …….…………… 7
7(8) Рыло короткое, 11.2–17.4% SL, перитонеальные пятна имеются, позвонков (миомеров) 45–46, Индо-Вест-Пацифика ……….. D. minuscula
8(7) Рыло длинное, 19.6–25.4% SL, перитонеальные пятна отсутствуют, позвонков (миомеров) 40–42, Северная Атлантика ……………… D. rostrata
9(10) Глаза пузыревидные, с хорошо обособленным шаровидным телом, содержащим дополнительный хрусталик; у рыб SL > 112 мм имеются две корнеальные линзы позади шаровидного тела, позвонков 67–85, зубы на сошнике однорядные, мальки имеют продольный ряд пятен по дорсальному краю тела … (Bathylychnops) ……………….……... 11
10(9) Глаза телескопические, с хорошо обособленным шаровидным телом, но без дополнительного хрусталика (есть у Dolichopteroides (?): Parin et al., 2009) и без корнеальных линз близ нижнего и нижнезаднего края глаза; позвонков 41–60, озубление сошника многорядное, нет дорсальных пигментных пятен у молоди …………… 15
11(12) Позвонков 65–73 …… B. brachyrhynchus
12(11) Позвонков 77–85 …………………………. 13
13(14) V прикрепляются далеко впереди вертикали начала D, жировой плавник расположен над концом А, Юго-Восточная Пацифика … B. chilensis
14(13) V и D начинаются близ одной вертикали, жировой плавник расположен над передней третью или серединой А, Северная Пацифика ………………….………………………........... B. exilis
15(16) Позвонков 58–60; и основание V, и основание A хотя бы частично располагаются под основанием D; Р значительно длиннее V ………………….…..…......... Dolichopteroides binocularis
16(15) Позвонков 41–48, основание V всегда расположено заметно впереди вертикали начала D, Р значительно короче V или примерно одинаковой длины с ними … (Dolichopteryx) …........... 17
17(18) Жировой плавник имеется, перитонеальных пятен у молоди нет (кроме D. vityazi; не известно для D. parini)……...................................... 19
18(17) Жировой плавник отсутствует, перитонеальные пятна у молоди имеются …….…………. 27
19(20) Р и V сильно удлинённые, начало А расположено на вертикали середины длины основания D, у нижнего края глаза имеется участок молочно-белой (не склеротизированной) ткани………………………....................................... 21
20(19) Р много короче V, начало А расположено перед концом основания D или позади него, нет специфической ткани у нижнего края глаза …………... 23
21(22) Позвонков (миомеров) 41–44, V 12; P, V и D не пигментированы; крупный овальный участок белой ткани у нижнего края глаза; тропическая Индо-Вест-Пацифика ................ D. anascopa
22(21) Позвонков (миомеров) 46–47, V 10–11; P, V и D пигментированы; узкий полулунный участок белой ткани у нижнего края глаза; переходная зона Северной Пацифики …............. D. parini
23(24) Перитонеальные пятна у молоди имеются [sp. br 23–28; тропическая Индо-Вест-Пацифика] ….…………........................................ D. vityazi
24(23) Перитонеальных пятен у молоди нет...... 25
25(26) sp. br 31–35, Калифорнийский переходный район и экваториальная часть Тихого океана от Новой Каледонии до о-вов Галапагос...D. pseudolongipes
26(25) sp. br 11–15, воды Южного полушария между 41° и 53° ю.ш. ……………….............. D. trunovi
27(28) Четыре перитонеальных пятна в промежутке P–V, жаберные дуги с точечной меланофорной пигментацией (рис. 4и) [V не окрашены; начало A под концом D] …………..…. D. andriashevi
28(27) Три перитонеальных пятна в промежутке P–V, жаберные дуги не пигментированы ………... 29
29(30) Начало А немного впереди вертикали конца D, перепонка между третьим–седьмым лучами V интенсивно-чёрная (кроме самого основания), тропическая южная часть Тихого океана …....................................... D. nigripes sp. nov.
30(29) Начало А позади вертикали конца D, V не пигментированы, Атлантический океан … D. longipes
Список литературы
Кобылянский С.Г. 1990. Таксономический статус микростомовых рыб и некоторые вопросы классификации подотряда Argentinoidei (Salmoniformes, Teleostei) // Тр. ИО АН СССР. Т. 125. С. 148–177.
Кобылянский С.Г. 2006. Bathylagus niger sp. nova (Bathylagidae, Salmoniformes) – новый вид батилага из субполярных вод Южного океана // Вопр. ихтиологии. Т. 46. № 4. С. 437–441.
Кобылянский С.Г., Федоров В.В. 2001. Новый вид рода Dolichopteryx – D. parini (Opisthoproctidae) из мезопелагиали Охотского и Берингова морей // Там же. Т. 41. № 1. С. 125−128.
Парин Н.В. 2004. Новая мезопелагическая рыба Ioichthys kashkini, gen. et sp. nova (Opisthoproctidae) из северо-западной части Индийского океана // Там же. Т. 44. № 4. С. 437−440.
Парин Н.В. 2005. Dolichopteryx trunovi sp. nova – замещающее название для D. anascopa (nec Brauer, 1901) Trunov, 1997 (Opisthoproctidae, Argentinoidea) // Там же. Т. 45. № 1. С. 139−140.
Парин Н.В., Федоров В.В., Бородулина О.Д., Беккер В.Э. 1995. Мезопелагические и эпипелагические рыбы, впервые обнаруженные в тихоокеанских водах у Южных Курильских островов // Там же. Т. 35. № 6. С. 732−739.
Прокофьев А.М. 2014. Новые и редкие виды глубоководных пелагических рыб из семейств Opisthoproctidae, Melanostomiidae, Oneirodidae и Linophrynidae // Там же. Т. 54. № 4. С. 379–386. https://doi.org/10.7868/S0042875214040092
Трунов И.А. 1997. Виды семейства Opisthoproctidae из южных вод Атлантического океана // Там же. Т. 37. № 6. С. 847−851.
Aizawa M. 2002. 88. Opisthoproctidae barreleyes // Fishes of Japan with pictorial keys to the species. V. 1 / Ed. Nakabo T. Tokyo: Tokai Univ. Press. P. 287–288.
Badcock J. 1988. Evidence for the assignment of Dolichopteryx brachyrhinchus Parr to the genus Bathylychnops Cohen (Pisces, Opisthoproctidae) // J. Fish. Biol. V. 32. № 3. P. 423−432.
Beebe W. 1932. Nineteen new species and four post-larval deep-sea fish // Zoologica (N.Y.). V. 13. № 4. P. 47−107.
Beebe W. 1933. Deep-sea fishes of the Bermuda oceanographic expeditions. № 3. Family Argentinoidei // Ibid. V. 16. № 3. P. 59−70.
Brauer A. 1908. Die Tiefsee-Fische. II. Anatomischer Teil // Wissenschaftliche Ergebnisse der Deutschen Tiefsee-Expedition auf dem Dampfer “Valdivia” 1898–1899. Bd. 15. Jena: Verlag von Gustav Fischer, 266 S., Taf. XIX–XLIV.
Cohen D.M. 1958. Bathylychnops exilis, a new genus and species of argentinid fish from the North Pacific // Stanford Ichthyol. Bull. V. 7. № 3. P. 47−52.
Cohen D.M. 1960. New records of the opisthoproctid genus Bathylychnops, with a notice of neoteny in the related genus Dolichopteryx // Copeia. 1960. № 2. P. 147–149.
Cohen D.M. 1964. Suborder Argentinoidea // Fishes of the western North Atlantic. Pt. 4 (Mem. Sears Found. Mar Res. № 1) / Ed. Bigelow H.B. New Haven: Yale Univ. P. 1–70.
Fitch J.E., Lavenberg R.J. 1968. Deep-water teleostean fishes of California // California Natural History Guides № 25. Berkeley: Univ. Calif. Press, 155 p.
Frederiksen R.D. 1973. On the retinal diverticula in the tubular-eyed opisthoproctid deep-sea fishes Macropinna microstoma and Dolichopteryx longipes // Vidensk. Meddr. Dansk Naturh. Foren. V. 136. P. 233–244.
Fujii E. 1985. Family Opisthoproctidae // The fishes of the Japanese Archipelago / Eds. Masuda H. et al. Tokyo: Tokai Univ. Press. V. 1. P. 41−42. V. 2. Pl. 46.
Fukui A., Kitagawa Y. 2006a. Dolichopteryx minuscula, a new species of spookfish (Argentinoidei: Opisthoproctidae) from the Indo-West Pacific // Ichthyol. Res. V. 53. № 2. P. 113–120.
Fukui A., Kitagawa Y. 2006b. Dolichopteryx rostrata, a new species of spookfish (Argentinoidea: Opisthoproctidae) from the eastern North Atlantic Ocean // Ibid. V. 53. № 1. P. 7–12.
Fukui A., Kitagawa Y., Parin N.V. 2008. Dolichopteryx pseudolongipes, a new species of spookfish (Argentinoidei: Opisthoproctidae) from the eastern Pacific Ocean // Ibid. V. 55. № 3. P. 267–273.
Greenwood P.H., Rosen D.E. 1971. Notes on the structure and relationships of the alepocephaloid fishes // Amer. Mus. Novit. № 2473. 141 p.
Grey M. 1952. First record of the deepsea fish, Dolichopteryx longipes from the Pacific, with notes on Ophthalmopelton macropus // Copeia. № 2. P. 87−90.
Haedrich R.L., Craddock J.E. 1968. Distribution and biology of the opisthoproctid fish Winteria telescopa Brauer, 1901 // Breviora. № 294. 11 p.
Harrisson C.M.H. 1967. On methods for sampling mesopelagic fishes // Symp. Zool. Soc. Lond. V. 19. P. 71–126.
Hatooka K. 2002. 86. Argentinidae argentines // Fishes of Japan with pictorial keys to the species. V. 1 / Ed. Nakabo T. Tokyo: Tokai Univ. Press. P. 283.
Hubbs C.L., Lagler K.F. 1958. Fishes of the Great Lakes region // Cranbrook Inst. Sci. Bull. № 26. 213 p.
Kawaguchi K., Butler J.L. 1984. Fishes of the genus Nansenia (Microstomatidae) with descriptions of seven new species // Contr. Sci. Los Angeles Co. Mus. № 352. 22 p.
Land M.F. 2000. On the functions of double eyes in midwater animals // Phil. Trans. R. Soc. Ser. B. V. 355. № 1401. P. 1147–1150.
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. 2002. Fishes of Alaska. Maryland, Bethesda: Amer. Fish. Sci., 1037 p.
Mizusawa N., Fukui A. 2009. First Japanese record of a spook-fish, Dolichopteryx parini (Argentinoidei: Opisthoproctidae), from off the Pacific coast of Aomori Prefecture // Jpn. J. Ichthyol. V. 56. № 2. P. 149–152.
Mizusawa N., Takami M., Fukui A. 2015. Redescription of the spookfish Dolichopteryx anascopa Brauer, 1901 (Argentinoidei: Opisthoproctidae) // Ichthyol. Res. V. 62. № 2. P. 236–239.
Moser H.G. 1996. Opisthoproctidae: spookfishes // The early stages of fishes in the California Current region. CalCOFI Atlas 33. Lawrence, Kansas: Allen Press. P. 216–223.
Parin N.V., Belyanina T.N., Evseenko S.A. 2009. Materials to the revision of the genus Dolichopteryx and closely related taxa (Ioichthys, Bathylychnops) with the separation of a new genus Dolichopteroides and description of three new species (fam. Opisthoproctidae) // J. Ichthyol. V. 49. № 10. P. 839–851.
Parr A.E. 1937. Concluding report on fishes. Fishes of the Third Oceanographic Expedition of the “Pawnee” // Bull. Bingham Oceanogr. Coll. Peabody Mus. Nat. Hist. Yale Univ. V. 3. Art. 7. P. 1–79.
Partridge J.C., Douglas R.H., Marshall N.J. et al. 2014. Reflecting optics in the diverticular eye of a deep-sea barreleye fish (Rhynchohyalus natalensis) // Proc. Roy. Soc. B: Biol. Sci. V. 281. P. 1–9. https://doi.org/10.1098/rspb.2013.3223
Pearcy W.G., Meyer S.L., Munk O. 1965. A “four-eyed” fish from the deep sea: Bathylychnops exilis Cohen, 1958 // Nature. V. 207. № 5003. P. 1260–1262.
Prokofiev A.M., Pietsch T.W. 2019. First record of the ceratioid anglerfish species Gigantactis microdontis (Teleostei: Lophiiformes: Gigantactinidae) in the western Pacific Ocean // Zootaxa. V. 4664. № 3. P. 441–444.
Robison B.H., Reisenbichler K.R. 2008. Macropinna microstoma and the paradox of its tubular eyes // Copeia. № 4. P. 780–784.
Roule L., Angel F. 1930. Larves et alevines de poisons provenant des croisières du Prince Albert I de Monaco // Result Camp. Sci. Prince Albert I. V. 79. P. 1−148.
Shinohara G. 2009. Opisthoproctidae gen. et sp. indet // Deep-sea fishes of Peru. Libro de Peces de Aguas Profundas del Perú / Eds. Nakaya K. et al. Tokyo: Jpn. Deep Sea Trawlers Ass. P. 95.
Stein D.L., Bond C.E. 1985. Observations on the morphology, ecology, and behaviour of Bathylychnops exilis Cohen // J. Fish. Biol. V. 27. № 3. P. 215–228.
Stewart A.L. 2015. Family Opisthoproctidae spookfishes // The Fishes of New Zealand. V. 1 / Eds. Roberts C.D. et al. Wellington: Te Papa Press. P. 326–331.
Wagner H.-J., Douglas R.H., Frank T.M. et al. 2009. A novel vertebrate eye using both refractive and reflective optics // Curr. Biol. V. 19. № 2. P. 108–114.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


