Вопросы ихтиологии, 2020, T. 60, № 6, стр. 665-681
Динамика разнообразия щиповок рода Cobitis Закавказья в антропогенный период по данным музейных коллекций. I. Морфологическая изменчивость и диагностические признаки C. saniae (Cobitidae)
Е. Д. Васильева 1, *, В. П. Васильев 2
1 Зоологический музей Московского государственного университета
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: vas_katerina@mail.ru
Поступила в редакцию 25.12.2019
После доработки 30.01.2020
Принята к публикации 30.01.2020
Аннотация
С целью выяснения динамики разнообразия щиповок Закавказья в антропогенный период проведено исследование изменчивости морфологических признаков и особенностей окраски, используемых для идентификации вида Cobitis saniae, на материалах коллекции Зоологического музея МГУ, включающей ваучерные выборки с генетически подтверждённым видовым статусом. Выявлена существенная изменчивость многих характеристик на внутривидовом уровне. Показано, что предложенные определительные ключи не позволяют идентифицировать виды C. saniae и C. faridpaki, которые принимаются в статусе криптических аллопатричных видов, дифференцируемых на основе анализа митохондриального генома. Отмечаются признаки, позволяющие дифференцировать C. saniae от обитающих в бассейне Каспийского моря C. taenia и C. melanoleuca и двух видов, известных из водоёмов в пределах современного ареала C. saniae: распространённой в бассейне Кызылагачского залива в 1930-е гг. хвалынской щиповки C. amphilekta и описанного из бассейна Куры нового вида C. derzhavini.
Щиповки рода Cobitis Linnaeus, 1758 представляют собой богатую видами группу мелких вьюновых рыб (Cobitidae, Cypriniformes), распространённых в Европе, Северной Африке и Азии и являющихся объектами многочисленных генетических и таксономических исследований, которые до сих пор приводят к описанию новых таксонов (Nakajima, 2016; Vasil’eva et al., 2016; Eagderi et al., 2017a; Erk’akan et al., 2017; Chen et al., 2018; Freyhof et al., 2018; Özdemir, 2019). Несмотря на высокое видовое разнообразие этих рыб в целом ряде стран (например, в Китае, Греции, Турции, Корее и Иране), вплоть до последнего времени для водоёмов Азербайджана и Грузии приводился лишь один вид, который фигурировал как самостоятельный Cobitis satunini Gladkov, 1935 или как подвид C. taenia Linnaeus, 1758 − C. taenia satunini (Барач, 1941; Абдурахманов, 1962; Касымов, 1965; Казанчеев, 1981; Эланидзе, 1983; Ninua, Japoshvili, 2008; Naseka 2010). Однако выявленное кариологическое разнообразие щиповок Кавказа позволяло рассматривать их в качестве комплексной группы, обособленной от C. taenia (Vasil’ev, Vasil’eva, 1994). Позднее Насека (Naseka, 2010) предположил, что на востоке Закавказья (от бассейна Куры до Сефидруда) обитает не C. satunini, а другой вид щиповок, который он обозначил как C. cf. satunini.
В результате дальнейших исследований из юго-западной части бассейна Каспия были описаны два новых вида щиповок: хвалынская щиповка C. amphilekta Vasil’eva et Vasil’ev, 2012 из Ленкоранского района Азербайджана и C. saniae Eagderi, Jouladeh-Roudbar, Jalili, Sayyadzadeh et Esmaeili, 2017 из провинции Гилан в Иране. Ещё один вид – C. faridpaki Mousavi-Sabet, Vasil’eva, Vatandoust et Vasil’ev, 2011 – был описан из юго-восточной части бассейна Каспия. Анализ филогенетических связей щиповок рода Cobitis Ближнего Востока на основе изменчивости участка митохондриального гена цитохромоксидазы I (COI) (Freyhof et al., 2018) показал, что щиповки р. Арас (= Аракс) (самый большой правый приток Куры) в Армении и Иране конспецифичны иранскому C. saniae. К этому же виду Фрейхоф с соавторами (Freyhof et al., 2018) отнесли мелкую особь (стандартная длина (SL) 45 мм) из р. Цхенисцкали (правый приток р. Риони) выше Самтредиа в Грузии и несколько экземпляров из провинции Карс в Северо-Восточной Турции. Генетический анализ этих рыб не проводился, тогда как другие щиповки из р. Цхенисцкали на основе молекулярно-генетических данных были идентифицированы как C. satunini (Freyhof et al., 2018. P. 29). Присутствие в бассейне Риони двух видов − C. satunini и C. saniae – было продемонстрировано в результате филогенетического анализа западных палеарктических видов рода Cobitis, основанного на изменчивости гена cyt b (Perdices et al., 2018). Проведённый нами анализ изменчивости фрагмента митохондриального гена COI и ядерного гена RAG1 у щиповок из целого ряда популяций, населяющих водоёмы Каспийского бассейна на территории Ирана и Азербайджана и бассейн Чёрного моря на территории Грузии (Vasilyeva et al., 2019), показал, что в настоящее время вид C. saniae широко распространён в бассейне Западного Каспия от р. Сефидруд до Куры. В бассейне среднего течения Куры C. saniae встречается симпатрично с обнаруженным нами новым видом щиповок C. derzhavini Vasil’eva, Solovyeva, Levin et Vasil’ev, 2020, а в речках Ленкоранской низменности он, по-видимому, вытеснил ранее многочисленный вид C. amphilekta. В пробах из бассейна Чёрного моря в Грузии C. saniae мы не обнаружили (Vasilyeva et al., 2019).
Полученные данные по генетическому составу изученных популяций создают основу для реконструкции динамики видового разнообразия щиповок Закавказья в антропогенный период, позволяя использовать для этой цели музейные коллекции, для идентификации которых должна быть разработана адекватная система морфологических видовых диагностических признаков на основе генетически определённых особей. В связи с этой целью мы изучили морфологическую изменчивость щиповок из многочисленных проб в коллекции Зоологического музея МГУ (ЗММУ), собранных в разные годы в Закавказье и из соседних регионов. В настоящем сообщении приводятся данные по изменчивости и распространению C. saniae.
МАТЕРИАЛ И МЕТОДИКА
Исследования внешней морфологии и особенностей окраски щиповок рода Cobitis Закавказья и прилежащих регионов c целью выявления характеристик, пригодных для диагностики видов на музейных коллекциях, проводили на основе выборок с видовой идентификацией, подтверждённой молекулярно-генетическими исследованиями (Vasilyeva et al., 2019; Vasil’eva et al., 2020). Были изучены следующие выборки ваучерных экземпляров, депонированные в Зоологическом музее МГУ (ЗММУ).
C. saniae: P-22310 – 4 экз., пос. Гафтони, Ленкоранский район, Азербайджан, 2010 г., коллектор А. Кидов; Р-23665 – 1 экз., р. Сефидруд, пров. Гилан, Иран, 37°00′36″ с.ш. 49°22′12″ в.д., 08.08.2014 г., коллекторы Васильевы; Р-23666 – 6 экз., р. Сефидруд, пров. Гилан, Иран, 36°30′ с.ш. 49°21′ в.д., 08.08.2014 г., коллекторы Васильевы; P-23668 – 32 экз., р. Сефидруд, пров. Гилан, Иран, 36°30′ с.ш. 49°21′ в.д., 08.08.2014 г., коллекторы Васильевы; P-23669 – 13 экз., р. Сефидруд, пров. Гилан, Иран, 37°00′36″ с.ш. 49°22′12″ в.д., 08.08.2014 г., коллекторы Васильевы; P-23670 – 17 экз., р. Сияку у Тахтакерана, Астаринский район, Азербайджан, сентябрь 2014 г., коллектор А. Кидов; P-23672 – 23 экз., р. Гизум, пров. Гилан, Иран, 37°24′ с.ш. 49°01′48″ в.д., 08.08.2014 г., коллекторы Васильевы; P-24124 – 79 экз., р. Арчиванчай (=Казандашчай) у пос. Арчиван, Астаринский район, Азербайджан, 38°17′24″ с.ш. 48°30′ в.д., 07.06 и 09.06.2018 г., коллекторы Васильевы; P-24125 – 1 экз., Нариманабад-2, канал к морю (Малый Кызылагачский залив), Ленкоранский район, Азербайджан, 38°33′36″ с.ш. 48°32′24″ в.д., 05.06.2018 г., коллекторы Васильевы; P-24126 – 5 экз., р. Пенсарчай у Сияку, Астаринский район, Азербайджан, 38°21′ с.ш. 48°28′48″ в.д., 06.06.2018 г., коллекторы Васильевы; P-24127 – 13 экз., р. Астара у Астары, Астаринский район, Азербайджан, 38°16′12″ с.ш. 48°28′12″ в.д., 09.06.2018, коллекторы Васильевы; P-24129 – 3 экз., р. Виляшчай у Аркивана, Масаллинский район, Азербайджан, 39°00′43.4″ с.ш. 48°35′48.7″ в.д., 07.10.2012 г., коллекторы Б. Левин и др.; P-24130 – 3 экз., р. Виляшчай, у Аркивана, Масаллинский район, Азербайджан, 39°01′03.8″ с.ш. 48°42′08.9″ в.д., 07.10.2012 г., коллекторы Б. Левин и др.; P-24131 – 4 экз., р. Гёйтепе у Гёйтепе, Джалилабадский район, Азербайджан, 39°07′05.5″ с.ш. 48°35′47.5″ в.д., 06.10.2012 г., коллекторы Б. Левин и др.; P-24132 – 5 экз., р. Акстафа (бассейн Куры) у Киракского Кесемена, Гянджа-Газахский район, Азербайджан, 41°13′38.0″ с.ш. 45°26′14.8″ в.д., 05.10.2012 г., коллекторы Б. Левин и др.; P-24133 – 1 экз., р. Болгарчай у Шорбачи, Джалилабадский район, Азербайджан, 39°25′34.3″ с.ш. 48°28′35.59″ в.д., 06.10.2012 г., коллекторы Б. Левин и др.; P-24134 – 4 экз., р. Болгарчай, у Шорбачи, Джалилабадский район, Азербайджан, 39°27′36.4″ с.ш. 48°39′01.0″ в.д., 06.10.2012 г., коллекторы Б. Левин и др.
C. derzhavini: P-24183 – 17 экз., приток р. Кара-су у Цадохлы, Гянджа-Газахский район, Азербайджан, 41°22′48.6″ с.ш. 45°09′24.5″ в.д., 04.10.2012 г., коллекторы Б. Левин и др.; P-24184 – 1 экз., приток р. Кара-су у Цадохлы, Гянджа-Газахский район, Азербайджан, 41°22′48.6″ с.ш. 45°09′24.5″ в.д., 04.10.2012 г., коллекторы Б. Левин и др.; P-24187 – 2 экз., р. Кара-су у Ниязы, Гянджа-Газахский район, Азербайджан, 41°16′51.2″ с.ш. 45°09′24.5″ в.д., 04.10.2012 г., коллекторы Б. Левин и др.; P-24201 – 1 экз., р. Акстафа у Киракского Кесемена, Гянджа-Газахский район, Азербайджан, 41°13′38.0″ с.ш. 45°26′14.8″ в.д., 05.10.2012 г., коллекторы Б. Левин и др.
C. faridpaki: P-23656 – 20 экз., р. Баболруд, пров. Мазандаран, Иран, 36°24′ с.ш. 52°42′ в.д., 10.08.2014 г., коллекторы H. Mousavi-Sabet и др.; P-23671 – 11 экз., р. Теджен, пров. Мазандаран, Иран, 36°18′10″ с.ш. 53°10′57″ в.д., коллекторы H. Mousavi-Sabet и др.
Помимо проб с видовой принадлежностью, подтверждённой генетическим анализом, исследованы также типовые экземпляры.
C. faridpaki (паратипы): P-22694 – 2 экз., р. Сиахруд, пров. Мазандаран, Иран, 36°15′36″ с.ш. 52°33′36″ в.д., 07.08.2009 г., коллекторы H. Mousavi-Sabet, S. Vatandoust.
C. amphilekta (паратипы, сборы Я.И. Гинзбурга из Ленкоранского района Азербайджана): P-3737 – 2 экз., Каспийское море против старого русла р. Кумбаши, 08.06.1937 г.; P-3741 – 4 экз., Каспийское море у Порта Ильича, 02.06.1937 г.; P-3751 – 6 экз., между селениями Кызылагач и р. Кумбаши, 26.09.1936 г.; P-22795 – 5 экз., р. Кумбаши, ст. 100, 03.07.1937 г.
C. satunini (сборы К.А. Сатунина в Грузии 30.07.1906 г.): P-2852 – голотип, низовья р. Кинтриш; P-2313 – 2 экз. (паратипы), низовья р. Кинтриш, Кобулети.
Изменчивость морфологических признаков C. saniae и видовой состав локальных популяций щиповок изучали на следующих пробах из коллекции ЗММУ. Все пробы переопределены первым автором настоящей публикации; полученные из Интернета координаты населённых пунктов и водоёмов и дополнительная информация даны в скобках.
C. saniae (сборы Я.И. Гинзбурга из Азербайджана): P-3732 – 19 экз., Джильское озеро (Ленкоранская низменность, 38о47′36″ с.ш. 48°45′59″ в.д.), 13.09.1937 г.; P-3733 – 1 экз., р. Хирмандали (= Хырмандалы), ниже селения Хирмандали (39°31′34″ с.ш. 48°33′23″ в.д.), Билясуварский район, 18.04.1937 г.; P-3734 – 6 экз., р. Виляшчай у устья, Масаллинский район, 21.06.1937 г.; P-3735 – 3 экз., р. Хирмандали, Билясуварский район, 18.04.1937 г.; P-3736 – 9 экз., р. Хирмандали, Кызылагачский залив, Билясуварский район, 22.06.1937 г.; P-3738 – 13 экз., Джильское озеро у ракуши, 12.06.1937 г.; P-3739 – 3 экз., р. Виляшчай “у Мосолов” (Масаллы? 39°01′06″ с.ш. 48°40′01″ в.д.), Масаллинский район, 20.06.1937 г.; P-3743 – 11 экз., Джильское озеро у ракуши, 12.06.1937 г.; P-3750 – 4 экз., р. Виляшчай, Масаллинский район, 16.04.1937 г.; P-3753 – 16 экз., р. Кумбаши (=Гумбаши) (впадает в Малый Кызылагачский залив, ~39°01′ с.ш. 48°40′ в.д.), 06.06.1937 г.; P-3769 – 3 экз., р. Хирмандали, 18.04.1937 г.; P-3770 – 1 экз., р. Кумбаши у рыбзавода, 06.06.1937 г.; P-3771 – 2 экз., р. Акуша (39°36′30″ с.ш. 48°58′ в.д., Сальянский район) 25.06.1937 г.; P-3774 – 1 экз., Арбатан-Марышлы (39°35′41″ с.ш. 48°57′56″ в.д − 39°34′52″ с.ш. 48°55′21″ в.д., Сальянский район), 21.06.1932 г.; P-3784 – 12 экз., р. Силовор (?), Южный Каспий, 04.08.1932 г.; P-24198 – 2 экз., р. Кумбаши, 11.04.1934 г. (выделены из пробы Р-3786 C. amphilekta).
C. saniae (остальные сборы): Р-2277 – 1 экз., р. Акстафа, с. Каравансарай, б. Елизаветпольской губернии (ныне Агстафинский район Азербайджана, Елизаветполь=Гянджа, 40°40′58″ с.ш. 46°21′38″ в.д), коллектор К.А. Сатунин; P-3740 – 2 экз., р. Кергери, Восточное Закавказье (бассейн Южного Каспия на участке от Астары до Энзели, Иран), 14.08.1932 г., коллектор Я.И. Гинзбург; P-24179 – 16 экз., Малый Кызылагачский залив, Азербайджан, 09-11.05.1985 г., коллектор В.П. Васильев; P-24180 – 12 экз., Малый Кызылагачский залив, у Нариманабад-2, 20-24.04.1982 г., коллектор В.П. Васильев; P-24197 – 1 экз., Большой Кызылагачский залив, 20.04.1982 г., коллектор В.П. Васильев; P-24199 − 7 экз., р. Алвады (=Алвади-чай, Масаллинский район), Азербайджан, 25.04.1982 г., коллектор В.П. Васильев; P-24200 – 6 экз., р. Виляшчай, Азербайджан, 25.04.1982 г., коллектор В.П. Васильев.
При составлении карты распространения C. saniae (рис. 1) также использованы молекулярные данные по изученным экземплярам (Vasil’eva et al., 2020) из р. Алазань у селения Матани в Кахетии, Грузия (42°03′32″ с.ш. 45°14′03″ в.д.) и из р. Куракчай у Надиркенда, Гянджа-Газахский район Азербайджана (40°39′31″ с.ш. 46°37′53″ в.д.).
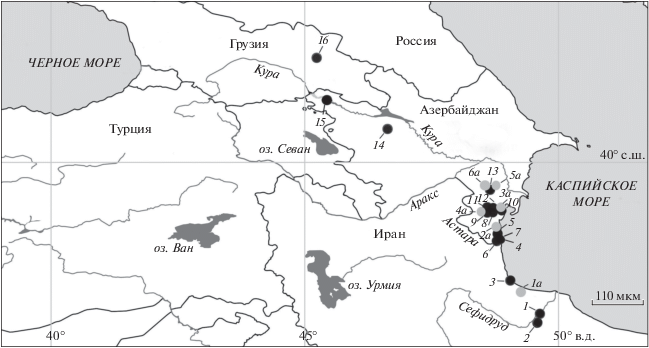
Рис. 1.
Локализация изученных популяций Cobitis saniae: (⚫) − ваучерные выборки, использованные для молекулярно-генетического анализа (Vasilyeva
et al., 2019): 1, 2 – р. Сефидруд, 3 – р. Гизум, 4 – р. Арчиванчай, 5 – р. Пенсарчай, 6 − р. Астара, 7 – р. Сияку; 8, 9 – р. Виляшчай, 10 – Малый Кызылагачский залив (Нариманабад), 11 – р. Гёйтепе, 12 − пос. Гафтони, 13 – р. Болгарчай, 14 – р. Куракчай, 15 – р. Акстафа, 16 − р. Алазань; ( ) − популяции, изученные только по признакам внешней морфологии и окраски: 1а – р. Кергери, 2а − Джильское озеро, 3а – р. Кумбаши, 4а – р. Алвады, 5а − р. Акуша, 6а – р. Хирмандали. Масштаб: 110 км.
) − популяции, изученные только по признакам внешней морфологии и окраски: 1а – р. Кергери, 2а − Джильское озеро, 3а – р. Кумбаши, 4а – р. Алвады, 5а − р. Акуша, 6а – р. Хирмандали. Масштаб: 110 км.
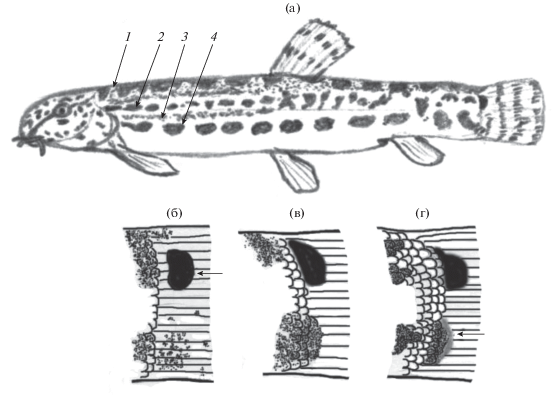
Во всех выборках анализировали признаки, обычно используемые для диагностики разных видов рода Cobitis: окраску (сохранилась не у всех особей из старых коллекций), форму нижней губы, чешуи, органа Канестрини у самцов, относительную длину усиков, развитие кожистых килей на хвостовом стебле (Васильева, 1988; Mousavi-Sabet et al., 2011; Freyhof et al., 2018; Vasil’eva et al., 2020); измеряли общую длину тела (TL). При изучении изменчивости окраски руководствовались общей схемой Гамбетты (Gambetta, 1934), включающей четыре полосы пигментации на теле, начиная с Z1 (узкая полоса мелких пятен непосредственно под серединным дорсальным рядом крупных пятен) до Z4 (средний боковой ряд пятен) (рис. 2а). При оценке структуры пятен у основания хвостового плавника выделяли два пигментных слоя: поверхностный (на коже) и более глубокий (подкожный) (по: Saitoh, Aizawa, 1987) (рис. 2б−2г). У ряда особей подсчитывали число лучей в плавниках, считая два последних ветвистых луча спинного и анального плавников, причленяющихся к одному птеригофору, как “1½" (Kottelat, Freyhof, 2007). Аналогично считали два сближенных последних ветвистых луча (нормально развитый и недоразвитый) в парных плавниках.
Рис. 2.
Зоны пигментации Гамбетты (1−4) у самки Cobitis saniae TL 61 мм из Малого Кызылагачского залива (а) и варианты изменчивости пигментации у основания хвостового плавника у конспецифичных особей из той же выборки Р-24179: с одним чёрным овальным пятном в верхнем (кожном) слое верхней части основания плавника (б–в) и с тёмным пятном, просвечивающим через кожный покров из глубокого (подкожного) слоя в нижней части основания плавника (г) (←).
На нескольких выборках изучали изменчивость 23 морфометрических признаков, обычно применяемых в исследованиях по щиповкам (Васильева, 1988; Vasil’eva et al., 2016, 2020). Для статистического анализа характеристик использовали стандартные унивариантные методы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При описании вида C. saniae в качестве диагностических признаков были указаны: наличие единственного органа Канестрини в грудном плавнике самцов; большое, почти округлое или овальное чёрное пятно в верхней части основания хвостового плавника; 13−23 крупных тёмно-коричневых пятна, по размеру превышающих диаметр глаза, в Z4; маленькая фокальная зона на субдорсальных чешуях; удлинённая горизонтальная часть эктоптеригоида (Eagderi et al., 2017a). Из сравнительных замечаний можно также почерпнуть, что у C. saniae у основания хвостового плавника только одно пятно; на жаберной крышке имеется почти отчётливая полоса Z4; у самцов в Z4 16−17 (модальное значение – 16), а у самок 13−23 (21) крупных пятен; на хвостовом стебле имеются низкие прерывающиеся кили; линия соединения пластинки органа Канестрини и причленённого луча широкая (Eagderi et al., 2017a). В последующем обзоре видов щиповок Ближнего Востока (Freyhof et al., 2018) в качестве диагностических признаков C. saniae указываются: широкое соединение пластинки органа Канестрини с лучом грудного плавника, форма чешуи, сильно пигментированная щека между глазом и жаберной крышкой и наличие низких килей на хвостовом стебле. В ключах для черноморских видов также указывается, что у C. saniae пятна Z4 горизонтально вытянутые, часто очень густо сидящие и сливающиеся в короткие или более длинные полоски перед началом спинного плавника (Freyhof et al., 2018).
В результате проведённого нами исследования вышеперечисленных признаков на материалах из коллекции ЗММУ, идентифицированных в настоящей работе как C. saniae, с подтверждением таксономического статуса данными молекулярно-генетического анализа и последующей экстраполяцией диагностических характеристик на генетически не изученные выборки были получены следующие результаты по внутривидовой изменчивости морфологических структур, окраски и габитуса особей.
Форма чешуи. У всех изученных особей C. saniae субдорсальные чешуи с очень маленькой (точечной у взрослых рыб) фокальной зоной, сильно смещённой к краю чешуи, как указано в описании вида (Eagderi et al., 2017a. Fig. 7). Обычно чешуи имеют вытянутую форму, редко − более или менее округлую (например, у крупной самки из р. Акстафа – Р-2277, TL 87 мм), иногда – округлую со слабо смещённой фокальной зоной, как у двух самок из р. Болгарчай (Р-24134, 4 экз.), у всех 4 экз. из р. Гёйтепе (Р-24131) и у молоди из рек Сефидруд (Р-23668, Р-23669, всего 25 экз. TL 31.0–45.0 мм), Хирмандали (Р-3733 и Р-3769, 4 экз. TL 23.5–37.0 мм), Акуша (Р-3771, 2 экз. TL 34.0 и 35.5 мм), Кумбаши (Р-3753, Р-3770, Р-3786, всего 18 экз. TL 21.0–43.0 мм), Силовор (Р-3784, 12 экз. TL 29.0–41.0 мм), из речек в районе Арбатан-Марышлы (Р-3774, TL 41.5 мм) и Сияку (Р-23670, TL 31.0–45.0 мм). При этом величина отношения диаметра фокальной зоны к наибольшему диаметру чешуи у молоди варьирует от 0.2–0.4 (чешуи промерены у особей из Сефидруда TL 34.0–35.0 мм) до 0.19–0.23 (особи из Сефидруда TL 43.0–44.0 мм). У взрослых рыб чешуя крупная, сильно вытянутая к внешнему концу с отношением величины фокальной зоны к наибольшему диаметру 0.08–0.09 и меньше. Как следует из этих данных, по форме чешуи C. saniae существенно отличается от обитающих в бассейне Каспийского моря C. amphilekta, C. taenia и C. melanoleuca Nichols, 1925, у которых отношение диаметра фокальной зоны к наибольшему диаметру чешуи составляет ≥1/3, но сходен с C. satunini, C. faridpaki и новым видом щиповок C. derzhavini, описанным нами из бассейна нижнего течения Куры (Васильева, 1984; Freyhof et al., 2018; Vasil’eva et al., 2020; данные настоящей работы).
Пятна у основания хвостового плавника. Одно яркое чёрное почти округлое или полулунное пятно в верхней части основания хвостового плавника обнаружено у всех особей C. saniae из рек Акстафа (Р-24132, 5 экз. TL 54.2–80.5 мм; Р-2277), Гёйтепе, Виляшчай, Алвады (Р-24199, 7 экз.), Кумбаши, Пенсарчай (Р-24162, 5 экз.), Астара (Р-24127, 13 экз.), Кергери Р-3740, 2 экз.), Силовор, из речки в районе пос. Гафтони (Р-22310, 4 экз.) и из Арбатан-Марышлы, у подавляющего большинства особей из Малого Кызылагачского залива (Р-24179 и Р-24180 − у 27 из 28 экз.). Это пятно верхнего слоя кожи у основания хвостового плавника (рис. 2). У одной особи из р. Болгарчай (Р-24133, самец TL 67 мм) оно слабо выражено в отличие от яркого полулунного пятна у остальных особей в пробе (Р-24134, два самца и две самки).
У трёх самых мелких экземпляров из р. Сефидруд (Р-23668, Р-23669, TL 31.0–36.5 мм) наряду с ярким чёрным овальным пятном в верхнем (кожном) слое верхней части основания хвостового плавника, присутствующего у всех остальных особей из р. Сефидруд (Р-23665, Р-23666, Р-23668, Р-23669 − 49 из 52 экз.) (рис. 3), в нижней части хорошо заметно тёмное пятно, просвечивающее через кожный покров из глубокого (подкожного) слоя (рис. 4, 5). Просвечивающее тёмное пятно подкожного слоя в нижней части основания хвостового плавника обнаружено у большей части молоди (7/12 TL 31.0–45.0) и одной мелкой самки (TL 57.0 мм) из речки в районе Сияку (рис. 4б, 5б), у одной самки (1/16, рис. 2г) из Малого Кызылагачского залива (Р-24179). Следы второго пятна в нижней части основания хвостового плавника отмечаются у сильно депигментированной молоди из р. Хирмандали; у самой мелкой особи (TL 23.5 мм) − два полукруглых пятна у основания хвостового плавника одинакового жёлтого цвета (1/4) (рис. 4в). Два пятна одинакового жёлтого цвета обнаружены у одного из 2 экз. молоди из р. Акуша, у 1 экз. молоди (1/18) из р. Кумбаши. Среди щиповок из Джильского озера (Р-3732, Р-3738, Р-3743, 43 экз.) обнаружены две крупные самки (TL 83 и 86 мм) с двумя яркими чёрными полулунными сливающимися пятнами в верхнем (кожном) слое основания хвостового плавника (рис. 3е, 6); ещё у одной самки прослеживаются следы второго пятна в нижней части основания хвостового плавника (рис. 3ж). Заметно второе пятно в нижней части основания хвостового плавника у части особей из р. Арчиванчай (Р-24124). У этих рыб (8/79) обычно в кожном слое нижнее пятно светлее интенсивно чёрного пятна верхней части основания хвостового плавника, по интенсивности окраски оно сходно с пятнами зоны Z4, при этом здесь же обычно просвечивает тёмное пятно из нижнего, подкожного слоя (рис. 3б−3г, 4в, 5в−5д).
Рис. 3.
Изменчивость пигментации у Cobitis saniae из разных популяций: а – р. Сефидруд, самка TL 79 мм, Р-23668; б–г – р. Арчиванчай, Р-24124 (б – самец TL 64.5 мм, в – самец TL 52.0 мм, г – самка TL 82.0 мм); д–ж – Джильское озеро (д – самец TL 88 мм с деформированным грудным плавником, Р-3743; е – самка TL 86 мм, Р-3743; ж – самка TL 84 мм, Р-3732).

Рис. 4.
Молодь Cobitis saniae: а – р. Сефидруд (TL 31–41 мм, Р-23669), б – речка в районе Сияку (TL 31–34 мм, Р-23670), в – р. Арчиванчай (TL 41.5 мм, Р-24124), г – р. Хирмандали (TL 23.5–37.0 мм, Р-3769).

Рис. 5.
Хвостовая часть щиповок Cobitis saniae с тёмным пятном, просвечивающим через кожный покров в нижней части основания хвостового плавника: а – р. Сефидруд, молодь TL 31 мм; б – речка в районе Сияку, молодь TL 31 и 34 мм; в–д – р. Арчиванчай (в – молодь TL 41.5 мм, г – самец TL 64.5 мм, д – самец TL 52.0 мм).

Согласно этим данным, наличие яркого, почти округлого или полулунного чёрного пятна в кожном слое верхней части основания хвостового плавника является стабильным признаком вида C. saniae. Такое же (или более узкое) пятно имеется у C. satunini, C. taenia и C. faridpaki (рис. 7); у C. amphilekta это пятно очень маленькое и узкое, а у C. derzhavini оно отсутствует (Vasil’eva et al., 2020). Второе пятно в кожном слое нижней части основания хвостового плавника у C. saniae встречается в единичных случаях (2 экз. в пробе из Джильского озера), также очень редко (преимущественно у молоди) в нижней части основания хвостового плавника заметно тёмное пятно, просвечивающее через кожный покров из подкожного слоя. Среди видов рода Cobitis из бассейна Каспийского моря только у C. melanoleuca всегда имеются два тёмных пятна (узких, в виде скобок) в основании хвостового плавника, часто сливающихся между собой (Васильева, 1984, 1988; Васильева и др., 1989).
Число пятен в пигментной зоне Z4. У всех особей C. saniae из р. Акстафа пятна крупнее глаза, их число варьирует от 11 до 19; у крупных особей (TL > 70 мм) пятна в передней части тела обычно сливаются. У особей из р. Болгарчай 13–19 пятен, у большинства рыб пятна крупнее глаза, сливаются в передней части, у одного самца (Р-24133) больше глаза только самое последнее пятно. У щиповок из р. Гёйтепе 12–13 крупных пятен (3) или 18 пятен по величине менее глаза (1). У особей из р. Виляшчай 12–20, чаще 16 или 17 пятен (11/25), обычно крупнее глаза, у рыб из Малого Кызылагачского залива 10–19 крупных пятен, модальное значение – 13 (7/28). У мелкой молоди из р. Хирмандали 11–13 пятен, чаще 11 (2/4) (рис. 4г), у более крупных и взрослых особей (TL 45.0–79.0 мм, Р-3735 и Р-3736, 12 экз.) 13–19 пятен, чаще 18 (3). У всех рыб из Джильского озера пятна Z4 крупные, крупнее глаза, у ряда рыб (12/43) частично сливаются в сплошную полосу (рис. 3д, 3е); число пятен (там, где это удалось сосчитать) варьирует от 11 до 20, чаще встречается 15–16 пятен (7). (У некоторых щиповок из Джильского озера имеется дополнительный ряд крупных пятен ниже Z4; обычно линия этих пятен заканчивается не далее уровня окончания брюшного плавника, у 1 экз. пятна доходят до уровня начала анального плавника.)
Часто сливаются крупные пятна в передней части тела у щиповок из р. Арчиванчай (32/79) (рис. 3б−3г); число дискретных (или частично слившихся пятен) варьирует от 9 до 16, чаще встречается 11 (11/54) или 12 (11/54) пятен. У рыб из р. Сефидруд в Z4 от 10 до 18 пятен, чаще 12 (9/52), 13 (9/52) или 14 (8/52), только у мелких рыб эти пятна бывают меньше диаметра глаза (рис. 4а). У щиповок из р. Пенсарчай 13–18 крупных пятен, из р. Астара 13–17, чаще 17 (5/13), из р. Кергери 13–14, из р. Силовор 10–15, чаще 11 (4/12), из района пос. Гафтони 10–12, чаще 11 (2/4), из района пос. Сияку 9–16, чаще 12 (5/17). У щиповок из р. Алвады 11–17 крупных пятен, чаще 13 (2/7); у молоди из р. Акуша 13–14 пятен, у молоди и одного взрослого самца (Р-3786, TL 56.5 мм) из р. Кумбаши 11–17 пятен. У взрослых особей пятна Z4 обычно горизонтально вытянутые, а у молоди – более или менее округлые.
Таким образом, на изученном нами материале значения числа пятен в разных выборках даже ниже показателей типовой серии C. saniae как по общему диапазону, так и по модальным значениям (см. выше), которые в разных пробах лежат в диапазоне 11−17. Тем не менее этот признак не позволяет дифференцировать C. saniae от других видов Каспийского региона, включая и C. faridpaki, для которого в описании (Mousavi-Sabet et al., 2011) в качестве диагностического признака указывалось наличие 25–30 обычно сливающихся мелких (меньше диаметра глаза) пятен. Последующие исследования показали, что число пятен у C. faridpaki варьирует в более широком диапазоне: 14−30 − по данным литературы (Eagderi еt al., 2017b; Freyhof et al., 2018), 11−22 − в выборках ЗММУ из рек Баболруд и Теджен (Р-23656, Р-23671) с генетически подтверждённым статусом (настоящая работа). Кроме этого, у некоторых экземпляров C. faridpaki встречаются пятна, превышающие по размеру диаметр глаза, хотя бы в задней части Z4 (рис. 7a), а среди C. saniae, как было отмечено выше, попадаются особи, у которых пятна меньше диаметра глаза.
Орган Канестрини (=lamina circularis) – костная пластинка в основании 1-го ветвистого луча грудного плавника у самцов рода Cobitis (рис. 8). В описании C. saniae указано, что в отличие от C. faridpaki и C. linea (Heckel, 1847) у этого вида линия соединения пластинки органа Канестрини и причленённого луча широкая (Eagderi et al., 2017a). Авторы конкретно не указывают, что они подразумевают под этой “линией”, очевидно, речь идёт о расстоянии между точками, отмеченными нами стрелками на копии рис. 13 из их работы (рис. 8а). Следует отметить, что этот рисунок выполнен схематично, структура кости и членистость луча не показаны. Кроме этого, нет информации о том, у каких самцов была изучена форма органа Канестрини, сколько их было, и какого размера были особи. Судя по табл. 4 (Eagderi et al., 2017a), в изученной авторами типовой серии присутствовали, по меньшей мере, два самца (среди девяти паратипов); если морфометрический анализ проводили на основе только типовой серии (о чём в табл. 3 авторы не сообщают), то их было не менее 3 экз. SL 49.2–71.8 мм. Измеренная нами по единственному представленному рисунку относительная длина линии соединения пластинки органа и луча составляет 47% длины органа и 114.9% его ширины, измеренных по схеме, представленной на рис. 8б. У изученного нами одного самца из р. Сефидруд (рис. 8б) эти показатели составили соответственно 50.5 и 110.0%, у самца из р. Алвады (рис. 8г) – 29.1 и 53.3%, а в выборке из Малого Кызылагачского залива, демонстрирующей широкую изменчивость формы органа у разных самцов (рис. 8в), варьируют в диапазонах 30.2–46.5 и 85.7–111.1%. Эти данные убедительно демонстрируют высокую изменчивость предложенного Игдери с соавторами (Eagderi et al., 2017a) диагностического признака в разных выборках C. saniae. Более того, параметры органа Канестрини, полученные нами по рисунку из описания C. faridpaki (Mousavi-Sabet et al., 2011. Fig. 4e), очень близки к таковым у C. saniae из р. Алвады: соответственно 25.6 и 55.6%. У нового вида щиповок из бассейна Куры C. derzhavini эти параметры варьируют в диапазонах 36.8−43.4 и 91.7–95.8% (Vasil’eva et al., 2020. Fig. 6b, 13) и полностью укладываются в соответствующие диапазоны в выборке C. saniae из Малого Кызылагачского залива. У одного предварительно изученного нами экземпляра C. satunini из низовьев р. Кинтриш (Р-2851) эти показатели ниже − соответственно 23.9 и 51.6%. Однако они опять же сходны с параметрами самца C. saniae из р. Алвады.
Рис. 6.
Хвостовая часть самки Cobitis saniae из Джильского озера с двумя чёрными полулунными сливающимися пятнами в верхнем слое основания хвостового плавника (TL 85 мм, Р-3743).

Рис. 7.
Самец Cobitis faridpaki из р. Теджен TL 70.5 мм, Р-23671 (а) и его увеличенная хвостовая часть (б).

Рис. 8.
Форма органа Канестрини у самцов Cobitis saniae из разных локальностей: а, б – р. Сефидруд (а – по: Eagderi et al., 2017а; (→) – точки возможной оценки длины соединения пластинки и луча; б − самец TL 55 мм, Р-23668, (→) – промеры длины и ширины органа); в − Малый Кызылагачский залив, TL 49–60 мм, Р-24180; г – р. Алвады, TL 58 мм, Р-24199.
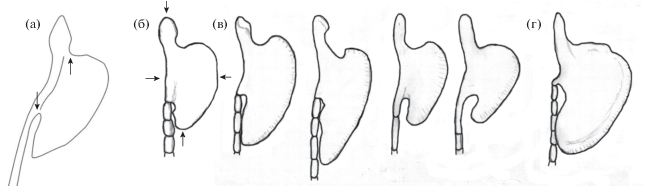
Таким образом, относительная длина соединения пластинки органа Канестрини и причленённого луча, используемая Фрейхофом с соавторами (Freyhof et al., 2018) в ключах для определения щиповок рода Cobitis как Каспийского бассейна, так и бассейна южной части Чёрного моря, не пригодна для идентификации этих видов. В целом, несмотря на выявленную изменчивость формы пластинки у отдельных самцов, относительно широкий, внешне напоминающий топорик, орган Канестрини у C. saniae сходен с таковым у C. satunini и большинства видов рода, известных из бассейна Каспия: C. taenia, C. faridpaki, C. amphilekta и C. derzhavini. От этой группы видов отличается только C. melanoleuca, у которого орган Канестрини с узкой бутылковидной пластинкой (Васильева, 1984, 1988; Васильева и др., 1989).
Ранее мы отмечали, что у описанного нами нового вида щиповок из бассейна Куры, в отличие от C. saniae, пластинка органа Канестрини никогда не достигает 3/4 3-го членика причленённого луча (Vasil’eva et al., 2020). У C. amphilekta она обычно не достигает конца 3-го членика, а у C. taenia, наоборот, как правило, достигает 4−5-го членика причленённого луча (Васильева, Васильев, 2012). В настоящей работе мы изучили изменчивость этого признака на всех выборках C. saniae из коллекции ЗММУ. Наряду с индивидуальными и межпопуляционными различиями можно отметить, что с ростом рыб не только увеличиваются общие размеры органа, но и относительная длина его пластинки. Так у мелких самцов из р. Акстафа (TL ~ 54 мм) пластинка достигает не далее конца 2-го членика причленённого луча, а у крупных самцов доходит до конца 4-го членика. Среди восьми самцов с органом Канестрини из р. Сефидруд у самого мелкого экземпляра (TL 44 мм) пластинка заканчивается, не доходя до начала члеников луча, а у остальных особей достигает от 1/2 2-го (рис. 8б) до конца 3-го членика. У одного из двух мелких самцов из Малого Кызылагачского залива пластинка не доходит до начала члеников луча, у второго достигает уровня 1/3 1-го членика (рис. 8в), а у остальных самцов доходит до конца 2-го членика (4/20) и далее – вплоть до конца 5-го (1/20), чаще заканчиваясь на уровне 3-го членика (7/20). У трёх самцов из р. Болгарчай пластинка доходит до конца 3-го (1) или 4-го (2) членика, у двух самцов из р. Гёйтепе – до конца 4-го или 5-го члеников. У трёх мелких самцов из р. Виляшчай пластинка доходит до конца 2-го членика (Р-3734, TL 39–43 мм), у более крупных самцов (TL ≥ 68 мм) доходит до середины (Р-3750, 2 экз.) или до конца (Р-24200, 2 экз.) 3-го членика; до конца 3-го членика доходит пластинка у единственного взрослого самца из р. Хирмандали, до середины 3-го членика – у единственного взрослого самца из р. Кумбаши. В пробах из Джильского озера обнаружены всего три самца (TL 58–75 мм), у которых пластинка доходит до середины 4-го–до конца 5-го членика, как и у двух самцов из р. Алвады (рис. 8г). У единственного самца из р. Пенсарчай пластинка доходит до конца 3-го членика, а у двух из шести самцов из Астары – до конца 4-го членика, у трёх – до конца 2-го и у одного − до середины 3-го. У одного самца из района Гафтони пластинка доходит до конца 3-го членика, а у второго – до 1/3 5-го; у самца из р. Кергери – до 1/3 4-го. Из 41 самца из р. Арчиванчай только у двух пластинка достигает середины 5-го членика луча, а у трёх доходит только до конца 1-го членика; у большинства рыб она достигает конца 3-го (15) или конца 2-го (9) членика. Таким образом, у большинства крупных самцов (TL ≥ 58 мм) C. saniae пластинка органа Канестрини достигает конца 3-го членика прикреплённого луча и далее. У C. faridpaki наблюдается сходная ситуация. У мелких самцов (TL < 50 мм) пластинка доходит до конца 1-го–конца 2-го членика луча, а у крупных – до конца 3-го членика (3/12) и далее, вплоть до конца 5-го (1/12).
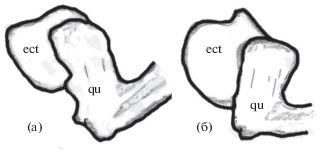
Форма эктоптеригоида. У всех щиповок рода Сobitis есть наружная крыловидная кость (ectopterygoideum) − тонкая косточка, ограничивающая наружный край верхней челюсти между нёбной и квадратной костями (как и у других костистых рыб). Нижний отросток этой изогнутой кости упирается в передний край квадратной кости, а горизонтальный – в верхний край quadratum и в заднекрыловидную кость (metapterygoideum). На профиле головы переднюю и нижнюю часть эктоптеригоида частично перекрывают челюстные кости. Авторы видового описания C. saniae указывают, что для остеологического исследования 8 экз. из р. Сефидруд были очищены, окрашены в соответствии с принятыми методами и изучены с использованием стереомикроскопа, а скелетные элементы они сканировали и иллюстрировали с помощью программного обеспечения (Eagderi et al., 2017а. P. 49). Понятно, что полученные таким образом диагностические признаки вряд ли можно использовать для практической идентификации видов, а также для широкого анализа изменчивости на внутривидовом уровне. При этом качество иллюстраций, полученных авторами в результате такого трудоёмкого процесса, вызывает определённые вопросы, поскольку какая-либо морфологическая структура на всех костных элементах (Eagderi et al., 2017а. Fig. 12, 13 ) отсутствует. Тем не менее мы провели препаровку элементов челюстной дуги у двух крупных самок: C. saniae из р. Сефидруд (TL 73 мм, Р-23669) и C. faridpaki из р. Теджен (TL 80.5 мм, Р-23671). Принципиальных отличий в строении эктоптеригоида мы не обнаружили, хотя у изученного экземпляра C. saniae (рис. 9а) вертикальная часть кости несколько ýже, а горизонтальная – относительно длиннее, чем у изученного экземпляра C. faridpaki (рис. 9б). Однако от рисунков, приведённых для данных видов в работе Игдери с соавторами (Eagderi et al., 2017а. Fig. 12, 13 ), они отличались существенно сильнее, что свидетельствует о значительной внутривидовой изменчивости формы эктоптеригоида и неправомочности её использования в качестве диагностического видового признака.
Рис. 9.
Форма эктоптеригоида у Cobitis saniae (а) и C. faridpaki (б): ect – ectopterygoideum, qu – quadratum.
Пигментация щёчной области. Щёчная область у особей C. saniae с сохранившейся окраской обычно хорошо пигментирована. В задней части жаберной крышки у многих рыб имеется тёмное пятно, похожее на продолжение зоны пигментации тела Z4, или тёмный рисунок в виде знака “>” (рис. 3): у большинства особей из р. Сефидруд (47/52), у всех изученных особей из рек Болгарчай, Арчиванчай и Астара, у единичных особей из Джильского озера и из р. Виляшчай. У других рыб выделяется тёмная полоса, почти параллельная верхнему краю крышечной кости: единичные особи из Сефидруда и из Джильского озера, 2 экз. из р. Алвады, все 6 экз. из проб Р-3739 и Р-24129 из р. Виляшчай. Однако и у изученных нами особей C. faridpaki щёчная область головы хорошо пигментирована (рис. 7а) (Mousavi-Sabet et al., 2011. Fig. 3, 4a, 4b), здесь также можно усмотреть все варианты пигментации, обнаруженные у C. saniae, включая полосу, похожую на продолжение зоны Z4; заметна она и на фотографии C. faridpaki в работе Фрейхофа с соавторами (Freyhof et al., 2018. Fig. 14 ). В этой связи совершенно непонятно происхождение диагностического признака этого вида в их работе: “зона между глазом и жаберной крышкой слабо пигментирована или не пигментирована” в противоположность “сильно пигментированной зоне” C. saniae (Freyhof et al., 2018. P. 8, 29). На изученных нами материалах по C. faridpaki с хорошей сохранностью мы депигментации щёчной области не наблюдали.
Помимо представленных выше характеристик мы проанализировали изменчивость относительной длины мандибулярного усика и степени развития зоны пигментации Z3, также используемые для диагностики видов щиповок (Васильева, Васильев, 1998; Freyhof et al., 2018).
Длина мандибулярного усика. У особей C. saniae из р. Акстафа усик заходит за передний край глаза только у крупной самки (TL 80.5 мм) и самого крупного самца; у остальных рыб (3/5) он не доходит до уровня переднего края глаза, как и у всех рыб из рек Гёйтепе и Пенсарчай и у большинства особей из р. Сефидруд (42/52). У щиповок из Малого Кызылагачского залива ус чаще не доходит до переднего края глаза (14/28), но у единичных самцов доходит до середины глаза (2); у половины особей из р. Хирмандали ус не доходит до переднего края глаза, у единичных рыб − заходит за передний край (2/12). У всех трёх самцов из Джильского озера ус доходит до переднего края глаза, а у большинства самок (TL 59.0–97.5 мм) − не доходит (27/40), как и у особей из рек Алвады (6/7), Виляшчай (11/13). Доходит ус до переднего края глаза у молоди из р. Акуша, у половины самцов из р. Астара и у большинства щиповок из р. Арчиванчай; заходит за передний край глаза – у одного самца из четырёх особей из района Гафтони, у самца и самки из р. Кергери (TL 55.0–55.5 мм). В описании C. saniae указано, что усик (по ошибке назван авторами максиллярным) достигает середины глаза (Eagderi et al., 2017a). В целом усики у C. saniae короткие, как и у многих других видов рода, включая рассматриваемые в настоящей работе C. amphilekta, C. satunini, C. faridpaki, C. taenia, C. derzhavini.
Степень развития пигментной зоны Z3. У всех особей C. saniae из р. Акстафа эта зона пигментации узкая, плохо выражена, доходит не далее уровня окончания брюшного плавника, чаще заканчивается раньше (3/5); доходит она до конца тела только у одного самца из р. Болгарчай (Р-24133), а у остальных рыб заканчивается перед анальным плавником. Среди щиповок из Малого Кызылагачского залива обнаружен один самец с широкой Z3, доходящей до конца тела, у остальных рыб зона узкая, чаще не доходит до анального плавника (10/28) (рис. 2а), у отдельных рыб совсем не развита (2/28). Аналогично широкая зона Z3 доходит до конца тела у одного самца (с 18 пятнами в зоне Z4) из р. Гёйтепе, заканчиваясь на уровне начала брюшного плавника (1) или перед анальным отверстием (2) у остальных особей. У рыб из рек Пенсарчай, Виляшчай и Астара и из района Гафтони Z3 доходит не далее анального отверстия, у обоих экземпляров из р. Кергери – до конца брюшного плавника. Редко доходит Z3 до конца тела у щиповок из Хирмандали (3/16), чаще она видна не далее брюшного плавника (4/16) или совсем не выражена (2/16). Также редко широкая зона Z3 доходит до конца тела у рыб из р. Сефидруд, при этом у наиболее крупных особей (TL 55.0–79.5 мм, 5/12) обычно она не доходит до анального отверстия, а у восьми мелких рыб совсем не выражена. Не выражена зона Z3 у большей части молоди из р. Силовор (10/12), у остальных рыб доходит не далее начала брюшного плавника. У щиповок из р. Арчиванчай Z3 обычно доходит не далее начала анального плавника (77/79), у одной крупной самки совсем не выражена (рис. 3г). У небольшого числа особей из Джильского озера (8/43) Z3 доходит до основания хвостового плавника, сливаясь с Z2 (рис. 3д, 3е), у ряда рыб эта зона полностью отсутствует (7/43), у большинства доходит не далее уровня окончания брюшного плавника (23/43). У большинства щиповок из р. Алвады Z3 доходит не далее анального отверстия, а у одного самца сливается с Z2 на всём протяжении; у молоди из р. Акуша Z3 доходит не далее окончания брюшного плавника или совсем не выражена; у молоди и одного взрослого самца из р. Кумбаши Z3 доходит не далее начала анального плавника или совсем не выражена (1/18). В целом по изменчивости степени развития зоны Z3 C. saniae сходен с C. amphilekta (Васильева, Васильев, 2012). Не менее изменчив по степени развития зоны Z3 и C. faridpaki, о чём свидетельствует сравнительный анализ наших материалов и фотографий из публикаций (Mousavi-Sabet et al., 2011; Eagderi et al., 2017b).
Морфометрические признаки. Морфометрические характеристики C. saniae из трёх популяций представлены в таблице. На основании этих данных можно отметить размерную изменчивость по высоте и толщине тела (H, h, Crm, cr), а также половой диморфизм по высоте спинного плавника (hD) и длине грудного плавника (lP); в некоторых выборках самцы отличаются также большей длиной брюшного плавника (lV). Показатели разных выборок в целом очень близки, часть наблюдаемых небольших различий можно объяснить размерной разнокачественностью выборок.
Некоторые морфометрические признаки щиповки Cobitis saniae из разных водоёмов
| Признак | Кызылагачский залив | Река Алвады | Река Виляшчай | |||
|---|---|---|---|---|---|---|
| Самки (n = 2) |
Самцы (n = 15) |
Самки (n = 4) |
Самцы (n = 7) |
Самки (n = 4) |
Самцы (n = 3) |
|
| TL, мм | $\frac{{54.2{\kern 1pt} --{\kern 1pt} 61.0}}{{57.6}}$ | $\frac{{50.2{\kern 1pt} --{\kern 1pt} 64.8}}{{56.0 \pm 1.02}}$ | $\frac{{43.5{\kern 1pt} --{\kern 1pt} 79.5}}{{69.1}}$ | $\frac{{56.7{\kern 1pt} --{\kern 1pt} 63.0}}{{59.6}}$ | $\frac{{45.7{\kern 1pt} --{\kern 1pt} 56.0}}{{52.4}}$ | $\frac{{42.0{\kern 1pt} --{\kern 1pt} 49.7}}{{45.9}}$ |
| SL, мм | $\frac{{46.6{\kern 1pt} --{\kern 1pt} 53.0}}{{49.8}}$ | $\frac{{42.2{\kern 1pt} --{\kern 1pt} 55.0}}{{47.8 \pm 0.91}}$ | $\frac{{37.0{\kern 1pt} --{\kern 1pt} 68.0}}{{59.6}}$ | $\frac{{48.0{\kern 1pt} --{\kern 1pt} 53.2}}{{50.3}}$ | $\frac{{41.2{\kern 1pt} --{\kern 1pt} 49.0}}{{45.6}}$ | $\frac{{35.7{\kern 1pt} --{\kern 1pt} 42.0}}{{39.2}}$ |
| В % SL | ||||||
| aD | $\frac{{53.7{\kern 1pt} --{\kern 1pt} 54.7}}{{54.2}}$ | $\frac{{51.0{\kern 1pt} --{\kern 1pt} 54.9}}{{52.8 \pm 0.34}}$ | $\frac{{50.4{\kern 1pt} --{\kern 1pt} 53.1}}{{52.4}}$ | $\frac{{47.4{\kern 1pt} --{\kern 1pt} 52.1}}{{50.0}}$ | $\frac{{50.0{\kern 1pt} --{\kern 1pt} 55.7}}{{53.1}}$ | $\frac{{49.0{\kern 1pt} --{\kern 1pt} 50.8}}{{50.1}}$ |
| pD | $\frac{{39.3{\kern 1pt} --{\kern 1pt} 39.8}}{{39.6}}$ | $\frac{{36.5{\kern 1pt} --{\kern 1pt} 41.7}}{{39.1 \pm 0.43}}$ | $\frac{{37.3{\kern 1pt} --{\kern 1pt} 41.1}}{{39.6}}$ | $\frac{{37.0{\kern 1pt} --{\kern 1pt} 43.3}}{{40.9}}$ | $\frac{{35.8{\kern 1pt} --{\kern 1pt} 42.5}}{{38.8}}$ | $\frac{{39.8{\kern 1pt} --{\kern 1pt} 42.0}}{{40.8}}$ |
| aV | $\frac{{55.3{\kern 1pt} --{\kern 1pt} 55.8}}{{55.6}}$ | $\frac{{51.9{\kern 1pt} --{\kern 1pt} 57.3}}{{54.7 \pm 0.43}}$ | $\frac{{48.5{\kern 1pt} --{\kern 1pt} 56.8}}{{53.3}}$ | $\frac{{53.2{\kern 1pt} --{\kern 1pt} 54.7}}{{53.8}}$ | $\frac{{49.4{\kern 1pt} --{\kern 1pt} 53.9}}{{51.7}}$ | $\frac{{52.8{\kern 1pt} --{\kern 1pt} 56.4}}{{54.8}}$ |
| aA | $\frac{{78.3{\kern 1pt} --{\kern 1pt} 81.1}}{{79.7}}$ | $\frac{{77.4{\kern 1pt} --{\kern 1pt} 82.2}}{{79.7 \pm 0.31}}$ | $\frac{{74.4{\kern 1pt} --{\kern 1pt} 81.6}}{{77.8}}$ | $\frac{{77.4{\kern 1pt} --{\kern 1pt} 78.2}}{{77.9}}$ | $\frac{{78.2{\kern 1pt} --{\kern 1pt} 81.1}}{{79.7}}$ | $\frac{{77.5{\kern 1pt} --{\kern 1pt} 80.1}}{{78.5}}$ |
| lpc | $\frac{{13.4{\kern 1pt} --{\kern 1pt} 15.0}}{{14.2}}$ | $\frac{{12.6{\kern 1pt} --{\kern 1pt} 16.3}}{{14.3 \pm 0.29}}$ | $\frac{{13.0{\kern 1pt} --{\kern 1pt} 15.2}}{{14.3}}$ | $\frac{{12.5{\kern 1pt} --{\kern 1pt} 15.3}}{{14.1}}$ | $\frac{{12.6{\kern 1pt} --{\kern 1pt} 14.3}}{{13.6}}$ | $\frac{{14.0{\kern 1pt} --{\kern 1pt} 14.3}}{{14.2}}$ |
| H | $\frac{{14.4{\kern 1pt} --{\kern 1pt} 15.7}}{{15.1}}$ | $\frac{{13.0--{\kern 1pt} {\kern 1pt} 16.9*}}{{15.3 \pm 0.33}}$ | $\frac{{13.2{\kern 1pt} --{\kern 1pt} 18.1}}{{16.0}}$ | $\frac{{14.1{\kern 1pt} --{\kern 1pt} 16.6}}{{15.5}}$ | $\frac{{10.4--18.3}}{{14.4}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 14.3}}{{12.8}}$ |
| h | $\frac{{9.8{\kern 1pt} --{\kern 1pt} 10.3}}{{10.1}}$ | $\frac{{8.5{\kern 1pt} --{\kern 1pt} 10.8*}}{{9.7 \pm 0.20}}$ | $\frac{{8.8{\kern 1pt} --{\kern 1pt} 9.5}}{{9.1}}$ | $\frac{{8.2{\kern 1pt} --{\kern 1pt} 10.9}}{{9.8}}$ | $\frac{{7.6{\kern 1pt} --{\kern 1pt} 10.3}}{{8.5}}$ | $\frac{{7.8{\kern 1pt} --{\kern 1pt} 8.4}}{{8.2}}$ |
| Crm | $\frac{{7.9{\kern 1pt} --{\kern 1pt} 9.2}}{{8.6}}$ | $\frac{{5.6{\kern 1pt} --{\kern 1pt} 9.4{\kern 1pt} *}}{{7.6 \pm 0.33}}$ | $\frac{{7.9{\kern 1pt} --{\kern 1pt} 9.2}}{{8.4}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 8.7}}{{7.7}}$ | $\frac{{4.9{\kern 1pt} --{\kern 1pt} 7.8}}{{6.5}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 7.4}}{{7.2}}$ |
| cr | $\frac{{1.9{\kern 1pt} --{\kern 1pt} 2.2}}{{2.1}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 2.9{\kern 1pt} *}}{{2.0 \pm 0.15}}$ | $\frac{{1.7{\kern 1pt} --{\kern 1pt} 2.2}}{{1.9}}$ | $\frac{{1.4{\kern 1pt} --{\kern 1pt} 2.1}}{{1.9}}$ | $\frac{{1.4{\kern 1pt} --{\kern 1pt} 2.1}}{{1.7}}$ | $\frac{{1.2{\kern 1pt} --{\kern 1pt} 1.3}}{{1.3}}$ |
| P-V | $\frac{{35.3{\kern 1pt} --{\kern 1pt} 36.3}}{{35.8}}$ | $\frac{{30.3{\kern 1pt} --{\kern 1pt} 37.0}}{{33.7 \pm 0.51}}$ | $\frac{{28.7{\kern 1pt} --{\kern 1pt} 34.3}}{{32.7}}$ | $\frac{{31.8{\kern 1pt} --{\kern 1pt} 32.9}}{{32.3}}$ | $\frac{{30.8{\kern 1pt} --{\kern 1pt} 34.5}}{{33.1}}$ | $\frac{{33.9{\kern 1pt} --{\kern 1pt} 36.2}}{{34.8}}$ |
| lP | $\frac{{14.6{\kern 1pt} --{\kern 1pt} 15.1}}{{14.9}}$ | $\frac{{16.0{\kern 1pt} --{\kern 1pt} 23.0}}{{19.8 \pm 0.55}}$ | $\frac{{13.8{\kern 1pt} --{\kern 1pt} 16.2}}{{15.1}}$ | $\frac{{19.0{\kern 1pt} --{\kern 1pt} 21.6}}{{20.2}}$ | $\frac{{12.5{\kern 1pt} --{\kern 1pt} 15.5}}{{14.6}}$ | $\frac{{18.2{\kern 1pt} --{\kern 1pt} 20.5}}{{19.0}}$ |
| lV | $\frac{{11.9{\kern 1pt} --{\kern 1pt} 12.9}}{{12.4}}$ | $\frac{{13.1{\kern 1pt} --{\kern 1pt} 16.9}}{{15.5 \pm 0.28}}$ | $\frac{{11.4{\kern 1pt} --{\kern 1pt} 12.7}}{{12.1}}$ | $\frac{{14.1{\kern 1pt} --{\kern 1pt} 16.3}}{{15.1}}$ | $\frac{{12.9{\kern 1pt} --{\kern 1pt} 14.6}}{{13.7}}$ | $\frac{{13.3{\kern 1pt} --{\kern 1pt} 14.0}}{{13.6}}$ |
| lD | $\frac{{8.6{\kern 1pt} --{\kern 1pt} 10.0}}{{9.3}}$ | $\frac{{8.2{\kern 1pt} --{\kern 1pt} 11.3}}{{9.5 \pm 0.26}}$ | $\frac{{8.2{\kern 1pt} --{\kern 1pt} 10.2}}{{8.9}}$ | $\frac{{8.8{\kern 1pt} --{\kern 1pt} 11.1}}{{9.5}}$ | $\frac{{8.2{\kern 1pt} --{\kern 1pt} 9.2}}{{8.8}}$ | $\frac{{8.4{\kern 1pt} --{\kern 1pt} 9.3}}{{8.8}}$ |
| lA | $\frac{{6.7{\kern 1pt} --{\kern 1pt} 7.9}}{{7.3}}$ | $\frac{{6.8{\kern 1pt} --{\kern 1pt} 8.5}}{{7.3 \pm 0.13}}$ | $\frac{{6.3{\kern 1pt} --{\kern 1pt} 6.8}}{{6.5}}$ | $\frac{{6.5{\kern 1pt} --{\kern 1pt} 7.6}}{{7.0}}$ | $\frac{{5.2{\kern 1pt} --{\kern 1pt} 7.4}}{{6.5}}$ | $\frac{{6.4{\kern 1pt} --{\kern 1pt} 7.3}}{{6.9}}$ |
| hD | $\frac{{12.8{\kern 1pt} --{\kern 1pt} 13.5}}{{13.2}}$ | $\frac{{15.0{\kern 1pt} --{\kern 1pt} 18.4}}{{16.4 \pm 0.33}}$ | $\frac{{12.7{\kern 1pt} --{\kern 1pt} 15.4}}{{13.9}}$ | $\frac{{15.7{\kern 1pt} --{\kern 1pt} 17.9}}{{16.7}}$ | $\frac{{13.9{\kern 1pt} --{\kern 1pt} 17.1}}{{15.4}}$ | 15.8* |
| c | $\frac{{19.7{\kern 1pt} --{\kern 1pt} 21.1}}{{20.4}}$ | $\frac{{19.5{\kern 1pt} --{\kern 1pt} 22.9}}{{21.5 \pm 0.25}}$ | $\frac{{20.5{\kern 1pt} --{\kern 1pt} 21.6}}{{21.0}}$ | $\frac{{20.3{\kern 1pt} --{\kern 1pt} 22.0}}{{20.9}}$ | $\frac{{19.6{\kern 1pt} --{\kern 1pt} 21.9}}{{21.2}}$ | $\frac{{20.2{\kern 1pt} --{\kern 1pt} 20.8}}{{20.6}}$ |
| В % с | ||||||
| lB1 | $\frac{{9.8{\kern 1pt} --{\kern 1pt} 10.7}}{{10.3}}$ | $\frac{{6.9{\kern 1pt} --{\kern 1pt} 17.7{\kern 1pt} *}}{{13.1 \pm 1.06}}$ | $\frac{{6.6{\kern 1pt} --{\kern 1pt} 8.8}}{{7.7}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 8.9}}{{7.9}}$ | $\frac{{7.3{\kern 1pt} --{\kern 1pt} 9.4}}{{8.4}}$ | 4.8* |
| lB3 | $\frac{{15.2{\kern 1pt} --{\kern 1pt} 19.6}}{{17.4}}$ | $\frac{{18.7{\kern 1pt} --{\kern 1pt} 24.2{\kern 1pt} *}}{{21.4 \pm 0.54}}$ | $\frac{{11.4{\kern 1pt} --{\kern 1pt} 17.0}}{{14.2}}$ | $\frac{{9.7{\kern 1pt} --{\kern 1pt} 21.2}}{{15.0}}$ | $\frac{{11.2{\kern 1pt} --{\kern 1pt} 18.8}}{{14.5}}$ | 14.5* |
| ao | $\frac{{38.0{\kern 1pt} --{\kern 1pt} 42.9}}{{40.5}}$ | $\frac{{33.3{\kern 1pt} --{\kern 1pt} 41.7}}{{38.2 \pm 0.67}}$ | $\frac{{32.9{\kern 1pt} --{\kern 1pt} 40.8}}{{37.8}}$ | $\frac{{37.0{\kern 1pt} --{\kern 1pt} 40.7}}{{38.5}}$ | $\frac{{36.5{\kern 1pt} --{\kern 1pt} 39.3}}{{38.2}}$ | $\frac{{36.1{\kern 1pt} --{\kern 1pt} 39.1}}{{37.9}}$ |
| o | $\frac{{16.1{\kern 1pt} --{\kern 1pt} 19.6}}{{17.9}}$ | $\frac{{15.2{\kern 1pt} --{\kern 1pt} 20.9}}{{18.3 \pm 0.52}}$ | $\frac{{14.6{\kern 1pt} --{\kern 1pt} 17.0}}{{15.9}}$ | $\frac{{17.7{\kern 1pt} --{\kern 1pt} 21.0}}{{18.7}}$ | $\frac{{15.6{\kern 1pt} --{\kern 1pt} 21.4}}{{18.0}}$ | $\frac{{15.7{\kern 1pt} --{\kern 1pt} 22.2}}{{18.4}}$ |
| po | $\frac{{53.3{\kern 1pt} --{\kern 1pt} 53.6}}{{53.5}}$ | $\frac{{46.2{\kern 1pt} --{\kern 1pt} 56.1}}{{51.4 \pm 0.69}}$ | $\frac{{51.1{\kern 1pt} --{\kern 1pt} 53.7}}{{52.3}}$ | $\frac{{48.1{\kern 1pt} --{\kern 1pt} 54.7}}{{52.3}}$ | $\frac{{47.1{\kern 1pt} --{\kern 1pt} 54.2}}{{49.4}}$ | $\frac{{47.1{\kern 1pt} --{\kern 1pt} 55.6}}{{51.1}}$ |
| hc | $\frac{{50.9{\kern 1pt} --{\kern 1pt} 52.2}}{{51.6}}$ | $\frac{{45.8{\kern 1pt} --{\kern 1pt} 53.9}}{{49.9 \pm 0.80}}$ | $\frac{{50.7{\kern 1pt} --{\kern 1pt} 53.2}}{{51.5}}$ | $\frac{{49.1{\kern 1pt} --{\kern 1pt} 53.1}}{{50.8}}$ | $\frac{{48.3{\kern 1pt} --{\kern 1pt} 53.1}}{{50.6}}$ | $\frac{{48.2{\kern 1pt} --{\kern 1pt} 55.6}}{{51.8}}$ |
| io | $\frac{{17.9{\kern 1pt} --{\kern 1pt} 19.6}}{{18.8}}$ | $\frac{{11.6{\kern 1pt} --{\kern 1pt} 20.8{\kern 1pt} *}}{{16.6 \pm 0.85}}$ | $\frac{{12.7{\kern 1pt} --{\kern 1pt} 16.1}}{{14.3}}$ | $\frac{{10.6{\kern 1pt} --{\kern 1pt} 16.0}}{{13.3}}$ | $\frac{{12.4{\kern 1pt} --{\kern 1pt} 13.5}}{{13.0}}$ | $\frac{{13.3{\kern 1pt} --{\kern 1pt} 15.3}}{{14.1}}$ |
Примечание. TL, SL – общая и стандартная длина; aD, pD, aV, aA – антедорсальное, постдорсальное, антевентральное и антеанальное расстояния; lpc – длина хвостового стебля, H – наибольшая высота тела перед спинным плавником, h – высота хвостового стебля, Crm – толщина тела на уровне спинного плавника, cr – толщина хвостового стебля, P–V – пектовентральное расстояние; lP, lV – длина грудного и брюшного плавников; lD, lA – длина основания спинного и анального плавников; hD – высота спинного плавника, с – длина головы, lB1 – длина усиков 1-й пары, lB3 – длина мандибулярных усиков (3-я пара), ao – длина рыла, о – горизонтальный диаметр глаза, po – заглазничное расстояние, hс – высота головы на уровне середины глаза, io – межглазничное расстояние. Над чертой − пределы изменчивости, под чертой – среднее значение и его ошибка, n – число исследованных особей, экз.
Сравнение наших данных с приведёнными в описании вида не позволяет использовать статистический анализ, поскольку суммарное число самцов и самок, для которых приведены средние значения, равно 9 (голотип сюда не включён) и вычисление авторами стандартного отклонения не корректно (Eagderi et al., 2017a. Table 3 ). Тем не менее на основе диапазонов изменчивости признаков и приведённых средних значений можно отметить существенные отличия по следующим признакам. В цитируемой работе приводятся явно завышенные значения постдорсального расстояния (pD) с диапазоном изменчивости 45.4−49.9% SL и средними значениями 47.4 и 48.6% у самок и самцов соответственно. По отношению к нашим данным наблюдается явно выраженный хиатус (таблица). По-видимому, авторы измеряли это расстояние от начала, а не от конца основания спинного плавника. В противном случае сумма средних значений предорсального расстояния, длины спинного плавника и постдорсального расстояния, по их данным, будет составлять 109.2% SL для самок и 110.4% SL для самцов. Также вызывают удивление полученные авторами описания практически одинаковые значения длины грудного плавника для самцов и самок: в среднем 12.1% SL у самок и 12.5% у самцов. С отмеченным нами выше половым диморфизмом по этому признаку согласуются фотографии из первоописания (Eagderi et al., 2017a. Fig. 4, 5), где хорошо заметны более длинные грудные плавники у самца из типовой серии по сравнению с паратипами-самками. Небольшие отличия наших данных от данных из первоописания по относительной высоте головы и горизонтальному диаметру глаза могут быть связаны с размерной изменчивостью данных характеристик и межвыборочными различиями по размерам особей. Возможно, размерной изменчивостью обусловлены и значительные отличия по величине межглазничного расстояния, диапазоны изменчивости которого в типовой выборке составляют 20.6–25.0% длины головы. С учётом внутри- и межпопуляционной изменчивости морфометрических признаков можно констатировать отсутствие существенных отличий между разными видами рассматриваемой группы рода Cobitis. Мы не выявили существенных отличий между анализируемыми видами и по числу лучей в плавниках (поэтому полученные данные не приводятся).
Таким образом, проведённый сравнительный анализ ряда морфологических признаков и окраски щиповки C. saniae на обширном материале из коллекции ЗММУ с использованием ваучерных выборок с таксономическим статусом, подтверждённым с помощью молекулярно-генетических исследований, выявил широкую внутривидовую изменчивость характеристик. Показано, что предложенные в качестве диагностических признаков C. saniae протяжённость линии соединения пластинки и причленённого луча органа Канестрини, пигментация щёчной области, число, размеры и форма пятен зоны пигментации Z4 вариабельны на внутри- и межпопуляционном уровнях. Возможность использования какой-либо из этих характеристик для видовой идентификации требует учёта внутривидовой изменчивости, равно как и в случае с формой эктоптеригоида. Совершенно очевидно, что они не пригодны для идентификации особей C. saniae и C. faridpaki (для чего они, собственно, и были предложены), как и более стабильные на внутривидовом уровне характеристики, по которым эти виды сходны (форма чешуи, пигментация основания хвостового плавника, развитие килей на хвостовом стебле, длина усиков, морфометрические характеристики). На основе проведённого анализа C. saniae и C. faridpaki можно рассматривать в качестве криптических аллопатричных видов, дифференцируемых на основе анализа митохондриального генома: величина дистанции между ними для последовательностей участка митохондриального гена COI составляет 2.33% (Eagderi et al., 2017a). Различия эти невелики, а по ядерному гену RAG1 они не дифференцируются: дистанция составляет 0.12% (Vasil’eva et al., 2020). Тем не менее мы не склонны сводить C. saniae в синонимы C. faridpaki. Их репродуктивная изоляция и стабильность в качестве самостоятельных эволюционных единиц с собственной достаточно сложной популяционной структурой поддерживаются географической изоляцией, благодаря которой у близких видов могли не сформироваться чёткие различия по изученным внешним признакам. Совершенно очевидно, что предложенные для дифференциации этой пары видов ключи (Freyhof et al., 2018) не позволяют их диагностировать. Поэтому при разработке региональных определителей щиповок можно предложить включать ареал и менее категоричные формулировки по пигментации зоны Z4: обычно менее 20 крупных пятен, превышающих диаметр глаза, у взрослых особей C. saniae и обычно не менее 20 мелких пятен, меньше диаметра глаза, − у C. faridpaki.
Однако в плане настоящего исследования динамики структуры видового разнообразия щиповок Закавказья представляет интерес возможность дифференцировать C. saniae от других генетически обособленных видов щиповок, известных в настоящее время из водоёмов Кавказа и бассейна Западного Каспия. Как показывают результаты настоящей работы, C. saniae хорошо отличается от описанной из бассейна Малого Кызылагачского залива по сборам 1930-х гг. хвалынской щиповки C. amphilekta: 1) по форме чешуи: с очень маленькой фокальной зоной (~ 1/10 диаметра чешуи у взрослых особей), сильно смещённой к краю чешуи у C. saniae, и с центральным положением большой фокальной зоны (≥1/3 диаметра чешуи) у C. amphilekta; 2) по форме пятна в верхней части основания хвостового плавника: яркое чёрное почти округлое или полулунное пятно у C. saniae и слабо заметное очень маленькое и узкое пятно у C. amphilekta; 3) по форме органа Канестрини: пластинка органа у крупных самцов достигает конца 3-го членика прикреплённого луча и далее у C. saniae и обычно не достигает конца 3-го членика у C. amphilekta. На основе этих различий можно продолжить попытки поиска C. amphilekta в водоёмах современного Азербайджана и в случае находки дать оценку генетических различий этих видов.
От описанного нами из бассейна Куры нового вида C. derzhavini C. saniae отличается по совокупности следующих характеристик: 1) характеру пигментации основания хвостового плавника: у C. derzhavini отсутствует характерное для C. saniae яркое чёрное округлое или полулунное пятно кожного слоя в верхней части основания хвостового плавника; вместо этого у основания хвостового плавника в кожном слое два нечётких пятна, образованных редкими крапинками, на уровне которых просвечивают из подкожного слоя два сливающихся тёмных пятна в виде круглых скобок; 2) по форме органа Канестрини: пластинка органа у C. derzhavini не достигает ¾ 3-го сегмента причленённого луча; 3) по размеру пятен зоны пигментации Z4: обычно крупные, превышающие горизонтальный диаметр глаза у C. saniae и обычно мелкие, по размеру равные или меньше горизонтального диаметра глаза у C. derzhavini. На основе совокупности этих характеристик возможна идентификация особей двух видов в зоне их симпатрии, к настоящему времени обнаруженной нами в р. Акстафа и подтверждённой молекулярно-генетической дивергенцией (Vasil’eva et al., 2020).
Населяющая бассейн северо-западной части Каспия сибирская щиповка C. melanoleuca отличается от C. saniae по форме чешуи (продолговатая с центральной большой фокальной зоной), наличию двух узких скобкообразных пятен у основания хвостового плавника, часто сливающихся, и по форме органа Канестрини (узкий, бутылкообразный). В водоёмах Закавказья этот вид не обнаружен. Не обнаружена здесь и обыкновенная щиповка C. taenia, широко распространённая в бассейне Волги. От C. saniae этот вид хорошо дифференцируется по форме чешуи, которая у него округлая с большой центральной фокальной зоной и диаметр которой составляет ~ 1/3 диаметра чешуи.
В то же время такой важный компонент структуры видового разнообразия щиповок рода Cobitis закавказского региона, как C. satunini, остаётся практически не изученным. Прежнее включение в состав одного вида (подвида) популяций щиповок Грузии, Азербайджана и Ирана размыло его и без того очень нечёткие морфологические и экологические характеристики. В результате в настоящий момент он гораздо лучше исследован на молекулярно-генетическом уровне, чем на классическом таксономическом. В частности, в неоднократно цитируемом обзоре щиповок Ближнего Востока в видовом диагнозе указано только, что он отличается от C. saniae узким прикреплением пластинки органа Канестрини к причленённому лучу и тем, что пятна зоны Z4 перед спинным плавником у него округлой или неправильной квадратной формы (Freyhof et al., 2018. Р. 29). Оба эти признака, как следует из полученных нами данных, варьируют в пределах вида C. saniae. Поэтому вряд ли следует рассчитывать на их стабильность у C. satunini. В этой связи актуальность изучения морфологической изменчивости C. satunini и выявления его диагностических характеристик не вызывает сомнений, тем более что в отличие от ситуаций с аллопатричными видами к настоящему времени уже выявлены случаи обнаружения C. saniae в водоёмах Черноморского бассейна (Perdices et al., 2018), где предположительно должен был обитать лишь вид C. satunini.
В этой связи в следующем нашем сообщении будет представлен анализ изменчивости морфологических характеристик и окраски в разных популяциях C. satunini на основе коллекций ЗММУ и переописание этого вида с учётом современных представлений по таксономии рода Cobitis.
Список литературы
Абдурахманов Ю.А. 1962. Рыбы пресных вод Азербайджана. Баку: Изд-во АН АзССР, 407 с.
Барач Г.П. 1941. Фауна Грузии. Т. 1. Рыбы пресных вод. Тбилиси: Изд-во АН ГрузССР, 281 с.
Васильева Е.Д. 1984. Сравнительный морфологический анализ двух популяций щиповок (род Cobitis, Cobitidae), отличающихся числом пятен у основания хвостового плавника // Вопр. ихтиологии. Т. 24. Вып. 1. С. 43–53.
Васильева Е.Д. 1988. Переописание, морфо-экологическая характеристика и распространение Cobitis granoei (Teleostei, Cobitidae) // Зоол. журн. Т. 67. № 7. С. 1025–1036.
Васильева Е.Д., Васильев В.П. 1998. Виды-двойники в роде Cobitis (Cobitidae). 1. Южнорусская щиповка Cobitis rossomeridionalis sp. nova // Вопр. ихтиологии. Т. 38. № 5. С. 604–614.
Васильева Е.Д., Васильев В.П. 2012. Cobitis amphilekta sp. nova − новый вид щиповки (Cobitidae, Cypriniformes) из бассейна Каспийского моря // Там же. Т. 52. № 2. С. 177–183.
Васильева Е.Д., Осинов А.Г., Васильев В.П. 1989. К проблеме сетчатого видообразования у позвоночных: диплоидно-триплоидно-тетраплоидный комплекс в роде Cobitis (Cobitidae). I. Диплоидные виды // Там же. Т. 29. Вып. 5. С. 705–717.
Казанчеев Е.Н. 1981. Рыбы Каспийского моря. М.: Лег. и пищ. пром-сть, 168 с.
Касымов A.Г. 1965. Гидрофауна нижней Куры и Мингечаурского водохранилища. Баку: Изд-во АН АзССР, 372 с.
Эланидзе Р.Ф. 1983. Ихтиофауна рек и озер Грузии. Тбилиси: Мецниереба, 319 с.
Chen Y.-X., Chen H., He D.-K., Chen Y.-F. 2018. Two new species of the genus Cobitis (Cypriniformes: Cobitidae) from South China // Zool. Systematics. V. 43. № 2. P. 156–168.
Eagderi S., Jouladeh-Roudbar A., Jalili P. et al. 2017a. Taxonomic status of the genus Cobitis Linnaeus, 1758 (Teleostei: Cobitidae) in the southern Caspian Sea basin, Iran with description of a new species // FishTaxa. V. 2. № 1. P. 48–61.
Eagderi S., Jouladeh-Roudbar A., Nasri M., Sayyadzadeh G., Esmaeili H.R. 2017b. Taxonomic status of the genus Cobitis (Teleostei: Cobitidae) in the Namak Lake basin, Iran // Iranian J. Ichthyol. V. 4. № 2. P. 131–139.
Erk’akan F., Özdemir F., Özeren S.C. 2017. Two new species of the genus Cobitis Linnaeus (Teleostei: Cobitidae) from Turkey // FishTaxa. V. 2. № 2. P. 82–89.
Freyhof J., Bayçelebí E., Geiger M. 2018. Review of the genus Cobitis in the Middle East, with the description of eight new species (Teleostei: Cobitidae) // Zootaxa. V. 4535. № 1. P. 001–075.
Gambetta L. 1934. Sulla variabilità del cobite fluviatile (Cobitis taenia) e sul rapporto numerico dei sessi // Boll. Mus. Zool. Anat. Comp. Univ. Torino. V. 44. P. 297–324.
Kottelat M., Freyhof J. 2007. Handbook of European freshwater fishes. Cornol, Switzerland; Berlin, Germany: Kottelat and Freyhof, 646 p.
Mousavi-Sabet H., Vasil’eva E.D., Vatandoust S., Vasil’ev V.P. 2011. Cobitis faridpaki sp. nova – a new spined loach species (Cobitidae) from the southern Caspian Sea basin (Iran) // J. Ichthyol. V. 51. № 10. P. 925–931. .https://doi.org/10.1134/S0032945211100055
Nakajima J. 2016. Cobitis takenoi sp. n. (Cypriniformes, Cobitidae): a new spined loach from Honshu Island, Japan // ZooKeys. V. 568. P. 119–128.
Naseka A.M. 2010. Zoogeographical freshwater divisions of the Caucasus as a part of the West Asian Transitional Region // Proc. Zool. Inst. RAS. V. 314. № 4. P. 469–492.
Ninua N.Sh., Japoshvili B.O. 2008. Check list of fishes of Georgia // Proc. Inst. Zool. Tbilisi. V. 23. P. 163–176.
Özdemir F. 2019. Cobitis fusunae, a new spined loach species (Teleostei: Cobitidae) from the Sultan Marsh, (Kayseri, Turkey) // Hacettepe J. Biol. Chem. V. 46. № 4. P. 593–599. https://doi.org/10.15671/HJBC.2018.265
Perdices A., Ozeren C.S., Erkakan F., Freyhof J. 2018. Diversity of spined loaches from Asia Minor in a phylogenetic context (Teleostei: Cobitidae) // PLoS ONE. V. 13. № 10. Article e0205678. https://doi.org/10.1371/journal.pone.0205678
Saitoh K., Aizawa H. 1987. Local differentiation within the striated spined loach (the striata type of Cobitis taenia complex) // Jpn. J. Ichthyol. V. 34. № 3. P. 334–345.
Vasilev V.P., Vasil’eva E.D. 1994. The karyological diversity in spined loaches from genera Cobitis and Sabanejewia // VIII Congr. Europ. Ichthyol. “Fishes and their environment”. Oviedo, Spain. P. 67.
Vasil’eva E.D., Kim D., Vasil’ev V.P. et al. 2016. Cobitis nalbanti, a new species of spined loach from South Korea, and redescription of Cobitis lutheri (Teleostei: Cobitidae) // Zootaxa. V. 4208. № 6. P. 577–591. https://doi.org/10.11646/zootaxa.4208.6.5
Vasil’eva E.D., Solovyeva E.N., Levin B.A., Vasil’ev V.P. 2020. Cobitis derzhavini sp. nova – a new spined loach species (Teleostei: Cobitidae) discovered in the Transcaucasia // J. Ichthyol. V. 60. № 2. P. 135−153. https://doi.org/10.1134/S0032945220020198
Vasilyeva E.D., Solovyeva E.N., Levin B.A., Vasil’ev V.P. 2019. Taxonomic diversity of spined loaches (Cobitidae: Cobitis) in the Caucasus // Abstr. Front. Mar. Sci. Conference XVI Europ. Congress Ichthyol. Lausanne, Switzerland. P. 242–246.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


