Вопросы ихтиологии, 2021, T. 61, № 4, стр. 441-453
Сравнительная характеристика биологической структуры, состояния запасов и промыслового использования тихоокеанских лососей (Oncorhynchus, Salmonidae) Магаданского региона в конце XX–начале XXI веков
М. Н. Горохов 1, В. В. Волобуев 1, *, А. А. Смирнов 2, 3, А. В. Ямборко 1
1 Магаданский филиал Всероссийского научно-исследовательского института рыбного
хозяйства и океанографии − МагаданНИРО
Магадан, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
3 Северо-Восточный государственный университет − СВГУ
Магадан, Россия
* E-mail: volobuev@magadanniro.ru
Поступила в редакцию 01.06.2020
После доработки 04.09.2020
Принята к публикации 10.09.2020
Аннотация
Проведён сравнительный анализ динамики биологических показателей, подходов и вылова горбуши Oncorhynchus gorbuscha, кеты O. keta и кижуча O. kisutch в Магаданском регионе в течение 1985−2000 и 2001−2019 гг. Показано, что к концу второго периода у трёх рассматриваемых видов произошло синхронное снижение длины, массы тела и плодовитости; у кеты и кижуча отмечена смена доминирующих возрастных групп: возраст обоих видов увеличился. Выявлены особенности динамики подходов горбуши для двух основных районов промысла: зал. Шелихова и Тауйской губы. В конце XX в. они колебались в противофазе по линиям чётных и нечётных лет, в начале XXI в. отмечено доминирование подходов нечётного ряда лет; с 2015 г. урожайными стали подходы по обеим генерациям чётных и нечётных лет. Подходы кеты и кижуча находятся на подъёме. Отмечена утрата промыслового значения Тауйской губы как основного района добычи горбуши и кеты.
Горбуша Oncorhynchus gorbuscha и кета O. keta составляют > 90% общих уловов тихоокеанских лососей в Магаданской области. В годы урожайных подходов горбуши её доля в уловах может достигать 85%, в годы низкой численности − ~30%; в такие годы в уловах, как правило, преобладает в подходах кета − >60%. Кижуч O. kisutch – третий по значимости промысловый вид, доля которого в уловах варьирует от 2 до 7%. Нерку O. nerka добывают в небольших объёмах как прилов при добыче горбуши и ранней формы кеты и как объект любительского рыболовства.
Основные биологические показатели локальных стад лососей (длина и масса тела, возрастной состав, плодовитость и т.д.) не остаются постоянными, они меняются по годам. Считается, что межгодовые изменения этих показателей связаны с колебаниями численности самих популяций и с кумулятивным эффектом воздействия факторов внешней среды (Бирман, 1985; Гриценко, 2002; Кловач, 2003; Савваитова и др., 2003; Crozier et al., 2008; Шунтов, Темных, 2008; Waples et al., 2008; Зорбиди, 2010; Волобуев, Марченко, 2011; Myers et al., 2016; Павлов и др., 2016). Оперативная информация о показателях структуры популяций разных видов лососей в крупных регионах и отдельных реках в конкретный год, соотнесённая с долговременными рядами, позволяет достаточно объективно оценивать состояние локальных стад, заблаговременно выявлять негативные тенденции и принимать адекватные управленческие решения. Причины краткосрочных и долгосрочных колебаний этих параметров до конца не изучены; считается, что первостепенное значение имеют такие факторы, как колебания численности самих популяций, климатические изменения в пресноводных и морских частях ареала видов и популяций (Бирман, 1985; Гриценко, 2002; Кловач, 2003; Савваитова и др., 2003; Шунтов, Темных, 2008; Заволокин, 2014).
В морских водах Северной Пацифики в последние 80−90 лет выявлены несколько климатических сдвигов, которые отражают масштабные изменения атмосферных и океанологических процессов и вызванные ими перестройки в экосистемах поверхностных и шельфовых вод (Mantua, Hare, 2002; Overland et al., 2008; Заволокин, 2014). В течение 1970-х гг. наблюдалась преимущественно пониженная температура поверхности Тихого океана, это был период “холодной эпохи”. С конца 1990-х гг. и по настоящее время, наоборот, температура воды по всей северной части Тихого океана повышается, что привело, в частности, к росту численности некоторых стад тихоокеанских лососей (Azumaya et al., 2007; Abdul-Aziz et al., 2011; Kaeriyama et al., 2014; Myers et al., 2016). Кроме того, повсеместно наблюдается смещение в северном направлении нагульной части ареала почти всех видов лососей, особенно в западной части Тихого океана (Welch et al., 2000; Myers et al., 2007, 2016; Irvine et al., 2009; Abdul-Aziz et al., 2011).
Изменения численности и структуры локальных стад тихоокеанских лососей имеют разнонаправленный характер в разных регионах и причины этих процессов не всегда ясны (Myers et al., 2007; Beamish et al., 2009; Urawa et al., 2016). В настоящее время представляется важным накопление знаний о структуре популяций и состоянии запасов лососей из разных участков их ареала. Наличие точных данных по отдельным речным системам и регионам позволит лучше понимать влияние крупномасштабных климатических изменений и параметров внешней среды в пресных водах и в океанической среде на локальные стада лососей в целом, оценивать перспективы их состояния и разрабатывать более точные прогнозы промысла. В то же время степень изученности лососей в разных регионах не одинакова, поэтому приводимые данные по тихоокеанским лососям материкового побережья Охотского моря представляют собой важное звено в оценке происходящих изменений в азиатской части Северной Пацифики.
В связи с этим цель исследования – анализ тенденций в изменениях важнейших биологических показателей и промысла трёх видов тихоокеанских лососей Магаданского региона на протяжении двух периодов – 1985−2000 и 2001−2019 гг.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в 1985−2019 гг. в нерестовых лососёвых водоёмах Магаданской области в ходе выполняемых МагаданНИРО ежегодных мониторинговых исследований по изучению биологической структуры популяций тихоокеанских лососей. Исторически в регионе структура промысла лососей включает два района − зал. Шелихова и Тауйскую губу; граница между районами проходит по меридиану 153°30ʹ (рис. 1). В течение анадромной миграции горбуши, кеты и кижуча лососей с начала и до её окончания регулярно (раз в пятидневку) брали выборки не менее 100 экз. каждого вида. Рыб отлавливали закидным неводом, плавными и ставными сетями с разным размером ячеи (50 × 50 и 65 × 65 мм). Часть материала получена в период проведения мониторинговых работ на промышленных неводах. Всего в 2001−2019 гг. собрано и обработано 65 777 экз. горбуши, 79 517 экз. кеты и 19076 экз. кижуча. За период 1985−2000 гг. использованы фондовые материалы МагаданНИРО по биологии, подходам и вылову горбуши, кеты и кижуча – соответственно 33 427, 45 170 и 2678 экз.
Рис. 1.
Карта-схема побережья Магаданской области с указанием границы (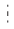 ) между районами промысла тихоокеанских лососей: зал. Шелихова и Тауйская губа.
) между районами промысла тихоокеанских лососей: зал. Шелихова и Тауйская губа.

Для всех рыб выполнен полный биологический анализ: измеряли длину по Смитту (FL) и массу, собирали пробы чешуи для определения возраста, пробы икры для определения абсолютной плодовитости. При сборе и обработке материала использовали общепринятые методы исследований (Правдин, 1966; Глубоковский и др., 2017) и некоторые специальные: численность производителей лососей, пропущенных на нерестилища, определяли методом аэровизуального учёта с применением малой авиации: вертолетов Ми-8, самолетов Ан-2, Альбатрос Л-42 (Остроумов, 1964; Кондюрин, 1965; Евзеров, 1970, 1975; Волобуев и др., 2012). Сведения о вылове лососей получены в Охотском территориальном управлении Росрыболовства и в Управлении “Охотскрыбвод”. Численность подходов лососей определяли в результате суммирования данных о вылове и пропуске рыб на нерестилища.
РЕЗУЛЬТАТЫ
Горбуша. При сравнении основных биологических показателей горбуши двух периодов можно отметить, что в начале XXI в. её средняя длина и масса были больше, чем в конце ХХ в.: 47.7 против 46.3 см, 1.30 против 1.27 кг (табл. 1). Однако к 2019 г. наметилось снижение этих показателей; наиболее резко выражено снижение массы (рис. 2а, 2б). Абсолютная плодовитость горбуши была выше в ХХ в. − в среднем 1530 против 1449 шт. в XXI в. (табл. 1, рис. 2в).
Таблица 1.
Среднемноголетние значения биологических показателей и подходов тихоокеанских лососей (Oncorhynchus) Магаданской области в конце ХХ и в начале XXI вв.
| Показатель | Горбуша | Кета | Кижуч | |||
|---|---|---|---|---|---|---|
| 1985−2000 | 2001−2019 | 1985−2000 | 2001−2019 | 1985−2000 | 2001−2019 | |
| Длина (FL), см | $\frac{{46.3 \pm 0.1}}{{32.0{\kern 1pt} - {\kern 1pt} 65.0}}$ | $\frac{{47.7 \pm 0.2}}{{38.0{\kern 1pt} - {\kern 1pt} 63.8}}$ | $\frac{{62.8 \pm 0.1}}{{41.0{\kern 1pt} - {\kern 1pt} 80.0}}$ | $\frac{{64.4 \pm 0.1}}{{35.0{\kern 1pt} - {\kern 1pt} 83.0}}$ | $\frac{{66.1 \pm 0.1}}{{28.5{\kern 1pt} - {\kern 1pt} 78.0}}$ | $\frac{{64.0 \pm 0.1}}{{0.27{\kern 1pt} - {\kern 1pt} 82.0}}$ |
| Масса, кг | $\frac{{1.27 \pm 0.01}}{{0.40{\kern 1pt} - {\kern 1pt} 3.10}}$ | $\frac{{1.30 \pm 0.02}}{{0.45{\kern 1pt} - {\kern 1pt} 2.52}}$ | $\frac{{3.54 \pm 0.03}}{{1.32{\kern 1pt} - {\kern 1pt} 7.27}}$ | $\frac{{3.36 \pm 0.02}}{{1.03{\kern 1pt} - {\kern 1pt} 7.90}}$ | $\frac{{4.26 \pm 0.03}}{{0.31{\kern 1pt} - {\kern 1pt} 8.12}}$ | $\frac{{3.45 \pm 0.01}}{{0.29{\kern 1pt} - {\kern 1pt} 8.55}}$ |
| Абсолютная плодовитость, шт. | $\frac{{1530 \pm 17}}{{581{\kern 1pt} - {\kern 1pt} 2656}}$ | $\frac{{1449 \pm 15}}{{132{\kern 1pt} - {\kern 1pt} 3372}}$ | $\frac{{2492 \pm 11}}{{585{\kern 1pt} - {\kern 1pt} 9025}}$ | $\frac{{2535 \pm 14}}{{300{\kern 1pt} - {\kern 1pt} 10{\kern 1pt} 332}}$ | $\frac{{4847 \pm 45}}{{520{\kern 1pt} - {\kern 1pt} 19{\kern 1pt} 850}}$ | $\frac{{4307 \pm 54}}{{435{\kern 1pt} - {\kern 1pt} 11{\kern 1pt} 571}}$ |
| Подход, тыс. экз. | 12327 | 11568 | 1658 | 1699 | 78 | 123 |
| Средний возраст, годы | 3.50 | 3.71 | ||||
| Доминирующая группа: | ||||||
| – возраст, лет | 3+ | 4+ | 1.1 | 2.1 | ||
| – доля, % | 47.9 | 52.7 | 54.8 | 73.6 | ||
Рис. 2.
Динамика биологических показателей североохотоморской горбуши Oncorhynchus gorbuscha в конце ХХ–начале XXI вв.: а − длина (FL), б – масса, в – плодовитость; здесь и на рис. 3–7: ( ) – средние значения, (—) – линии тренда, (
) – средние значения, (—) – линии тренда, ( ) − граница веков.
) − граница веков.
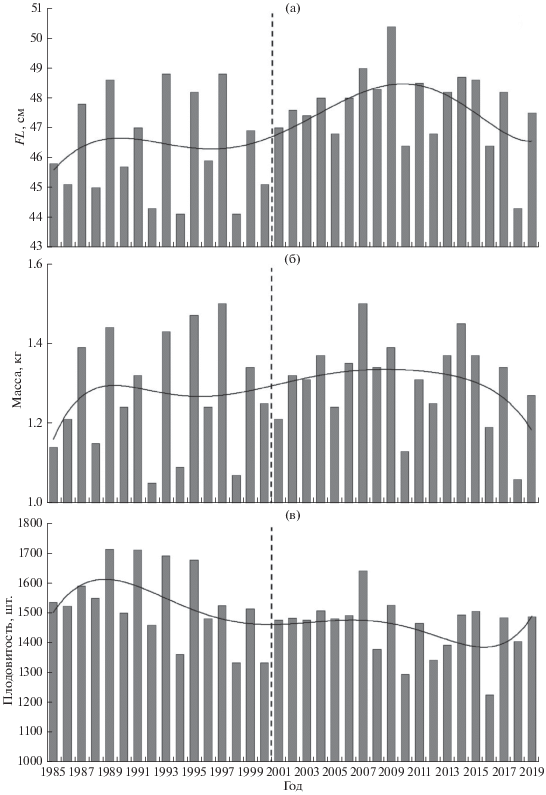
Возможно, такая динамика биологических показателей сопряжена с изменениями величины подходов горбуши к побережью Магаданской области. Установлено, что в годы мощных подходов размерно-весовые показатели лососей снижаются (Volobuev, 2000; Волобуев, Волобуев, 2000). Максимальные после депрессии 1960−1970-х гг. подходы горбуши приходятся на начало 1990-х гг. – >40 млн экз. в 1993 г. (рис. 3а). Затем они вновь снизились. В 2000−2014 гг. наблюдалось резкое снижение подходов горбуши по линии чётных лет, а с 2015 г. наметился чёткий тренд на рост её запасов по обоим рядам поколений. Среднемноголетние величины подходов горбуши в конце ХХ и в начале XXI вв. близки – соответственно 12.3 и 11.6 млн экз. (табл. 1), но максимальный подход в текущем столетии составляет лишь 69.7% зарегистрированного в конце ХХ в. (табл. 2).
Рис. 3.
Динамика подходов (а) и вылова (б) североохотоморской горбуши Oncorhynchus gorbuscha в конце ХХ–начале XXI вв., здесь и на рис. 5: ( ), (—) – Магаданский регион в целом; (◼), (− −) – зал. Шелехова; (◻), (- -) – Тайская
губа.
), (—) – Магаданский регион в целом; (◼), (− −) – зал. Шелехова; (◻), (- -) – Тайская
губа.
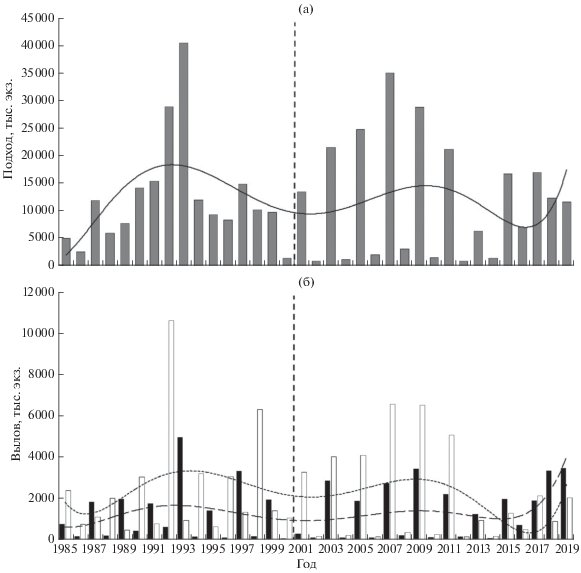
Таблица 2.
Максимальные подходы тихоокеанских лососей (Oncorhynchus), зарегистрированные в Магаданской области в конце ХХ и в начале XXI вв.
| Вид | Максимум ХХ в. | Максимум XXI в. | Доля, % максимума ХХ в. |
||
|---|---|---|---|---|---|
| Год | Подход, тыс. экз. | Год | Подход, тыс. экз. | ||
| Горбуша | 1993 | 40 382 | 2009 | 28 315 | 69.7 |
| Кета | 1966 | 3463 | 2007 | 2473 | 71.4 |
| Кижуч | 1992 | 181 | 2014 | 223 | 123.2 |
Уловы горбуши в конце ХХ в. были выше, но не стабильны (рис. 3б). В 1985−2011 гг. основным промысловым районом на побережье Магаданской области была Тауйская губа. Затем уловы горбуши здесь резко упали, но стали выше в зал. Шелихова. Однако они не достигли уровня добычи, наблюдавшегося в Тауйской губе в начале 1990-х гг. (например, ~10.5 млн экз. в 1992 г.).
При рассмотрении объёма вылова горбуши по линии чётных лет можно видеть, что после 2000 г. наступила депрессия запасов в обоих районах промысла, которая длилась до 2015 г. (рис. 3б). До 2000 г. уловы горбуши в Тауйской губе и зал. Шелихова в соответствии с подходами колебались в противофазе: в чётные годы были выше в Тауйской губе, в нечётные – в зал. Шелихова; они имели сопоставимые величины. После 2000 г. в Тауйской губе произошла смена доминант с чётной на нечётную линию лет; в обоих районах более высокими стали уловы уже в нечётные годы. До 2011 г. уловы были выше в Тауйской губе, но затем они стали нарастать в зал. Шелихова, а в Тауйской губе снизились, и она утратила своё ведущее промысловое значение.
Кета. В конце ХХ в. наблюдалось снижение размерно-весовых показателей кеты − с 65 см и 4.0 кг в середине 1980-х гг. до 61−62 см и 3.2 кг к 2000 г. (рис. 4а, 4б). Затем в первом 10-летии XXI в. произошло увеличение длины при довольно резком снижении массы тела кеты. К 2019 г. продолжилось устойчивое снижение длины до 63 см. В целом в рассматриваемый период более существенно изменялась масса. При сравнении среднемноголених показателей (табл. 1) можно заметить, что в конце ХХ в. при меньшей длине кеты её масса была больше, чем в начале XXI в. (62.8 см и 3.54 кг против 64.4 см и 3.36 кг), т.е. она стала более прогонистой в начале XXI в. Плодовитость кеты снизилась в середине 1990-х гг. с 2600 до 2200 шт., в начале 2000-х гг. опять увеличилась до 2900 шт., а затем до 2019 г. устойчиво снижалась до 2400 шт. (рис. 4в). Снижение плодовитости закономерно связано с уменьшением массы кеты: высокая корреляция между этими показателями показана на примере кижуча (Марченко и др., 2013).
Рис. 4.
Динамика биологических показателей североохотоморской кеты Oncorhynchus keta в конце ХХ–начале XXI вв.: а − длина (FL), б – масса, в – плодовитость.
В начале XXI в. средний возраст кеты в возвратах увеличился на 0.21 года вследствие доминирования возрастной группы 4+, а не 3+, как это было в конце ХХ в. (табл. 1). По сравнению с 1970−1980 гг., когда средний возраст составлял 3.26−3.45 года (Волобуев, Марченко, 2011), в начале XXI в. этот показатель стал выше на 0.26−0.45 года. Это свидетельствует о происходящих нежелательных трансформациях биологической структуры популяций североохотоморской кеты: она стала более тугорослой и менее плодовитой, в подходах стали доминировать рыбы старшего возраста (4+ – до 52.7%) (Горохов и др., 2020). Очевидно, всё это негативно сказывается на скорости созревания и темпе формирования биомассы вида. Значительная часть кеты стала дольше задерживаться в океане для нагула, о чём свидетельствует увеличение среднего возраста до 3.71 года (табл. 1). При этом показатели длины и массы тела кеты стали ниже по сравнению с периодом, когда средний возраст составлял 3.50 года, а в подходах доминировали рыбы более молодой генерации – 3+ (табл. 1).
Средние величины подходов в сравниваемые периоды были сходными (табл. 1), хотя в целом до 1996 г. подходы кеты были выше, чем в XXI в. Максимальный подход в текущем столетии составляет 71.4% зарегистрированного в конце ХХ в. (табл. 2). Снижение подходов кеты на рубеже веков, как мы полагаем, было обусловлено сложной социальной обстановкой в стране в конце 1990-х гг. Как раз в эти годы резко возрос пресс браконьерского лова лососей: изъятие кеты достигало 80−90% подходов в отдельных реках. С 2013 г. наблюдается устойчивый рост подходов (рис. 5а) и уловов (рис. 5б). При этом отмечен рост уловов в зал. Шелихова и их снижение в Тауйской губе.
Рис. 5.
Динамика подходов (а) и вылова (б) североохотоморской кеты Oncorhynchus keta в конце ХХ–начале XXI вв.

Кижуч. С конца 1980-х гг. наблюдается снижение размерно-весовых показателей североохотоморского кижуча (рис. 6а, 6б). Наиболее резкое снижение длины тела (с 68 до 63 см) произошло к 2007−2009 гг.; затем после небольшого подъёма она снизилась ещё более – до 61 см. В динамике массы происходило то же самое: с 4.2 кг в конце 1980-х гг. к 2008 г. она снизилась до 3.2 кг, а после небольшого увеличения опять понизилась почти до 3 кг. Надо заметить, что к 2019 г. произошло довольно резкое снижение этих показателей, особенно массы. Абсолютная плодовитость снижалась к концу ХХ в., затем возросла в начале первого пятилетия XXI в. и опять снизилась (рис. 6в).
Рис. 6.
Динамика биологических показателей североохотоморского кижуча Oncorhynchus kisutch в конце ХХ–начале XXI вв.: а − длина (FL), б – масса, в – плодовитость.

Среднемноголетние значения длины, массы и плодовитости кижуча в начале XXI в. относительно таковых в конце ХХ в. снизились соответственно на 2.1 см, 0.8 кг и 540 икринок (табл. 1). Кроме того, в 1995 г. произошла смена доминирующих возрастных групп: вместо более молодой 1.1 преобладающей стала возрастная группа 2.1. То есть у кижуча, как и у кеты, произошли негативные изменения в биологической структуре подходов: отмечено снижение размерно-весовых показателей и плодовитости.
Подходы кижуча после пиковой величины в 1992 г. (180 тыс. экз.) снизились к концу ХХ в., оставались низкими до 2005 г. и затем значительно увеличились после 2010 г. до 180−220 тыс. экз. (рис. 7а). Максимальный подход кижуча в текущем столетии, в отличие от горбуши и кеты, превышает таковой в конце ХХ в. на 23.2% (табл. 2). Последние три года его подходы находятся на уровне 160−180 тыс. экз., что обеспечивает оптимум пропуска производителей на нерестилища и вылов до 200−240 т. Возможно, что измельчание кижуча и рост подходов связаны между собой.
Рис. 7.
Динамика подходов (а) и вылова (б) североохотоморского кижуча Oncorhynchus kisutch в конце ХХ–начале XXI вв.

Основные запасы кижуча сосредоточены в Тауйской губе; в зал. Шелихова (преимущественно в р. Яма) добывается всего 10−15% общего вылова кижуча в Магаданском регионе, поэтому мы посчитали возможным рассмотреть динамику его вылова в целом по региону. Динамика этого показателя в основном повторяет таковую его подходов: относительно небольшие уловы кижуча до 2005 г. и их устойчивый рост в последующий период (рис. 7б).
В настоящее время состояние запасов кижуча в регионе не вызывает опасений. Они находятся на подъёме, вероятной причиной роста численности подходов может быть искусственное воспроизводство. В начале 2000-х гг. Магаданская область была лидером по объёмам выпуска заводской молоди кижуча на Дальнем Востоке, которые достигали 4−5 млн экз/год. В настоящее время производители кижуча стабильно отмечаются при выполнении авиаучётных работ по оценке численности производителей на нерестилищах в реках зал. Шелихова, хотя и в небольших объёмах – до 3−5 тыс. экз. До 2000 г. производителей кижуча в реках Гижигинской губы в таких объёмах не наблюдалось.
ОБСУЖДЕНИЕ
Синхронное снижение размерно-весовых показателей и плодовитости у всех трёх видов тихоокеанских лососей Магаданского региона и старение популяций кеты и кижуча на протяжении последних лет может косвенно свидетельствовать об ограниченности экологической ёмкости субарктической эпипелагиали экосистемы северо-западной части Тихого океана и напряжённости биоценотических отношений и трофических условий в местах основного нагула азиатских лососей (российских и японских). Вполне вероятно, что обострение пищевой конкуренции как между разными видами массовых стайных морских видов рыб, так и между видами тихоокеанских лососей может оказывать негативное влияние на темп роста и скорость формирования общей биомассы продукции тихоокеанских лососей Магаданской области.
Об этом же свидетельствуют данные других исследователей, связывающих снижение размерно-весовых показателей тихоокеанских лососей с ухудшением трофических условий нагула вследствие роста их общей численности, и кеты в частности, в том числе за счёт искусственного воспроизводства (Helle, Hoffman, 1995, 1998; Ricker, 1995; Bigler et al., 1996; Heаrd, 1998; Гриценко и др., 2001; Кловач, 2003). По данным Хëрда (Heаrd, 1998), общая численность одновременно нагуливающейся неполовозрелой части азиатских и североамериканских стад лососей оценивается в 25 млрд экз., из которых до 25% (5.5−6.0 млрд экз.) составляют искусственно воспроизведённые особи. Подобных концентраций лососей природного и заводского происхождения ранее никогда не было в местах их океанического нагула. Возможно, что высокая плотность лососей в местах их совместного нагула обостряет внутри- и межвидовые конкурентные отношения, включает плотностно-зависимые механизмы регуляции, обусловливающие замедление роста, снижение размерно-весовых показателей и увеличение возраста созревания. При увеличении численности японской кеты, произошедшем в результате высокого объёма её искусственного воспроизводства, уменьшился размер особей в возвратах, чему, по мнению Кэриямы (Kaeriyama, 1989), способствовала плотностно-зависимая связь с ростом, которая может существовать в стадах, между стадами и между видами в океане (Крогиус, 1965; Rogers, 1980; Peterman, 1984, 1991; Ogura et al., 1991).
Такой же точки зрения о влиянии плотностно-зависимых факторов на снижение качественных показателей лососей Канады и США придерживаются и североамериканские исследователи (Batten et al., 2017; Debertin et al., 2017; Jeffrey et al., 2017; Ruggerone, Irvine, 2018). Ряд авторов считают, что влияние океанического плотностно-зависимого фактора, подавляющего рост лососей российского и японского происхождения в океанический период, является одной из основных причин, определяющих снижение их размерно-весовых показателей (Ishida еt al., 1993; Nagasava, 2000; Kaeriyama et al., 2009). По мнению этих авторов, рост численности японской кеты снизил темп роста российской кеты в Северной Пацифике. В настоящее время этот порядок не изменился, только в Северо-Западной Пацифике значительно увеличилась доля российских лососей природного происхождения.
Такого же мнения придерживаются и камчатские учёные. Карпенко с соавторами (2013) подчеркивают, что кета наиболее резко реагировала на возросшую численность лососей, нагуливающихся в морских водах: масса её особей повсеместно снизилась. Особенно чётко это явление прослеживается в Северной Америке и Японии, где средняя масса рыб снизилась на 1.0−1.1 кг (Карпенко и др., 2013). Кроме того, в подходах горбуши в Карагинский район (северо-восток Камчатки) в 2009 г. отмечена аномально низкая средняя масса рыб (Коваль, 2009) при высокоурожайном подходе (~220 млн экз.). При этом автор отмечает снижение обеспеченности пищей горбуши в юго-западной части Берингова моря в 2009 г., что подтверждается двукратным уменьшением индекса наполнения желудков и расширением пищевого спектра. Ранее Андриевская (1966) установила, что в годы высокой численности пищевой спектр горбуши и кеты расширяется, а их средняя масса уменьшается. Это может быть связано с высокой плотностью рыб в местах нагульных скоплений и переходом на питание второстепенными малокалорийными пищевыми объектами.
Согласно представлениям других авторов, в эпипелагиали (0−200 м) Северной Пацифики среднегодовое потребление пищи нектоном составляет 210−327 млн т, а лососи из этого объёма потребляют всего 4−8 млн т макропланктона и мелкого нектона (Шунтов, Темных, 2008, 2011; Шунтов и др., 2017). По оценкам этих авторов, в Беринговом море среднегодовое потребление пищи нектоном составляет от 43.0 до 71.6% биомассы макропланктона в эпипелагиали в разных районах российских вод. Лососи выедают лишь от 1 до 15% общего потребления пищи нектоном в разных районах Охотского, Берингова морей и в тихоокеанских водах (Дулепова, 2002; Чучукало, 2006; Шунтов, Темных, 2008, 2011). По мнению упомянутых авторов, это является аргументом в пользу того, что пищевой фактор в районах нагула тихоокеанских лососей не играет определяющей роли при формировании их продуктивности в морских водах. На этом основывается их вывод о том, что раз суммарное потребление корма лососями от общего его выедания всем нектоном незначительно, то и конкурентные отношения между ними несущественны.
Общая биомасса лососей, обитающих в Северной Пацифике, оценивается на уровне 4−5 млн т (Шунтов и др., 2017). Однако, если исходить из оценки их численности (25 млрд экз.), общая биомасса должна быть намного больше: 25 млрд экз. × × 1.5 кг11 = 37.5 млн т (т.е. оценки различаются в несколько раз). Возможно, этого достаточно для того, чтобы между видами или между особями одного вида при их массовых скоплениях возникла пищевая конкуренция. Кроме того, несмотря на сверхобеспеченность пищей лососей (Шунтов, Темных, 2008, 2011; Шунтов и др., 2017), у отдельных их видов, вероятно, может существовать узкая избирательная специализация в питании (частная пищевая ниша) теми или иными видами макропланктона, в результате чего при большой плотности лососей возможен дефицит такого корма в отдельных районах Северной Пацифики. Конкурентные отношения за пищу между лососями, когда на их долю приходится небольшая часть в общем спектре потребления макропланктона, Карпенко с соавторами (2013) объясняют именно конкуренцией в пределах узкой экологической ниши.
Исследования трофических отношений лососей, а также их отношений с сопутствующими видами рыб и гидробионтов позволили сделать вывод о том, что основное влияние на динамику размерно-весовых показателей тихоокеанских лососей камчатских популяций в последние годы оказывает именно трофический фактор (Karpenko et al., 2007; Karpenko, Koval, 2012; Карпенко и др., 2012). По мнению этих авторов, широкий пищевой спектр лососей-планктофагов, к которым относятся горбуша и кета, в период океанического нагула обусловлен не только адаптационными способностями видов-потребителей, но и напрямую связан с общей численностью отдельных поколений, нагуливающихся совместно, и обычно вызван недостатком тех или иных видов-жертв. При этом авторы отмечают, что многолетние изменения пищевого спектра лососей могли послужить причиной снижения биологических показателей взрослых рыб, а в некоторых случаях и изменения возрастного состава производителей в отдельных районах воспроизводства. Карпенко с соавторами (2013) к основными факторам, регулирующим энергообмен и рост лососей в морских и океанических экосистемах, относят освещённость, температуру воды, размер тела, рацион и его энергетическую ценность, а также пищевые конкурентные отношения.
Считаем, что более логичное объяснение наблюдаемых изменений длины, массы и плодовитости даёт точка зрения, базирующаяся на допущении наличия конкурентных трофических отношений между стадами, видами лососей, а также между лососями и другими массовыми морскими видами рыб в пределах экосистемы Северо-Западной Пацифики, где происходит основной нагул видов и стад азиатских лососей.
Список литературы
Андриевская Л.Д. 1966. Пищевые взаимоотношения тихоокеанских лососей в море // Вопр. ихтиологии. Вып. 6. С. 84−90.
Бирман И.Б. 1985. Морской период жизни и вопросы динамики стад тихоокеанских лососей. М.: Агропромиздат, 208 с.
Волобуев В.В., Волобуев М.В. 2000. Экология и структура популяций как основные элементы формирования жизненной стратегии кеты Oncorhynchus keta континентального побережья Охотского моря // Вопр. ихтиологии. Т. 40. № 4. С. 516−529.
Волобуев В.В., Марченко С.Л. 2011. Тихоокеанские лососи континентального побережья Охотского моря. Магадан: Изд-во СВНЦ ДВО РАН, 303 с.
Волобуев В.В., Мордовин А.И., Голованов И.С. 2012. Методы количественного учета тихоокеанских лососей, применяемые в Магаданской области // Матер. Всерос. науч. конф., посвящ. 80-летнему юбилею КамчатНИРО. Петропавловск-Камчатский: Изд-во КамчатНИРО. С. 296−301.
Глубоковский М.К., Марченко С.Л., Темных О.С., Шевляков Е.А. 2017. Методические рекомендации по исследованию тихоокеанских лососей. М.: Изд-во ВНИРО, 80 с.
Горохов М.Н., Волобуев В.В., Смирнов А.А., Ямборко А.В. 2020. Основные элементы биологической структуры тихоокеанских лососей рода Oncorhynchus (Salmoniformes, Salmonidae) Магаданского региона в начале 21 в. // Вопр. рыболовства. Т. 21. № 2. С. 1−25.
Гриценко О.Ф. 2002. Проходные рыбы острова Сахалин (систематика, экология, промысел). М.: Изд-во ВНИРО, 248 с.
Гриценко О.Ф., Заварина Л.О., Ковтун А.А., Путивкин С.В. 2001. Экологические последствия крупномасштабного искусственного разведения кеты // Мировой океан: использование биологических ресурсов. Вып. 2. М.: Изд-во ВИНИТИ. С. 168−174.
Дулепова Е.П. 2002. Сравнительная биопродуктивность макроэкосистем дальневосточных морей. Владивосток: Изд-во ТИНРО, 273 с.
Евзеров А.В. 1970. К методике аэровизуального учета // Изв. ТИНРО. Т. 71. С. 199−204.
Евзеров А.В. 1975. Оценка погрешностей аэровизуального метода учета лососей // Тр. ВНИРО. Т. 106. С. 82−84.
Заволокин А.В. 2014. Пищевая обеспеченность тихоокеанских лососей в период морского и океанического нагула: Автореф. дис. … докт. биол. наук. Владивосток: ТИНРО-центр, 48 с.
Зорбиди Ж.Х. 2010. Кижуч азиатских стад. Петропавловск-Камчатский: Изд-во КамчатНИРО, 306 с.
Карпенко В.И., Андриевская Л.Д., Коваль М.В. 2012. Роль трофического фактора в формировании продукции тихоокеанских лососей Камчатки в морских водах // Матер. Всерос. науч. конф., посвящ. 80-летнему юбилею КамчатНИРО. Петропавловск-Камчатский: Изд-во КамчатНИРО. С. 165−175.
Карпенко В.И., Андриевская Л.Д., Коваль М.В. 2013. Питание и особенности роста тихоокеанских лососей в морских водах. Петропавловск-Камчатский: Изд-во КамчатНИРО, 304 с.
Кловач Н.В. 2003. Экологические последствия крупномасштабного разведения кеты. М.: Изд-во ВНИРО, 164 с.
Коваль М.В. 2009. Особенности нагула и преднерестовых миграций тихоокеанских лососей в прикамчатских водах летом 2009 г. // Изучение тихоокеанских лососей на Дальнем Востоке. Бюл. № 4. С. 150−158.
Кондюрин В.В. 1965. Некоторые данные по аэровизуальному учету тихоокеанских лососей и обследованию нерестовых рек материкового побережья Охотского моря // Изв. ТИНРО. Т. 59. С. 156−159.
Крогиус Ф.В. 1965. О причинах изменения темпа роста красной Oncorhynchus nerka (Walb.) р. Озерной // Вопр. ихтиологии. Т. 5. Вып. 3. С. 504−517.
Марченко С.Л., Волобуев В.В., Макаров Д.В. 2013. Биологическая структура кижуча Oncorhynchus kisutch (Walbaum) материкового побережья Охотского моря // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 29. Ч. 1. С. 70−83.
Остроумов А.Г. 1964. Опыт применения аэрометодов для оценки заполнения нерестилищ лососями // Лососевое хозяйство Дальнего Востока. М.: Наука. С. 90−99.
Павлов Д.С., Кириллов П.И., Кириллова Е.А. и др. 2016. Состояние биоразнообразия лососёвых рыб и рыбообразных и среды их обитания в бассейне реки Утхолок. М.: Т-во науч. изд. КМК, 197 с.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Савваитова К.А., Кузищин К.В., Груздева М.А. и др. 2003. Долгосрочные и краткосрочные изменения структуры популяций камчатской микижи Parasalmo mykiss из рек западной Камчатки // Вопр. ихтиологии. Т. 43. № 6. С. 789−800.
Чучукало В.И. 2006. Питание и пищевые отношения нектона и нектобентоса в дальневосточных морях. Владивосток: Изд-во ТИНРО-центр, 484 с.
Шунтов В.П., Темных О.С. 2008. Тихоокеанские лососи в морских и океанических экосистемах. Т. 1. Владивосток: Изд-во ТИНРО-центр, 481 с.
Шунтов В.П., Темных О.С. 2011. Тихоокеанские лососи в морских и океанических экосистемах. Т. 2. Владивосток: Изд-во ТИНРО-центр, 473 с.
Шунтов В.П., Темных О.С., Иванов О.А. 2017. Об устойчивости стереотипов в представлениях о морской экологии тихоокеанских лососей (Oncorhyncyus spp.) // Изв. ТИНРО. Т. 188. С. 3−36.
Abdul-Aziz O., Mantua N.J., Myers K.W. 2011. Potential climate change impacts on thermal habits of Pacific salmon (Oncorhynchus spp.) in the North Pacific Ocean and adjacent seas // Can. J. Fish. Aquat. Sci. V. 68. P. 1660−1680.
Azumaya T., Nagasawa T., Temnykh O.S., Khen G.V. 2007. Regional and seasonal differences in temperature and salinity limitation of Pacific Salmon (Oncorhynchus spp.) // NPAFC Bull. № 4. P. 179−187.
Batten S.D., Ruggerone G.T., Ortiz I. 2017. Interannual variability in the feeding and condition of subyearling Chinook salmon off Oregon and Washington in relation to fluctuating ocean conditions // Fish. Oceanogr. V. 26. № 1. P. 1−6.
Beamish R.J., Riddel B.E., Lange K.L. et al. 2009. The effects of climate on Pacific salmon – a summary of published literature // NPAFC Spec. Publ. № 1. 44 p.
Bigler B.C., Welch D.W., Helle J.H. 1996. A review of size trends among North Pacific Salmon (Oncorhynchus spp.) // Can. J. Fish. Aquat. Sci. V. 53. P. 455−465.
Crozier L.G., Hendry A.P., Lawson P.W. et al. 2008. Potential responses to climate change in organisms with complex life histories: evolution and plasticity in Pacific salmon // Evol. Appl. V. 1. № 2. P. 252–270. https://doi.org/10.1111/j.1752-4571.2008.00033.x
Debertin A.J., Irvine J.R., Holt C.A. et al. 2017. Marine growth patterns of southern British Columbia chum salmon explained by interactions between density-dependent competition and changing climate // Can. J. Fish. Aquat. Sci. V. 74. № 7. P. 1077−1087.
Heard W.R. 1998. Do hatchery salmon affect the North Pacific Ocean ecosystem? // NPAFC Bull. № 1. P. 405−411.
Helle J.H., Hoffman M.S. 1995. Size decline and older age at maturity of two chum salmon (Oncorhynchus keta) stocks in western America, 1972–92. Climate change and northern fish populations // Can. Spec. Publ. Fish. Aquat. Sci. V. 121. P. 245–260.
Helle J.H., Hoffman M.S. 1998. Changes in size and age at maturity of two North American stocks of regime shift in the North Pacific Ocean. Assessment and status Pacific Rim salmonid stocks // NPAFC Bull. № 1. P. 81–89.
Irvine J.R., Fukuwaka T., Kaga T. et. al. 2009. Pacific salmon status and abundance trends // NPAFC Doc. № 1199. 153 p.
Ishida Y., Kaeriyama M., McKinnel S., Nagasava K. 1993. Recent Changes in Size of Chum Salmon (Oncorhynchus keta) in the North Pacific Ocean and Possible Causes // Can. J. Fish. Aquat. Sci. V. 50. № 2. P. 290−295.
Jeffrey K.M., Cote I.M., Irvine J.R., Reynolds J.D. 2017. Changes in bode size of Canadian Pacific salmon over six decades // Ibid. V. 74. № 2. P. 191−201.
Kaeriyama M. 1989. Aspects of salmon ranching in Japan // Physiol. Ecol. Jpn. Spec. V. 1. P. 625−638.
Kaeriyama M., Seo H., Kudo H. 2009. Trends in run size and carrying capacity of Pacific salmon in the North Pacific Ocean // NPAFC Bull. № 5. P. 293−302.
Kaeriyama M., Seo H., Qui Y. 2014. Effect of global warming on the life history and population dynamics of Japanese salmon // Fish. Sci. V. 80. № 2. P. 251−260. https://doi.org/10.1007/s12562-013-0693-7
Karpenko V.I., Koval M.V. 2012. Feeding strategies and trends of pink and chum salmon growth in the marine Kamchatka waters // NPAFC Tech. Rept. № 8. P. 82−86.
Karpenko V.I., Volkov A.F., Koval M.V. 2007. Diets of pacific salmon in the Sea of Okhotsk, Bering Sea, and Northwest Pacific Ocean // NPAFC Bull. № 4. P. 105−116.
Mantua N.J., Hare S.R. 2002. The Pacific decadal oscillation // J. Oceanogr. V. 58. P. 35−44.
Myers K.W., Klovatch N.V., Gritsenko O.F. et al. 2007. Stock-specific distributions of Asian and North American salmon in the open ocean, interannual changes, and oceanographic conditions // NPAFC Bull. № 4. P. 159−177.
Myers K.W., Irvine J.R., Logerwell E.A. et al. 2016. Pacific salmon and steelhead: lift in a changing winter ocean // Ibid. № 6. P. 113−138.
Nagasava K. 2000. Winter zooplankton biomass in the subarctic North Pacific, with a discussion on the overwintering survival strategy of Pacific salmon (Oncorhynchus spp.) // Ibid. № 2. P. 21−32.
Ogura M., Ishida Y., Ito S. 1991. Growth variation of coho salmon Oncorhynchus kisutch in the western North Pacific // Nippon Suisan Gakkaishi. № 1089. P. 1098−1093.
Overland J., Rodionov S., Minobe S., Bond N. 2008. North Pacific regime shifts: definitions, issues and recent transitions. // Prog. Oceanogr. V. 77. P. 92−102.
Peterman R.M. 1984. Density-dependent growth in early ocean life of sockeye salmon (Oncorhynchus nerka) // Can. J. Fish. Aquat. Sci. V. 41. P. 1825−1829.
Peterman R.M. 1991. Density-dependent marine processes in North Pacific salmonids: lessons for experimental design of large-scale manipulations of fish stocks // ICES Mar. Sci. Symp. № 192. P. 69−77.
Ricker W.E. 1995. Trends in the average size of Pacific salmon in Canadian catches // Can. Spec. Publ. Fish. Aquat. Sci. V. 121. P. 593−602.
Rogers D.E. 1980. Density-dependent growth of Bristol Day sockeye salmon // Salmonid ecosystems of the North Pacific / Eds. McNeil W.J., Himsworth D.C. Corvallis: Oregon State Univ. Press. P. 267−283.
Ruggerone G.T., Irvine J.R. 2018. Numbers and biomass of natural- and hatchery-origin pink salmon, chum salmon, and sockeye salmon in the North Pacific Ocean, 1925−2015 // Mar. Coast. Fish. V. 10. № 2. P. 152−168. https://doi.org/10.1002./mcf2.10023
Urawa S., Irvine J.R., Kim J.K. et al. 2016. Forecasting Pacific salmon in a changing climate: a review of the 2011−2015 NPAFC science plan. Pacific salmon and steelhead production in a changing climate: past, present, and future // NPAFC Bull. № 6. P. 501−534.
Volobuev V.V. 2000. Long-term changes in the biological parameters of chum salmon of the Okhotsk Sea // Ibid. № 2. P. 175−180.
Waples R.S., Pess G.R., Beechie T. 2008. Evolutionary history of Pacific salmon in dynamic environments // Evol. Appl. V. 1. № 2. P. 189−206. https://doi.org/10.1111/j.1752-4571.2008.00023.x
Welch D.W., Ward B.R., Smith B.D., Eveson J.P. 2000. Temporal and spatial responses of British Columbia steelhead (Oncorhynchus mykiss) populations to ocean climate shifts // Fish. Oceanogr. V. 9. № 1. P. 17−32. https://doi.org/10.1046/j.1365-2419.2000.00119.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


