Вопросы ихтиологии, 2021, T. 61, № 5, стр. 576-582
Исследование аномалий осевого скелета у обыкновенной плотвы Rutilus rutilus (Cyprinidae) системы реки Ангара
Ю. П. Толмачева 1, 2, *, А. С. Сапожников 1, С. Ю. Петухов 1
1 Лимнологический институт Сибирского отделения РАН
Иркутск, Россия
2 Иркутский государственный аграрный университет
Иркутск, Россия
* E-mail: tjul78@mail.ru
Поступила в редакцию 11.06.2020
После доработки 07.08.2020
Принята к публикации 24.08.2020
Аннотация
Представлены результаты сравнительного анализа частоты встречаемости и разнообразия аномалий осевого скелета у плотвы Rutilus rutilus, обитающей на четырёх участках р. Ангара с разным уровнем техногенной нагрузки. Всего обнаружено десять типов аномалий, две из которых встречаются повсеместно. Прослеживается тенденция увеличения доли взрослых особей с аномалиями по мере ухудшения качества поверхностных вод в период их раннего онтогенеза. Максимальная частота встречаемости и разнообразие фенодевиантов отмечены на участках, подверженных хроническому техногенному влиянию (2−3-й класс загрязнения вод).
Байкало-Ангарская водная система включает естественные (оз. Байкал и р. Ангара) и искусственные водоёмы (водохранилища каскада ГЭС) с разным уровнем загрязнения вод. В связи с этим данная гидрологическая сеть представляет интерес для изучения стабильности развития гидробионтов в популяциях, обитающих в градиенте техногенного загрязнения. В качестве наиболее информативных индикаторов качества среды рассматриваются экологически пластичные виды рыб, формирующие многочисленные популяции. Основу ихтиоценов р. Ангара и водоёмов каскада ГЭС составляет обыкновенная плотва Rutilus rutilus, характеризующаяся высоким адаптивным потенциалом (Матвеев, Самусенок, 2009). Плотва обитает повсеместно, практически во всех водоёмах средней полосы Евразии (Атлас …, 2002), что делает этот вид одним из наиболее доступных и информативных объектов биоиндикации.
Традиционно для оценки степени и типа влияния загрязнённой токсичными элементами среды на биоту водного объекта используют показатель частоты встречаемости различных морфологических аномалий у рыб, в том числе разнообразных деформаций скелета. В частности, описана чёткая зависимость возрастания уровня фенодевиаций у молоди рыб в ответ на различные стрессовые факторы во время раннего онтогенеза (Bengtsson, 1975; Кирпичников, 1987; Ванюшина, 1990; Касьянов и др., 2001; Таликина и др., 2005, 2006; Чеботарева, 2009, 2018; Hansen et al., 2010; Yurtseva et al., 2010; Boglione et al., 2013, 2014; Чеботарева и др., 2016; Яблоков, 2018). Исследование характера и частоты проявления аномалий скелетных структур является одним из наглядных и доступных для широкого использования способов оценки состояния популяции. В природных условиях этот метод часто используют для оценки последствий долговременного загрязнения водоёмов и реконструкции воздействия негативных влияний в период раннего онтогенеза индивидуумов, отобранных из естественной среды обитания (Bengtsson, 1975; Crawford, Guarina, 1985; Евланов и др., 1999; Boglione et al., 2001; Sun et al., 2009; Моисеенко и др., 2010; Sfakianakis et al., 2015).
Исследование характера морфологических аномалий у рыб, обитающих на разных участках Байкало-Ангарской водной системы, может послужить инструментом для оценки состояния популяций, а также позволит на основе связи между степенью загрязнения воды и качественными и количественными показателями выявленных аномалий определить критерии качества среды при проведении биологического мониторинга.
Цель работы – изучить разнообразие деформаций осевого скелета и частоту их встречаемости у плотвы в градиенте техногенной нагрузки на разных участках р. Ангара.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования послужили половозрелые особи плотвы в возрасте 3−4 лет. Рыб отлавливали жаберными сетями (ячея 18−28 мм) в летний период 2016−2017 гг. на четырёх участках Ангары (рис. 1, табл. 1). В период раннего онтогенеза отловленных особей (2013−2015 гг.) воды на этих станциях относились к разным классам загрязнения (Государственный доклад, 2014, 2015, 2016). Исследуемые станции (за исключением ст. IV) расположены в черте (I) или в 2 км ниже (II и III) крупных населённых пунктов, в зонах воздействия промышленных и бытовых узлов районного (канализационно-очистные сооружения − КОС) и регионального масштаба (Ангарская нефтехимическая компания, “Усольехимпром”, ТЭЦ). Преобладающими группами поллютантов, содержание которых ежегодно превышает предельно допустимые концентрации (ПДК) в 1.5−2.5 раза, являются: хлорорганические соединения, фенолы, нефтепродукты и тяжёлые металлы (Коваль, 2003; Леонова, Андрулайтис, 2006; Государственный доклад, 2014, 2015, 2016).
Рис. 1.
Карта-схема расположения станций (⚫) в русле Ангары (I−III) и Братском водохранилище (IV), 2016−2017 гг.: I – г. Иркутск, II – г. Ангарск, III – г. Усолье-Сибирское, IV – зал. Обуса. Масштаб: 50 км.

Таблица 1.
Краткая характеристика районов сбора материала и объём исследованных выборок
| Станция | Локация | Расстояние от Иркутской ГЭС, км | Класс загрязнения* | Число рыб, экз. |
|---|---|---|---|---|
| I | р. Ангара, г. Иркутск | 15 | 1 | 64 |
| II | р. Ангара, в 2 км по течению ниже г. Ангарск | 46 | 2 | 52 |
| III | р. Ангара, в 2 км по течению ниже г. Усолье-Сибирское | 90 | 3 | 60 |
| IV | Братское водохранилище (верхний участок), зал. Обуса | 210 | 2 | 65 |
Осевой скелет плотвы препарировали согласно методике, описанной в работе Яковлева с соавторами (1981). Весь остеологический материал был визуализирован с помощью цифрового микроскопа Levenhuk DTX 90. Подсчитывали число позвонков в туловищном (vert.а.), переходном (vert.i.) и хвостовом (vert.c.) отделах, включая позвонки В-еберова аппарата и преуральные 2, 3 (Ядренкина и др., 2005; Чеботарева и др., 2016). К позвонкам переходного отдела относили последние позвонки туловищного отдела, отличающиеся от типичных туловищных наличием развитых парапофизов, а от хвостовых − отсутствием нижнего остистого отростка. Позвонковые фенотипы представлены в виде формулы: vert.а.−vert.i.−vert.c. Подсчитывали число особей, относящихся к определённому фенотипу, и их долю (%).
Типы позвонковых аномалий дифференцировали, руководствуясь принятой в литературе классификацией (Чеботарева, 2009; Bogutskaya et al., 2011; Чеботарева и др., 2016). У каждой особи определяли наличие, число и расположение отдельных видов позвонковых деформаций. Рассчитывали долю особей с аномалиями в каждой выборке (%) и относительное число каждого типа аномалий (% их общего числа). Для описания расположения и вида аномалии в работе приняты буквенно-цифровые обозначения. Туловищный отдел: A1 – раздвоение верхних остистых отростков, A2 – незамкнутая невральная дуга, A3 – раздвоение основания ветви невральной дуги с переносом на соседний позвонок; переходный отдел: I1 – деформация гемальной дуги; хвостовой отдел: С1 – наличие дополнительной ветви невральной и гемальной дуги, C2 – наличие дополнительной ветви невральной дуги, C3 – раздвоение остистого отростка, C4 – сращение нижних остистых отростков соседних позвоноков, C5 – деформация гемальной дуги.
В качестве меры разнообразия позвонковых фенотипов и аномалий внутри выборок использовали индекс (μ) Животовского (1982). Достоверность различий между выборками оценивали с помощью критерия χ2 (с поправкой на непрерывность), взаимосвязь между разными показателями − с применением коэффициента ранговой корреляции Спирмена (Лакин, 1990). Статистическая обработка материала проведена в системе анализа R (Мастицкий, Шитиков, 2014).
РЕЗУЛЬТАТЫ
Остеометрический анализ. Общее число позвонков у исследованных особей плотвы варьирует в характерных для этого вида пределах − 38−41. В туловищном отделе насчитывается 17−20 позвонков, в хвостовом – 17−19, в переходном − 2−6, в основном преобладали вариации 3−4 (70−100%), что отмечалось ранее для плотвы из других водоёмов (Ядренкина и др., 2005). Исключение составила выборка плотвы из района г. Усолье-Сибирское, у которой доминировал (частота встречаемости 61.5%) вариант vert.i. 2, что может быть локальной особенностью морфологической изменчивости в популяции.
В целом во всех исследованных выборках зарегистрированы 23 позвонковых фенотипа. Повсеместно распространён позвонковый фенотип 19−3−19, частота его встречаемости в разных популяциях составляет 20.2−45.1%. На долю каждого из остальных фенотипов приходится не более 5−10%. У плотвы, обитающей на участке реки вблизи г. Усолье-Сибирское, преобладают фенотипы 19−2−19 и 19−2−18 с частотой встречаемости соответственно 30.5 и 15.1%. Как указано выше, эти варианты являются проявлением локального фенотипа с малым числом позвонков в переходном отделе.
Классификация и частота встречаемости аномалий. Все зарегистрированные аномалии были классифицированы на девять типов, относящихся к трём отделам (рис. 2). На всех станциях встречаются два типа позвонковых аномалий туловищного отдела: раздвоение верхних остистых отростков (А3 – 41.4% общего числа аномалий) и незамкнутая невральная дуга (А2 – 11.1%): суммарная встречаемость фенодевиаций туловищного отдела (включая А1) составляет 59.9% всех аномалий (табл. 2).
Рис. 2.
Аномалии строения позвонков разных отделов осевого скелета плотвы Rutilus rutilus р. Ангара. Туловищный отдел: vert.a. – норма, A1 – раздвоение верхних остистых отростков, A2 – незамкнутая невральная дуга, A3 – раздвоение основания ветви невральной дуги с переносом на соседний позвонок; переходный отдел: vert.i. – норма, I1 – деформация гемальной дуги; хвостовой отдел: vert.c. – норма, С1 – наличие дополнительной ветви невральной и гемальной дуги, C2 – наличие дополнительной ветви невральной дуги, C3 – раздвоение остистого отростка, C4 – сращение нижних остистых отростков соседних позвонков, C5 – деформация гемальной дуги.
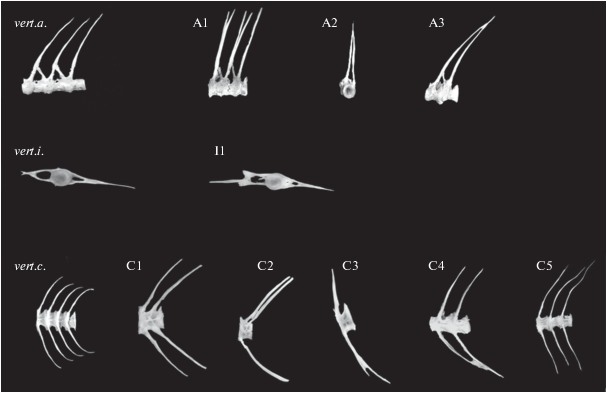
Таблица 2.
Частота встречаемости разных типов позвонковых аномалий, а также показатели разнообразия аномалий и фенотипов позвоночника плотвы Rutilus rutilus на четырёх участках р. Ангара
| Станция | Частота встречаемости, % общего числа аномалий | Доля рыб с аномалиями, % | Число фенотипов | Индексы разнообразия (μ) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| туловищный отдел | переходный отдел | хвостовой отдел | |||||||||||
| А1 | А2 | А3 | I1 | C1 | C2 | C3 | C4 | C5 | аномалий | фенотипов | |||
| I | – | 0.6 | 8.6 | 1.2 | 20.3 | 9 | 1.9 | 8.9 | |||||
| II | 1.9 | 1.9 | 8.6 | 1.9 | 3.1 | 28.1 | 10 | 3.2 | 9.4 | ||||
| III | 3.1 | 5.6 | 12.3 | 3.1 | 3.8 | 6.8 | 6.8 | 51.4 | 11 | 4.7 | 10.0 | ||
| IV | 2.4 | 3.1 | 11.7 | 3.8 | 5.6 | 1.9 | 2.4 | 38.3 | 10 | 4.1 | 9.6 | ||
| Всего | 7.4 | 11.1 | 41.4 | 3.1 | 10.5 | 15.4 | 1.9 | 2.4 | 6.8 | ||||
Морфологические нарушения хвостового отдела более разнообразны − пять типов, составившие в сумме 37.0%. По частоте встречаемости преобладают фенодевианты, характеризующиеся наличием дополнительных ветвей невральной дуги (С2) и гемальной и невральной дуг (С1). В переходном отделе фенодевиации отмечены в единичных случаях. Тяжёлые аномалии в виде позвоночного сжатия, кифоза, лордоза не зарегистрированы.
Прослеживается тенденция увеличения доли рыб с аномалиями вниз по течению Ангары (табл. 2). Минимальное значение (20.3%) зарегистрировано на участке реки, вблизи КОС г. Иркутск, максимальное (51.4%) − на станции в Усольском районе. Вниз по течению, в зал. Обуса Братского водохранилища, этот показатель снижается (38.3%). Установлено, что частота встречаемости фенодевиантных особей положительно коррелирует с показателем разнообразия позвонковых фенотипов (r = 0.81) и аномалий (r = 0.79). В целом вниз по течению р. Ангара разнообразие исследуемых признаков увеличивается.
ОБСУЖДЕНИЕ
В результате воздействия токсикантов на ранний онтогенез рыб разнообразие позвонковых фенотипов и фенодевиаций повышается, что свидетельствует о снижении стабильности развития плотвы. Ранее было установлено, что при воздействии разных внешних факторов зачастую происходит развитие сходных типов аномалий, что свидетельствует о неспецифичности ряда аномалий (Crawford, Guarina, 1985; Lagardère et al., 1993). Соответственно, причины возникновения конкретного вида аномалий остаются открытым вопросом в связи с многообразием потенциальных факторов воздействия и недостаточной изученностью механизмов формирования различных форм отклонений развития (Boglione et al., 2001, 2013; Чеботарева, 2009; Bogutskaya et al., 2011; Чеботарева и др., 2016; Yablokov, 2017; Яблоков, 2018). В целом аномалии позвоночника у исследованных особей аналогичны описанным ранее у плотвы и других видов рыб в естественных и экспериментальных условиях (Yershov, 2008; Чеботарева, 2009, 2018; Lewis-McCrea, Lall, 2010; Bogutskaya et al., 2011; Чеботарева и др., 2016; Яблоков, 2018). Тяжёлые аномалии − анкилоз, кифоз и лордоз – не встречались, что, вероятно, обусловлено стабилизирующим отбором в природных популяциях и гибелью особей с подобными пороками развития на ранних стадиях развития (Кирпичников, 1987; Hilomen-Garcia, 1997; Gavaia et al., 2002, 2009; Esin, 2015; Чеботарева, 2018).
В то же время количественные показатели морфологических аномалий (частота встречаемости и индекс разнообразия) могут служить индикатором качества природной среды (Евланов и др., 1999; Boglione et al., 2001; Sun et al., 2009; Моисеенко и др., 2010; Sfakianakis et al., 2015). Выявленная тенденция увеличения разнообразия фенодевиаций и доли особей плотвы с аномалиями от верхнего участка Ангары вниз по течению соответствует классификации качества поверхностных вод (табл. 1). Очевидно, подавляющий объём загрязнённых сточных вод распределяется на участке реки ниже Иркутска и в верхней части Братского водохранилища.
Наименьшие значения частоты встречаемости рыб с аномалиями (20.3%) и индекса разнообразия (1.9) отмечены в выборке с участка реки вблизи КОС Иркутска, воды которого относятся к условно чистым (1-й класс). Это связано с тем, что в нижнем бьефе Иркутской ГЭС в силу большого и стабильного расхода воды создаются весьма благоприятные условия для разбавления стоков; а способность реки к самоочищению характеризуется как высокая благодаря интенсивному перемешиванию потока и свободному доступу кислорода. Незначительное повышение доли рыб с аномалиями на участке реки в районе Ангарска (28.1%) может быть обусловлено постепенным ухудшением качества вод (1−2-й класс) в результате негативного влияния промышленных узлов (Ангарская нефтехимическая компания, ТЭЦ и др.), которые являются источником загрязнения грунтовых и поверхностных вод нефтепродуктами (Государственный доклад, 2014, 2015, 2016). Полученные результаты в целом соответствуют данным для плотвы и других видов рыб, согласно которым в природных популяциях, обитающих в удовлетворительных условиях, доля особей с морфологическими отклонениями осевого скелета не превышает 18−25% (Чеботарева, 2009; Bogutskaya et al., 2011; Яблоков, 2018).
Однако в условиях техногенного загрязнения частота встречаемости особей с отклонениями развития осевого скелета может значительно возрастать. Например, экспериментально установлено, что при воздействии токсикантов на ранних стадиях развития плотвы число особей с аномалиями увеличивается в 2.5−5.0 раза (Чеботарева, 2009). Очевидно, что возрастание доли особей с фенодевиантами (51.4%) на станции III может свидетельствовать о существенном нарушении стабильности развития плотвы, обитающей на этом участке реки. Наряду с поллютантами верхнего течения Ангары в данной точке отмечается повышенное содержание высокотоксичных соединений ртути, качество поверхностных вод соответствует классу 3 (умеренно загрязнённые) (Государственный доклад, 2014, 2015, 2016). Ртутный электролиз на предприятии “Усольехимпром” был прекращён в 1998 г., но прилежащие речные участки и верхняя часть Братского водохранилища по-прежнему остаются районом повышенной экологической опасности вследствие высокой концентрации ртути в поверхностных донных осадках (Коваль, 2003; Леонова, Андрулайтис, 2006). Несмотря на высокую степень загрязнения отходами промышленных производств, качество воды постепенно улучшается (2-й класс − слабо загрязнённая) благодаря большому объёму воды вниз по течению в зал. Обуса Братского водохранилища, частота встречаемости рыб с фенодевиациями снижается (38.3%). В целом полученные результаты не противоречат концепции, согласно которой в условиях токсического стресса доля особей с морфологическими отклонениями может значительно возрастать.
Техногенный стресс является одним из ведущих факторов, нарушающих естественный процесс развития организма, что проявляется в виде различных деформаций скелета у части особей в популяции. Количественные показатели фенодевиаций − частота встречаемости и индекс разнообразия − коррелируют с уровнем загрязнения среды. В целом на исследуемом участке р. Ангара прослеживается тенденция увеличения взрослых особей с аномалиями из-за ухудшения качества поверхностных вод в период их раннего развития. Учитывая постоянную антропогенную нагрузку на водоёмы Ангаро-Байкальской системы, нарушения развития осевого скелета рыб могут представлять интерес для оценки хронического и отдалённого загрязнения среды. Однако на природном материале не всегда можно определить, что является причиной различий в частоте встречаемости особей с нарушениями развития. Очевидно, что применяемый подход требует дальнейшей корректировки с учётом особенностей условий раннего развития разных возрастных групп.
Список литературы
Атлас пресноводных рыб России в 2 томах. 2002. Т. 2 / Под. ред. Решетникова Ю.С. М.: Наука, 253 с.
Ванюшина О.Г. 1990. Развитие осевого скелета у леща (Abramis brama L.) и плотвы (Rutilus rutilus L.) // Тр. ИБВВ АН СССР. Т. 59. С. 4−9.
Государственный доклад. 2014. О состоянии окружающей среды в Иркутской области в 2013 году. Иркутск: Изд-во ИГ СО РАН, 389 с.
Государственный доклад. 2015. О состоянии окружающей среды в Иркутской области в 2014 году. Иркутск: Форвард, 328 с.
Государственный доклад. 2016. О состоянии окружающей среды в Иркутской области в 2015 году. Иркутск: Время странствий, 316 с.
Евланов И.А., Минеев А.К., Розенберг Г.С. 1999. Оценка состояния пресноводных экосистем по морфологическим аномалиям у личинок рыб. Тольятти: Изд-во ИЭВБ РАН, 38 с.
Животовский Л.А. 1982. Показатели популяционной изменчивости по полиморфным признакам // Фенетика популяций. М.: Наука. С. 38−44.
Касьянов А.Н., Таликина М.Г., Изюмов Ю.Г. и др. 2001. Изменчивость признаков осевого скелета у сеголеток плотвы Rutilus rutilus после воздействия токсических веществ в период раннего индивидуального развития // Вопр. ихтиологии. Т. 41. № 4. С. 495−503.
Кирпичников В.С. 1987. Генетика и селекция рыб. Л.: Наука, 520 с.
Коваль П.В. 2003. Антропогенная компонента и баланс ртути в экосистеме Братского водохранилищ // Докл. РАН. Т. 388. № 2. С. 225–227.
Лакин Г.Ф. 1990. Биометрия. М.: Высш. шк., 352 с.
Леонова Г.А., Андрулайтис Л.Д. 2006. Ртуть в экосистеме Братского водохранилища // Экология промышленного производства. № 1. С. 12–17.
Матвеев А.Н., Самусенок В.П. 2009. Круглоротые (Cyclostomata) и рыбы (Pisces) водоемов бассейна реки Ангара // Аннотированный список фауны озера Байкал и его водосборного бассейна в 2 т. Т. 2. Новосибирск: Наука. С. 396−416.
Мастицкий С.Э., Шитиков В.К. 2014. Статистический анализ и визуализация данных с помощью R. (http://r-analytics.blogspot.com)
Моисеенко Т.И., Гашев С.Н., Селюков А.Г. и др. 2010. Биологические методы оценки качества вод. Ч. 1. Биоиндикация // Вестн. ТГУ. Экология и природопользование. № 7. С. 20−40.
Таликина М.Г., Изюмов Ю.Г., Чеботарева Ю.В. 2005. Отдаленные ответы сеголеток плотвы Rutilus rutilus на действие низких концентраций хлорофоса в период раннего индивидуального развития // Вопр. ихтиологии. Т. 45. № 4. С. 548−553.
Таликина М.Г., Комов В.Т., Чеботарева Ю.В., Гремячих В.А. 2006. Комплексная оценка длительного воздействия ртути на молодь плотвы Rutilus rutilus в экспериментальных условиях // Там же. Т. 44. № 6. С. 847−852.
Чеботарева Ю.В. 2009. Аномалии в строении позвоночника у сеголеток плотвы Rutilus Rutilus (Cyprinidae, Cypriniformes) после воздействия токсикантов на ранние стадии развития // Там же. Т. 49. № 1. С. 102−110.
Чеботарева Ю.В. 2018. Аномалии позвоночника и позвонковые фенотипы у сеголеток и двухлеток плотвы Rutilus rutilus (L.) (Cyprinidae, Cypriniformes), развившихся из одной выборки эмбрионов // Тр. ИБВВ РАН. Т. 84 (87). С. 58−67. https://doi.org/10.24411/0320-3557-2018-10019
Чеботарева Ю.В., Изюмов Ю.Г., Крылов В.В. 2016. Особенности строения позвоночника сеголеток Rutilus rutilus (Cyprinidae) после раздельного и совместного воздействия магнитного поля и повышенной температуры на эмбрионы и их связь с размерными показателями рыб // Вопр. ихтиологии. Т. 56. № 3. С. 345−355. https://doi.org/10.7868/S0042875216030036
Яблоков Н.О. 2018. Морфологические аномалии скелета у молоди рыб р. Качи (бассейн среднего Енисея) в градиенте техногенной нагрузки // Вестн. ТГУ. № 41. С. 156−173. https://doi.org/10.17223/19988591/41/9
Ядренкина Е.Н., Интересова Е.А., Ядренкин А.В., Хакимов Р.М. 2005. К вопросу о пространственной дифференциации популяций карповых рыб озера Чаны (Западная Сибирь) // Сиб. экол. журн. Т. 12. № 2. С. 293−304
Яковлев В.Н., Изюмов Ю.Г., Касьянов А.Н. 1981. Фенетический метод исследований популяций карповых рыб // Биол. науки. № 2. С. 98−101.
Bengtsson B.E. 1975. Vertebral damage in fish induced by pollutants // Sublethal effects of toxic chemicals on aquatic animals / Eds. Koeman J.H., Strik J.J.T.W.A. Amsterdam: Elsevier Sci. Publ. Co. P. 23−30.
Boglione C., Gagliardi F., Scardi M., Cataudella S. 2001. Skeletal descriptors and quality assessment in larvae and post-larvae of wild-caught and hatchery-reared gilthead sea bream (Sparus aurata L. 1758) // Aquaculture. V. 192. № 1. P. 1−22. https://doi.org/10.1016/S0044-8486(00)00446-4
Boglione C., Ginsbert E., Gavaia P. et al. 2013. Skeletal anomalies in reared European fish larvae and juveniles. Part 2: main typologies, occurrences and causative factors // Rev. Aquacult. V. 5. № 1. P. 121−167. https://doi.org/10.1111/raq.12016
Boglione C., Pulcini D., Scardi M. et al. 2014. Skeletal anomaly monitoring in rainbow trout (Oncorhynchus mykiss, Walbaum 1792) reared under different conditions // PLoS ONE. V. 9. № 5. P. 1−17. https://doi.org/10.1371/journal.pone.0096983
Bogutskaya N.G., Zuykov M.A., Naseka A.M., Anderson E.B. 2011. Normal axial skeleton structure in common roach Rutilus rutilus (Actinopterygii: Cyprinidae) and malformations due to radiation contamination in the area of the Mayak (Chelyabinsk Province, Russia) nuclear plant // J. Fish Biol. V. 79. № 4. P. 991−1016. https://doi.org/10.1111/j.1095-8649.2011.03078.x
Crawford R.B., Guarina A.M. 1985. Effects of environmental toxicants on development of a teleost embryo // Bull. Environ. Pathol. Toxicol. Oncol. V. 6. № 2. P. 123−130.
Esin E.V. 2015. Developmental abnormalities in salmonids (Salmonidae) under the conditions of large-scale volcanic pollution of their spawning ground (using dolly varden Salvelinus malma as an example) // Rus. J. Devel. Biol. V. 46. № 2. P. 88−98. https://doi.org/10.1134/S1062360415020046
Gavaia P.J., Dinis M.T., Cancela M.L. 2002. Osteological development and abnormalities of the vertebral column and caudal skeleton in larval and juvenile stages of hatchery-reared Senegal sole (Solea senegalensis) // Aquaculture. V. 211. P. 305–323. https://doi.org/10.1016/S0044-8486(02)00167-9
Gavaia P.J., Domingues S., Engrola S. et al. 2009. Comparing skeletal development of wild and hatchery-reared Senegalese sole (Solea senegalensis, Kaup 1858): evaluation in larval and postlarval stages // Aquacult. Res. V. 40. P. № 14. 1585–1593. https://doi.org/10.1111/j.1365-2109.2009.02258.x.
Hansen T., Fjelldal P.G., Yurtseva A. et al. 2010. A possible relation between growth and number of deformed vertebrae in Atlantic salmon (Salmo salar L.) // J. Appl. Ichthyol. V. 26. № 2. P. 355−359. https://doi.org/10.1111/j.1439-0426.2010.01434.x
Hilomen-Garcia G.V. 1997. Morphological abnormalities in hatchery-bred milkfish (Chanos chanos Forsskal) fry and juveniles // Aquaculture. V. 152. № 1. P. 155–166. https://doi.org/10.1016/ S0044-8486(96)01518-9
Lagardère F., Boulhic M., Bürgin T. 1993. Anomalies in the cephalic area of laboratory-reared larvae and juveniles of the common sole, Solea solea: oral jaw apparatus, dermal papillae and pigmentation // Environ. Biol. Fish. V. 36. № 1. P. 35−46. https://doi.org/10.1007/BF00005978
Lewis-McCrea L.M., Lall S.P. 2010. Effects of phosphorus and vitamin C deficiency, vitamin A toxicity and lipid peroxidation on skeletal abnormalities in Atlantic halibut (Hippoglossus hippoglossus) // J. Appl. Ichthyol. V. 26. № 2. P. 334−343. https://doi.org/10.1111/j.1439-0426.2010.01431.x
Sfakianakis D.G., Renieri E., Kentouri M., Tsatsakis A.M. 2015. Effect of heavy metals on fish larvae deformities: a review // Environ. Res. V. 137. P. 246−255. https://doi.org/10.1016/j.envres.2014.12.014
Sun P.L., Hawkins W.E., Overstreet R.M., Brown-Peterson N.J. 2009. Morphological deformities as biomarkers in fish from contaminated rivers in Taiwan // Int. J. Environ. Res. Public Health. V. 6. № 8. P. 2307−2331. https://doi.org/10.3390/ijerph6082307
Yablokov N.O. 2017. Skeletal anomalies in juveniles of Siberian grayling Thymallus arcticus (Pallas, 1776) from the Mana River (Middle Yenisei River system) under artificial and natural reproduction // J. Sib. Fed. Univ. Biol. V. 10. № 3. P. 343−357. https://doi.org/10.17516/1997-1389-0030
Yershov P.N. 2008. The vertebral abnormalities in eelpout Zoarces viviparus (Linnaeus, 1758) (Pisces, Zoarcidae) // Proc. Zool. Inst. RAS. V. 312. № 1/2. P. 74−82.
Yurtseva A., Lajus D., Artamonova V., Makhrov A. 2010. Effect of hatchery environment on cranial morphology and developmental stability of Atlantic salmon (Salmo salar L.) from North-West Russia // J. Appl. Ichthyol. V. 26. № 2. P. 307–314. https://doi.org/10.1111/j.1439-0426.2010.01427.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


