Вопросы ихтиологии, 2021, T. 61, № 5, стр. 553-575
Жилой кижуч Oncorhynchus kisutch в азиатской части ареала. К вопросу о пресноводной компоненте в структуре вида
Е. А. Кириллова 1, *, П. И. Кириллов 1, А. М. Малютина 2, К. В. Кузищин 1, 2, М. А. Груздева 2, Д. С. Павлов 1, 2
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
2 Московский государственный университет
Москва, Россия
* E-mail: ekirillova@sevin.ru
Поступила в редакцию 24.08.2020
После доработки 15.09.2020
Принята к публикации 16.09.2020
Аннотация
Представлены новые данные по жилому кижучу Oncorhynchus kisutch из водоёмов Камчатки и о-ва Беринга (Командорские о-ва): описана типично резидентная жизненная форма в озёрах Курильское и Большое Лисинское; приведена биологическая характеристика карликовых (неотенических) самцов кижуча из бассейна р. Коль (Западная Камчатка). На основе собственных материалов и данных литературы проанализированы состав и структура пресноводных группировок кижуча. Новые находки жилого кижуча указывают на более широкое, чем считалось ранее, его распространение в азиатской части ареала. Пресноводная компонента в популяциях кижуча неоднородна и представлена тремя вариантами: 1) изолированные озёрные популяции (типично резидентная форма), 2) формирующие единый репродуктивный комплекс с проходными рыбами озёрно-речные особи (типично резидентная форма) обоих полов либо только самцы, 3) карликовые (неотенические) самцы, обитающие в реках, не имеющих озёр в своём бассейне. Рассматривается гипотеза о том, что появление и распространение резидентных форм кижуча в азиатской части ареала может быть следствием масштабных изменений климата Северной Пацифики, продолжающихся в настоящее время. Наличие у кижуча полиморфных пресноводных группировок можно рассматривать как проявление широкой нормы реакции вида, обеспечивающей усложнение структуры отдельных популяций, появление дополнительных элементов в их составе и, следовательно, повышение их устойчивости и приспособленности к динамичной среде обитания.
Тихоокеанские лососи рода Oncorhynchus широко распространены в Северной Пацифике благодаря способности адаптироваться к динамично меняющимся условиям среды, заключающейся в реализации разных типов жизненной стратегии (анадромной или резидентной) и существовании разнообразных жизненных форм (Waples et al., 2001; Quinn, 2005; Павлов, Савваитова, 2008, 2010; Glubokovsky, Marchenko, 2019). Внутривидовая дифференциация у разных видов тихоокеанских лососей выражена в разной степени. Сложная внутривидовая структура свойственна эволюционно более древним представителям рода, сохранившим тесную трофическую связь с пресными водами (McPhail, 1997; Waples et al., 2001, 2008; Животовский, 2015; Glubokovsky, Marchenko, 2019). К числу видов, имеющих сложную внутривидовую структуру, относится и кижуч O. kisutch. Он воспроизводится в различных водоёмах, условия для нереста и нагула в которых очень разнообразны – от крупных речных и озёрно-речных систем до небольших рек и родниковых ручьёв. На всём ареале, на азиатском и американском побережьях Тихого океана, кижуч реализует преимущественно анадромную жизненную стратегию (Берг, 1948; Shapovalov, Taft, 1954; Смирнов, 1975; Groot, Margolis, 1991; Behnke, 2002; Quinn, 2005; Зорбиди, 2010; Волобуев, Марченко, 2011).
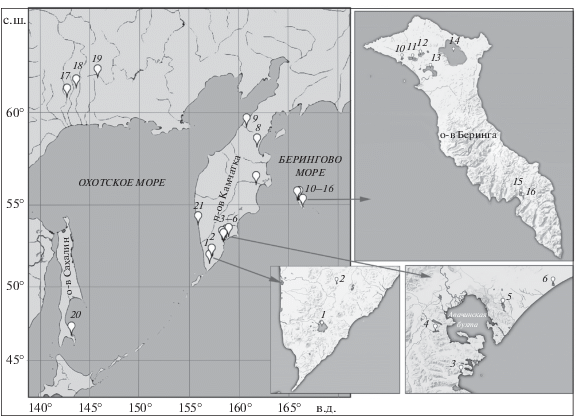
Сведения о наличии пресноводной компоненты в структуре вида – жилого (резидентного) кижуча − появились в середине XX в. и до начала 1980-х гг. были единичными (Правдин, 1940; Грибанов, 1948; Двинин, 1949; Шмидт, 1950; Foerster, Ricker, 1953; Rounsefell, 1958; Куренков, 1977; Куренков и др., 1982). В конце ХХ–начале XXI вв. стало появляться всё больше данных, показавших широкую встречаемость жилого кижуча. Следует отметить, что подавляющее большинство находок жилого кижуча относится к азиатской части ареала (рис. 1). На американском побережье до настоящего времени он известен в оз. Култус, в провинции Британская Колумбия, Канада (Foerster, Ricker, 1953) и в оз. Бочарова, бассейн р. Эгиджик, Аляска (Rounsefell, 1958). В азиатской части ареала изолированные популяции жилого кижуча выявлены на Камчатке в озёрах Котельное и Малое Саранное (Куренков и др., 1982), а также в утративших связь с рекой малых озёрах в бассейне р. Хайлюля (Зорбиди и др., 2006). Жилые рыбы, обитающие симпатрично с проходными, описаны на Камчатке в озёрах Дальнее (Введенская, Куренков, 1988), Голыгинское (Токранов и др., 2004; Зорбиди и др., 2006), Аяогытгын (бассейн р. Лесная) (Красная книга …, 2018); отмечены в оз. Азабачье (бассейн р. Камчатка) (Горшков, 1977). На Командорских о-вах жилой кижуч обитает в озёрах Саранное, Лодыгинское и Гаванское (Куренков, 1977; Куренков и др., 1982), Шангинское и Китовое (Красная книга …, 2006, 2018). Также он обнаружен в ряде озёрно-речных систем на материковом побережье Охотского моря: озёрах Корраль (бассейн р. Охота) (Волобуев, Рогатных, 1982; Волобуев, Марченко, 2011), Берёзовое (бассейн р. Ульбея) (Волобуев, Рогатных, 1982; Волобуев, Марченко, 2011) и в озёрах системы Хэл-Дэги (бассейн р. Иня) (Волобуев, Рогатных, 1982). В то же время в обширной литературе, посвящённой биологии кижуча, до настоящего времени не были описаны резидентные карликовые, или неотенические (Берг, 1948, 1961; Смирнов, 1975; Иванков, Броневский, 1978), самцы в диких популяциях. При этом для кижуча искусственного воспроизводства известен случай обнаружения созревающих самцов возраста 1+ (2 экз.) в рыбоводном ручье на территории Адо-Тымовского рыбоводного завода, расположенного в бассейне р. Тымь (о. Сахалин) (Христофоров, 1986).
Рис. 1.
Распространение жилого кижуча Oncorhynchus kisutch в азиатской части ареала (по литературным и собственным данным): 1 – оз. Курильское, 2 – оз. Голыгинское, 3 – оз. Малое Саранное, 4 – оз. Дальнее, 5 – оз. Халактырское, 6 – оз. Котельное, 7 – оз. Азабачье, 8 – озёра в бассейне р. Хайлюля, 9 – оз. Аяогытгын, 10 – оз. Китовое, 11 – оз. Лодыгинское, 12 – оз. Шангинское, 13 – оз. Гаванское, 14 – оз. Саранное, 15−16 – озёрно-речная система Лисинская (Большое и Малое Лисинское озёра), 17 – оз. Корраль, система Уегинских озёр, бассейн р. Охота; 18 – оз. Берёзовое, бассейн р. Ульбея; 19 – система озёр Хэл-Дэги, бассейн р. Иня; 20 – оз. Тунайча, 21 – р. Коль.
В 2013 г. мы впервые достоверно установили существование жилого кижуча в оз. Курильское на юге Камчатки (Кириллова и др., 2014). В 2014–2016 гг. он впервые обнаружен в озёрно-речной системе Лисинская на о-ве Беринга, Командорские о-ва (Малютина и др., 2019). В 2002–2008 гг. в бассейне р. Коль на западе Камчатки впервые нами обнаружены резидентные карликовые самцы кижуча (Павлов и др., 2009).
Новые находки жилого кижуча определили цель настоящей работы: провести ревизию представлений о разнообразии кижуча и дать характеристику его пресноводной компоненты – разнообразных внутривидовых группировок, приуроченных к пресноводным водоёмам. Задачи исследования включают морфобиологическую характеристику новых находок жилого кижуча и их сравнительный анализ с литературными и архивными материалами.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в оз. Курильское (бассейн р. Озёрная) на юге Камчатки, в озёрно-речной системе Лисинская на о-ве Беринга и в р. Коль, Западная Камчатка (рис. 1).
Курильское озеро расположено на юге п-ова Камчатка. Озеро относится к кратерному типу, площадь его поверхности 77 км2, максимальная глубина 316 м, средняя глубина 195.2 м (Остроумов, 1985; Николаев, Николаева, 1991). Береговая линия развита слабо – коэффициент извилистости составляет 1.68 (Крохин, Крогиус, 1937), в ландшафте отсутствуют закрытые бухты и глубоко врезанные в сушу заливы. Озеро даёт начало р. Озёрная, впадающей в Охотское море. Из многочисленных притоков оз. Курильское только десять имеют значение как нерестово-нагульные для лососёвых рыб (Крохин, Крогиус, 1937; Остроумов, 1970; Бугаев, Кириченко, 2008). Курильское озеро является нерестово-нагульным водоёмом для крупнейшего в Азии стада нерки O. nerka (Крохин, Крогиус, 1937; Остроумов, 1970; Бугаев, 1995; Бугаев, Кириченко, 2008). Также в озёрно-речной системе многочисленна мальма Salvelinus malma, в небольшом количестве заходят горбуша O. gorbusha и кета O. keta.
Малая озёрно-речная система Лисинская расположена в юго-западной части о-ва Беринга. Она состоит из двух озёр (Большое Лисинское и Малое Лисинское), соединённых протокой, шести крупных притоков и вытекающей р. Лисинская, впадающей в Тихий океан. Притоки озёр – короткие, бурные реки, их истоки расположены в горных распадках южной части острова. Площадь поверхности озёр соответственно 1.25 и 0.15 км2, их максимальная глубина ~ 5 м. Берега озёр пологие, дно имеет конусовидный профиль с наибольшей глубиной в центре. Дно озёр каменистое или галечное с участками россыпи гравия. По всей площади дна озёр есть многочисленные выходы холодных (~4°С в течение всего года) грунтовых вод. В соответствии с классификацией нерестово-нагульных озёр по характеру их происхождения и типу питания Большое и Малое Лисинские озёра представляют собой обширный лимнокрен (Остроумов, 1985). Протока между озёрами имеет длину 850 м, ширину ~ 4 м, глубину 0.3–0.4 м, дно сложено гравием и галькой и представляет собой сплошное поле выходов холодных грунтовых вод. Вытекающая из оз. Малое Лисинское река имеет длину 3 км, ширину в устье 5 м, среднюю глубину 0.5 м, скорость течения 1.2 м/с. В озёрно-речной системе Лисинская обитают кижуч, нерка, горбуша и мальма.
Река Коль – крупный водоток длиной 122 км (Государственный водный реестр, 2020) на западном побережье п-ова Камчатка. На всём своём протяжении река имеет горный или предгорный характер. В среднем и нижнем течении хорошо развита система придаточных водоёмов. В русле многочисленны древесные завалы и заломы. В реку впадают 14 крупных притоков. Подробное описание водотока приведено ранее (Павлов и др., 2009).
При сборе и анализе полевого материала применяли комплексный подход, предполагающий использование как стандартных (Правдин, 1966), так и оригинальных методик (Павлов и др., 2001, 2016; Кузищин, 2010). Для отлова половозрелых рыб использовали разнообразные орудия лова: закидной невод, ставные сети с разным шагом ячеи, удебные снасти. Для отлова молоди использовали мальковые ловушки (вентери), мальковые невода и электролов Smith-Root 24L в щадящем режиме (Bird, Cowx, 1993). Применение электролова было целесообразно для проведения тотального облова реперных участков русла без умерщвления рыб и определения видового состава, плотности и биомассы рыб на данном участке (Zippin, 1956; Reynolds et al., 2003; Kouřil et al., 2009). Для оценки морфобиологических показателей молоди из улова неселективно отбирали репрезентативные выборки объёмом от 200 до 500 экз.
Для определения морфобиологических характеристик рыб подвергали полному биологическому анализу, включавшему измерение длины по Смитту (FL) и массы тела, определение стадии зрелости гонад (Правдин, 1966). При вскрытии отмечали цвет мускулатуры, состояние брюшной полости и внутренних органов (наличие паразитов, патологий), описывали состав пищевого комка.
Для оценки внутривидовой дифференциации выполнен морфометрический анализ части рыб по модифицированной схеме, принятой для лососёвых рыб (Павлов и др., 2001): оценивали 25 пластических и 10 меристических признаков. Для описания пропорций тела рыб значения пластических признаков выражены в % FL (Правдин, 1966). Для устранения размерной изменчивости и снижения влияния аллометрии в росте рыб на расчёты при описании фенотипического разнообразия значения пластических признаков преобразованы в индексы Рейста (Reist, 1985, 1986, 1987). Морфометрические данные обработаны методами унивариантного статистического анализа (Лакин, 1980). Для выявления морфологических различий между кижучем разных группировок проведён кластерный анализ (методом невзвешенных попарных средних, в качестве меры расстояния принято Евклидово расстояние). Для оценки фенотипического разнообразия выборок применяли дискриминантный анализ с пошаговым включением переменных. Статистический анализ проводили средствами программы Statistica 12.0.
Для сравнительного анализа привлечены морфометрические данные по кижучу разных жизненных форм – типично анадромной и карликовой анадромной, или каюркам (precocious (dwarf) anadromous, – по: Glubokovsky, Marchenko, 2019. Р. 516), а также по молоди без признаков смолтификации (пестряток) из р. Коль и оз. Курильское, собранной нами в 1995–2019 гг. Кроме того, использованы архивные данные кафедры ихтиологии биологического факультета МГУ. Места сбора, объём используемого и привлечённого материала представлены в соответствующих таблицах и на рисунках.
При определении возраста и расчёте темпа роста использовали чешую с неразрушенным центром. С помощью гидравлического пресса (давление 200 Па, температура 85°C) изготавливали отпечатки чешуи на акрилацетатных пластинках. При помощи системы цифровой обработки изображений (image-cаpture system, микроскоп Leica DMLS с набором объективов кратностью от ×2.5 до ×10, цифровая камера Canon X500-D) получали высококачественное электронное изображение отпечатков чешуи в виде файлов в формате TIFF. Ширину годовых зон (с точностью до 0.001 мм) и число склеритов в годовых зонах измеряли средствами компьютерной программы Image Pro Plus 4.1. Число склеритов просчитывали вдоль профиля, по которому измеряли годовые зоны (Бугаев, 1995; Кузищин и др., 1999, Павлов и др., 2001). При указании биографической группы рыб использовали схему Правдина (1966) для лососёвых рыб, где первая цифра обозначает число лет, проведённых в пресной воде, вторая цифра – число лет, прожитых в море (S) или в озере (L).
Реконструкцию жизненного цикла проводили с помощью микрохимического анализа отолитов: определяли соотношение Sr2+/Ca2+ в трансектах от центра до края отолита, что позволяет точно определять длительность пребывания особи в пресных, солоноватых и морских водах (Kalish, 1990; Zimmerman, Reeves, 2000; Зиммерман и др., 2003; Кузищин и др., 2003; Павлов и др., 2013). Для количественного определения микроэлементного состава отолитов применяли метод рентгенофлуоресцентного (РФА) микроанализа, выполняемого посредством энергодисперсионного спектрометра Tornado M4 (“Bruker AXS”, Германия). Метод ранее успешно был апробирован на других видах рыб, включая представителей Salmonidae. Подробное его описание, методика подготовки препаратов отолитов и построение трансект жизненного цикла представлены в работе Павлова с соавторами (2013).
РЕЗУЛЬТАТЫ
Жилой кижуч озера Курильское
В августе−сентябре половозрелый проходной кижуч образует скопления на участках акватории озера, примыкающих к устьям крупных притоков (реки Этамынк и Выченкия); рыбы держатся на удалении 20–50 м от берега. На этих участках были обнаружены три особи жилого кижуча. Две из них были пойманы в 2013 г.: первая FL 250 мм и массой 195.4 г – 09 сентября вблизи устья р. Выченкия; вторая FL 490 мм и массой 1320 г – 27 сентября вблизи устья р. Этамынк. Третья особь FL 335 мм (масса не установлена) поймана также вблизи устья р. Этамынк 02.11.2019 г. Все обнаруженные особи жилого кижуча – самцы с семенниками IV стадии зрелости. На момент поимки две первые особи питались: в желудках обнаружены полупереваренные останки рыб длиной ~ 65–70 мм, личинки и имаго насекомых (Diptera); кишечник был заполнен полупереваренными остатками пищи. Данные о наличии пищи в пищеварительном тракте третьей особи отсутствуют. При этом у всех особей проходного кижуча (n = 25 экз.), пойманных в приустьевой зоне у нерестовых притоков, в желудках и кишечниках не было следов пищи. Мускулатура жилых особей кижуча светло-розовая, у более крупных она более яркая; у проходных рыб – насыщенного красного или красно-оранжевого цвета. В полости тела жилых рыб отсутствовали жировые отложения, в отличие от проходных рыб. У особей жилого кижуча внутренние органы (желудок, пилорические придатки, кишечник, печень) и полость тела были в высокой степени заражены паразитами, среди которых выявлены типично пресноводные организмы: нематоды Cucullanus truttae и скребни Neoechinorhynchus sp.
У жилого кижуча тело высокое (22–23% FL), массивное, овальное в передней части, а хвостовой отдел сжат с боков. Наибольшая высота тела перед спинным плавником, на уровне 1/2 пектовентрального расстояния (P–V). За спинным плавником тело уплощено с боков и клиновидно сужено к хвостовому плавнику. Хвостовой стебель низкий (7–8% FL) и сжат с боков, его длина составляет 18% FL. Грудные плавники длинные и заострённые на вершине, достигают 1/2 P–V. Боковая линия прямая. Хвостовой плавник глубоко выемчатый, обе лопасти имеют заострённые края. Голова массивная (23–24% FL), конической формы, челюсти равной длины либо верхняя челюсть чуть длиннее нижней. Рот большой, верхнечелюстная кость далеко заходит за задний край глаза. Окраска тела в целом пелагическая, но отличается у рыб, пойманных в разное время. Особь, пойманная в начале сентября, имела тёмную спину с отчётливым зеленоватым оттенком, серебристые бока, белое брюхо, легко опадающую чешую, светлые грудные, брюшные и анальный плавники, светлое основание хвостового плавника, тёмные края лопастей. Пойманные в конце сентября и начале ноября особи имели более тёмную и тусклую окраску – буро-зелёную спину, серые с розоватым отливом бока тела, плотно держащуюся в коже чешую, тёмные с оливковым оттенком грудные, брюшные и анальный плавники, однотонный тёмный хвостовой плавник, со светлой каймой по наружному краю. Выше боковой линии, от головы и до основания хвостового плавника, расположены многочисленные ɔ- и ς-образные чёрные пятнышки, округлые или овальные по верхнему краю спины. По наружному краю верхней и нижней лопастей хвостового плавника расположены удлинённо-овальные чёрные пятна, в средней части хвостового плавника пятен нет. Морфометрическая характеристика жилого кижуча оз. Курильское представлена в табл. 1. Меристические признаки жилого и проходного кижуча сходны (табл. 2).
Таблица 1.
Морфометрическая характеристика жилого кижуча Oncorhynchus kisutch озёр Курильское и Большое Лисинское и карликовых самцов р. Коль
| Признак | Оз. Курильское (n = 2) |
Оз. Большое Лисинское (n = 3) |
Р. Коль (n = 8) |
||||||
|---|---|---|---|---|---|---|---|---|---|
| M ± σ | lim | CV | M ± σ | lim | CV | M ± σ | lim | CV | |
| В % FL | |||||||||
| c | 23.3 ± 1.33 | 22.4–24.3 | 5.71 | 21.0 ± 1.27 | 20.0–22.4 | 6.05 | 24.7 ± 0.59 | 23.7–25.2 | 2.39 |
| ao | 8.3 ± 0.98 | 7.6–9.0 | 11.77 | 4.9 ± 0.29 | 4.7–5.2 | 6.05 | 6.3 ± 0.44 | 5.7–7.1 | 7.00 |
| o | 3.5 ± 0.66 | 3.1–4.0 | 18.80 | 5.0 ± 0.24 | 4.8–5.2 | 4.69 | 6.2 ± 0.41 | 5.6–7.0 | 6.58 |
| po | 13.0 ± 0.24 | 12.9–13.2 | 1.86 | 12.3 ± 0.60 | 11.9–13.0 | 4.84 | 11.2 ± 0.62 | 10.3–11.9 | 5.52 |
| io | 8.2 ± 0.83 | 7.6–8.8 | 10.15 | 8.0 ± 0.36 | 7.6–8.3 | 4.52 | 6.4 ± 0.25 | 6.0–6.7 | 3.94 |
| cH | 11.5 ± 0.45 | 11.2–11.8 | 3.91 | 16.2 ± 0.48 | 15.7–16.7 | 2.95 | 17.1 ± 0.84 | 15.5–18 | 4.93 |
| lm | 13.1 ± 1.04 | 12.4–13.9 | 7.95 | 11.7 ± 1.68 | 10.2–13.5 | 14.28 | 13.0 ± 0.98 | 11.2–14.2 | 7.54 |
| lmx | 9.3 ± 0.42 | 9.0–9.6 | 4.50 | 9.0 ± 1.78 | 7.4–10.9 | 19.86 | 9.8 ± 0.34 | 9.4–10.5 | 3.43 |
| hmx | 2.4 ± 0.03 | 2.4–2.4 | 1.43 | 1.7 ± 0.15 | 1.6–1.9 | 8.91 | 2.7 ± 0.13 | 2.5–2.9 | 4.98 |
| lmd | 14.7 ± 1.50 | 13.6–15.7 | 10.2 | 12.8 ± 0.27 | 12.5–13.0 | 2.09 | 11.6 ± 1.75 | 9.7–15.2 | 15.07 |
| H | 22.5 ± 0.75 | 22.0–23.1 | 3.33 | 23.3 ± 0.09 | 23.3–23.4 | 0.39 | 22.9 ± 0.50 | 22.2–23.9 | 2.19 |
| h | 7.7 ± 0.40 | 7.4–8.0 | 5.15 | 7.8 ± 0.47 | 7.4–8.3 | 6.05 | 8.1 ± 0.30 | 7.6–8.4 | 3.72 |
| lpc | 18.2 ± 0.31 | 18.0–18.4 | 1.71 | 18.0 ± 0.24 | 17.7–18.1 | 1.32 | 16.3 ± 0.60 | 15.2–16.8 | 3.70 |
| lD | 10.5 ± 0.42 | 10.2–10.8 | 4.01 | 10.7 ± 0.23 | 10.5–10.9 | 2.16 | 10.7 ± 0.96 | 8.6–11.7 | 8.96 |
| hD | 13.0 ± 0.81 | 12.4–13.6 | 6.25 | 15.2 ± 0.12 | 15.1–15.3 | 0.80 | 17.0 ± 0.61 | 16.2–17.7 | 3.60 |
| lA | 12.2 ± 0.25 | 12.0–12.4 | 2.08 | 12.0 ± 0.45 | 11.6–12.5 | 3.71 | 12.3 ± 0.73 | 11.1–12.9 | 5.91 |
| hA | 9.3 ± 1.28 | 8.4–10.2 | 13.71 | 11.5 ± 0.11 | 11.4–11.6 | 0.93 | 12.9 ± 0.76 | 12.3–14.3 | 5.86 |
| lP | 14.1 ± 1.49 | 13.0–15.1 | 10.58 | 13.5 ± 0.95 | 12.9–14.6 | 7.06 | 15.7 ± 0.92 | 13.8–16.7 | 5.87 |
| lV | 11.1 ± 0.16 | 11.0–11.2 | 1.43 | 11.2 ± 0.25 | 11.0–11.5 | 2.27 | 12.7 ± 0.74 | 11.2–13.3 | 5.85 |
| aD | 46.1 ± 0.66 | 45.6–46.5 | 1.43 | 44.7 ± 2.10 | 43.3–47.1 | 4.69 | 43.6 ± 3.22 | 38.5–46.0 | 7.37 |
| pD | 39.9 ± 1.86 | 38.6–41.2 | 4.66 | 39.1 ± 0.48 | 38.6–39.5 | 1.23 | 37.3 ± 2.13 | 33.3–38.9 | 5.73 |
| aV | 49.9 ± 1.29 | 49.0–50.8 | 2.58 | 48.7 ± 1.70 | 47.6–50.7 | 3.48 | 46.2 ± 1.94 | 42.7–47.8 | 4.20 |
| aA | 65.2 ± 2.78 | 63.3–67.2 | 4.27 | 66 ± 1.06 | 64.8–66.7 | 1.60 | 62.5 ± 2.8 | 56.9–64.6 | 4.48 |
| P–V | 29.2 ± 1.73 | 28.0–30.4 | 5.91 | 28.5 ± 0.39 | 28.1–28.8 | 1.35 | 27.3 ± 1.03 | 25.6–28.3 | 3.76 |
| V–A | 17.0 ± 0.90 | 16.3–17.6 | 5.31 | 17.3 ± 0.57 | 16.7–17.7 | 3.27 | 16.5 ± 0.65 | 15.4–17.2 | 3.97 |
Примечание. FL – длина по Смитту, с – длина головы, ао – длина рыла, о – горизонтальный диаметр глаза, ро – заглазничное расстояние, io – межглазничное расстояние, cH – высота головы на уровне затылка, lm – полная длина верхней челюсти; lmx, hmx – длина и ширина верхнечелюстной кости; lmd – длина нижней челюсти, Н – наибольшая высота тела; h, lpc – высота и длина хвостового стебля; 1D – длина основания спинного плавника, hD – высота спинного плавника, lA – длина основания анального плавника, hА – высота анального плавника; lР, lV – длина грудного и брюшного плавника; расстояния: aD – антедорсальное, pD – постдорсальное, aV – антевентральное, аА – антеанальное, P–V – пектовентральное, V–A – вентроанальное; n – число изученных особей, экз., M ± σ – среднее значение и стандартное отклонение, lim – пределы варьирования, CV – коэффициент вариации.
Таблица 2.
Меристические признаки жилого кижуча Oncorhynchus kisutch озёр Курильское и Большое Лисинское, карликовых самцов р. Коль и симпатричных группировок проходного кижуча
| Признак | Оз. Курильское | Оз. Большое Лисинское | Р. Коль | |||
|---|---|---|---|---|---|---|
| Жилой (n = 2) |
Проходной (n = 14) |
Жилой (n = 3) |
Проходной (n = 24) |
Карликовые самцы (n = 7) | Проходной (n = 300) |
|
| ll | $\frac{{140.0 \pm 4.24}}{{137{\kern 1pt} --{\kern 1pt} 143}}$ | $\frac{{138.3 \pm 3.37}}{{131{\kern 1pt} --{\kern 1pt} 146}}$ | $\frac{{134.7 \pm 1.56}}{{133{\kern 1pt} --{\kern 1pt} 136}}$ | $\frac{{135.7 \pm 1.96}}{{132{\kern 1pt} --{\kern 1pt} 140}}$ | $\frac{{133.8 \pm 2.38}}{{130{\kern 1pt} --{\kern 1pt} 135}}$ | $\frac{{132.3 \pm 6.93}}{{129{\kern 1pt} --{\kern 1pt} 136}}$ |
| D | $\frac{{10.0 \pm 0}}{{10{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{10.3 \pm 0.71}}{{9{\kern 1pt} --{\kern 1pt} 11}}$ | $\frac{{9.0 \pm 1.00}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{9.1 \pm 0.54}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{9.1 \pm 0.85}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{9.0 \pm 1.91}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ |
| A | $\frac{{13.5 \pm 0.71}}{{13{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{14.1 \pm 0.82}}{{13{\kern 1pt} --{\kern 1pt} 16}}$ | $\frac{{13.0 \pm 1.00}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.4 \pm 0.59}}{{11{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{13.1 \pm 0.74}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.9 \pm 1.73}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ |
| P | $\frac{{13.5 \pm 0.71}}{{13{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.4 \pm 0.64}}{{13{\kern 1pt} --{\kern 1pt} 15}}$ | $\frac{{13.7 \pm 1.54}}{{12{\kern 1pt} --{\kern 1pt} 15}}$ | $\frac{{13.1 \pm 0.73}}{{11{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.0 \pm 0.71}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.2 \pm 1.91}}{{12{\kern 1pt} --{\kern 1pt} 15}}$ |
| V | $\frac{{9.0 \pm 0}}{{9{\kern 1pt} --{\kern 1pt} 9}}$ | $\frac{{9.1 \pm 0.45}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{9.0 \pm 0}}{{9{\kern 1pt} --{\kern 1pt} 9}}$ | $\frac{{9.0 \pm 0.29}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{8.0 \pm 0}}{{8{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{8.1 \pm 1.39}}{{7{\kern 1pt} --{\kern 1pt} 9}}$ |
| rb1 | $\frac{{13.5 \pm 0.71}}{{13{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.4 \pm 0.75}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{14.0 \pm 1.00}}{{13{\kern 1pt} --{\kern 1pt} 15}}$ | $\frac{{13.9 \pm 0.83}}{{12{\kern 1pt} --{\kern 1pt} 15}}$ | $\frac{{3.4 \pm 0.69}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.5 \pm 2.25}}{{12{\kern 1pt} --{\kern 1pt} 15}}$ |
| rb2 | $\frac{{13.5 \pm 0.71}}{{13{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.0 \pm 0.79}}{{11{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.7 \pm 1.16}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.2 \pm 0.54}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.1 \pm 0.66}}{{11{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.8 \pm 2.08}}{{11{\kern 1pt} --{\kern 1pt} 14}}$ |
| sp.br. | $\frac{{21.0 \pm 1.41}}{{20{\kern 1pt} --{\kern 1pt} 22}}$ | $\frac{{21.6 \pm 1.50}}{{20{\kern 1pt} --{\kern 1pt} 24}}$ | $\frac{{21.3 \pm 2.08}}{{19{\kern 1pt} --{\kern 1pt} 23}}$ | $\frac{{21.7 \pm 1.22}}{{19{\kern 1pt} --{\kern 1pt} 24}}$ | $\frac{{21.5 \pm 2.33}}{{20{\kern 1pt} --{\kern 1pt} 24}}$ | $\frac{{21.7 \pm 2.94}}{{20{\kern 1pt} --{\kern 1pt} 24}}$ |
| pc | $\frac{{50.0 \pm 12.73}}{{41{\kern 1pt} --{\kern 1pt} 59}}$ | $\frac{{56.6 \pm 6.10}}{{41{\kern 1pt} --{\kern 1pt} 66}}$ | $\frac{{66.3 \pm 9.60}}{{56{\kern 1pt} --{\kern 1pt} 75}}$ | $\frac{{67.0 \pm 7.20}}{{50{\kern 1pt} --{\kern 1pt} 76}}$ | $\frac{{58.8 \pm 5.21}}{{49{\kern 1pt} --{\kern 1pt} 69}}$ | $\frac{{62.8 \pm 14.03}}{{47{\kern 1pt} --{\kern 1pt} 73}}$ |
| vert. | $\frac{{67.5 \pm 0.71}}{{67{\kern 1pt} --{\kern 1pt} 68}}$ | $\frac{{65.8 \pm 1.35}}{{64{\kern 1pt} --{\kern 1pt} 68}}$ | $\frac{{66.7 \pm 1.52}}{{65{\kern 1pt} --{\kern 1pt} 68}}$ | $\frac{{66.0 \pm 1.57}}{{62{\kern 1pt} --{\kern 1pt} 69}}$ | $\frac{{64.8 \pm 2.14}}{{61{\kern 1pt} --{\kern 1pt} 67}}$ | $\frac{{64.9 \pm 5.37}}{{61{\kern 1pt} --{\kern 1pt} 68}}$ |
Примечание. ll – число чешуй в боковой линии; D, A – число ветвистых лучей в спинном и анальном плавниках; P, V − число ветвистых лучей в левых грудном и брюшном плавниках; rb1, rb2 – число жаберных лучей слева и справа, sp.br. – число жаберных тычинок на 1-й жаберной дуге с левой стороны, pc – число пилорических придатков, vert. – число позвонков. Здесь и в табл. 3: над чертой − среднее значение и стандартное отклонение, под чертой – пределы варьирования признака.
Проходной кижуч визуально хорошо отличается от жилого. У проходных рыб тело веретеновидное и более высокое (22–26% FL), наибольшая высота тела под спинным плавником, хвостовой стебель короче и выше (15–17 и 8–9% FL), грудные плавники короткие, их длина не достигает 1/2 P–V. У самцов проходного кижуча голова в среднем более массивная (23–27% FL), верхняя челюсть заметно длиннее нижней и нависает над ней. Чешуя всех проходных особей, находившихся в сентябре в устьевой зоне притоков, плотно держалась в коже. Окраска проходных рыб темнее и насыщеннее: бока тела разных оттенков малинового цвета, все плавники тёмного цвета, на хвостовом плавнике удлинённо-овальные пятна только по верхнему краю.
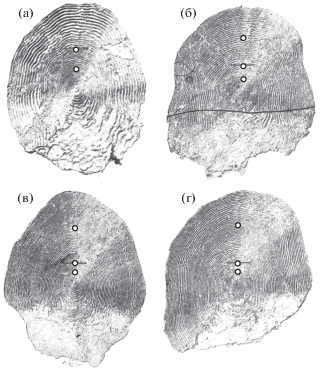
На чешуе кижуча выделяются две зоны – центральная, соответствующая периоду пресноводного нагула до определения жизненной стратегии (анадромной или резидентной), и периферическая, соответствующая периоду ускоренного темпа роста в озере или в море. Центральные зоны у жилых и проходных особей по своему строению сходны, различия между ними недостоверны (табл. 3). Годовые кольца в центральной зоне узкие, шириной ~0.03 мм, в них сформировано по 7–10 склеритов. Периферическая зона чешуи у жилого и проходного кижуча шире, чем центральная: годовые кольца в ней имеют вдвое больше склеритов и бо́льшие межсклеритные расстояния. При этом у жилого кижуча средняя ширина первого годового кольца периферической зоны почти в два раза меньше, чем у проходного: ~ 0.08 против 0.15 мм (табл. 3, рис. 2).
Таблица 3.
Число склеритов и ширина годовых колец в центральной и периферической зонах чешуи жилого и проходного кижуча Oncorhynchus kisutch оз. Курильское
| Зона | Жилые (n = 3) | Проходные (n = 25) | ||
|---|---|---|---|---|
| Число склеритов | Ширина, ×10–2 мм |
Число склеритов | Ширина, ×10–2 мм |
|
| Центральная: | ||||
| – 1-е годовое кольцо | $\frac{{7.66 \pm 0.33}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{2.96 \pm 0.22}}{{2.71{\kern 1pt} --{\kern 1pt} 3.34}}$ | $\frac{{7.55 \pm 0.17}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{2.57 \pm 0.13}}{{2.10{\kern 1pt} --{\kern 1pt} 3.30}}$ |
| – 2-е годовое кольцо | $\frac{{9.01 \pm 0.57}}{{8{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{3.61 \pm 0.30}}{{3.30{\kern 1pt} --{\kern 1pt} 4.21}}$ | $\frac{{8.57 \pm 0.34}}{{7{\kern 1pt} --{\kern 1pt} 10}}$ | $\frac{{3.04 \pm 0.21}}{{2.00{\kern 1pt} --{\kern 1pt} 4.20}}$ |
| Периферическая озёрная: | ||||
| – прирост текущего* года | $\frac{{15.67 \pm 1.20}}{{13{\kern 1pt} --{\kern 1pt} 18}}$ | $\frac{{8.34 \pm 1.06}}{{6.90{\kern 1pt} --{\kern 1pt} 9.80}}$ | ||
| Периферическая морская: | ||||
| – 1-е годовое кольцо | $\frac{{28.89 \pm 1.44}}{{23{\kern 1pt} --{\kern 1pt} 37}}$ | $\frac{{15.05 \pm 1.03}}{{10.20{\kern 1pt} --{\kern 1pt} 20.70}}$ | ||
| – прирост текущего года | $\frac{{22.24 \pm 0.53}}{{20{\kern 1pt} --{\kern 1pt} 26}}$ | $\frac{{11.21 \pm 0.51}}{{9.89{\kern 1pt} --{\kern 1pt} 13.14}}$ | ||
Рис. 2.
Чешуя жилых (а, б) и проходных (в, г) особей кижуча Oncorhynchus kisutch из оз. Курильское (относительные размеры чешуй не соблюдены): а – самец FL 335 мм, IV стадия зрелости гонад, возраст 2+, озёрный прирост – периферическая зона
текущего года, биографическая группа 2.0L+; б – самец FL 490 мм, IV, 3+, зона озёрного прироста – полный год и прирост текущего года, 2.1L+;
в – самец FL 602 мм, IV, 3+, 2.1S+; г – самка FL 639 мм, IV, 3+, 2.1S+; (⚪) – границы годовых колец; ( ) – граница между центральной и периферической зонами.
) – граница между центральной и периферической зонами.
Анализ соотношения Sr2+/Ca2+ в отолитах жилого кижуча выявил колеблющиеся, но в целом низкие значения по всей длине трансект. Соотношение Sr2+/Ca2+ варьирует в пределах от 1.30 × 103 до 5.02 × 103. При этом наиболее высокие значения содержания ионов стронция наблюдаются в нуклеарной зоне отолитов, в примордиумах и на удалении не более 250 мкм от центра зоны примордиумов (рис. 3). На остальном участке трансекты соотношение Sr2+/Ca2+ низкое – составляет в среднем 2.63 × 103. На трансектах отолитов проходных особей кижуча соотношение Sr2+/Ca2+ в первые годы жизни сходно с таковыми у жилых, но после пресноводных лет жизни у особей с низким уровнем соотношения Sr2+ и Ca2+ по направлению к краю отолита происходит повышение уровня содержания ионов стронция (значения соотношения Sr2+/Ca2+ возрастают до 5.67–7.86 × 103), что соответствует периоду пребывания их в море. Высокий уровень соотношения Sr2+/Ca2+ в морской зоне отолита сохраняется таковым до момента возврата особей в реку.
Рис. 3.
Трансекты жизненной истории кижуча Oncorhynchus kisutch оз. Курильское, по данным соотношения Sr2+/Ca2+ в отолитах: ( ) − период пресноводного нагула до реализации анадромной или резидентной (озёрно-речной)
жизненной стратегии; (—) – жилой самец FL 250 мм, стадия зрелости гонад III–IV; (
) − период пресноводного нагула до реализации анадромной или резидентной (озёрно-речной)
жизненной стратегии; (—) – жилой самец FL 250 мм, стадия зрелости гонад III–IV; ( ) – жилой самец FL 490 мм, IV; (− ⋅ −) – проходной самец FL 639 мм, IV–V; (- - -) – проходная самка FL 602 мм, IV.
) – жилой самец FL 490 мм, IV; (− ⋅ −) – проходной самец FL 639 мм, IV–V; (- - -) – проходная самка FL 602 мм, IV.

Жилой кижуч озёрно-речной системы Лисинская
В бассейне р. Лисинская были пойманы три особи жилого кижуча FL 218, 220, 300 мм и массой соответственно 100, 110, 330 г. Они были отловлены в прибрежной зоне оз. Большое Лисинское в середине августа 2015 и в 2016 гг., за 3–4 недели до начала захода проходного кижуча из моря. Половозрелые особи жилого кижуча находились среди молоди кижуча и мальмы, которые в это время во множестве присутствуют среди нерестящейся нерки и питаются её икрой, вымытой из гнёзд. Молодь кижуча и мальмы в большом количестве встречается в притоках озёр Большое и Малое Лисинское, однако за три года наблюдений (2014–2016) жилой кижуч был отмечен в уловах только в оз. Большое Лисинское.
Возраст трёх особей жилого кижуча – 3+, биографическая группа – 2.1L+, т.е. после определения резидентной стратегии в возрасте 2+ они провели полный год в озере. В годовых кольцах центральной зоны сформировано по 7–10 склеритов, ширина годовых колец варьирует в пределах 0.028−0.031 мм, в периферической (озёрной) зоне в первом годовом кольце содержится 10–13 (в среднем 11.7 ± 0.98) склеритов, ширина первого годового кольца 0.068–0.080 (0.078) мм.
У жилого кижуча оз. Большое Лисинское тело веретеновидное, невысокое (20–21% FL), несколько более массивное и вальковатое в передней части. Наибольшая высота тела перед спинным плавником. За спинным плавником тело менее вальковатое, чем в передней части. Хвостовой стебель укороченный (17–18% FL) и высокий (7–8% FL), овальный в сечении. Грудные плавники короткие (lP < 1/2 P–V), закруглённые. Боковая линия прямая. Хвостовой плавник глубоко выемчатый, обе лопасти с закруглёнными краями. Голова массивная (>20% FL), конической формы, рыло закруглённое, челюсти равной длины. Рот большой, верхнечелюстная кость заходит за задний край глаза. Окраска тела пелагическая, спина серая, бока серебристые, брюхо белое. На спине есть немногочисленные чёрные ɔ- и ς-образные пятнышки, расположенные на участке от головы до вертикали, проходящей через задний край спинного плавника. На плавниках пятен нет. Спинной и хвостовой плавники серые, полупрозрачные, вершина спинного плавника светлая, грудной плавник с желтоватым отливом, брюшной и анальный плавники светлые полупрозрачные. Особи жилого кижуча хорошо отличаются от молоди полным отсутствием мальковых пятен. Морфометрическая характеристика жилого кижуча оз. Большое Лисинское представлена в табл. 1, 2.
Карликовые (неотенические) самцы кижуча р. Коль
С 2003 по 2008 гг. при проведении тотальных обловов электроловом реперных участков русла реки, её притоков и водоёмов придаточной системы общий улов молоди кижуча разного возраста составил 84 358 экз., среди которых были выявлены всего восемь карликовых самцов. Ежегодно в общем улове по всем обследованным участкам встречались один–два карликовых самца. Все случаи поимок отмечены в середине сентября в среднем течении двух притоков реки. Места поимки карликовых самцов приурочены к нерестилищам горбуши и симы O. masou. Карликовые самцы кижуча встречались в составе поливидовых групп разновозрастной молоди лососёвых рыб, но всегда держались в наиболее глубоких местах под подмытыми берегами, подобно карликовым самцам симы. В момент поимки карликовых самцов кижуча нерест симы и горбуши уже прошёл, поэтому в составе пищевого комка молоди кижуча были только личинки и имаго насекомых, тогда как карликовые самцы кижуча вели хищный образ жизни и питались мелкими особями мальмы, длина тела которых была 30–40 мм. Рыбная пища была обнаружена в желудках всех без исключения карликовых самцов. При этом более крупные (FL > 180 мм) карликовые самцы симы и мальмы, обитающие совместно с молодью и карликовыми самцами кижуча, питались исключительно водными и наземными беспозвоночными.
Все карликовые самцы кижуча имели возраст 2+, их длина составляла 105−122 (115.1) мм, масса – 12.8−22.0 (16.7) г, масса семенников – 1.2−2.5 (1.93) г. Семенники в середине сентября были на IV–V и V стадиях зрелости, в задней части семенников у всех особей была семенная жидкость. Нерест кижуча в бассейне р. Коль начинается в середине I декады октября. Таким образом, карликовые самцы кижуча приходят в текучее состояние минимум за три недели до нереста.
Карликовые самцы кижуча имеют характерный для ювенильных особей лососёвых рыб облик и внешне едва отличаются от неполовозрелой молоди. Карликовые самцы имеют несколько более массивную голову, более высокое тело, более короткий и высокий хвостовой стебель. По сравнению с молодью карликовые самцы имеют более насыщенную окраску тела: спина серо-зелёная, бока с золотистым отливом, а отдельные чешуйки на боках тела имеют блестящий золотистый цвет, брюхо желтоватое с тёмной сеточкой, мальковые пятна на боках более тёмные и контрастные. На спине от головы до основания хвостового плавника контрастные мелкие чёрные пятнышки. Спинной плавник тёмный, его вершина светлая, хвостовой плавник без чёрных пятен, лопасти закруглённые, задний край окаймлён красно-бурой полосой, брюшные и анальный плавники серые с красноватым отливом, грудные плавники тёмно-серые с красноватой каймой по наружному краю. Морфометрическая характеристика карликовых самцов представлена в табл. 1, по меристическим признакам карликовые самцы не отличаются от проходных особей (табл. 2).
Фенетическое разнообразие кижуча
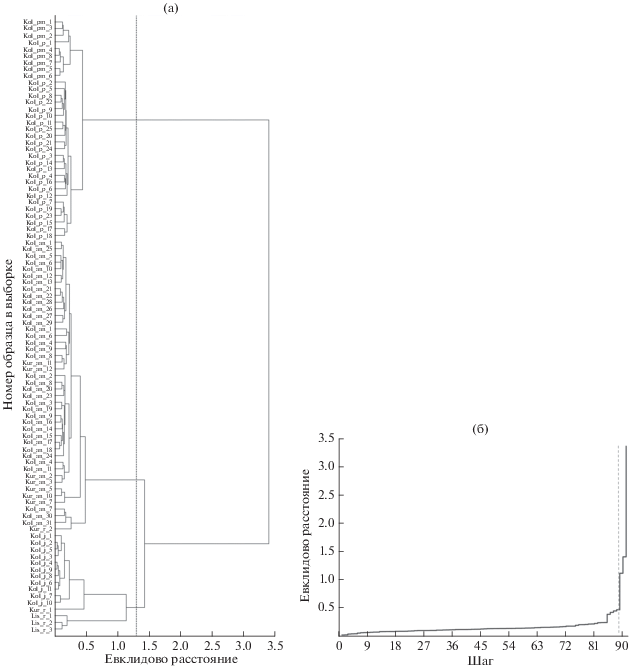
Кластерный анализ данных морфометрии кижуча из разных водоёмов показал неоднородность выборки: на дендрограмме выделяются три дендрита, состоящие из особей разных групп и жизненных форм, реализующих анадромную или резидентную жизненную стратегию (названия форм по: Glubokovsky, Marchenko, 2019), что позволяет разделить выборку на три группы (рис. 4). Первая группа включает карликовых (неотенических) самцов и пестряток р. Коль, вторая – типично анадромных рыб из оз. Курильское и р. Коль, а также типично резидентных (озёрно-речных) рыб из Курильского озёра; третья – каюрок р. Коль и типично резидентных (озёрно-речных) особей из оз. Большое Лисинское (рис. 4а). Согласно графику процесса объединения (рис. 4б), в качестве точки перелома можно рассматривать шаг номер 89 (вертикальная пунктирная линия). Таким образом, разделение генеральной совокупности данных на три кластера (группы) объективно.
Рис. 4.
Дендрограмма морфометрического сходства кижуча Oncorhynchus kisutch разных групп (а) и график объединения объектов в классы (б). Обозначения выборок:
Lis – оз. Большое Лисинское, Kur – оз. Курильское, Kol – р. Коль; an – типично анадромная
форма, r – типично резидентная форма; j – каюрки, pm – карликовые (неотенические)
самцы, p – пестрятки; ( )– критическое расстояние, на котором происходит обособление дендритов; (
)– критическое расстояние, на котором происходит обособление дендритов; ( ) – точка перелома.
) – точка перелома.
Ведущая роль при кластеризации морфометрических выборок кижуча принадлежит габитуальным особенностям, присущим той или иной жизненной форме, а не географической принадлежности выборки. Попадание типично резидентных особей в группы, содержащие типично анадромных и карликовых анадромных особей (каюрок), вероятно, обусловлено малым объёмом выборок резидентов и пелагическим образом жизни в море и в озёрах.
В результате дискриминантного анализа с пошаговым включением переменных была построена модель, в которую вошли 17 из 25 пластических признаков. Значения критерия Фишера (F) и их уровней значимости (p) показали, что различия групп статистически достоверны (табл. 4). Выделенные дискриминирующие функции статистически достоверны (χ2 для первой канонической переменной равен 513.8, p < 0.001; для второй канонической переменной — 139.7 p < 0.001). Первая каноническая переменная объясняет 95.6% морфологической изменчивости.
Таблица 4.
Вторичная матрица дискриминантного анализа пластических признаков кижуча Oncorhynchus kisutch разных жизненных форм
| Группа | Группа | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| 1 | 52.01* | 102.97* | |
| 2 | 100.96 | 430.30* | |
| 3 | 216.89 | 468.45 | |
Примечание. Здесь и в табл. 6: под диагональю – квадраты расстояний Махаланобиса, над ней – значения критерия Фишера (F), *F-значения действительны при p < 0.001.
В поле канонических корней области, соответствующие группам, выделенным посредством кластерного анализа по совокупности пластических признаков, не пересекаются (рис. 5) – значение λ Уилкса составляет 0.002 (p < 0.001) – и разнесены на значительные расстояния (табл. 4). Наибольшее значение в дискриминацию вносят переменные ao, cH, lmd, lP, hA, lV, lpс (частная λ Уилкса > 0.002); прочие переменные менее значимы для дискриминации выделенных областей (табл. 5). При этом группа 1 находится в области положительных значений по оси абсцисс (корень 1), тогда как группа 2 – в зоне отрицательных значений, а группа 3 занимает промежуточное положение. По оси ординат (корень 2) группы 1 и 2 расположены в области отрицательных значений, группа 3 – в области положительных значений.
Рис. 5.
Фенетические отношения групп кижуча Oncorhynchus kisutch, выделенных по совокупности 25 пластических признаков, в поле канонических корней: (◇) − группа 1, пестрятки и карликовые самцы р. Коль; (⬜) − группа 2, типично анадромные и типично резидентные рыбы Курильского озера, а также типично анадромные рыбы из р. Коль; (⚪) − группа 3, каюрки р. Коль и типично резидентные особи оз. Большое Лисинское.
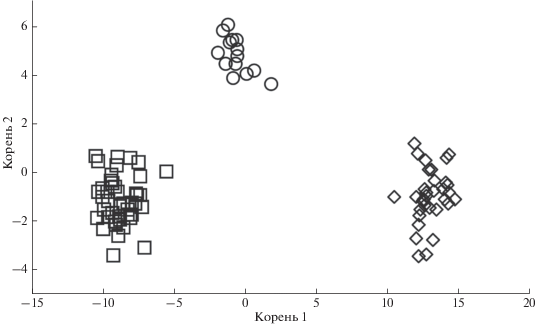
Таблица 5.
Нагрузки собственных векторов пластических признаков (объединённые внутригрупповые корреляции переменных с соответствующими дискриминантными функциями) разных группировок кижуча Oncorhynchus kisutch, выделенные посредством кластерного анализа
| Признак | Корень 1 | Корень 2 |
|---|---|---|
| lpc | –0.672800 | 0.021976 |
| lP | –0.551304 | –0.157752 |
| cH | –0.441873 | 0.104110 |
| io | –0.568813 | 0.113231 |
| ao | –0.399597 | –0.051260 |
| c | –0.521888 | –0.087609 |
| hA | –0.459508 | 0.027208 |
| lmd | –0.521821 | –0.033495 |
| lV | –0.559157 | –0.123991 |
| P−V | –0.583219 | 0.056507 |
| po | –0.606412 | 0.089903 |
| hD | –0.532225 | –0.034895 |
| lm | –0.484974 | –0.043622 |
| aD | –0.590353 | 0.010733 |
| pD | –0.579174 | 0.107316 |
| H | –0.506885 | 0.059305 |
| h | –0.536073 | 0.008111 |
Применение дискриминантного анализа с пошаговым включением переменных к выборкам половозрелого кижуча разных жизненных форм и неполовозрелых пестряток из разных водоёмов (оз. Курильское, оз. Большое Лисинское, р. Коль) показало более высокий уровень дифференциации. В построенную модель вошли 23 из 25 переменных. Значения критерия Фишера (F) и их уровней значимости (p) показали, что различия групп статистически достоверны (табл. 6). Выделенные дискриминирующие функции статистически достоверны (χ2 для первой канонической переменной равен 971.7, p < 0.001; для второй канонической переменной − 529.5 p < 0.001). Первая каноническая переменная объясняет 94.5% морфологической изменчивости.
Таблица 6.
Вторичная матрица дискриминантного анализа разных жизненных форм кижуча Oncorhynchus kisutch по совокупности 25 пластических признаков
| Водоём, жизненная форма/группа | Водоём, жизненная форма/группа | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 1. Р. Коль, карликовые (неотенические) самцы | 7.69* | 280.94* | 123.21* | 42.02* | 225.43* | 22.21* | |
| 2. Р. Коль, пестрятки | 39.39 | 676.00* | 223.64* | 54.74* | 424.01* | 29.66* | |
| 3. Р. Коль, типично анадромная (проходные) | 1371.03 | 1515.79 | 41.49* | 13.19* | 13.90* | 47.96* | |
| 4. Р. Коль, карликовая анадромная (каюрки) | 825.48 | 908.49 | 158.59 | 10.74* | 9.93* | 19.27** | |
| 5. Оз. Курильское, типично резидентная (озёрно-речные) | 815.03 | 917.27 | 217.87 | 196.93 | 179.77* | 11.86* | |
| 6. Оз. Курильское, типично анадромная (проходные) | 1457.39 | 1622.78 | 49.85 | 251.83 | 179.76 | 49.79* | |
| 7. Оз. Большое Лисинское, типично резидентная (озёрно-речные) | 315.80 | 343.60 | 544.11 | 253.71 | 306.83 | 643.72 | |
Значения частной λ Уилкса показывают, что наибольший вклад в дискриминацию вносят переменные c, cH, o, ao (>0.00005) и lmd, hmx, io, lP, lV (>0.00004) (табл. 7).
Таблица 7.
Нагрузки собственных векторов пластических признаков (объединённые внутригрупповые корреляции переменных с соответствующими дискриминантными функциями) кижуча Oncorhynchus kisutch разных жизненных форм из разных водоёмов
| Признак | Корень 1 | Корень 2 |
|---|---|---|
| aA | 0.702269 | –0.051463 |
| c | 0.612062 | –0.310279 |
| cH | 0.485774 | 0.073442 |
| ao | 0.458796 | –0.276930 |
| lmd | 0.467541 | –0.151917 |
| o | 0.263117 | –0.150046 |
| lP | 0.506583 | –0.268512 |
| hmx | 0.329023 | –0.056536 |
| po | 0.654778 | –0.064114 |
| hA | 0.484832 | –0.036159 |
| io | 0.588426 | –0.021176 |
| lV | 0.583018 | –0.289789 |
| lpc | 0.628478 | –0.217312 |
| aV | 0.663683 | –0.081564 |
| P−V | 0.590419 | –0.060437 |
| hD | 0.453051 | –0.181492 |
| H | 0.607692 | –0.076018 |
| h | 0.546604 | –0.160142 |
| lA | 0.525417 | –0.109830 |
| aD | 0.634402 | –0.124896 |
| lD | 0.487521 | –0.121366 |
| V−A | 0.616020 | –0.145937 |
| pD | 0.629595 | –0.013870 |
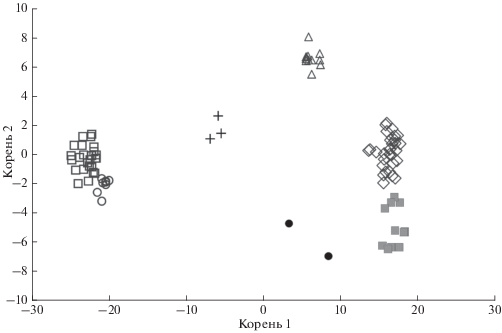
На диаграмме рассеивания все группы занимают обособленное положение (рис. 6). Исключение составляют пестрятки и карликовые самцы из р. Коль, выборки которых в поле главных дискриминирующих корней расположены в непосредственной близости – квадрат расстояния Махаланобиса составляет 39.39 (табл. 6). Однако значения критерия Фишера и их уровней значимости подтверждают, что различия между всеми группами достоверны. Группировки типично анадромных особей и каюрок из р. Коль, а также типично анадромные особи из оз. Курильское смещены в область положительных значений по оси абсцисс, тогда как пестрятки и карликовые самцы расположены в области отрицательных значений (рис. 6). Типично резидентные (озёрно-речные) особи из озёр Курильское и Большое Лисинское занимают промежуточное положение. По оси ординат анадромные и резидентные особи из Курильского озера, а также карликовые самцы из р. Коль расположены в области отрицательных значений. Каюрки из р. Коль и типично резидентные (озёрно-речные) особи из оз. Большое Лисинское смещены в область положительных значений, тогда как пестрятки и типично анадромные особи из р. Коль занимают промежуточное положение.
Рис. 6.
Фенетические отношения кижуча Oncorhynchus kisutch из оз. Курильское, оз. Большое Лисинское и р. Коль, оценённые методом дискриминантного
анализа с пошаговым включением переменных: (◇) – типично анадромные особи р. Коль
(n = 30), (△) – каюрки р. Коль (n = 18), (◻) – пестрятки р. Коль (n = 25), (⚪) – карликовые самцы р. Коль (n = 8), (⚫) – типично резидентные (озёрно-речные) особи оз. Курильское (n = 2), (+) – типично резидентные (озёрно-речные) особи оз. Большое Лисинское (n = 3), ( ) – типично анадромные особи оз. Курильское (n = 12).
) – типично анадромные особи оз. Курильское (n = 12).
ОБСУЖДЕНИЕ
В роде тихоокеанских лососей Oncorhynchus s. str. степень выраженности анадромии и резидентности существенно варьирует как у разных видов, так и на внутривидовом уровне (Waples et al., 2001; Quinn, 2005; Павлов, Савваитова, 2008, 2010; Glubokovsky, Marchenko, 2019). Среди шести видов рода пресноводные (жилые) жизненные формы широко распространены у нерки и симы; зачастую они обитают симпатрично с проходными, но также известны случаи формирования изолированных от моря самовоспроизводящихся популяций (Ricker, 1938, 1940; Моисеев, 1957; Крохин, 1967; Nelson, 1968; Смирнов, 1975; Honda et al., 1980, 1983; Крогиус, 1981; Groot, Margolis, 1991; Бугаев, 1995; Quinn, 2005). Относительно недавно жилые формы (карликовые самцы и типично резидентная форма) были обнаружены в природной популяции чавычи O. tshawytscha из Снэйк-Ривер − бассейна р. Колумбия (Johnson et al., 2012; Jeffers, 2019). Кроме того, были установлены случаи формирования искусственных изолированных пресноводных популяций чавычи выше дамб и плотин (Romer, Monzyk, 2014; Perales et al., 2015). Пресноводные формы в пределах естественного ареала не описаны только у горбуши и кеты (Смирнов, 1975; Groot, Margolis, 1991; Quinn, 2005).
Новые данные, появившиеся в последние 20–30 лет, указывают на то, что жилой кижуч распространён значительно шире в пределах азиатской части ареала, а структура вида более сложна, чем принято считать (Токранов и др., 2004; Зорбиди и др., 2006; Зорбиди, 2010; Волобуев, Марченко, 2011; Кириллова и др., 2014).
Пресноводная компонента в структуре вида чаще представлена созревающими в пресной воде самцами, реже – особями обоих полов. Исключение составляют уникальные природные самовоспроизводящиеся популяции, обитающие в изолированных озёрах лагунного типа Котельное и Малое Саранное на восточном побережье Камчатки (Смирнов, 1975; Куренков и др., 1982; Зорбиди и др., 2006; Зорбиди, 2010). Очевидно, возникновение этих пресноводных популяций кижуча связано с природными процессами, в недавнем геологическом прошлом (поднятием суши) приведшими к изоляции водоёмов от моря и невозможности захода в них проходных рыб (Смирнов, 1975; Куренков и др., 1982).
В озёрно-речных системах, не имеющих физических барьеров для захода рыб из моря, пресноводный кижуч является неотъемлемой составляющей локальной популяции, формируя единый репродуктивный комплекс с проходным (табл. 8). Показательным примером тому является оз. Саранное на о-ве Беринга (Командорские о-ва), где жилой кижуч (“байдарка”) размножается совместно с проходным на одних и тех же нерестилищах в одно и то же время (Смирнов, 1975; Куренков, 1977; Куренков и др., 1982).
Таблица 8.
Характеристика пресноводных группировок кижуча Oncorhynchus kisutch из некоторых водных систем Камчатки и о-ва Беринга
| Параметр | Озеро, локальность, источник информации | ||||||
|---|---|---|---|---|---|---|---|
| Курильское | Большое Лисинское | Саранное | Котельное | Малое Саранное | Халактырское | Голыгинское | |
| юг Камчатки | о-в Беринга | Восточная Камчатка | юг Камчатки | ||||
| Наши данные | Наши данные | Куренков и др., 1982; архив МГУ* | Зорбиди, 2010 | Смирнов, 1975 | Куренков и др., 1982 | Зорбиди, 2010 | |
| Тип водоёма | Озёрно-речная система, озеро расположено в горной местности | Озёрно-речная система, озеро расположено в предгорьях | Озёрно-речная система, озеро расположено в предгорьях | Озеро лагунного типа | Озеро лагунного типа | Озеро лагунного типа, испытывает антропогенную эвтрофикацию | Озёрно-речная система, озеро расположено в горной местности |
| Сток в море | Есть | Есть | Есть | Нет | Нет | Есть | Есть |
| Длина (FL), мм | 250–490 | 218–300 | 290–530 | 250–350 | 290–530 | 212–245 | 246–286 |
| Масса, г | 195–1320 | 100–330 | 200–2100 | до 600 | до 550 | 124–160 | 231–339 |
| Возраст, лет | 2+−3+ | 2+ | 3+−4+ | 3+−4+ | 3+−4+ | 1+−4+ | 1+−3+ |
| Половой состав | Самцы | Самцы | Самцы и самки | Самцы и самки | Самцы и самки | Самцы и самки | Самцы и самки |
| Самцы : самки, % | 100 | 100 | 52−60 : 40−48 | 50 : 50 | 50 : 50 | – | 57 : 43 |
| Локализация нерестилищ | В притоках озера | На литорали озера | – | ||||
| Взаимоотношения с проходными рыбами | Единое стадо | Озёрный изолят | Единое стадо | ||||
Причины формирования пресноводной компоненты у кижуча в отдельных водоёмах заключаются в особенностях нагульных условий, при которых становится возможным созревание некоторой части особей без выхода в море (Wood, Foote, 1996; Hendry et al., 2004; Glubokovsky, Marchenko, 2019). Согласно данным литературы и нашим собственным, ключевым условием для созревания кижуча в пресной воде является переход на хищничество и обеспеченность рыбной пищей (Введенская, 1983; Введенская, Куренков, 1988; Зорбиди и др., 2006; Кириллова и др., 2014). Среди тихоокеанских лососей кижуч во время морской фазы жизненного цикла в наибольшей степени является хищником (Emmett et al., 1986; Hofmeister, 1987; Коваль, 2007; Johnson, Schindler, 2009), в связи с чем некоторые исследователи считают, что переход на потребление рыбы у кижуча в условиях крупного пресноводного водоёма (озера) может быть обусловлен генетически (Куренков и др., 1982; Введенская, Куренков, 1988; Ruggerone, Rogers, 1992). По-видимому, именно доступность рыбы в качестве кормового объекта в оз. Саранное (Куренков и др., 1982) обеспечивает существование жилого кижуча. Несмотря на то что, согласно гидрохимическим характеристикам, это озеро является олиготрофным, гомотермия и интенсивное высвобождение биогенных элементов в результате ветрового перемешивания способствуют развитию обильной бентофауны (Куренков, 1970), также входящей в спектр питания кижуча.
Примечательно, что перечисленные выше водоёмы (озёра Котельное, Малое Саранное и Саранное) расположены на небольшом удалении от моря. Новые свидетельства существования жилого кижуча в экосистемах Камчатки и материкового побережья Охотского моря в конце ХХ–начале XXI вв. относятся к сточным водоёмам, удалённым от моря на десятки и сотни километров.
В оз. Халактырское на восточном побережье Камчатки, имеющем свободный сток в море, но расположенном на значительном удалении от него, жилой кижуч, как и в оз. Саранное, представлен особями обоих полов (табл. 8). Однако преобладание пресноводной компоненты в локальной популяции кижуча в этом озере, по-видимому, обусловлено не естественными причинами, а коренной антропогенной трансформацией экосистемы, которая включает изменение температурного режима в результате сброса тёплых вод с расположенной на берегу ТЭЦ, и сопутствующей эвтрофикацией водоёма из-за поступления бытовых стоков (Ступникова, Голованева, 2019). Также существует гипотеза о том, что формированию типично резидентной формы способствовал избыточный вылов проходного кижуча (Куренков и др., 1982; Токранов и др., 2004; Зорбиди, 2010), что считается возможной причиной смещения популяционного равновесия в сторону повышения доли резидентных рыб (Myers et al., 1986; Gross, 1991).
В оз. Курильское, в котором ранее резидентные формы тихоокеанских лососей не отмечались вовсе, были обнаружены только пресноводные самцы кижуча, ведущие озёрно-речной образ жизни (табл. 8). Пресноводный образ жизни пойманных особей подтверждает соотношение Sr2+/Ca2+ в отолитах (рис. 3), которое соответствует уровню, свойственному резидентным лососёвым рыбам, в том числе в популяциях, где они обитают симпатрично с анадромными (Rieman et al., 1994; Radtke et al., 1996; Зиммерман и др., 2003; Bacon et al., 2004; Gillanders, 2005; Hobbs et al., 2005). Относительно высокое значение соотношения Sr2+/Ca2+ в зоне примордиумов как жилых, так и проходных особей кижуча оз. Курильское является проявлением материнского эффекта: соотношение ионов Sr2+/Ca2+ в примордиуме соответствует среде, в которой проходил период вителлогенеза, и указывают на то, что все исследованные особи произошли от проходных самок (Kalish, 1990; Rieman et al., 1994; Volk et al., 2000; Зиммерман и др., 2003; Кузищин и др., 2003). Снижение соотношения Sr2+/Ca2+ к моменту поимки у проходной особи FL 639 мм, по-видимому, обусловлено её более длительным пребыванием в пресной воде, чем особи FL 602 мм (рис. 3).
Анализ чешуи показал, что жилой кижуч Курильского озера характеризуется ускоренным темпом роста во время полового созревания в пресной воде: в этот период на чешуе закладывается большее число расширенных склеритов (табл. 3, рис. 2). Сходство строения центральных зон чешуи жилого и проходного кижуча со структурой чешуи молоди, нагуливающейся на литорали озера вблизи притоков Этамынк и Выченкия, указывает на то, что молодь проводит первые два года жизни в низовьях притоков и в прилежащей акватории озера. По завершении этого этапа нагула в пресной воде большинство рыб реализует анадромную жизненную стратегию и мигрирует в море, небольшая часть остаётся в озере, реализуя резидентную жизненную стратегию.
Появление и распространение жилого кижуча в Курильском озере, по-видимому, является отражением долгопериодных изменений условий обитания в водоёме (Кириллова и др., 2014). Так, с конца 1970-х–начала 1980-х гг. наблюдается повышение температуры воды в озере (Лепская, Маслов, 2009), которое, очевидно, является следствием масштабных климатических колебаний в Северной Пацифике, особенно явно проявляющихся с конца ХХ в. (Mantua, Hare, 2002; Кляшторин, Любушин, 2005; Overland et al., 2008). Изменения температурного режима Курильского озера сопряжены с изменениями его гидрологического режима. Так, в 2000-х гг. наблюдалось увеличение годовой нормы осадков, преимущественно в зимний период, которые летом служат источником воды для нерестовых притоков (Лепская, Маслов, 2009), что привело к повышению уровня воды в озере, затоплению обширных участков суши в весенне-летний период (Кириллова и др., 2012, 2014). Известно, что молодь кижуча в пресной воде тяготеет к хорошо прогреваемым участкам с замедленным течением (Shapovalov, Taft, 1954; Смирнов, 1975; Groot, Margolis, 1991), потому затопление литорали оз. Курильское создало благоприятные условия для массового нагула молоди кижуча на этих участках (Кириллова и др., 2012, 2014). Нагульными акваториями для молоди кижуча стали затопленные устья бывших русел притоков и заболоченные низовья отдельных притоков (реки Этамынк и Кирушутк). Особо следует отметить бухты Зелёная и Тёплая, в которых бьют горячие термальные ключи. До откочёвки в пелагиаль озера эти участки акватории использовали для нагула сеголетки нерки и молодь трёхиглой колюшки Gasterosteus aculeatus – объекты питания кижуча. Улучшение условий питания для молоди кижуча могло привести к созреванию части особей в пресной воде озера. Не исключено, что аналогичные процессы происходят и в оз. Голыгинское, которое расположено недалеко от оз. Курильское (расстояние между ними составляет ~ 40 км).
Все описанные выше находки жилого кижуча относятся к озёрам и озёрно-речным системам. Однако мы установили, что и в речных системах, не имеющих озёр в своих бассейнах, в составе популяций кижуча возможно наличие пресноводной компоненты, представленной карликовыми (неотеническими) самцами. Ранее эта жизненная форма у кижуча не была известна вовсе. Поимки карликовых самцов при тотальных обловах (в бассейне р. Коль обследовано 11 притоков, 26 родниковых ручьёв и 14 участков основного русла реки; проведено 1108 обловов, площадь которых составила 653 га) и биологический анализ выборок, объём которых исчисляется тысячами особей, подтверждают, что это явление – крайне редкое. Поэтому нельзя исключать, что и в других водотоках в пределах ареала вида карликовые самцы кижуча являются неотъемлемой составляющей локальных популяций, но в силу малочисленности их обнаружение затруднительно. При этом следует пояснить, что так называемые “карлики”, упомянутые в литературе (Горшков, 1977; Куренков, 1977; Куренков и др., 1982; Введенская, Куренков, 1988; Зорбиди и др., 2006; Зорбиди, 2010), описаны в озёрах и по своим свойствам (мелкие рыбы, созревающие в возрасте 1+, имеющие серебристую окраску, обитающие в толще воды) относятся к типично резидентной форме (Glubokovsky, Marchenko, 2019).
Таким образом, имеющиеся на сегодняшний день данные позволяют в новом свете рассмотреть структуру вида кижуча (рис. 7). Вид представлен особями, реализующими анадромную и резидентную жизненные стратегии. Среди анадромных (проходных) рыб преобладает типично анадромная форма (Shapovalov, Taft, 1954; Groot, Margolis, 1991; Зорбиди, 2010), но нередко встречается и карликовая анадромная (каюрки). Резидентные (жилые) рыбы, составляющие пресноводную компоненту в структуре вида, в подавляющем большинстве представлены типично резидентной формой, и лишь недавно нами была обнаружена карликовая резидентная форма (неотенические самцы). Типично резидентная форма состоит из двух различных по своей сути элементов: обоеполых озёрных изолятов и озёрно-речных рыб.
Рис. 7.
Структура вида кижуча Oncorhynchus kisutch и взаимоотношения внутривидовых группировок (схема).

Обоеполые озёрные изоляты населяют водоёмы, в которые не заходят проходные рыбы. Примером таких популяций является кижуч из озёр Котельное и Малое Саранное. По своим биологическим свойствам эти популяции, возможно, являются аналогом изолированных популяций нерки-кокани (Крохин, Крогиус, 1936; Ricker, 1938, 1940; Остроумов, 1977), произошедшей от проходной формы, но обособившейся настолько, что некоторые исследователи рассматривают её в ранге подвида O. nerka kennerlyi (Крохин, Крогиус, 1936; Ricker, 1938, 1940; Nelson, 1968). Однако без соответствующих генетических исследований кижуча из озёрных изолятов их подвидовой статус дискуссионен.
То, что кижуч при определённых условиях может формировать пресноводные популяции, подтверждается данными по его интродукции. Так, у южной границы ареала вида в Азии, на юге о-ва Сахалин, в оз. Тунайча, в 1990-х гг. проводили эксперимент по акклиматизации кижуча из северных районов (Любаев, 2002). В озере, помимо типично анадромной, сформировалась симпатрично обитающая с ней типично резидентная форма. Однако без поддержки искусственного воспроизводства численность резидентного кижуча в этом водоёме снижалась (Гудков, Заварзина, 2006) до полного его исчезновения в начале 2010-х гг. (Живоглядов и др., 2015). Кроме того, известно, что на североамериканском побережье в бессточных озёрах штата Монтана проводили зарыбление молодью кижуча для организации спортивного рыболовства, но устойчивые самовоспроизводящиеся популяции при этом не образовывались (Rounsefell, 1958).
Жилые озёрно-речные рыбы встречаются в полиморфных популяциях, населяющих озёра со свободным стоком в море. В таких водоёмах проходные и пресноводные компоненты вида сосуществуют и взаимодействуют друг с другом, причём среди жилых (озёрно-речных) рыб есть и самцы, и самки. Примером такой популяции может служить кижуч в оз. Саранное на о-ве Беринга (Смирнов, 1975; Куренков и др., 1982). В данном случае жилой и проходной кижуч оз. Саранное – элементы одной популяционной системы, формирующие единый репродуктивный комплекс (Куренков, 1977; Куренков и др., 1982). Следует отметить, что такая организация популяции у кижуча не аналогична симпатрично обитающим популяциям проходной нерки и кокани, степень дивергенции которых очень высока, а гибридизация ограничена пре- и постзиготическими барьерами (Foote, Larkin, 1988; Wood, Foote, 1990, 1996; Craig, Foote, 2001). Можно предположить, что полиморфизм популяции кижуча этого водоёма вторичен: жилой кижуч оз. Саранное сформировался как изолят, аналогично озёрам Котельное и Малое Саранное, если в относительно недавней геологической истории водоёма был период изоляции от моря. Впоследствии, после восстановления стока, произошла реколонизация водоёма проходным кижучем. Командорские о-ва расположены в геологической зоне с множеством тектонических разрывов (Baranov et al., 1991; Баранов и др., 2010; Чебров и др., 2019), формирующих несколько десятков трансформных блоков (Кравчуновская, 2008). По границам блоков наблюдаются вертикальные смещения, величина которых варьирует от нескольких до 20−25 м (Чуян и др., 2004; Левин и др., 2006; Kozhurin, 2007; Баранов и др., 2010). Таким образом, в настоящее время возможность созревания части популяции кижуча (как самцов, так и самок) в пресной воде оз. Саранное на о-ве Беринга может быть следствием геологических процессов и существующих в настоящее время специфических термических и трофических условий в водоёме.
Лагунно-лиманное происхождение оз. Халактырское (Остроумов, 1985) позволяет предположить, что причины появления в нём кижуча типично резидентной формы, представленной самцами и самками, и её симпатрического обитания с типично анадромной формой в отсутствие препятствий для выхода в море, аналогичны таковым в Саранном озере. Коренная антропогенная трансформация водоёма в наши дни, приведшая к его эвтрофикации (Ступникова, Голованева, 2019), в совокупности с избыточным выловом проходного кижуча привели к преобладанию пресноводной компоненты в локальной популяции.
В большинстве случаев жилой кижуч представлен созревающими в озёрах самцами, которые являются неотъемлемым элементом локальной популяции. Обнаружение жилых особей кижуча в Курильском озере, в котором ранее не были известны пресноводные формы тихоокеанских лососей, указывает на их происхождение от проходных рыб. Вследствие глобальных климатических изменений термические и трофические условия в водоёме стали благоприятны для созревания некоторой части популяции в пресной воде. Известно, что для достижения половой зрелости самцам требуется меньше энергетических ресурсов, чем самкам (Крохин, 1967; Никольской, 1980; Павлов, Савваитова, 2008), поэтому появление жилых самцов в водоёме, где ранее обитали только проходные особи, представляется закономерным.
Жилой кижуч озёр Курильское и Большое Лисинское, равно как и других водоёмов, где он был обнаружен (рис. 1), фактически представляет собой аналог остаточной формы нерки, когда в озёрах часть самцов созревает без выхода в море и при этом является составной частью общего нерестового стада (Ricker, 1940; Крохин, 1967). Такое же название – residual − используется для жилого кижуча из оз. Култус (Британская Колумбия) (Foerster, Ricker, 1953). Сходство рыб остаточной формы у кижуча и нерки проявляется в менее выраженном брачном наряде по сравнению с проходными особями (Ricker, 1940; Foerster, Ricker, 1953; Куренков и др., 1982; Зорбиди, 2010; наши данные).
В подтверждение тесной связи проходных и жилых рыб, в том числе остаточной формы у тихоокеанских лососей выступает тот факт, что в отдельных популяциях доля таких резидентных особей может быть весьма высока, тогда как среди проходных рыб соотношение полов значительно смещено в сторону самок. Так, в бассейне оз. Дальнее (Восточная Камчатка) доля остаточной нерки, на 95% состоящей из самцов, варьирует в пределах 20–27%; у нерки р. Ола (Тауйская губа, материковое побережье Охотского моря) ~ 75% проходной нерки составляют самки (Марченко и др., 2017); у симы подходы на 60–90% состоят из самок, а самцы резидентных форм во время нереста восполняют дефицит проходных самцов (Glubokovsky, Marchenko, 2019).
Особым элементом структуры популяций кижуча являются карликовые (неотенические) самцы, обитающие в реках (рис. 7), не имеющих озёр в своём бассейне. При этом р. Коль, в которой были обнаружены карликовые самцы кижуча, отличается сложной геоморфологической структурой, имеет развитую систему придаточных водоёмов, которые молодь лососёвых использует для нагула (Павлов и др., 2009). Благоприятные трофические условия (разнообразие нагульных биотопов) предопределили возможность реализации резидентной жизненной стратегии у кижуча в реке. Но для достижения половой зрелости без выхода в море, как и в озёрах, необходимо потребление рыбной пищи. В р. Коль, отличающейся высоким видовым разнообразием и высокой плотностью молоди рыб (Павлов и др., 2009), это условие выполнимо – рыбная пища доступна для молоди кижуча в необходимом для созревания количестве.
Присутствие жилых особей у тихоокеанских лососей (кроме горбуши и кеты) в озёрно-речных и речных системах является результатом проявления индивидуальной изменчивости в пределах нормы реакции вида. Обнаружение значительного количества озёрных изолятов кижуча даёт основание полагать, что способность к реализации резидентной жизненной стратегии у этого вида выше, чем принято считать. Но до недавнего времени находки жилых особей кижуча рассматривались как редкий феномен и не являлись поводом для ревизии структуры вида.
Глобальные климатические сдвиги, произошедшие на рубеже XX–ХXI вв. и продолжающиеся по настоящее время, привели к изменениям температурных и трофических условий в лососёвых водоёмах. Это предопределило проявление генетически детерминированных адаптивных способностей у лососёвых рыб (экологической пластичности), в том числе и у кижуча. Экологическая пластичность лососёвых проявляется в быстром изменении структуры популяций за счёт образования новых жизненных форм (фенотипов) или изменения соотношения существующих. Дифференциация анадромного и резидентного кижуча разных жизненных форм и пестряток, жизненная стратегия которых ещё не определена, по совокупности пластических признаков (рис. 4−6) является проявлением морфологических адаптаций к условиям обитания. Закономерно, что карликовые самцы и пестрятки, ведущие демерсальный образ жизни, имеют относительно короткий хвостовой стебель, крупные грудные плавники и большой глаз в отличие от типично анадромных особей и каюрок, ведущих пелагический образ жизни и совершающих протяжённые миграции. Попадание жилых особей из озёр Курильское и Большое Лисинское в разные кластеры (рис. 4), возможно, обусловлено, как уже отмечалось ранее, крайне малыми объёмами выборок, однако бесспорно, что специфика условий в отдельных водоёмах может приводить к формированию локальных габитуальных особенностей жилого и проходного кижуча (рис. 5, 6).
Наличие в структуре вида у кижуча разнообразных пресноводных группировок (рис. 7) может рассматриваться как проявление широкой нормы реакции генома (или скрытого полиморфизма), пластичности индивидуальных программ развития особей в ответ на воздействие факторов среды обитания. Известно, что лососёвые рыбы способны реализовывать резервные потенциальные возможности вида на популяционном уровне организации (Hendry, Stearns, 2004), которые обеспечивают усложнение структуры популяции, появление дополнительных элементов в её составе и, как следствие, повышение её устойчивости и приспособленности к переменчивой среде. Кижуч представляет собой показательный пример этого. Однако для понимания протекающих в природе микроэволюционных процессов необходимы уточнённые данные по взаимоотношениям жилых и проходных особей в случае симпатрического обитания, включая молекулярно-генетический анализ.
Обнаруженные проявления внутривидовой изменчивости у кижуча, его экологической пластичности требуют проведения дополнительных исследований. Представляется важным формирование более полной картины встречаемости элементов пресноводной компоненты на ареале. Так, жилой кижуч до настоящего времени не обнаружен на севере материкового побережья Охотского моря и на Чукотке. По-видимому, для формирования жилых форм необходимо соблюдение ряда условий, среди которых ключевыми являются слабая проточность водоёма, температурные условия и благоприятные условия питания (наличие корма и его доступность). Можно предположить, что в условиях глобальных климатических изменений возможно появление жилого кижуча в озёрно-речных системах, где ранее были известны только проходные особи. В настоящее время Курильское озеро – самый южный водоём, в котором обнаружен жилой кижуч типично резидентной формы, при том, что проходной кижуч распространён дальше на юг, вплоть до о-ва Хоккайдо (Groot, Margolis 1991; Зорбиди, 2010). Возможность появления жилого кижуча в более южных водоёмах показана в результате эксперимента по интродукции в оз. Тунайча (о. Сахалин) (Любаев, 2002), однако причины, по которым самовоспроизводящаяся популяция в водоёме не сформировалась, являются предметом отдельного исследования. Вероятно, перечень находок жилого кижуча расширят исследования реликтовых озёр, не имеющих рыбохозяйственной ценности в силу отсутствия проходных форм тихоокеанских лососей. Эти сведения, несомненно, будут представлять интерес для познания становления кижуча как вида, ревизии структуры вида и эволюционной истории лососёвых рыб.
Список литературы
Баранов Б.В., Гедике К., Фрейтаг Р., Дозорова К.А. 2010. Активные разломы юго-восточной части Камчатского полуострова и Командорская зона сдвига // Вестн. КРАУНЦ. Науки о Земле. № 2. Вып. № 16. С. 66−77.
Берг Л.С. 1948. Рыбы пресных вод СССР и сопредельных стран. Ч. 1. М.; Л.: Изд-во АН СССР, 466 с.
Берг Л.С. 1961. Избранные труды. Т. 4. Ихтиология. М.; Л.: Изд-во АН СССР, 746 с.
Бугаев В.Ф. 1995. Азиатская нерка (пресноводный период жизни, структура локальных стад, динамика численности). М.: Колос, 464 с.
Бугаев В.Ф., Кириченко В.Е. 2008. Нагульно-нерестовые озёра азиатской нерки (включая некоторые другие водоёмы ареала). Петропавловск-Камчатский: Камчатпресс, 280 с.
Введенская Т.Л. 1983. Некоторые черты биологии молоди кижуча, нагуливающегося в бассейне оз. Дальнего (Камчатка) // Тез. докл. X Всесоюз. симп. “Биологические проблемы Севера”. Ч. 2. Животный мир. Магадан: Изд-во ИБПС. С. 151–152.
Введенская Т.Л., Куренков И.В. 1988. Некоторые черты биологии пресноводного кижуча оз. Дальнего (Камчатка) // Тез. докл. III Всесоюз. совещ. “Современное состояние исследований лососевидных рыб”. Тольятти. С. 54–55.
Волобуев В.В., Марченко С.Л. 2011. Тихоокеанские лососи континентального побережья Охотского моря. Магадан: Изд-во МагаданНИРО, 303 с.
Волобуев В.В., Рогатных А.Ю. 1982. Эколого-морфологическая характеристика кижуча Oncorhynchus kisutch (Walb.) (Salmonidae) материкового побережья Охотского моря // Вопр. ихтиологии. Т. 22. Вып. 6. С. 974–980.
Горшков С.А. 1977. К вопросу о дорсальных фонтанелях у жилых и карликовых форм кижуча Oncorhynchus kisutch (Walb.) и нерки Oncorhynchus nerka (Walb.) // Основы классификации и филогении лососевидных рыб. Л.: Изд-во ЗИН АН СССР. С. 49–53.
Государственный водный реестр РФ. 2020. (https://goo.su/1kH6. Version 08/2020)
Грибанов В.И. 1948. Кижуч Oncorhynchus kisutch (Walb.) // Изв. ТИНРО. Т. 28. С. 45–101.
Гудков П.К., Заварзина Н.К. 2006. Сравнительный анализ ихтиофауны некоторых водоёмов Тонино-Анивского полуострова Сахалина // Тр. СахНИРО. Т. 8. С. 50–66.
Двинин П.A. 1949. Жилая фopмa кижуча из oзepa Саранного // ДАН СССР. Т. 69. № 5. С. 695–698.
Живоглядов А.А., Живоглядова Л.А., Метленков А.В. 2015. Питание массовых видов рыб солоноватоводного оз. Тунайча (юго-восточный Сахалин) весной 2012 г. // Тр. ВНИРО. Т. 158. С. 64–74.
Животовский Л.А. 2015. Эволюционная история тихоокеанских лососей и форелей // Там же. Т. 157. С. 4–23.
Зиммерман К.Е., Кузищин К.В., Груздева М.А. и др. 2003. Опыт определения жизненной стратегии микижи Parasalmo mykiss (Walbaum) (Salmonidae, Salmoniformes) Камчатки на основании анализа соотношения Sr/Ca в отолитах // ДАН. Т. 389. № 2. С. 274–279.
Зорбиди Ж.Х. 2010. Кижуч азиатских стад. Петропавловск-Камчатский: Изд-во КамчатНИРО, 306 с.
Зорбиди Ж.Х., Толстяк Т.И., Маслов А.В. 2006. Характеристика внутривидовых форм азиатского кижуча Oncorhynchus kisutch Walbaum (Salmonidae) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 8. С. 126–141.
Иванков В.Н., Броневский В.М. 1978. Постларвальная неотения у рыб // Зоол. журн. Т. 57. Вып. 1. С. 87–93.
Кириллова Е.А., Кириллов П.И., Павлов Д.С., Звездин А.О. 2012. Состав ихтиофауны, распределение и миграции молоди рыб в бассейне Курильского озера и реки Озёрной (южная Камчатка) // Сб. науч. тр. Кроноцкого гос. природ. биосфер. заповедника. Вып. 2. Петропавловск-Камчатский: Камчатпресс. С. 221–230.
Кириллова Е.А., Кириллов П.И., Павлов Д.С. 2014. Изменения структуры ихтиофауны Курильского озера (южная Камчатка) // Чтения памяти В.Я. Леванидова. Вып. 6. С. 302–310.
Кляшторин Л.Б., Любушин А.А. 2005. Циклические изменения климата и рыбопродуктивности. М.: Изд-во ВНИРО, 235 с.
Коваль М.В. 2007. Кормовая база и особенности питания тихоокеанских лососей в прикамчатских водах Охотского и Берингова морей и в северной части Тихого океана: Автореф. дис. … канд. биол. наук. Петропавловск-Камчатский: КамчатГТУ, 24 с.
Кравчуновская Е.А. 2008. Определение относительного возраста движения блоков земной коры методами морфотектоники (на примере острова Беринга) // Вестн. МГУ. Сер. 5. География. № 4. С. 37−41.
Красная книга Камчатского края. 2018. Т. 1. Животные. Петропавловск-Камчатский: Камчатпресс, 196 с.
Красная книга Камчатки. 2006. Т. 1. Животные. Петропавловск-Камчатский: Камчат. печат. двор, 272 с.
Крогиус Ф.В. 1981. Роль карликовых форм в воспроизводстве проходной красной Oncorhynchus nerka (Walbaum) // Вопр. ихтиологии. Т. 21. Вып. 6. С. 976–984.
Крохин Е.М. 1967. Материалы к познанию карликовой красной Oncorhynchus nerka Walb. в Дальнем озере (Камчатка) // Там же. Т. 7. Вып. 3 (44). С. 433–445.
Крохин Е.М., Крогиус Ф.В. 1936. Озёрная форма красной (Oncorhynchus nerka) из Кроноцкого озера на Камчатке // ДАН СССР. Т. 4 (13). № 2 (106). С. 87–90.
Крохин Е.М., Крогиус Ф.В. 1937. Очерк Курильского озера и биологии красной Oncorhynchus nerka (Walb.) в его бассейне // Труды Тихоокеанской компании. Т. IV. Курильское озеро. М.; Л.: Изд-во АН СССР, 187 с.
Кузищин К.В. 2010. Формирование и адаптивное значение внутривидового экологического разнообразия лососёвых рыб (семейство Salmonidae): Автореф. дис. … докт. биол. наук. М.: ИПЭЭ РАН, 49 с.
Кузищин К.В., Савваитова К.А., Груздева М.А. 1999. Структура чешуи как критерий дифференциации локальных популяций микижи Parasalmo mykiss из рек западной Камчатки и Северной Америки // Вопр. ихтиологии. Т. 39. № 6. С. 809–818.
Кузищин К.В., Груздева М.А., Зиммерман К. и др. 2003. Определение жизненной стратегии камчатской микижи Parasalmo mykiss (Walb.) по соотношению Sr/Ca в отолитах // Матер. IV науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский. С. 59–60.
Куренков С.И. 1970. Красная озера Саранного (Командорские острова) // Изв. ТИНРО. Т. 78. С. 49–60.
Куренков С.И. 1977. Жилой кижуч камчатских озер // Вопр. географии Камчатки. Вып. 7. С. 52–55.
Куренков С.И., Горшков С.А., Толстяк Т.И. 1982. Распространение и биология пресноводного кижуча Oncorhynchus kisutch (Walb.) (Salmonidae) на Камчатке // Вопр. ихтиологии. Т. 22. Вып. 6. С. 966–873.
Лакин Г.Ф. 1980. Биометрия. М.: Высш. шк., 294 с.
Левин В.Е., Магуськин М.А., Бахтиаров В.Ф. и др. 2006. Мультисистемный геодезический мониторинг современных движений земной коры на Камчатке и Командорских островах // Вулканология и сейсмология. № 3. С. 54−67.
Лепская Е.В., Маслов А.В. 2009. Долгосрочные изменения гидрометеорологической обстановки в бассейне озера Курильского (Камчатка) и особенности трансформации “рыбного” фосфора в озёрной экосистеме // Изв. ТИНРО. Т. 158. С 293–302.
Любаев В.Я. 2002. Экологические и биотехнические аспекты создания стад кижуча на рыбоводных заводах: Автореф. дис. … канд. биол. наук. М.: МГТА, 22 с.
Малютина А.М., Жукова К.А., Кузищин К.В. 2019. О находке жилого кижуча в бассейне р. Лисинской (о. Беринга, Командорские о-ва) // Матер. ХX Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский. С. 216–218.
Марченко С.Л., Голованов И.С., Хованская Л.Л. и др. 2017. Жилая нерка озера Киси (реки Ола) // Матер. VIII Всерос. науч.-практ. конф. “Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование”. Ч. I. Петропавловск-Камчатский: Изд-во КамчатГТУ. С. 154–156.
Моисеев П.А. 1957. Образование жилой формы симы (Oncorhynchus masou morpha formosanus (Jordan et Oshima) в бассейне реки Седанка // ДАН СССР. Т. 112. № 1. С. 163–164.
Николаев А.С., Николаева Е.Т. 1991. Некоторые аспекты лимнологической классификации нерковых озёр Камчатки // Исследования биологии и динамики численности промысловых рыб Камчатского шельфа. Вып. 1. Ч. 1. Петропавловск-Камчатский: Изд-во КоТИНРО. С. 3−17.
Никольский Г.В. 1980. Структура вида и закономерности изменчивости рыб. М.: Пищ. пром-сть, 184 с.
Остроумов А.Г. 1970. Результаты аэровизуального учета и аэрофотосъемки красной и её нерестилищ в бассейне оз. Курильского // Изв. ТИНРО. Т. 78. С. 17−32.
Остроумов А.Г. 1977. Жилая нерка Oncorhynchus nerka kennerlyi (Suckley) в бассейне р. Воровская (Западная Камчатка) // Вопр. ихтиологии. Т. 17. Вып. 6 (106). С. 941–943.
Остроумов А.Г. 1985. Нерестовые озёра Камчатки // Вопр. географии Камчатки. Вып. 9. С. 47–56.
Павлов Д.С., Савваитова К.А. 2008. К проблеме соотношения анадромии и резидентности у лососёвых рыб (Salmonidae) // Вопр. ихтиологии. Т. 48. № 6. С. 810–824.
Павлов Д.С., Савваитова К.А. 2010. Внутривидовая структура рыб. Анадромия и резидентность у лососёвых рыб // Актуальные проблемы современной ихтиологии. М.: Т-во науч. изд. МКМ. С. 33–61.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2001. Тихоокеанские благородные лососи и форели Азии. М.: Науч. мир, 200 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2009. Состояние и мониторинг биоразнообразия лососёвых рыб и среды их обитания на Камчатке (на примере территории заказника “Река Коль”). М.: Т-во науч. изд. КМК, 152 с.
Павлов Д.С., Кузищин К.В., Груздева М.А. и др. 2013. Разнообразие жизненной стратегии мальмы Salvelinus malma (Walbaum) (Salmonidae, Salmoniformes) Камчатки: онтогенетические реконструкции по данным рентгенофлуоресцентного анализа микроэлементного состава регистрирующих структур // ДАН. Т. 450. № 2. С. 240–244. https://doi.org/10.7868/S0869565213150267
Павлов Д.С., Кириллов П.И., Кириллова Е.А. и др. 2016. Состояние биоразнообразия лососёвых рыб и рыбообразных и среды их обитания в бассейне реки Утхолок. М.: Т-во науч. изд. КМК, 197 с.
Правдин И.Ф. 1940. Обзор исследований дальневосточных лососей // Изв. ТИНРО. Т. 18. 105 с.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Смирнов А.И. 1975. Биология, размножение и развитие тихоокеанских лососей. М.: Изд-во МГУ, 335 с.
Ступникова Н.А., Голованева А.Е. 2019. Оценка устойчивости экосистемы озера Халактырского к эвтрофированию // Матер. X Всерос. науч.-практ. конф. “Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование”. Петропавловск-Камчатский. С. 124–127.
Токранов А.М., Бугаев В.Ф., Павлов Н.М. 2004. Жилой кижуч Oncorhynchus kisutch оз. Голыгинское (южная Камчатка) // Матер. V Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский. С. 92–94.
Христофоров О.Л. 1986. Состояние гонад в осенний период у кижуча Oncorhynchus kisutch (Walbaum) − объекта заводского воспроизводства в бассейне р. Тымь (северный Сахалин) // Тр. ЗИН АН СССР. Т. 154. С. 99–107.
Чебров Д.В., Чеброва А.Ю., Матвеенко Е.А. и др. 2019. Камчатка и Командорские острова // Землетрясения Северной Евразии. Вып. 22. Обнинск: Изд-во ФИЦ ЕГС РАН. С. 198–213. https://doi.org/10.35540/1818-6254.2019.22.17.
Чуян Г.Н., Разжигаева Н.Г., Быкасов В.Е. 2004. Геоморфология прибрежной зоны острова Беринга // Тр. Камчат. фил. ТИГ ДВО РАН. Вып. V. С. 421–426.
Шмидт П.Ю. 1950. Рыбы Охотского моря. М.; Л.: Изд-во АН СССР, 370 с.
Bacon C.R., Weber P.K., Larsen K.A. et al. 2004. Migration and rearing histories of chinook salmon (Oncorhynchus tshawytscha) determined by ion microprobe Sr isotope and Sr/Ca transects of otoliths // Can. J. Fish. Aquat. Sci. V. 61. № 12. P. 2425–2439. https://doi.org/10.1139/f04-167
Baranov B.V., Seliverstov N.I., Muravev A.V. et al. 1991. The Komandorsky Basin as a product of spreading behind a transform plate boundary // Tectonophysics. V. 199. P. 237−269. https://doi.org/10.1016/0040-1951(91)90174-Q
Behnke R.J. 2002. Trout and salmon of North America. N. Y.: The Free Press, 360 p.
Bird D.J., Cowx I.G. 1993. The selection of suitable pulsed currents for electric fishing in fresh waters // Fish. Res. V. 18. P. 363–376. https://doi.org/10.1016/0165-7836(93)90163-2
Craig J.K., Foote C.J. 2001. Countergradient variation and secondary sexual color: phenotypic convergence promotes genetic divergence in carotenoid use between sympatric anadromous and nonanadromous morphs of sockeye salmon (Oncorhynchus nerka) // Evolution. V. 55. P. 380–391. https://doi.org/10.1111/j.0014-3820.2001.tb01301.x
Emmett R.L., Miller D.R., Blahm T.H. 1986. Food of juvenile chinook, Oncorhynchus tshawytscha, and coho, O. kisutch, salmon off the Northern Oregon and Southern Washington coasts // Calif. Fish Game Tech. Rept. V. 72. № 1. P. 38-46.
Foerster R.E., Ricker W.E. 1953. The coho salmon of Cultus Lake and Sweltzer Creek // J. Fish. Res. Board Can. V. 10. P. 293–319. https://doi.org/10.1139/f53-021
Foote C.J., Larkin P.A. 1988. The role of male choice in the assortative mating of anadromous and non-anadromous sockeye salmon (Oncorhynchus nerka) // Behaviour. V. 106. № 1–2. P. 43–61.
Gillanders B.M. 2005. Otolith chemistry to determine movements of diadromous and freshwater fish // Aquat. Living Resour. V. 18. P. 291–300. https://doi.org/10.1051/alr:2005033
Glubokovsky M.K., Marchenko S.L. 2019. On the issue of life strategy formation in Pacific salmon of the genus Oncorhynchus (Salmonidae) // J. Ichthyol. V. 59. № 4. 516–526. https://doi.org/10.1134/S0032945219040040
Groot C., Margolis L. (Eds.). 1991. Pacific salmon life histories. Vancouver: UBC Press, 564 p.
Gross M.R. 1991. Salmon breeding behavior and the life history evolution in changing environments // Ecology. V. 72. P. 1180–1186. https://doi.org/10.2307/1941091
Hendry A.P., Stearns S.C. 2004. Evolution illuminated. Salmon and their relatives. N.Y.: Oxford Univ. Press, 510 p.
Hendry A.P., Morbey Y.E., Berg O.K., Wenburg J.K. 2004. Adaptive variation in senescence: reproductive lifespan in a wild salmon population // Proc. R. Soc. London. Ser. B. Biol. Sci. V. 271. P. 259–266. https://doi.org/10.1098/rspb.2003.2600.
Hobbs J.A., Yin Q.Z., Burton J., Bennett W.A. 2005. Retrospective determination of natal habitats for an estuarine fish with otolith strontium isotope ratios // Mar. Freshwat. Res. V. 56. № 5. P 655–660. https://doi.org/10.1071/MF04136
Hofmeister K.T. 1987. King and coho salmon in nearshore saltwater nursery areas of southeastern Southeast Alaska // Proc. Northeast Pacific pink and chum salmon Workshop. Port Townsend, WA. P. 193–200.
Honda N., Suzuki K., Amita K. et al. 1980. Studies on reproduction of landlocked masu salmon Oncorhynchus masou (Brevoot) in Okutadami reservoir. I. Vertical distribution and feeding habits of fish // Rept. Niigata Pref. Inland Water Fish. Exp. St. V. 8. P. 5−15
Honda N., Kataoka T., Hoshino M., Seki Y. 1983. Studies on the reproduction of landlocked masu salmon Oncorhynchus masou (Brevoot), in Okutadami reservoir. V. Studies on the growth and age of maturity of the land-locked masu salmon in Okutadami reservoir // Ibid. V. 10. P. 13−20.
Jeffers C.A. 2019. Novel life history tactic observed in fall-run Chinook salmon // Ecology. V. 100. № 9. Article e02733. https://doi.org/10.1002/ecy.2733.
Johnson J., Johnson T., Copeland T. 2012. Defining life histories of precocious male parr, minijack, and jack Chinook salmon using scale patterns // Trans. Amer. Fish. Soc. V. 141. P. 1545–1556. https://doi.org/10.1080/00028487.2012.705256
Johnson S.P., Schindler D.E. 2009. Trophic ecology of Pacific salmon (Oncorhynchus spp.) in the ocean: a synthesis of stable isotope research // Ecol. Res. V. 24. P. 855–863. https://doi.org/10.1007/s11284-008-0559-0
Kalish J.M. 1990. Use of otolith microchemistry to distinguish the progeny of sympatric anadromous and nonanadromous salmonids // Fish. Bull. US. V. 88. № 4. P. 657–666.
Kouřil J., Mikodina E., Mikulin A. et al. 2009. Different sensitivity between adult salmonids fish species and grayling to an anaesthetic clove oil // Abstr. Int. Conf. “Aquaculture Europe 2009”. Trondheim, Norway. P. 89.
Kozhurin A. 2007. Active faulting in the Kamchatsky Peninsula, Kamchatka-Aleutian junction // Volcanism and subduction: Kamchatka Region / Eds. Eichelberger J. et al. Washington: Amer. Geophys. Union. P. 263−282.
Mantua N.J., Hare S.R. 2002. The Pacific decadal oscillation // J. Oceanogr. V. 58. P. 35−44. https://doi.org/10.1023/A:1015820616384
McPhail J.D. 1997. The origin and speciation of Oncorhynchus revisited // Pacific salmon and their ecosystems / Eds. Stouder D.J. et al. Boston: Springer. P. 29–38. https://doi.org/10.1007/978-1-4615-6375-4_4.
Myers R.A., Hutchings J.A., Gibson R.J. 1986. Variation in male parr maturation within and among populations of Atlantic salmon, Salmo salar // Can. J. Fish. Aquat. Sci. V. 43. P. 1242–1248. https://doi.org/10.1139/f86-154
Nelson J.S. 1968. Distribution and nomenclature of North American kokanee, Oncorhynchus nerka // J. Fish. Res. Board Can. V. 25. № 2. P. 409–414. https://doi.org/10.1139/f68-032
Overland J., Rodionov S., Minobe S., Bond N. 2008. North Pacific regime shifts: definitions, issues and recent transitions // Progr. Oceanogr. V. 77. P. 92−102. https://doi.org/10.1016/j.pocean.2008.03.016
Perales K.M., Rowan J., Moyle P.B. 2015. Evidence of landlocked Chinook salmon populations in California // N. Amer. J. Fish. Manag. V. 35. № 6. P. 1101–1105. https://doi.org/10.1080/02755947.2015.1082518
Quinn T.P. 2005. The behavior and ecology of Pacific salmon and trout. Washington: Univ. Wash. Press, 378 p.
Radtke R.L., Svenning M., Malone D. et al. 1996. Migrations in an extreme northern population of Arctic charr Salvelinus alpinus: insights from otolith microchemistry // Mar. Ecol. Prog. Ser. V. 136. № 1–3. P. 13–23. https://doi.org/10.3354/meps136013
Reist J.D. 1985. An empirical evaluation of several univariate methods that adjust for size variation in morphometric data // Can. J. Zool. V. 63. P. 1429–1439. https://doi.org/10.1139/z85-213
Reist J.D. 1986. An empirical evaluation of coefficients used in residual and allometric adjustment of size covariation // Ibid. V. 64. P. 1363–1368. https://doi.org/10.1139/z86-203
Reist J.D. 1987. Comparative morphometry and phenetics of the genera of esocoid fishes (Salmoniformes) // Zool. J. Linnean Soc. V. 89. № 3. P. 275–294. https://doi.org/10.1111/j.1096-3642.1987.tb01565.x
Reynolds L., Herlihy A.T., Kaufmann P.R. et al. 2003. Electrofishing effort requirements for assessing species richness and biotic integrity in Western Oregon streams // N. Amer. J. Fish. Manag. V. 23. № 2. P. 450–461. https://doi.org/10.1577/1548-8675(2003)023<0450:EERFAS>2.0.CO;2
Ricker W.E. 1938. «Residual» and kokanee salmon in Cultus Lake // J. Fish. Res. Board Can. V. 4a. № 3. P. 192–218. https://doi.org/10.1139/f38-018
Ricker W.E. 1940. On the origin of kokanee, a fresh water type of sockeye salmon // Trans. R. Soc. Can. Ser. 3. V. 34. № 5. P. 121–135.
Rieman B.E., Myers D.L., Nielsen R.L. 1994. Use of otolith microchemistry to discriminate Oncorhynchus nerka of resident and anadromous origin // Can. J. Fish. Aquat. Sci. V. 51. № 1. P. 68–77. https://doi.org/10.1139/f94-009
Romer J.D., Monzyk F.R. 2014. Adfluvial life history in spring Chinook salmon from Quartzville Creek, Oregon // N. Amer. J. Fish. Manag. V. 34. P. 885–891. https://doi.org/10.1080/02755947.2014.923073
Rounsefell G.A. 1958. Anadromy in North American Salmonidae // Fish. Bull. Fish Wild. Serv. V. 58. P. 171–185.
Ruggerone G.T., Rogers D.E. 1992. Predation on sockeye salmon fry by juvenile coho salmon in the Chignik Lakes, Alaska: implications for salmon management // N. Amer. J. Fish. Manag. V. 12. P. 87–102. https://doi.org/10.1577/1548-8675(1992)012<0087:POSSFB>2.3.CO;2
Shapovalov L., Taft A.C. 1954. The life histories of the steelhead rainbow trout (Salmo gairdneri) and silver salmon (Oncorhynchus kisutch) with special reference to Waddell Creek, California, and recommendations regarding their management // Fish. Bull. Calif. Dept. Fish Game. № 98. 375 p.
Volk E.C., Blakley A., Schroder S.L., Kuehner S.M. 2000. Otolith chemistry reflects migratory characteristics of Pacific salmonids: using otolith core chemistry to distinguish maternal associations with sea and freshwaters // Fish. Res. V. 46. P. 251–266. https://doi.org/10.1016/S0165-7836(00)00150-8
Waples R.S., Gustafson R.G., Wietcamp L.A. et al. 2001. Characterizing diversity in salmon from the Pacific Northwest // J. Fish Biol. V. 59. Suppl. A. P. 1–41. https://doi.org/10.1111/j.1095-8649.2001.tb01376.x
Waples R.S., Pess G.R., Beechie T. 2008. Evolutionary history of Pacific salmon in dynamic environments // Evol. App-l. V. 1. P. 189–206. https://doi.org/10.1111/j.1752-4571.2008.00023.x
Wood C.C., Foote C.J. 1990. Genetic differences in the early development and growth of sympatric sockeye salmon and kokanee (Oncorhynchus nerka), and their hybrids // Can. J. Fish. Aquat. Sci. V. 47. P. 2250–2260. https://doi.org/10.1139/f90-250
Wood C.C., Foote C.J. 1996. Evidence for sympatric genetic divergence of anadromous and nonanadromous morphs of sockeye salmon (Oncorhynchus nerka) // Evolution. V. 50. P. 1265–1279. https://doi.org/10.1111/j.1558-5646.1996.tb02367.x
Zimmerman C.E., Reeves G.H. 2000. Population structure of sympatric anadromous and nonanadromous Oncorhynchus mykiss: evidence from spawning surveys and otolith microchemistry // Can. J. Fish. Aquat. Sci. V. 57. P. 2152–2162. https://doi.org/10.1139/f00-192
Zippin C. 1956. An evaluation of the removal method of estimation animal populations // Biometrics. V. 12. № 2. P. 163–189. https://doi.org/10.2307/3001759
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


