Вопросы ихтиологии, 2021, T. 61, № 5, стр. 616-620
Репродуктивные отношения белого гольца и мальмы Salvelinus malma complex (Salmonidae) низовий реки Камчатка
Е. В. Есин 1, 2, 3, *, Н. О. Мельник 1, Е. С. Бочарова 4, Г. Н. Маркевич 3
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
2 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии − ВНИРО
Москва, Россия
3 Кроноцкий государственный природный биосферный заповедник
Елизово, Камчатский край, Россия
4 Институт биологии развития РАН – ИБР РАН,
Москва, Россия
* E-mail: evgesin@gmail.com
Поступила в редакцию 02.11.2020
После доработки 23.11.2020
Принята к публикации 27.11.2020
Аннотация
В притоках р. Камчатка обнаружены нерестилища эндемичного белого гольца и симпатрично обитающей с ним мальмы Salvelinus malma complex. Подтверждена частичная репродуктивная изоляция двух групп, выявлены экологические механизмы, способствующие их расхождению по разным речным нерестилищам.
Адаптивная радиация речных рыб на основе пищевой специализации и прогрессирующей ассортативности скрещивания неоднократно показана в тропических экосистемах, приуроченных к участкам врезанных русел доголоценового возраста (Feulner et al., 2009; Schwarzer et al., 2011; Levin et al., 2020). В реках высоких широт, русловая сеть которых окончательно оформилась после ледникового периода, диверсификации с разделением лимитированных ресурсов препятствует градуальное изменение условий среды внутри речного континуума и, соответственно, отсутствие выраженных границ между экологическими нишами. Единственный известный нам пример экологической диверсификации в открытых речных системах высоких широт − комплекс симпатрических гольцов филогенетической линии Salvelinus malma complex (Salmonidae) из бассейна р. Камчатка. В среднем течении этой реки вместе с проходной мальмой обитает бентосоядный голец, нерестящийся в ключах (Савваитова и др., 1992), и рыбоядный “каменный” голец, нерестящийся в специфических условиях в зоне еловой тайги (Melnik et al., 2020). В нижнем течении в составе комплекса выделяют две речные группы – крупного рыбоядного гольца и более тугорослого бентофага. Хищник питается в реке мелкими рыбами, создающими скопления во время нерестовых и кормовых миграций (Маховенко, 1972; Савваитова и др., 1992). На основе морфологической специфики эту группу включили в состав узкоэндемичного вида S. albus (Глубоковский, 1977). Достоверные различия по аллельным частотам микросателлитных локусов ДНК (Салменкова и др., 2009), по группам крови (Васильев, Савваитова, 1972), числу и локализации ядрышкообразующих районов хромосом (Фролов, 2001) позволяют предположить наследственный характер различий между бентосоядным и хищным гольцами. С другой стороны, отсутствие аллозимных различий (Осинов, 2001) и общий набор гаплотипов митохондриальной ДНК (Олейник и др., 2010) указывают на их близкое родство и недавнюю дивергенцию. Мы предполагаем, что хищный белый голец (БГ) обособился от предка бентосоядной мальмы (МА) непосредственно в бассейне р. Камчатка.
О биологии размножения БГ до недавнего времени было известно мало. Предположения о растянутом характере его нереста (Глубоковский, 1977) во множестве притоков разного размера (Черешнев и др., 2002) не объясняют механизм его репродуктивной изоляции от МА. Анализ генетической подразделённости групп был выполнен без указания критериев их классификации в смешанных уловах (Салменкова и др., 2009). Мы впервые обнаружили нерестилище БГ, верифицировали репродуктивную изоляцию групп путём анализа полиморфизма микросателлитной ДНК и оценили экологические факторы, способствующие ассортративному скрещиванию и формированию экологических презиготических барьеров.
МАТЕРИАЛ И МЕТОДИКА
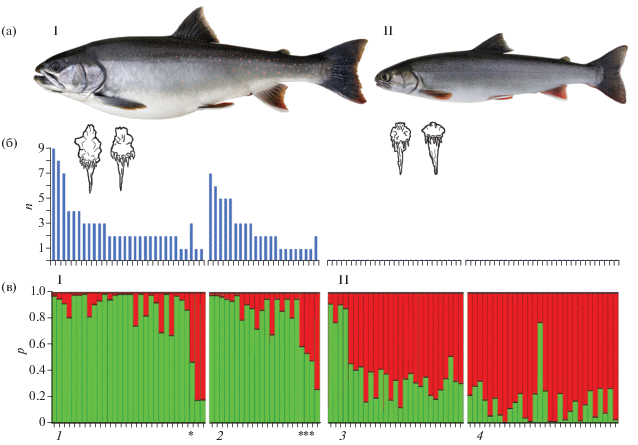
Взрослых рыб с гонадами IV−V стадии зрелости (суммарно 111 экз.) отловили спиннингами и жаберными сетями в августе−октябре 2019 г. на нерестилище в р. Радуга (56°33′26″ с.ш. 161°51′17″ в.д.), в основном русле р. Камчатка (56°13′48″ с.ш. 162°7′8″ в.д.) и на нерестилище в р. Пономарская (56°11′58″ с.ш. 161°45′59″ в.д.). У всех производителей измерили длину по Смитту (FL) и массу. На месте провели идентификацию: БГ отличали по V-образному ряду (или “грозди”) зубов на сошнике и наличию плероцеркоид Diphyllobothrium spp. в стенке желудка, МА − по прямому ряду редких зубов на сошнике и отсутствию паразита (рисунок, а, б). Промежуточный вариант строения сошника у зрелых особей не встречался. Производители, идентифицированные как БГ, присутствовали в уловах р. Радуга и основного русла (30 и 22 экз.), МА − в основном русле и в р. Пономарская (29 и 30 экз.).
Идентификация белого гольца (I) и мальмы (II) Salvelinus malma complex: а − внешний вид особей и их сошников из основного русла р. Камчатка; б − число плероцеркоид Diphyllobothrium spp. (n) на стенке желудка каждой из особей; в − гистограмма генетического смешения выборок (в программе STRUCTURE) для К = 2 (каждая особь представлена вертикальным столбцом, разделённым на цветные сегменты в соответствии с вероятностью (р) членства в одном из двух кластеров; * потенциальные гибриды). Выборки: 1 – белый голец из р. Радуга, 2 – белый голец из основного русла, 3 – мальма из основного русла, 4 – мальма из р. Пономарская.
Наличие репродуктивной изоляции между группами (выборками) проверили по полиморфизму микросателлитной ДНК. Для этого из фрагментов плавников выделили ДНК и амплифицировали локусы Smm10, Smm21, Smm22, Smm24 (вместо Smm5), Ssosl456, Ogo1a, Ssa197 и Omy301 по протоколу, предложенному ранее (Салменкова и др., 2009), дополнив панель локусами Sco204, Sco205 и Sco218 (Dehaan, Ardren, 2005). Продукты амплификации разделили капиллярным электрофорезом, длины аллелей определили в программе GeneMapper v. 5. Все проанализированные локусы оказались полиморфными; обеднение гетерозиготности относительно ожидаемой по Харди−Вайнбергу не было достоверным (χ2-тесты в FSTAT v. 2.9, p > 0.05) ни в одном из локусов одновременно в выборках БГ и МА (Приложение 1 ).
После проверки на наличие нуль-аллелей в MicroChecker v. 2.2 (во всех случаях р > 0.05), а также неравновесного сцепления локусов в GENEPOP v. 4.7 (во всех случаях р < 0.05) оценили наиболее вероятное число генетических кластеров от одного до семи. Использовали два информационных критерия: BIC, рассчитанный в R adegenet, функция find.cluster (Jombart et al., 2010), и ΔK из Structure Harvest (Evanno et al., 2005). В первом случае применили модель кластеризации k-средних с последующей редукцией дисперсии методом главных компонент (программные предустановки по умолчанию). Во втором случае принадлежность особей к одному из кластеров смоделировали в STRUCTURE v. 2.3 (программные предустановки по умолчанию, 15/50 тыс. burn-in итераций/МС повторностей, по 6 реплик на кластер) (Pritchard et al., 2000). Возможный уровень гибридизации кластеров оценили по вероятностному критерию q (Anderson, Thompson, 2002). Величину межвыборочной дифференциации оценили по коэффициенту генетической подразделённости (FST) с поправкой Бенферрони в Arlequin v. 3.5. Дополнительно для оценки генетической структуры применили метод многомерного шкалирования (PCoA) на основе матрицы индивидуальных кодоминантных генотипических дистанций, полученных в GenAlEx v. 6.5. Статистические показатели генетического разнообразия рассчитали в GenAlEx (Na, Ne, I) и FSTAT v. 2.9 (Rs, Но и Не).
В процессе обловов в притоках наблюдали нерест гольцов от момента образования первых пар до миграции отнерестившихся производителей вниз по течению. В местах размножения в течение недели пика нереста шесть раз в сутки измеряли температуру воды (тестер HI98130 Hanna Inst.). Над 25 нерестовыми гнёздами в обоих притоках измеряли скорость течения в придонном слое воды вертушкой ИСП-1 (“Гидрометприбор”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка наиболее вероятного числа генетических кластеров в объединённой выборке гольцов показала BIC = 235.1 (оптимальное число РС корней = 22) для двух кластеров и BIC > 237.1 (>30 корней) для трёх и более кластеров; ΔK = = 12.6 (дисперсия ln p ± 5.1) для двух кластеров и ΔK < 3.8 (дисперсия ln p > 45.9) для трёх и более кластеров (Приложение 2 ). Статистически обоснованные альтернативные кластеры включили рыб, определённых как БГ или как МА, с ошибкой классификации 11.5% (БГ – р = 0.0233, МА – р = 0.0295). Согласно генетическим данным, в основном русле по фенотипу были ошибочно определены пять рыб из 51, в р. Радуга – две из 30, в р. Пономарская – одна из 30. Среди рыб с фенотипом БГ четыре были потенциальными гибридами с МА (рисунок, в). В пространстве двух первых координатных корней перекрытие областей БГ и МА составило 45%, при исключении ошибочно определённых особей – 15% (Приложение 3 ). При моделировании генетического смешения для К = 3 и К = 4 ошибка классификации возрастала до соответственно 19 и 37% (Приложение 4 ). Различия по аллельным частотам микросателлитных локусов между БГ и МА оказались достоверными, FST = 0.024 р = 0.0159. Между выборками БГ из двух локальностей FST = 0.001, между выборками МА FST = 0.003. Таким образом, в верхнем течении р. Радуга нерестился БГ (возможно, с минимальной примесью МА), в р. Пономарская − МА.
БГ из основного русла и с нерестилища оказался генетически однороднее, чем МА, однако значительного обеднения аллельного разнообразия у него не обнаружено (таблица). Число уникальных аллелей у БГ несколько выше, чем у МА (3.27 ± 0.865 против 2.73 ± 0.954).
Индексы генетического разнообразия белого гольца и мальмы Salvelinus malma complex из нижнего течения р. Камчатка по 11 микросателлитным локусам
| Выборка | n, экз. | Na | Ne | I | Rs | Ho | He |
|---|---|---|---|---|---|---|---|
| Белый голец: | |||||||
| – основное русло | 23 | 12.22 | 8.11 | 1.826 | 10.431 | 0.673 | 0.695 |
| – р. Радуга | 28 | 12.97 | 8.55 | 1.833 | 11.341 | 0.663 | 0.686 |
| Мальма: | |||||||
| – основное русло | 28 | 14.44 | 9.46 | 1.945 | 12.731 | 0.690 | 0.710 |
| – р. Пономарская | 29 | 13.37 | 8.82 | 1.914 | 11.992 | 0.691 | 0.699 |
Нерест БГ проходил на тальвеге горного русла шириной 20−30 м в высотном диапазоне 180−190 м над уровнем моря. Вероятно, сюда же поднялись производители из основного русла, где нерест лососёвых никогда не отмечали. Размножение началось в первых числах сентября, достигло пика через неделю и закончилось к октябрю. Производители FL 33−73 (54.8 ± 1.12) см и массой 0.4−3.3 (1.73 ± 0.007) кг строили гнёзда из галечно-валунистого субстрата на мощном потоке со средней скоростью 1.8 ± 0.31 (1.5–2.0) м/с. Нерестилище населяла разновозрастная молодь гольца, но оседлых карликовых самцов поймано не было. Размножение по времени совпало с интенсивным осенним снижением температуры воды: в период 7−14 сентября она упала с 7 до 4°С (в среднем составляла 5.1°С).
Нерест МА проходил в мелководных рукавах горного ручья в высотном диапазоне 60−70 м над уровнем моря. Размножение длилось со второй половины сентября по конец октября с пиком в конце сентября–начале октября. Размеры производителей составляли 21−39 (26.3 ± 0.92) см и 0.1−0.6 (0.18 ± 0.001) кг, что достоверно меньше размеров БГ (t-тесты: p < 0.001). В нересте МА принимали участие карликовые самцы FL 14−20 см и массой 30−85 г. Гнёзда они сооружали на гравийно-галечном субстрате при средней скорости течения 0.55 ± 0.12 (0.4−1.1) м/с. Температура воды в зоне нереста к концу сентября снизилась до 3−5°С (в среднем 3.6°С). Сходные условия нереста МА были показаны для других рек Камчатки (Melnik et al., 2020).
ЗАКЛЮЧЕНИЕ
Выявленные различия условий размножения рыбоядного БГ и бентосоядной МА объясняют ограничение потока генов между ними в притоках нижнего течения р. Камчатка. Репродуктивный барьер создаётся в результате расхождения двух форм по срокам и местам нереста. Значимые демографические события, маркируемые сниженным генетическим разнообразием и дефицитом (избытком) гетерозигот в одной из симпатрических групп (Castric et al., 2002), в течение последних тысяч лет в системе популяций БГ–МА не прослеживаются. По всей видимости, мелкая жилая МА созревает осенью позже БГ, она не способна долго удерживаться на потоке в зоне нереста БГ и конкурировать с его крупными и, соответственно, более агрессивными производителями, занимая нерестовые участки с более медленным течением. В случаях контакта производителей ассортативность может достигаться теми же механизмами, что и в паре Oncorhynchus tshawytscha–O. gorbuscha, где первая вытесняет вторую на периферию перекатов (Леман, 2003).
На обследованном нами нерестилище МА встречались в основном жилые рыбы, так как анадромные особи из уловов в устье реки значительно крупнее – в среднем FL 40 (до 70) см и 1.2 (до 4.5) кг (Черешнев и др., 2002; наши данные). Вероятно, ограниченная гибридизация БГ и МА объясняется единичным заходом крупных производителей проходной МА в р. Радуга. Основные нерестилища проходной МА в бассейне р. Камчатка известны из среднего−верхнего течения, куда БГ не поднимается (Глубоковский, 1977; Савваитова и др., 1992). При этом для проходной МА показан выраженный хоминг (Sandstrom, Harwood. 2002; Bond et al., 2014), что, вероятно, и определяет частичную репродуктивную изоляция групп.
Список литературы
Васильев В.П., Савваитова К.А. 1972. Иммунологический анализ арктического гольца // Науч. докл. высш. шк. Биол. науки. № 6. С. 19–22.
Глубоковский М.К. 1977. Salvelinus albus sp. n. из бассейна реки Камчатка // Биология моря. Т. 4. С. 48–56.
Леман В.Н. 2003. Экологическая и видовая специфика нерестилищ тихоокеанских лососей р. Oncorhynchus на Камчатке // Чтения памяти В.Я. Леванидова. Вып. 2. С. 12−34.
Маховенко Т.Е. 1972. Об особенностях паразитофауны различных форм гольца Salvelinus alpinus (L.) Камчатки // Паразитология. Т. 6. № 4. С. 369–375.
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. 2010. Генетическая дифференциация митохондриальной ДНК белого гольца Salvelinus albus и северной мальмы Salvelinus malma malma // Генетика. Т. 46. № 3. С. 389–400.
Осинов А.Г. 2001. Эволюционные взаимоотношения между основными таксонами Salvelinus alpinus–Salvelinus malma complex: результаты сравнительного анализа аллозимных данных разных авторов // Вопр. ихтиологии. Т. 41. № 2. С. 167–183.
Савваитова К.А., Пичугин М.Ю., Груздева М.А., Максимов В.А. 1992. К проблеме формообразования у пресноводных гольцов рода Salvelinus из бассейна реки Камчатка // Там же. Т. 32. Вып. 6. С. 33–40.
Салменкова Е.А., Омельченко В.Т., Афанасьев К.И. и др. 2009. Генетическая дивергенция популяций белого гольца Salvelinus albus, северной и южной форм мальмы S. malma (Salmonidae) по микросателлитным локусам ДНК // Там же. Т. 49. № 6. С. 752−762.
Фролов С.В. 2001. Кариологические различия северной мальмы Salvelinus malma malma и белого гольца Salvelinus albus из бассейна реки Камчатки // Генетика. Т. 37. № 3. С. 350–357. https://doi.org/10.1023/A:1009009126962
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. 2002. Белый голец – Salvelinus albus Glubokovsky, 1997 // Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука. С. 332−339.
Anderson E.C., Thompson E.A. 2002. A model-based method for identifying species hybrids using multilocus genetic data // Genetics. V. 160. № 3. P. 1217–1229.
Bond M.H., Crane P.A., Larson W.A., Quinn T.P. 2014. Is isolation by adaptation driving genetic divergence among proximate Dolly Varden char populations? // Ecol. Evol. V. 4. № 12. P. 2515–2532. https://doi.org/10.1002/ece3.1113
Castric V., Bernatchez L., Belkhir K., Bonhomme F. 2002. Heterozygote deficiencies in small lacustrine populations of Brook charr Salvelinus fontinalis Mitchill (Pisces, Salmonidae): a test of alternative hypotheses // Heredity. V. 89. P. 27−35. https://doi.org/10.1038/sj.hdy.6800089
DeHaan P.W., Ardren W.R. 2005. Characterization of 20 highly variable tetranucleotide microsatellite loci for bull trout (Salvelinus confluentus) and cross-amplification in other Salvelinus species // Mol. Ecol. Notes. V. 5. P. 582–585. https://doi.org/10.1111/j.1471-8286.2005.00997.x
Evanno G., Regnaut S., Goudet J. 2005. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study // Mol. Ecol. V. 14. № 8. P. 2611−2620. https://doi.org/10.1111/j.1365-294X.2005.02553.x
Feulner P.G., Plath M., Engelmann J. et al. 2009. Electrifying love: Electric fish use species-specific discharge for mate recognition // Biol. Lett. V. 5. № 2. P. 225−228. https://doi.org/10.1098/rsbl.2008.0566
Jombart T., Devillard S., Balloux F. 2010. Discriminant analysis of principal components: A new method for the analysis of genetically structured populations // BMC Genet. V. 11. № 94. P. 1−15. https://doi.org/10.1186/1471-2156-11-94
Levin B.A., Simonov E., Dgebuadze Yu.Y. et al. 2020. In the rivers: Multiple adaptive radiations of cyprinid fishes (Labeobarbus) in Ethiopian Highlands // Sci. Rept. V. 10. № 1. Article e7192. https://doi.org/10.1038/s41598-020-64350-4
Melnik N.O., Markevich G.N., Taylor E.B. et al. 2020. Evidence for divergence between sympatric stone charr and Dolly Varden along unique environmental gradients in Kamchatka // J. Zool. Syst. Evol. Res. V. 58. P. 1135−1150. https://doi.org/10.1111/jzs.12367
Pritchard J.K., Stephens M., Donnelly P. 2000. Inference of population structure using multilocus genotype data // Genetics. V. 155. P. 945–959.
Sandstrom S.J., Harwood LA. 2002. Studies of anadromous Dolly Varden (Salvelinus malma) (W.) of the Big Fish River, NT, Canada, 1972-1994 // Can. Man. Rept. Fish. Aquat. Sci. 31 p. https://doi.org/10.13140/RG.2.1.3542.4883
Schwarzer J., Misof B., Ifuta S.N., Schliewen U.K. 2011. Time and origin of cichlid colonization of the lower Congo rapids // PLoS ONE. V. 6. № 7. Article e22380. https://doi.org/10.1371/journal.pone.0022380
Дополнительные материалы
- скачать ESM_1.docx
- Приложение 1.
- скачать ESM_2.docx
- Приложение 2.
- скачать ESM_3.docx
- Приложение 3.
- скачать ESM_4.docx
- Приложение 4.
Инструменты
Вопросы ихтиологии


