Вопросы ихтиологии, 2021, T. 61, № 5, стр. 599-606
Содержание кортизола и активность Na+/K+-АТФазы при адаптации молоди горбуши Oncorhynchus gorbuscha (Salmonidae) к изменению солёности среды
Н. Н. Немова 1, Е. И. Кяйвяряйнен 1, Н. Л. Рендаков 1, *, К. М. Никерова 2, Д. А. Ефремов 1
1 Институт биологии Карельского научного центра РАН − ИБ КарНЦ РАН
Петрозаводск, Россия
2 Институт леса Карельского научного центра РАН − ИЛ КарНЦ РАН
Петрозаводск, Россия
* E-mail: nlrend@mail.ru
Поступила в редакцию 16.10.2020
После доработки 28.10.2020
Принята к публикации 02.11.2020
Аннотация
В эксперименте получены новые данные об изменении активности Na+/K+-АТФазы и уровня кортизола у покинувшей нерестовые гнёзда (р. Ольховка, бассейн Белого моря) молоди горбуши Oncorhynchus gorbuscha при перемещении её из пресной воды в морскую (25‰) и обратно. Развитие устойчивости к повышенной солёности у молоди горбуши сопровождается активацией Na+/K+-АТФазы через 1 и 24 ч пребывания в морской воде и повышением содержания кортизола через 1 ч данной экспозиции с последующим возвращением к исходному уровню через 24 ч. Полученные результаты свидетельствуют о готовности молоди горбуши к покатной миграции в морскую среду сразу после выхода из нерестовых гнёзд. При последующем перемещении рыб из солёной воды в пресную через 24 ч активность Na+/K+-АТФазы и содержание кортизола у них снижается, что может свидетельствовать о пластичности осморегуляторной реакции смолтов горбуши.
Возраст, в котором разные виды лососёвых (Salmonidae) начинают покатную миграцию, значительно различается. Большинство анадромных видов лососёвых после вылупления проводят в реке от одного года до нескольких лет, пока не достигнут длины 10–15 см (McCormick, Saunders, 1987). Горбуша Oncorhynchus gorbuscha и кета O. keta относятся к видам, для которых характерна ранняя смолтификация; они приобретают устойчивость к солёной среде ко времени выхода из гнёзд и вскоре после рассасывания желточного мешка мигрируют в морскую воду (Sackville et al., 2012; Gallagher et al., 2013; McCormick, 2013).
Кортизол обладает как глюко-, так и минералокортикоидной активностью (Bern, Madsen, 1992; Sturm et al., 2005) и участвует в регуляции широкого спектра физиологических процессов рыб, включая осморегуляцию (Mommsen et al., 1999; Das et al., 2018). У лососёвых рыб при смолтификации установлена гиперактивность интерреналовых клеток, вырабатывающих кортизол (McCormick, 2013), который приводит к повышению активности Na+/K+-АТФазы (NKA) и устойчивости к изменению солёности (Varsamos et al., 2005). Повышение активности NKA при смолтификации необходимо для поддержания ионного гомеостаза и, соответственно, для выживания рыб в гиперосмотических условиях (Folmar, Dickhoff, 1980; Blanco, Mercer, 1998). В жабрах рыб NKA локализуется в основном в мембранах специализированных клеток (ионоцитов) и состоит из субъединиц, по-разному реагирующих на осмотические изменения и акклимацию к солёности (Richards et al., 2003; Liao et al., 2009; Madsen et al., 2009). Так, субъединица α1a NKA лососёвых преимущественно экспрессируется в пресной воде, а α1b – в морской (Richards et al., 2003; McCormick et al., 2009). Дифференцировка ионоцитов в жабрах регулируется кортизолом (Wong, Chan, 2001; Sakamoto, McCormick, 2006; Cruz et al., 2013), который у эвригалинных видов рыб участвует в адаптации как к солёной, так и к пресной воде (Wendelaar Bonga, 1997; McCormick, 2001).
Цель данной работы − изучить изменения уровня кортизола и активности Na+/K+-АТФазы у молоди горбуши при переносе её из пресной воды в морскую и обратно, а также выявить способность к гипоосморегуляции, необходимой для обитания молоди в морской среде.
МАТЕРИАЛ И МЕТОДИКА
Схема эксперимента. Ювенильных особей (смолтов) горбуши c остатками желточного мешка отловили 20.06.2019 г. в р. Ольховка (рис. 1) и поместили в установленный в русле садок. На следующий день из садка отобрали контрольную пробу (20 экз.), которую, как и последующие, зафиксировали в жидком азоте и хранили в лаборатории при −80°С до начала анализа. Остальных рыб поместили в ёмкость с морской водой из Белого моря (25‰). Через 1 и 24 ч после перевода в морскую воду отловили и заморозили по 20 экз. Оставшихся мальков пересадили в ёмкость с пресной водой и через 24 ч взяли пробу для анализа.
Рис. 1.
Карта-схема района проведения исследований: 1 – место отлова мальков горбуши Oncorhynchus gorbuscha. Масштаб: 10 км.
Перемещение рыб из одной среды в другую осуществляли при минимальном стрессовом воздействии с учётом методических рекомендаций при проведении исследований (Guidelines…, 2014). На дне каждой ёмкости находилась сетка, которую аккуратно поднимали, чтобы доставить к поверхности всех рыб и переместить необходимое их количество в соседнюю ёмкость. Для предотвращения механического травмирования к границам ёмкостей был присоединён пластиковый “мост”, погружённый в воду ёмкости-приемника (эта ёмкость находилась под наклоном. В ходе эксперимента в ёмкости с мальками горбуши подавали воздух c помощью компрессора Sera air 275R. Гибель рыб в процессе эксперимента не наблюдали. Измерение общей длины (TL) и массы проводили у половины особей из каждой экспериментальной группы (у той её части, которая была использована для определения активности Na+/K+-АТФазы). Во всех выборках особи имели сходную длину и массу (таблица).
Длина и масса молоди горбуши Oncorhynchus gorbuscha, использованной в эксперименте (число рыб – 10 экз.)
| Группа | Длина (TL), см | Масса, г |
|---|---|---|
| Контроль (пресная вода) | 3.20 ± 0.03 | 0.140 ± 0.004 |
| Эксперимент: | ||
| – морская вода, 1 ч | 3.16 ± 0.03 | 0.140 ± 0.002 |
| – морская вода, 24 ч | 3.18 ± 0.04 | 0.140 ± 0.009 |
| – пресная вода, 24 ч | 3.20 ± 0.02 | 0.140 ± 0.001 |
Определение концентрации кортизола проводили индивидуально у 10 особей из каждой экспериментальной группы. Не размораживая, 1 экз. горбуши помещали в пластиковую пробирку объёмом 2 мл, в которую предварительно наливали 1 мл смеси для экстракции кортизола (этилацетат : этанол, 1 : 1 по объёму) для разрушения комплексов стероидов с белками и перевода стероидов в раствор. Образцы гомогенизировали в течение 1 мин при 50 Гц в аппарате TissueLyser LT (“QIAGEN”, ФРГ), затем смесь встряхивали в течение 30 мин при 2500 об/мин с помощью Disruptor Genie (“Scientific Industries”, СШA) и центрифугировали при 3000 g в течение 5 мин. Супернатант (0.8 мл) переносили в пробирку и упаривали экстракт при комнатной температуре, а затем растворяли сухой остаток в 0.1 мл ацетонитрила (подвижная фаза) (Hauser et al., 2008).
Содержание кортизола в экстрактах определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием жидкостного хроматографа Agilent 1200 c времяпролетным масс-спектрометрическим детектором 6210 (“Agilent Technologies”, США). Разделение проводили на колонке ZORBAX Eclipse XDB-C18 5 мкм, 4.6 × 150 мм с предколонкой ZORBAX XDB-C18 5 мкм, 12.5 × 4.6 мм (“Agilent Technologies”, США). Температуру колонки поддерживали на уровне 30°C. Подвижную фазу, состоящую из ацетонитрила – А (“Криохром”, осч) и 0.1%-ного раствора муравьиной кислоты (“Ленреактив”, имп) в бидистиллированной воде – В (бидистиллятор GFL 2102, ФРГ) подавали со скоростью 0.4 мл/мин. Для подвижной фазы был подобран следующий градиент по воде (канал B): 90—90—50—50—90—90% за 0—0.5—4.0—5.8—6.0—15 мин, причём остаточное время при этом градиенте использовали для промывки колонки. Общее время анализа составляло 15 мин. Объём инжекции 100 мкл. Поглощение регистрировали в ультрафиолетовой области при 244 нм.
Рабочие калибровочные растворы получали путём разведения в ацетонитриле стандарта кортизола (1 мг/мл в метаноле, C-106 Cerilliant, “Sigma Aldrich”, США) в диапазоне концентраций 1−50 нг/мл. Для проверки точности калибровочной прямой использовали рабочий калибровочный раствор 25 нг/мл. Ошибка не превышала 5% среднего значения.
Работу масс-спектрометра осуществляли при ионизации электроспреем (Dual-ESI) в режиме регистрации положительных ионов. Условия работы источника ионизации: температура 350°С, напряжение на капилляре 4 кВ, давление газа-небулайзера 172.37 кПа, скорость потока осушающего газа 10 л/мин. Диапазон регистрируемых значений отношения массы к заряду (m/z) составил 100−3000. Масс-спектрометр ежедневно калибровали с использованием смеси для калибровки ВЭЖХ-МС ESI-L Low Concentration Tuning Mix (“Agilent Technologies”, США) в диапазоне значений m/z: 118.086255−2721.894829. Результаты анализа ВЭЖХ-МС обрабатывали с помощью программы Agilent MassHunter Qualitative Analysis.
Время удерживания кортизола в градуировочных растворах и в образцах составило 11.44 мин (рис. 2). Кортизол был обнаружен в виде положительного иона (M + H)+, m/z 363.216−363.217 (рис. 3), что согласуется с базой данных (Agilent METLIN Personal Metabolite Database). Регистрируемая ошибка при определении составила не более 3‰. Концентрацию кортизола в образцах определяли по уравнению линейной зависимости концентрации кортизола от площади пика: y = 0.009x + 1.783, R2 = 0.997 (рис. 4).
Рис. 3.
Масс-спектр кортизола: (←) − пик, соответствующий протонированной форме кортизола (M + H)+, m/z 363.216.
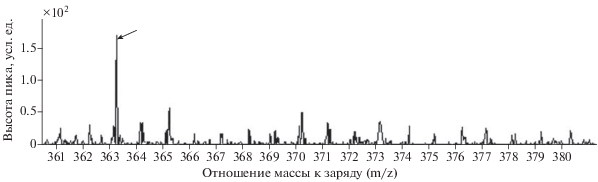
Рис. 4.
Калибровочный график зависимости концентрации кортизола от площади пика: y = 0.009x + 1.783, R2 = 0.997.

Активность Na+/K+-АТФазы (КФ 3.6.1.3) определяли индивидуально в осадке после гомогенизации и центрифугирования отобранных на анализ особей горбуши (по 10 экз. из каждой экспериментальной группы) (Елаев, Семенов, 1974). Предварительно рыб размораживали, измеряли их длину и массу, затем измельчали ножницами. Осадок ресуспендировали в буфере для гомогенизации в соотношении 1 : 3 (г/мл) и добавляли 2%-ный раствор дезоксихолата натрия до конечной концентрации 0.2%. Приготовленный раствор выдерживали при 4°C в течение 2 ч. Суспензию центрифугировали при 15 000 g в течение 30 мин. В полученном супернатанте оценивали активность NKA по разнице неорганического фосфата (Pi) в инкубационной среде (субстратный буфер) и среде без Na+ и K+ в присутствии ингибитора уабаина (104 М). Полная инкубационная среда для определения активности фермента содержала 0.01 М NaCl, 0.02 М KCl, 0.002 M MgCl2, 3 мM АТФ. В контроль добавляли уабаин до конечной концентрации 103 М, вместо субстратного буфера использовали буфер Трис-НС1 (рН 7.55) без добавления солей. Реакцию проводили при 37°С в течение 30 мин и останавливали добавлением равного объёма 10%-ной трихлоруксусной кислоты. После центрифугирования (6000 g в течение 20 мин) в надосадочной жидкости определяли Pi (Kahovcová, Odavić, 1969). Содержание Рi в пробе определяли по величине экстинкции по калибровочной кривой. Активность NKA оценивали по разности содержания Pi в полной среде и в среде без Na+ и K+ в присутствии уабаина за 30 мин реакции в расчёте на концентрацию белка и выражали в условных единицах (усл. ед.), соответствующих мкг Pi/мг белка за 30 мин реакции.
У рыб ионо- и осморегуляция осуществляется в жабрах, почках и кишечнике, при этом у взрослых рыб – в основном в жабрах, которые непосредственно контактируют с внешней средой и обеспечивают бóльшую часть трансэпителиального ионного обмена (Evans et al., 2005; Takei et al., 2014; Guh et al., 2015; Yan, Hwang, 2019). В нашем эксперименте были исследованы особи смолтов горбуши (длиной около 3 см), которые уже обладают функциональными жабрами (Sullivan et al., 1983).
Количественное содержание белка в исследуемом материале определяли методом Бредфорда (Bradford, 1976). В качестве стандарта для построения калибровочной кривой использовали бычий сывороточный альбумин в физрастворе.
Статистическая обработка результатов. Межгрупповые различия оценивали с помощью критерия Вилкоксона−Манна−Уитни. Исследования выполнены на оборудовании Центра коллективного пользования КарНЦ РАН.
РЕЗУЛЬТАТЫ
Концентрация кортизола в тканях молоди горбуши контрольной группы составила 9.22 ± 2.36 нг/г (рис. 5а). Через 1 ч после воздействия морской воды уровень кортизола в образцах превысил контрольные значения более чем в три раза и составил 32.09 ± 2.80 нг/г ткани (p < 0.001). Через 1 сут после перемещения молоди горбуши в морскую воду концентрация кортизола возвращалась к исходному уровню. При последующем перемещении рыб в пресную воду уровень кортизола у них через 1 сут несколько снизился, однако от контроля достоверно не отличался.
Рис. 5.
Содержание кортизола (а) и активность Na+/K+-АТФазы (б) у молоди горбуши Oncorhynchus gorbuscha при адаптации к морской и пресной воде; отличия от контроля достоверны при р: ** < 0.01, *** < 0.001.

Перенос мальков из пресной воды в морскую через 1 ч индуцировал увеличение активности NKA примерно в 1.5 раза (p < 0.01) относительно контроля (рис. 5б). Через 24 ч пребывания молоди горбуши в морской воде активность NKA повысилась в 2.5 раза (p < 0.001) по сравнению с контролем. Последующее перемещение рыб в пресную воду привело через 24 ч воздействия к незначительному снижению активности NKA, при этом уровень активности фермента был выше контрольных значений в два раза (p < 0.001).
ОБСУЖДЕНИЕ
В рассматриваемом эксперименте воздействие морской воды (солёность 25‰, характерная для Белого моря) на молодь горбуши в течение 1 ч привело к осмотическому (солевому) стрессу, сопровождающемуся значительным повышением содержания кортизола и активности NKA. Известно, что для поддержания гомеостаза при стрессе, в данном случае осмотическом, у рыб активируется нейроэндокринная система – гипоталамо-гипофизарно-интерреналовая ось, что приводит к высвобождению катехоламинов и кортизола из соответствующих железистых тканей и повышению уровня этих гормонов в крови (Wendelaar Bonga, 1997; Gorissen, Flik, 2016). Синхронное повышение изученных биохимических показателей у молоди горбуши через 1 ч пребывания в морской воде может быть связано с регулирующим влиянием кортизола на активность NKA, что может обеспечивать устойчивость к повышенной солёности. Ранее было показано, что при акклимации к морской воде атлантического лосося, кумжи и кижуча NKA в жабрах стимулируется синергическим действием кортизола, соматотропина и инсулиноподобного фактора роста I (Madsen, 1990a; McCormick, 2001; Varsamos et al., 2005). В культуре ткани жаберных лепестков (gill culture) атлантического лосося кортизол участвует в индукции морской изоформы NKA – NKAa1b (Kiilerich et al., 2007; Bernier et al., 2009). Быстрая активация NKA при акклимации к морской воде солёностью 30‰ ранее была обнаружена также у таких эвригалинных видов рыб, как лобан Mugil cephalus (через 3 ч воздействия) (Hossler, 1980), обыкновенный фундулюс Fundulus heteroclitus (1.5 ч воздействия) (Towle et al., 1977; Mancera, McCormick, 2000) и мозамбикская тиляпия Oreochromis mossambicus (3 ч воздействия) (Hwang et al., 1989).
Через 1 сут пребывания в морской воде первоначальное повышение содержания кортизола у молоди горбуши сменилось его снижением до контрольного уровня (рис. 5а). Подобный характер изменения уровня кортизола при остром стрессовом воздействии в эксперименте был описан для молоди чавычи (Maule et al., 1989): уровень кортизола достигал максимума через 4 ч после стрессового воздействия и возвращался к норме через 24 ч. Изменения солёности среды, которые воздействовали на молодь горбуши в нашем эксперименте, вызывали у рыб стрессовую реакцию (так называемый солевой стресс) и, соответственно, приводили к изменению уровня кортизола. Возвращение уровня кортизола через 24 ч после переноса молоди горбуши в морскую воду к исходным значениям является, по-видимому, нормальной физиологической реакцией, свидетельствующей о переходе острой стрессовой реакции в фазу адаптации.
В нашем эксперименте через 24 ч пребывания молоди горбуши в морской воде наблюдалось дальнейшее повышение активности NKA, что согласуется с данными, полученными ранее на мальках горбуши массой 0.2 г (Grant et al., 2010). Можно полагать, что увеличение активности NKA у мальков горбуши после 24-часовой акклимации к морской воде может быть связано с дифференциальной регуляцией изоформ этого фермента и с увеличением числа ионоцитов. Кортизол, будучи одним из основных биохимических показателей стрессовой реакции, может участвовать в её запуске, возвращаясь в дальнейшем к исходному уровню. По этой причине считается, что уровень кортизола и степень выраженности стрессовой реакции необязательно коррелируют друг с другом (Schreck, Tort, 2016; Magnoni et al., 2019). Возможно, именно этим объясняется отсутствие синхронности между содержанием кортизола и активностью NKA в нашем эксперименте через 24 ч экспозиции смолтов в солёной воде.
Последующий перенос мальков горбуши в пресную воду привёл через 24 ч к некоторому снижению активности NKA и уровня кортизола (на 25%). Возможно, уровень кортизола повышается только в первые минуты воздействия пресной воды, что приводит к перестройке осморегуляторных органов (Wendelaar Bonga, 1997; McCormick, 2001; Takei, McCormick, 2012). Например, при перемещении эвригалинного буропятнистого групера Epinephelus fuscoguttatus из морской воды (31‰) в солоноватую (≤5‰) уровень кортизола у рыб повышается до максимальных значений в первые 5 мин после перемещения, а через 2 ч он снижается до контрольных значений (Tahir et al., 2018). На разных видах рыб показано, что при стрессовых воздействиях вначале наблюдается острая реакция, которая через несколько часов проходит (Davis, McEntire, 2009).
Имеются данные, что специфическую адаптацию к пресной воде у рыб совместно с кортизолом обеспечивает гормон пролактин (McCormick, 2001; Sakamoto, McCormick, 2006). Можно предположить, что снижение активности NKA в пресной воде у молоди горбуши в нашем эксперименте было опосредовано пролактином. Например, введение пролактина уменьшало активность NKA в жабрах гипофизэктомированных фундулюсов, обитающих в пресной воде (Pickford et al., 1970).
В нашем эксперименте гибель смолтов горбуши при их переносе из пресной воды в морскую и обратно не наблюдалась, а уровень кортизола, несмотря на его повышение, находился в физиологических границах, выявленных для смолтов кеты (de Jesus, Hirano, 1992). Из этого следует, что стрессовое воздействие на рыб в данных условиях не было экстремальным, и молодь горбуши хорошо адаптирована к резким изменениям солёности. Устойчивость молоди горбуши к морской воде, по-видимому, связана с повышением активности NKA, что обеспечивает эффективное поддержание водно-солевого обмена и 100%-ную выживаемость. Результаты эксперимента свидетельствуют о готовности осморегуляторной системы горбуши, вышедшей из гнезда, к активному функционированию в морской среде. Для сравнения можно отметить, что резкое перемещение в морскую воду пестряток-годовиков кумжи, вида с поздней смолтификацией, приводит к их гибели из-за осмотического стресса (Madsen, 1990b; McCormick, 2013).
Таким образом, воздействие изменения солёности на молодь горбуши при перемещении её из пресной воды в морскую и обратно можно рассматривать как развитие стрессовой реакции, что подтверждается данными о повышении уровня кортизола у исследуемых особей уже через 1 ч экспозиции в морской воде солёностью 25‰. При этом возрастание уровня кортизола было в физиологических границах, характерных для молоди кеты − вида сходной биологии в раннем онтогенезе. Изменения в осморегуляторной системе исследуемых рыб с участием NKA и кортизола при резких изменениях солёности среды обитания на фоне отсутствия смертности особей в проведённом эксперименте свидетельствуют об адаптивной пластичности молоди горбуши. Результаты нашего эксперимента согласуются с тем известным фактом, что смолтификация у горбуши происходит сравнительно рано, уже на стадии выхода молоди из нерестовых гнёзд.
Список литературы
Елаев Н.Р., Семенов Е.В. 1974. Изменение активности мембранных АТФаз мозга при воздействии холино- и адреномиметических веществ // Биохимия. Т. 39. № 3. С. 42–46.
Bern H.A., Madsen S.S. 1992. A selective survey of the endocrine system of the rainbow trout (Oncorhynchus mykiss) with emphasis on the hormonal regulation of ion balance // Aquaculture. V. 100. № 1–3. P. 237–262. https://doi.org/10.1016/0044-8486(92)90384-W
Bernier N.J., Flik G., Klaren P.H.M. 2009. Regulation and contribution of the corticotropic, melanotropic and thyrotropic axes to the stress response in fishes // Fish Physiology. V. 28. Fish Neuroendocrinology / Eds. Bernier N.J. et al. London: Academic Press. P. 235–311. https://doi.org/10.1016/S1546-5098(09)28006-X.
Blanco G., Mercer R.W. 1998. Isozymes of the Na-K-ATPase: heterogeneity in structure, diversity in function // Amer. J. Physiol. Renal Physiol. V. 275. № 5. P. F633–F650. https://doi.org/10.1152/ajprenal.1998.275.5.F633
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. V. 72. P. 248–254. https://doi.org/10.1006/abio.1976.9999
Cruz S.A., Chao P.-L., Hwang P.-P. 2013. Cortisol promotes differentiation of epidermal ionocytes through Foxi3 transcription factors in zebrafish (Danio rerio) // Comp. Biochem. Physiol. V. 164A. № 1. P. 249–257. https://doi.org/10.1016/j.cbpa.2012.09.011
Das C., Thraya M., Vijayan M.M. 2018. Nongenomic cortisol signaling in fish // Gen. Comp. Endocrinol. V. 265. P. 121–127. https://doi.org/10.1016/j.ygcen.2018.04.019
Davis K.B., McEntire M. 2009. Comparison of the cortisol and glucose stress response to acute confinement among white bass, Morone chrysops, striped bass, Morone saxatilis, and sunshine bass, Morone chrysops X Morone saxatilis // J. World Aquacult. Soc. V. 40. № 4. P. 567–572. https://doi.org/10.1111/j.1749-7345.2009.00275.x
de Jesus E.G.T., Hirano T. 1992. Changes in whole body concentrations of cortisol, thyroid hormones, and sex steroids during early development of the chum salmon, Oncorhynchus keta // Gen. Comp. Endocrinol. V. 85. № 1. P. 55–61. https://doi.org/10.1016/0016-6480(92)90171-F
Evans D.H., Piermarini P.M., Choe K.P. 2005. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste // Physiol. Rev. V. 85. № 1. P. 97–177. https://doi.org/10.1152/physrev.00050.2003
Folmar L.C., Dickhoff W.W. 1980. The parr-smolt transformation (smoltification) and seawater adaptation in salmonids // Aquaculture. V. 21. № 1. P. 1–37. https://doi.org/10.1016/0044-8486(80)90123-4
Gallagher Z.S., Bystriansky J.S., Farrell A.P., Brauner C.J. 2013. A novel pattern of smoltification in the most anadromous salmonid: pink salmon (Oncorhynchus gorbuscha) // Can. J. Fish. Aquat. Sci. V. 70. № 3. P. 349–357. https://doi.org/10.1139/cjfas-2012-0390
Gorissen M., Flik G. 2016. The endocrinology of the stress response in fish: an adaptation-physiological view // Fish Physiology. V. 35. Biology of stress in fish / Eds. Schreck C.B. et al. London: Acad. Press. P. 75–111. https://doi.org/10.1016/B978-0-12-802728-8.00003-5.
Grant A.M., Gardner M., Hanson L.M. et al. 2010. Early life stage salinity tolerance of wild and hatchery-reared juvenile pink salmon Oncorhynchus gorbuscha // J. Fish Biol. V. 77. № 6. P. 1282–1292. https://doi.org/10.1111/j.1095-8649.2010.02747.x
Guh Y.-J., Lin C.-H., Hwang P.-P. 2015. Osmoregulation in zebrafish: ion transport mechanisms and functional regulation // EXCLI J. V. 14. P. 627–659. https://dx.doi.org/10.17179%2Fexcli2015-246.
Guidelines for the use of fishes in research. 2014. Bethesda: Am. Fish. Soc., 90 p.
Hauser B., Deschner T., Boesch C. 2008. Development of a liquid chromatography–tandem mass spectrometry method for the determination of 23 endogenous steroids in small quantities of primate urine // J. Chromatogr. V. 862B. № 1–2. P. 100–112. https://doi.org/10.1016/j.jchromb.2007.11.009
Hossler F.E. 1980. Gill arch of the mullet, Mugil cephalus III. Rate of response to salinity change // Amer. J. Physiol. V. 238. № 3. P. R160–R164. https://doi.org/10.1152/ajpregu.1980.238.3.R160
Hwang P.P., Sun C.M., Wu S.M. 1989. Changes of plasma osmolality, chloride concentration and gill Na-K-ATPase activity in tilapia Oreochromis mossambicus during seawater acclimation // Mar. Biol. V. 100. № 3. P. 295–299. https://doi.org/10.1007/BF00391142
Kahovcová J., Odavić R. 1969. A simple method for the quantitative analysis of phospholipids separated by thin layer chromatography // J. Chromatogr. V. 40. № 1. P. 90–96. https://doi.org/10.1016/S0021-9673(01)96622-1
Kiilerich P., Kristiansen K., Madsen S.S. 2007. Cortisol regulation of ion transporter mRNA in Atlantic salmon gill and the effect of salinity on the signaling pathway // J. Endocrinol. V. 194. № 2. P. 417–427. https://doi.org/10.1677/JOE-07-0185
Liao B.-K., Chen R.-D., Hwang P.-P. 2009. Expression regulation of Na+-K+-ATPase α1-subunit subtypes in zebrafish gill ionocytes // Amer. J. Physiol. Regul. Integr. Comp. Physiol. V. 296. № 6. P. R1897–R1906. https://doi.org/10.1152/ajpregu.00029.2009
Madsen S.S. 1990a. Enhanced hypoosmoregulatory response to growth hormone after cortisol treatment in immature rainbow trout, Salmo gairdneri // Fish Physiol. Biochem. V. 8. № 4. P. 271–279. https://doi.org/10.1007/BF00003422
Madsen S.S. 1990b. The role of cortisol and growth hormone in seawater adaptation and development of hypoosmoregulatory mechanisms in sea trout parr (Salmo trutta trutta) // Gen. Comp. Endocrinol. V. 79. № 1. P. 1–11. https://doi.org/10.1016/0016-6480(90)90082-W
Madsen S.S., Kiilerich P., Tipsmark C.K. 2009. Multiplicity of expression of Na+,K+-ATPase α-subunit isoforms in the gill of Atlantic salmon (Salmo salar): cellular localisation and absolute quantification in response to salinity change // J. Exp. Biol. V. 212. № 1. P. 78–88. https://doi.org/10.1242/jeb.024612
Magnoni L.J., Novais S.C., Eding E. et al. 2019. Acute stress and an electrolyte-imbalanced diet, but not chronic hypoxia, increase oxidative stress and hamper innate immune status in a rainbow trout (Oncorhynchus mykiss) isogenic line // Front. Physiol. V. 10. P. 453. https://doi.org/10.3389/fphys.2019.00453
Mancera J.M., McCormick S.D. 2000. Rapid activation of gill Na+,K+-ATPase in the euryhaline teleost Fundulus heteroclitus // J. Exp. Zool. V. 287. № 4. P. 263–274. https://doi.org/10.1002/1097-010X(20000901)287:4%3C263::AID-JEZ1%3E3.0.CO;2-I
Maule A.G., Tripp R.A., Kaattari S.L., Schreck C.B. 1989. Stress alters immune function and disease resistance in chinook salmon (Oncorhynchus tshawytscha) // J. Endocrinol. V. 120. № 1. P. 135–142. https://doi.org/10.1677/joe.0.1200135
McCormick S.D. 2001. Endocrine control of osmoregulation in teleost fish // Amer. Zoologist. V. 41. № 4. P. 781–794. https://doi.org/10.1093/icb/41.4.781
McCormick S.D. 2013. Smolt physiology and endocrinology // Euryhaline fishes / Eds. McCormick S.D. et al. Oxford: Acad. Press. P. 199–251. https://doi.org/10.1016/B978-0-12-396951-4.00005-0.
McCormick S.D., Saunders R.L. 1987. Preparatory physiological adaptations for marine life of salmonids: osmoregulation, growth, and metabolism // Amer. Fish. Soc. Symp. V. 1. P. 211–229.
McCormick S.D., Regish A.M., Christensen A.K. 2009. Distinct freshwater and seawater isoforms of Na+/K+-ATPase in gill chloride cells of Atlantic salmon // J. Exp. Biol. V. 212. № 24. P. 3994–4001. https://doi.org/10.1242/jeb.037275
Mommsen T.P., Vijayan M.M., Moon T.W. 1999. Cortisol in teleosts: dynamics, mechanisms of action, and metabolic regulation // Rev. Fish Biol. Fish. V. 9. № 3. P. 211–268. https://doi.org/10.1023/A:1008924418720
Pickford G.E., Griffith R.W., Torretti J. et al. 1970. Branchial reduction and renal stimulation of (Na+, K+)-ATPase by prolactin in hypophysectomized killifish in fresh water // Nature. V. 228. № 5269. P. 378–379. https://doi.org/10.1038/228378a0
Richards J.G., Semple J.W., Bystriansky J.S., Schulte P.M. 2003. Na+/K+-ATPase α-isoform switching in gills of rainbow trout (Oncorhynchus mykiss) during salinity transfer // J. Exp. Biol. V. 206. Pt. 24. P. 4475–4486. https://doi.org/10.1242/jeb.00701
Sackville M., Wilson J.M., Farrell A.P., Brauner C.J. 2012. Water balance trumps ion balance for early marine survival of juvenile pink salmon (Oncorhynchus gorbuscha) // J. Comp. Physiol. V. 182B. № 6. P. 781–792. https://doi.org/10.1007/s00360-012-0660-0
Sakamoto T., McCormick S.D. 2006. Prolactin and growth hormone in fish osmoregulation // Gen. Comp. Endocrinol. V. 147. № 1. P. 24–30. https://doi.org/10.1016/j.ygcen.2005.10.008
Schreck C.B., Tort L. 2016. The concept of stress in fish // Fish Physiology. V. 35. Biology of stress in fish / Eds. Schreck C.B. et al. London: Acad. Press. P. 1–34. https://doi.org/10.1016/B978-0-12-802728-8.00001-1.
Sturm A., Bury N., Dengreville L. et al. 2005. 11-Deoxycorticosterone is a potent agonist of the rainbow trout (Oncorhynchus mykiss) mineralocorticoid receptor // Endocrinology. V. 146. № 1. P. 47–55. https://doi.org/10.1210/en.2004-0128
Sullivan C.V., Brewer S.D., Johnston G.P., Dickhoff W.W. 1983. Plasma thyroid-hormone concentrations and gill (Na + K)-ATPase activities in postemergent pink salmon // Trans. Am. Fish. Soc. V. 112. № 6. P. 825–829. https://doi.org/10.1577/1548-8659(1983)112<825:PTCAGN> 2.0.CO;2
Tahir D., Shariff M., Syukri F., Yusoff F.M. 2018. Serum cortisol level and survival rate of juvenile Epinephelus fuscoguttatus following exposure to different salinities // Vet. World. V. 11. № 3. P. 327–331. https://doi.org/10.14202/vetworld.2018.327-331
Takei Y., McCormick S.D. 2012. Hormonal control of fish euryhalinity // Euryhaline fishes / Eds. McCormick S.D. et al. Oxford: Acad. Press. P. 69–123. https://doi.org/10.1016/B978-0-12-396951-4.00003-7.
Takei Y., Hiroi J., Takahashi H., Sakamoto T. 2014. Diverse mechanisms for body fluid regulation in teleost fishes // Amer. J. Physiol. Regul. Integr. Comp. Physiol. V. 307. № 7. P. R778–R792. https://doi.org/10.1152/ajpregu.00104.2014
Towle D.W., Gilman M.E., Hempel J.D. 1977. Rapid modulation of gill Na+ + K+-dependent ATPase activity during acclimation of the killifish Fundulus heteroclitus to salinity change // J. Exp. Zool. V. 202. № 2. P. 179–185. https://doi.org/10.1002/jez.1402020206
Varsamos S., Nebel C., Charmantier G. 2005. Ontogeny of osmoregulation in postembryonic fish: a review // Comp. Biochem. Physiol. V. 141A. № 4. P. 401–429. https://doi.org/10.1016/j.cbpb.2005.01.013
Wendelaar Bonga S.E. 1997. The stress response in fish // Physiol. Rev. V. 77. № 3. P. 591–625. https://doi.org/10.1152/physrev.1997.77.3.591
Wong C., Chan D. 2001. Effects of cortisol on chloride cells in the gill epithelium of Japanese eel, Anguilla japonica // J. Endocrinol. V. 168. № 1. P. 185–192. https://doi.org/10.1677/joe.0.1680185
Yan J.-J., Hwang P.-P. 2019. Novel discoveries in acid-base regulation and osmoregulation: a review of selected hormonal actions in zebrafish and medaka // Gen. Comp. Endocrinol. V. 277. P. 20–29. https://doi.org/10.1016/j.ygcen.2019.03.007
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии



