Вопросы ихтиологии, 2021, T. 61, № 6, стр. 697-712
Вкусовые предпочтения и оросенсорное тестирование пищи у мраморного гурами Trichopodus trichopterus (Osphronemidae)
Е. С. Михайлова 1, *, А. О. Касумян 1
1 Московский государственный университет,
Москва, Россия
* E-mail: elena_mikhailova@mail.ru
Поступила в редакцию 05.10.2020
После доработки 13.10.2020
Принята к публикации 13.10.2020
Аннотация
Установлено, что для мраморного гурами Trichopodus trichopterus из 21 исследованной L-аминокислоты 14 имеют привлекательный вкус и только одна (тирозин) вызывает аверсивные ответы. Отвергание агар-агаровых гранул, содержащих тестируемые вещества, вызывает также сахароза, тогда как лимонная кислота и хлориды натрия и кальция не влияют на потребление. При сравнении с жемчужным гурами T. leerii, исследованным ранее близкородственным и сходным по образу жизни видом, отмечены противоположные или несовпадающие вкусовые ответы на большинство веществ. Поведение, демонстрируемое гурами при тестировании пищи, имеет одни и те же особенности (предварительные касания гранул губами, многочисленные отвергания и повторные схватывания, генерация звуков), что указывает на его консервативность по сравнению с вкусовыми предпочтениями. Предполагается, что наличие лабиринтового наджаберного органа, сокращающего доступную для распределения вкусовых рецепторов площадь ротовой полости, не влияет на возможность гурами дифференцированно реагировать на пищевые объекты, различающиеся вкусовыми свойствами.
Сенсорные свойства схваченной пищи рыбы оценивают многочисленными вкусовыми и тактильными рецепторами, находящимися в эпителии ротовой полости. Плотность распределения интраоральных вкусовых почек у некоторых бентосоядных рыб достигает нескольких сотен на 1 мм2 поверхности, а их общее число составляет десятки тысяч и более (Atema, 1971; Finger et al., 1991; Sibbing, 1991). Крупные специализированные структуры, присутствующие в ротовой полости у некоторых рыб, значительно сокращают площадь сенсорной поверхности. К числу таких рыб относятся представители подотряда ползуновидных (Anabantoidei), имеющие в ротовой полости лабиринтовый наджаберный орган, предназначенный для воздушного дыхания (Graham, 1997). В связи с этим изучение функциональных возможностей вкусовой рецепции у Anabantoidei представляет особый интерес.
Семейство гурамиевых (Osphronemidae) – наиболее крупное в составе Anabantoidei, оно объединяет свыше 130 видов пресноводных рыб Южной Азии (Froese, Pauly, 2021). Многие из них являются популярными объектами аквариумистики. Это делает гурамиевых доступными и удобными для выполнения различных экспериментальных исследований, в том числе в области физиологии и поведения (Bischof, 1996; Hollis, 1999; Ladich, 2007; Blank, Burggren, 2014; Ramos, Gonçalves, 2019). При изучении вкусовых предпочтений у жемчужного гурами Trichopodus leerii и пищевого поведения, демонстрируемого этой рыбой при оросенсорной оценке гранул корма разного вкусового качества, было выяснено, что этот вид отличается от многих рыб крайне узким спектром привлекательных по вкусу аминокислот и необычайно высокой склонностью к многократным повторным тестированиям пищевых объектов (Виноградская и др., 2017). Связаны ли эти особенности с морфологической организацией ротовой полости жемчужного гурами (наличие наджаберного органа), осталось невыясненным.
Основной задачей настоящей работы было исследовать вкусовые предпочтения и пищевое поведение мраморного гурами T. trichopterus и сравнить их с таковыми жемчужного гурами с целью выявить специфические и общие особенности вкусовой рецепции и поведения этих двух представителей Anabantoidei. Поскольку ареалы обоих видов гурами перекрываются, а образ жизни сходный (Linke, 1991; Sule et al., 2016), в задачи работы входила сравнительная оценка вкусовых спектров у этих близкородственных и симпатрических рыб. Данные, касающиеся этой проблемы, немногочисленны и противоречивы (Михайлова, Касумян, 2015).
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена на 16 половозрелых особях мраморного гурами абсолютной длиной (TL) 75–95 мм. Гурами получены из частного аквариума (Москва), страна происхождения рыб неизвестна. Рыб рассаживали поодиночке в аквариумы объёмом 10 л. Зрительный контакт между рыбами в соседних аквариумах блокировали непрозрачные задняя и боковые стенки. Температуру воды поддерживали равной 26°С с помощью терморегуляторов AquaEL EH-25W. Грунт в аквариумах отсутствовал. Рыб кормили личинками Chironomidae до насыщения один раз в сутки после завершения экспериментов.
До начала опытов у рыб вырабатывали устойчивый навык схватывать подаваемые поштучно агар-агаровые (Reanal, 2%) гранулы, в состав которых вводили водный экстракт личинок хирономид (175 г/л). В опытах использовали гранулы, содержащие одно из 25 химических веществ, полный перечень которых и их концентрация приведены в табл. 1. В качестве контроля использовали гранулы, не содержащие каких-либо дополнительных веществ. Все гранулы, включая контрольные, имели ярко-красный цвет, создаваемый красителем (Ponceau 4R, 5 мкM). Гранулы (длина 4 мм, диаметр 2 мм) вырезали из агар-агарового геля непосредственно перед внесением в аквариум. Гель хранили при температуре +4°С не более двух недель, с экстрактом хирономид − не более 3 сут.
Таблица 1.
Вкусовые ответы (М ± m) мраморного гурами Trichogaster trichopterus на гранулы с тестируемыми веществами
| Раздражитель | Концентрация, М (%) | Потребление гранул, % | Индекс вкусовой привлекательности | Число схватываний | Продолжительность удержания гранулы, с | |
|---|---|---|---|---|---|---|
| после первого схватывания | в течение всего опыта | |||||
| Классические вкусовые вещества | ||||||
| Лимонная кислота | 0.26 (5) | 25.0 ± 4.4 | 17.1 | 6.2 ± 0.5 | 1.5 ± 0.1 | 10.7 ± 1.1 |
| Хлористый кальций | 0.9 (10) | 19.8 ± 4.1 | 5.6 | 4.1 ± 0.4*** | 1.1 ± 0.1* | 7.5 ± 1.0 |
| Хлористый натрий | 1.73 (10) | 9.4 ± 3.0 | –30.6 | 3.5 ± 0.3*** | 1.2 ± 0.1 | 4.0 ± 0.4*** |
| Сахароза | 0.29 (10) | 4.2 ± 2.1** | –61.6 | 4.1 ± 0.4*** | 1.1 ± 0.1* | 3.9 ± 0.3*** |
| Свободные аминокислоты | ||||||
| Пролин | 0.1 | 91.7 ± 2.8*** | 67.6 | 2.9 ± 0.2*** | 4.5 ± 0.4*** | 12.3 ± 0.4** |
| Серин | 0.1 | 79.2 ± 4.2*** | 63.5 | 3.9 ± 0.3*** | 4.2 ± 0.5*** | 15.3 ± 0.8*** |
| Треонин | 0.1 | 79.2 ± 4.2*** | 63.5 | 3.5 ± 0.3*** | 4.6 ± 0.5*** | 11.7 ± 0.5* |
| Цистеин | 0.1 | 72.9 ± 4.6*** | 60.9 | 3.9 ± 0.3*** | 3.9 ± 0.4*** | 12.6 ± 0.6** |
| Глицин | 0.1 | 68.8 ± 4.8*** | 59.1 | 5.6 ± 0.3** | 2.7 ± 0.4** | 15.0 ± 0.8*** |
| Аланин | 0.1 | 66.7 ± 4.8*** | 58.1 | 8.3 ± 0.6 | 2.6 ± 0.3** | 21.6 ± 1.5*** |
| Норвалин | 0.1 | 59.4 ± 5.0*** | 54.1 | 5.5 ± 0.3* | 2.7 ± 0.3*** | 13.6 ± 0.7*** |
| Фенилаланин | 0.1 | 52.1 ± 5.1*** | 49.3 | 6.9 ± 0.4 | 1.5 ± 0.1 | 13.4 ± 1.0** |
| Валин | 0.1 | 50.0 ± 5.1*** | 47.7 | 6.3 ± 0.3 | 1.9 ± 0.2 | 14.0 ± 0.9*** |
| Метионин | 0.1 | 50.0 ± 5.1*** | 47.7 | 6.1 ± 0.4 | 1.9 ± 0.2 | 13.0 ± 0.9** |
| Гистидин | 0.1 | 47.9 ± 5.1*** | 46.0 | 7.5 ± 0.5 | 1.6 ± 0.2 | 15.3 ± 1.1*** |
| Глутамин | 0.1 | 42.7 ± 5.1*** | 41.4 | 6.9 ± 0.5 | 1.8 ± 0.2 | 13.2 ± 1.0** |
| Аспарагин | 0.1 | 32.3 ± 4.8* | 29.2 | 6.8 ± 0.5 | 1.6 ± 0.2 | 12.1 ± 1.2 |
| Лизин | 0.1 | 26.0 ± 4.5 | 19.0 | 5.3 ± 0.4** | 1.7 ± 0.1 | 10.2 ± 1.0 |
| Аргинин | 0.1 | 9.4 ± 3.0 | –30.6 | 4.5 ± 0.5*** | 1.0 ± 0.0** | 5.4 ± 0.8*** |
| Аспарагиновая кислота | 0.01 | 43.8 ± 5.1*** | 42.4 | 5.6 ± 0.4** | 1.5 ± 0.1 | 9.8 ± 0.7 |
| Глутаминовая кислота | 0.01 | 25.0 ± 4.4 | 17.1 | 6.7 ± 0.4 | 1.7 ± 0.1 | 10.7 ± 1.0 |
| Изолейцин | 0.01 | 24.0 ± 4.4 | 15.1 | 5.7 ± 0.4* | 1.5 ± 0.1 | 8.6 ± 0.7 |
| Лейцин | 0.01 | 13.5 ± 3.5 | –13.5 | 5.8 ± 0.5 | 1.2 ± 0.1 | 6.3 ± 0.7** |
| Триптофан | 0.01 | 8.3 ± 2.8 | –36.2 | 4.8 ± 0.3*** | 1.2 ± 0.1 | 5.7 ± 0.5*** |
| Тирозин | 0.001 | 6.3 ± 2.5* | –47.5 | 5.5 ± 0.4** | 1.2 ± 0.1 | 6.4 ± 0.6** |
| Экстракт Chironomidae | 175.0 | 91.7 ± 2.8*** | 67.6 | 8.6 ± 0.6* | 2.4 ± 0.3* | 22.4 ± 0.9*** |
| Контроль | 17.7 ± 3.9 | 7.2 ± 0.5 | 1.5 ± 0.2 | 9.5 ± 0.8 | ||
Примечание. Здесь и в табл. 3: M ± m – среднее значение показателя и его ошибка; концентрация экстракта хирономид приведена в г/л; с каждым типом гранул проведено 96 опытов; отличия от контроля достоверны при р: * < 0.05, ** < 0.01, *** < 0.001.
В опытах подсчитывали число повторных схватываний гранулы и продолжительность ее удержания рыбой при первом схватывании и в течение всего опыта. О заглатывании гранулы судили по прекращению характерных движений челюстями и восстановлению рыбой ритма дыхательных движений жаберными крышками. При окончательном отказе от гранулы рыба уходила от неё или ориентировалась в другую сторону. Если схватывания поданной в аквариум гранулы не происходило, то гранулу удаляли и опыт считали не состоявшимся. Если рыба разрушала схваченную гранулу, но заглатывала менее её половины, считали, что потребления не происходило. Гранулы разных типов подавали в случайной последовательности. Длительность опыта – менее 2 мин, интервал между опытами на одной и той же особи – не менее 20 мин. Измерения длительности удержаний гранулы проводили с помощью механического ручного секундомера суммирующего типа “Агат” с точностью 0.2 с. Более детальное изложение методики выполнения опытов приведено в ранее опубликованных статьях (Касумян, Морси, 1996; Михайлова, Касумян, 2015).
Общее число опытов – 2592. Для количественной оценки вкусового предпочтения веществ рассчитывали долю потреблённых гранул (% числа опытов) и индекс вкусовой привлекательности по формуле: Indpal = (R – C)/(R + C) × 100, где R – число заглоченных гранул с веществом, C – число заглоченных контрольных гранул (Касумян, Морси, 1996). Indpal представляет собой модифицированный индекс элективности питания, предложенный Ивлевым (1977).
Статистический анализ выполнен с использованием критериев χ2, U-критерий Манна–Уитни и рангового коэффициента корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ
Классические вкусовые вещества. Присутствие сахарозы в гранулах вызывало достоверное снижение потребления более чем в четыре раза относительно контроля (табл. 1). Остальные вещества этой группы не оказывали значимого влияния на потребление гранул, но приводили к снижению числа схватываний (хлористый натрий, хлористый кальций) и времени удержания гранулы во рту при первом схватывании (хлористый кальций) и суммарно во время схватываний, совершенных в опыте (хлористый натрий). Лимонная кислота не оказывала эффекта ни на один из регистрировавшихся параметров ответа рыб. Количество опытов по мере увеличения числа зарегистрированных в них схватываний закономерно снижалось (табл. 2).
Таблица 2.
Доля опытов с разным числом схватываний гранулы особями мраморного гурами Trichopodus trichopterus, % общего числа опытов
| Раздражитель | Число схватываний | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ≥10 (max N) | |
| Классические вкусовые вещества | ||||||||||
| Лимонная кислота | 15 | 10 | 13 | 6 | 11 | 8 | 4 | 6 | 5 | 22 (31) |
| CaCl2 | 34 | 12 | 16 | 4 | 8 | 6 | 4 | 4 | 2 | 10 (21) |
| NaCl | 25 | 23 | 15 | 11 | 6 | 6 | 5 | 4 | 1 | 4 (13) |
| Сахароза | 22 | 18 | 17 | 12 | 9 | 4 | 6 | 1 | 4 | 7 (18) |
| Свободные аминокислоты | ||||||||||
| Пролин | 23 | 27 | 21 | 16 | 4 | 4 | – | 3 | – | 2 (10) |
| Серин | 16 | 23 | 16 | 16 | 8 | 4 | 6 | 7 | – | 4 (13) |
| Треонин | 31 | 21 | 11 | 11 | 6 | 7 | 6 | 1 | – | 6 (14) |
| Цистеин | 16 | 15 | 28 | 13 | 6 | 4 | 8 | 4 | 2 | 4 (12) |
| Глицин | 6 | 10 | 18 | 14 | 6 | 12 | 9 | 6 | 9 | 10 (19) |
| Аланин | 6 | 6 | 7 | 6 | 13 | 7 | 11 | 4 | 7 | 33 (26) |
| Норвалин | 4 | 11 | 10 | 15 | 18 | 13 | 12 | 6 | 3 | 8 (15) |
| Фенилаланин | 7 | 1 | 6 | 14 | 14 | 13 | 6 | 10 | 7 | 22 (23) |
| Валин | 5 | 3 | 12 | 9 | 16 | 11 | 11 | 8 | 11 | 14 (16) |
| Метионин | 7 | 9 | 11 | 12 | 13 | 5 | 10 | 10 | 10 | 13 (20) |
| Гистидин | 12 | 6 | 7 | 6 | 6 | 11 | 11 | 9 | 4 | 28 (25) |
| Глутамин | 11 | 7 | 9 | 12 | 5 | 5 | 13 | 8 | 8 | 22 (19) |
| Аспарагин | 13 | 3 | 13 | 9 | 11 | 7 | 8 | 6 | 11 | 19 (25) |
| Лизин | 21 | 5 | 14 | 9 | 11 | 9 | 7 | 2 | 5 | 17 (17) |
| Аргинин | 41 | 11 | 12 | 3 | 5 | 2 | 2 | 3 | 3 | 18 (22) |
| Аспарагиновая кислота | 5 | 10 | 13 | 18 | 16 | 8 | 8 | 7 | 5 | 10 (31) |
| Глутаминовая кислота | 6 | 9 | 7 | 9 | 12 | 9 | 9 | 7 | 11 | 21 (24) |
| Изолейцин | 14 | 5 | 10 | 16 | 8 | 13 | 12 | 5 | 3 | 14 (25) |
| Лейцин | 12 | 19 | 6 | 13 | 11 | 8 | 5 | 3 | 2 | 21 (29) |
| Триптофан | 10 | 14 | 17 | 14 | 16 | 8 | 4 | 4 | 5 | 8 (18) |
| Тирозин | 16 | 12 | 8 | 18 | 3 | 14 | 5 | 6 | 2 | 16 (21) |
| Экстракт Chironomidae | 4 | 9 | 6 | 6 | 6 | 10 | 6 | 9 | 7 | 37 (27) |
| Контроль | 5 | 7 | 10 | 5 | 12 | 16 | 5 | 11 | 6 | 23 (22) |
Аминокислоты. Из 15 аминокислот, содержание которых в гранулах было 0.1 М, 13 оказывали стимулирующее действие на потребление. Из 6 аминокислот, которые из-за более низкой растворимости были протестированы при концентрации 0.01−0.001 М, таким же эффектом обладала аспарагиновая кислота11, а тирозин значимо снижал потребление гранул (табл. 1). Другие аминокислоты с отталкивающим вкусом не выявлены.
Наиболее привлекательный вкус был у пролина, гранулы с которым потреблялись рыбами так же хорошо, как и гранулы с экстрактом хирономид, – более чем в пять раз лучше, чем контрольные. Гранулы с пролином реже, чем остальные, подвергались повторным тестированиям, они долго удерживались в ротовой полости. Гранулы с высоко привлекательными по вкусу серином, треонином, цистеином, глицином, аланином и норвалином рыбы реже повторно схватывали, но удерживали дольше, чем контрольные (табл. 1). Среди этих аминокислот выделяется реакция рыб на аланин, гранулы с которым они удерживали суммарно за опыт рекордно длительное время (в среднем 21.6 с), т.е. почти как гранулы с экстрактом хирономид (22.4 с). Менее привлекательные по вкусу фенилаланин, валин, метионин, гистидин и глутамин не изменяли частоту схватываний, но повышали суммарное время удержания гранулы в опыте; аспарагин не оказывал влияния не только на частоту схватываний, но и на длительность удержания. Три из шести индифферентных по вкусу аминокислот (аргинин, лейцин и триптофан) уменьшали длительность удержания гранулы, как и тирозин – единственная детеррентная аминокислота. Гранулы с экстрактом хирономид, как и с привлекательными по вкусу аминокислотами, рыбы удерживали дольше, чем контрольные, но, в отличие от аминокислот, чаще, чем контрольные, схватывали.
Поведение тестирования гранул. Рыбы схватывали гранулу обычно в толще воды, при этом могли предварительно многократно, в среднем от трёх до семи раз подряд, очень быстро касаться или на мгновение придерживать гранулу губами. Почти во всех случаях касания завершались первым схватыванием внесённой гранулы, перед следующими схватываниями они наблюдались редко. Касания происходили в 36% всех опытов, но в опытах с разными веществами эта величина варьировала от 10 до >60%. Реагируя на гранулу, опускающуюся в толще воды, рыбы могли направлять в её сторону свои длинные брюшные плавники, но к грануле никогда не прикасались.
В течение опыта рыбы совершали по нескольку десятков повторных схватываний до проглатывания гранулы или окончательного отказа от потребления. Максимальное число схватываний (31) зарегистрировано в опытах с лимонной и аспарагиновой кислотами, >20 схватываний – в опытах с 12 другими типами гранул (табл. 2). Однако доля опытов, в которых происходило лишь одно схватывание гранулы, была наибольшей (14.3%). В половине всех выполненных опытов наблюдалось не более четырёх схватываний, в 15.4 и 1.2% опытах гранулу схватывали более 10 и 20 раз (рис. 1). Число схватываний гранулы не коррелирует ни с одним из параметров, регистрировавшихся в опытах (рис. 2).
Рис. 1.
Распределение опытов, выполненных на мраморном гурами Trichopodus trichopterus (n = 2592): а – по числу схватываний гранулы, б – по длительности удержания гранулы после первого схватывания, в – по суммарной длительности удержания гранулы.
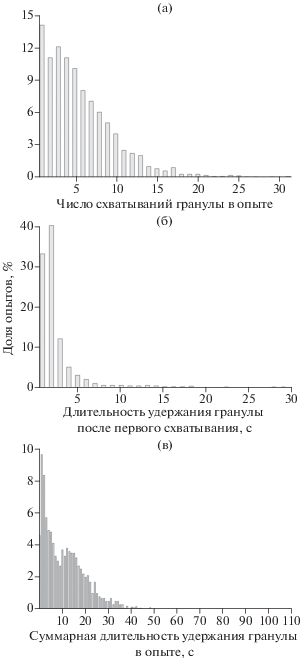
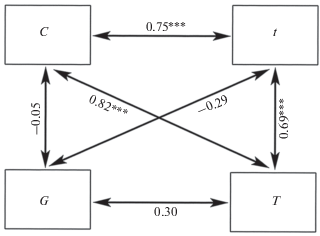
Рис. 2.
Коэффициент корреляции Спирмена между параметрами вкусового ответа на гранулы с L-аминокислотами у мраморного гурами Trichopodus trichopterus (все опыты): C – потребление гранул, G – число схватываний гранулы в опыте, t – длительность удержания гранулы после первого схватывания, T – суммарная длительность удержания гранулы в опыте, уровень значимости отличий при p: *** < 0.001.
В некоторых опытах при повторных схватываниях был замечен выход мелких пузырьков воздуха изо рта рыб. В момент схватывания гранулы, особенно лежащей на дне, когда рыбы движениями грудных плавников совершали небольшой резкий бросок вперёд и сразу же возвращались назад на исходное место, часто были хорошо слышны короткие звуки – щелчки. Доля опытов со звуками составила 14.5%, число щелчков, регистрировавшихся в опыте, варьировало от 1 до 31 (в среднем 6.7 ± 0.2).
Схваченную гранулу рыбы удерживали в ротовой полости от 0.2 до 28.8 с при первом схватывании и от 0.4 до 108.6 с суммарно в течение опыта. В половине случаев гранулы при первом схватывании удерживались не более 1.2 с, а суммарно – не более 10 с (рис. 1б, 1в). Длительность удержания гранул при первой апробации и в течение всего опыта тесно коррелируют друг с другом и с привлекательностью содержащегося в них вещества (рис. 2).
Выполненное на примере аминокислот сравнение опытов, завершившихся потреблением гранулы (ПГ-опыты), с опытами, в которых рыбы после тестирования отказались от потребления гранулы (ОГ-опыты), показало, что поведение рыб в этих двух вариантах ответа различается (табл. 3). В ПГ-опытах рыбы в среднем в два−три раза чаще совершали повторные схватывания гранул, особенно если они содержат в себе вещества с невысокой вкусовой привлекательностью. Это различие выявлено для 17 аминокислот из 21, причём для 15 аминокислот оно достоверно. В ПГ-опытах гранулы с 19 аминокислотами удерживались после первого схватывания в 1.5−3.0 раза дольше, но различие было достоверным для 11 аминокислот. Суммарное время удержания достоверно больше в ПГ-опытах для всех без исключения аминокислот, средние значения различались до четырёх−шести раз, как, например, для гранул с аргинином, лейцином, аспарагином и лизином.
Таблица 3.
Параметры вкусового ответа (M ± m) мраморного гурами Trichopodus trichopterus в опытах, закончившихся потреблением (над чертой) и отверганием (под чертой) гранулы
| Раздражитель | Концентрация, М (%) | Число схватываний | Продолжительность удержания гранулы, с | Число опытов | |
|---|---|---|---|---|---|
| после первого схватывания | в течение всего опыта | ||||
| Лимонная кислота | 0.26 (5) | $\frac{{8.5 \pm 1.3}}{{5.4 \pm 0.5{\kern 1pt} **}}$ | $\frac{{2.4 \pm 0.4}}{{1.2 \pm 0.1{\kern 1pt} ***}}$ | $\frac{{23.7 \pm 2.1}}{{6.3 \pm 0.7{\kern 1pt} ***}}$ | $\frac{{24}}{{72}}$ |
| Хлористый кальций | 0.9 (10) | $\frac{{8.2 \pm 0.9}}{{3.1 \pm 0.4{\kern 1pt} ***}}$ | $\frac{{1.4 \pm 0.3}}{{1.1 \pm 0.1}}$ | $\frac{{23.1 \pm 1.7}}{{3.7 \pm 0.6{\kern 1pt} ***}}$ | $\frac{{19}}{{77}}$ |
| Хлористый натрий | 1.73 (10) | $\frac{{7.4 \pm 1.3}}{{3.1 \pm 0.2{\kern 1pt} ***}}$ | $\frac{{3.0 \pm 1.3}}{{1.0 \pm 0.1{\kern 1pt} ***}}$ | $\frac{{15.0 \pm 1.0}}{{2.9 \pm 0.3{\kern 1pt} ***}}$ | $\frac{9}{{87}}$ |
| Сахароза | 0.29 (10) | $\frac{{13.3 \pm 2.1}}{{3.8 \pm 0.3{\kern 1pt} ***}}$ | $\frac{{1.2 \pm 0.3}}{{1.1 \pm 0.1}}$ | $\frac{{14.1 \pm 1.8}}{{3.4 \pm 0.3{\kern 1pt} ***}}$ | $\frac{4}{{92}}$ |
| Пролин | 0.1 | $\frac{{2.9 \pm 0.2}}{{3.8 \pm 0.7}}$ | $\frac{{4.7 \pm 0.5}}{{1.8 \pm 0.4}}$ | $\frac{{12.8 \pm 0.3}}{{6.7 \pm 1.5{\kern 1pt} ***}}$ | $\frac{{88}}{8}$ |
| Серин | 0.1 | $\frac{{3.8 \pm 0.3}}{{4.4 \pm 0.7}}$ | $\frac{{4.8 \pm 0.6}}{{2.1 \pm 0.5{\kern 1pt} *}}$ | $\frac{{17.5 \pm 0.9}}{{7.1 \pm 0.9{\kern 1pt} ***}}$ | $\frac{{76}}{{20}}$ |
| Треонин | 0.1 | $\frac{{3.3 \pm 0.3}}{{4.3 \pm 0.8}}$ | $\frac{{5.4 \pm 0.5}}{{1.5 \pm 0.2{\kern 1pt} ***}}$ | $\frac{{13.5 \pm 0.5}}{{5.1 \pm 1.0{\kern 1pt} ***}}$ | $\frac{{76}}{{20}}$ |
| Цистеин | 0.1 | $\frac{{3.6 \pm 0.3}}{{4.8 \pm 0.5{\kern 1pt} *}}$ | $\frac{{4.7 \pm 0.5}}{{1.5 \pm 0.2{\kern 1pt} ***}}$ | $\frac{{14.9 \pm 0.6}}{{6.6 \pm 0.8{\kern 1pt} ***}}$ | $\frac{{70}}{{26}}$ |
| Глицин | 0.1 | $\frac{{6.2 \pm 0.4}}{{4.2 \pm 0.4{\kern 1pt} **}}$ | $\frac{{3.1 \pm 0.5}}{{1.6 \pm 0.2}}$ | $\frac{{19.2 \pm 0.8}}{{5.7 \pm 0.6{\kern 1pt} ***}}$ | $\frac{{66}}{{30}}$ |
| Аланин | 0.1 | $\frac{{8.6 \pm 0.7}}{{7.8 \pm 1.0}}$ | $\frac{{3.1 \pm 0.5}}{{1.4 \pm 0.1{\kern 1pt} *}}$ | $\frac{{27.6 \pm 1.8}}{{9.7 \pm 1.1{\kern 1pt} ***}}$ | $\frac{{64}}{{32}}$ |
| Норвалин | 0.1 | $\frac{{5.6 \pm 0.4}}{{5.2 \pm 0.5}}$ | $\frac{{3.2 \pm 0.4}}{{2.0 \pm 0.3{\kern 1pt} *}}$ | $\frac{{17.3 \pm 0.7}}{{8.3 \pm 0.8{\kern 1pt} ***}}$ | $\frac{{57}}{{39}}$ |
| Фенилаланин | 0.1 | $\frac{{8.3 \pm 0.4}}{{5.4 \pm 0.6{\kern 1pt} ***}}$ | $\frac{{1.6 \pm 0.2}}{{1.3 \pm 0.1}}$ | $\frac{{20.3 \pm 1.1}}{{5.9 \pm 0.7{\kern 1pt} ***}}$ | $\frac{{50}}{{46}}$ |
| Валин | 0.1 | $\frac{{7.0 \pm 0.5}}{{5.6 \pm 0.4{\kern 1pt} *}}$ | $\frac{{2.3 \pm 0.3}}{{1.6 \pm 0.2{\kern 1pt} *}}$ | $\frac{{20.8 \pm 0.9}}{{7.2 \pm 0.7{\kern 1pt} ***}}$ | $\frac{{48}}{{48}}$ |
| Метионин | 0.1 | $\frac{{7.0 \pm 0.5}}{{5.2 \pm 0.5{\kern 1pt} *}}$ | $\frac{{2.0 \pm 0.2}}{{1.8 \pm 0.3}}$ | $\frac{{18.8 \pm 1.0}}{{7.2 \pm 0.8{\kern 1pt} ***}}$ | $\frac{{48}}{{48}}$ |
| Гистидин | 0.1 | $\frac{{9.3 \pm 0.7}}{{5.8 \pm 0.7{\kern 1pt} **}}$ | $\frac{{1.8 \pm 0.3}}{{1.5 \pm 0.2}}$ | $\frac{{23.2 \pm 1.2}}{{8.0 \pm 1.0{\kern 1pt} ***}}$ | $\frac{{46}}{{50}}$ |
| Глутамин | 0.1 | $\frac{{9.0 \pm 0.7}}{{5.4 \pm 0.6{\kern 1pt} ***}}$ | $\frac{{2.2 \pm 0.5}}{{1.5 \pm 0.2}}$ | $\frac{{22.0 \pm 1.2}}{{6.6 \pm 0.8{\kern 1pt} ***}}$ | $\frac{{41}}{{55}}$ |
| Аспарагин | 0.1 | $\frac{{10.7 \pm 1.1}}{{5.0 \pm 0.4{\kern 1pt} ***}}$ | $\frac{{2.2 \pm 0.6}}{{1.3 \pm 0.1{\kern 1pt} *}}$ | $\frac{{24.6 \pm 2.3}}{{6.1 \pm 0.6{\kern 1pt} ***}}$ | $\frac{{31}}{{65}}$ |
| Лизин | 0.1 | $\frac{{7.9 \pm 0.7}}{{4.4 \pm 0.4{\kern 1pt} ***}}$ | $\frac{{2.2 \pm 0.4}}{{1.5 \pm 0.1{\kern 1pt} *}}$ | $\frac{{23.3 \pm 1.3}}{{5.5 \pm 0.7{\kern 1pt} ***}}$ | $\frac{{25}}{{71}}$ |
| Аргинин | 0.1 | $\frac{{10.8 \pm 1.0}}{{3.8 \pm 0.5{\kern 1pt} ***}}$ | $\frac{{1.0 \pm 0.1}}{{1.0 \pm 0.1}}$ | $\frac{{21.9 \pm 2.2}}{{3.7 \pm 0.6{\kern 1pt} ***}}$ | $\frac{9}{{87}}$ |
| Аспарагиновая кислота | 0.01 | $\frac{{7.3 \pm 0.7}}{{4.3 \pm 0.3{\kern 1pt} ***}}$ | $\frac{{1.8 \pm 0.2}}{{1.3 \pm 0.1{\kern 1pt} *}}$ | $\frac{{15.7 \pm 0.7}}{{5.2 \pm 0.5{\kern 1pt} ***}}$ | $\frac{{42}}{{54}}$ |
| Глутаминовая кислота | 0.01 | $\frac{{10.8 \pm 0.9}}{{5.4 \pm 0.3{\kern 1pt} ***}}$ | $\frac{{2.0 \pm 0.3}}{{1.6 \pm 0.1}}$ | $\frac{{22.6 \pm 2.2}}{{6.8 \pm 0.6{\kern 1pt} ***}}$ | $\frac{{24}}{{72}}$ |
| Изолейцин | 0.01 | $\frac{{7.7 \pm 0.6}}{{4.8 \pm 0.4{\kern 1pt} ***}}$ | $\frac{{1.8 \pm 0.4}}{{1.4 \pm 0.1}}$ | $\frac{{17.6 \pm 0.8}}{{5.6 \pm 0.5{\kern 1pt} ***}}$ | $\frac{{22}}{{73}}$ |
| Лейцин | 0.01 | $\frac{{13.6 \pm 1.6}}{{4.6 \pm 0.4{\kern 1pt} ***}}$ | $\frac{{1.1 \pm 0.2}}{{1.2 \pm 0.1}}$ | $\frac{{19.9 \pm 2.8}}{{4.1 \pm 0.3{\kern 1pt} ***}}$ | $\frac{{13}}{{83}}$ |
| Триптофан | 0.01 | $\frac{{10.5 \pm 1.6}}{{4.3 \pm 0.3{\kern 1pt} ***}}$ | $\frac{{1.9 \pm 0.4}}{{1.1 \pm 0.1{\kern 1pt} ***}}$ | $\frac{{16.0 \pm 1.1}}{{4.8 \pm 0.4{\kern 1pt} ***}}$ | $\frac{8}{{88}}$ |
| Тирозин | 0.001 | $\frac{{9.7 \pm 2.5}}{{5.2 \pm 0.4{\kern 1pt} *}}$ | $\frac{{1.9 \pm 0.6}}{{1.2 \pm 0.1{\kern 1pt} *}}$ | $\frac{{18.5 \pm 3.8}}{{5.6 \pm 0.5{\kern 1pt} ***}}$ | $\frac{6}{{90}}$ |
| Экстракт Chironomidae | 175.0 | $\frac{{8.3 \pm 0.6}}{{13.0 \pm 1.9{\kern 1pt} *}}$ | $\frac{{2.3 \pm 0.4}}{{0.8 \pm 0.1}}$ | $\frac{{23.1 \pm 0.9}}{{15.1 \pm 3.8{\kern 1pt} *}}$ | $\frac{{88}}{8}$ |
| Контроль | $\frac{{12.5 \pm 1.4}}{{6.0 \pm 0.4{\kern 1pt} ***}}$ | $\frac{{2.6 \pm 0.8}}{{1.3 \pm 0.1{\kern 1pt} **}}$ | $\frac{{23.1 \pm 2.2}}{{6.5 \pm 0.5{\kern 1pt} ***}}$ | $\frac{{17}}{{79}}$ | |
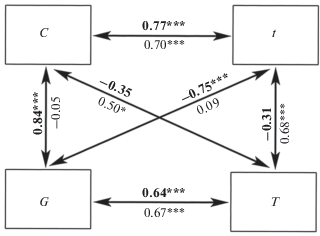
В ПГ- и ОГ-опытах различаются корреляции показателей реакции рыб на гранулы. Так, в ПГ-опытах проявляется сильно выраженная отрицательная корреляция между потреблением и числом схватываний гранул и между числом схватываний и длительностью первого удержания. В ОГ-опытах значимая связь между этими парами параметров не обнаружена. Различается связь между потреблением и суммарной длительностью удержания и между суммарной длительностью и первым удержанием (рис. 3).
Рис. 3.
Коэффициент корреляции Спирмена между параметрами вкусового ответа на гранулы с L-аминокислотами у мраморного гурами Trichopodus trichopterus для опытов, завершившихся потреблением (выделено полужирным шрифтом) и отверганием гранулы: уровень значимости отличий при p: * < 0.05, ** < 0.01, *** < 0.001; обозначения см. на рис. 2.
ОБСУЖДЕНИЕ
Сравнение вкусовых спектров двух видов гурами. Полученные результаты показывают, что вкусовая рецепция у мраморного гурами хорошо развита, что позволяет ему различать присутствие химических веществ в пищевых объектах и проявлять по отношению к ним вкусовые ответы разного типа. Из 25 веществ, подвергнутых тестированию, 14 были привлекательными по вкусу, два имели отталкивающие вкусовые свойства и остальные девять индифферентными, т.е. их присутствие в гранулах не влияло на потребление. Однако из веществ последней группы только лимонная и глутаминовая кислоты были индифферентными стимулами также и по всем другим регистрировавшимся параметрам ответа (схватывания, удержание гранулы).
У другого представителя Anabantoidei – жемчужного гурами − эффективными стимулами также были 16 веществ. Однако, в отличие от мраморного гурами, среди них доминировали обладающие аверсивными (детеррентными) вкусовыми свойствами вещества – 13. В число веществ, обладавших значимыми вкусовыми свойствами для жемчужного гурами, вошли все пять аминокислот, использовавшиеся при низкой концентрации (0.01 М), но, в отличие от мраморного гурами, не вошёл тирозин (0.001 М). Среди девяти веществ, не оказывавших эффекта на потребление гранул жемчужным гурами, индифферентность по всем остальным параметрам ответа проявили четыре вещества, включая, как и у мраморного гурами, лимонную кислоту (Виноградская и др., 2017).
Таким образом, большинство испытанных веществ – 16 из 25 (64%) – обладают значимыми вкусовыми свойствами для обоих видов гурами, т.е. стимулируют или подавляют потребление гранул. Если принять во внимание влияние на все параметры вкусового ответа рыб, то доля эффективных веществ составляет 84% (21 из 25) у жемчужного гурами и 92% (23 из 25) у мраморного гурами, что сопоставимо с соотношением этих групп веществ, например, у рыб, питающихся донными животными, таких как карп Cyprinus carpio и линь Tinca tinca (Касумян, Морси, 1996; Касумян, Прокопова, 2001). Это позволяет считать, что гурами по уровню развития вкусовой рецепции не уступают другим рыбам, несмотря на то что большая часть ротовой полости у них занята крупным наджаберным органом, в эпителии которого у Anabantoidei вкусовых почек не находят (Hughes, Munshi, 1973). Хорошее развитие вкусовой рецепции у мраморного гурами подтверждает также способность этих рыб различать вкусовые качества химических веществ, близких по структуре и конфигурации молекулы, таких как L- и D-изомеры аминокислот, аминокислоты с α- и β-положением аминогруппы и другие (Kasumyan, Mouromtsev, 2020).
Сравнение вкусовых предпочтений двух видов гурами показывает, что, несмотря на одинаковое число эффективных веществ для обоих видов (16 из 25), их перечень и действие различаются (Виноградская и др., 2017; наши данные). Противоположные вкусовые свойства имеют восемь веществ, 12 веществ являются привлекательными или отталкивающими для одного вида, но индифферентными для другого. И только действие пяти веществ одинаково: два из них усиливают потребление, три не влияют на него.
Особый интерес вызывает отношение гурами к двум классическим вкусовым веществам – сахарозе и лимонной кислоте. Известно, что для многих животных, использующих в пищу растения и их плоды, сахароза имеет привлекательный вкус (Harborne, 1993). Это общее правило в полной мере приложимо и к рыбам: у рыб, питающихся растительностью, сахароза повышает потребление (белый амур Ctenopharyngodon idella, гуппи Poecilia reticulata, плотва Rutilus rutilus) (Касумян, Морси, 1997; Kasumyan, Nikolaeva, 2002). Для большинства других рыб, питающихся в основном животной пищей, вкус сахарозы индифферентен и лишь для некоторых из них – отталкивающий (Hidaka, 1982; Kasumyan, Døving, 2003; Goli et al., 2015). Питание гурами в природе изучено плохо. Известно, что оба вида гурами всеядны (Froese, Pauly, 2021). В пищеварительном тракте мраморного гурами, который изучен лучше, чем жемчужный, находят зоопланктон (копеподы, кладоцеры, остракоды), личинки насекомых, икру рыб, детрит, а также диатомовые и нитчатые водоросли и макрофиты (Rainboth, 1996; Graham, 1997; Talde et al., 2004; Webb et al., 2007; Froese, Pauly, 2021). Перифитон (диатомовые водоросли) и зоопланктон составляют основу питания жемчужного гурами (Zahid et al., 2009). Некоторые источники относят растения в питании гурами к случайным объектам (CABI, 2018; Low, 2019). В литературе по аквариумным рыбам сообщается, что для мраморного гурами растения не представляют пищевого интереса, тогда как жемчужный гурами охотно потребляет водную растительность, а присутствие растительных компонентов в пище благоприятно сказывается на его состоянии (Ильин, Расс, 1971; Axelrod, Vorderwinkler, 1995; Чеботаева, 2005, 2006). Это косвенно указывает на то, что отношение обоих гурами к вкусу сахарозы (позитивное у жемчужного и негативное у мраморного), по-видимому, соответствует общему правилу: она привлекательна для растительноядных животных и безразлична для тех, кто растения в пищу не использует.
Лимонная кислота для большинства рыб – сильный вкусовой раздражитель, безразличное отношение к нему характерно лишь для 26% исследованных видов (семь видов из 27) (Kasumyan, Døving, 2003). Оба вида гурами относятся к последним. Безразличный вкус для них имеют также хлорид натрия и хлорид кальция. Таким образом, отношение к вкусу трёх из четырёх классических вкусовых веществ у сравниваемых видов совпадает, но к одному веществу (сахароза) оно противоположное.
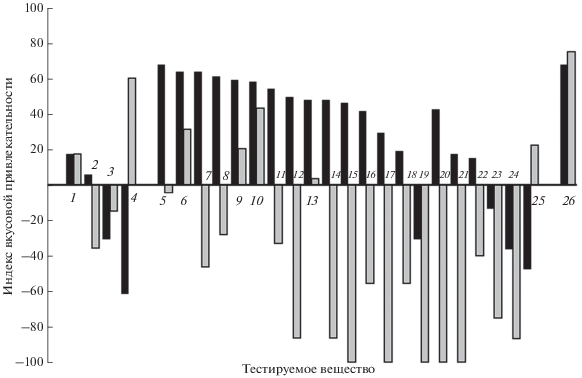
Вкусовые свойства аминокислот различаются для гурами сильнее. Из 21 аминокислоты сходный эффект вызывают только аланин и серин, они имеют привлекательный вкус для обоих видов, но занимают разное положение в ранжированном ряду. Треонин, фенилаланин, метионин, гистидин, глутамин, аспарагин, аспарагиновая кислота усиливают потребление гранул у мраморного гурами, но подавляют у жемчужного. Действие остальных аминокислот также не совпадает. Например, высокопривлекательные для мраморного гурами пролин, цистеин и глицин индифферентны для жемчужного гурами, а имеющие отталкивающий вкус для жемчужного гурами глутаминовая кислота, лейцин, изолейцин, лизин и аргинин идифферентны для мраморного гурами. Однако последовательность многих аминокислот в ранжированных рядах эффективности близка (рис. 4), что объясняет слабую, но достоверную корреляцию (rs = 0.48, p < 0.05) вкусовой привлекательности аминокислот для сравниваемых видов гурами. При использовании для такого анализа всех типов гранул совместно, т.е. содержащих аминокислоты, классические вкусовые вещества, экстракт хирономид и контрольные, связь между двумя видами не достоверна (rs = = 0.30, p > 0.05).
Рис. 4.
Индекс вкусовой привлекательности классических вкусовых веществ (1−4), L-аминокислот (5−25) и экстракта Chironomidae (26) для мраморного Trichopodus trichopterus (◼) и жемчужного гурами T. leerii (◻): 1 – лимонная кислота (0.26 М, 5%), 2 – хлористый кальций (0.9 М, 10%), 3 – хлористый натрий (1.73 М, 10%), 4 – сахароза (0.29 М, 10%); 5–19 – 0.1 М: 5 – пролин, 6 – серин, 7 – треонин, 8 – цистеин, 9 – глицин, 10 – аланин, 11 – норвалин, 12 – фенилаланин, 13 – валин, 14 – метионин, 15 – гистидин, 16 – глутамин, 17 – аспарагин, 18 – лизин, 19 – аргинин; 20–24 – 0.01 М: 20 – аспарагиновая кислота, 21 – глутаминовая кислота, 22 – изолейцин, 23 – лейцин, 24 – триптофан; 25 – тирозин (0.001 М), 26 – экстракт личинок Chironomidae (175.0 г/л).
Мраморный и жемчужный гурами имеют совпадающие ареалы (Linke, 1991) и обитают в водоёмах совместно (Mizuno, Furtado, 1982; Roberts, 1989; Pranata et al., 2016; Muthmainnah, Gaffar, 2017). Населяют они пресноводные болота и торфяники, пруды и озёра, небольшие медленно текущие реки и ручьи, временные водоёмы в заливаемых поймах, рисовые чеки, оросительные и ирригационные каналы и канавы, предпочитают одинаковые биотопы – участки с густыми зарослями водной растительности (Smith, 1945; Linke, 1991; Low, Lim, 2012; Low, 2019). Оба вида могут встречаться здесь совместно в одних и тех же местах (Roberts, 1989; Pranata et al., 2016). Различающиеся, часто противоположные, вкусовые предпочтения могут, по-видимому, приводить к питанию разными организмами и снижать пищевую конкуренцию между этими симпатрическими рыбами, близкими по генетике и образу жизни (Linke, 1991; Rüber et al., 2006; Wang et al., 2016). Это подтверждают краткие данные о составе потреблённых организмов в пищеварительном тракте мраморного и жемчужного гурами, отловленных в небольших заболоченных лесных водоёмах Центрального Калимантана (Zahid, 2008). Возможно, снижение пищевой конкуренции между ними достигается благодаря присущей гурами агрессивности (Forselius, 1957; Tooker, Miller, 1980; Hollis et al., 1997; Hollis, 1999; Low, 2019). Это даёт возможность особям использовать локальные пищевые ресурсы и не допускать к ним конкурентов. В отличие от гурами близкородственные и часто встречающиеся совместно трёхиглая колюшка Gasterosteus aculeatus и девятииглая колюшка Pungitius pungitius обладают близкими вкусовыми спектрами и потребляют сходные организмы. Снижение пищевой конкуренции между колюшками достигается за счёт расхождения этих рыб в водоёме по разным биотопам: трёхиглая колюшка предпочитает пелагиаль, девятииглая – прибрежную зону с водной растительностью (Hynes, 1950; Ketele, Verheyen, 1985; Hart, 2003; Касумян, Михайлова, 2014; Михайлова, Касумян, 2015). Таким образом, территориальность наряду с расхождением рыб по разным биотопам входят в число экологических и поведенческих механизмов, которые снижают пищевую напряжённость между сосуществующими видами.
Сравнение вкусовых предпочтений гурами и других видов рыб. Мраморный гурами относится к числу немногих видов рыб, для которых вкус большинства аминокислот (15) привлекателен: у линя Tinca tinca и кеты Oncorhynchus keta таких аминокислот 12, у девятииглой колюшки москворецкой популяции – 16 (Kasumyan, Døving, 2003; Михайлова, Касумян, 2015). Тирозин – единственная аминокислота, обладающая для мраморного гурами детеррентным действием, для многих рыб индифферентен либо стимулирует потребление пищи. Пролин, вкусовая привлекательность которого у мраморного гурами соизмерима с экстрактом хирономид, обладает таким же действием и для других рыб, но всё же у большинства видов он входит в число индифферентных вкусовых веществ (Касумян, 2016). Наряду с этими и другими примерами своеобразия вкусовых предпочтений мраморного гурами можно отметить и некоторые черты сходства с другими рыбами. Так, индифферентные для мраморного гурами лейцин, изолейцин, триптофан, лизин, аргинин такими же вкусовыми свойствами обладают для более чем половины из 32 исследованных видов рыб (Касумян, 2016). Однако сравнение аминокислотных спектров мраморного гурами и других рыб обнаруживает достоверную связь лишь в некоторых случаях, причём с видами, далёкими от мраморного гурами по образу жизни, питанию и систематике (табл. 4). Результаты этого сравнения подтверждают видовую специфику вкусовых предпочтений и важную роль вкусовой рецепции в обеспечении пищевой избирательности.
Таблица 4.
Значения рангового коэффициента корреляции Спирмена (rs) для вкусовых предпочтений 21 свободной аминокислоты между мраморным гурами Trichopodus trichopterus и другими видами рыб
| Вид | rs | Источник информации |
|---|---|---|
| Гольян Phoxinus phoxinus | 0.55** | Касумян, Марусов, 2003 |
| Линь Tinca tinca | 0.53* | Касумян, Прокопова, 2001 |
| Клариевый сом Clarias gariepinus | 0.52* | Kasumyan, 2014 |
| Жемчужный гурами Trichopodus leerii | 0.48* | Виноградская и др., 2017 |
| Девятииглая колюшка Pungitius pungitius1 | 0.44* | Михайлова, Касумян, 2015 |
| Трёхиглая колюшка Gasterosteus aculeatus2 | 0.36 | Касумян, Михайлова, 2014 |
| Персидский осётр Acipenser persicus | 0.36 | Джафари Шамушаки и др., 2008 |
| Севрюга A. stellatus | 0.30 | Касумян, Сидоров, 1994б |
| Озёрный голец Salvelinus namaycush | 0.30 | Касумян, Сидоров, 2001 |
| Полярная камбала Liopsetta glacialis | 0.26 | Kasumyan, Nikolaeva, 2002 |
| Усатый голец Barbatula barbatula | 0.24 | Касумян, Сидоров, 2010 |
| Кета Oncorhynchus keta | 0.13 | Касумян, Сидоров, 1992 |
| Гуппи Poecilia reticulata | 0.13 | Касумян, Николаева, 1997 |
| Сибирский осётр A. baerii (19 – без цистеина и норвалина) | 0.07 | Касумян, Сидоров, 1994б |
| Плотва Rutilus rutilus | 0.02 | Kasumyan, Nikolaeva, 2002 |
| Карп Cyprinus carpio | 0.01 | Касумян, Морси, 1996 |
| Русский осётр A. gueldenstaedtii | –0.05 | Касумян, Сидоров, 1994б |
| Голец-даватчан S. alpinus erythrinus | –0.05 | Касумян, Сидоров, 1995 |
| Серебряный карась Carassius auratus | –0.24 | Kasumyan, Nikolaeva, 2002 |
| Кумжа Salmo trutta | –0.26 | Касумян, Сидоров, 1994а |
Пищевое поведение. Поведение, проявляемое мраморным гурами при тестировании пищевых объектов, имеет такие же особенности, что и у жемчужного гурами, но отличается от поведения многих других рыб. Обоим видам гурами присущи многократные хемотактильные контакты с объектом, в том числе на этапе, предваряющем схватывание, что у рыб встречается редко, в основном у питающихся организмами эпи- и инфауны, зрение у которых не участвует в обнаружении пищи или зрительные возможности слабые и ограничены внешними условиями (низкая освещённость, высокая мутность воды и др.). Эти рыбы перед схватыванием могут касаться объекта не только губами, как гурами, но и усами, плавниками, рострумом, головой, туловищем. В отличие от гурами им достаточно однократного касания, но для большинства видов оно является обязательным элементом пищевого поведения (сомообразные (Siluriformes), осетровые (Acipenseridae), некоторые тресковые (Gadidae), султанка Mullus barbatus ponticus, усатый голец Barbatula barbatula, угольная рыба Anoplopoma fimbria, слепая пещерная рыба Astyanax fasciatus и другие) (Parker, 1910; Андрияшев, 1944а, 1944б; Аронов, 1959; Павлов, 1959, 1962; Bardach, Case, 1965; Brawn, 1969; Bruton, 1979; Døving, Selset, 1980; Stoner, Sturm, 2004; Касумян, Сидоров, 2010; Kasumyan, 2014, 2018; Касумян, Марусов, 2015). На губах у рыб, у мраморного гурами в частности (Scharrer et al., 1947), располагаются вкусовые почки; у многих видов они имеются на усах, плавниках и поверхности тела (Kapoor et al., 1975; Devitsina, 2005), поэтому, прикасаясь к объекту, рыбы в состоянии получить предварительную информацию о его вкусовых свойствах. Касания имеют отношение и к тактильному чувству, функционально связанному с вкусовой рецепцией (Kasumyan, 2011). Длинные нитевидные лучи брюшных плавников, несмотря на то что они у гурами чувствительны к тактильным стимулам и в дистальной части несут вкусовые почки, такие же, как на губах (Scharrer et al., 1947), для сенсорной оценки пищевых объектов не используются, по крайней мере, при высокой освещённости (Касумян и др., 2014; наши данные).
Гурами не только многократно касаются пищевых объектов перед их схватыванием, но и подвергают их многочисленным повторным оросенсорным тестированиям, прежде чем проглотить или отказаться от потребления. Число таких тестирований, совершаемых с большой частотой, у обоих видов может превышать 20–30. Быстрые отвергания и повторные схватывания пищевых объектов характерны в основном для рыб, отыскивающих пищу с помощью зрения и населяющих биотопы или водоёмы, в которых течение слабое или отсутствует. Именно такие условия обитания характерны для обоих гурами (Linke, 1991; Webb, 2007; Webb et al., 2007). Более того, гурами относят к территориальным и агрессивным рыбам (Hollis, 1999; Webb, 2007; Webb et al., 2007). Даже вне периода размножения, когда гурами вновь объединяются в группы, доминирование и иерархия при появлении пищи сразу же восстанавливаются (Hollis, 1999). Это предполагает отсутствие рядом с питающейся рыбой непосредственных конкурентов, которые, как это показано для трёхиглой колюшки, могут перехватить временно отвергнутую добычу (Gill, Hart, 1996). Видимо, сочетание асоциальности и обитания вне потока и обусловило рекордно частые для рыб манипуляции с пищевыми объектами. Следует, однако, подчеркнуть, что многократные тестирования наблюдаются у мраморного гурами далеко не во всех случаях: в 50% опытов происходило не более четырёх повторных схватываний, а наиболее обычными были случаи, когда рыбам для принятия решения о пригодности гранулы было достаточно одного тестирования (рис. 1а).
Многократные повторные схватывания приводят к тому, что в некоторых опытах суммарная длительность пребывания гранулы в ротовой полости рыб превышает 1 мин; однако в большинстве опытов это время существенно меньше – до 10 с. Средние величины этого параметра соответствуют наблюдаемым у многих других рыб, что не позволяет считать присутствие лабиринтового органа, снижающего площадь эпителия ротовой полости, где могут размещаться вкусовые и тактильные рецепторы, влияющим на длительность тестирования. Отсутствие значимой корреляции с числом схватываний и хорошо выраженная связь с вкусовой привлекательностью вещества, присутствующего в пищевом объекте (рис. 2), указывают на то, что длительность тестирования схваченного объекта обусловлена другими механизмами, прежде всего, имеющими отношение к процессам оросенсорной рецепции и анализа информации в мозговых центрах (Finger, 2008). Гурами затрачивают в несколько раз меньше времени на оценку вкусовых качеств малопотребляемых гранул, чем на оценку привлекательных по вкусу. Такое поведение характерно для многих других рыб (Kasumyan, Nikolaeva, 2002; Касумян, Михайлова, 2014). Оно оптимизирует питание, снижая непродуктивные затраты времени на оценку свойств мало пригодных для питания объектов, тогда как длительное тестирование пищи, вероятность потребления которой высокая, повышает надёжность сенсорной оценки её адекватности потребностям рыбы.
Гурами способны к звукогенерации. Благодаря особому устройству грудных плавников они издают характерные и хорошо слышимые двойные щелчки, относимые к специализированным звукам, поскольку производятся в определённых ситуациях (при конфликтах в группах), а также сигнализируют о потенциале соперника (Ladich et al., 1992). Мраморный гурами издаёт щелчки при схватываниях любых гранул. Способность генерировать звуки при питании отмечена нами ранее у жемчужного гурами (Виноградская и др., 2017). Являются ли эти звуки сопутствующими питанию (неспециализированными) или имеют коммуникативное значение, требует выяснения.
Схваченная рыбами пища может быть в итоге проглочена или отвергнута; поведение, которое приводит к этим двум возможным конечным результатам, различается (рис. 5а−5г). Мраморный и жемчужный гурами гранулы одного и того же типа независимо от их вкусового качества схватывают значительно чаще и тестируют в ротовой полости намного дольше перед проглатыванием, чем в случаях итогового отказа от потребления. Длительное удержание гранулы перед заглатыванием присуще большинству рыб (Касумян, Тинькова, 2013; Касумян, Михайлова, 2014; Михайлова, Касумян, 2015). Несомненно, это вызвано важностью решения о пригодности пищи и теми опасными следствиями, часто фатальными, к которым может привести ошибка, допущенная рыбами при питании (Yamamori et al., 1988; Gosselin et al., 1989).
Рис. 5.
Стереотипы пищевого поведения (а–г) и зависимости его параметров от индекса вкусовой
привлекательности тестируемых веществ (Indpal) (д–з) для мраморного гурами Trichopodus trichopterus: а – поза ожидания гранулы, б – схватывание гранулы, в – потребление гранулы (ПГ-опыты),
г – отказ от потребления гранулы (ОГ-опыты), д – число повторных схватываний гранулы
в ПГ-опытах (у = –0.0497х + 9.2969, R2 = 0.4948), е – то же в ОГ-опытах (y = 0.0182x + + 4.625, R2 = 0.1443), ж − длительность первого (◆) и суммарного ( ) удержания гранулы в ПГ-опытах (y = 0.018x + 2.0528, R2 = 0.3472 и y = 0.0108x + 19.24, R2 = 0.0119), з – то же в ОГ-опытах (y = 0.0047x + 1.2831, R2 = 0.3422 и y = 0.0397x + + 5.3457, R2 = 0.4167); а–г – размер гранулы относительно размеров рыбы не соблюдён.
) удержания гранулы в ПГ-опытах (y = 0.018x + 2.0528, R2 = 0.3472 и y = 0.0108x + 19.24, R2 = 0.0119), з – то же в ОГ-опытах (y = 0.0047x + 1.2831, R2 = 0.3422 и y = 0.0397x + + 5.3457, R2 = 0.4167); а–г – размер гранулы относительно размеров рыбы не соблюдён.
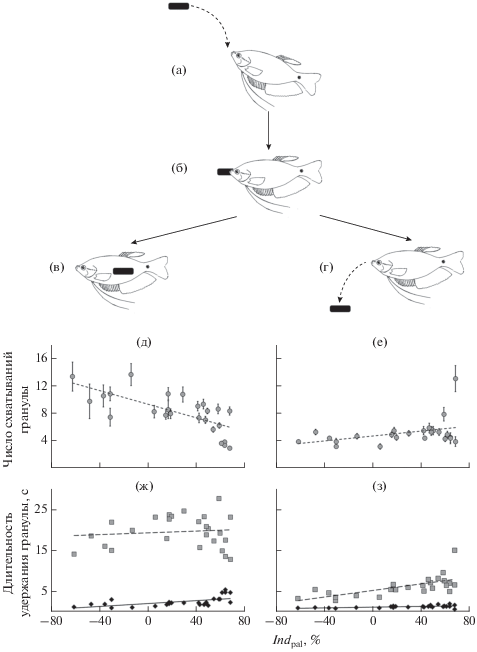
Выполненный регрессионный анализ впервые обнаружил, что выраженность различий между стереотипами поведения определяется привлекательностью вкуса действующего вещества: разница между числом схватываний в ПГ- и ОГ-опытах максимальна для гранул с индифферентными и малопривлекательными по вкусу веществами, но по мере увеличения вкусовой привлекательности гранул она постепенно нивелируется за счёт снижения схватываний в ПГ-опытах и медленного увеличения в ОГ-опытах (рис. 5д, 5е). Это находит отражение и в значениях коэффициента корреляции между числом схватываний и потреблением гранул для этих групп опытов (рис. 3). Влияние привлекательности гранулы на длительность её удержания в ПГ- и ОГ-опытах слабое (рис. 5ж, 5з). Являются ли эти зависимости специфичными для мраморного гурами или они имеют такой же характер и у других рыб, требует выяснения.
ЗАКЛЮЧЕНИЕ
Ползуновидные рыбы широко распространены в равнинных водоёмах Африки и юга Азии – мелководных, густо заросших водной растительностью, богатых детритом и другим органическим материалом, прогреваемых, непроточных или со слабым течением. Наличие лабиринтового наджаберного органа позволяет этим рыбам использовать воздушное дыхание и успешно выживать в условиях постоянного дефицита кислорода в воде (Graham, 1997). Полученные результаты показывают, что присутствие столь крупной структуры в ротовой полости не влияет на возможность гурами дифференцированно реагировать на пищевые объекты разного вкусового качества. Питаясь одними объектами и отказываясь от потребления других, гурами проявляют разные стереотипы пищевого поведения, что характерно для рыб бореальной зоны, использующих только жаберный тип дыхания. Как и у многих рыб, вкусовые предпочтения у мраморного и жемчужного гурами видоспецифичны, несмотря на филогенетическую близость, совпадение ареалов и сходный образ жизни. В отличие от вкусовых предпочтений поведение, демонстрируемое гурами при тестировании пищи, более консервативно и имеет одни и те же особенности: предварительные частые касания объекта губами, многочисленные отвергания и повторные схватывания, генерация звуков. Выполнение аналогичных исследований на других представителях Anabantoidei представляет интерес для уточнения полученных выводов.
Многие представители Anabantoidei являются популярными аквариумными рыбами, разводимыми в больших масштабах, некоторых из них, в том числе мраморного гурами, в ряде тропических стран культивируют для использования в пищу (Halwart, Gupta, 2004). В последние годы происходит успешная инвазия мраморного гурами не только в районы, прилегающие к его естественному ареалу (Австралия, Филиппины, Индия и др.), но и располагающиеся на других континентах (Африка, Северная и Южная Америка) (Webb, 2007; Geheber et al., 2010; Gutiérrez et al., 2012; Rodrigues-Filho et al., 2017; CABI, 2018). В ряде случаев формирующиеся в новых районах популяции мраморного гурами оказывают заметное негативное влияние на численность аборигенных рыб (Liao, Liu, 1989 – цит. по: Webb, 2007). В связи с этим сведения о пищевом поведении и его сенсорном регулировании у гурами имеют важное прикладное значение.
Список литературы
Андрияшев А.П. 1944а. Роль органов чувств в отыскании пищи у морского налима // Журн. общ. биологии. Т. 5. № 2. С. 123–127.
Андрияшев А.П. 1944б. Способы отыскания пищи у султанки Mullus barbatus ponticus // Там же. Т. 5. № 3. С. 193–196.
Аронов М.П. 1959. О наружном вкусовом аппарате морского налима // Науч. докл. высш. шк. Биол. науки. № 4. С. 38–41.
Виноградская М.И., Михайлова Е.С., Касумян А.О. 2017. Вкусовые предпочтения, оросенсорное тестирование и генерация звуков при питании у жемчужного гурами Trichopodus leerii (Osphronemidae) // Вопр. ихтиологии. Т. 57. № 3. С. 324–337. https://doi.org/10.7868/S004287521703016X
Джафари Шамушаки В., Абтахи Б., Касумян А.О. и др. 2008. Вкусовая привлекательность свободных аминокислот для молоди персидского осетра Acipenser persicus // Там же. Т. 48. № 1. С. 130–140.
Ивлев В.С. 1977. Экспериментальная экология питания рыб. Киев: Наук. думка, 272 с.
Ильин М.Н., Расс Т.С. 1971. Подотряд ползуновидные (Anabantoidei) // Жизнь животных. Т. 4. Рыбы. М.: Просвещение. С. 551–553.
Касумян А.О. 2016. Вкусовая привлекательность и физико-химические и биологические свойства свободных аминокислот (на примере рыб) // Журн. эволюц. биохимии и физиологии. Т. 52. № 4. С. 245–254.
Касумян А.О., Марусов Е.А. 2003. Поведенческие ответы интактных и хронически аносмированных обыкновенных гольянов Phoxinus phoxinus (Cyprinidae) на свободные аминокислоты // Вопр. ихтиологии. Т. 43. № 4. С. 528–539.
Касумян А.О., Марусов Е.А. 2015. Хемоориентация в пищевом поведении у слепой пещерной рыбы Asyanax fasciatus (Characidae, Teleostei) // Экология. № 6. С. 439–443. https://doi.org/10.7868/S0367059715060050
Касумян А.О., Михайлова Е.С. 2014. Вкусовые предпочтения и пищевое поведение трёхиглой колюшки Gasterosteus aculeatus популяций бассейнов Атлантического и Тихого океанов // Вопр. ихтиологии. Т. 54. № 4. С. 446–469. https://doi.org/10.7868/S004287521404002X
Касумян А.О., Морси А.М.Х. 1996. Вкусовая чувствительность карпа Cyprinus carpio к свободным аминокислотам и классическим вкусовым веществам // Там же. Т. 36. № 3. С. 386–399.
Касумян А.О., Морси А.М.Х. 1997. Вкусовые предпочтения классических вкусовых веществ молоди белого амура, Ctenopharyngodon idella (Cyprinidae, Pisces), выращенной на животном и растительном корме // ДАН. Т. 357. № 2. С. 284–286.
Касумян А.О., Николаева Е.В. 1997. Вкусовые предпочтения гуппи Poecilia reticulata (Cyprinodontiformes) // Вопр. ихтиологии. Т. 37. № 5. С. 696–703.
Касумян А.О., Прокопова О.М. 2001. Вкусовые предпочтения и динамика вкусового поведенческого ответа у линя Tinca tinca (Cyprinidae) // Там же. Т. 41. № 5. С. 670–685.
Касумян А.О., Сидоров С.С. 1992. Вкусовая чувствительность кеты Oncorhynchus keta к основным типам вкусовых раздражителей и аминокислотам // Сенсорные системы. Т. 6. № 3. С. 100–103.
Касумян А.О., Сидоров С.С. 1994а. Вкусовые свойства свободных аминокислот для молоди каспийской кумжи Salmo trutta caspius Kessler // Вопр. ихтиологии. Т. 34. № 6. С. 831–838.
Касумян А.О., Сидоров С.С. 1994б. Сравнение интраоральных и экстраоральных вкусовых ответов на свободные аминокислоты у трех видов осетровых рыб рода Acipenser // Биофизика. Т. 39. Вып. 3. С. 526–529.
Касумян А.О., Сидоров С.С. 1995. Сравнительный анализ вкусовых ответов молоди кумжи Salmo trutta trutta популяций Балтийского и Белого морей // ДАН. Т. 343. № 3. С. 417–419.
Касумян А.О., Сидоров С.С. 2001. Вкусовая чувствительность молоди озерного гольца Salvelinus namaycush (Salmonidae) // Вопр. рыболовства. Приложение 1. С. 121–126.
Касумян А.О., Сидоров С.С. 2010. Вкусовые предпочтения и поведение тестирования вкусовых качеств корма у усатого гольца Barbatula barbatula (Balitoridae, Cypriniformes) // Вопр. ихтиологии. Т. 50. № 5. С. 708–720.
Касумян А.О., Тинькова Т.В. 2013. Вкусовая привлекательность различных гидробионтов для плотвы Rutilus rutilus, горчака Rhodeus sericeus amarus и радужной форели Parasalmo (= Oncorhynchus) mykiss // Там же. Т. 53. № 4. С. 479–489. https://doi.org/10.7868/S0042875213040024
Касумян А.О., Михайлова Е.С., Марусов Е.А. 2014. Роль тактильного чувства и других сенсорных систем в регуляции пищевого поведения у гурами рода Trichopodus // ДАН. Т. 454. № 3. С. 362–365. https://doi.org/10.7868/S086956521403027X
Михайлова Е.С., Касумян А.О. 2015. Вкусовые предпочтения и пищевое поведение девятииглой колюшки Pungitius pungitius трех географически удаленных популяций // Вопр. ихтиологии. Т. 55. № 5. С. 539–562. https://doi.org/10.7868/S0042875215050112
Павлов Д.С. 1959. Опыты по питанию налима Lota lota (L.) при различной освещенности // Науч. докл. высш. шк. Биол. науки. № 4. С. 42–46.
Павлов Д.С. 1962. Некоторые данные обоняния морского налима (Gaidropsarus mediterraneus) и его значение при отыскании пищи // Вопр. ихтиологии. Т. 2. Вып. 2. С. 361–366.
Чеботаева А. 2005. Тюлевая рыбка // Аквариум. № 6. С. 10–11.
Чеботаева А. 2006. Гурами вчера и сегодня // Там же. № 3. С. 14–17.
Atema J. 1971. Structures and functions of the sense of taste in the catfish // Brain Behav. Evol. V. 4. P. 273–294.
Axelrod H.R., Vorderwinkler W. 1995. Encyclopedia of tropical fishes with special emphasis on techniques of breeding. Neptune City: TFH Publ., 762 p.
Bardach J.E., Case J. 1965. Sensory capabilities of the modified fins of squirrel hake (Urophycis chuss) and sea robins (Prionotus carolinus and P. evolans) // Copeia. № 2. P. 194–206.
Bischof C. 1996. Diversity in agonistic behavior of croaking gouramis (Trichopsis vittata, T. schalleri and T. pumpila; Anabantoidei) and the paradise fish (Macropodus opercularis; Anabantoidei) // Aggressive Behav. V. 22. № 6. P. 447–455.
Blank T., Burggren W. 2014. Hypoxia-induced developmental plasticity of the gills and air-breathing organ of Trichopodus trichopterus // J. Fish Biol. V. 84. P. 808–826. https://doi.org/10.1111/jfb.12319
Brawn V.M. 1969. Feeding behaviour of cod (Gadus morhua) // J. Fish. Res. Board Can. V. 26. № 3. P. 583–596.
Bruton M.N. 1979. The food and feeding behaviour of Clarias gariepinus (Pisces: Clariidae) in Lake Sibaya, South Africa, with emphasis on its role as a predator of cichlids // Trans. Zool. Soc. London. V. 35. Pt. 1. P. 47–114.
CABI. 2018. Trichopodus trichopterus (three spot gourami) // Invasive species compendium. Wallingford, U.K.: CAB International. https://www.cabi.org/ISC/datasheet/121020, version 11/2018.
Devitsina G.V. 2005. Comparative morphology of intraoral taste apparatus in fish // J. Ichthyol. V. 45. № 2. P. 286–306.
Døving K.B., Selset R. 1980. Behavior patterns in cod released by electrical stimulation of olfactory tract bundlets // Science. V. 207. P. 559–560.
Finger T.E. 2008. Sorting food from stones: the vagal taste system in goldfish, Carassius auratus // J. Comp. Physiol. V. 194A. P. 135–143. https://doi.org/10.1007/s00359-007-0276-0
Finger T.E., Drake S.K., Kotrschal K. et al. 1991. Postlarval growth of the peripheral gustatory system in the channel catfish, Ictalurus punctatus // J. Comp. Neurol. V. 314. P. 55–66.
Forselius S. 1957. Studies of anabantid fishes // Zool. Bidrag Fran Uppsala. V. 32. P. 93–597.
Froese R., Pauly D. (eds.). 2021. FishBase. World Wide Web electronic publication. www.fishbase.org. Version 06/2021.
Geheber A.D., Mcmahan C.D., Piller K.R. 2010. First record of the non-native three spot gourami, Trichogaster trichopterus (Pallas 1770) (Teleostei: Osphronemidae) in Jamaica // Aquat. Invasions. V. 5. № 1. Suppl. 1. P. S13–S16. https://doi.org/10.3391/ai.2010.5.S1.004.
Gill A.B., Hart P.J.B. 1996. Unequal competition between three-spined stickleback, Gasterosteus aculeatus L., encountering sequential prey // Anim. Behav. V. 51. P. 689–698.
Goli S., Jafari V., Ghorbani R., Kasumyan A. 2015. Taste preferences to classical taste substances and feeding behaviour in the kutum Rutilus frisii kutum (Teleostei: Cyprinidae) // Physiol. Behav. V. 140. № 3. P. 111–117.
Gosselin S., Fortier L., Gagne J.A. 1989. Vulnerability of marine fish larvae to the toxic diniflagellate Protogonyaulax tamarensis // Mar. Ecol. Progr. Ser. V. 57. P. 1–10.
Graham J.B. 1997. Air-breathing fishes. Evolution, diversity and adaptation. San Diego: Acad. Press, 299 p.
Gutiérrez F. de P., Lasso C.A., Baptiste M.P. et al. (eds.). 2012. VI Catálogo de la biodiversidad acuática exótica y trasplantada en Colombia: moluscos, crustáceos, peces, anfibios, reptiles y aves. Bogotá, Colombia: IAvH, 335 p.
Halwart M., Gupta M.V. (eds.). 2004. Culture of fish in rice fields. Rome; Penang: FAO; The WorldFish Center, 83 p.
Harborne J.B. 1993. Introduction to ecological biochemistry. London: Acad. Press, 384 p.
Hart P.J.B. 2003. Habitat use and feeding behaviour in two closely related fish species, the three-spined and nine-spined stickleback: an experimental analysis // J. Anim. Ecol. V. 72. P. 777–783.
Hidaka I. 1982. Taste receptor stimulation and feeding behavior in the puffer // Chemoreception in fishes / Ed. Hara T.J. Amsterdam: Elsevier Sci. Publ. P. 243–257.
Hollis K.L. 1999. The role of learning in the aggressive and reproductive behaviour of blue gouramis, Trichogaster trichopterus // Environ. Biol. Fish. V. 54. P. 355–369.
Hollis K.L., Pharr V.L., Dumas M.J., et al. 1997. Classical conditioning provides paternity advantage for territorial male blue gouramis (Trichogaster trichopterus) // J. Comp. Psychol. V. 111. № 3. P 219–225. https://doi.org/10.1037/0735-7036.111.3.219
Hughes G.M., Munshi J.S.D. 1973. Fine structure of the respiratory organs of the climbing perch, Anabas testudineus (Pisces: Anabantidae) // J. Zool. London. V. 170. P. 201–225.
Hynes H.B.N. 1950. The food of fresh-water sticklebacks (Gasterosteus aculeatus and Pygosteus pungitius), with a review of methods used in studies of the food of fishes // J. Anim. Ecol. V. 19. P. 36–58.
Kapoor B.G., Evans H.E., Pevzner R.A. 1975. The gustatory system in fish // Advances Mar. Biol. V. 13. P. 53–108.
Kasumyan A.O. 2011. Tactile reception and behavior of fish // J. Ichthyol. V. 51. № 11. P. 1035–1103. https://doi.org/10.1134/S003294521111004X
Kasumyan A.O. 2014. Behavior and gustatory reception of air-breathing catfishes (Clariidae) // Ibid. V. 54. № 10. P. 934–943. https://doi.org/10.1134/S0032945214100075
Kasumyan A. 2018. Olfaction and gustation in Acipenseridae, with special references to the Siberian sturgeon, Acipenser baerii // The Siberian sturgeon (Acipenser baerii, Brandt, 1869) / Eds. Williot P. et al. V. 1. Biology. Cham: Springer. P. 173–205. https://doi.org/10.1007/978-3-319-61664-3_10.
Kasumyan A.O., Døving K.B. 2003. Taste preferences in fish // Fish Fish. V. 4. P. 289–347.
Kasumyan A.O., Mouromtsev G.E. 2020. The teleost fish, blue gourami Trichopodus trichopterus, distinguishes the taste of chemically similar substances // Sci. Rept. V. 10. Article 7487. https://doi.org/10.1038/s41598-020-64556-6
Kasumyan A.O., Nikolaeva E.V. 2002. Comparative analysis of taste preferences in fishes with different ecology and feeding // J. Ichthyol. V. 42. Suppl. 2. P. 203–214.
Ketele A.G.L., Verheyen R.F. 1985. Competition for space between the three-spined stickleback, Gasterosteus aculeatus L.f. leiura and the nine-spined stickleback, Pungitius pungitius (L.) // Behaviour. № 93 P. 127–138.
Ladich F. 2007. Females whisper briefly during sex: context- and sex-specific differences in sounds made by croaking gouramis // Animal Behav. V. 73. P. 379–387. https://doi.org/10.1016/j.anbehav.2006.04.014
Ladich F., Brittinger W., Kratochvil H. 1992. Significance of agonistic vocalization in the croaking gourami (Trichopsis vittatus, Teleostei) // Ethology. V. 90. № 4. P. 307–314.
Linke H. 1991. Labyrinth fish: the bubble-nest-builders. Germany: Tetra-Press Melle, 180 p.
Low B.W. 2019. Trichopodus trichopterus. The IUCN Red list of threatened species 2019: e.T187981A89805622. https://doi.org/10.2305/IUCN.UK.2019-2.RLTS.T1879-81A89805622.en.
Low B.W., Lim K.K.P. 2012. Gouramies of the genus Trichopodus in Singapore (Actinopterigii: Perciformes: Osphronemidae) // Nature Singapore. V. 5. P. 83–93.
Mizuno N., Furtado J.L. 1982. Ecological notes on fishes. 47 // Tasek Bera / Eds. Furtado J.I., Mori S. V. Dordrecht: Springer. P. 321–354. https://doi.org/10.1007/978-94-009-7980-2_7.
Muthmainnah D., Gaffar A.K. 2017. Fish and fisheries in flood plain swamp in middle part of Musi River // Indones. J. Environ. Manag. Sustainability. V. 1. P. 1–5. https://doi.org/10.26554/ijems.2017.1.1.1-5
Parker G.H. 1910. Olfactory reactions in fishes // J. Exp. Zool. V. 8. P. 535–542.
Pranata N.D., Purnama A.A., Yolanda R., Karno R. 2016. Iktiofauna Sungai Sangkir Kabupaten Rokan Hulu Provinsi Riau Ichthyofauna of Sangkir river, Rokan Hulu District Riau Province // Depik. V. 5. № 3. P. 100–106. https://doi.org/10.13170/depik.5.3.5574
Rainboth W.J. 1996. Fishes of the Cambodian Mekong. FAO species identification field guide for fishery purposes. Rome: FAO, 265 p.
Ramos A., Gonçalves D. 2019. Artificial selection for male winners in the Siamese fighting fish Betta splendens correlates with high female aggression // Front. Zool. V. 16. Article 34. https://doi.org/10.1186/s12983-019-0333-x
Roberts T.R. 1989. The freshwater fishes of Western Borneo (Kalimantan Barat, Indonesia) // Mem. Calif. Acad. Sci. № 14. P. 1–210.
Rodrigues-Filho C.A.S., Gurgel-Lourenço R.C., Sánchez-Botero J.I. 2017. First report of the alien species Trichopodus trichopterus (Pallas, 1770) in the state of Ceará, Brazil // Braz. J. Biol. V. 78. № 2. P. 394−395. https://doi.org/10.1590/1519-6984.170472
Rüber L., Britz R., Zardoya R. 2006. Molecular phylogenetics and evolutionary diversification of labyrinth fishes (Perciformes: Anabantoidei) // Syst. Biol. V. 55. № 3. P. 374–397. https://doi.org/10.1080/10635150500541664
Scharrer E., Smith S.W., Palay S.L. 1947. Chemical sense and taste in the fishes, Prionotus and Trichogaster // J. Comp. Neurol. V. 86. P. 183–198.
Sibbing F.A. 1991. Food capture and oral processing // Cyprinid fishes: systematics, biology and exploitation / Eds. Winfield I.J., Nelson J.S. Fish Fish. Ser. V. 3. London: Chapman and Hall. P. 377–412. https://doi.org/10.1007/978-94-011-3092-9_13.
Smith H.M. 1945. The fresh-water fishes of Siam, or Thailand. Washington: Gov. Print. Office, 622 p.
Stoner A.W., Sturm E.A. 2004. Temperature and hunger mediate sablefish (Anoplopoma fimbria) feeding motivation: implications and stock assessment // Can. J. Fish. Aquat. Sci. V. 61. P. 238–246. https://doi.org/10.1139/F03-170
Sule H.A., Ismail A., Amal M.N.A. 2016. A review of the ichthyofauna of Malaysian peat swamp forest // J. Trop. Agric. Sci. V. 39. № 4. P 421–458.
Talde C.M., Mammaril Sr. A.C., Palomares M.L.D. 2004. The diet composition of some economically important fishes in the three floodplain lakes in Agusan Marsh wildlife sanctuary in the Philippines // Sri Lanka J. Aquat. Sci. V. 9. P. 45–56.
Tooker C.P., Miller R.J. 1980. The ontogeny of agonistic behaviour in the blue gourami, Trichogaster trichopterus (Pisces, Anabantoidei) // Anim. Behav. V. 28. P. 973–988.
Wang G.-P., Liu W.-J., Si G.-C., Hu G.-W. 2016. The complete mitochondrial genome sequence of Trichopodus leerii (Perciformes: Osphronemidae) and phylogenetic studies of Osphronemidae // Mitochondrial DNA. Pt. A. V. 27. P. 2570–2571. https://doi.org/10.3109/19401736.2015.1038808.
Webb A.C. 2007 Status of non-native freshwater fishes in tropical northern Queensland, including establishment success, rates of spread, range and introduction pathways // J. Proc. Roy. Soc. N.S.W. V. 140. P. 63–78.
Webb A., Maughan M., Knott M. 2007. Pest fish profiles: Trichogaster trichopterus − three spot gourami. Brisbane: ACTFR, James Cook Univ., 5 p.
Yamamori K., Nakamura M., Matsui T., Hara T.J. 1988. Gustatory responses to tetrodoxin and saxitoxin in fish: a possible mechanism for avoiding marine toxins // Can. J. Fish. Aquat. Sci. V. 45. № 12. P. 2182–2186. https://doi.org/10.1139/f88-253
Zahid A. 2008. Ekologi trofik ikan-ikan dominan (Trichogaster leerii, T. trichopterus, dan Rasbora dusonensis) di hutan rawa gambut Desa Dadahup, Kalimantan Tengah. Bogor: Institut Pertanian Bogor. P. 75.
Zahid A., Rahardjo M.F., Sukimin S., Syafei L.S. 2009. Variasi temporal makan ikan sepat layang (Trichogaster leerii, Blkr. 1852) di hutan rawa gambut desa Dadahup, Kalimantan Tengah // J. Biol. Res. V. 15. № 1. P. 53–62. https://doi.org/10.23869/bphjbr.15.1.200910
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


