Вопросы ихтиологии, 2022, T. 62, № 1, стр. 59-68
Распределение и экология желтопёрой Limanda aspera и сахалинской L. sakhalinensis камбал (Pleuronectidae) в тихоокеанских водах Камчатки в летний период 2016–2020 гг.
Р. Т. Овчеренко 1, 2, *, Ю. К. Курбанов 1
1 Камчатский филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – КамчатНИРО
Петропавловск-Камчатский, Россия
2 Камчатский государственный технический университет – КамчатГТУ
Петропавловск-Камчатский, Россия
* E-mail: madimarova.r.m@kamniro.ru
Поступила в редакцию 29.01.2021
После доработки 23.03.2021
Принята к публикации 26.03.2021
- EDN: QUNXNS
- DOI: 10.31857/S0042875222010118
Аннотация
По материалам 2016–2020 гг. выявлено, что желтопёрая Limanda aspera и сахалинская L. sakhalinensis камбалы образуют основные скопления в Авачинском (преимущественно в северной части) и Кроноцком заливах. Причём значительные скопления L. aspera отмечены в верхних участках шельфа, а L. sakhalinensis преимущественно в нижних. Мелкоразмерные особи желтопёрой камбалы (средняя длина 21.3 см) встречаются в верхних районах шельфа на глубинах < 40 м, более крупные (27.0 см) – в диапазоне 81–100 м. Мелкие особи сахалинской камбалы (17.7 см) отмечены в диапазоне 40–80 м, более крупные рыбы (22.5 см) – на глубинах 121–140 м. Динамики запасов обоих видов в период исследований носят разнонаправленный характер с тенденцией к снижению. Значения биомассы исследуемых камбал близки к показателям, полученным в 1981–1985 гг.
Шельф у тихоокеанского побережья Камчатки является одним из районов обитания представителей семейства камбаловых (Pleuronectidae), имеющих важное промысловое значение. По итогам донных траловых съёмок 2016–2020 гг. средняя биомасса всех камбал в этом районе составила 17.6% от общей биомассы донных и придонных рыб. В водах у юго-восточного побережья Камчатки с 2003 по 2017 гг. вылов камбаловых варьировал от 2.7 до 13.2 тыс. т, при этом основным объектом промысла являлась северная двухлинейная камбала Lepidopsetta polyxystra (Овчеренко, 2019). Остальные виды встречаются не в столь значительных количествах, но их вклад в общий вылов весьма существен, в том числе и желтопёрой камбалы Limanda aspera (Орлов, 1998; Золотов, Захаров, 2008; Антонов, 2011). В свою очередь сахалинская камбала L. sakhalinensis из-за небольших размеров (≤36 см) практически не используется промыслом и является видом прилова (Линдберг, Фёдоров, 1993; Фадеев, 2005; Орлов и др., 2011).
Распределению L. aspera и L. sakhalinensis в различных рыбопромысловых районах посвящено немало работ: на шельфе у Западной (Моисеев, 1953; Дьяков, 2002, 2006, 2011; Токранов, 2018) и Северо-Восточной (Фадеев, 1987; Золотов, 2011) Камчатки, а также в юго-восточной (Фадеев, 1965, 1987) и северо-западной (Датский, Андронов, 2007) частях Берингова моря. Однако об особенностях распределения этих видов у юго-восточного побережья Камчатки информация крайне ограничена и фрагментарна, имеются лишь общие сведения (Легеза, 1959; Токранов, Полутов, 1984; Абрамова, 1990; Токранов, 1990; Дьяков и др., 1995; Орлов, 1998, 2010; Дьяков, 2006, 2007; Антонов, 2011; Орлов и др., 2011; Орлов, Токранов, 2014). Проведённое нами исследование позволит понять, как распределяются эти виды в акватории тихоокеанских вод, и восполнить информационный пробел в их биологии.
Цель работы – изучить пространственное распределение желтопёрой и сахалинской камбал на шельфе у Юго-Восточной Камчатки, оценить их численность и биомассу, описать размерный состав, а также рассмотреть видовой состав сопутствующих рыб в уловах.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в июне–сентябре 2016–2020 гг. во время донных траловых съёмок (379 тралений) КамчатНИРО на судах МРТК “Инженер Мартынов” и РС “МРТК-316” на шельфе тихоокеанских вод Камчатки: в акватории Кроноцкого и Авачинского заливов, а также у юго-восточной оконечности п-ова. Траления осуществляли донным тралом ДТ 18.8/28.5 с вертикальным раскрытием 3.5 м и горизонтальным 16 м, за исключением 2018 г., когда использовали трал ДТ 14.3/24.2 с параметрами соответственно 3 и 12 м. Траления продолжительностью 5–30 мин выполняли только в светлое время суток в диапазоне глубин 18–250 м при средней скорости судна 3 узла.
Для построения карт распределения камбал использовали программу “ArcView 3.3”. Характер распределения рыб по акватории тихоокеанского шельфа отображён на карте растровым методом в виде небольших однотипных смежных ячеек, что обеспечивает сопоставимость значений, описывающих стандартные полигоны осреднения для исследования пространственного распределения видов (Атлас…, 2003). Плотность распределения (экз/км2 и кг/км2) рассчитывали по уловам, в зависимости от протраленной площади, учитывая коэффициент уловистости, по формуле: $P~ = \frac{m}{{1.852~~a~v~t~k~0.001}}$, где Р – плотность распределения вида, экз/км2 или кг/км2; m – улов, экз. или кг; v – скорость траления, узлы; t – время траления, ч; a – горизонтальное раскрытие трала, м; k – коэффициент уловистости; 1.852 – коэффициент перевода длины, выраженной в морских милях, в километры; 0.001 – коэффициент перевода метров в километры (Аксютина, 1968; Лапко, 2002; Савин, 2012). Затем проводили осреднение данного показателя по глубинам. По отношению к рассматриваемым видам приняты коэффициенты уловистости: 0.5 для L. aspera и 0.4 для L. sakhalinensis, которые ранее были использованы в работах других исследователей (Борец, 1997; Ильинский, 2007; Савин и др., 2011).
Распределение двух видов камбал по глубинам анализировали по доле их среднего улова за 1 ч траления на определённой глубине в % суммы средних уловов за 1 ч траления на всех глубинах (Токранов, Полутов, 1984). Встречаемость (%) рассчитывали как отношение числа уловов, в которых присутствовал вид, к общему числу уловов. Длину рыб по Смитту (FL) измеряли от кончика рыла до конца средних лучей хвостового плавника с точностью до 1 мм. Всего промерено 2099 экз. L. aspera и 1791 экз. L. sakhalinensis.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Встречаемость, широтное и меридиональное распределение
Желтопёрая камбала широко распространена в северной части Тихого океана. Её ареал простирается вдоль азиатского побережья от япономорских вод у п-ова Корея и с тихоокеанской стороны о-ва Хоккайдо до Британской Колумбии (о-ва Королевы Шарлотты) в северо-восточном секторе Пацифики, включая акваторию Охотского моря (за исключением Шантарских о-вов и средней части Курильской гряды) и Алеутского архипелага. Также отмечается в прилегающих районах Арктики, таких как восточная часть Чукотского моря и море Бофорта у м. Барроу (Моисеев, 1953; Quast, Hall, 1972; Линдберг, Фёдоров, 1993; Фадеев, 2005; Mecklenburg et al., 2007).
На столь значительном ареале желтопёрая камбала распределена неравномерно и в отдельных, порой изолированных друг от друга акваториях образует большие скопления, используемые промыслом, а в остальных случаях отмечается в виде прилова (Фадеев, 1970). К одному из районов с низкой численностью данного вида относятся воды у тихоокеанского побережья Камчатки. Несмотря на то что в период исследований частота встречаемости желтопёрой камбалы варьировала от 42.5 до 53.8%, её доля по массе в уловах уступала другим камбаловым, составляя ~5.9%. Отметим, что, по данным Полутова (1967), в начале 1950-х гг. желтопёрая камбала являлась доминирующим видом в этой акватории.
Мы отметили прерывистый характер распределения желтопёрой камбалы у тихоокеанского побережья Камчатки (рис. 1а). Основные скопления (до 95 кг/км2) были сосредоточены в Авачинском и Кроноцком заливах. Между ними, в акватории, прилегающей к м. Шипунский, плотности скоплений были незначительными и редко достигали 10 кг/км2. Можно заключить, что в исследуемом районе обитает несколько самостоятельных, обособленных друг от друга группировок данного вида с наибольшей плотностью распределения в Кроноцком заливе. В пользу этого предположения может служить тот факт, что из-за слаборазвитой шельфовой зоны у юго-восточного побережья желтопёрая камбала не совершает протяжённых миграций в меридиональном направлении, как это выражено, например, у Западной Камчатки (Полутов, Пашкеев, 1967). В связи с этим основные её скопления в исследуемом районе приурочены к глубоководным каньонам, расположенным в акватории вдающихся в полуостров заливов, в пределах которых камбала проводит зиму. Отметим, что поимки желтопёрой камбалы у юго-восточной оконечности Камчатки, где её плотности были не столь существенны (до 30 кг/км2), имели не случайный характер. Ранее было показано (Орлов, Токранов, 2014), что в этом районе обитает локальная группировка, особи из которой непрерывно встречались в уловах в южном направлении вплоть до Второго Курильского пролива. Наиболее многочисленные скопления отмечены у м. Лопатка, о-вов Шумшу и Парамушир, где средняя плотность распределения, по данным Орлова (2010), составляла 22.5 кг/милю2 (6.56 кг/км2).
Рис. 1.
Распределение желтопёрой Limanda aspera (а) и сахалинской Limanda sakhalinensis (б) камбал у Юго-Восточной Камчатки в летний период 2016–2020 гг.

В отличие от желтопёрой камбалы ареал сахалинской менее обширен и приурочен к северо-западной части Тихого океана: от зал. Петра Великого в Японском море на юге до Берингова пролива на севере. Изредка она встречается в юго-восточной части Чукотского моря у п-ова Аляска. В Охотском море этот вид является одним из доминирующих среди камбал (Борец, 1997; Фадеев, 2005, Дьяков, 2007; Савин и др., 2011).
В акваториях Кроноцкого и Авачинского заливов, а также у юго-восточной оконечности Камчатки в период исследований частота встречаемости L. sakhalinensis нередко превышала таковую L. aspera, варьируя от 46.8 до 61.6%. L. sakhalinensis считается многочисленным видом (Шейко, Фёдоров, 2000), однако её доля в уловах по массе была меньше, чем у L. aspera, и составила в среднем 4.7%, что, по нашему мнению, обусловлено её малыми размерами.
Характер распределения L. sakhalinensis у юго-восточного побережья Камчатки был схож с таковым L. aspera. Летом основные скопления сахалинской камбалы отмечены в Кроноцком заливе и на севере Авачинского залива (рис. 1б). При этом скопления повышенной плотности (до 71.7 кг/км2) отмечены не вблизи берега, как у желтопёрой камбалы (рис. 1а), а на более мористых участках. Отсутствие сахалинской камбалы в южной части Авачинского залива вплоть до м. Поворотный, а также низкие плотностные показатели у юго-восточной оконечности Камчатки (до 15 кг/км2), вероятно, подтверждают правильность мнения Орлова и Токранова (2014) о проникновении сахалинской камбалы, обнаруженной на участке между 51° и 52° с.ш., из Охотского моря через мелководные Первый и Второй Курильский проливы.
Батиметрическое распределение
Желтопёрая камбала является представителем элиторального ихтиоцена, обитает на глубинах до 796 м в соответствии с сезонами года и районом обитания, образуя плотные скопления в основном на шельфе и прилегающих участках материкового склона (Шейко, Фёдоров, 2000; Фадеев, 2005; Дьяков, 2006; Орлов, Токранов, 2014; Парин и др., 2014). По данным съёмок, проведённых в 2016–2020 гг. в летний период, этот вид отмечался в диапазоне 27–202 м, где значительные уловы рыб были приурочены к мелководным зонам до глубины 60 м (68.2%) (табл. 1). Отметим, что, по данным Токранова (1990), L. aspera ранее являлась наиболее часто встречаемым видом в прибрежной зоне Кроноцкого заповедника. Подобный характер распределения обусловлен миграцией камбал в это время на хорошо прогретый шельф к местам нагула и нереста (Моисеев, 1953; Полутов, Пашкеев, 1967). Поимки, зарегистрированные на глубинах > 200 м, носили единичный характер.
Таблица 1.
Средние уловы и средняя плотность распределения желтопёрой Limanda aspera и сахалинской L. sakhalinensis камбал по диапазонам глубин у Юго-Восточной Камчатки в летний период 2016–2020 гг.
| Глубины, м | L. aspera | L. sakhalinensis | ||||||
|---|---|---|---|---|---|---|---|---|
| Улов за 1 ч траления | Плотность | Улов за 1 ч траления | Плотность | |||||
| экз. | % | экз/км2 | кг/км2 | экз. | % | экз/км2 | кг/км2 | |
| <40 | 391.1 | 38.2 | 9182 | 1220 | 167.3 | 8.1 | 4781 | 303 |
| 40–60 | 312.7 | 30.0 | 7107 | 1700 | 281.3 | 13.7 | 8380 | 483 |
| 61–80 | 81.9 | 7.9 | 1668 | 436 | 175.8 | 8.5 | 4987 | 227 |
| 81–100 | 144.2 | 13.9 | 3084 | 873 | 330.2 | 16.1 | 9332 | 680 |
| 101–120 | 52.5 | 5.0 | 1085 | 462 | 395.7 | 19.2 | 11303 | 1026 |
| 121–140 | 50.0 | 4.8 | 1127 | 342 | 456.5 | 22.2 | 12843 | 1480 |
| 141–160 | 79.9 | 3.9 | 2247 | 299 | ||||
| 161–180 | 166.0 | 8.1 | 4668 | 659 | ||||
| 181–200 | 4.0 | 0.2 | 112 | 15 | ||||
| >200 | 2.0 | 0.2 | 45 | 16 | ||||
| Всего | 1034.4 | 100 | 23298 | 5049 | 2056.7 | 100 | 58653 | 5172 |
Наибольшие значения средней плотности распределения отмечены на глубинах < 40 м и достигли 9182 экз/км2 (1220.1 кг/км2) (табл. 1). В диапазоне 40–60 м плотностные показатели желтопёрой камбалы также были высоки и составляли 7107 экз/км2 (1699.6 кг/км2). Подчеркнём, что образование плотных скоплений в верхних районах шельфа в летний период на глубинах <60–70 м свойственно желтопёрой камбале на значительной части ареала (Моисеев, 1953; Борец, 1997; Тарасюк, 1997; Иванкова, 2000; Ким, 2003; Дьяков, Дьякова, 2009; Золотов, 2011).
Известно (Шейко, Фёдоров, 2000; Фадеев, 2005; Парин и др., 2014), что L. sakhalinensis менее глубоководна по сравнению с желтопёрой камбалой и обитает на глубинах 10–360 м. У юго-восточного побережья Камчатки в период исследований, несмотря на постепенное увеличение уловов с глубиной, сахалинская камбала была широко представлена во всех батиметрических диапазонах от 28 до 190 м (табл. 1). Основные скопления отмечены на глубинах 81–140 м (57.5%). Максимальные значения средней плотности распределения зарегистрированы на 101–120 и 121–140 м. Отметим, что в других частях ареала, например, у о-ва Сахалин и у западного побережья Камчатки, данный вид в летний период концентрируется в верхних участках шельфа на глубинах до 100 м (Сафронов, Тарасюк, 1989; Дьяков, Дьякова, 2009; Асеева, 2010).
Сопутствующие виды в уловах
Видовой состав уловов с желтопёрой и сахалинской камбалами в целом был сходен и представлен рыбами разных экологических группировок, которые преимущественно являются постоянными обитателями восточнокамчатского шельфа, такими как, например: треска Gadus macrocephalus, шлемоносцы Gymnocanthus spp., получешуйники Hemilepidotus spp., минтай Gadus chalcogrammus, северная двухлинейная камбала. При этом желтопёрая и сахалинская камбалы одновременно в уловах встречались непостоянно, что обусловлено особенностями их батиметрического распределения в летний период (табл. 1). Это же отразилось и на частоте встречаемости сопутствующих им видов (табл. 2).
Таблица 2.
Видовой состав уловов с желтопёрой Limanda aspera и сахалинской L. sakhalinensis камбалами у Юго-Восточной Камчатки в летний период 2016–2020 гг.
| Семейство, вид | Частота встречаемости, % | |
|---|---|---|
| L. aspera | L. sakhalinensis | |
| Arynchobatidae | ||
| Bathyraja aleutica | 10.2 | 16.4 |
| B. maculata | + | 5.6 |
| B. parmifera | 50.8 | 54.5 |
| B. violacea | 26.7 | 42.3 |
| Osmeridae | ||
| Mallotus villosus | 28.3 | 23.0 |
| Gadidae | ||
| Gadus macrocephalus | 95.2 | 89.7 |
| G. chalcogrammus | 97.9 | 99.5 |
| Hexagrammidae | ||
| Pleurogrammus monopterygius | 36.4 | 32.9 |
| Cottidae | ||
| Artediellus camchaticus | 32.6 | 38.5 |
| Gymnocanthus detrisus | 78.1 | 90.1 |
| G. galeatus | 53.5 | 51.6 |
| G. pistilliger | 16.0 | 12.7 |
| Hemilepidotus gilberti | 38.0 | 40.4 |
| H. jordani | 69.5 | 70.4 |
| Icelus spiniger | + | 15.0 |
| Myoxocephalus jaok | 28.3 | 15.5 |
| M. polyacanthocephalus | 75.4 | 81.7 |
| Triglops forficatus | 11.8 | 21.6 |
| T. pingelii | 24.1 | 23.9 |
| T. scepticus | + | 6.6 |
| Psychrolutidae | ||
| Dasycottus setiger | 5.3 | 9.4 |
| Agonidae | ||
| Aspidophoroides monopterygius | 5.9 | 9.4 |
| Percis japonica | + | 11.3 |
| Podothecus veternus | 70.1 | 60.1 |
| Sarritor frenatus | 10.2 | 11.3 |
| S. leptorhynchus | 27.3 | 30.0 |
| Liparidae | ||
| Careproctus furcellus | 13.4 | 17.4 |
| Liparis ochotensis | 13.4 | 20.7 |
| Bathymasteridae | ||
| Bathymaster signatus | + | 7.0 |
| Zoarcidae | ||
| Lycodes cf. brashnikovi | 11.8 | 28.6 |
| Trichodontidae | ||
| Trichodon trichodon | 9.1 | + |
| Ammodytidae | ||
| Ammodytes hexapterus | 8.0 | + |
| Pleuronectidae | ||
| Atheresthes evermanni | 42.2 | 51.2 |
| A. stomias | 21.4 | 23.5 |
| Hippoglossoides elassodon | 84.5 | 92.5 |
| Hippoglossus stenolepis | 50.3 | 37.6 |
| Lepidopsetta polyxystra | 94.4 | 92.5 |
| Limanda aspera | 100 | 67.6 |
| L. sakhalinensis | 77.0 | 100 |
| Myzopsetta proboscidea | 9.1 | 5.2 |
| Platichthys stellatus | 19.3 | 6.1 |
| Pleuronectes quadrituberculatus | 90.9 | 89.2 |
Желтопёрой камбале по сравнению с сахалинской наиболее часто сопутствовали представители сублиторального ихтиоцена: нитчатый шлемоносец G. pistilliger, звёздчатая Platichthys stellatus и хоботная Myzopsetta proboscidea камбалы. Среди элиторальных видов, имеющих относительно широкий батиметрический диапазон обитания, но чей жизненный цикл в основном проходит в верхних районах шельфа, наибόльшая частота встречаемости отмечена у керчака-яока Myoxocephalus jaok, тихоокеанской песчанки Ammodytes hexapterus и обыкновенного волосозуба Trichodon trichodon.
В уловах с сахалинской камбалой отмечено увеличение частоты встречаемости мезобентальных видов, использующих нижние районы шельфа в качестве мест нагула в летний период. К ним относятся, например, группа скатов рода Bathyraja и азиатский стрелозубый палтус Atheresthes evermanni. К числу элиторальных рыб, которых чаще отмечали с сахалинской камбалой, можно отнести северного колючего ицела Icelus spiniger, японскую лисичку Percis japonica, вильчатохвостого триглопса Triglops forficatus, ликода Lycodes cf. brashnikovi и другие виды (табл. 2). Этим рыбам в тёплый период года свойственно обитание в смежных с сахалинской камбалой экологических нишах – в нижней части шельфа и прилегающих участках материкового склона.
Размерный состав
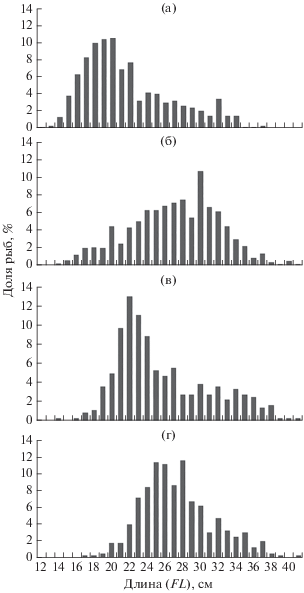
Как известно, желтопёрая камбала среди представителей рода Limanda является наиболее крупным видом, достигая длины 49 см, однако в уловах она мельче прочих представителей камбаловых, обитающих в тихоокеанских водах Камчатки (Фадеев, 2005). По результатам работ, проведённых в 2016–2020 гг. у юго-восточного побережья Камчатки, размерные показатели этого вида составляли 12–41 см. При этом установлена закономерность в изменении этого показателя в зависимости от глубины обитания – с увеличением последней повышалась доля средних и крупных рыб в уловах (рис. 2). Так, на глубине < 40 м основу уловов (53.8%) составляли особи FL 17–22 (в среднем 21.3) см. В диапазоне 40–60 м более 60% камбал в уловах были представлены особями FL 24–32 (26.6) см. В батиметрическом диапазоне 61–80 м незначительно снизился средний размер камбал (25.3 см), а основу уловов составляли особи FL 21–23 см (33.9%). А на глубинах 81–100 м их средняя длина составила 27.0 см, несмотря на доминирование рыб модальной группы 24–28 см. Так как период проведения учётных работ на тихоокеанском шельфе юго-восточной части Камчатки совпадал с нерестовым периодом желтопёрой камбалы, можно заключить, что в это время исследованиями были охвачены почти все размерные группы.
Рис. 2.
Размерный состав желтопёрой камбалы Limanda aspera на различных глубинах у Юго-Восточной Камчатки в летний период 2016–2020 гг.: а – <40 м (М = 21.3 ± 0.12 см; n = 520 экз.); б – 40–60 м (М = = 26.6 ± 0.09 см; n = 814 экз.); в – 61–80 м (М = 25.3 ± ± 0.11 см; n = 360 экз.); г – 81–100 м (М = 27.0 ± 0.08 см; n = 405 экз.).
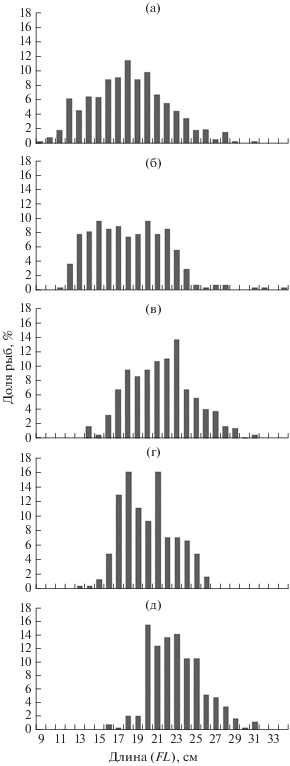
Так же, как и у L. aspera, у L. sakhalinensis юго-восточного побережья Камчатки отмечены изменения размерного состава в зависимости от батиметрического диапазона (рис. 3). На глубинах 40–80 м доминировали мелкие рыбы FL 13–21 (17.7) см. По мере увеличения глубины в уловах стали преобладать средне- и крупноразмерные особи. Так, в батиметрических диапазонах 81–100 м и 121–140 м основу уловов составляли особи соответственно FL 18–23 (21.0) см (62.9%) и 20–25 (22.5) см (77.0%). Подобные изменения в размерных характеристиках, по нашему мнению, объясняются следующим образом. Известно, что по мере роста у сахалинской камбалы происходит изменение типа питания – вторичный переход с бентосного на планктонное (Напазаков, 2015). Вследствие этого вид в массовом количестве часто встречается в пелагиали (Борец, 2000; Фадеев, 2005). Вероятно, по этой же причине значительные уловы сахалинской камбалы в районе исследований были отмечены в широком батиметрическом диапазоне (табл. 1).
Рис. 3.
Размерный состав сахалинской камбалы Limanda sakhalinensis на различных глубинах у Юго-Восточной Камчатки в летний период 2016–2020 гг.: а – 40–60 м (М = 17.7 ± 0.09 см; n = 732 экз.); б – 61–80 м (М = 17.7 ± 0.10 см; n = 271 экз.); в – 81–100 м (М = = 21.0 ± 0.07 см; n = 337 экз.); г – 101–120 м (М = 19.5 ± ± 0.06 см; n =225 экз.); д – 121–140 м (М = 22.5 ± 0.06 см; n = 226 экз.).
Состояние запасов
Информация о динамике численности и биомассы желтопёрой и сахалинской камбал в исследуемой акватории крайне ограничена. Имеется лишь оценка их биомассы по результатам донных траловых съёмок, выполненных в 1999 и 2002 гг. (Коростелев, Василец, 2004), а также информация о вкладе исследуемых видов в учтённую биомассу всех камбал в акватории тихоокеанских вод Камчатки и северных Курильских островов (Антонов, 2011; Золотов, Дубинина, 2013). Так, согласно первой из упомянутых публикаций суммарная биомасса желтопёрой камбалы в акваториях Авачинского, Кроноцкого и Камчатского заливов в 1999 г. составила 1.387, сахалинской – 0.723 тыс. т. В 2002 г. этот показатель был равен соответственно 0.688 и 0.717 тыс. т.
По результатам учётных работ в период исследований наблюдается разнонаправленный характер динамики численности и биомассы двух видов камбал (табл. 3). Так, у L. aspera отмечено увеличение значений этих показателей к 2018 г. с последующим спадом, при этом её доля по биомассе показывает относительный рост. Вместе с тем с 2018 по 2020 гг. зафиксировано резкое снижение запасов сахалинской камбалы, при этом она доминировала по численности над желтопёрой и уступала ей по биомассе.
Таблица 3.
Численность, биомасса Limanda aspera и L. sakhalinensis и их доля по биомассе среди всех видов камбал в тихоокеанских водах Камчатки в летний период 2016–2020 гг.
| Показатель | 2016 | 2017 | 2018 | 2019 | 2020 | В среднем |
|---|---|---|---|---|---|---|
| L. aspera | ||||||
| Численность, млн экз. | 10.17 | 13.64 | 21.41 | 9.64 | 4.48 | 11.87 |
| Биомасса, тыс. т | 1.905 | 2.907 | 5.861 | 2.476 | 1.089 | 2.847 |
| Доля, % биомассы всех видов камбал | 4.5 | 4.2 | 6.5 | 7.6 | 6.8 | 5.9 |
| L. sakhalinensis | ||||||
| Численность, млн экз. | 41.59 | 43.69 | 44.45 | 12.57 | 6.42 | 29.74 |
| Биомасса, тыс. т | 3.200 | 3.371 | 3.422 | 1.118 | 0.640 | 2.350 |
| Доля, % биомассы всех видов камбал | 7.6 | 4.9 | 3.8 | 3.4 | 4.0 | 4.7 |
Подобная тенденция динамики запасов L. aspera и L. sakhalinensis в тихоокеанских водах Камчатки, вероятно, обусловлена не столько промысловым воздействием, что может быть наиболее применимо к желтопёрой камбале в целом, сколько отражением естественных процессов формирования численности и биомассы рыб (Золотов, Дубинина, 2013). Раскрытие механизмов этих процессов является одной из задач будущих исследований. Обратим внимание, что осреднённая доля рассматриваемых видов среди биомассы всех камбал в прошедшее пятилетие наиболее близка к показателям первой половины 1980-х гг. (Золотов, Дубинина, 2013), где они для L. aspera составили 5.85, а для L. sakhalinensis 3.65%.
ЗАКЛЮЧЕНИЕ
В тихоокеанских водах Камчатки основные скопления желтопёрой и сахалинской камбал отмечены в Кроноцком и Авачинском заливах и представлены отдельными обособленными друг от друга группировками. При этом распределение этих видов дифференцировано как в широтном и меридиональном направлениях, так и по глубине. Желтопёрая камбала в летний период концентрируется в прибрежных районах на глубинах <60 м, а сахалинская – на более мористых участках в диапазоне 81–140 м.
Из-за особенностей вертикального распределения отмечены различия в частоте встречаемости сопутствующих с ними в уловах видов рыб, несмотря на их сходный видовой состав. На тихоокеанском шельфе Камчатки желтопёрой и сахалинской камбалам в уловах чаще всего сопутствовали треска, минтай, шлемоносцы, получешуйники и северная двухлинейная камбала.
Как у L. aspera, так и у L. sakhalinensis, в тихоокеанских водах Камчатки отмечены изменения размерного состава с увеличением батиметрического диапазона. Мелкоразмерные особи (средняя FL 21.3 см) желтопёрой камбалы встречаются в верхних районах шельфа на глубинах <40 м, а более крупные (FL 27.0 см) – в диапазоне 81–100 м, что подразумевает, вероятно, отсутствие пищевой конкуренцией внутри вида. Мелкие особи (средняя FL 17.7 см) сахалинской камбалы отмечены в диапазоне 40–80 м, более крупные рыбы (22.5 см) встречены на глубинах 121–140 м. Подобная дифференциация разноразмерных особей по глубине обитания объясняется переходом рыб с бентосного типа питания на планктонное по мере роста, соответственно, данный вид часто встречается в пелагиали. По этой же причине значительные уловы L. sakhalinensis в районе исследований были отмечены в более широком батиметрическом диапазоне по сравнению с желтопёрой камбалой.
Анализ динамики запасов обоих видов в рассматриваемое пятилетие показал её разнонаправленный характер с тенденцией к снижению, а также близость вклада их биомассы в общую биомассу камбал к показателям, полученным в 1981–1985 гг. В то же время L. sakhalinensis по численности доминировала над L. aspera, но уступала ей по биомассе. Несмотря на это, сахалинскую камбалу можно считать наиболее многочисленным видом рода Limanda в акваториях Кроноцкого и Авачинского заливов, а также в водах у юго-восточной оконечности Камчатки.
Список литературы
Абрамова С.В. 1990. Состав и структура донных ихтиоценов Кроноцкого залива // Биология моря. № 4. С. 51–56.
Аксютина З.М. 1968. Элементы математической оценки результатов наблюдений в биологических и рыбохозяйственных исследованиях. М.: Пищ. пром-сть, 289 с.
Асеева Н.П. 2010. Запасы и распределение трёх массовых видов камбал побережья западной Камчатки в 1997 и 2007 гг. // Науч. тр. Дальрыбвтуза. № 22. С. 3–10.
Атлас количественного распределения нектона в Охотском море. 2003 / Под ред. Шунтова В.П., Бочарова Л.Н. М.: Нац. рыб. ресурсы, 1040 с.
Антонов Н.П. 2011. Промысловые рыбы Камчатского края: биология, запасы, промысел. М.: Изд-во ВНИРО, 244 с.
Борец Л.А. 1997. Донные ихтиоцены российского шельфа дальневосточных морей: состав, структура, элементы функционирования и промысловое значение. Владивосток: Изд-во ТИНРО-центр, 217 с.
Борец Л.А. 2000. Аннотированный список рыб дальневосточных морей. Владивосток: Изд-во ТИНРО-Центр, 192 с.
Датский А.В., Андронов П.Ю. 2007. Ихтиоцен верхнего шельфа северо-западной части Берингова моря. Магадан: Изд-во СВНЦ ДВО РАН, 261с.
Дьяков Ю.П. 2002. Западнокамчатские камбалы (распределение, биология и динамика популяций) // Изв. ТИНРО. Т. 130. С. 954–1000.
Дьяков Ю.П. 2006. Батитермическое распределение и миграции камбалообразных рыб (Pleuronectiformes) в дальневосточных морях России // Исследования вод. биол. ресурсов Камчатки и северо-западной части Тихого океана. № 8. С. 54–84.
Дьяков Ю.П. 2007. Распространение и зоогеографическая характеристика камбалообразных рыб (Pleuronectiformes) дальневосточных морей России // Там же. № 9. С. 205–229.
Дьяков Ю.П. 2011. Камбалообразные дальневосточных морей России. Петропавловск-Камчатский: Изд-во КамчатНИРО, 428 с.
Дьяков Ю.П., Дьякова Н.П. 2009. О распределении промысловых видов камбал в водах западной Камчатки // Вестн. КамчатГТУ. № 9. С. 42–54.
Дьяков Ю.П., Полутов В.И., Куприянов С.В. 1995. Особенности распределения массовых видов камбал (Pleuronectidae) камчатского шельфа // Исследования биологии и динамики численности промысловых рыб Камчатского шельфа. Вып. 3. Петропавловск-Камчатский: Изд-во КамчатНИРО. С. 134–138.
Золотов А.О. 2011. Распределение и сезонные миграции камбал Карагинского и Олюторского заливов // Исследования вод. биол. ресурсов Камчатки и северо-западной части Тихого океана. № 21. С.73–100.
Золотов А.О., Дубинина А.Ю. 2013. Состав и многолетняя динамика биомассы донных рыб тихоокеанского шельфа Камчатки и северных Курильских островов // Изв. ТИНРО. Т. 173. С. 46–66.
Золотов А.О., Захаров Д.В. 2008. Камбалы тихоокеанского побережья Камчатки: запасы и промысел // Рыб. хоз-во. № 3. С. 44–47.
Иванкова З.Г. 2000. Биология и состояние запасов камбал залива Петра Великого. 1. Желтопёрая и малоротая камбалы // Изв. ТИНРО. Т. 127. С. 188–202.
Ильинский Е.Н. 2007. Динамика состава и структуры донного ихтиоцена западнокамчатского шельфа // Там же. Т. 150. С. 48–55.
Ким Л.Н. 2003. Некоторые данные по динамике распределения промысловых видов камбал Уссурийского залива // Там же. Т. 132. С. 249–263.
Коростелев С.Г., Василец П.М. 2004. Изменения в составе донных ихтиоценов на шельфе Авачинского, Кроноцкого и Камчатского заливов под влиянием промыслового пресса // Там же. Т. 137. С. 253–261.
Лапко В.В. 2002. Результаты исследований нектона в эпипелагиали северной части Охотского моря // Там же. Т. 130. С. 929–939.
Легеза М.И. 1959. Некоторые данные о распределении камбаловых рыб в районе Северных Курильских островов // Тр. ИО АН СССР. Т. 36. С. 275–281.
Линдберг Г.У., Фёдоров B.B. 1993. Рыбы Японского моря и сопредельных частей Охотского и Жёлтого морей. Часть 6. СПб.: Наука, 272 с.
Моисеев П.А. 1953. Треска и камбалы дальневосточных морей // Изв. ТИНРО. Т. 40. С. 1–288.
Напазаков В.В. 2015. Питание и трофический статус сахалинской камбалы Limanda sakhalinensis (Pleuronectidae) на западнокамчатском шельфе в летний период // Вопр. ихтиологии Т. 54. № 4. С. 439–445. https://doi.org/10.7868/S0042875215010154
Овчеренко Р.Т. 2019. Обзор промысла камбал семейства Pleuronectidae в тихоокеанских водах Камчатки // Исследования вод. биол. ресурсов Камчатки и северо-западной части Тихого океана. № 52. С. 79–88. https://doi.org/10.15853/2072-8212.2019.52.79-88
Орлов А.М. 1998. Демерсальная ихтиофауна тихоокеанских вод северных Курильских островов и юго-восточной Камчатки // Биология моря. Т. 24. № 3. С.146–160.
Орлов А.М. 2010. Количественное распределение демерсального нектона тихоокеанских вод северных Курильских островов и юго-восточной Камчатки. М.: Изд-во ВНИРО, 335 с. https://doi.org/10.13140/RG.2.1.1775.3040
Орлов А.М., Токранов А.М. 2014. Распределение, некоторые черты биологии и динамика уловов желтопёрой, четырехбугорчатой, сахалинской и колючей камбал в тихоокеанских водах Северных Курильских островов и юго-восточной Камчатки // Вестник АГТУ. Сер. Рыб. хоз-во. № 3. С. 29–51.
Орлов А.М., Токранов А.М., Тарасюк С.Н. 2011. Новые данные по биологии четырёх видов камбал в тихоокеанских водах северных Курильских островов и юго-восточной Камчатки // Матер. II Всерос. науч.-практ. конф. “Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование”. Петропавловск-Камчатский: Изд-во КамчатГТУ. С. 211–214.
Парин Н.В., Евсеенко С.А., Васильева Е.Д. 2014. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК, 733 с
Полутов И.А. 1967. Запасы камбаловых и донных рыб в водах Камчатки и развитие активного рыболовства // Изв. ТИНРО. Т. 57. С. 98–121.
Полутов И.А., Пашкеев Е.И. 1967. Миграции камбал в прибрежных водах Камчатки // Вопр. ихтиологии. Т. 7. № 3. С. 529–539.
Савин А.Б. 2012. Донные и придонные рыбы верхней части материкового склона востока Охотского моря // Там же. Т. 52. № 4. С. 432–445.
Савин А.Б., Ильинский Е.Н., Асеева Н.Л. 2011. Многолетняя динамика в составе донных и придонных рыб на западнокамчатском шельфе в 1982–2010 гг. // Изв. ТИНРО. Т. 166. С. 149–165.
Сафронов С.Н., Тарасюк С.Н. 1989. Морфоэкологическая характеристика и таксономический статус сахалинской лиманды Limanda sakhalinensis // Вопр. ихтиологии. Т. 29. № 4. С. 539–549.
Тарасюк С.Н. 1997. Биология и динамика численности основных промысловых видов камбал Сахалина: Автореф. дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 22 с.
Токранов А.М. 1990. К познанию морской ихтиофауны Кроноцкого заповедника // Вопр. географии Камчатки. Вып. 10. С. 173–178.
Токранов А.М. 2018. Потенциальные объекты прибрежного рыболовства прикамчатских вод Охотского моря и проблемы использования их ресурсов // Вестн. КамчатГТУ. Вып. 44. С. 109–113. https://doi.org/10.17217/2079-0333-2018-44-109-113
Токранов A.M., Полутов В.И. 1984. Распределение рыб в Кроноцком заливе и факторы, его определяющие // Зоол. журнал. Т. 63. № 9. С. 1363–1373.
Фадеев Н.С. 1965. Сравнительный очерк биологии камбал юго-восточной части Берингова моря и состояние их запасов // Тр. ВНИРО. Т. 58. Вып. IV. С. 121–138.
Фадеев Н.С. 1970. Закономерности распространения желтопёрой камбалы (Limanda aspera Pal.) в северной части Тихого океана // Изв. ТИНРО. Т. 74. С. 3–21.
Фадеев Н.С. 1987. Северотихоокеанские камбалы (распространение и биология). М.: Агропромиздат, 175 с.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 365 с.
Шейко Б.А., Федоров В.В. 2000. Класс Cephalaspidomorphi – Миноги. Класс Chondrichthyes – Хрящевые рыбы. Класс Holocephali – Цельноголовые. Класс Osteichthyes – Костные рыбы // Каталог позвоночных животных Камчатки и сопредельных морских акваторий. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Mecklenburg C.W., Stein D.L., Sheiko B.A. et al. 2007. Russian-American long-term census of the Arctic: benthic fishes trawled in the Chukchi Sea and Bering Strait, August 2004 // Northwest Nat. № 88. P. 168–187.
Quast J.C., Hall E.L. 1972. List of the fishes of Alaska and adjacent waters with a guide to some of their literature // US Dept. Comm. NOAA Tech. Rep. NMFS SSRF-658. 47 p.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


