Вопросы ихтиологии, 2022, T. 62, № 1, стр. 100-116
Раннее развитие Pardachirus pavoninus (Soleidae) из Южно-Китайского моря (Центральный Вьетнам), идентифицированного с помощью метода ДНК-баркодинга
А. М. Шадрин 1, *, А. В. Семенова 1, 2, Нгуен Тхи Хай Тхань 3
1 Московский государственный университет
Москва, Россия
2 Институт общей генетики РАН – ИОГен РАН
Москва, Россия
3 Приморское отделение Совместного российско-вьетнамского научного
и технологического тропического центра
Нячанг, Вьетнам
* E-mail: shadrin-mail@mail.ru
Поступила в редакцию 15.12.2020
После доработки 11.02.2021
Принята к публикации 11.02.2021
- EDN: MRXSCT
- DOI: 10.31857/S0042875222010155
Аннотация
Представлено иллюстрированное морфологическое описание развития Pardachirus pavoninus от обособления хвостовой почки эмбриона до завершения перехода к бентосному образу жизни. Отслежен процесс становления сегментной формулы, формирования и редукции грудных плавников. Материал для исследования получен из ихтиопланктонных сборов и проинкубирован в лабораторных условиях при температуре ~24°C. Таксономическая идентификация проведена с помощью молекулярно-генетического метода ДНК-баркодинга на основании анализа нуклеотидной последовательности первой субъединицы гена цитохромоксидазы CO1 митохондриальной ДНК.
Павлинья солея Pardachirus pavoninus распространена в водах восточной части Индийского океана и в Западной Пацифике: от Шри-Ланки на восток до Тонга, на север до Южной Японии, на юг до Онслоу (запад Австралии) и Новой Каледонии. Кроме P. pavoninus в состав рода входят ещё шесть видов: P. balius, P. marmoratus и P. morrow (западная часть Индийского океана), P. hedleyi (Австралия), P. poropterus (Индонезия, на восток до Новой Гвинеи, на север до Филиппин; Северная Австралия), P. rautheri (Австралия и Новая Гвинея) (Fricke et al., 2021). В Южно-Китайском море P. pavoninus является единственным представителем рода (Randall, Lim, 2000).
В состав семейства Soleidae входят примерно 175 видов, распределённых по 32 родам (Nelson et al., 2016). По данным Рэндалла и Лима (Randall, Lim, 2000), в Южно-Китайском море отмечены 33 вида, входящие в состав 13 родов. В результате проведённых позже исследований из списка исключены роды Parachirus и Coryphillus, добавлен Dexillus (Froese, Pauly, 2019). К числу родов, не отмеченных ранее в составе ихтиофауны Южно-Китайского моря, добавлен род Typhlachirus с тремя видами, обитающими в этом регионе (Hui, Grinang, 2020). На основании данных, представленных в работе Ворониной с соавторами (Voronina et al., 2016), к списку видов добавлены ещё два вида родов Soleichthys и Zebrias. С учётом современных данных в фауну Южно-Китайского моря входят представители 13 родов: Solea (1 вид), Brachirus (11), Synaptura (1), Aesopia (1), Aseraggodes (6 видов, 1 из них ранее относили к роду Coryphillus и 1 − к роду Parachirus), Heteromycteris (3), Liachirus (1), Pardachirus (1), Pseudaesopia (1), Soleichthys (3), Zebrias (5), Dexillus (1 вид, который ранее относили к роду Brachirus) и Typhlachirus (3 вида).
Исследования раннего онтогенеза рыб – это главный инструмент для решения проблемы их таксономической идентификации на ранних стадиях развития, которая является важнейшим компонентом большинства комплексных исследований морских экосистем. Таксономическая идентификация также необходима при изучении жизненных циклов рыб, их миграций и зоогеографического распределения, при оценке состояния коралловых сообществ, экологическом мониторинге, прогнозировании численности хозяйственно важных видов и т.д. Дефицит данных о раннем развитии рыб особенно остро ощущается в регионах с наибольшим биоразнообразием ихтиофауны. Морфологические описания раннего развития выполнены лишь для небольшой доли из множества существующих на планете видов рыб. Менее чем для 50% видов Индо-Пацифики есть описание хотя бы одной личиночной стадии, лишь для очень немногих видов имеется более или менее полное описание развития. Заметно выше дефицит информации о самых ранних стадиях, так как определение видовой принадлежности икры и ранних личинок является более сложной задачей (Leis, 2015). Для большинства рыб неизвестно строение их яиц, для очень многих нет данных даже о типе нереста. Данные о морфологии ранних стадий развития представителей рода Pardachirus в литературе отсутствуют. Информация о некоторых периодах раннего онтогенеза имеется только для ~ 20 видов, принадлежащих к 13 родам: Aesopia (Ikeda, Mito, 1988), Solea (Thangaraja, Ramamoorthi, 1982; Devauchelle et al., 1987; Marinaro, 1991a; Strydom et al., 2015; Rodriguez et al., 2017), Synaptura (Brownell, I979; Ramanathan, Natarajan, 1979; Thompson et al., 2007), Synapturichthys (Brownell, 1979), Pegusa (Дехник, 1973; Russell, 1976; Marinaro, 1991a), Monochirus (Olivar, Fortuño, 1991), Zebrias (Ikeda, Mito, 1988), Austroglossus (Brownell, 1979; Wood, 2000), Heteromycteris (Fraser, Smith, 1974; Brownell, I979), Barnardichthys (Brownell, I979), Buglossidium (Russell, 1976), Dicologlossa (Herrera et al., 2010), Microchirus (Russell, 1976; Marinaro, 1991b).
Из всех Soleidae Южно-Китайского моря только для трёх видов (Solea ovata, Zebrias zebra и Aesopia cornuta) имеются некоторые данные о морфологии ранних стадий. Также в научной литературе представлена информация, касающаяся раннего развития нескольких видов, не входящих в состав фауны Южно-Китайского моря, но принадлежащих к родам (Aseraggodes, Heteromycteris, Synaptura, Solea), имеющих в ней своих представителей.
Цель работы − описать морфологию раннего развития P. pavoninus, идентифицированного с помощью метода ДНК-баркодинга, и выделить значимые для таксономической идентификации морфологические признаки.
МАТЕРИАЛ И МЕТОДИКА
При подготовке публикации использованы результаты исследований, проведённых в 1993−2020 гг. на базе Приморского отделения Совместного российско-вьетнамского научного и технологического тропического центра. Пробы ихтиопланктона собирали в пределах акватории зал. Нячанг (Центральный Вьетнам), в проливах между островами Че и Мьеу, Че и Там, Че и Мот, а также между островами Мот и Мун. Ловы проводили утром (с 5 до 8 ч) в слое воды 0−5 м над глубинами 10−40 м стандартной планктонной сетью Джеди с диаметром входного отверстия 36 см с процеживающим конусом из мельничного сита № 23 (сторона ячейки 0.333 мм) посредством 30-минутной циркуляции. Объём прошедшей через сеть воды составлял ~ 142 м3. При каждом выходе в море выполняли три лова в разных точках залива. Во все годы работы проводили в зимне-весенний период (февраль−май); в 2004−2012 гг. − дополнительно в сезон дождей (октябрь−декабрь), в 1993 г. – в августе–октябре и в 2004 г. – в июне–июле. Продолжительность сезона работ составляла ~ 2 мес. В течение этого времени исследовали материалы, собранные в результате 15–20 выходов в море.
Пробы в термостатируемых ёмкостях доставляли в лабораторию, где из них извлекали живую икру рыб для последующей инкубации. Икру и личинок в течение первых 12–15 сут после вылупления содержали в пластиковых стаканах (диаметр дна ~ 6 см, высота столба воды ~ 7 см) в объёме воды ~ 170 мл. После этого их переводили в прямоугольные стеклянные аквариумы (дно 12 × 12 см, уровень воды 4–6 см) в объёме воды ~ 720 мл. В течение всего периода воду в используемых ёмкостях полностью заменяли два–три раза в сутки; температура воды в среднем составляла 24 (23.0−25.5)°С, солёность − 32–34‰. Личинок кормили науплиями артемии Artemia salina в марте–апреле 2020 г.
За весь период работ было поймано ~ 40 икринок P. pavoninus. Измерения и морфологические описания выполнены на живом материале: эмбриональное и личиночное развитие до перехода на внешнее питание на основе наблюдений за 16 экз., инкубированных в 1998, 2000, 2014, 2015, 2019 и 2020 гг.; после перехода на внешнее питание − 6 экз., исследованных в 2020 г., 4 экз. из них до перехода к бентосному образу жизни. Представленные в публикации фото выполнены в 2014−2020 гг. Молекулярно-генетический анализ проведён на одной особи из зафиксированных в этот же период.
Измерения яиц выполнены в разные сезоны всего периода проведения работ и представлены как выборочное среднее со стандартной ошибкой. У предличинок и личинок измеряли полную длину (TL), данные измерения 2–5 особей на соответствующей стадии представлены в виде диапазона значений.
Тотальную ДНК выделяли с помощью набора DiatomPrep 100 (“Изоген”, Россия) по протоколу производителя. Для видовой характеристики исследованного образца были получены нуклеотидные последовательности первой субъединицы митохондриального гена цитохромоксидазы С (CO1). Для полимеразной цепной реакции (ПЦР) использовали праймеры, специально разработанные для амплификации СО1 рыб − FishF1 и FishR1 (Ward et al., 2005).
Амплификацию проводили в 10 мкл готовых смесей для ПЦР GenePak PCR Core (“Изоген”, Россия) с добавлением 5 мкл праймеров (конечная концентрация 0.5 мкМ) и 5 мкл ДНК. Режим амплификации: I – 2 мин при температуре 95°С; II – 30 с при 94°С, 45 с при 52 и 60 с при 72°С (35 циклов); III – 10 мин при температуре 72°C. Секвенирование ДНК проводили с помощью набора реактивов ABI PRISM BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе Applied Biosystems 3730 DNA Analyzer в ЦКП “Геном” ИМБ РАН.
Верификацию видовой идентификации проводили путём сравнения полученной нуклеотидной последовательности с гомологичными сиквенсами из базы GenBank (алгоритм BLAST) (NCBI), а также из базы BOLD (2020).
РЕЗУЛЬТАТЫ
Таксономическая идентификация объекта исследования. Для таксономической идентификации объекта исследования были получены нуклеотидные последовательности длиной 651 пара нуклеотидов (п.н.) СО1 мтДНК. Полученный сиквенс депонирован в GenBank (№ MW380722). Сравнение с гомологичными последовательностями из базы GenBank (NCBI) показало сходство > 99% с экземплярами Р. pаvoninus, описанными из Южно-Китайского моря (№ MK777670.1, MK777669.1 и др.) (Thu et al., 2019). Сравнительный анализ с данными, приведёнными на сайте BOLD, со 100%-ной вероятностью подтвердил принадлежность изучаемого вида к роду Pardachirus и с уровнем сходства > 99.8% определил его видовую принадлежность как P. pаvoninus.
Встречаемость в пробах. Икра P. pavoninus встречалась в пробах, собранных в феврале–апреле, в небольшом количестве и не каждый год. Максимальное число пойманных яиц за сезон составляло 8 шт. В осенне-зимнее время в уловах они не встречались. Для ориентировочной оценки частоты встречаемости P. pavoninus в пробах общее число икры рыб, пойманной за сезон работ, составляло ~ 5–10 тыс. осенью и 15–45 тыс. в зимне-весенний период. Максимальные дневные уловы яиц P. pavoninus (на три пробы) составляли 5 шт. (22.03.2020 г.).
Морфологическое описание некоторых стадий раннего развития P. pavoninus. Яйца P. pavoninus сферической формы диаметром 1.50 ± 0.02 (1.40–1.60) мм (n = 16). Оболочка прозрачная, с гладкой, без выраженной структурированности внешней поверхностью. Желток гомогенный, прозрачный, несегментированный на гранулы, почти бесцветный, иногда с едва заметным желтоватым оттенком, содержит большое количество (40–60) мелких, диаметром 0.04–0.08 мм бесцветных жировых капель, подавляющее большинство которых распределено под поверхностью желтка (рис. 1). При этом у всех исследованных яиц под поверхностью вентральной части желтка жировых капель было значительно меньше или они там отсутствовали. Ткани зародышей всегда прозрачны и бесцветны.
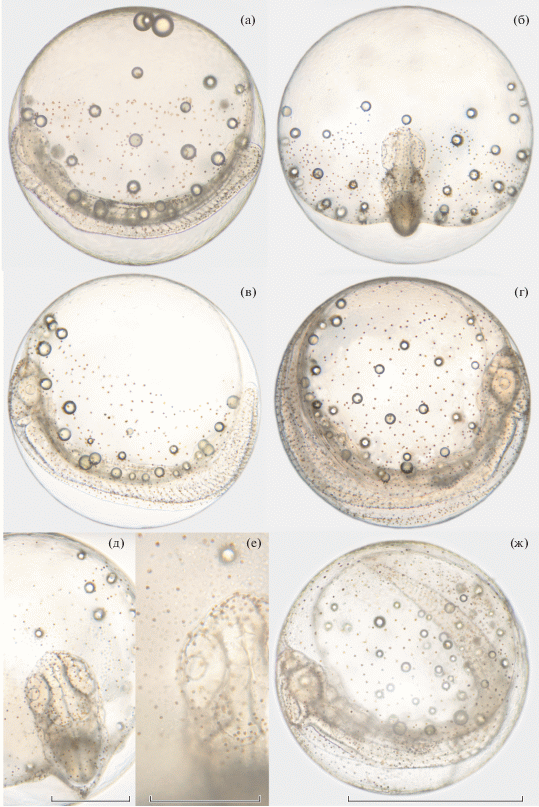
Рис. 1.
Эмбриональное развитие Pardachirus pavoninus (возраст, ч до вылупления): а, б − обособление хвостовой почки, редукция Купферова пузырька, ~27 ч; в − подвижное состояние, 38–41 мускульный сегмент, ~21 ч; г − 42–44 мускульных сегмента, ~10 ч; д, е – головной отдел и прилежащий участок желточного мешка, вид сверху; ж – готовый к вылуплению эмбрион, ~2 ч. Масштаб, мм: а–г, ж – 1.00, д – 0.25 , е – 0.50.
Икра P. pavoninus имеет хорошо выраженную положительную плавучесть. Яйцо с живым эмбрионом, находящееся на глубине 5–7 см при солёности воды 32–34‰ в отсутствие дополнительной турбулентности, занимает положение непосредственно под поверхностной плёнкой воды в течение примерно 8–12 с.
К моменту начала проведения работ в лаборатории зародыши всех исследованных яиц P. pavoninus находились на стадиях развития, близких к началу обособления хвостовой почки и дифференцировке в осевой мезодерме 20–24 пар сомитов.
Возраст ~ 27 ч до вылупления (д. в.) (рис. 1а, 1б). Обособление хвостовой почки уже началось. В боковых закладках осевой мезодермы выделилось 22 пары сомитов. Передние сомиты имеют V-образную (шевронообразную) форму. В обонятельных и слуховых плакодах дифференцировались полости, сформировались глазные бокалы, внутри которых начали образовываться хрусталики. Формируется плавниковая складка. Под задней частью тела зародыша расположен Купферов пузырёк, который с дальнейшим обособлением хвостовой почки начинает быстро уменьшаться в размерах, приобретает неправильную форму и в течение 2–3 ч исчезает. Покровы зародыша пигментированы множеством компактно сгруппированных коричневых меланофоров, распределённых почти равномерно по всей поверхности зародыша. На желточном мешке плотность расположения меланофоров сравнительно ниже, на вентральном полушарии они отсутствуют.
Возраст ~ 21 ч д. в. (рис. 1в). В теле зародыша выделилось 38–41 мускульных сегментов. Эмбрион находится в подвижном состоянии, мускулатура туловища совершает едва заметные движения. По сердечной мышце ~ 1 раз/с проходит очень слабая волна сокращения. Хорошо дифференцирована спинная, хвостовая и постанальная части протоптеригия. Коричневые меланофоры примерно равномерно распределены по поверхности всех отделов тела эмбриона и дорсального полушария желточного мешка. Появились чёрные меланофоры. Они имеют дендровидную форму, окрашены в серый цвет и в большом количестве имеются на вентральной части желточного мешка. Лишь некоторые из них присутствуют в областях, пигментированных коричневыми клетками.
Возраст ~ 10 ч д. в. (рис. 1г). В теле эмбриона выделилось 42–44 мускульных сегмента. Каждые 1.0–1.5 мин в мускулатуре тела проходит волна сокращения, охватывающая туловищный и хвостовой отделы. При этом эмбрион может менять положение хвостового отдела. Частота сердечных сокращений не изменилась, но увеличилась их амплитуда. На желточном мешке, на уровне 4–6-го сегментов вблизи тела эмбриона, расположены зачатки грудных плавников (рис. 1г, 1д). Между покровным слоем и органами головного и туловищного отделов формируется пространство гидросинуса. Железы вылупления располагаются на головном отделе и на желточном мешке вокруг него (рис. 1д, 1е). Усилилась пигментация тела эмбриона, особенно протоптеригия и областей формирования зачатков грудных плавников. Заметно увеличилась площадь распространения коричневых меланофоров на желточном мешке, граница которой сильно сдвинулась в вентральную область. Подавляющее большинство коричневых меланофоров сохраняет компактную форму. Чёрные пигментные клетки относительно малочисленны и распределены практически по всей поверхности тела эмбриона и желточного мешка вместе с коричневыми.
Возраст 2 ч д. в. (рис. 1ж). Интенсивность движений эмбриона возросла слабо. Зачатки грудных плавников заметно увеличились в размере. Очень сильно вырос объём гидросинуса, охватывающего головной и значительную часть туловищного отдела. Все области желточного мешка пигментированы почти равномерно. На протоптеригии и гидросинусе начали формироваться группы меланофоров, определяющие специфический рисунок окраски предличинок. Многие пигментные клетки приобрели дендровидную форму.
Возраст 2 ч после вылупления (п. в.), TL 3.35–3.45 мм (рис. 2а). В теле насчитывается 42–44 мускульных сегмента: 15–16 туловищных и 27–29 хвостовых. Вылупившиеся предличинки имеют хорошо выраженную положительную плавучесть, малоподвижны и бóльшую часть времени находятся в неподвижном состоянии под поверхностной плёнкой, касаясь её вентральной частью поверхности желточного мешка. Зачатки грудных плавников расположены на уровне 4–7-го сегментов. Они увеличились в размерах, на поверхности каждого сформировался интенсивно пигментированный гребень, зачаток свободной лопасти. Анальное отверстие открывается в нижней части протоптеригия, разделяя его на преанальную и постанальную части. Гидросинус охватывает головной отдел со второй половины среднего мозга и бóльшую часть туловищного отдела. Интенсивность пигментации усилилась за счёт приобретения большинством меланофоров дендровидной формы. Множество этих клеток равномерно распределено по всему желточному мешку. Они располагаются на внутренней поверхности покровного слоя и на поверхности мускулатуры тела, отделов головного мозга, зачатков глаз и т.д. Более отчётливо дифференцировались скопления, заложившиеся на поздних эмбриональных стадиях, и появились новые. Формируются небольшие группы меланофоров на верхней части гидросинуса, над задней частью среднего мозга, над задней частью продолговатого мозга. Лучше выделяются группы над границей туловищного и хвостового отделов, почти симметрично на спинной и постанальной частях протоптеригия на уровне 24–39-го сегментов тела (широкое поясковое скопление в середине хвостового отдела). Имеется рассеянная группа пигментных клеток на хвостовой части плавниковой складки и компактная группа около анального отверстия. Мускулатура тела интенсивно пигментирована.
Рис. 2.
Личиночное развитие Pardachirus pavoninus от вылупления до перехода на внешнее питание (возраст, ч после вылупления): а − предличинка TL 3.40 мм, 2 ч; б – TL 3.60 мм, 6 ч; в – TL 3.90 мм, 31 ч (дистальная половина лопасти зачатка грудного плавника загнута вперёд покровным стеклом при фиксации предличинки в процессе фотосъёмки); г − TL 4.10 мм, 54 ч (свободная лопасть зачатка грудного плавника прижата назад покровным стеклом при фиксации предличинки в процессе фотосъёмки); д − переход на внешнее питание, личинка TL 4.25 мм, 81 ч. Масштаб: 1 мм.

Возраст 6 ч п. в., TL 3.45–3.50 мм (рис. 2б). В теле насчитывается 41–43 мускульных сегмента: 14–15 туловищных и 27–29 хвостовых. Основания зачатков грудных плавников, имеющих форму высоких, сильно уплощённых гребней, расположены на уровне 3–6-го сегментов тела на линии границы желточного мешка и боковой поверхности предличинки. Мочевой пузырь сокращается и наполняется с частотой 1 раз в 5–10 мин. Характер пигментации желточного мешка не изменился. Все заложившиеся на гидросинусе и протоптеригии скопления меланофоров стали более отчётливо выраженными. Рассеянная по хвостовой части протоптеригия группа пигментных клеток сконцентрировалась в терминальной области хвостового отдела. Пищеварительный тракт немного прогибается вниз, слегка продавливая под собой желток. Предличинки имеют слабо положительную или нейтральную плавучесть и бóльшую часть времени находятся в неподвижном состоянии под поверхностью воды или в её толще во взвешенном состоянии, периодически, раз в 1–5 мин, проплывают 1–3 см.
Возраст 31 ч п. в., TL 3.8–4.0 (рис. 2в). В теле насчитывается 40–41 мускульных сегментов: 13–14 туловищных и 28–29 хвостовых. Желток резорбирован на 70–80% первоначального объёма. Число и размер жировых капель заметно не изменились. Основания зачатков грудных плавников расположены на боковых поверхностях тела почти вертикально, но с небольшим наклоном вперёд. Интенсивно пигментированные обширные плоскости их свободных лопастей направлены вбок с таким же небольшим наклоном вперёд, как и их основания. Отчётливо видны дифференцирующиеся элементы зачатка нижней челюсти. Сформированы кровеносные сосуды мандибулярной и гиоидной дуг. Краниальная воронковидная часть передней кишки сужается и переходит в среднюю, которая делает плавный изгиб вправо, вниз и из нижней точки на уровне задней половины желтка дугообразным изгибом направляется вверх, переходя в заднюю кишку, и вниз к анальному отверстию. Перистальтика отсутствует. Предличинки сохраняют относительно низкую подвижность, при почти нейтральной плавучести. Каждые 20–30 с они проплывают 1–3 см, после чего остаются во взвешенном состоянии в толще воды, не совершая активных движений. Характер пигментации не изменился, но заметно увеличилась её интенсивность.
Возраст 54 ч п. в., TL 4.05–4.18 мм (рис. 2г). В теле насчитывается 39–42 мускульных сегмента: 10–11 туловищных и 29–31 хвостовых. Желток резорбирован на 80–90%. Зачатки грудных плавников неподвижны. Их основания сохранили прежнее положение; интенсивно пигментированные свободные лопасти, площадь которых достигла максимального размера, направлены в стороны почти перпендикулярно телу. Челюстной аппарат неподвижен. Нижняя челюсть заметно короче верхней. Передняя кишка направляется вниз и вправо, переходя в среднюю. Средняя кишка идёт вверх и почти сразу вниз к анусу, переходя в заднюю. Перистальтики нет. Сформированы все сосуды висцерального аппарата. Началась циркуляции форменных элементов крови. Функционируют гиоидные и мандибулярные дуги, корни аорты, спинная аорта, хвостовая артерия и вена. Подкишечная вена огибает заднюю кишку и проходит под вентральной частью пищеварительного тракта, повсеместно слабо ветвясь. Сосуд проходит под изгибом средней кишки, рудиментом желточного мешка с зачатком печени и через Кювьеровы протоки впадает в венозный синус. Плавучесть предличинок нейтральная или очень слабо отрицательная. Они могут находиться в толще воды неподвижно во взвешенном состоянии в течение 30–40 с и более.
Возраст 81 ч п. в., TL 4.2–4.3 мм (рис. 2д). В теле насчитывается 38–40 мускульных сегментов: 10 туловищных и 28–30 хвостовых. Личинки перешли на внешнее питание. Нижняя челюсть длиннее верхней. Пищевод направляется в каудальном направлении и вниз и впадает в обширный желудок, сформированный в результате расширения передней части правозакрученной петли средней кишки. После желудка пищеварительный тракт переходит в кишечник, направленный сначала вверх, потом горизонтально и вниз в виде прямой кишки. Желток резорбирован почти полностью и лишь небольшое количество окружает сохранившиеся жировые капли, размер которых составлял 0.03–0.9 мм. Челюстной аппарат и свободные лопасти грудных плавников подвижны. Личинки стали заметно активнее, двигаются по сложной траектории, периодически останавливаются, разворачиваются на месте, S-образно изгибают тело и совершают броски, сопровождающиеся хватательными движениями челюстей. Плавучесть слабо отрицательная. Зачаток печени располагается в передней части полости тела сразу за клейтрумом. Спереди его прикрывает остаток желтка с жировыми каплями. Сзади к нему примыкает передняя часть изгиба желудка. Все участки пищеварительного тракта вовлечены в проходящую периодически волну перистальтического сокращения. Характер пигментации практически не изменился. Глаза полностью пигментированы. Их меланиновая пигментация в проходящем свете придает им абсолютно чёрную окраску, а гуаниновая проявляется металлическим блеском в отражённом свете.
Возраст 14 сут п. в. Личинки активно плавают и питаются, используя весь предоставленный объём в равной степени. Иногда примерно на 15–30 с ложатся набок на дно.
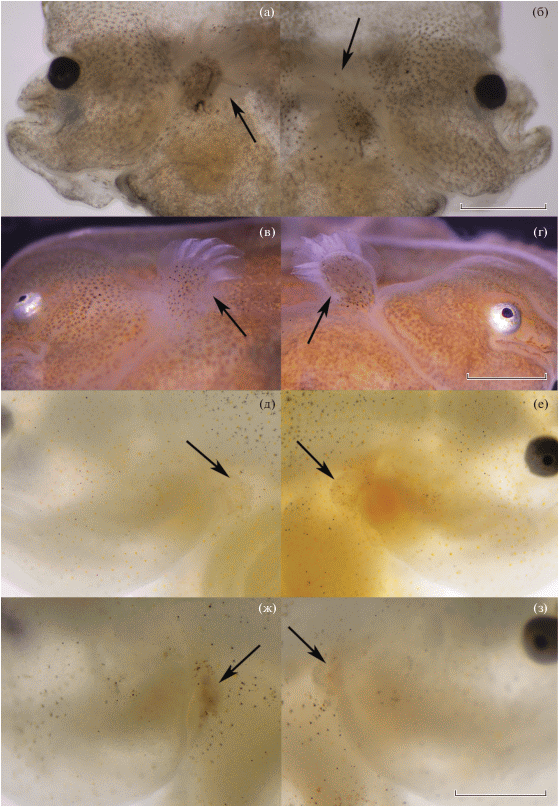
Возраст 19.5 сут п. в., TL 7.2–7.6 мм (рис. 3). В спинном плавнике насчитывается 62–63 луча, в анальном – 52–53. Личинки имеют симметричное строение. Правый и левый грудные плавники развиты одинаково хорошо (рис. 4а, 4б) и активно используются при плавании. Зачатки брюшных плавников, напоминающие полукружные кожные складки, располагаются на вентральной поверхности непосредственно за головным отделом. Пигментация интенсивная, доминируют оттенки коричневого цвета. Реакции на свет не наблюдается. Бóльшую часть времени личинки активно перемещаются по всему объёму и охотятся на науплиев в местах их наиболее плотных скоплений (у поверхности воды или у дна); часто ложатся набок, иногда продолжая питаться, или перемещаются на другое место в этом же положении. Наблюдались случаи, когда личинки переворачивались брюшной стороной вверх и проводили по 10–20 с в таком положении, касаясь дна и стенки ёмкости.
Рис. 3.
Личиночное развитие Pardachirus pavoninus в период перехода к донному образу жизни (возраст, сут после вылупления): а – пелагическая личинка TL 7.50 мм, 19.5 сут; б, в – правая и левая сторона личинки TL 8.65 мм, 26 сут, начало перехода к бентосной фазе; г, д – то же личинки TL 12.50 мм, 33 сут, после полного перехода к бентосному образу жизни; е, ж – то же личинки TL 14.00 мм, 37.5 сут, завершение миграции левого глаза. Масштаб, мм: а – 1, б−ж − 2.
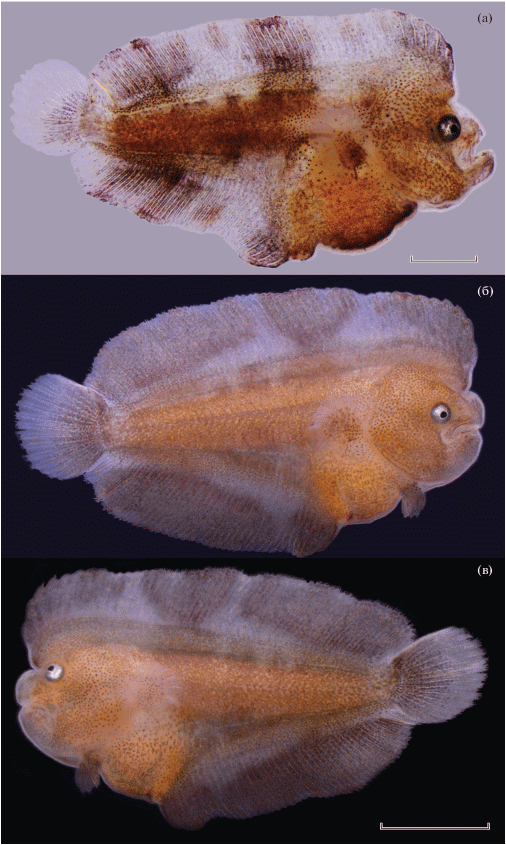
Рис. 3.
Окончание.
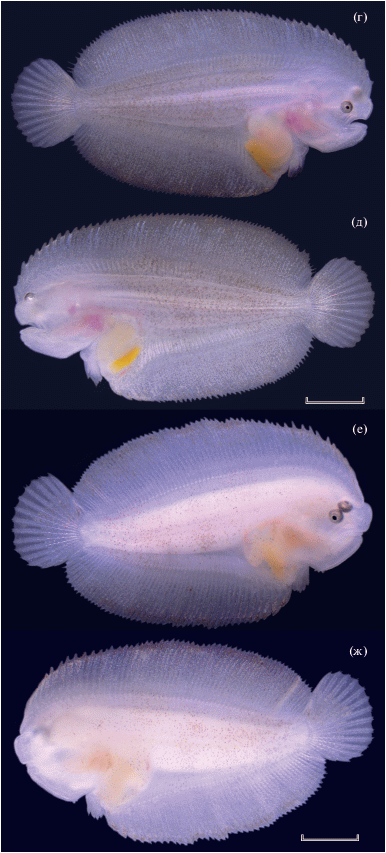
Рис. 4.
Стадии развития правого (а, в, д, ж) и левого (б, г, е, з) грудного плавников (→) у личинок Pardachirus pavoninus разного возраста (сут после вылупления): а, б − TL 7.50 мм, 19.5 сут; в, г − TL 8.65 мм, 26 сут; д, е − TL 12.50 мм, 33 сут; ж, з − TL 14.00 мм, 37.5 сут. Масштаб: 1 мм.
Возраст 22 сут п. в. Характер движения и поведения принципиально не изменились, но личинки стали больше времени проводить лежа на боку.
Возраст 24 сут п. в. Периодически личинки плавают, используя весь предоставленный объём, иногда питаются под самой поверхностью, оставаясь там по несколько минут, но большую часть времени (80–90%) проводят, лежа на левой стороне и охотясь. При этом они приобрели способность удерживаться на месте под воздействием сильной струи воды, как бы прилипая к субстрату.
Возраст 26 сут п. в., TL 8.4–8.8 мм (рис. 3б, 3в). Число лучей в спинном плавнике 66–67, в анальном – 53–54. Обе стороны тела личинки по строению и пигментации не имеют заметных отличий. Правый и левый грудные плавники развиты одинаково хорошо (рис. 4в, 4г), подвижны и используются при плавании. Брюшные плавники хорошо сформированы и содержат лучи. Пигментация интенсивная, доминируют оттенки коричневого цвета. Реакции на свет не наблюдается. В результате начавшейся миграции левый глаз заметно сместился в дорсальном направлении. Бóльшую часть времени личинки проводят в горизонтальном положении правой стороной вверх. Лучи спинного и анального плавников приобрели способность создавать их волнообразное движение.
Возраст 31 сут п. в., TL 11.0–11.5 мм. Личинки почти всё время проводят на дне, но изредка поднимаются к поверхности и охотятся в скоплениях науплиев. Окраска стала заметно светлее.
Возраст 33 сут п. в., TL 12.0–12.5 мм (рис. 3г, 3д). Число лучей в спинном плавнике 65–66, в анальном – 52–53. Левый глаз находится на дорсальной стороне. Оба грудных плавника подверглись значительной редукции примерно в равной степени (рис. 4д, 4е). Реакции на освещённость и цвет субстрата обнаружить не удалось. Личинки примерно с равной вероятностью находятся на светлых, тёмных, хорошо освещённых и затенённых участках. Окраска сильно изменилась. Общий фон стал светло-серым, по нему разбросаны группы коричневых меланофоров. В пигментации правой и левой стороны тела принципиальных различий не наблюдается.
Возраст 37.5 сут п. в., TL 13.5–14.0 мм (рис. 3е, 3ж). Число лучей в спинном плавнике 65–66, в анальном – 51–52. Левый глаз полностью переместился на правую сторону. Грудные плавники редуцированы примерно в равной степени, но, возможно, процесс деградации левого зашёл немного глубже; при этом оба стали немного меньше (рис. 4ж, 4з). Личинка все время проводит на дне, лежа на левой, слепой, стороне, передвигаясь и питаясь.
ОБСУЖДЕНИЕ
Уровень идентичности (>99%) полученных сиквенсов СО1 с таковыми для P. pаvoninus из GenBank и BOLD позволяют сделать вывод о том, что исследуемый образец представляет вид P. pаvo-ninus.
Большинства пелагофилов в районе работ нерестятся перед восходом (в 4–5 ч) и вскоре после захода солнца (в 18–19 ч). Все пойманные P. pavoninus находились на стадиях развития, очень близких к началу обособления хвостовой почки. Следствием наличия утреннего нереста с большой вероятностью было бы присутствие в наших уловах икры P. pavoninus на довольно ранних стадиях развития (возраст не более 7–8 ч) и на заметно более поздних (старше 30 ч), что ни разу не наблюдалось. По-видимому, в районе проведения исследований P. pavoninus нерестится только вечером, тогда продолжительность инкубационного периода у этого вида ориентировочно составляет 46–49 ч. Это вполне сопоставимо с данными, полученными для других Soleidae. В частности, эмбриональный период Dagetichthys marginatus при 19°С составляет 42–49 ч (Thompson et al., 2007), Solea senegalensis при 17–21°С – 36–42 ч (Sarasquete et al., 2019), S. solea при 13°С – ~3.5 сут (Lagardère, Troadec, 1997).
В пределах семейства икра P. pavoninus является сравнительно крупной, её диаметр заметно превышает диаметр яиц большинства изученных видов (табл. 1). Примерно такой же размер яиц у Barnardichthys fulvomarginata, Solea solea, Aesopia cornuta и Zebrias zebra, у некоторых представителей Microchirus – немного меньше. Виды родов Barnardichthys и Microchirus и Solea solea в водах Тихого океана отсутствуют.
Таблица 1.
Характеристика яиц и ранних предличинок некоторых видов семейства Soleidae
| Вид | Диаметр яиц, мм |
Жировые капли | Желток | Поверхность оболочки яйца |
Длина при вылуплении, мм | Число сегментов | Источник информации | |||
|---|---|---|---|---|---|---|---|---|---|---|
| число | размер | расположение в желтке | TL | SL | ||||||
| Aesopia cornuta1 | 1.45–1.60 | Много | Мелкие | Рассеяны | Гом. | Структ. | 4.30 | Ikeda, Mito, 1988 | ||
| Austroglossus microlepis3 | 0.88 | 12–20 | То же | Сгруппированы в заднедорсальной части под зародышем | То же | Неструкт. | 1.80 | 9 + 46 | Brownell, 1979 | |
| Barnardichthys fulvomarginata4 | 1.52 | Много | Очень мелкие | Группами по периферии | » | То же | 3.50 | 9 + 32 | Тот же | |
| Buglossidium luteum3 | 0.64–0.94 | 12–15 | Среднего размера | Рассеянны | Сегм. | » | 1.80–2.30* | Russell, 1976 | ||
| Dicologlossa cuneata3 | ~20 | Очень мелкие | То же | Гом. | » | 2.30– 2.40* | Herrera et al., 2008, 2010 | |||
| 60–80 | Мелкие | » | Сегм. | » | 9 + (35–38) | Lagardère, Aboussouan, 1981 | ||||
| Heteromycteris capensis2 | 1.00 | Нет | Гом. | » | 2.10 | 9 + (31–34) | Brownell, 1979 | |||
| Microchirus ocellatus4 | 0.90–1.10 | 30–40 | То же | По периферии | Сегм. | » | 1.98* | Olivar, Fortuño, 1991 | ||
| 1.30–1.45 | 25–100 | Очень мелкие | Группами и одиночно по периферии | Гом. | » | 2.50–3.20 | Marinaro, 1991b | |||
| M. azevia3 | 1.25–1.30 | Много | Мелкие | По периферии | То же | » | Тот же | |||
| M. variegates3 | 1.20–1.44 | 35–57 | То же | То же | Сегм. | » | 2.10–2.40 | » | ||
| 1.28–1.42 | >50 | » | Рассеяны | То же | » | 2.42* | Russell, 1976 | |||
| 1.16–1.42 | 30−50 | » | По периферии | » | Nichols, 1976 | |||||
| Pegusa lascaris2 | 1.38 | >50 | » | То же | » | » | Marinaro, 1991a | |||
| 1.28–1.38 | >50 | » | » | » | » | 3.46* | Russell, 1976 | |||
| Solea ovate1 | 0.91–0.98 | Много | » | Сгруппированы в заднедорсальной части под зародышем и в вентральной части | Гом. | » | 1.84* | Thangaraja, Ramamoorthi, 1982 | ||
| Solea theophilus2 | 0.95–1.15 | Очень много | Очень мелкие | Группами и одиночно по периферии | » | 2.50–3.00 | Marinaro, 1991a | |||
| S. senegalensis2 | 0.93–1.03 | То же | То же | То же | » | 2.60–2.80 | То же | |||
| 0.99–1.03 | 2.40−2.80* | Sarasquete et al., 2019 | ||||||||
| S. solea2 | 1.00–1.60 | Очень много | » | Группами по периферии и под зародышем | Сегм. | » | 2.50–3.75* | Russell, 1976 | ||
| 1.20–1.57 | То же | » | То же | » | Devauchelle et al., 1987 | |||||
| Synaptura marginata2 | Mного | Мелкие | Сгруппированы в заднедорсальной части под зародышем и отдельные группы по периферии | 2.10–2.20* | >35 | Thompson et al., 2007 | ||||
| То же | То же | То же | Гом. | » | 3.40 | >35 | Brownell, 1979 | |||
| Synaptura kleini2 | 1.34 | » | Очень мелкие | Группами по периферии | То же | Структ. | 3.00 | (9–10) + + (33–35) |
Ikeda, Mito, 1988 | |
| Zebrias zebra1 | 1.42–1.69 | » | То же | Рассеяны | » | То же | 3.00 | Тот же | ||
Примечание. 1 Отмечен в Южно-Китайском море, 2 отмечен в Индо-Пацифике, но не обнаружен в Южно-Китайском море, 3 не отмечен в Индо-Пацифике, 4 отмечен в Индийском океане, но не обнаружен в Тихом; желток: гом. – гомогенный, сегм. – сегментированный по перифирии; поверхность оболочки яйца: структ. − структурированная на шестигранники, неструкт. − неструктурированная; *в источнике не указано, какую длину измеряли.
Яйца P. pavoninus выделяются не только размером, но и числом и особенностями локализации жировых капель, а также ранней и интенсивной пигментацией зародыша и желточного мешка. Это отличает их от многих видов костистых рыб, но является довольно характерным для некоторых представителей семейства Soleidae. В районе проведения исследований лишь немногие виды (представители отрядов Anguilliformes, Clupeiformes, Gasterosteiformes, Trachiniformes и Tetraodontiformes) имеют икру такого же или большего диаметра (Ikeda, Mito, 1988), однако яйца этих рыб достаточно хорошо отличаются от исследованного вида по другим признакам. Присутствующие в Южно-Китайском море Aesopia cornuta и Zebrias zebra при сходных с P. pavoninus размерах имеют яйца со структурированной на шестигранники поверхностью и отличаются числом, размером и расположением жировых капель.
Ранние предличинки P. pavoninus являются одними из самых крупных среди изученных представителей семейства (табл. 1). На более поздних стадиях, вплоть до метаморфоза, эта особенность сохраняется (Ahlstrom et al., 1984).
Для раннего онтогенеза P. pavoninus характерна довольно низкая степень эмбрионизации. Начало подвижного состояния происходит в течение последней трети эмбрионального периода. Движения, которые совершает эмбрион, очень простые и имеют низкую интенсивность. Уровень дифференцировки систем органов, большой запас желтка и очень низкая подвижность характеризуют состояние организма предличинки скорее как эмбриональное, что характерно для большинства пелагофилов с относительно большой плодовитостью.
Число мускульных сегментов у личинок рыб находится в прямой зависимости от числа позвонков у взрослых особей и является важнейшим таксономическим признаком. Формирование мускульных сегментов в эмбриональном и личиночном развитии P. pavoninus имеет характерную динамику. Число выделившихся сегментов увеличивалось в процессе эмбриогенеза и достигло максимального значения 42–44 (15–16 туловищных + 27–29 хвостовых) у предличинок сразу после вылупления. После этого оно стало сокращаться и примерно через 1 сут составило 40–41 (13–14 + 28–29), а через 2 сут – 39–42 (10–11 + 29–31). С переходом на внешнее питание (~3.5 сут п.в.) в теле личинки насчитывалось 38–40 мускульных сегментов, что соответствует числу позвонков у взрослых P. pavoninus − 38–41 (10 туловищных + 28−30 хвостовых) (Voronina et al., 2016; Froese, Pauly, 2019). Уменьшение общего числа сегментов происходит за счёт деградации границ терминальных хвостовых. Сокращение числа миомеров туловищного отдела в процессе онтогенеза, отмеченное у личинок многих видов Teleostei (Leis, Carson-Ewart, 2000), происходит за счёт смещения задней границы полости тела в процессе развития и дифференцировки её органов относительно сегментов тела. С их переходом в функциональное состояние число миомеров туловищного отдела становится близким к дефинитивному, для многих Soleidae характерно 9–10 (Fraser, Smith, 1974; Nichols, 1976; Brownell, 1979; Randall, Bartsch, 2005; Randall, Gon, 2006; Vachon et al., 2008; Voronina et al., 2016). Однако Лейс и Карсон-Эварт (Leis, Carson-Ewart, 2000), в характеристике личинок Soleidae приводят сегментную формулу c гораздо более широким диапазоном для туловищного отдела − 4–20.
У других представителей Pleuronectiformes к моменту перехода на внешнее питание или немного раньше также устанавливается сегментная формула, близкая к позвонковой взрослых особей. В частности, число сегментов в туловищном и хвостовом отделах, а также их общее число у предличинок и личинок азиатского стрелозубого палтуса Atheresthes evermanni, колючей камбалы Надежного Acanthopsetta nadeshnyi, желтопёрой камбалы Limanda aspera (Перцева-Остроумова, 1961), речной камбалы Pleuronectes flesus (Соин, 1970) совпадает с соответствующим показателем по позвонкам у взрослых рыб (Андрияшев, 1954; Линдберг, Федоров, 1993) или отличается от него на одну–две единицы.
При остром недостатке данных о ранних стадиях развития представителей Soleidae определение большинства видов является трудной задачей. В этих обстоятельствах знание сегментной формулы личинок и позвонковой формулы взрослых рыб очень полезно при их таксономической идентификации на ранних стадиях развития. К сожалению, данные по числу позвонков есть не для всех представителей семейства. Известно, что виды родов Solea, Soleichthys, Aesopia, Liachirus, Typhlachirus и Zebrias хорошо отличаются от P. pavoninus по числу позвонков; Pseudaesopia и Dexillus пересекаются с ним на верхней границе диапазона значений, Heteromycteris – на нижней, а в случае Brachirus, Aseraggodes и Synaptura имеется их полное или значительное перекрывание. Исследованные виды Synaptura, Heteromycteris, Typhlachirus и Pseudaesopia не перекрываются с P. pavoninus по числу лучей в спинном или анальном плавниках (табл. 2).
Таблица 2.
Число видов Soleidae, представленных в Южно-Китайском море, и их счётные признаки
| Род | Число видов рода | Счётные признаки | Источник информации | ||||
|---|---|---|---|---|---|---|---|
| общее | в Южно-Китайском море | D | A | V | |||
| всего | исследованных | ||||||
| Solea | 9 | 1 | 1 | 61 | 48 | 32–35 | Vachon et al., 2008; Voronina et al., 2016 |
| Soleichthys | 8 | 3 | 2 | 79–102 | 70–87 | 45–50 | Voronina et al., 2016; Froese, Pauly, 2019 |
| Brachirus | 20 | 11 | 8 | 53–80 | 42–60 | 32–46 | Okiyama, 1988; Gonzales et al., 1994; Lapierre, 2007; Voronina et al., 2016; Kim et al., 2019 |
| Synaptura | 6 | 1 | 1 | 70–83 | 59–65 | 39 | Ramanathan, Natarajan, 1979; Voronina et al., 2016 |
| Aesopia | 1 | 1 | 1 | 70–78 | 57–68 | 46 | Okiyama, 1988 |
| Aseraggodes | 54 | 6 | 4 | 64–75 | 42–55 | 33–53 | Okiyama, 1988; Voronina et al., 2016 Froese, Pauly, 2019 |
| Heteromycteris | 6 | 3 | 2 | 79–101 | 52–65 | 36–38 | Okiyama, 1988; Voronina et al., 2016; Froese, Pauly, 2019 |
| Liachirus | 6 | 1 | 1 | 58–68 | 42–50 | 33–34 | Fraser, Smith, 1974; Okiyama, 1988; Voronina et al., 2016 |
| Pardachirus | 6 | 1 | 1 | 62–73 | 48–58 | 38–41 | Voronina et al., 2016; Froese, Pauly, 2019 |
| Zebrias | 20 | 5 | 4 | 67–95 | 52–79 | 43–52 | Voronina et al., 2016; Froese, Pauly, 2019 |
| Pseudaesopia | 1 | 1 | 1 | 71–78 | 59–67 | 41–43 | Okiyama, 1988 |
| Dexillus | 1 | 1 | 1 | 62–72 | 47–57 | 40–43 | Lapierre, 2007 |
| Typhlachirus | 3 | 3 | 3 | 48–56 | 34–41 | 33–36 | Hui, Grinang, 2020; Евсеенко, Большаков, 2018 |
Характер и интенсивность пигментации разных представителей Soleidae в раннем развитии существенно различаются, при этом могут заметно меняться в течение онтогенеза одного вида (Leis, Carson-Ewart, 2000). В период развития, начиная с поздних эмбриональных стадий и до середины метаморфоза, P. рavoninus можно считать одним из наиболее сильно пигментированных в семействе. Вскоре после начала миграции глаза его окраска претерпевает принципиальное изменение и становится очень светлой. В литературе удалось обнаружить описание и изображение личинки семейства Soleidae после завершения миграции глаза, идентифицированной как Pardachirus sp. (Mwaluma et al., 2014): её пигментация почти полностью сходна с таковой у особей из наших экспериментов.
Взрослые особи P. pavoninus не имеют грудных плавников. Закладка их зачатков происходит примерно за 12–15 ч д.в. Во время пелагической фазы онтогенеза они развиваются, достигают подвижного состояния и активно используются при плавании. Процесс их деградации происходит в период перехода к бентосному образу жизни и практически полностью завершается на 37-е сут п.в. Отчётливые различия в темпе и глубине редукции наружных элементов правого и левого плавников не обнаружены, возможно, на последних исследованных стадиях левый деградировал немного больше.
Особенности поведения личинок P. pavoninus, свидетельствующие о переходе к бентосному образу жизни, проявились раньше начала миграции левого глаза, которая завершилась только через 10 сут после практически полного изменения поведения, связанного с оседанием на дно. Наблюдаемую несогласованность этих процессов частично объясняют результаты детального исследования метаморфоза челюстного аппарата Dagetichthys marginatus (Soleidae) (Ende, Hecht, 2011), в развитии которого трансформация полностью завершалась, когда глаз ещё не начинал мигрировать, он переместился только через более чем 10 сут. По-видимому, эти процессы являются относительно независимыми, и в переходе к бентосному образу жизни определяющую роль играет перестройка висцерального аппарата, а не миграция глаза.
Список литературы
Андрияшев А.П. 1954. Рыбы северных морей СССР. М.; Л.: Изд-во АН СССР, 566 с.
Дехник Т.В. 1973. Ихтиопланктон Черного моря. Киев: Наук. думка, 235 с.
Евсеенко С.А., Большаков Д.В. 2018. О морфологии слепого языка Typhlachirus elongatus (Soleidae) с замечаниями по таксономии рода Typhlachirus // Вопр. ихтиологии. Т. 58. № 5. С. 553–559. https://doi.org/10.1134/S0042875218050089
Линдберг Г.У., Федоров В.В. 1993. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 6. СПб.: Наука, 272 с.
Перцева-Остроумова Т.А. 1961. Размножение и развитие дальневосточных камбал. М.: Изд-во АН СССР, 484 с.
Соин С.Г. 1970. Эмбрионально-личиночное развитие беломорской речной камбалы (Pleuronectes flesus Bogdanovi Sandeberg) // Вопр. ихтиологии. Т. 10. Вып. 4(63). С. 678–693.
Ahlstrom E.H., Amaoka K., Hensley D.A. et al. 1984. Pleuronectiformes: development // Ontogeny and systematics of fishes. V. 1 / Eds. Moser H.G. et al. Lawrence: Allen Press. P. 565–573.
BOLD. 2020. Barcode of Life Data System. (www.barcodinglife.org. Version 10/2020)
Brownell C.L. 1979. Stages in the early development of 40 marine fish species with pelagic eggs from the Cape of Good Hope // Ichthyol. Bull. Smith Inst. Ichthyol. V. 40. P. 1–84.
Devauchelle N., Alexandre J.C., Le Corre N. et al. 1987. Spawning of sole (Solea solea) in capivity (sic) // Aquaculture. V. 66. P. 125–147. https://doi.org/10.1016/0044-8486(87)90227-4
Ende S.S.W., Hecht T. 2011. Ontogeny of the feeding apparatus of hatchery-reared white margined sole, Dagetichthys marginatus (Soleidae): implications for cultivation // J. Appl. Ichthyol. V. 27. P. 112–117. https://doi.org/10.1111/j.1439-0426.2010.01487.x
Fraser T.H., Smith M.M. 1974. An exterilium larval fish from South Africa with comments on its classification // Copeia. V. 4. P. 886–892. https://doi.org/10.2307/1442587
Fricke R., Eschmeyer W. N., van der Laan R. (eds.). 2021. Eschmeyer’s catalog of fishes: Genera, Species, References. (http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp. Version 02/ 2021)
Froese R., Pauly D. (eds.). 2019. FishBase. World Wide Web electronic publication. (www.fishbase.org/Version 12/2019).
Gonzales B.J., Okamura O., Nakamura K. et al. 1994. New record of the Annular Sole, Synaptura annularis (Soleidae, Pleuronectiformes) from Japan // Jpn. J. Ichthyol. V. 40. P. 491–494. https://doi.org/10.11369/jji1950.40.491
Herrera M., Hachero I., Rosano M. et al. 2008. First results on spawning, larval rearing and growth of the wedge sole (Dicologoglossa cuneata) in captivity, a candidate species for aquaculture // Aquacult. Int. V. 16. P. 69–84. https://doi.org/10.1007/s10499-007-9126-x
Herrera M., Hachero-Cruzado I., Naranjo A. et al. 2010. Organogenesis and histological development of the wedge sole Dicologoglossa cuneata M. larva with special reference to the digestive system // Rev. Fish Biol. Fish. V. 20. P. 489–497. https://doi.org/10.1007/s11160-010-9161-y
Hui T.H., Grinang J. 2020. Typhlachirus lipophthalmus, a rare eye-less sole from Borneo (Teleostei: Soleidae) // Ichthyol. Explor. Freshwat. V. 1150. P. 1–8. https://doi.org/10.23788/IEF-1150
Ikeda T., Mito S. 1988. Pelagic fish eggs // An atlas of the early stage fishes in Japan / Ed. Okiyama M. Tokyo: Tokai Univ. Press. P. 999–1083.
Kim M.J., Soo J.K., Byoung S.Y. et al. 2019. First record of the annular sole, Brachirus annularis (Soleidae, Pleuronectiformes) from Korea // Korean J. Ichthyol. V. 31. P. 178−182. https://doi.org/10.35399/ISK.31.3.178
Lagardère F., Aboussouan A. 1981. Développement du céteau, Dicologoglossa cuneata (Moreau, 1881) (Pisces, Pleuronectiformes, Soleidae). II. Description des larves // Cybium. V. 5. P. 53–72.
Lagardère F., Troadec H. 1997. Age estimation in common sole Solea solea larvae: validation of daily increments and evaluation of a pattern recognition technique // Mar. Ecol. Prog. Ser. V. 155. P. 223–237. https://doi.org/10.3354/meps155223
Lapierre K.L. 2007. Taxonomic revision of the genera Achiroides, Brachirus, Dexillus, and Paradicula (Pleuronectiformes: Soleidae): M. Sci. Thesis, Ottawa: Univ. Ottawa, Ottawa-Carleton Inst. Biol., 197 p.
Leis J.M. 2015. Taxonomy and systematics of larval Indo-Pacific fishes: a review of progress since 1981 // Ichthyol. Res. V. 62. № 1. P. 9–28. https://doi.org/10.1007/s10228-014-0426-7
Leis J.M., Carson-Ewart B.M. 2000. The larvae of Indo-Pacific coastal fishes: a guide to identification. Fauna Malesiana Handbooks. V. 2. Leiden: Brill, 850 p.
Marinaro J.Y. 1991a. Eggs and larvae in some species of the genus Solea (Pisces, Soleidae) of the north-eastern Atlantic and the Mediterranean // Boll. Zool. V. 58. P. 163–169. https://doi.org/0.1080/11250009109355748
Marinaro J.Y. 1991b. Eggs of the Microchirus species (Soleidae) from the bay of Algiers // J. Mar. Biol. Assoc. UK. V. 71. P. 117–125. https://doi.org/10.1017/S0025315400037437
Mwaluma J.M., Kaunda-Arara B., Strydom N.A. 2014. A guide to commonly occurring larval stages of fishes in Kenyan coastal waters // WIOMSA Book Ser. № 15. Dar es Salaam: Inst. Mar. Sci., 73 p.
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the World. Hoboken, N.J.: John Wiley and Sons, 752 p.
Nichols J.H. 1976. Soleidae of the Eastern North Atlantic // Fiches d’identification de zooplankton. № 150/151. 10 p.
Okiyama M. 1988. Soleidae // An atlas of early stages of fishes in Japan / Ed. Okiyama M. Tokyo: Tokai Univ. Press. 956–959 p.
Olivar M.P., Fortuño J.M. 1991. Guide to ichthyoplankton of the southeast Atlantic (Benguela Current Region) // Sci. Mar. V. 55. № 1. P. 1–383.
Ramanathan N., Natarajan R. 1979. Flat fish eggs, larvae and their development // Aquaculture. V. 18. P. 349−366. https://doi.org/10.1016/0044-8486(79)90038-3
Randall J.E., Bartsch P. 2005. Two new soleid fishes of the genus Aseraggodes from Micronesia, with a record of A. smithi from Palau // Micronesica. V. 38. № 1. P. 125–139.
Randall J.E., Gon O. 2006. Review of the soles of the genus Aseraggodes of the Western Indian Ocean, with descriptions of three new species // Israel J. Zool. V. 51. P. 165–190. https://doi.org/10.1560/785N-CRCR-EXRG-MPAV
Randall J.E., Lim K.K.P. 2000. A checklist of the fishes of the South China Sea // Raffl. Bull. Zool. Suppl. V. 8. P. 569–667.
Rodriguez J.M., Alemany F., Garcia A. 2017. A guide to the eggs and larvae of 100 common Western Mediterranean Sea bony fish species. Rome: FAO, 242 p.
Russell F.S. 1976. The eggs and planktonic stages of British marine fishes. London: Acad. Press, 524 p.
Sarasquete C., Gisbert E., Ortiz-Delgado J.B. 2019. Embryonic and larval ontogeny of the Senegalese sole, Solea senegalensis: normal patterns and pathological alterations // The biology of sole / Eds. Muñoz-Cueto J.A. et al. Boca Raton: CRC Press, 55 p.
Strydom N.A, Coetzer C.J., Pattrick P. 2015. The complex early life history of a marine estuarine-opportunist fish species, Solea turbynei (Soleidae) from temperate South Africa // Sci. Mar. V. 79. № 2. P. 169–178. https://doi.org/10.3989/scimar.04193.18A
Thangaraja M., Ramamoorthi K. 1982. Laboratory rearing of eggs and larvae of the flatfish Solea ovata Rich // Indian J. Mar. Sci. V. 11. P. 273–275.
Thompson E., Strydom N.A., Hecht T. 2007. Larval development of Dagetichthys marginatus (Family: Soleidae), obtained from hormone-induced spawning under artificial rearing conditions // Sci. Mar. V. 71. P. 421–428. https://doi.org/10.3989/scimar.2007.71n3421
Thu P.T., Huang W.C., Chou T.K. et al. 2019. DNA barcoding of coastal ray-finned fishes in Vietnam // PLoS One. V. 14. № 9. Article e0222631. https://doi.org/10.1371/journal.pone.0222631
Vachon J., Cha Pleau F., Desoutter-Meniger M. 2008. Révision taxinomique du genre Solea et réhabilitation du genre Barnadichthys (Soleidae; Pleuronectiformes) // Cybium. V. 32. № 1. P. 9–26.
Voronina E.P., Prokofiev A.M., Prirodina V.P. 2016. Review of the flatfishes of Vietnam in the collection of Zoological Institute, Saint Petersburg // Proc. Zool. Inst. RAS. V. 320. № 4. P. 381–430.
Ward R.D., Zemlac T.C., Innes B.H. et al. 2005. DNA barcoding Australia’s fish species // Philos. Trans. Roy. Soc. London. V. 360B. P. 1847–1857. https://doi.org/10.1098/rstb.2005.1716
Wood A.D. 2000. The description of Austroglossus pectoralis (Teleostei: Soleidae) larvae from the south-east coast of South Africa // Sci. Mar. V. 64. № 4. P. 387–392. https://doi.org/10.3989/scimar.2000.64n4387
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


