Вопросы ихтиологии, 2022, T. 62, № 2, стр. 188-197
Возраст, рост, созревание и смертность султанки Mullus barbatus (Mullidae) Крыма, Чёрное море
Д. Н. Куцын *
Институт биологии южный морей РАН – ИнБЮМ РАН
Севастополь, Россия
* E-mail: makaira88@gmail.com
Поступила в редакцию 03.03.2021
После доработки 22.03.2021
Принята к публикации 22.03.2021
- EDN: BASJBU
- DOI: 10.31857/S0042875222010088
Аннотация
Изучены половая и размерно-возрастная структура, рост, динамика созревания и смертность султанки Mullus barbatus акватории Крыма. Соотношение полов в уловах смещено в сторону самок (1.00 : 0.72). Максимальная общая длина и предельный возраст самок 21.4 см и 6 лет, самцов − 15.8 см и 4 года. Выявлены выраженные межполовые различия в росте. Рассчитаны значения параметров уравнения Берталанфи: для самок предельная длина составляет 29.8 см, масса − 191 г, коэффициент роста − 0.15 год–1; для самцов – 22.8 см, 108 г и 0.16 год–1. 50% самок созревают при общей длине 10.83 см, 50% самцов – 9.73 см в возрасте 1 год. Коэффициенты общей, естественной и промысловой смертности самок составляют соответственно 1.21, 0.39 и 0.82 год–1; самцов – 1.60, 0.53 и 1.07 год–1. Коэффициент эксплуатации обоих полов составляет 0.65, что соответствует чрезмерной промысловой нагрузке. Наиболее изменчивой характеристикой жизненного цикла султанки является темп роста на первых годах жизни, который в акватории Крыма ниже, чем в Средиземном море.
Султанка Mullus barbatus – морской демерсальный вид рыб семейства султанковые (Mullidae). Распространена в Восточной Атлантике: от Британских о-вов и Скандинавии на севере до Дакара, Сенегала, Канарских о-вов и архипелага Кабо-Верде на юге (Hureau, 1986). В Средиземном и Чёрном морях встречается у всех берегов. Заходит в Азовское море, где распространяется до акватории Таганрогского залива (Световидов, 1964). В пределах Средиземноморского бассейна султанка достигает высокой численности и имеет промысловое значение (Sampson et al., 2014); у берегов Крыма занимает одно из ведущих мест в вылове (до 42% в 2000−2017 гг.) среди демерсальных видов рыб (Кожурин и др., 2018).
Биологические особенности султанки часто оказываются в фокусе внимания исследователей. В значительной степени это обусловлено её важным хозяйственным значением и необходимостью организации промысла. Сведения о росте, возрасте, созревании и смертности известны для султанки Эгейского моря (Papaconstantinou et al., 1981; Akyol et al., 2000; Çelik, Torcu, 2000; Arslan, Işmen, 2014; Kurtul, Özaydın, 2017; Tüzün et al., 2019), Ионического моря (Tursi et al., 1994), Левантийского моря (Özvarol et al., 2006; Atar, Mete, 2009; Çiçek, 2015), побережья Алжира (Talet et al., 2016), северного побережья Сицилии (Sieli et al., 2011), Адриатического моря (Joksimović et al., 2008), Сицилийского пролива (Gancitano et al., 2012). В пределах черноморской части ареала имеются данные о биологии султанки из прибрежных вод Турции (Samsun, 1992; Genç, 2000; Aksu et al., 2011; Aydın, Karadurmuş, 2013; Yıldız, Karakulak, 2016; Kasapoğlu, 2018). Известны работы по биологии, динамике численности и размножению султанки Чёрного моря, датированные второй половиной XX века (Павловская, 1954; Овен, 1961; Выскребенцева, 1966; Данилевский, Выскребенцева, 1966). Из наиболее поздних публикаций следует отметить работу Овен с соавторами (2009), в которой рассматриваются морфологические, физиологические и популяционные особенности султанки у берегов Севастополя. При этом биологические особенности M. barbatus прибрежной акватории Крыма в современных условиях, а также эколого-географические закономерности изменчивости жизненного цикла данного вида остаются малоизученными.
Размеры, возраст, рост, созревание и смертность являются ключевыми характеристиками жизненного цикла рыб. Изучение экологической и географической изменчивости жизненных циклов необходимо для понимания влияния факторов среды на вектор эволюционных изменений, что особенно актуально в условиях климатических изменений и роста антропогенной нагрузки. Без этих знаний невозможна организация рационального промысла и охрана вида.
Цель работы – изучить половую, размерно-возрастную структуру, рост, созревание и смертность M. barbatus акватории Юго-Западного Крыма и проанализировать эколого-географическую изменчивость биологических особенностей вида.
МАТЕРИАЛ И МЕТОДИКА
Материал собирали в июне−сентябре 2020 г. у юго-западного побережья Крыма от б. Ласпи на юге до б. Севастопольская на севере (рис. 1). Рыб отлавливали ставными неводами (ячея 12 мм) на глубинах от 5 до 20 м. Объём исследованного материала, включая неполовозрелых особей, составил 1668 экз., из них 925 с определением возраста.
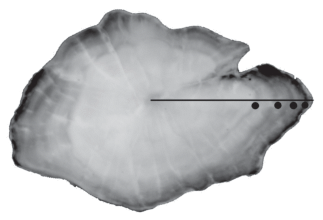
Биологический анализ включал измерение длины – общей (TL), по Смитту (FL) и стандартной (SL)11 с точностью 0.1 см, общей массы тела с точностью 0.1 г, определение пола. Стадию зрелости гонад оценивали по 5-балльной шкале (Правдин, 1966). Экземпляр считали половозрелым, если его гонады находились на IV стадии зрелости и выше. Возраст определяли по отолитам. После очистки и просушки их просматривали в отражённом свете на тёмном фоне при 20-кратном увеличении. Годовым кольцом считали границу между внешним краем транслюцентной зоны (тёмной) и внутренним краем опаковой (светлой). Радиус отолита (OR) определяли как прямую, соединяющую ядро отолита и ростральный край (рис. 2). Обратные расчисления проводили по формуле Фрейзера–Ли (Lee, 1920): Li = [Si(Lc – – c)/Sc] + c, где Si – радиус годового кольца, соответствующий возрасту i; Lc – TL рыбы при поимке; Sc – радиус отолита (OR) при поимке; c – интерсепт линейной регрессии TL−OR.
Рис. 2.
Отолит самки султанки Mullus barbatus TL 18.3 см, возраст 4+: (⚫) − годовые кольца, (—) – радиус отолита.
Для описания роста султанки разные авторы традиционно используют уравнение Берталанфи (Papaconstantinou et al., 1981; Akyol et al., 2000; Çelik, Torcu, 2000; Arslan, Işmen, 2014; Kurtul, Özaydın, 2017; Tüzün et al., 2019). Однако следует учитывать некоторые ограничения соответствующей модели, связанные с аппроксимацией роста неполовозрелых особей. В связи с этим в данной работе при описании роста приведены как эмпирические данные, так и уравнения Берталанфи (для анализа географической изменчивости роста) (Bertalanffy, 1938; Мина, Клевезаль, 1976; Рикер, 1979): L = L∞[1 – e–k(t – to)] и W = W∞[1 – e–k(t – to)]b, где L∞ – предельная (асимптотическая) длина, W∞ – асимптотическая масса; k – константа, характеризующая скорость приближения к L∞ или W∞; t0 – возраст рыбы, когда её длина и масса в рассматриваемой модели равна 0; b – показатель степени в зависимости массы от длины (W = aLb). Рассчитывали индекс роста для линейных размеров и массы (Pauly et al., 1988): φ′ = lg k + 2 lg L∞ и φ = lg k + (2 lg W∞)/3. При построении моделей использованы результаты обратных расчислений.
При изучении созревания использовали логистическую модель: YTL = 100/[1 + exp–a(TL–b)], где YTL – доля половозрелых особей, a – угловой коэффициент, b – точка перегиба, соответствующая длине, при которой созревают 50% особей (TL50) в принятой модели (Shiraishi et al., 2010).
Для определения общей смертности (Z) строили линейную регрессию: ln Nt = a + bt, где t – возраст, Nt – численность особей в возрасте t. В данной модели Z = –b (Cadima, 2003). Естественную смертность (M) определяли по эмпирической формуле (Pauly, 1980): log M = –0.0066 – 0.279 log L∞ + + 0.6543 log k + 0.463 log T, где T – среднегодовая температура поверхности моря. Промысловую смертность (F) рассчитывали как разницу между общей и естественной смертностью: F = Z – M (Рикер, 1979). Коэффициент эксплуатации (E) оценивали как: E = F/Z (Gulland, 1971).
Для анализа связи параметров роста с температурой поверхности моря (ТПМ) применяли коэффициент ранговой корреляции Спирмена при p < 0.05. Данные по ТПМ взяты из электронного источника (World Sea Temperature, 2021). При анализе полового состава применяли критерий χ2. Для сравнения распределений по длине, массе и возрасту между полами использовали непараметрический критерий Колмогорова−Смирнова. Статистический анализ осуществляли с помощью программных пакетов MS Excel и Statistica 12.
РЕЗУЛЬТАТЫ
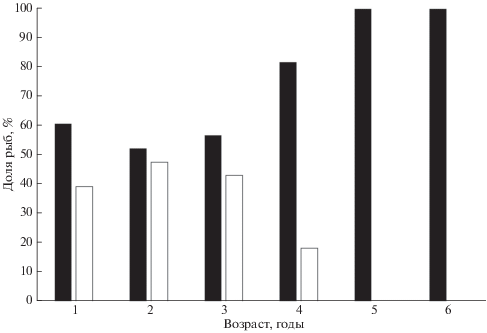
Половая и размерно-возрастная структура. У юго-западного побережья Крыма соотношение полов в уловах M. barbatus смещено в сторону самок и составляет 1.00 : 0.72. Отличие от 1 : 1 статистически значимо (χ2 = 25, df = 1, p < 0.05). Доля самок увеличивается в старших возрастных группах (рис. 3).
Рис. 3.
Соотношение самок (◼) и самцов (⬜) в разных возрастных группах султанки Mullus barbatus Юго-Западного Крыма.
В уловах отмечены самки TL 8.8–21.4 (в среднем 12.7 ± 0.07) см, самцы – 8.4–15.8 (11.3 ± 0.07) см (рис. 4а). Межполовые различия распределений по длине статистически значимы (тест Колмогорова–Смирнова, nf = 504, nm = 314, p = 0.001). Для обоих полов средняя длина составила 12.1 ± 0.06, n = = 818.
Рис. 4.
Распределение по длине (а), массе (б) и возрасту (в) самок и самцов султанки Mullus barbatus в уловах у юго-западного побережья Крыма; обозначения см. на рис. 3.
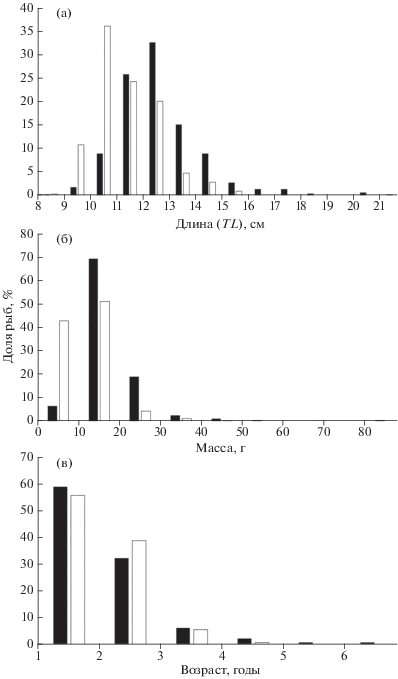
Масса самок варьировала в пределах 6.4−83.4 (17.5 ± 0.4) г, самцов – 5.7–40.8 (12.2 ± 0.3) г (рис. 4б). Межполовые различия распределения по массе статистически значимы (тест Колмогорова–Смирнова, nf = 504, nm = 314, p = 0.001). Для обоих полов средняя масса составляет 15.5 ± 0.28 г, n = 818.
Максимальный возраст самок составил 6 лет, самцов – 4 года (рис. 4в); средний возраст соответственно 1.48 ± 0.03 и 1.38 ± 0.03 года. Межполовые различия распределения по возрасту статистически незначимые (тест Колмогорова–Смирнова, nf = 539, nm = 314, p > 0.10). Для обоих полов средний возраст составил 1.45 ± 0.02 года, n = 853.
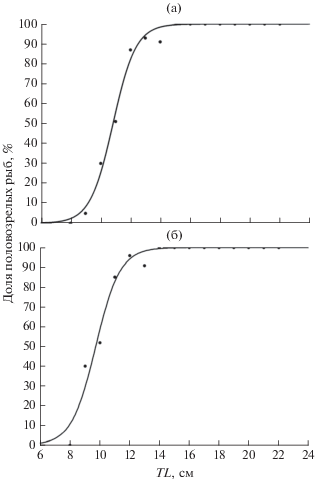
Рост и созревание. По эмпирическим данным, наибольший прирост длины султанки наблюдается до полового созревания, и на первом году жизни составляет в среднем 10.7 см для самок и 10.3 см для самцов (табл. 1). Массовое созревание происходит в возрасте 1+ и описывается логистическими функциями: YTL = 100/[1 + e– 1.31 (TL– 10.83)] для самок; YTL =100/[1 + e– 1.22 (TL– 9.73)] для самцов. Созревание самок и самцов начинается при достижении TL 8 см и завершается соответственно при 14 и 13 см; у самок TL50 = 10.83 ± 0.16 см, у самцов – 9.73 ± 0.24 см (рис. 5). После достижения половой зрелости темп роста заметно снижается. Уже на 2-м году жизни абсолютный годовой прирост общей длины самок составляет в среднем 2.5 см, самцов – 2.2 см; на 4-м году – соответственно 2.2 и 1.3 см. К концу жизненного цикла, на 6-м году, абсолютный прирост самок сокращается до 0.6 см. Наибольшие годовые абсолютные приросты массы у самок наблюдаются на 4-м и 5-м году жизни (15 и 24 г), самцов – на 3-м и 4-м году (10 и 13 г).
Таблица 1.
Длина и масса (М ± SE) самок и самцов султанки Mullus barbatus разного возраста в уловах у юго-западного побережья Крыма
| Возраст, годы | Самки | Самцы | ||||
|---|---|---|---|---|---|---|
| Длина (TL), см | Масса, г | n, экз. | Длина (TL), см | Масса, г | n, экз. | |
| 1 | 10.7 ± 0.07 | 14.3 ± 0.21 | 447 | 10.3 ± 0.05 | 10.1 ± 0.17 | 220 |
| 2 | 13.2 ± 0.08 | 18.7 ± 0.38 | 183 | 12.5 ± 0.17 | 14.7 ± 0.35 | 142 |
| 3 | 15.5 ± 0.22 | 28.0 ± 1.33 | 37 | 14.1 ± 0.17 | 24.2 ± 1.61 | 22 |
| 4 | 17.7 ± 0.36 | 43.3 ± 2.88 | 11 | 15.4 ± 0.25 | 37.6 ± 3.19 | 2 |
| 5 | 20.1 ± 0.27 | 67.7 ± 4.61 | 3 | |||
| 6 | 20.7 ± 0.40 | 72.5 ± 7.82 | 3 | |||
Рис. 5.
Доля половозрелых самок (а) и самцов (б) султанки Mullus barbatus в зависимости от длины (TL) у юго-западного побережья Крыма.
Зависимости массы (W, г) от длины (TL, см) у самок, самцов и у обоих полов описываются уравнениями соответственно: W = 0.0126TL2.84 (R2 = = 0.87), W = 0.0051TL3.19 (R2 = 0.90), W = = 0.0088TL2.95 (R2 = 0.88). Из уравнений следует, что весовой рост самок характеризуется отрицательной аллометрией (b = 2.84 ± 0.05), а самцов – положительной (b = 3.19 ± 0.06). Межполовые различия могут объясняться сроками отбора проб. Бóльшая часть материала собрана в июне−июле, когда наблюдается пик нерестовой активности. Интенсивное развитие гонад и многопорционное икрометание у самок в этот период приводят к уменьшению соотношения общей массы тела к длине.
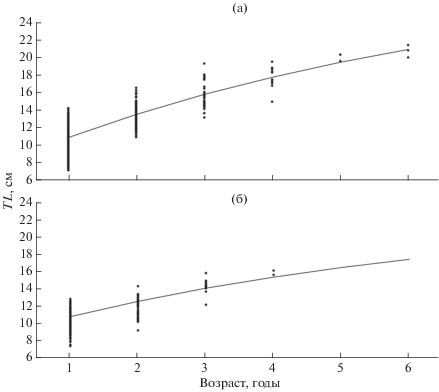
Моделирование роста. Линейный и весовой рост султанки Юго-Западного Крыма описывается следующими уравнениями Берталанфи: самки − TL = 29.8[1 – e–0.15(t+ 2.05)] и W = 191[1 – – e–0.15(t+ 2.05)]2.84, самцы − TL = 22.8[1 – e–0.16 (t+ 2.99)] и W = 108[1 – e–0.16(t+ 2.99)]3.19. Согласно моделям рост M. barbatus в районе исследований характеризуется выраженными межполовыми различиями (рис. 6). Темп роста самок заметно выше: асимптотическая длина самок составляет 29.8 см против 22.8 см у самцов, а асимптотическая масса – 191 г против 108 г. При этом значения коэффициента k у обоих полов сопоставимы. Индекс линейного роста самок φ′ = 2.12, самцов – φ′ = 1.92, весового роста соответственно φ = 0.70 и 0.56.
Рис. 6.
Кривые линейного роста (TL) султанки Mullus barbatus у юго-западного побережья Крыма, аппроксимированные уравнениями Берталанфи: а – самки, б – самцы: (⚫) – эмпирические данные, (—) – кривая роста.
Смертность. Коэффициент общей смертности самок и самцов M. barbatus Юго-Западного Крыма составляет 1.21 и 1.60 год–1. Коэффициент естественной смертности связан со скоростью метаболизма, темпом роста, предельными размерами и температурой окружающей среды (Pauly, 1980). Поскольку у M. barbatus имеются выраженные межполовые различия в темпе роста и предельных размерах, значения коэффициентов смертности самок и самцов различаются. Так, у самцов коэффициент естественной смертности выше (0.53 против 0.39 год–1 у самок), а промысловой смертности ниже (0.82 против 1.07 год–1). Коэффициент эксплуатации как самцов, так и самок составляет 0.65, что соответствует чрезмерной промысловой нагрузке (E > 0.50).
ОБСУЖДЕНИЕ
Для половой и размерно-возрастной структуры популяции, роста, созревания и смертности характерна как видовая, так и популяционная специфичность. Эти биологические показатели приспособительно меняются в соответствии с условиями среды (Никольский, 1974). Поэтому анализ их экологической и географической изменчивости позволяет установить направление адаптивных изменений как в пространстве, так и во времени.
Половая структура и половой диморфизм во многом определяют эволюционную пластичность вида и часто связаны с условиями обитания (Никольский, 1974). Для M. barbatus из акватории Крыма, как и из других участков ареала, характерно преобладание самок в половозрелой части популяции (Tursi et al., 1994; Özvarol et al., 2006; Talet et al., 2016; Yıldız, Karakulak 2016; Kasapoğlu, 2018; Tüzün et al., 2019). Такое несимметричное распределение полов сопряжено с выраженными межполовыми различиями жизненного цикла: темп роста, длина наступления половой зрелости, предельные размеры и продолжительность жизни у самцов заметно ниже, чем у самок (табл. 2). Как следствие, показатель естественной смертности у самцов выше, что приводит к преобладанию самок, особенно в старших возрастных группах. Преимущество данной стратегии проявляется в стабильных условиях обитания и заключается в большей популяционной плодовитости, чем при равном соотношении полов. Недостаток стратегии заключается в меньшем числе вариантов рекомбинаций генов у потомства, что снижает генетическое разнообразие, эволюционную пластичность и менее эффективно в лабильных условиях.
Таблица 2.
Параметры уравнений Берталанфи и индексы роста султанки Mullus barbatus из разных частей ареала
| Регион | Пол | Параметры уравнения Берталанфи | Индексы роста | Источник информации | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| L∞, см | k, год–1 | W∞, г | a | b | t0, год | φ′ | φ | |||
| Чёрное море: | ||||||||||
| – Юго-Западный Крым | Самки | 29.8 | 0.15 | 191 | 0.0126 | 2.84 | –2.05 | 2.12 | 0.70 | Наши данные |
| Самцы | 22.8 | 0.16 | 108 | 0.0050 | 3.19 | –2.99 | 1.92 | 0.56 | ||
| – центральная часть | Оба пола | 29.5 | 0.10 | –3.22 | 1.95 | Samsun, 1992 | ||||
| То же | 20.2 | 0.33 | 0.0107 | 2.97 | 2.13 | Aksu et al., 2011 | ||||
| – восточная часть | » | 23.8 | 0.23 | 152 | 0.0074 | 3.11 | –1.62 | 2.11 | 0.82 | Genç, 2000 |
| Самки | 25.6 | 0.24 | 189 | 0.0064 | 3.18 | –1.32 | 2.19 | 0.90 | ||
| Самцы | 22.2 | 0.21 | 115 | 0.0074 | 3.11 | –2.03 | 2.01 | 0.70 | ||
| Оба пола | 27.4 | 0.14 | 0.0088 | 3.03 | –2.35 | 2.02 | Aydın Karadurmuş, 2013 | |||
| Самки | 25.4 | 0.14 | 171 | –2.70 | 1.96 | 0.63 | ||||
| Самцы | 19.3 | 0.35 | 73 | –0.75 | 2.11 | 0.79 | ||||
| – западная часть | Оба пола | 24.1 | 0.17 | 0.0109 | 2.99 | –1.98 | 1.99 | Yıldız, Karakulak, 2016 | ||
| Самки | 24.8 | 0.16 | 0.0103 | 3.01 | –2.32 | 1.98 | ||||
| Самцы | 23.1 | 0.18 | 0.0137 | 2.90 | –1.91 | 1.98 | ||||
| Эгейское море | Самки | 25.5* | 0.21 | 2.14 | Vassilopoulou, Papaconstantinou, 1992 | |||||
| Самцы | 22.7* | 0.25 | 2.11 | |||||||
| Оба пола | 27.0* | 0.18 | 0.0063 | 3.36 | –1.51 | 2.13 | Akyol et al., 2000 | |||
| Самки | 27.0* | 0.17 | 0.0059 | 3.29 | –1.84 | 2.10 | ||||
| Самцы | 22.5* | 0.20 | 0.0077 | 3.28 | –2.30 | 2.01 | ||||
| Оба пола | 28.8 | 0.16 | 0.0084 | 3.08 | –1.92 | 2.10 | Arslan, Işmen, 2014 | |||
| Самки | 26.6 | 0.18 | 0.0610 | 3.19 | –1.75 | 2.11 | ||||
| Самцы | 28.3 | 0.14 | 0.0800 | 3.09 | –2.39 | 2.06 | ||||
| Оба пола | 18.4* | 0.62 | 0.0100 | 3.20 | –0.91 | 2.32 | Kurtul, Özaydın, 2017 | |||
| То же | 26.1* | 0.13 | 0.0157 | 2.98 | –3.54 | 1.94 | Çelik, Torcu, 2000 | |||
| » | 19.1 | 0.38 | 0.0060 | 3.22 | –1.56 | 2.15 | Tüzün et al., 2019 | |||
| Самки | 27.2 | 0.17 | 0.0060 | 3.22 | –2.49 | 2.10 | ||||
| Самцы | 15.9 | 0.74 | 0.0070 | 3.15 | –0.83 | 2.27 | ||||
| Ионическое море | Оба пола | 25.2 | 0.26 | –1.71 | 2.22 | Tursi et al., 1994 | ||||
| Самки | 24.5 | 0.27 | –1.98 | 2.21 | ||||||
| Самцы | 22.4 | 0.28 | –1.85 | 2.15 | ||||||
| Левантийское море | Самки | 30.3 | 0.10 | 0.1329 | 3.08 | –4.47 | 1.98 | Özvarol et al., 2006 | ||
| Самцы | 24.2 | 0.11 | 0.0979 | 3.32 | –5.52 | 1.79 | ||||
| Оба пола | 27.9 | 0.12 | 0.0212 | 2.80 | –3.47 | 1.95 | Atar, Mete, 2009 | |||
| То же | 22.0 | 0.19 | 0.0072 | 3.16 | –1.17 | 1.97 | Çiçek, 2015 | |||
| Адриатическое море | » | 30.1 | 0.12 | 0.0077 | 3.10 | –3.18 | 2.03 | Joksimović et al., 2008 | ||
| Самки | 27.5 | 0.15 | 0.0073 | 3.12 | –2.69 | 2.05 | ||||
| Самцы | 17.8 | 0.28 | 0.0077 | 3.09 | –3.01 | 1.95 | ||||
| Тирренское море, побережье Сицилии | Самки | 22.1 | 0.38 | –0.94 | 2.27 | Sieli et al., 2011 | ||||
| Средиземное море: | ||||||||||
| – побережье Алжира | Оба пола | 25.1 | 0.49 | 0.0172 | 2.84 | –0.19 | 2.49 | Talet et al., 2016 | ||
| Самки | 25.1 | 0.60 | 0.0176 | 2.82 | –0.15 | 2.58 | ||||
| Самцы | 20.9 | 0.66 | 0.0079 | 3.11 | –0.14 | 2.46 | ||||
| – Сицилийский пролив | Самки | 23.6 | 0.45 | 0.0134 | 2.94 | –0.80 | 2.40 | Gancitano et al., 2012 | ||
| Самцы | 20.2 | 0.57 | 0.0176 | 2.82 | –0.80 | 2.37 | ||||
Развитие, рост и размеры пойкилотермных животных, в особенности водных, связаны с температурой окружающей среды. В переделах ареала вида при снижении температуры в направлении к высоким широтам скорость развития и темп роста снижаются, а максимальные размеры увеличиваются (Pauly, 1998). Это правило справедливо также для описания связи размеров и роста с температурой в условиях потепления климата. Закономерность находит различные объяснения из области физиологии, биохимии и эволюционной теории. Часто уменьшение размеров на фоне повышения температуры связывают с растущими потребностями в кислороде, разной чувствительностью катаболизма и анаболизма к температуре, отрицательной аллометрией роста органов дыхания, а также влиянием отбора (Verberk et al., 2021). Согласно этому правилу M. barbatus акватории Чёрного моря должна характеризоваться наибольшими предельными размерами (L∞) и наименьшим темпом роста (низким значением k). Действительно, при сравнении султанки акватории Крыма и южной части Средиземного моря (Sieli et al., 2011; Gancitano et al., 2012; Talet et al., 2016) эта закономерность подтверждается. Значения L∞ и k для самок в первом случае составляет 29.8 см и 0.15 год–1, в то время как у побережья Алжира значения этих показателей 25.1 см и 0.60 год–1 (табл. 2). Аналогичная ситуация наблюдается и в случае с самцами. При этом корреляционный анализ L∞, k и φ′ у M. barbatus из разных участков ареала с ТПМ не позволяет констатировать существование заметной связи между этими параметрами (табл. 3). Это может быть связано с комплексным влиянием других факторов, сильно варьирующих в пределах бассейна Средиземного моря (промысловая нагрузка, продуктивность акватории, солёность, антропогенное загрязнение и пр.).
Таблица 3.
Значения коэффициента корреляции Спирмена при анализе связи параметров роста султанки Mullus barbatus со среднегодовой температурой поверхности моря
| Пол | Предельная длина (L∞) | Параметр k | Индекс линейного роста (φ′) |
|---|---|---|---|
| Самки | –0.035 | +0.238 | +0.223 |
| Самцы | –0.217 | +0.347 | +0.378 |
Географическая изменчивость параметра k существенно выше, чем L∞. Максимальные размеры M. barbatus, как смоделированные, так и эмпирические, слабо отличаются между разными частями ареала. При этом индекс линейного роста (φ′) для султанки Чёрного моря варьирует в пределах 1.92–2.19, а в Средиземном море достигает 2.58 (Talet et al., 2016). Более низкое значение коэффициента k у султанки из северных районов свидетельствует о сравнительно низком темпе роста. Так, M. barbatus акватории Крыма в возрасте 3 года достигает в среднем TL 15.8 см, а в Южном Средиземноморье − 21.3 см (Talet et al., 2016). Характерно, что при такой разнице в росте на первых годах жизни к концу жизненного цикла султанка как северных, так и южных популяций достигает TL 24–25 см и максимального возраста 6–7 лет (Samsun, 1992; Talet et al., 2016; Tüzün et al., 2019). Длина тела при наступлении полового созревания также слабо варьирует в пределах ареала и составляет 9.0–12.5 см (Froese, Pauly, 2021), что соответствует второму году жизни.
Помимо непосредственного влияния температуры на метаболизм и рост следует указать и на роль отбора в формировании характера жизненного цикла M. barbatus. У южных границ ареала биологическое разнообразие и давление хищников выше, чем в пределах Чёрного моря. В связи с этим высокий темп роста султанки южных популяций позволяет эффективнее выходить из-под пресса хищников. В то же время быстрый рост способствует увеличению плодовитости, что адаптивно в условиях высокой смертности и закрепляется отбором.
Также следует отметить, что черноморские популяции обитают в условиях сезонности климата. Это обстоятельство ограничивает доступность пищевых ресурсов в зимний период, когда рыбы переходят на эндогенное питание (Шульман, Урденко, 1989), что отрицательным образом сказывается на их темпе роста, связанным с параметром k.
Таким образом, наиболее изменчивой характеристикой жизненного цикла M. barbatus является темп роста на первых годах жизни, который в изучаемой акватории Крыма имеет низкие значения. Такие показатели, как максимальные размеры, максимальный возраст, длина и сроки наступления половой зрелости, варьируют слабо. В связи с этим потепление климата в долгосрочной перспективе может привести к увеличению темпа роста M. barbatus Чёрного моря, не оказав при этом существенного влияния на предельные размеры и возраст. В целях сохранения численности и организации рационального промыслового использования султанки можно рекомендовать сокращение объёмов вылова, поскольку в настоящее время коэффициент эксплуатации превышает 0.50.
Список литературы
Выскребенцева Л.И. 1966. О значении биологических показателей в оценке состояния запаса черноморской барабули в 1963 г. // К вопросу динамики численности основных промысловых рыб Азовского и Чёрного морей. Вып. 24. С. 81–86.
Данилевский Н.Н., Выскребенцева Л.И. 1966. Динамика численности барабули // Там же. Вып. 24. С. 71–80.
Кожурин Е.А., Шляхов В.А., Губанов Е.П. 2018. Динамика уловов промысловых рыб Крыма в Чёрном море // Тр. ВНИРО. Т. 171. С. 157–169.
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291 с.
Никольский Г.В. 1974. Теория динамики стада рыб. М.: Пищ. пром-сть, 448 с.
Овен Л.С. 1961. О специфике порционного икрометания и о плодовитости черноморской султанки Mullus barbatus ponticus Essipov // Вопр. ихтиологии. Т. 1 (17). С. 33–38.
Овен Л.С., Салехова Л.П., Кузьминова Н.С. 2009. Современное состояние популяции черноморской султанки Mullus barbatus ponticus, обитающей в прибрежной зоне у Севастополя // Там же. Т. 49. № 2. С. 214−224.
Павловская Р.М. 1954. Размножение шпрота, ставриды и барабули в Чёрном море // Рыбохоз. исслед. Черномор. науч.-промысл. экспедиции ВНИРО. Т. 28. С. 126–135.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 391 с.
Рикер У.Е. 1979. Методы оценки и интерпретации биологических показателей популяций рыб. М.: Пищ. пром-сть, 408 с.
Световидов А.Н. 1964. Рыбы Чёрного моря. М.: Наука, 550 с.
Шульман Г.Е., Урденко С.Ю. 1989. Продуктивность рыб Черного моря. Киев: Наук. думка, 188 с.
Aksu H., Erdem Y., Özdemir S., Erdem E. 2011. Estimation of some population parameters of red mullet (Mullus barbatus ponticus, Essipov, 1927) caught in the Black Sea // J. Fish. Sci. V. 5. P. 345–353. https://doi.org/10.3153/jfscom.2011039
Akyol O., Tosunoğlu Z., Tokaç A. 2000. Investigations of the growth and reproduction of red mullet (Mullus barbatus Linnaeus, 1758) population in the Bay of Izmir (Aegean Sea) // Anadolu Üniv. Bilim Teknol. Derg. A. V. 1. P. 121–127.
Arslan M., Işmen A. 2014. Age, growth, reproduction and feeding of Mullus barbatus in Saros Bay (North Aegean Sea) // J. Black Sea / Mediterr. Environ. V. 20. № 3. P. 184–199.
Atar H.H., Mete T. 2009. Investigating of some biological features of red mullet (Mullus sp. Linnaeus, 1758) distributing in Mersin Bay // Biol. Sci. Res. J. V. 2. № 2. P. 29–34.
Aydın M., Karadurmuş U. 2013. An investigation on age, growth and biological characteristics of red mullet (Mullus barbatus ponticus Essipov, 1927) in the Eastern Black Sea // Iran. J. Fish. Sci. V. 12. № 2. P. 277–288.
Bertalanffy L. Von. 1938. A quantitative theory of organic growth (Inquiries on growth laws II) // Human Biol. V. 10. P. 181−213.
Cadima E.L. 2003. Fish stock assessment manual // FAO Fish. Tech. Paper № 393. 161 p.
Çelik Ö., Torcu H. 2000. Investigations on the biology of red mullet (Mullus barbatus Linnaeus, 1758) in Edremit Bay, Aegean Sea, Turkey // Turk. J. Vet. Anim. Sci. V. 24. P. 287–295.
Çiçek E. 2015. Age, growth and mortality parameters of Mullus barbatus Linnaeus, 1758 (Perciformes: Mullidae) in Iskenderun Bay, northeastern Mediterranean // Iran. J. Ichthyol. V. 2. № 4. P. 262–269.
Froese R., Pauly D. (eds.). 2021. FishBase. World Wide Web electronic publication. (www.fishbase.org, version 02/2021).
Gancitano V., Badalucco C., Cusumano S. et al. 2012. Age cohort analysis of red mullet, Mullus barbatus (L. 1758) (Pisces: Mullidae), in the strait of Sicily (GSA 15 and 16) // Biol. Mar. Mediterr. V. 19. № 1. P. 208–209.
Genç Y. 2000. Population parameters and bio-ecological features of the red mullet (Mullus barbatus ponticus, Ess. 1927) stocks from the Eastern Black Sea coast of Turkey: Ph.D. Thesis. Trabzon: Black Sea Tech. Univ., 182 p.
Gulland J.A. 1971. The fish resources of the ocean. West Byfleet, U.K.: Fishing News (Books) Ltd, 255 p.
Hureau J.C. 1986. Mullidae // Fishes of the north-eastern Atlantic and the Mediterranean. V. 2. Paris: UNESCO. P. 877−882.
Joksimović A., Regner S., Kasalica O. et al. 2008. Growth of the red mullet, Mullus barbatus (Linnaeus, 1758) on the Montenegrin Shelf (South Adriatic) // Electron. J. Ichthyol. V. 1. P. 1–7.
Kasapoğlu N. 2018. Age, growth, and mortality of exploited stocks: anchovy, sprat, Mediterranean horse mackerel, whiting, and red mullet in the southeastern Black Sea // Aquat. Sci. Engineering. V. 33. № 2. P. 39–49. https://doi.org/10.18864/ase201807
Kurtul I., Özaydın O. 2017. Age, growth and length-weight relationship of red mullet (Mullus barbatus Linnaeus, 1758) in Gülbahçe Bay (Aegean Sea) // Turk. J. Aquat. Sci. V. 32. № 3. P. 135–145. https://doi.org/10.18864/TJAS2017
Lee R.M. 1920. A review of the methods of age and growth determinations in fishes by means of scales // Fish. Invest. London. Ser. II. V. 4. P. 1−35.
Özvarol Z.A.B., Balcı B.A., Özbaş M. et al. 2006. An investigation on the growth properties of red mullet (Mullus barbatus L. 1758) in Antalya Bay // Ege J. Fish. Aquat. Sci. V. 23. № 1/1. P. 113–118.
Papaconstantinou C., Tsimenidis N. Daoulas C. 1981. Age, growth and reproduction of red mullet (Mullus barbatus L. 1758) in the Gulf of Saronikos and Thermaikos // Thalassographica. V. 1. № 4. P. 39–66.
Pauly D. 1980. On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fishstocks // J. Cons. Int. Explor. Mer. V. 39. P. 175−192.
Pauly D. 1998. Tropical fishes: patterns and propensities // J. Fish Biol. V. 53. P. 1–17. https://doi.org/10.1006/jfbi.1998.0810
Pauly D., Moreau J., Prein M. 1988. A comparison of overall growth performance of tilapia in open waters and aquaculture // ICLARM Conf. Proc. V. 15. P. 469–479.
Sampson D., Damalas D., Osio G. (eds.). 2014. Scientific, Technical and Economic Committee for Fisheries (STECF) – Black Sea Assessments (STECF-14-14). Luxembourg: Publ. Office E. U., 421 p. https://doi.org/10.2788/19168
Samsun O. 1992. Research on some characteristics of the red mullet (Mullus barbatus ponticus Ess. 1927) caught by the trawlers in the mid Black Sea region from the point of view of fishery biology: Ph.D. Thesis. Atakum: Inst. Sci. Technol., Ondokuz Mayıs Univ., 88 p.
Shiraishi T., Tanaka H., Ohshimo S. et al. 2010. Age, growth and reproduction of two species of scad, Decapterus macrosoma and D. macarellus in the waters off southern Kyushu // Jpn. Agricult. Res. Quarterly. V. 44. № 2. P. 197−206. https://doi.org/10.6090/jarq.44.197
Sieli G., Badalucco C., Di Stefano G. et al. 2011. Biology of red mullet, Mullus barbatus (L. 1758), in the Gulf of Castellammare (NW Sicily, Mediterranean Sea) subject to a trawling ban // J. Appl. Ichthyol. V. 27. P. 1218–1225. https://doi.org/10.1111/j.1439-0426.2011.01784.x
Talet L.B., Talet A.B., Boutiba Z. 2016. Population dynamic parameters of the red mullet Mullus barbatus (Mullidae) in the Arzew Gulf, Algeria // Int. J. Aquat. Biol. V. 4. № 1. P. 1–10. https://doi.org/2016.01.001
Tursi A., Matarrese A., D’Onghia G., Sion L. 1994. Population biology of red mullet (Mullus barbatus L.) from the Ionian Sea // Mar. Life (Marseille). V. 4. № 2. P. 33−43.
Tüzün S., Dalyan C., Eryilmaz L. 2019. Age and growth of the red mullet Mullus barbatus in the North Aegean Sea // J. Ichthyol. V. 59. № 4. P. 572−582. https://doi.org/10.1134/S0032945219040179
Vassilopoulou V., Papaconstantinou C. 1992. Aspects on the biology and dynamics of red mullet (Mullus barbatus) in the Aegean Sea // FAO Fish. Rept. № 477. Rome: FAO. P. 115–126.
Verberk W.C., Atkinson D., Hoefnagel K.N. et al. 2021. Shrinking body sizes in response to warming: explanations for the temperature–size rule with special emphasis on the role of oxygen // Biol. Rev. V. 96. № 1. P. 247–268. https://doi.org/10.1111/brv.12653
World Sea Temperature. 2021. https://www.seatempera-ture.org/mediterranean-sea (ver. 02/2021).
Yıldız T., Karakulak F.S. 2016. An investigation of age, growth and mortality of the red mullet (Mullus barbatus Linnaeus, 1758) in the western Black Sea // Cah. Biol. Mar. V. 57. № 4. P. 415–425.
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии