Вопросы ихтиологии, 2022, T. 62, № 3, стр. 356-363
Уровень тиреоидных и половых стероидных гормонов у горбуши Oncorhynchus gorbuscha в морской и пресноводный периоды нерестовой миграции
Е. Д. Павлов 1, *, Е. В. Ганжа 1, Д. С. Павлов 1
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 22.05.2021
После доработки 22.06.2021
Принята к публикации 23.06.2021
- EDN: IDJAYN
- DOI: 10.31857/S004287522203016X
Аннотация
Изучены тиреоидные и половые стероидные гормоны у производителей горбуши Oncorhynchus gorbuscha на этапе смены морского отрезка пути нерестовой миграции на пресноводный. Самцы меньшего размера заходят в р. Кереть раньше, чем крупные особи; у самок такие различия не выявлены. По сравнению с особями, находящимися в море, самки в реке характеризуются высоким уровнем трийодтиронина и повышенной скоростью дейодирования, а самцы – высоким уровнем тестостерона. Самки как в море, так и в реке отличаются от самцов высоким уровнем эстрадиола-17β и низким значением соотношения концентраций тестостерона к эстрадиолу-17β.
Горбуша Oncorhynchus gorbuscha – моноцикличный вид, ареал которого был существенно расширен за счёт случайного вселения в Великие озёра (Collins, 1975; Kennedy et al., 2005) и целенаправленной интродукции в реки бассейна Белого моря (Кудерский, 2001; Павлов, 2014; Алексеев и др., 2019). Предполагалось, что горбуша, освоив резервную кормовую базу Белого моря, не будет совершать дальних миграций (Смирнов, 1994). Интродукцию горбуши на Кольском п-ове проводили в несколько этапов, начиная с 1956 г. Первое время горбуша в основном возвращалась в р. Умба (Кандалакшский залив, Мурманская область), но в течение десятилетия распространилась по многим рекам Белого моря, что связывают с высокой степенью стреинга (Алтухов и др., 1997). В текущем столетии численность подходов горбуши нечётной линии в реки Кольского п-ова увеличилась: средний вылов в 2001−2017 гг. составил 143.8 т (Алексеев и др., 2019). Возрос темп расселения горбуши, которая мигрирует не только в российские реки бассейна Баренцева моря, но и в реки ряда государств Северной Европы − Норвегии, Исландии и Великобритании (Hesthagen, Sandlund, 2007; Pettit, 2017; Sandlund et al., 2019), что указывает на высокую степень адаптации вида к условиям бассейна Северного Ледовитого океана. Горбуша Белого моря представляет уникальный материал для исследования механизмов адаптации, поскольку большинство попыток переселения анадромных лососей других видов семейства Salmonidae были в основном безуспешными (Гордеева и др., 2005). При этом есть основания полагать, что лимитирующим фактором расселения вида является именно температура воды (Гордеева, 2010).
Эндокринная регуляция является основным связующим звеном между влиянием абиотических факторов, внутренними ритмами и сезонными физиологическими реакциями (Gwinner, 1981). Тиреоидные гормоны играют важную роль в покатной миграции лососёвых, принимают непосредственное участие в адаптации молоди к новым условиям среды при миграции в море (Баранникова, 1975; Iwata, 1995; Ojima, Iwata, 2010; Arjona et al., 2011; Campinho, 2019). Установлено, что у рыб концентрации тиреоидных и половых стероидных гормонов коррелируют между собой (Comeau, Campana, 2006).
В доступной литературе мы не обнаружили информацию о концентрации тиреоидных и половых стероидных гормонов у горбуши при совершении миграции из морской воды в пресную. Есть данные о динамике концентраций тиреоидных (Biddiscombe, Idler, 1983; Youngson, Webb, 1993; Leonard et al., 2001) и половых стероидных гормонов (Ueda et al., 1983; Ueda, Yamauchi, 1995; Leonard et al., 2001) у других лососёвых в процессе нерестовой миграции. Однако эти сведения не дают чёткого представления о происходящих изменениях гормональной регуляции в период смены морского отрезка пути миграции на пресноводный. Всё возрастающая роль горбуши в экосистемах беломорских рек (Алексеев и др., 2019) требует всесторонней оценки её физиологического состояния, в том числе гормонального.
Цель данной работы – сравнить уровень тиреоидных и половых стероидных гормонов у горбуши на морском (Белое море) и пресноводном (р. Кереть) отрезках пути нерестовой миграции.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования – производители горбуши нечётной линии в возрасте 2 года. Материал собирали 15–17.07.2019 г. в низовье р. Кереть (66°16′15′′ с.ш. 33°33′02′′ в.д.) и в Белом море (66°15′32′′ с.ш. 33°57′36′′ в.д.) (рис. 1) в период массовой нерестовой миграции вида. Река Кереть относится к Баренцево-Беломорскому бассейновому округу; площадь водосборного бассейна составляет 3360 км2; протяжённость реки 80 км, берёт начало в оз. Петриярви, впадает в Белое море (Государственный водный реестр, 2020) напротив двух островов Керетского архипелага (о. Горелый и о. Средний, Кандалакшский залив Белого моря, Республика Карелия). В период отбора проб температура воды в реке составляла 13°C, а в море – 10°C.
Рис. 1.
Карта-схема района работ: (⚫) – районы отлова горбуши Oncorhynchus gorbuscha; острова: 1 – Горелый, 2 – Средний, 3 – Кереть, 4 – Пежостров.
Производителей горбуши для исследований из р. Кереть нам любезно предоставляли рыбаки, осуществлявшие её лицензионный лов в 2 км выше Керетской губы. Горбушу из моря приобрели у ООО “РиК”, осуществлявшего её отлов ставными неводами вблизи восточной оконечности о-ва Пежостров (в ~15 км от впадения р. Кереть в Белое море). Переданные в живом виде рыбы до момента отбора проб (≤30 мин) находились в садках соответственно в пресной или в морской воде.
У каждой особи прижизненно из хвостовой вены шприцом отбирали кровь (две пробы по 1.5 мл), измеряли длину по Смитту (FL) и массу тела; пол определяли по морфологическому строению половых желёз.
Кровь в пробирке объёмом 2 мл центрифугировали и замораживали при температуре −20°C. В камеральных условиях сыворотку (общий объём индивидуальной пробы ~ 2 мл) размораживали и методом иммуноферментного анализа с использованием тест-наборов производства DRG (ФРГ) на приборе Mindray MR 96A (КНР) определяли в ней концентрацию шести гормонов: общего (Т3) и свободного (FT3) трийодтиронина, общего (Т4) и свободного (FT4) тироксина, тестостерона (Ts) и эстрадиола-17β (E). Бóльшая часть Т3 и T4 в крови связана с белками сыворотки, а оставшаяся доля (<1%), т.е. FT3 и FT4, является биологически активной фракцией гормона (Ebbesson et al., 2000; Comeau, Campana, 2006). Рассчитывали доли свободных тиреоидных гормонов от их общего содержания (FT3/T3 и FT4/T4) в процентах, а также показатель T4/T3 для оценки дейодирования – превращения Т4 в Т3 (Johnston, Eales, 1995; Comeau, Campana, 2006) – и показатель Ts/E для оценки перехода Ts в E (Kagawa et al., 1984; Павлов и др., 2015). Каждую пробу исследовали на содержание гормонов в двух повторностях. Всего уровень гормонов определили в крови 54 рыб: 28 экз. из реки и 26 экз. из моря.
Статистическая обработка материала выполнена по индивидуальным и обобщённым показателям. Сравнительный анализ длины и массы тела рыб выполнен с использованием t-критерия Стьюдента. Совокупность значений уровня гормонов в выборках соответствовала распределению, отличному от нормального: p < 0.05 (Колмогоров–Смирнов). Для оценки различий концентраций гормонов у разных групп рыб применяли U-критерий Манна−Уитни. Для оценки связи уровня в крови тиреоидных и половых стероидных гормонов рассчитан коэффициент ранговой корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ
Длина и масса рыб. В Белом море и р. Кереть самки горбуши не различались по длине и массе тела (p > 0.05 здесь и далее по t-критерию Стьюдента) (табл. 1). При этом длина и масса самок были заметно меньше, чем у самок из той же реки, исследованных в 2001 и 2003 гг. (Гордеева, 2003; Дорофеева, 2009). Самцы в реке имели меньшие размеры и массу, чем в море (p < 0.001). В выборке из Белого моря был один самец FL 55 см и массой 2020 г, что в два раза превышало среднюю массу остальных пойманных в этом районе самцов (статистический анализ длины и массы горбуши проведён без учёта этой особи).
Таблица 1.
Длина (FL) и масса производителей горбуши Oncorhynchus gorbuscha из Белого моря и р. Кереть
| Место отлова | Самки | Самцы | ||||
|---|---|---|---|---|---|---|
| FL, см | Масса, г | n, экз. | FL, см | Масса, г | n, экз. | |
| Белое море | $\frac{{43 \pm 0.9}}{{39{\kern 1pt} --{\kern 1pt} 46}}$ | $\frac{{1009 \pm 61.3}}{{660{\kern 1pt} --{\kern 1pt} 1200}}$ | 8 | $\frac{{45 \pm 0.9}}{{40{\kern 1pt} --{\kern 1pt} 52}}$ | $\frac{{1212 \pm 78.9}}{{830{\kern 1pt} --{\kern 1pt} 2020}}$ | 18 |
| Р. Кереть | $\frac{{44 \pm 0.6}}{{40{\kern 1pt} --{\kern 1pt} 48}}$ | $\frac{{1047 \pm 44.5}}{{655{\kern 1pt} --{\kern 1pt} 1280}}$ | 17 | $\frac{{43 \pm 1.4}}{{37{\kern 1pt} --{\kern 1pt} 55}}$ | $\frac{{1003 \pm 115.0}}{{625{\kern 1pt} --{\kern 1pt} 2095}}$ | 11 |
Примечание. Здесь и в табл. 2: над чертой – среднее значение и его ошибка, под чертой – пределы варьирования показателя.
Концентрация тиреоидных гормонов. Попарное сравнение (U-критерий) концентраций тиреоидных гормонов и их относительных показателей выявило ряд достоверных различий при миграции горбуши из морской воды в пресную (табл. 2). Уровень T3 у самок, зашедших в реку, по сравнению с самками из моря выше в два раза. Доля свободной фракции этого гормона (FT3/T3) и показатель T4/T3, напротив, ниже соответственно в 1.9 и 4.7 раза. У самцов отмечена лишь сходная тенденция (различия недостоверны) изменения уровней T3, FT3 и T4/T3.
Таблица 2.
Содержание тиреоидных гормонов у самок и самцов горбуши Oncorhynchus gorbuscha из Белого моря и р. Кереть
| Показатель | Белое море | Р. Кереть | ||
|---|---|---|---|---|
| Самки | Самцы | Самки | Самцы | |
| T3, нг/мл | $\frac{{1.2 \pm {{{0.34}}^{{{\text{а,б}}}}}}}{{0.2{\kern 1pt} --{\kern 1pt} 3.2}}$ | $\frac{{2.6 \pm 0.61}}{{0.5{\kern 1pt} --{\kern 1pt} 10.5}}$ | $\frac{{2.5 \pm {{{0.40}}^{{\text{a}}}}}}{{0.3{\kern 1pt} --{\kern 1pt} 4.9}}$ | $\frac{{3.3 \pm {{{0.74}}^{{\text{б}}}}}}{{0.9{\kern 1pt} --{\kern 1pt} 8.8}}$ |
| FT3, пг/мл | $\frac{{11.7 \pm 2.28}}{{4.0{\kern 1pt} --{\kern 1pt} 20.8}}$ | $\frac{{14.5 \pm 1.89}}{{1.7{\kern 1pt} --{\kern 1pt} 28.3}}$ | $\frac{{13.6 \pm 1.34}}{{4.8{\kern 1pt} --{\kern 1pt} 22.7}}$ | $\frac{{15.5 \pm 1.90}}{{7.0{\kern 1pt} --{\kern 1pt} 26.8}}$ |
| T4, мкг/дл | $\frac{{3.1 \pm 1.17}}{{0.5{\kern 1pt} --{\kern 1pt} 10.3}}$ | $\frac{{6.2 \pm {{{1.11}}^{{\text{a}}}}}}{{0.5{\kern 1pt} --{\kern 1pt} 18.4}}$ | $\frac{{2.7 \pm {{{0.54}}^{{\text{a}}}}}}{{0.1{\kern 1pt} --{\kern 1pt} 7.7}}$ | $\frac{{4.2 \pm 1.07}}{{0.6{\kern 1pt} --{\kern 1pt} 11.9}}$ |
| FT4, нг/дл | $\frac{{0.6 \pm 0.23}}{{0.2{\kern 1pt} --{\kern 1pt} 1.2}}$ | $\frac{{0.8 \pm 0.14}}{{0.2{\kern 1pt} --{\kern 1pt} 1.5}}$ | $\frac{{1.0 \pm 0.06}}{{0.5{\kern 1pt} --{\kern 1pt} 1.4}}$ | $\frac{{0.8 \pm 0.01}}{{0.4{\kern 1pt} --{\kern 1pt} 1.4}}$ |
| FT3/T3, % | $\frac{{1.44 \pm {{{0.318}}^{{{\text{a, б}}}}}}}{{0.46{\kern 1pt} --{\kern 1pt} 2.79}}$ | $\frac{{0.84 \pm 0.157}}{{0.01{\kern 1pt} --{\kern 1pt} 2.24}}$ | $\frac{{0.78 \pm {{{0.153}}^{{\text{a}}}}}}{{0.30{\kern 1pt} --{\kern 1pt} 2.55}}$ | $\frac{{0.68 \pm {{{0.173}}^{{\text{б}}}}}}{{0.28{\kern 1pt} --{\kern 1pt} 2.12}}$ |
| FT4/T4, % | $\frac{{0.03 \pm 0.014}}{{0.01{\kern 1pt} --{\kern 1pt} 0.07}}$ | $\frac{{0.01 \pm {{{0.003}}^{{\text{a}}}}}}{{0.01{\kern 1pt} --{\kern 1pt} 0.02}}$ | $\frac{{0.05 \pm {{{0.012}}^{{\text{a}}}}}}{{0.02{\kern 1pt} --{\kern 1pt} 0.15}}$ | $\frac{{0.04 \pm 0.009}}{{0.01{\kern 1pt} --{\kern 1pt} 0.10}}$ |
| T4/T3 | $\frac{{35.3 \pm {{{10.20}}^{{\text{a}}}}}}{{5.5{\kern 1pt} --{\kern 1pt} 92.6}}$ | $\frac{{25.6 \pm {{{4.85}}^{{\text{б}}}}}}{{9.3{\kern 1pt} --{\kern 1pt} 87.2}}$ | $\frac{{7.5 \pm {{{1.44}}^{{{\text{a, б}}}}}}}{{0.6{\kern 1pt} --{\kern 1pt} 17.0}}$ | $\frac{{20.2 \pm 7.14}}{{1.9{\kern 1pt} --{\kern 1pt} 66.1}}$ |
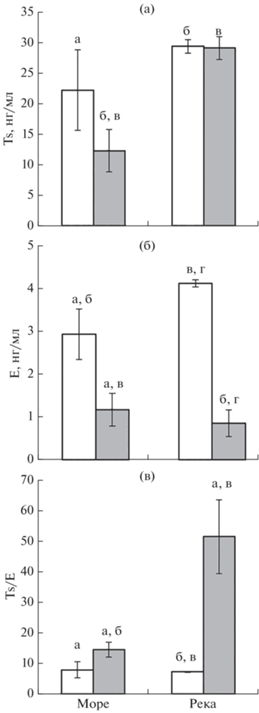
Концентрация половых стероидных гормонов. Концентрация Ts в крови самцов, находящихся в реке, в 2.4 раза выше, чем у самцов в море (рис. 2а). Концентрация Е в первую очередь отражает половые различия: у самок уровень этого гормона значительно выше, чем у самцов − в море в 2.5 раза, а в реке в 4.8 раза (рис. 2б). Показатель Ts/E у самок при миграции из моря в реку не меняется, а у самцов возрастает в 3.6 раза преимущественно за счёт увеличения концентрации тестостерона (рис. 2в).
Рис. 2.
Содержание половых стероидных гормонов в крови самок (◻) и самцов ( ) горбуши Oncorhynchus gorbuscha из Белого моря и р. Кереть: а − тестостерон (Тs), б – эстрадиол-17β (Е), в – соотношение
концентраций Ts/E; (|) – ошибка средней; одинаковые буквы (a–г) указывают на достоверные различия (U-критерий: p < 0.05).
) горбуши Oncorhynchus gorbuscha из Белого моря и р. Кереть: а − тестостерон (Тs), б – эстрадиол-17β (Е), в – соотношение
концентраций Ts/E; (|) – ошибка средней; одинаковые буквы (a–г) указывают на достоверные различия (U-критерий: p < 0.05).
Корреляционный анализ показал, что у самок как в море, так и в реке наблюдается положительная связь содержания Ts и E в крови: соответственно rs = 0.71 при p = 0.047 и rs = 0.67 при p = 0.003. У самцов в море такая связь выражена слабее (rs = 0.49 при p = 0.048), а в реке она не выявлена (p > 0.05).
Самцы в море характеризуются положительной связью концентраций T3 и FT3 с уровнем половых стероидных гормонов (Ts и E): T3 и Ts – rs = = 0.53 при p = 0.027; T3 и E – rs = 0.68 при p = 0.002; FT3 и Ts – rs = 0.77 при p = 0.001; FT3 и E – rs = 0.84 при p < 0.001. У этих рыб содержание T4 в крови коррелирует с уровнем E (rs = 0.57 при p = 0.013), а показатель T4/T3 связан с Ts/E: –0.60 при p = = 0.013. У самцов, находящихся в реке, все указанные связи недостоверны (p > 0.05).
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют, что по ряду эндокринологических показателей производители горбуши, зашедшие в реку, отличаются от особей, ещё находящихся в море. Происходящие гормональные изменения при миграции рыб из морской воды в пресную, как правило, обусловлены двумя параллельными процессами: адаптацией особи к гипоосмолярной среде и продолжающимся половым созреванием в пресной воде. Проанализируем полученные данные, основываясь на ходе этих процессов.
Адаптация рыб при перемещении в пресную воду осуществляется путём осморегуляции, в которой могут принимать участие и гормоны щитовидной железы (Comeau, Campana, 2006). Однако оценку уровня тиреоидных гормонов у лососёвых авторы чаще соотносят с периодом их полового созревания. Так, у атлантического лосося Salmo salar при содержании в морской и пресной воде отмечали повышение концентраций T3 и T4 в преднерестовый период и их снижение во время нереста (Dickhoff et al., 1989). Половые различия у рыб по этим гормонам регистрировали только во время нереста. Уровень T3 у производителей атлантического лосося был максимальным при нахождении особей в прибрежной зоне и снижался в пресноводный период миграции, достигая минимума у рыб вблизи нерестилищ (Youngson, Webb, 1993). У самок и самцов нерки Oncorhynchus nerka в течение нерестовой миграции (по мере достижения нерестово-выростных участков) концентрации T3 и T4 снижаются (Biddiscombe, Idler, 1983; Leonard et al., 2001).
В отличие от приведённых данных литературы наши исследования проведены в течение короткого периода (3 сут), поэтому они не позволяют рассмотреть динамику изменения уровня гормонов. Тем не менее с помощью них можно оценить изменения тиреоидных гормонов, связанные с адаптацией рыб к пресной воде. Достоверные различия между производителями горбуши в реке и находящимися ещё в море отмечены только у самок по T3 и относительным показателям − FT3/T3 и T4/T3; у самцов наблюдается лишь сходная тенденция. Разная скорость изменения указанных показателей у самок и самцов может быть обусловлена разными сроками их захода в реку. В целом отсутствие выраженных изменений в работе щитовидной железы (по всем исследованным тиреоидным гормонам и их соотношениям) у горбуши может быть связано с реализацией её адаптации к пресной воде ещё на морском отрезке пути нерестовой миграции. Так, например, у смолтов черноморской кумжи Salmo trutta labrax перестройка осморегуляции начинается в преддверии ската в море (Павлов и др., 2017). Подготовка к переходу из морской среды в пресную у горбуши может также происходить заранее – ещё в море. На вероятность такого механизма указывают данные по кижучу O. kisutch (Sower, Schreck, 1982), у которого блокировка возможности перехода из морской воды в пресную приводит к высокой смертности.
Отметим, что модификация работы эндокринной системы может быть связанa не только с изменением осмолярности среды, но и с температурой воды. Так, на Danio rerio показано регуляторное действие тиреоидных гормонов при снижении температуры (Little et al., 2013). Есть данные, что скорость дейодирования, которую отражает показатель T4/T3, у радужной форели (Eales et al., 1982; Johnston, Eales, 1995), зимней камбалы Pseudopleuronectes americanus (Eales, Fletcher, 1982) и трески Gadus morhua (Comeau, Campana, 2006) прямо коррелирует с температурой воды. В нашей работе показано, что при миграции в реку у самок горбуши за счёт увеличения скорости дейодирования (снижение T4/T3) возрастает уровень T3. Эти изменения также могут быть связаны с более высокой температурой воды в р. Кереть по сравнению с морем (13 против 10°С).
Концентрации половых стероидных гормонов, вероятно, слабо связаны с переходом рыб в гипоосмотическую среду. Например, у кеты O. keta высокие концентрации E у самок и Ts у самцов наблюдаются на протяжении морского и речного преднерестового периодов, снижаясь во время нереста (Ueda et al., 1983; Ueda, Yamauchi, 1995). В то же время похожие данные были получены на резидентной нерке (весь жизненный цикл проходит в пресной воде) в период её нерестовой миграции на озёрные нерестилища (Leonard et al., 2001). То есть концентрации половых стероидных гормонов у рыб в первую очередь отражают их половую зрелость. Сравним концентрации половых стероидных гормонов у горбуши из реки и моря. Уровень Ts в крови самцов горбуши в реке был заметно выше, чем у самцов, находящихся ещё в море, что указывает на продолжающееся половое созревание. Концентрация E при миграции в реку практически не менялась ни у самцов, ни у самок. Половые различия хорошо отражает уровень E (у самок выше, чем у самцов) и показатель Ts/E (у самок ниже, чем у самцов). У самцов Ts/E заметно повышается при миграции в реку преимущественно за счёт увеличения содержания тестостерона в крови. Выявленные закономерности свидетельствуют о том, что самки горбуши во время захода в реку и в море характеризуются сходным состоянием репродуктивной системы, а самцы, достигшие реки, более зрелые, чем самцы в море. Увеличение концентрации Ts у самцов горбуши в реке указывает на то, что заход в пресную воду катализирует их сперматогенез. На производителях кижуча показано (Sower, Schreck, 1982), что отсутствие возможности мигрировать из моря в реку угнетает репродуктивную функцию как самок, так и самцов.
Самцы горбуши, вероятно, могут заходить в реку раньше самок. На это указывают различия в реакции репродуктивной системы самцов (положительная реакция) и самок (отсутствие реакции) на их перемещение в пресную воду. Половой диморфизм по срокам захода в реку в период нерестовой миграции отмечали у горбуши Британской Колумбии (Pritchard, 1937), у других лососёвых (Shapovalov, Taft, 1954; Lorz, Northcote, 1965; Quinn et al., 2016), в том числе и у полицикличного вида − кумжи S. trutta. Так, для самцов кумжи по сравнению с самками характерны поздняя покатная миграция в море и раннее возвращение в реку на нерест (Pemberton 1976; Berg, Jonsson 1990). В некоторых случаях это приводит к тому, что самцы достигают нерестовых участков раньше самок (Jonsson, Jonsson, 2011). Однако есть данные (Dahl et al., 2015) о раннем заходе самок кумжи в реку по сравнению с самцами. Отметим, что продолжительность нахождения лососёвых в море связана не только c полом, но и во многом зависит от температурных и кормовых условий (de Leeuw et al., 2007).
Длина и масса самцов горбуши в выборке из реки заметно меньше, чем в таковой из моря. Вероятно, самцы меньшего размера заходят в реку и достигают половой зрелости несколько раньше, чем крупные особи. Это хорошо согласуется с информацией о том, что в новом регионе обитания горбуша сохранила присущую ей в нативном ареале (р. Ола, Магаданская область) особенность – увеличение к концу хода доли более крупных производителей (Дорофеева, 2009). Увеличение размеров горбуши к концу нерестового хода отмечали и в другой части ареала – Британской Колумбии (Pritchard, 1937). Мы предполагаем, что это связано с тем, что крупным особям требуется несколько больше времени для достижения полового созревания.
Выявленные изменения концентраций исследованных гормонов отражают их связь на морском и речном этапах нерестовой миграции горбуши, а также её половой диморфизм. Самки как в море, так и в реке характеризуются стабильной связью Ts с E при отсутствии значимых корреляций по концентрациям тиреоидных гормонов. У самцов в море выявлены корреляции уровней тиреоидных и половых стероидных гормонов, однако такие связи значительно ослабевают в реке. Следовательно, в период подготовки к миграции в реку самки и самцы горбуши характеризуются не только разным гормональным статусом, но и, по всей видимости, разной степенью вовлечения тиреоидных гормонов в процессы полового созревания. По сравнению с особями, находящимися в море, самки горбуши в реке характеризуются высоким уровнем Т3 и повышенной скоростью дейодирования, а самцы – более высоким уровнем Ts. Выявленные особенности указывают на половой диморфизм у горбуши при миграции из моря в реку.
ВЫВОДЫ
1. При нерестовой миграции из Белого моря в р. Кереть у самок горбуши повышается уровень трийодтиронина, снижается доля его свободной фракции, увеличивается скорость дейодирования (превращение T4 в T3). У самцов прослеживается сходная тенденция, но различия недостоверны.
2. Находящиеся ещё в море и зашедшие в реку самки не различаются по уровню половых стероидных гормонов и показателю их отношения (Ts/E). Самцы, зашедшие в реку, характеризуются более зрелым состоянием, чем самцы в море, на что указывают высокий уровень тестостерона и величина Ts/E.
3. На этапе смены морского отрезка пути нерестовой миграции на пресноводный самки горбуши отличаются от самцов высоким уровнем эстрадиола-17β и низким значением Ts/E.
Список литературы
Алексеев М.Ю., Ткаченко А.В., Зубченко А.В. и др. 2019. Распространение, эффективность нереста и возможность промысла интродуцированной горбуши (Oncorhynchus gorbusha Walbaum) в реках Мурманской области // Рос. журн. биол. инвазий. Т. 12. № 1. С. 1–13.
Алтухов Ю.П., Салменкова Е.А., Омельченко В.Т. 1997. Популяционная генетика лососёвых рыб. М.: Наука, 228 с.
Баранникова И.А. 1975. Функциональные основы миграций рыб. Л.: Наука, 210 с.
Гордеева Н.В. 2003. Генетические процессы у горбуши интродуцированной в бассейне Белого моря: Автореф. дис. … канд. биол. наук. М.: ИОГен РАН, 24 с.
Гордеева Н.В. 2010. Беломорская горбуша: итоги и перспективы акклиматизации // Рыб. хоз-во. № 5. С. 65–67.
Гордеева Н.В., Салменкова Е.А., Алтухов Ю.П. 2005. Генетическая дифференциация тихоокеанской горбуши при освоении нового ареала // ДАН. Т. 400. № 5. С. 714–717.
Государственный водный реестр. 2020. (http://textual.ru/gvr/. Version 05/2020).
Дорофеева Е.А. 2009. Морфобиологические адаптации горбуши в Белом море // Матер. XXVIII Междунар. конф. “Биологические ресурсы Белого моря и внутренних водоемов Европейского Севера”. СПб. С. 195–202.
Кудерский Л.А. 2001. Акклиматизация рыб в водоёмах России: состояние и пути развития // Вопр. рыболовства. Т. 2. № 1(5). С. 6–85.
Павлов Д.С., Павлов Е.Д., Ганжа Е.В., Костин В.В. 2015. Содержание тиреоидных и половых стероидных гормонов у сеголеток черноморской кумжи Salmo trutta labrax из двух пространственных группировок при разной продолжительности голодания // Изв. РАН. Сер. биол. № 4. С. 415–422. https://doi.org/10.7868/S0002332915040116
Павлов Д.С., Павлов Е.Д., Ганжа Е.В., Костин В.В. 2017. Содержание Na+, K+, Cl– и Ca2+ в крови молоди черноморской кумжи Salmo trutta labrax при внутрипопуляционной дифференциации // Там же. № 6. С. 585‒592. https://doi.org/10.7868/S0002332917060017
Павлов С.Д. 2014. Результаты акклиматизации дальневосточной горбуши в Европе и о стабилизации уловов // Рыб. хоз-во. № 2. С. 85–88.
Смирнов А.И. 1994. Экологические подходы к работе с горбушей и кетой в бассейнах Баренцева и Белого морей // Матер. V Всерос. совещ. “Систематика, биология и биотехника разведения лососёвых рыб”. СПб. С. 181–183.
Arjona F.J., Vargas-Chacoff L., del Río M.P. et al. 2011. Effects of cortisol and thyroid hormone on peripheral outer ring deiodination and osmoregulatory parameters in the Senegalese sole (Solea senegalensis) // J. Endocrinol. V. 208. № 3. P. 323–330. https://doi.org/10.1530/JOE-10-0416
Berg O.K., Jonsson B. 1990. Growth and survival rates of anadromous trout (Salmo trutta L.) from the Vardnes river, northern Norway // Environ. Biol. Fish. V. 29. P. 145–154. https://doi.org/10.1007/BF00005031
Biddiscombe S., Idler D.R. 1983. Plasma levels of thyroid hormones in sockeye salmon (Oncorhynchus nerka) decrease before spawning // Gen. Comp. Endocrinol. V. 52. № 3. P. 467–470. https://doi.org/10.1016/0016-6480(83)90187-9
Campinho M.A. 2019. Teleost metamorphosis: the role of thyroid hormone // Front. Endocrinol. V. 10. P. 1–12. https://doi.org/10.3389/fendo.2019.00383
Collins J.J. 1975. Occurrence of pink salmon (Oncorhynchus gorbuscha) in Lake Huron // J. Fish. Res. Board Can. V. 32. № 3. P. 402–404. https://doi.org/10.1139/f75-047
Comeau L.A., Campana S.E. 2006. Correlations between thyroidal and reproductive endocrine status in wild Atlantic cod // Can. Tech. Rept. Fish. Aquat. Sci. № 2682. 14 p.
Dahl J., Dannewitz J., Karlsson L. et al. 2015. The timing of spawning migration: implications of environmental variation, life history, and sex // Can. J. Zool. V. 82. № 12. P. 1864–1870. https://doi.org/10.1139/z04-184
de Leeuw J.J., ter Hofstede R., Winer H.V. 2007. Sea growth of anadromous brown trout (Salmo trutta) // J. Sea. Res. V. 58. № 2. P. 163–165. https://doi.org/10.1016/j.seares.2006.12.001
Dickhoff W.W., Yan L., Plisetskaya E.M. et al. 1989. Relationship between metabolic and reproductive hormones in salmonid fish // Fish Physiol. Biochem. V. 7. № 1–6. P. 147–155. https://doi.org/10.1007/bf00004701
Eales J.G., Fletcher G.L. 1982. Circannual cycles of thyroid hormones in plasma of winter flounder (Pseudopleuronectes americanus Walbaum) // Can. J. Zool. V. 60. № 3. P. 304–309. https://doi.org/10.1139/z82-040
Eales J.G., Chan J.P., Van Der Kraak G.J. et al. 1982. Effects of temperature on plasma thyroxine and iodide kinetics in rainbow trout, Salmo gairdneri // Gen. Comp. Endocrinol. V. 47. № 3. P. 295–307. https://doi.org/10.1016/0016-6480(82)90237-4
Ebbesson L.O.E., Björnsson B.T., Stefansson S.O., Ekström P. 2000. Free plasma thyroxine levels in coho salmon, Oncorhynchus kisutch, during parr-smolt transformation: comparison with total thyroxine, total triiodothyronine, and growth hormone levels // Fish Physiol. Biochem. V. 22. № 1. P. 45–50. https://doi.org/10.1023/a:1007841517552
Gwinner E. 1981. Circannual systems // Biological rhythms / Ed. Aschoff J. N.Y.: Plenum. P. 391–410.
Hesthagen T., Sandlund O.T. 2007. Non-native freshwater fishes in Norway: history, consequences and perspectives // J. Fish Biol. V. 71. Suppl. D. P. 173–183. https://doi.org/10.1111/j.1095-8649.2007.01676.x.
Iwata M. 1995. Downstream migratory behavior of salmonids and its relationship with cortisol and thyroid hormones: a review // Aquaculture. V. 135. № 1−3. P. 131–139. https://doi.org/10.1016/0044-8486(95)01000-9
Johnston C.E., Eales J.G. 1995. Effects of acclimation and assay temperature on outer- and inner-ring thyroxine and 3,5,3-triiodo-L-thyronine deiodination by liver microsomes of rainbow trout, Oncorhynchus mykiss // J. Exp. Zool. V. 272. № 6. P. 426–434. https://doi.org/10.1002/jez.1402720604
Jonsson B., Jonsson N. 2011. Ecology of Atlantic salmon and brown trout: habitat as a template for life histories // Fish Fish. Ser. V. 33. 680 p. https://doi.org/10.1007/978-94-007-1189-1.
Kagawa H., Young G., Nagahama Y. 1984. In vitro estradiol-17 beta and testosterone production by ovarian follicles of the goldfish, Carassius auratus // Gen. Comp. Endocrinol. V. 54. № 1. P. 139–143. https://doi.org/10.1016/0016-6480(84)90209-0
Kennedy A.J., Greil R.W., Back R.C., Sutton T.M. 2005. Population characteristics and spawning migration dynamics of pink salmon in U.S. Waters of the St. Marys river // J. Great Lakes Res. V. 31. № 1. P. 11–21. https://doi.org/10.1016/s0380-1330(05)70234-3
Leonard J.B.K., Iwata M., Ueda H. 2001. Seasonal changes of hormones and muscle enzymes in adult lacustrine masu (Oncorhynchus masou) and sockeye salmon (O. nerka) // Fish Physiol. Biochem. V. 25. № 2. P. 153–163. https://doi.org/10.1023/a:1020512105096
Little A.G., Kunisue T., Kannan K., Seebacher F. 2013. Thyroid hormone actions are temperature–specific and regulate thermal acclimation in zebrafish (Danio rerio) // BMC Biol. V. 11. № 1. Article 26. https://doi.org/10.1186/1741-7007-11-26
Lorz H.W., Northcote T.G. 1965. Factors affecting stream location, and timing and intensity of entry by spawning kokanee (Oncorhynchus nerka) into an inlet of Nicola Lake, British Columbia // J. Fish. Res. Board Can. V. 22. № 3. P. 665–685. https://doi.org/10.1139/f65-060
Ojima D., Iwata M. 2010. Central administration of growth hormone-releasing hormone and corticotropin-releasing hormone stimulate downstream movement and thyroxine secretion in fall-smolting coho salmon (Oncorhynchus kisutch) // Gen. Comp. Endocrinol. V. 168. № 1. P. 82–87. https://doi.org/10.1016/j.ygcen.2010.04.007
Pemberton R. 1976. Sea trout in North Argyll sea lochs, population, distribution and movements // J. Fish Biol. V. 9. № 2. P. 157–179. https://doi.org/10.1111/j.1095-8649.1976.tb04670.x
Pettit H. 2017. Britain’s native salmon are under threat from a pink rival that escaped into the sea from Russian farms. (https://www.dailymail.co.uk/sciencetech/article-4829918/Britain-s-native-salmon-threat-pink-rival.html. Version 05/2021).
Pritchard A.L. 1937. Variation in the time of run, sex proportions, size and egg content of adult pink salmon (Oncorhynchus gorbuscha) at McClinton Creek, Masset Inlet, B.C. // J. Biol. Board Can. V. 3. № 5. P. 403–416. https://doi.org/10.1139/f37-023
Quinn T.P., McGinnity P., Reed T.E. 2016. The paradox of “premature migration” by adult anadromous salmonid fishes: patterns and hypotheses // Can. J. Fish. Aquat. Sci. V. 73. № 7. P. 1–68. https://doi.org/10.1139/cjfas-2015-0345
Sandlund O.T., Berntsen H.H., Fiske P. et al. 2019. Pink salmon in Norway: the reluctant invader // Biol. Invasions. V. 21. № 4. P. 1033–1054. https://doi.org/10.1007/s10530-018-1904-z
Shapovalov L., Taft A.C. 1954. The life histories of the steelhead rainbow trout (Salmo gairdneri gairdneri) and silver salmon (Oncorhynchus kisutch) // Fish Bull. Cal. Dept. Fish Game. V. 98. P. 1–375.
Sower S.A., Schreck C.B. 1982. Steroid and thyroid hormones during sexual maturation of coho salmon (Oncorhynchus kisutch) in seawater or fresh water // Gen. Comp. Endocrinol. P. 47. № 1. P. 42–53. https://doi.org/10.1016/0016-6480(82)90082-x
Ueda H., Yamauchi K. 1995. Chapter 14. Biochemistry of fish migration // Biochemistry and molecular biology of fish V. 5 / Eds. Hochachka P.W., Mommsen T.P. Amsterdam: Elsevier Sci. P. 265–279. https://doi.org/10.1016/s1873-0140(06)80040-8.
Ueda H., Hiroi O., Hara A. et al. 1983. Changes in serum concentrations of steroid hormones, thyroxine, and vitellogenin during spawning migration of the chum salmon, Oncorhynchus keta // Gen. Comp. Endocrinol. V. 53. № 2. P. 203–211. https://doi.org/10.1016/0016-6480(84)90243-0
Youngson A.F., Webb J.H. 1993. Thyroid hormone levels in Atlantic salmon (Salmo salar) during the return migration from the ocean to spawn // J. Fish Biol. V. 42. № 2. P. 293–300. https://doi.org/10.1111/j.1095-8649.1993.tb00329.x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


