Вопросы ихтиологии, 2022, T. 62, № 4, стр. 413-420
Новые данные о биологии кильдинской трески Gadus morhua kildinensis (Gadidae) из озера Могильное (о. Кильдин, Баренцево море) по результатам эхометрирования и фотосъёмки
А. Н. Строганов 1, *, П. П. Стрелков 2, 3, Н. И. Шилин 4, Н. В. Мухина 5, М. Ю. Меньшакова 3, М. Л. Федюк 6
1 Московский государственный университет
Москва, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
3 Мурманский арктический государственный университет
Мурманск, Россия
4 Всероссийский научно-исследовательский институт охраны
окружающей среды − ВНИИ Экология
Москва, Россия
5 Полярный филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – ПИНРО
Мурманск, Россия
6 Санкт-Петербургский государственный педиатрический медицинский университет
Санкт-Петербург, Россия
* E-mail: andrei_str@mail.ru
Поступила в редакцию 10.09.2021
После доработки 25.10.2021
Принята к публикации 28.10.2021
- EDN: XBORZB
- DOI: 10.31857/S0042875222030225
Аннотация
На основании результатов эхолотных и гидрологических съёмок, фотофиксаций и натурных наблюдений рассматривается распределение кильдинской трески Gadus morhua kildinensis в оз. Могильное (о. Кильдин, Баренцево море). Сеголетки обитают в нижней части распреснённого верхнего слоя, младшие возрастные группы локализуются в зоне перемычки в юго-восточной части озера, взрослые особи распределяются на акватории озера в пределах глубин 4.0–6.4 м (преимущественно 5.0–5.4 м), характеризующихся благоприятными значениями температуры, солёности и насыщения воды кислородом.
Кильдинская треска Gadus morhua kildinensis населяет расположенное на о-ве Кильдин (Баренцево море) субполярное меромиктическое реликтовое морское оз. Могильное (Световидов, 1948; Никольский, 1971; Титов и др., 2002), образовавшееся около 1500 лет назад путём отшнуровывания морского залива от акватории Кильдинской салмы в результате комплексного воздействия ряда факторов – поднятия морского дна, ледниковой аккумуляции, абразионно-аккумулятивной деятельности моря и др. (Дерюгин, 1925; Гуревич, Лийва, 1975; Коцубко, Кравченко, 2002; Митяев и др., 2008). В силу малого размера водоёма численность популяции кильдинской трески ограничена, поэтому данный подвид занесён в Красную книгу России и Мурманской области (Шилин, 2001; Andreev et al., 2015; Строганов и др., 2015; Zhivotovsky et al., 2016).
Более двух веков треска оз. Могильное привлекает внимание исследователей. Изучали её морфологию, биологию, паразитофауну, питание, условия обитания и их изменчивость (Озерецковский, 1804; Фаусек, 1891; Дерюгин, 1925; Есипов, 1930; Догель, 1936; Цееб, 1975; Цееб, Астафьева, 1975; Анциферов, Трофимов, 2002; Карасев, 2002; Мухина и др., 2002; Новиков и др., 2006). В наших предыдущих работах были рассмотрены генетические параметры кильдинской трески (Новиков и др., 2006; Строганов и др., 2011), выявлены истоки её экстремально высокой генной дифференциации от материнской популяции атлантической трески G. morhua норвежско-баренцевоморского региона и механизмы адаптации к специфическим условиям оз. Могильное (Строганов и др., 2015, 2017).
Цель настоящей работы – изучить распределение и другие биологические характеристики кильдинской трески на разных этапах онтогенеза в связи с абиотическими условиями среды с использованием эхометрирования и фотосъёмки.
МАТЕРИАЛ И МЕТОДИКА
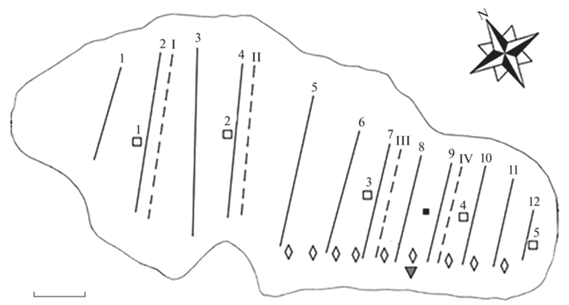
Материал собран в комплексных экспедициях МГУ, СПбГУ и ПИНРО на оз. Могильное (о. Кильдин, Баренцево море) в июле–августе 2011–2012, 2017–2018 и 2020 гг. Схема проведения эхолотных и гидрологических съёмок представлена на рис. 1. В работе использованы также опубликованные ранее морфобиологические и генетические данные (Новиков и др., 2006; Строганов и др., 2011, 2013).
Рис. 1.
Схема проведения съёмок на оз. Могильное: (─) – разрезы 1−12 эхолотной съёмки 25−30.07.2012 г., (− −) – разрезы I−IV эхолотной съёмки 03.08.2017 г., (◇) − эхолотная съёмка вдоль перемычки 30.07.2017 г.; (◻) – станции 1−5 гидрологической съёмки 28.07.2017 г., (◼) − станция гидрологической съёмки 12−13.08.2020 г.; (▼) – место расположения фотоловушки 26.07.2018 г. Масштаб: 50 м.
Рыб отлавливали крючковыми снастями с попеременным обловом разных участков озера по принципу поймал–отпусти (в соответствии с разрешениями Министерства природных ресурсов и экологии России). Перемещение орудий лова было вынужденным, так как на обловленном месте в течение суток или более треска не ловилась (несмотря на то, что выловленных особей практически сразу же выпускали в озеро). Выловленных рыб (75 экз., 2011–2012 гг.) фотографировали, определяли их полную длину (TL) и массу.
Для исследования особенностей распределения и поведения кильдинской трески провели эхометрические съёмки (эхолот “Humminbird PiranhaMAX 230e Portable”) (рис. 1). В 2012 г. перпендикулярно продольной оси озера было выполнено 12 разрезов, относительно равномерно распредёленных по его акватории (в трёх повторностях). В 2017 г. кроме четырёх разрезов перпендикулярно продольной оси озера для исследования распределения трески в прилежащей к перемычке акватории выполняли эхолокацию вдоль перемычки с направлением луча эхолота перпендикулярно подводной части её откоса (в трёх повторностях).
Для получения подводных фотографий трески использовали фотоловушку (видеокамера с интервальной съёмкой BRINNO BPC100 в герметичном прозрачном боксе), установленную аквалангистом на глубине 4 м вблизи перемычки в юго-восточной части озера (рис. 1).
При проведении гидрологических съёмок (рис. 1) применяли батометрический метод отбора проб (Шевлякова, 2017) с использованием батометра системы Алексеева. В 2017 г. температуру воды определяли ртутным термометром с ценой деления 0.5°C, солёность – рефрактометром-солемером Kelilong RHS-28BATC с ценой деления 1‰. Измерения проводили от поверхности до дна на пяти станциях, относительно равномерно распределённых вдоль срединного продольного сечения зеркала озера. В 2020 г. температуру, солёность и содержание растворённого в воде кислорода на разных горизонтах в центральной зоне юго-восточной части озера регистрировали рефрактометром S/Mill-E (Atago) и погружаемым термооксиметром Expert 009 (Econix-Expert Ltd).
РЕЗУЛЬТАТЫ
При проведении эхометрической съёмки 25–30.07.2012 г. в среднем (три повторности) в оз. Могильное зарегистрировано 278 экз. трески (половозрелые особи и крупные рекруты). В северо-западной части озера они были распределены достаточно равномерно (на разрезах № 1–6 доля особей составляла от 10 до 12%), на остальных разрезах наблюдали снижение доли особей в юго-восточном направлении (от 7 до 2%) (рис. 2).
Рис. 2.
Относительная численность кильдинской трески Gadus morhua kildinensis на 12 разрезах эхолотной съёмки (25–30.07.2012 г.). Приведены средние значения (три повторности) относительно среднего числа зарегистрированных крупных особей и рекрутов (278 экз.); нумерацию разрезов см. на рис. 1.

Основной целью съёмки, проведённой 03.08.2017 г. по четырём разрезам вдоль продольной линии озера, было выяснить батиметрическое распределение кильдинской трески в озере. По данным эхолокации, все зарегистрированные особи (114 экз.) локализовалась в диапазоне глубин 4.0–6.4 м: на всех разрезах большинство особей (от 56 до 78%, в среднем 68.6%) занимали горизонт 5.0–5.4 м (рис. 3).
Рис. 3.
Батиметрическое распределение кильдинской трески Gadus morhua kildinensis, по данным эхолотной съёмки 03.08.2017 г. (114 экз.).

Эхолотная съёмка вдоль перемычки (30.07.2017 г.), отделяющей озеро от Кильдинской салмы, выявила присутствие трески в этой зоне (28 экз.). Использовавшаяся модель эхолота позволяла различать размеры рыб лишь как крупные и мелкие. Следует отметить, что в 2011 и 2012 гг. по всей акватории озера в уловах были отмечены крупные особи (TL > 32.5 см и массой > 400 г). Исключением была акватория вдоль перемычки, где наряду с крупной треской очень редко ловились особи TL 13–14 см массой ~ 15 г, относимые к возрастной группе “двухлетки” (Чугунова, 1959; Мухина и др., 2002). Мы предполагаем, что эта размерная группа идентифицировалась эхолотом как мелкие. По данным съёмки, их доля составляла в среднем 51% общего числа зарегистрированных в зоне перемычки особей, они находились на расстоянии 4–7 м от перемычки. Особи трески, определённые эхолотом как крупные, распределялись на большем расстоянии от перемычки – от 4 до 26 м.
Оз. Могильное характеризуется вертикальной стратификацией вод по температуре, солёности, содержанию кислорода. По данным гидрологической съёмки 28.07.2017 г. (таблица), верхняя зона термоклина соответствовала горизонту 3 м, нижняя – 8 м; верхняя и нижняя зоны галоклина – соответственно 3–4 и 7–8 м. Рубеж между поверхностными сильно опреснёнными водами и более солёными глубинными мы условно проводим по изобате 3 м. Необходимо отметить, что выявленное в конце июля 2017 г. значительное опреснение в северо-западной части озера, захватывавшее даже горизонты глубже 8 м, скорее всего, имело ограниченный во времени характер и было связано с формированием стратификации вдоль продольной оси озера вследствие тихой погоды в течение нескольких дней на фоне специфического для оз. Могильное соотношения зон поступления пресных и морских вод (Гуревич, Лийва, 1975). Единично подобную ситуацию отмечали и ранее (Strelkov et al., 2019).
Распределение температуры (T) и солёности (S) по глубинам на пяти станциях в оз. Могильное 28.07.2017 г.
| Глубина, м | Станция | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||||||
| T, °C | S, ‰ | T, °C | S, ‰ | T, °C | S, ‰ | T, °C | S, ‰ | T, °C | S, ‰ | |
| 0 | 17.0 | 2 | 17.0 | 5 | 16.0 | 5 | 16.0 | 3 | 16.0 | 5 |
| 1 | 17.0 | 2 | 16.5 | 5 | 16.0 | 5 | 16.0 | 3 | 15.0 | 5 |
| 4 | 13.0 | 5 | 13.0 | 16 | 13.0 | 15 | 12.5 | 16 | 12.5 | 16 |
| 8 | 12.0 | 11 | 11.5 | 27 | 10.5 | 27 | 11.0 | 23 | 10.0 | 25 |
| 12 | 11.0 | 21 | 10.0 | 28 | 10.0 | 27 | 10.0 | 27 | ||
Примечание. Нумерацию станций см. на рис. 1.
В начале августа 2020 г. в центральной зоне юго-восточной части озера термогалинная характеристика была сходной с таковой в конце июля 2017 г., но с некоторыми особенностями. Температура поверхностного слоя (0–2 м) была несколько ниже, чем на глубине 3–4 м (13.7 против 15.0–16.0°C). В диапазоне глубин 5–9 м температура интенсивно снижалась (с 13.2 до 9.1°С), глубже 9 м и до дна она была стабильной (8.8–8.9°C). Солёность слоя 0–2 м составляла 4‰; в интервале глубин 3–7 м резко повышалась с 9 до 25‰, ниже 7 м и до дна постепенно увеличивалась до 29‰. Содержание кислорода в воде озера в поверхностном 5-метровом слое соответствовало 100%-ному насыщению и даже несколько превышало его (до 115% на глубине 3 м); в диапазоне 5–7 м показатель снижался с 88 до 11%; глубже 7 м и до дна находился на крайне низком и не подходящем для нормального существования рыб уровне (8–10%).
В 2018 г. с помощью фотоловушки впервые были получены подводные фотографии кильдинской трески (рис. 4). Ориентируясь на размеры актиний, попавших на фотографию, можно полагать, что это крупная половозрелая особь длиной ~ 60 см. Судя по чёткости снимка, положению подбородочного усика, брюшных плавников и хвостового плавника, эта треска зависла в толще воды на одном месте либо медленно перемещалась за счёт ундулирующих движений грудных плавников. Вывод о территориальном образе жизни кильдинской трески (Строганов и др., 2017) подтверждают наблюдения с берега крупных особей, остававшихся на одних и тех же местах в течение нескольких суток (Приложение 1 ).
Рис. 4.
Крупная особь кильдинской трески Gadus morhua kildinensis в естественных условиях, на дне актинии Metridium senile.

Кроме крупной трески впервые получены подводные снимки молоди. Приведённый в Приложении 2 блок фотографий демонстрирует перемещение в пелагиали стаек молоди трески, а также их подходы в прибрежную зону в районе откоса перемычки. Судя по размерам особей на фотографиях (ориентировочно 5–6 см) и их распределению в толще воды, стайки образованы потомством от нереста текущего года, относимых, в том числе по размерам, к возрастной группе “сеголетки” (Чугунова, 1959; Мухина и др., 2002). Такие стайки визуально наблюдали по всей акватории озера, в том числе на небольших глубинах (~1 м).
При сравнении окраски сеголеток, двухлеток и более крупных особей кильдинской трески выявлены коренные отличия. Ярко-пятнистая окраска крупных особей соответствует описанной в литературе и даже используемой для таксономической идентификации кильдинской трески (Световидов, 1948). Коричневые с буроватым оттенком некрупные яркие пятна диаметром 2–3 мм, обрамлённые светлой каймой, густо покрывают спину и верхнюю часть боковой поверхности, заходят на голову и спинные плавники. Нижняя челюсть, горло и брюхо ярко-белого цвета. По нашим данным, такая окраска характерна для рыб широкого возрастного ряда – от 3 до 12 лет. Окраска сеголеток и двухлеток кильдинской трески кардинально отличается – она блеклая, без ярких пятен. Спинка коричневато-оливковая, на боках выше и немного ниже боковой линии на светлом фоне крупные слабовыраженные желтовато-коричневые пятна неправильной формы. Нижняя челюсть, горло и брюхо желтовато-белого цвета.
ОБСУЖДЕНИЕ
Сравнение результатов эхолотных съёмок 2012 и 2017 гг. и данных лова крючковыми снастями позволяют предполагать достаточно стабильное состояние озёрной группировки трески. Данные эхолокационной съёмки продемонстрировали отличия в распределении трески на разрезах в северо-западной и юго-восточной частях озера, однако это, видимо, в большей степени связано с морфометрическими характеристиками озера (Гуревич, 1975). Ранее отмечалось (Строганов и др., 2015, 2017), что кильдинская треска для обеспечения выживания в условиях оз. Могильное модифицировала своё пищевое поведение, освоив пастбищную стратегию и, более того, перешла к образу жизни, аналогичному территориальному. Особи кильдинской трески держатся в рамках определённого участка, на это указывают представленные в настоящей работе результаты наблюдений (эхолот при тотальной съёмке фиксировал в глубине озера остававшихся на месте особей трески, не реагировавших на двигавшуюся по поверхности лодку; визуальные наблюдения особей, сутками остававшихся на одном месте; фото трески, в течение недели находившейся на глубине в акватории вблизи лагеря экспедиции в 2015 г.). Такой относительно малоподвижный, территориальный образ жизни, отличающийся от постоянно перемещающихся в поисках пищи особей атлантической трески мористых и прибрежных акваторий Баренцева и Норвежского морей (Бойцов и др., 2003; Орлова, Долгов, 2004), обусловлен не только малыми размерами оз. Могильное, но и способствует экономии энергии в условиях дефицита подходящей для крупных половозрелых особей кильдинской трески пищи (Бретт, 1983). В данной ситуации именно к кильдинской треске может быть применён термин “стационарная”, присваиваемый некоторыми авторами группировкам атлантической трески с более низкой миграционной активностью (Wentzel-Larsen, Nordeide, 2001; Nordeide et al., 2011; Тетерина, Животовский, 2017).
Крупная треска на акватории оз. Могильное практически не встречалась за пределами диапазона глубин 4.0–6.4 м; причём большинство особей (68.6%) занимало горизонт 5.0–5.4 м. Являясь подвидом представителя бореальной ихтиофауны – атлантической трески, кильдинская треска сохраняет соответствующие предпочтения в выборе диапазонов абиотических факторов, в частности, температуры и солёности. В оз. Могильное горизонт 5.0–5.4 м, видимо, характеризуется комфортными для взрослых особей трески параметрами среды. Так, на этом горизонте в летний период температура в отличие от перегретых поверхностных слоёв снижается до 9–11°C (Анциферов, Трофимов, 2002; Krasnova et al., 2019; настоящая работа). Солёность воды подповерхностного слоя в оз. Могильное вследствие распреснения за счёт осадков и подтока грунтовых вод варьирует в пределах 2–5‰. Согласно экспериментальным данным, кильдинская треска без явного для себя ущерба довольно длительное время может находиться в воде с такой низкой соленостью (Цееб, 1975). Как показывают наши результаты, а также данные литературы (Анциферов, Трофимов, 2002; Krasnova et al., 2019), с увеличением глубины солёность быстро возрастает и на горизонте 5.0–5.5 м достигает 20–25‰. Что касается степени насыщения воды кислородом, то в оз. Могильное наиболее благоприятной является верхняя опреснённая зона, в которой этот показатель составляет 100% и даже может достигать более высокого уровня за счёт фотосинтетической активности фитопланктона. Однако зона с высоким содержанием кислорода, как показывают наши результаты и данные других исследований последнего десятилетия, распространяется до глубины 5 м, после чего этот показатель резко снижается и на глубине 6 м составляет уже ~ 50% (Strelkov et al., 2014, 2019; Krasnova et al., 2019).
Таким образом, распределение трески в оз. Могильное в пределах узкого диапазона глубин (5.0–5.4 м) обусловлено значениями абиотических факторов: верхняя граница определяется температурой и солёностью, нижний – уровнем содержания кислорода. При этом не исключается выход отдельных особей на непродолжительное время за пределы верхней границы зоны обитания, например, для питания. Так, описаны наблюдения переворачивания крупной треской плоских окатанных камней и питания бокоплавами в прибрежной зоне озера у самого уреза воды (Серебров и др., 2002).
Младшие возрастные группы трески в оз. Могильное сложны для исследования. В большей степени это касается молоди в возрасте 1–2 года, которая ведёт скрытный образ жизни, в том числе из-за риска стать объектами питания крупных особей кильдинской трески (Мухина и др., 2002; Серебров, Игнашкин, 2002). Мы наблюдали случаи каннибализма в 2011 и 2012 гг., когда попавшуюся на крючок мелкую особь захватывала крупная треска. По данным ловов и эхолотных съёмок, молодь трески отмечена только в зоне перемычки в юго-восточной части оз. Могильное. На наш взгляд, это обусловлено особенностями рельефа подводного склона перемычки: окатанные валуны диаметром 0.25–1.00 м, крупнообломочный грунт, местами поросший макрофитами, предоставляют молоди большое число укрытий от крупной трески, что повышает степень её выживаемости. Следует отметить, что другие берега озера отлогие, с определённой степенью заиления, т.е. там отсутствуют надёжные укрытия для молоди. Кроме того, высокий уровень фильтрации в озеро солёных баренцевоморских вод в зоне перемычки, видимо, способствует повышению кормности и увеличению темпа роста молоди трески (Цееб, 1975; Мухина и др., 2002).
Полученные с помощью фотоловушки изображения впервые дали информацию об особенностях экологии сеголеток кильдинской трески до их перехода к придонному образу жизни. Установлено, что сеголетки стайками перемещаются в нижней части распреснённого верхнего слоя, подходят также в прибрежную зону в районе откоса перемычки. Желтовато-коричневая с крупными пятнами окраска сеголеток полностью совпадает с окраской двухлеток и коренным образом отличается от используемой в качестве определительного признака (Андрияшев, 1954) яркой окраски крупных особей кильдинской трески. Также нужно отметить, что окраска сеголеток кильдинской трески соответствует таковой ранней молоди атлантической трески и тихоокеанской трески G. macrocephalus (Расс, 1946; Auditore et al., 1994; Воскобойникова и др., 2012) и полностью отличается от приведённого в литературе описания (Цееб, 1975).
Полученные нами результаты комплексных исследований с учётом данных литературы в достаточно полном объёме позволяют составить представление об особенностях биологии кильдинской трески в разные периоды жизни. Развитие пелагической икры проходит в нижнем морском слое (6.5–7.5 м, солёность 26–27‰); здесь же локализуются предличинки и перешедшие на питание личинки (Цееб, Поздняков, 1975). После метаморфоза, перехода в мальковое состояние и развития гидростатической, двигательной и других функций сеголетки получают возможность расширить область обитания − освоить пелагиаль опреснённого слоя. В начале осеннего периода молодь из пелагиали переходит к придонному образу жизни, локализуясь в области перемычки (юго-восточная зона) и прилежащей к ней акватории. Под защитой крупнообломочного материала перемычки молодь кильдинской трески проводит, видимо, один−два года. Такая локализация молоди предохраняет её от чрезмерного выедания крупной треской и таким образом обеспечивает стабильность пополнения нерестовой группировки кильдинской трески в озере. Рыбы более старшего возраста распределяются достаточно равномерно по акватории озера, локализуясь в слое осолонённой воды на глубине 5.0–5.4 м.
В заключение следует отметить, что проводившиеся в разное время на оз. Могильное работы свидетельствуют об относительной стабильности этой популяции (Титов, 2002; Строганов и др., 2015), но для определения точной численности популяции кильдинской трески необходимы дополнительные исследования. В настоящее время по критериям угрозы исчезновения Красного списка МСОП (lUCN, 2012) кильдинская треска входит в наиболее угрожаемую категорию – критическое состояние (CR); в аналогичную категорию (КР – находящаяся под критической угрозой исчезновения) она занесена в Перечень объектов животного мира, занесенных в Красную книгу Российской Федерации (https://docs.cntd.ru/document/564578614). Это обусловлено её малым ареалом и постепенно суживающимся жизненным пространством из-за нарастания сероводородного слоя. Данная ситуация требует постоянного мониторинга как за состоянием экосистемы озера, так и за реакцией на его изменения со стороны кильдинской трески – результата уникального эксперимента природы (Титов, 2002; Zhivotovsky et al., 2016).
Дополнительная информация для этой статьи доступна по doi 10.31857/S0042875222030225 для авторизованных пользователей.
Список литературы
Андрияшев А.П. 1954. Рыбы северных морей СССР. М.; Л.: Изд-во АН СССР, 566 с.
Анциферов М.Ю., Трофимов А.Г. 2002. Гидрологические условия // Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО. С. 20–33.
Бойцов В.Д., Лебедь Н.И., Пономаренко В.П. и др. 2003. Треска Баренцева моря: биология и промысел. Мурманск: Изд-во ПИНРО, 296 с.
Бретт Дж. 1983. Факторы среды и рост // Биоэнергетика и рост рыб / Под ред. Хоар У. др. М.: Лег. и пищ. пром-сть. С. 275–345.
Воскобойникова О.С., Назаркин М.В., Голубова Е.Ю. 2012. Ранние стадии развития рыб северной части Охотского моря // Исследования фауны морей. Т. 68(76). С. 1–108.
Гуревич В.И. 1975. Рельеф, батиметрия, морфометрия // Реликтовое озеро Могильное. Л.: Наука. С. 18–21.
Гуревич В.И., Лийва А.А. 1975. Возраст оз. Могильного // Там же. С. 102–104.
Дерюгин К.М. 1925. Реликтовое озеро Могильное // Тр. Петергоф. естествен.-науч. ин-та. № 2. С. 1–98.
Догель В.А. 1936. Паразиты трески из озера Могильного // Уч. зап. ЛГУ. Сер. биол. Вып. 3. № 7. С. 123–133.
Есипов В.К. 1930. Треска озера Могильного на острове Кильдине в Баренцевом море // Гидробиол. журн. СССР. Т. 9. № 4−6. С. 131−137.
Карасев А.Б. 2002. Паразитофауна рыб // Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО. С. 81–87.
Коцубко Е.В., Кравченко А.С. 2002. Характеристика водосборной площади // Там же. С. 19.
Митяев М.В., Корсун С.А., Стрелков П.П., Матишов Г.Г. 2008. Древние береговые линии восточного Кильдина // ДАН. Т. 423. № 4. С. 546–550.
Мухина Н.В., Лепесевич Н.А., Филина Е.А. 2002. Биологическое состояние кильдинской трески // Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО. С. 88−109.
Никольский Г.В. 1971. Частная ихтиология. М.: Высш. шк., 472 с.
Новиков Г.Г., Строганов А.Н., Виноградский В.С. 2006. Морфобиологическая характеристика кильдинской трески // Тр. ББС МГУ. Т. 10. С. 110–116.
Озерецковский Н.Я. 1804. Описание Колы и Астрахани. СПб.: Изд-во Императ. АН, 82 с.
Орлова Э.Л., Долгов А.В. 2004. Многолетние аспекты пищевой стратегии трески в условиях нестабильной кормовой базы // Изв. ТИНРО. Т. 137. С. 85–100.
Расс Т.С. 1946. Ступени онтогенеза костистых рыб (Teleostei) // Зоол. журн. Т. 25. № 2. С. 137−148.
Световидов А.Н. 1948. Фауна СССР. Рыбы. Т. 9. Вып. 4. Трескообразные. М.; Л.: Изд-во АН СССР, 221 с.
Серебров Л.И., Игнашкин В.А. 2002. Оценка величины популяции кильдинской трески // Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО. С. 110–116.
Серебров Л.И., Дробышева С.С., Рочева Е.В., Долгов А.В. 2002. Численность и биомасса бентических бокоплавов в прибрежье // Там же. С. 77−81.
Строганов А.Н., Афанасьев К.И., Рубцова Г.А. и др. 2011. Данные по изменчивости микросателлитных локусов у кильдинской трески Gadus morhua kildinensis (Gadidae) // Вопр. ихтиологии. Т. 51. № 4. С. 459–466. https://doi.org/10.1134/S0032945211060087
Строганов А.Н., Мухина Н.В., Афанасьев К.И. и др. 2013. О комплексных экспедициях на оз. Могильное (о‑в Кильдин, Баренцево море) в 2011, 2012 гг. // Вестн. АГТУ. Сер. Рыб. хоз-во. № 3. С. 86−90.
Строганов А.Н., Криксунов Е.А., Зуйкова Н.В. т др. 2015. Особенности биологии кильдинской трески Gadus morhua kildinensis Derjugin, 1920 (Gadidae) // Биология моря. Т. 41. № 6. С. 395–402. https://doi.org/10.1134/S1063074015060140
Строганов А.Н., Афанасьев К.И., Бурменский В.А. и др. 2017. Механизмы адаптации кильдинской трески Gadus morhua kildinensis Derjugin, 1920 (Pisces: Gadidae) к специфическим условиям озера Могильное // Там же. Т. 43. № 2. С. 102–109. https://doi.org/10.1134/S1063074017020122
Тетерина А.А., Животовский Л.А. 2017. ДНК-маркеры для идентификации стационарного и мигрирующего экотипов атлантической трески Gadus morhua // Генетика. Т. 53. № 7. С. 872–876. https://doi.org/10.7868/S0016675817070128
Титов О.В. 2002. Заключение // Реликтовое озеро Могильное (исследования 1997–2000 гг.). Мурманск: Изд-во ПИНРО. С. 141−156.
Титов О.В., Серебров Л.И., Карасев А.Б. 2002. Введение // Там же. С. 3–17.
Фаусек В.А. 1891. На далеком севере: из поездки на Белое море и на океан // Вестн. Европы. № 8. С. 665–714.
Цееб Р.Я. 1975. Gadus morhua kildinensis Derjugin // Реликтовое озеро Могильное. Л.: Наука. С. 220–222.
Цееб Р.Я., Астафьева А.В. 1975. Морфология кильдинской трески // Там же. С. 259–276.
Цееб Р.Я., Поздняков Ю.Ф. 1975. Размножение // Там же. С. 227–247.
Чугунова Н.И. 1959. Руководство по изучению возраста и роста рыб. М.: Изд-во АН СССР, 164 с.
Шевлякова А.Д. 2017. Батометр: понятие, принцип действия и значение // Бюл. мед. Интернет-конференций. Т. 7. № 1. С. 312–313.
Шилин Н.И. 2001. Кильдинская треска Gadus morhua kildinensis Derugin, 1920 // Красная книга Российской Федерации. Животные. М.: АСТ Астрель. С. 308.
Andreev V., Fokin M., Mugue N., Strelkov P. 2015. Long-term persistence and evolutionary divergence of a marine fish population with a very small effective population size (Kildin cod Gadus morhua kildinensis) // Mar. Biol. V. 162. P. 979–992. https://doi.org/10.1007/s00227-015-2642-8
Auditore P.J., Lough R.G., Broughton E.A. 1994. A review of the comparative development of Atlantic cod (Gadus morhua L.) and haddock (Melanogrammus aeglefinus L.) based on an illustrated series of larvae and juveniles from Georges Bank // NAFO Sci. Coun. Stud. № 20. P. 7–18.
IUCN. 2012. Guidelines for application of IUCN Red List criteria at regional and national levels: version 4.0. Gland, Switzerland; Cambridge, UK: IUCN, 41 p.
Krasnova E.D., Efimov V.A., Fedyuk M.L. et al. 2019. New data on Lake Mogilnoe (Kildin Island, Barents Sea): the results of the 2018 expeditions // IOP Conf. Ser. Earth and Environ. Sci. V. 263. P. 1–8. https://doi.org/10.1088/1755-1315/263/1/012019.
Nordeide J.T., Johansen S.D., Jorgensen T.E. et al. 2011. Population connectivity among migratory and stationary cod Gadus morhua in the Northeast Atlantic – a review of 80 years of study // Mar. Ecol. Progr. Ser. V. 435. P. 269–283. https://doi.org/10.3354/meps09232
Strelkov P., Shunatova N., Fokin M. et al. 2014. Marine Lake Mogilnoe (Kildin Island, the Barents Sea): one hundred years of solitude // Polar Biol. V. 37. P. 297–310. https://doi.org/10.1007/s00300-013-1431-4
Strelkov P., Stogov I., Krasnova E. et al. 2019. Rapid unpredicted changes in the stratification of marine Lake Mogilnoe (Kildin Island, the Barents Sea) through the early 21-st century // Polar Res. V. 38. P. 1−7. https://doi.org/10.33265/polar.v38.3394
Wentzel-Larsen T., Nordeide J.T. 2001. Testing for homogeneity in sampling from sympatric noninterbreeding populations based on gene frequencies: the case of stationary and migratory cod // Sarsia. V. 86. P. 229–235. https://doi.org/10.1080/00364827.2001.10420479
Zhivotovsky L.A., Teterina A.A., Mukhina N.V. et al. 2016. Effects of genetic drift in a small population of Atlantic cod (Gadus morhua kildinensis Derjugin) landlocked in a meromictic lake: genetic variation and conservation measures // Conserv. Genet. V. 17. P. 229–238. https://doi.org/10.1007/s10592-015-0774-5
Дополнительные материалы
- скачать ESM_1.docx
- Приложение 1.
- скачать ESM_2.docx
- Приложение 2.
Инструменты
Вопросы ихтиологии


