Вопросы ихтиологии, 2022, T. 62, № 4, стр. 387-412
Особенности биологии массовых рыб в российских водах Чукотского моря. 1. Промысловая биомасса рыб. Семейство тресковые Gadidae
А. В. Датский 1, *, Е. В. Ведищева 1, А. О. Трофимова 1
1 Всероссийский научно-исследовательский институт рыбного
хозяйства и океанографии – ВНИРО
Москва, Россия
* E-mail: adatsky@vniro.ru
Поступила в редакцию 22.09.2021
После доработки 02.02.2022
Принята к публикации 02.02.2022
- EDN: TTZALI
- DOI: 10.31857/S0042875222040075
Аннотация
По результатам исследований 1995–2020 гг. выделены массовые и потенциально промысловые рыбы российских вод Чукотского моря. Из 72 видов, отмеченных в траловых уловах, 16 видов, принадлежащих шести семействам, являлись массовыми, среди которых абсолютно доминировали рыбы семейства тресковые (Gadidae), составляя в среднем 92.6% всей промысловой биомассы морских рыб. В конце 1990-х–начале 2000-х гг. основу запасов указанного семейства составляла сайка Boreogadus saida, в конце 2010-х гг. её биомасса существенно снизилась, однако значительно возросли запасы минтая Gadus chalcogrammus, обусловленные его миграциями из северной части Берингова моря. Для минтая, сайки, наваги Eleginus gracilis и трески G. macrocephalus проанализированы размерно-возрастные и весовые характеристики, особенности линейного и весового роста, сроки, масштабы и условия нереста. Проведено сравнение биологических показателей рыб из Чукотского и Берингова морей. Отмечено, что навага и треска в районе исследований представлены преимущественно молодью и неполовозрелыми особями. В составе минтая в 2018–2020 гг. помимо молоди в значительных количествах присутствовали рыбы длиной более 50 см в возрасте ≥ 7 лет. Сайка в пределах Чукотского шельфа отличалась меньшими размерами тела, нежели рыбы из северо-западной части Берингова моря.
Российская Арктика с её крайне суровыми природными условиями является стратегически значимым регионом в первую очередь по причине нахождения на арктическом шельфе до четверти неразведанных мировых запасов нефти и газа (Ковалев, Филиппова, 2010). Важную роль в этом регионе играют и возобновляемые биологические ресурсы. Именно значительные запасы морских рыб в западном секторе Арктики (преимущественно в Баренцевом море, в меньшей степени – в морях Белом, Карском и Лаптевых) позволяют проводить здесь многолетнее устойчивое рыболовство. К примеру, в 2020 г. в акватории этих морей было рекомендовано к вылову 56.84 тыс. т 45 единиц запасов рыб, в то время как в восточном секторе Арктики (Восточно-Сибирское, Чукотское моря) возможности промысла ограничивались 11 объектами рыболовства общим объёмом 3.91 тыс. т, притом что 3.9 тыс. т приходилось на один вид – сайку Boreogadus saida Чукотского моря.
Возрождение государственного интереса к арктическим морям привело к росту числа экспедиционных исследований и в первую очередь в Чукотском море, рыбопромысловая значимость которого до настоящего времени была слабо изучена. Если в 1990–2009 гг. в российской акватории моря было проведено пять комплексных траловых съёмок, то в последнее десятилетие столько же (три из них – в 2018–2020 гг.). Важным результатом регулярности проведения исследований явился факт обнаружения промысловых скоплений минтая Gadus chalcogrammus в юго-западной части Чукотского моря, что позволило в 2021 г. рекомендовать к вылову 37.2 тыс. т этого вида в режиме общего допустимого улова11.
Появление в 2018 г. и особенно в 2019–2020 гг. в российских водах Чукотского моря значительных запасов крупноразмерного минтая, который до этого практически не отмечался в ходе проводимых траловых исследований (Орлов и др., 2020), явилось следствием климатических и океанологических изменений в Беринговом и Чукотском морях в последние годы (Baker et al., 2020; Basyuk, Zuenko, 2020; Danielson et al., 2020; Плотников и др., 2020; Siddon et al., 2020). Общее потепление воздуха и морских вод, снижение площади морского льда и сокращение сроков его таяния, изменение циркуляций течений и состава кормовой базы способствовали перераспределению части скоплений минтая в северную часть Берингова моря с последующим их выходом через Берингов пролив в юго-западную часть Чукотского моря (Eisner et al., 2020; Nishio et al., 2020; Baker, 2021; Orlov et al., 2021). Повышение миграционной активности в северном направлении в пределах Берингова моря в конце 2010-х гг. отмечено и для тихоокеанской трески Gadus macrocephalus, сельди Clupea pallasii, горбуши Oncorhynchus gorbuscha, мойвы Mallotus villosus catervarius, молоди нерки O. nerka (Eisner et al., 2020; Farley et al., 2020; Yasumiishi et al., 2020; Датский, Самойленко, 2021). В целом изменение климата последнего десятилетия привело к значительным перестройкам в морских экосистемах, включая рыбные сообщества, что в значительной мере отразилось на распределении ресурсов рыб, их биомассы и биологии.
Уникальность российских вод Чукотского моря состоит в том, что, с одной стороны, на его водные массы оказывают мощное влияние тёплые и солёные трансформированные тихоокеанские воды, поступающие через Берингов пролив из Берингова моря, с другой стороны – холодные воды Северного Ледовитого океана и приходящие через пролив Лонга распреснённые воды Восточно-Сибирского моря (Думанская, 2017). Вполне вероятным представляется, что многие представители рыбных сообществ Чукотского моря могут реагировать на непостоянство среды обитания и являться некими индикаторами возможных перестроек в экосистеме этого водоёма и прилегающих к нему вод. В то же время даже по массовым рыбам, обитающим в акватории моря, отсутствует современная информация об особенностях их обитания, распределения и биологии (размерно-возрастной состав, темп роста, возраст и продолжительность созревания, сроки и масштабы нереста).
Цель исследования – выявить массовые и потенциально промысловые виды рыб в российских водах Чукотского моря, представить сравнительный анализ особенностей их биологии с аналогичными данными по рыбам из прилегающей акватории Берингова моря. В настоящей публикации (часть 1) приведены многолетние материалы по промысловой биомассе морских рыб и биологии представителей доминирующего в исследованной акватории семейства тресковые (Gadidae). В последующих работах (части 2 и 3) будут рассмотрены аналогичные данные по рыбам семейств камбаловые (Pleuronectidae), рогатковые (Cottidae), сельдевые (Clupeidae), корюшковые (Osmeridae) и лососёвые (Salmonidae), а также приведено итоговое заключение.
МАТЕРИАЛ И МЕТОДИКА
В работе использованы собранные в экспедициях данные по промысловой биомассе и биологии массовых видов рыб из российских вод Чукотского моря. Основой послужили материалы девяти комплексных траловых съёмок, выполненных в 1995–2020 гг. на научно-исследовательских судах Базы исследовательского флота ВНИРО (до 2018 г. − БИФ ТИНРО), в ходе которых выполнено 366 тралений. В целом в летне-осенний период исследованиями была охвачена значительная акватория российского сектора этого арктического моря, за исключением прибрежной мелководной части с глубинами < 26 м (табл. 1). Полученные данные по биологии рыб чукотского шельфа сопоставляли с материалами траловых съёмок в северо-западной части Берингова моря, представленными ранее (Датский, Андронов, 2007; Datsky, 2015b; Датский, 2016). Карта-схема российской акватории Чукотского моря и прилегающих к ней районов Берингова моря, в рамках которых проводили сравнение, приведена на рис 1. Координаты границы промысловой зоны “Чукотское море” на рисунке соответствуют указанным в приказе Минсельхоза22.
Таблица 1.
Площадь обследованной акватории, охват глубин, число тралений и пойманных видов рыб в Чукотском море в летне-осенний период 1995–2020 гг.
| Период исследований | Площадь района исследований, тыс. км2 | Глубины, м | Число | |
|---|---|---|---|---|
| тралений | видов рыб | |||
| 20–22.08.1995 г. | 87.0 | 40–52 | 8 | 9 |
| 25.08–02.09.1997 г. | 161.1 | 26–56 | 41 | 16 |
| 24–30.08.2003 г.* | 46.7 | 30–55 | 18 | 14 |
| 11–21.08.2007 г.* | 140.4 | 30–55 | 40 | 21 |
| 02–08.09.2008 г.* | 93.8 | 30–55 | 25 | 25 |
| 07–17.09.2010 г. | 104.5 | 45–54 | 38 | 17 |
| 31.08–10.09.2018 г. | 36.3 | 43–270 | 54 | 58 |
| 10–28.08.2019 г. | 229.2 | 27–267 | 80 | 42 |
| 26.08–04.09.2020 г. | 59.7 | 43–68 | 62 | 46 |
| Весь период | >229.2 | 26–270 | 366 | 72 |
Рис. 1.
Карта-схема российских вод Чукотского и отдельных районов северо-западной части Берингова морей: (⚫) – места научных тралений в 1995–2020 гг., (– –) – граница промысловой зоны “Чукотское море”, (–·–) – морская государственная граница России. Обозначения районов: ЧМ – Чукотское море, БЧ – бассейн Чирикова; СА, ЦА, ЗА – соответственно северная, центральная и западная части Анадырского залива; КР – Корякский район.

В Чукотском море вследствие суровых природных условий и отсутствия рыбопромысловой деятельности в отличие от Берингова моря, где биологические характеристики рыб фиксировали с помощью различных орудий лова в течение практически всего календарного года (Датский, Андронов, 2007; Датский, 2016, 2017а, 2017б; Датский, Мазникова, 2017), сбор материала осуществляли в ограниченные сроки (август–сентябрь) исключительно тралами. В ходе комплексных съёмок использовали донные и пелагические тралы со вставкой из мелкоячеистой дели в кутцевой части (ячея 10 мм) для эффективного облова молоди рыб с продолжительностью тралений по 30 мин. Траловые съёмки в 2003, 2007, 2008 гг. были пелагическими, в прочие годы – донными. В целях выяснения перспектив рыболовства минтая в южной части моря в начале сентября 2020 г. проведены также пять тралений вышеуказанным пелагическим тралом (но без мелкоячеистой вставки) продолжительностью по 3 ч.
Используя данные из рейсовых отчётов, в которых общая биомасса рыб была определена методом площадей (Аксютина, 1968) или модифицированным методом страт по ячейкам Вороного−Дирхле (Борисовец и др., 2003) по величине среднего улова на км2 обследованной акватории с дифференцированными коэффициентами уловистости трала (Макрофауна…, 2012), выявляли массовые и потенциально промысловые виды рыб. Для этого была рассчитана их промысловая биомасса – часть общих запасов гидробионтов, состоящая преимущественно из половозрелых особей, достигших промысловых размеров и, соответственно, представляющая интерес в рамках организации промышленного и прибрежного рыболовства. Отметим, что из-за отсутствия достаточных сведений по массовому созреванию рыб при достижении определенных длины тела и возраста, а также соответствующих биологических обоснований по определению минимальных промысловых размеров рыбных ресурсов в пределах Чукотского моря в работе использованы имеющиеся материалы по другим акваториям Дальневосточного рыбохозяйственного бассейна33. Таким образом, помимо информации о массово встречающихся в уловах видах (но зачастую представленных непромысловыми особями), получены новые данные о потенциально промысловых рыбах. Отметим, что массовыми считали рыб с частотой встречаемости в траловых уловах более 50% (Шейко, Федоров, 2000), если они соответствовали этому критерию по итогам исследований хотя бы одного года; потенциально промысловыми – виды, которые на данный момент не используются промыслом, но могут быть вовлечены в него при определенных условиях без ущерба для их воспроизводства.
При описании биологии рыб использованы данные 53945 тыс. промеров длины тела, 7367 тыс. биологических анализов (полных или только со вскрытием), 1343 тыс. определений возраста. Для размерно-весовой характеристики у всех рыб измеряли длину тела по Смитту (FL) с точностью до 1 см и определяли общую массу тела. Полный биологический анализ проводили не только для модальных размерных групп, но и у крупных и мелких особей обоих полов. Для этого целенаправленно отбирали по 5–10 экз. самцов и такое же количество самок на 1 см размерного ряда. В большинстве рейсов представителей ихтиофауны взвешивали на электронных весах Marel (“Marel”, Исландия), предназначенных для работы в условиях морской качки, с погрешностью 0.1 г. Соотношение полов, размерно-возрастной состав, распределение рыб по стадиям зрелости гонад представлены среднеарифметическими значениями относительных величин по годам.
Возраст определён по отолитам у 1343 рыб (сайка, минтай, северная палтусовидная камбала Hippoglossoides robustus и треска – соответственно 684, 478, 177 и 4 экз.). Возраст северной палтусовидной камбалы определяли в лабораторных условиях по целым отолитам (вне зависимости от их размера) с применением стереомикроскопа Olympus SZX 12 (“Olympus”, Япония) с использованием анализа изображений Cell в проходящем сквозь отолит свете (Lear, Ritt, 1975; Bowering, Nedreaаs, 2001; ICES, 2017). Для крупных отолитов камбал и всех отолитов тресковых применяли метод “break and burn”, широко используемый в исследованиях как тресковых рыб, так и камбал (Chilton, Beamish, 1982; Brodziak, Mikus, 2000; Буслов, Варкентин, 2001; Золотов, 2006; Fey, Weslawski, 2017). Согласно этой методике, отолит разламывали пополам и обжигали в пламени спиртовки, затем просматривали в отражённом свете с подсчётом годовых колец как совокупности светлой и темной зон.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Промысловая биомасса массовых рыб российских вод Чукотского моря
Проведённые ранее исследования (Datsky, 2015a) показали, что только 42 вида ихтиофауны российских вод Чукотского моря (38.2% учтённых видов рыб) постоянно встречаются в орудиях лова. Дополненные современными результатами траловых съёмок материалы уточнили число таких видов до 72 в основном за счёт расширения исследовательских работ в северной части моря (табл. 1). В то же время только 16 видов из шести семейств являлись в разные годы относительно массовыми и формирующими значимую биомассу, среди которых абсолютно доминировали тресковые рыбы (табл. 2), составляя в среднем 92.6% всей промысловой биомассы морских рыб. Следует отметить, что, если в конце 1990-х–начале 2000-х гг. основу запасов представителей этого семейства составляла сайка, то в конце 2010-х гг. её биомасса существенно снизилась, однако резко возросли запасы минтая, обусловленные, как уже говорилось выше, его миграциями в район исследования из северной части Берингова моря.
Таблица 2.
Промысловая биомасса (тыс. т) морских рыб в российских водах Чукотского моря по данным донных (1997, 2010, 2018–2020 гг.) и пелагических (2003, 2007, 2008 гг.) траловых съёмок
| Семейство, вид | 1997 | 2003 | 2007 | 2008 | 2010 | 2018 | 2019 | 2020 |
|---|---|---|---|---|---|---|---|---|
| Gadidae: | 366.000 | 156.100 | 18.900 | 0.730 | 15.007 | 44.286 | 428.580 | 369.895 |
| Gadus chalcogrammus | 0 | 0 | 0 | 0.070 | 0.157 | 31.598 | 380.00 | 364.700 |
| Boreogadus saida | 366.000 | 156.100 | 18.090 | 0.660 | 14.850 | 12.600 | 48.500 | 5.134 |
| Eleginus gracilis | 0 | 0 | 0 | 0 | 0 | 0 | 0.080 | 0.030 |
| Gadus macrocephalus | 0 | 0 | 0 | 0 | 0 | 0.088 | 0 | 0.031 |
| Pleuronectidae: | 16.280 | 0 | 0 | 0 | 0.817 | 3.857 | 17.240 | 6.745 |
| Hippoglossoides robustus | 16.280 | 0 | 0 | 0 | 0.580 | 3.716 | 17.240 | 6.585 |
| Pleuronectes quadrituberculatus | 0 | 0 | 0 | 0 | 0.236 | 0.123 | 0 | 0.115 |
| Limanda aspera | 0 | 0 | 0 | 0 | 0 | 0.015 | 0 | 0.014 |
| Platichthys stellatus | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.030 |
| Reinhardtius hippoglossoides | 0 | 0 | 0 | 0 | 0.001 | 0.003 | 0 | 0.001 |
| Osmeridae: | 0 | 4.720 | 0.480 | 3.216 | 0 | 0.784 | 0 | 0.726 |
| Mallotus villosus catervarius | 0 | 4.720 | 0.480 | 3.216 | 0 | 0.784 | 0 | 0.722 |
| Osmerus mordax dentex | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.004 |
| Cottidae: | 4.870 | 0 | 0 | 0.200 | 2.214 | 0.643 | 0 | 0.512 |
| Myoxocephalus verrucosus | 4.870 | 0 | 0 | 0.200 | 2.214 | 0.643 | 0 | 0.512 |
| Clupeidae: | 0.120 | 0 | 0.080 | 0.040 | 0.513 | 0.020 | 0.392 | 0.052 |
| Clupea pallasii | 0.120 | 0 | 0.080 | 0.040 | 0.513 | 0.020 | 0.392 | 0.052 |
| Salmonidae: | 0 | 0 | 0 | 1.250 | 0 | 0 | 0 | 0 |
| Oncorhynchus keta | 0 | 0 | 0 | 0.980 | 0 | 0 | 0 | 0 |
| O. tshawytscha | 0 | 0 | 0 | 0.150 | 0 | 0 | 0 | 0 |
| O. nerka | 0 | 0 | 0 | 0.120 | 0 | 0 | 0 | 0 |
| Всего | 387.270 | 160.820 | 19.460 | 5.436 | 18.551 | 49.590 | 446.212 | 377.930 |
Рыбы прочих семейств не так многочисленны, однако в отдельные годы биомассы некоторых из них (мойва, северная палтусовидная камбала, бородавчатый керчак Myoxocephalus verrucosus) превышали запасы тресковых рыб, включая сайку и минтая. Дополнительно можно упомянуть ещё одного из наиболее массовых представителей ихтиофауны Чукотского моря – арктического шлемоносца Gymnocanthus tricuspis, который по причине мелких размеров интереса для рыболовства представлять не может.
В качестве пояснения к данным табл. 2 следует отметить, что треска, навага и камбаловые рыбы (Pleuronectidae), входящие в состав донно-придонных сообществ, предсказуемо не встречались в уловах разноглубинных тралов в 2003, 2007 и 2008 гг. И, наоборот, лососёвые (Salmonidae), обитающие преимущественно в поверхностных водных массах, не попадались в донные тралы. В то же время минтай, сайка, сельдь и мойва, формирующие значительные скопления в пелагиали, по причине мелководности шельфа Чукотского моря в отдельные годы зарегистрированы в промысловых количествах и у дна. Такая особенность характерна для этих видов и в других районах их обитания (Шунтов и др., 1993; Датский, Андронов, 2007; Николаев и др., 2008; Кузнецов и др., 2013; Лобода, Жигалин, 2017; Великанов, 2018).
В целом можно с большой долей вероятности говорить о том, что вышеуказанные виды морских рыб в той или иной мере формируют основу ихтиофауны российских вод Чукотского моря. При этом известные значения биомассы некоторых из них (в первую очередь, наваги Eleginus gracilis, мойвы, зубастой корюшки Osmerus mordax dentex, кеты O. keta, нерки, звёздчатой камбалы Platichthys stellatus) могут измениться в сторону увеличения при условии расширения акватории и сроков исследований, типов применяемых орудий лова. Также необходимо уточнить, что сайка, навага, северная палтусовидная и звёздчатая камбалы, сельдь, мойва, корюшка и бородавчатый керчак с большой долей вероятности могут считаться постоянными обитателями Чукотского моря. В то же время минтай, треска, черный палтус, прочие виды камбал и тихоокеанские лососи являются временными обитателями чукотского шельфа, численность и биомасса которых здесь во многом зависят от абиотических и биотических факторов среды и интенсивности их миграций из Берингова моря. Следуя этому, по-видимому, сырьевую базу морских рыб в указанном водоёме нельзя признать устойчивой для возможного использования промыслом, притом что в отдельные годы она может быть весьма значительной и востребованной для различных видов рыболовства.
Особенности биологии рыб российских вод Чукотского моря. Семейство тресковые (Gadidae)
Минтай. До начала 2000-х гг. информация о встречаемости и биологии минтая в акватории Чукотского моря практически отсутствовала. Эпизодические сведения свидетельствовали о присутствии в юго-западной части моря незначительного количества молоди (преимущественно сеголетки), которая попадала сюда посредством тёплых течений через Берингов пролив из Берингова моря, где находятся основные нерестилища и нагульные акватории группировок этого вида (Wolotira et al., 1977; Шунтов и др., 1993; Степаненко, 1997; Грицай, 2003; Степаненко, Грицай, 2016, 2018). Климатические изменения в 2000–2010-х гг. (особенно значительные в 2017–2019 гг.) привели к перераспределению минтая: его более низкая численность по сравнению с историческими средними показателями отмечена в южных районах шельфа Берингова моря с одновременным увеличением численности половозрелых особей на севере моря (Eisner et al., 2020; Baker, 2021). Адаптация минтая к меняющимся условиям среды вкупе с поисками более доступной кормовой базы, по-видимому, и привели к миграциям части этих рыб на шельф Чукотского моря, о чём и свидетельствуют наши данные (рис. 2).
Рис. 2.
Размерный (а–е) и возрастной (ж–м) состав минтая Gadus chalcogrammus в траловых уловах в российских водах Чукотского моря: а, ж – август 2003 г. (M = 57.9 см, средний возраст 9.4 года, n = 63 экз.); б, з – август 2007 г. (M = 9.6 см, 0.6 года, n = 39 экз.); в, и – сентябрь 2008 г. (M = 10.8 см, 0.7 года, n = 32 экз.); г, к – сентябрь 2018 г. (M = 39.8 см, 6.0 года, n = 944 экз.); д, л – август 2019 г. (M = 51.6 см, 8.1 года, n = 3957 экз.); е, м – август–сентябрь 2020 г.: (◼) и (◻) – донные научные траления (M = 43.4 см, 6.7 года; n = 5080 экз.), (–○–) – пелагические промысловые траления (M = 54.1 см, 8.5 года, n = 886 экз.).

Так, в 2003 г. получены первые сведения о нахождении в районе чукотского шельфа особей минтая FL > 40 см, среди которых преобладали рыбы FL 50–60 см (58.7% всех уловов) в возрасте 7–10 лет (рис. 2а, 2ж). В 2007–2008 гг. в траловых уловах, за редким исключением, обнаружены особи FL 7–14 см с некоторым доминированием годовалых рыб (рис. 2б, 2в, 2з, 2и). В 2018–2020 гг. в уловах опять появился половозрелый минтай с преобладанием рыб FL 50–65 см: в разные годы их доля составляла 52.8–74.4%. Его возраст находился в пределах 1–16 лет с превалированием 8–10-годовалых особей поколения 2007–2012 гг. (рис. 2г–2е, 2к–2м). Учитывая небольшие глубины района исследований, размерно-возрастные характеристики минтая, пойманного у дна и в толще воды, имели значительное сходство, за исключением меньшего количества молоди и сверхкрупных особей FL > 65 см в возрасте 13–15 лет в уловах пелагических тралений (рис. 2е, 2м). Полученные данные по появлению половозрелого минтая в определенные годы в пределах чукотского шельфа вполне согласуются с материалами, свидетельствующими о чередовании тёплых (2002–2005, 2014–2019) и холодных (2006–2013) лет (Andrews et al., 2016; Baker et al., 2020; Danielson et al., 2020; Yasumiishi et al., 2020; Baker, 2021).
В целом за весь период исследований в российских водах Чукотского моря отмечено доминирование рыб FL 9–14 и 50–65 см в возрасте 2, 8–12 лет, доля которых превышала 82% (рис. 3). Отличительной особенностью нагуливающегося здесь минтая явилось практически полное отсутствие особей FL 22–45 см 2–5-годовалого возраста. В то же время в прилегающей к чукотскому шельфу акватории северо-западной части Берингова моря эти рыбы составляли ≥ 69% всех уловов, а старшевозрастной минтай, наоборот, отмечался в минимальных количествах (рис. 3в, 3е). Отметим, что осреднённый размерно-возрастной состав рыб в пелагиали и у дна в пределах чукотского шельфа различался незначительно: лишь во втором биотопе отмечена повышенная доля годовалых особей и рыб в возрасте 8–9 лет (рис. 3а–3д). В смежном Беринговом море распределение минтая в толще воды существенно отличалось: в пелагиали доминировали рыбы FL 25–40 см с модой 33–35 см в возрасте 2–4 года, у дна минтай сосредоточивался более равномерно с увеличенным присутствием особей FL 9–18 и 37–43 см соответственно в возрасте 2–3 и 5–6 лет. Объяснение этому видится в физико-географических особенностях северо-западной части Берингова моря, где наряду с обширным мелководным Анадырским заливом имеется значительный свал глубин южнее м. Наварин, благоприятный для нагула среднеразмерного минтая.
Рис. 3.
Размерный (а–в) и возрастной (г–е) состав минтая Gadus chalcogrammus в совокупных выборках из пелагических (а, г), донных (б, д) и смешанных (в, е) траловых уловов в российских водах в 1996–2020 гг.: (◼), (◻) – Чукотское море; (–○–) – Берингово море.

Учитывая, что минтай появляется в районе исследований в результате миграционных процессов через Берингов пролив из Берингова моря, проведено сопоставление размерно-возрастного состава рыб из различных акваторий северо-западной части Берингова моря с материалами по Чукотскому морю (рис. 1, 4). Отмечено, что наиболее сходен размерно-возрастной состав минтая в чукотских водах и центральной части Анадырского залива, что во многом обусловлено особенностями рельефа дна и схемой течений в этих акваториях. В обоих случаях имеется относительно пологий мелководный шельф (Удинцев и др., 1959; Моисеев, Гринфельдт, 2019), благоприятный для нагула минтая FL > 50 см и старше возраста 7+, а формированию скоплений сеголеток и годовалых рыб здесь способствует тёплое Наваринское течение (Датский, Андронов, 2007; Кузнецов и др., 2013). Это же течение содействует накоплению эвфаузиид (Euphasiidae) и копепод (Copepoda) – основы питания молоди минтая (Шунтов и др., 1993; Орлов и др., 2019). Нахождение крупноразмерных рыб в центральной части залива обусловлено наличием доступных для питания песчанок Ammodytes hexapterus и углохвостых креветок Pandalus goniurus (Згуровский, Хен, 1988; Чикилев, Датский, 2000; Андронов, Датский, 2019), а в чукотских водах помимо вышеуказанных видов – многочисленных мелких видов бычков рода Gymnocanthus и люмпена Фабриция Lumpenus fabricii. В целом миграциям половозрелого минтая в российские воды Чукотского моря в 2018–2020 гг. способствовали общее потепление воздушных и водных масс, снижение площади морского льда и сроков его таяния, характерные для конца 2010-х гг. (Baker et al., 2020; Danielson et al., 2020; Carvalho et al., 2021), и достаточная доступная кормовая база именно в этой части шельфа моря (Сиренко, Гагаев, 2007; Слабинский, Фигуркин, 2014; Grebmeier et al., 2015; Кузнецова, Горбатенко, 2021). К примеру, в американском секторе моря, по данным траловых съёмок 2017 и 2019 гг., крупный минтай также встречался, однако его численность была минимальной (Farley et al., 2017; личное сообщение И.В. Григорова).
Рис. 4.
Размерный (а–д) и возрастной (е–к) состав минтая Gadus chalcogrammus в донных траловых уловах в российских водах в 2001, 2019 гг.: (‑ ‑), (◻) – Чукотское море (M = 51.6 см, средний возраст 8.1 года, n = 3957 экз.); (—), (◼) – Берингово море: а, е – бассейн Чирикова (M = 15.8 см, 1.3 года, n = 409 экз.); б, ж – северная (M = 48.4 см, 8.2 года, n = 4567 экз.); в, з – центральная (M = 23.5 см, 2.9 года, n = 7912 экз.); г, и – западная (M = 33.7 см, 4.2 года, n = = 14167 экз.) части Анадырского залива; д, к – Корякский район (M = 20.3 см, 1.7 года, n = 51159 экз.).

Неполовозрелые особи в траловых уловах на шельфе Чукотского моря имели FL 7.5–24.0 см и массу тела 1–10 г. Среди половозрелых рыб самки были крупнее самцов, их FL составляла 25.3–82.0 см, масса – 106–4950 г. Самцы FL 25.0–76.1 см и массой 97–2506 г встречались в меньших количествах (в два–три раза), чем самки (табл. 3). Бо́льшие размеры самок и преобладание их среди старшевозрастного минтая характерны для вида в целом, что подтверждаются данными из других районов обитания рыб (Шунтов и др., 1993; Датский, 2016). Зависимость массы (W, г) минтая от длины (FL, см) в районе исследований хорошо описывается уравнением W = 0.004FL3.1335 (r = 0.99, n = = 606 экз.). Наиболее близко это соотношение к рыбам центральной части Анадырского залива: W = 0.0031 FL3.1802 (r = 0.94, n = 52 экз.).
Таблица 3.
Длина, масса и соотношение полов у минтая Gadus chalcogrammus в российских водах Чукотского моря
| Сроки работ | n, экз. | Длина (FL), см | Масса, г | Соотношение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполо- возрелые |
Половозрелые | Неполо- возрелые |
Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| Август 2007 | 40 | $\frac{{7.5{\kern 1pt} --{\kern 1pt} 11.1}}{{9.2}}$ | $\frac{{}}{{75.0}}$ | – | $\frac{{}}{{75.0}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 8.0}}{{4.4}}$ | .$\frac{{}}{{2914}}$ | – | $\frac{{}}{{2914}}$ | – |
| Сентябрь 2008 | 3 | $\frac{{21.0{\kern 1pt} --{\kern 1pt} 24.0}}{{22.5}}$ | $\frac{{}}{{72.0}}$ | – | $\frac{{}}{{72.0}}$ | $\frac{{60.0{\kern 1pt} --{\kern 1pt} 100.0}}{{80.0}}$ | $\frac{{}}{{2132}}$ | – | $\frac{{}}{{2132}}$ | – |
| Сентябрь 2010 | 1 | – | $\frac{{}}{{82.0}}$ | – | $\frac{{}}{{82.0}}$ | – | $\frac{{}}{{4950}}$ | – | $\frac{{}}{{4950}}$ | – |
| Август–сентябрь 2018 | 174 | $\frac{{10.0{\kern 1pt} --{\kern 1pt} 23.8}}{{17.8}}$ | $\frac{{25.3{\kern 1pt} --{\kern 1pt} 73.5}}{{56.7}}$ | $\frac{{25.0{\kern 1pt} --{\kern 1pt} 65.2}}{{55.8}}$ | $\frac{{25.0{\kern 1pt} --{\kern 1pt} 73.5}}{{56.5}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 97.0}}{{37.3}}$ | $\frac{{106{\kern 1pt} --{\kern 1pt} 3030}}{{1403}}$ | $\frac{{97{\kern 1pt} --{\kern 1pt} 1950}}{{1292}}$ | $\frac{{97{\kern 1pt} --{\kern 1pt} 3030}}{{1370}}$ | 2.3 : 1.0 |
| Август 2019 | 391 | – | $\frac{{47.0{\kern 1pt} --{\kern 1pt} 80.0}}{{60.5}}$ | $\frac{{45.0{\kern 1pt} --{\kern 1pt} 76.1}}{{57.8}}$ | $\frac{{45.0{\kern 1pt} --{\kern 1pt} 80.0}}{{59.8}}$ | – | $\frac{{120{\kern 1pt} --{\kern 1pt} 3295}}{{1522}}$ | $\frac{{695{\kern 1pt} --{\kern 1pt} 2100}}{{1381}}$ | $\frac{{120{\kern 1pt} --{\kern 1pt} 3295}}{{1486}}$ | 2.9 : 1.0 |
| Август–сентябрь 2020 | 905 | $\frac{{9.8{\kern 1pt} --{\kern 1pt} 21.4}}{{14.0}}$ | $\frac{{45.7{\kern 1pt} --{\kern 1pt} 78.9}}{{59.0}}$ | $\frac{{43.8{\kern 1pt} --{\kern 1pt} 69.2}}{{55.2}}$ | $\frac{{43.8{\kern 1pt} --{\kern 1pt} 78.9}}{{57.7}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 67.0}}{{20.9}}$ | $\frac{{643{\kern 1pt} --{\kern 1pt} 3538}}{{1523}}$ | $\frac{{498{\kern 1pt} --{\kern 1pt} 2506}}{{1237}}$ | $\frac{{498{\kern 1pt} --{\kern 1pt} 3538}}{{1428}}$ | 2.0 : 1.0 |
Примечание. Здесь и в табл. 6, 8: над чертой – пределы варьирования показателя, под чертой – среднее значение; здесь и в табл. 4, 6, 8: “–” – данные отсутствуют; здесь и в табл. 4–8: n – число рыб.
Рост минтая в течение жизни неравномерен. По данным 2018–2019 гг., наибольшие приросты длины тела рыб на шельфе Чукотского моря отмечались на 2-м и 3-м годах жизни: соответственно по 8.0 и 3.9 см в год. Также довольно высокие темпы линейного роста отмечены на 8-м году жизни (3.7–4.8 см), далее они снижаются у сверхкрупных рыб FL > 70 см в возрасте 13 лет и старше. Прирост по массе максимален у 8- и 10–11-годовалых особей: соответственно по 240–250 и 237–521 г (табл. 4).
Таблица 4.
Длина и масса минтая Gadus chalcogrammus разного возраста в российских водах Чукотского моря по данным 2018–2019 гг.
| Возраст, годы | 2018 г. | 2019 г. | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Длина (FL), см | Масса, г | n, экз. | Длина (FL), см | Масса, г | n, экз. | |||||
| min–max | М | min–max | М | min–max | М | min–max | М | |||
| 1 | 10–11 | 10.7 | 6–8 | 7 | 7 | – | – | – | – | 0 |
| 2 | 15–24 | 18.7 | 16–88 | 41 | 33 | – | – | – | – | 0 |
| 3 | 18–31 | 22.6 | 32–169 | 78 | 18 | – | – | – | – | 0 |
| 4 | – | – | – | – | 0 | – | – | – | – | 0 |
| 5 | – | – | – | – | 0 | – | – | – | – | 0 |
| 6 | – | – | – | – | 0 | 47–49 | 48.0 | 625–715 | 670 | 2 |
| 7 | 53–54 | 53.4 | 1036–1220 | 1128 | 2 | 48–54 | 50.8 | 692–1170 | 939 | 21 |
| 8 | 51–58 | 54.7 | 886–1550 | 1215 | 6 | 47–58 | 53.7 | 695–1380 | 1068 | 49 |
| 9 | 55–66 | 59.5 | 1074–2026 | 1467 | 20 | 51–62 | 57.4 | 915–210 | 1310 | 75 |
| 10 | 55–65 | 60.1 | 948–1920 | 1461 | 19 | 52–66 | 59.9 | 1085–2060 | 1513 | 87 |
| 11 | 60–74 | 63.9 | 1311–3030 | 1982 | 8 | 55–70 | 63.4 | 120–2450 | 1750 | 74 |
| 12 | 62–69 | 66.0 | 1950–2613 | 2311 | 4 | 59–72 | 66.4 | 1440–2930 | 1984 | 28 |
| 13 | – | – | – | – | 0 | 65–78 | 70.2 | 1510–2835 | 2155 | 12 |
| 14 | – | – | – | – | 0 | 67–80 | 71.9 | 1730–3295 | 2339 | 9 |
| 15 | – | – | – | – | 0 | – | 74.0 | – | 2135 | 1 |
Результаты в целом подтверждают жизненную стратегию минтая, когда в первые два–три года особям характерен наибольший линейный прирост с постепенным его снижением к семи годам. Это связано с периодом полового созревания, когда значительная часть энергии расходуется не на рост, как в первые три года жизни, а на созревание половых продуктов. В возрасте 8–9 лет спектр питания минтая значительно меняется, он переходит на питание преимущественно рыбными объектами, что, несомненно, способствует увеличению линейного и весового прироста. При приближении к предельному возрасту все функции организма вида начинают работать для поддержания необходимого обмена веществ (Датский, 2016), при этом в пределах своего ареала минтай может достигать FL 91 см, массы 5.2 кг и возраста 28 лет (Eschmeyer et al., 1983; Munk, 2001; Датский, 2016). Отметим также, что минтай, пойманный на шельфе Чукотского моря, по сравнению с рыбами северо-западной части Берингова моря в возрасте < 13 лет имел меньший темп прироста длины (рис. 5), что, вероятно, свидетельствует о менее благоприятных для него условиях обитания на северной периферии ареала.
Рис. 5.
Линейный рост минтая Gadus chalcogrammus в российских водах Чукотского и северо-западной части Берингова морей в 1995–2019 гг.: (‑ ‑) – Чукотское море (FL = 11.199t0.7322, r = 0.98, n = 478 экз.), (—) – Берингово море (FL = = 17.812t0.5447, r = 0.96, n = 1783 экз.).

Информация по размножению минтая в Чукотском море отсутствует. Ближайший к исследованной акватории район нереста вида зарегистрирован на севере Анадырского залива (Датский, 2004). Период икрометания в пределах Берингова моря растягивается на семь месяцев (с февраля по сентябрь) (Датский, Андронов, 2007). В то же время сравнительно большая доля рыб с гонадами VI−II стадии зрелости указывает на недавний нерест минтая. Косвенным подтверждением этого можно считать присутствие в августе–сентябре его личинок в северо-восточной части Чукотского моря (Logerwell et al., 2020), что может быть результатом их выноса в эту акваторию течениями. Наибольшее количество отнерестившихся особей встречалось в августе, к сентябрю их доля закономерно снижалась (табл. 5), самки в посленерестовом состоянии преобладали над самцами. Отнерестившиеся рыбы активно нагуливались, созревая: в августе до 18% самок и 48% самцов имели гонады III стадии зрелости, в сентябре доли этих рыб возросли соответственно до 49 и 71%.
Таблица 5.
Распределение минтая Gadus chalcogrammus по стадиям зрелости гонад в российских водах Чукотского моря в августе–сентябре, %
| Месяц, год | Пол | Стадия зрелости гонад | n, экз. | ||||
|---|---|---|---|---|---|---|---|
| II | III | IV | V | VI–II | |||
| Август, 2007 | Самки | 100 | 0 | 0 | 0 | 0 | 1 |
| Самцы | 0 | 0 | 0 | 0 | 0 | 0 | |
| Сентябрь, 2008 | Самки | 0 | 100 | 0 | 0 | 0 | 1 |
| Самцы | 0 | 0 | 0 | 0 | 0 | 0 | |
| Сентябрь, 2010 | Самки | 0 | 100 | 0 | 0 | 0 | 1 |
| Самцы | 0 | 0 | 0 | 0 | 0 | 0 | |
| Сентябрь, 2018 | Самки | 2.4 | 48.8 | 0 | 1.2 | 47.6 | 82 |
| Самцы | 14.3 | 71.4 | 5.7 | 0 | 8.6 | 35 | |
| Август, 2019 | Самки | 3.4 | 17.5 | 2.4 | 1.8 | 74.9 | 291 |
| Самцы | 5.0 | 33.0 | 1.0 | 0 | 61.0 | 10 | |
| Август, 2020 | Самки | 1.1 | 12.7 | 0.9 | 0.7 | 84.6 | 558 |
| Самцы | 1.4 | 47.7 | 0 | 0.4 | 50.5 | 279 | |
Сайка – криопелагический вид, который в отличие от минтая постоянно живёт и размножается в арктических водах (Мантейфель, 1943; Боркин и др., 1987; Новиков и др., 1992; Карамушко, 2020). Климатические перестройки в сторону потепления привели как к значительному сокращению ареала этого вида в конце 2010-х гг. в северной части Берингова моря и Чукотском море (Савин, 2021; Baker, 2021), так и к общему снижению промысловой биомассы рыб (табл. 1), однако сайка по-прежнему является одним из массовых видов рыбных сообществ чукотского шельфа.
В российских водах Чукотского моря встречались рыбы FL 3–29 см в возрасте 0+–6+. При этом в период высокой численности основу уловов сайки в 1995, 1997 и 2003 гг. составляли в основном (~88.4–92.5%) 2–3-годовалые особи FL 11–19 см (рис. 6а–6в). В последующем численность таких рыб снизилась до 74.1–78.0%, в пелагиали отмечено большое количество сеголеток FL 4–7 см (рис. 6г–6и), что в целом характерно и для северо-восточной части моря (De Robertis et al., 2017). Суммарный размерный ряд сайки характеризовался наличием двух максимумов: рыбы FL 5–7 и 9–15 см. В итоге при сопоставлении обобщённых за ряд лет данных выявлены бо́льшие размеры особей, встреченных у дна (рис. 7). Это подтверждают и более ранние исследования сайки Чукотского моря (Николаев и др., 2008; Helser et al., 2017; Савин, 2021).
Рис. 6.
Размерный состав сайки Boreogadus saida в траловых уловах в российских водах Чукотского моря: а – август 1995 г. (M = 15.9 см, n = 816 экз.), б – август–сентябрь 1997 г. (M = 14.9 см, n = 958 экз.), в – август 2003 г. (M = 11.8 см, n = 2261 экз.), г – август 2007 г. (M = 8.7 см, n = 4589 экз.), д – сентябрь 2008 г. (M = 6.7 см, n = 1734 экз.), е – сентябрь 2010 г. (M = 11.4 см, n = 3910 экз.), ж – сентябрь 2018 г. (M = 11.7 см, n = 3943 экз.), з – август 2019 г. (M = 13.3 см, n = 436 экз.); и – август–сентябрь 2020 г.: (◼) – донные научные траления (M = 11.8 см, n = 3264 экз.), (–○–) – пелагические промысловые траления (M = 11.1 см, n = 41 экз.).
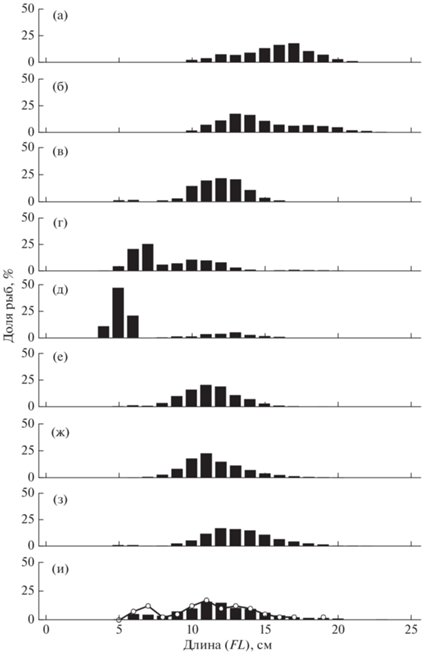
Рис. 7.
Размерный состав сайки Boreogadus saida в совокупных выборках из пелагических (а), донных (б) и смешанных (в) траловых уловов в российских водах Чукотского (◼) и Берингова (◻) морей в 1996–2020 гг.

В сравнительном плане сайка Чукотского моря мельче рыб, обитающих в северо-западной части Берингова моря. В последнем помимо вышеуказанных размерных группировок выделялись крупноразмерные особи FL 17–21 см, представленные в основном 4-годовиками, при этом наибольшие различия отмечены между рыбами, пойманными в пелагиали (рис. 7). По данным других исследований, в центральной части Анадырского залива Берингова моря встречалась сайка с максимальной FL 32 см (Савин, 2021), в морях Восточно-Сибирском, Лаптевых, Карском, Бофорта и Баренцевом – соответственно 20, 28, 31, 40 и 40 см (Шлейник, 1979; Coad, Reist, 2004; Антонов и др., 2016; Глебов и др., 2016; Горбатенко, Кияшко, 2019). В последнем случае это была рыба массой тела 430 г в возрасте 10 лет (Шлейник, 1979).
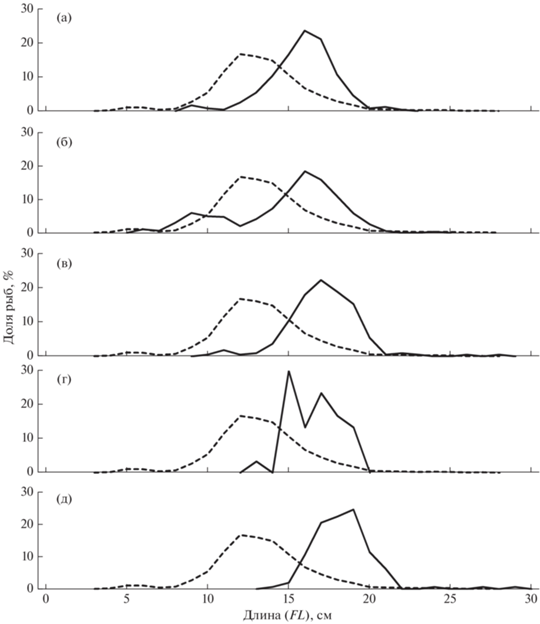
Считается (Бондарев, 1970), что сайка образует единую чукотско-беринговоморскую группировку и при условии её высокой численности могут происходить нагульные миграции преимущественно старшевозрастных рыб из Чукотского моря в Берингово, как правило, при условии года холодного типа (Фадеев, 1986; Николаев и др., 2008). Действительно, сайка в водах северо-западной части Берингова моря несколько крупнее рыб, встречающихся на чукотском шельфе, особенно в юго-западной части Анадырского залива и у корякского побережья (рис. 8). В то же время в северной части залива в значительных количествах отмечены и мелкоразмерные особи FL 5–10 см (рис. 8б). С учётом того, что с 2007 г. биомасса сайки значительно снизилась и её скопления практически исчезли в районе Берингова пролива (Николаев и др., 2008; Орлов и др., 2019), можно предположить, что в северной части Анадырского залива в холодных водных массах зимнего происхождения обитает относительно самостоятельная группировка вида. В годы высокой численности она может пополняться производителями из Чукотского моря, а нерест её проходит в заливе Креста северо-западной части Берингова моря. Приуроченность скоплений сайки к этой акватории отмечали и по картам распределения в разные годы исследований (Датский, Андронов, 2007). При этом масштабы миграций в большей степени находятся в зависимости от урожайности отдельных поколений и общей численности вида.
Рис. 8.
Размерный состав сайки Boreogadus saida в донных траловых уловах из российских вод в 2001 и 2019 гг.: (‑ ‑) – Чукотское море (M = 13.3 см, n = 4360 экз.); (—) – Берингово море: а – бассейн Чирикова (M = 16.9 см, n = 242 экз.); б–г – соответственно северная (M = 15.9 см, n = 1097 экз.), центральная (M = 18.2 см, n = 224 экз.) и западная (M = 17.6 см, n = 30 экз.) части Анадырского залива; д – Корякский район (M = 19.3 см, n = 161 экз.).
Размеры неполовозрелых особей в траловых уловах на шельфе Чукотского моря составляли 3.4–12.9 см при массе тела от 1 до 11 г. Самки за все годы наблюдений были крупнее самцов, достигая предельных длины и массы 28.2 см и 149 г. (табл. 6). Эта особенность характерна для вида в границах его ареала: все особи максимального размера и возраста (7–8 лет) были представлены исключительно самками (Боркин и др., 1987; Карамушко, 2020). Ещё одной закономерностью был тот факт, что сайка из донных уловов имела бо́льшие размерно-весовые параметры тела, нежели рыбы из пелагических скоплений. Это отмечено практически во все годы наблюдений как в смешанных уловах, так и отдельно у самок и самцов. Зависимость длина–масса у сайки в пределах Чукотского шельфа следующая: W = 0.0056FL3.0774 (r = 0.98, n = 3052 экз.).
Таблица 6.
Длина, масса и соотношение полов у сайки Boreogadus saida в российских водах Чукотского моря
| Сроки работ | n, экз. | Длина (FL), см | Масса, г | Соотношение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполово-зрелые | Половозрелые | Неполово-зрелые | Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| Август 1995 | 50 | – | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 20.0}}{{16.5}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 19.0}}{{16.4}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 20.0}}{{16.4}}$ | – | – | – | – | 1.0 : 1.1 |
| Август–сентябрь 1997 | 932 | $\frac{{6.6{\kern 1pt} --{\kern 1pt} 12.9}}{{9.8}}$ | $\frac{{10.6{\kern 1pt} --{\kern 1pt} 25.4}}{{15.2}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 25.9}}{{14.4}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 25.9}}{{14.6}}$ | – | – | – | – | 1.1 : 1.0 |
| Август 2003 | 627 | $\frac{{6.5{\kern 1pt} --{\kern 1pt} 10.4}}{{9.3}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 24.9}}{{14.7}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 23.5}}{{13.1}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 24.9}}{{13.9}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 9.0}}{{5.5}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 125.0}}{{29.5}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 112.0}}{{19.5}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 125.0}}{{24.7}}$ | 1.1 : 1.0 |
| Август 2007 | 835 | $\frac{{3.4{\kern 1pt} --{\kern 1pt} 10.4}}{{7.3}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 24.0}}{{15.1}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 23.0}}{{13.8}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 24.0}}{{14.6}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 9.0}}{{2.9}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 108.0}}{{31.3}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 88.0}}{{21.5}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 108.0}}{{26.9}}$ | 1.3 : 1.0 |
| Сентябрь 2008 | 136 | $\frac{{7.5{\kern 1pt} --{\kern 1pt} 10.2}}{{9.3}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 20.0}}{{14.0}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 20.0}}{{13.2}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 20.0}}{{13.6}}$ | $\frac{{2.0{\kern 1pt} --{\kern 1pt} 11.0}}{{5.5}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 66.0}}{{24.8}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 73.0}}{{19.7}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 73.0}}{{22.4}}$ | 1.1 : 1.0 |
| Сентябрь 2010 |
50 | $\frac{{9.2{\kern 1pt} --{\kern 1pt} 11.6}}{{10.8}}$ | $\frac{{12.4{\kern 1pt} --{\kern 1pt} 25.4}}{{17.7}}$ | $\frac{{11.7{\kern 1pt} --{\kern 1pt} 21.0}}{{15.5}}$ | $\frac{{11.7{\kern 1pt} --{\kern 1pt} 25.4}}{{16.8}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 10.0}}{{9.2}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 25.0}}{{17.7}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 21.0}}{{15.5}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 25.0}}{{16.8}}$ | 1.3 : 1.0 |
| Август–сентябрь 2018 | 1017 | $\frac{{6.9{\kern 1pt} --{\kern 1pt} 11.2}}{{9.2}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 25.9}}{{14.7}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 25.7}}{{13.8}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 25.9}}{{14.3}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 10.0}}{{4.9}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 149.0}}{{24.4}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 120.0}}{{20.2}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 149.0}}{{22.6}}$ | 1.3 : 1.0 |
| Август 2019 | 392 | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 10.2}}{{8.9}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 26.7}}{{16.2}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 26.1}}{{14.8}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 26.7}}{{15.6}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 8.0}}{{4.5}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 120.0}}{{33.2}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 125.0}}{{26.1}}$ | $\frac{{5.0{\kern 1pt} --{\kern 1pt} 125.0}}{{30.1}}$ | 1.3 : 1.0 |
| Август–сентябрь 2020 | 793 | $\frac{{5.2{\kern 1pt} --{\kern 1pt} 10.0}}{{8.4}}$ | $\frac{{10.1{\kern 1pt} --{\kern 1pt} 28.2}}{{16.1}}$ | $\frac{{10.3{\kern 1pt} --{\kern 1pt} 22.9}}{{15.2}}$ | $\frac{{10.1{\kern 1pt} --{\kern 1pt} 28.2}}{{15.7}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 9.0}}{{4.7}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 139.0}}{{34.0}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 84.0}}{{27.7}}$ | $\frac{{6.0{\kern 1pt} --{\kern 1pt} 139.0}}{{31.2}}$ | 1.2 : 1.0 |
По сравнению с другими представителями семейства тресковых сайка растёт медленно, в возрасте 5 лет достигает FL 18–20 см, в возрасте 7 лет – 25–27 см (Бенко, Пономаренко, 1972). В Чукотском и Беринговом морях выявлен высокий темп линейного роста у младших возрастных групп, который снижается в период наступления половой зрелости на 3-м году жизни (Черкасова, 1976). Более медленный рост сайки после 2–3-летнего возраста указан и для моря Бофорта (Craig et al., 1982) и зал. Аллена в Канадской Арктике (Matley et al., 2013). Поступательное снижение ежегодного абсолютного прироста длины после достижения половой зрелости выявлено и для сайки Баренцева моря (Шлейник, 1979).
В отличие от линейного роста абсолютный прирост массы тела сайки с возрастом постоянно увеличивается, и максимальное приращение массы происходит после наступления половой зрелости рыб, что, несомненно, является важным условием продуцирования максимального количества половых продуктов и увеличения популяционной плодовитости. Для моря Лаптевых, к примеру, особенно заметно увеличивался относительный темп весового роста рыб FL 20–23 см в возрасте 5–6 лет: от 7 до 16 г ежегодно (Карамушко, 2020). В пределах российских вод чукотского шельфа наибольший прирост массы отмечен у рыб FL 19–24 см, когда на каждый сантиметр длины тела их масса увеличивалась на 9–11 г.
Сайка относится к быстросозревающим рыбам и достигает половой зрелости в 2–3-годовалом возрасте при FL ~ 13 см (Москаленко, 1964; Боркин и др., 1987). Для рыб, обитающих в юго-восточной прибрежной части Баренцева моря, морях Карском и Лаптевых, созревание в возрасте двух лет происходит в диапазоне FL 8–14 см (Москаленко, 1964; Карамушко, 2020). В Чукотском море сезонное созревание гонад в августе–сентябре происходит у обоих полов, начиная с размерного класса 8–9 см и достигая 50%-ного созревания у самцов при FL 16 см, у самок – 19 см и более (Савин, 2021). Как и у всех тресковых, у сайки среди рыб мелких размеров встречается больше самцов, с возрастом начинают преобладать самки, которые крупнее самцов. Самки в скоплениях также численно превосходят самцов – соотношение полов 1.1–1.3 : 1.0 (табл. 6).
В морях Чукотском и Бофорта сайка впервые нерестится при FL ~ 12.5 см в возрасте 3 лет (Frost, Lowry, 1983) вблизи берегов, в основном в январе–феврале, подо льдом (Мантейфель, 1943; Мусиенко, 1970). При этом мнение о более раннем нересте рыб в пределах Чукотского и северной части Берингова морей (в октябре–декабре) не нашло своего подтверждения (Черкасова, 1976; Савин, 2021). По нашим данным, производители сайки в августе характеризовались наличием гонад преимущественно II стадии зрелости, начиная массово (более 50% проанализированных рыб) созревать (стадия III) только в сентябре. Среди таких особей было больше самцов (табл. 7), что лишь подтверждает их более раннюю готовность к размножению: у сайки в частности и у тресковых рыб в целом.
Таблица 7.
Распределение сайки Boreogadus saida по стадиям зрелости гонад в российских водах Чукотского моря в августе–сентябре, %
| Месяц и год | Пол | Стадия зрелости гонад | n, экз. | |||
|---|---|---|---|---|---|---|
| II | III | IV | VI–II | |||
| Август 1995 | Самки | 70.8 | 29.2 | 0 | 0 | 24 |
| Самцы | 38.5 | 61.5 | 0 | 0 | 26 | |
| Август 1997 | Самки | 100 | 0 | 0 | 0 | 454 |
| Самцы | 99.0 | 0.5 | 0.5 | 0 | 429 | |
| Август 2003 | Самки | 99.6 | 0.4 | 0 | 0 | 256 |
| Самцы | 99.6 | 0.4 | 0 | 0 | 237 | |
| Август 2007 | Самки | 99.1 | 0.9 | 0 | 0 | 227 |
| Самцы | 99.4 | 0.6 | 0 | 0 | 170 | |
| Сентябрь 2008 | Самки | 35.4 | 64.6 | 0 | 0 | 48 |
| Самцы | 13.9 | 86.1 | 0 | 0 | 43 | |
| Сентябрь 2010 | Самки | 94.7 | 5.3 | 0 | 0 | 19 |
| Самцы | 100 | 0 | 0 | 0 | 13 | |
| Сентябрь 2018 | Самки | 45.2 | 54.2 | 0.4 | 0.2 | 484 |
| Самцы | 43.9 | 54.5 | 0.8 | 0.8 | 364 | |
| Август 2019 | Самки | 86.4 | 0.9 | 0 | 12.7 | 212 |
| Самцы | 73.5 | 21.1 | 0 | 5.4 | 166 | |
| Август 2020 | Самки | 63.4 | 36.6 | 0 | 0 | 396 |
| Самцы | 43.3 | 56.7 | 0 | 0 | 334 | |
Информация о размножении этого вида в российской части Чукотского моря отсутствует, при этом в северо-восточной части моря в августе–сентябре зарегистрированы личинки сайки (Logerwell et al., 2020). В Беринговом море участки нереста вида располагаются преимущественно в северной части Анадырского залива, в зал. Креста и у Берингова пролива (Бондарев, 1970). Здесь же над глубинами 37–63 м при температуре –1.9…0.4°С концентрируются личинки и мальки FL соответственно 8–19 и 20–40 мм (Булатов, 1986).
Навага среди тресковых рыб дальневосточных морей и прилегающих акваторий имеет относительно небольшие размеры тела, занимая промежуточное положение между мелкой сайкой и более крупными минтаем и треской. Предельные длина, масса и возраст этого вида в основном не превышают соответственно 57 см, 1.3 кг и 15 лет (Датский, Андронов, 2007). У арктического побережья Канады навага достигает FL 63 см (Coad, Reist, 2004). Максимальные размеры отмечены у рыб из вод у западного побережья Камчатки и северо-западной части Берингова моря, в то время как в Чукотском море FL наваги не превышает 37 см, масса – 420 г, возраст – 15 лет (Семененко, 1965).
Действительно, на чукотском шельфе навага была представлена в траловых уловах преимущественно сеголетками и годовалыми особями FL 5–16 см (рис. 9). Причём если использовать данные 2020 г., то сеголетки FL 5–9 см предпочитали толщу воды, а годовалые рыбы бóльших размеров тела концентрировались у дна. В указанном году в уловах впервые отмечены особи FL 16–25 см, правда поимки таких рыб были единичными (рис. 9г).
Рис. 9.
Размерный состав наваги Eleginus gracilis в траловых уловах в российских водах Чукотского моря: а – сентябрь 2008 г. (M = 7.7 см, n = 74 экз.), б – сентябрь 2018 г. (M = 9.4 см, n = 43 экз.), в – август 2019 г. (M = 10.3 см, n = 3 экз.); г – август–сентябрь 2020 г.: (◼) – донные научные траления (M = 12.7 см, n = 157 экз.); (–○–) – пелагические промысловые траления (M = 7.2 см, n = 51 экз.).

Ещё более заметна разница в размерах наваги из юго-западной части Чукотского моря и северо-западной части Берингова моря (рис. 10). Помимо невысокой численности этого вида в донных траловых уловах в пределах чукотского шельфа здесь встречалась почти исключительно молодь FL 5–19 см в возрасте 0+–2+ (99.7%), которая в более южной акватории составляла лишь незначительную долю (10.8%) при доминировании особей FL 29–39 см (69.8%) в возрасте 4–6 лет (Датский, 2016). При этом в юго-восточной части Чукотского моря, по данным 2012 г., в уловах донного и разноглубинного тралов отмечена навага FL 3–34 см в возрасте 0+–7+ с высокой встречаемостью (до 50% у дна) рыб FL > 19 см (Helser et al., 2017).
Рис. 10.
Размерный состав наваги Eleginus gracilis в донных траловых уловах в российских водах в 1996–2020 гг.: (◼) – Чукотское море (M = 12.0 см, n = 203 экз.), (◻) – Берингово море (M = 31.3 см, n = 4179 экз.).

Размерный состав наваги существенно менялся в северном направлении (рис. 11). Если в Олюторско-Наваринском районе основу скоплений составляли рыбы FL 30–44 см (около 87% всех уловов) и лишь незначительная доля приходилась на молодь и впервые созревающих особей, то в западной части Анадырского залива рыб FL > 30 см почти не было, а доминировали особи FL 18–25 см (93.3%). На севере залива навага имела ещё меньшие размеры тела, абсолютно преобладали сеголетки FL 5–7 см (>66%), другие размерные группы были представлены в уловах незначительно. Присутствие молоди здесь можно объяснить близостью зал. Креста, топография дна, берегов и гидрологический режим которого, вероятно, благоприятствуют размножению наваги и последующему обитанию сеголеток. Не исключено, что в дальнейшем часть последних выносится течениями из северной части Анадырского залива в район бассейна Чирикова и отчасти в Чукотское море. В целом тенденция снижения размеров наваги в уловах с продвижением на север подтверждается и данными из восточных частей Берингова и Чукотского морей (De Robertis et al., 2017).
Рис. 11.
Размерный состав наваги Eleginus gracilis в донных траловых уловах в российских водах в 2001, 2018–2020 гг.: (‑ ‑) – Чукотское море (M = 12.0 см, n = 203 экз.); (—) – Берингово море: а, б – соответственно северная (M = 10.8 см, n = 213 экз.) и западная (M = 22.1 см, n = 208 экз.) части Анадырского залива; в – Корякский район (M = 35.3 см, n = = 3413 экз.).

Учитывая, что молодь предпочитает мелководные участки, а с глубиной возрастает доля крупных рыб (Датский, 2016), можно предположить, что чукотский шельф в пределах российских вод является акваторией нагула преимущественно неполовозрелых рыб. Для взрослых представителей вида здесь, вероятно, недостаточно благоприятных для нереста мелководных бухт и заливов (за исключением Нешканской лагуны и Колючинской губы, на выходе из которых и отмечены небольшие скопления наваги), сказываются и суровые условия среды в районе исследования.
Наибольший линейный рост наваги отмечен в первые четыре года её жизни, после чего ежегодно увеличение длины тела не превышает 2–3 см. Существенное возрастание её массы происходит в 5–8-летнем возрасте, в последующем приросты незначительны (Датский, 2016). В Чукотском море навага растёт медленнее, нежели в северной части Берингова моря, особенно в более молодом возрасте (до возраста 3+). Её средняя FL в восточной части чукотского шельфа в возрасте 0+, 1+, 2+, 3+ и 4+ не превышает соответственно 5–7, 13, 20, 24 и 28 см, в то время как на севере Берингова моря в пределах американских вод – 9, 17, 23, 25 и 28 см (Helser et al., 2017). Ещё более высокий темп линейного роста отмечен у наваги в Олюторско-Наваринском районе Берингова моря: в возрасте 3+ и 4+ она достигает FL соответственно 33 и 38 см (Датский, 2016).
Половая зрелость у дальневосточной наваги наступает в конце второго года жизни при FL 18–26 см. Наиболее позднее половое созревание в Чукотском море отмечено у обладающих низким темпом роста рыб Нешканской лагуны: у большей части особей на 4–5-м году по достижении FL > 21 см (Сафронов, 1986). Созревание гонад наваги начинается в августе и заканчивается к зиме, причём самцы готовятся к процессу размножения быстрее самок (Датский, 2016). В нашем случае в августе–сентябре все исследованные рыбы имели гонады II стадии зрелости, самки преобладали численно над самцами при более крупных размерах тела (табл. 8). Зависимость длина–масса для наваги описывается уравнением: W = 0.0019FL3.5346 (r = 0.98, n = 15 экз.).
Таблица 8.
Длина, масса и соотношение полов наваги Eleginus gracilis в российских водах Чукотского моря
| Сроки работ | n, экз. | Длина (FL), см | Масса, г | Соотношение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполо-возрелые | Половозрелые | Неполо-возрелые | Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| Сентябрь 2008 | 3 | – | – | – | $\frac{{11.0{\kern 1pt} --{\kern 1pt} 13.0}}{{11.7}}$ | – | – | – | $\frac{{10.0{\kern 1pt} --{\kern 1pt} 20.0}}{{13.3}}$ | – |
| Август–сентябрь 2018 | 12 | – | – | – | $\frac{{7.3{\kern 1pt} --{\kern 1pt} 14.3}}{{9.1}}$ | – | – | – | $\frac{{2.0{\kern 1pt} --{\kern 1pt} 20.0}}{{5.5}}$ | – |
| Август–сентябрь 2020 | 29 | $\frac{{10.8{\kern 1pt} --{\kern 1pt} 13.6}}{{12.5}}$ | $\frac{{11.0{\kern 1pt} --{\kern 1pt} 24.5}}{{14.6}}$ | $\frac{{12.2{\kern 1pt} --{\kern 1pt} 16.4}}{{14.2}}$ | $\frac{{11.0{\kern 1pt} --{\kern 1pt} 24.5}}{{14.2}}$ | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 19.0}}{{15.3}}$ | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 103.0}}{{24.7}}$ | $\frac{{15.0{\kern 1pt} --{\kern 1pt} 32.0}}{{19.6}}$ | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 103.0}}{{22.7}}$ | 1.6 : 1.0 |
В декабре–феврале навага нерестится при отрицательных температурах воды: –1.0…–1.9°С (Булатов, 1986; Сафронов, 1986). В бухтах и заливах Чукотского п-ова в пределах беринговоморских вод нерестящихся особей в наибольших количествах регистрировали в начале декабря. В восточной части Чукотского моря отмечены единичные поимки личинок данного вида (Logerwell et al., 2020).
Тихоокеанская треска – промысловая рыба, достигающая в пределах ареала FL 120 см, массы 22.7 кг и возраста 25 лет (Morrow, 1980; Lamb, Edgell, 1986; Munk, 201) и встречающаяся при промысле в российских водах преимущественно при FL 30–60 см в возрасте 3–6 лет (Богданов, 2006). На мелководных участках беринговоморского шельфа, включая бухты и заливы, образует скопления, как правило, молоди и впервые созревающих рыб FL < 40 см, в меньшей степени – средне- и старшевозрастных особей, которые предпочитают глубины > 10 м (Датский, Андронов, 2007). Вероятно, по этой причине особенности чукотского шельфа (обширные площади дна с малыми глубинами, слабая изрезанность береговой линии, суровые океанологические условия) не способствуют формированию здесь скоплений половозрелой трески.
Как и в случае с навагой, в районе исследований в основном присутствует неполовозрелая треска FL 10–17 и 5–9 см соответственно у дна и в пелагиали в возрасте 0+–1+ (рис. 12). Появлению незначительного количества молоди, по-видимому, благоприятствуют тёплые течения через Берингов пролив из Берингова моря, откуда она выносится на шельф Чукотского моря. В то же время в отличие от минтая общее потепление последних лет незначительно отразилось на масштабах миграции половозрелой трески на периферию ареала, хотя её основные скопления в Беринговом море также сместились севернее обычного (Stevenson, Lauth, 2019; Baker, 2021). Если в начале 2000-х гг. треска отсутствовала в траловых уловах в пределах чукотского шельфа и по нашим данным, и по материалам других исследователей (Mecklenburg et al., 2016), то в 2018–2020 гг. появившейся здесь молоди FL 10–18 см сопутствовали лишь немногочисленные особи FL 55–78 см (табл. 2, рис. 12). Ещё более наглядным это представлено при сравнении размерных рядов рыб с шельфов Чукотского и Берингова морей (рис. 13). Хорошо заметно, что в последней акватории обитает треска всех размеров, что указывает на более благоприятные здесь условия обитания вида в отличие от района исследований. Наиболее крупные скопления таких рыб отмечены вдоль корякского побережья и в западной части Анадырского залива, в северо-восточном направлении зарегистрировано снижение численности среднеразмерной трески в уловах с увеличением доли неполовозрелых особей (рис. 14). На чукотский шельф помимо молоди мигрируют в основном рыбы предельных размеров, по большей части из прилегающих бухт Чукотского п-ова, в которых они, вероятно, ведут оседлый придонный образ жизни, что в целом характерно для трески и минтая (Шунтов и др., 1993). И в этом случае можно предположить, что значительные по биомассе миграции старшевозрастного минтая в район исследований в 2018–2020 гг. препятствуют нагулу здесь трески, которая ограничена не столько межгодовой изменчивостью температуры придонных водных масс, сколько наличием доступной кормовой базы (Baker, 2021). При этом составы пищи минтая и трески FL > 50 см в северо-западной части Берингова моря довольно схожи: их основу помимо десятиногих ракообразных (Decapoda) и двустворчатых моллюсков (Bivalvia) (только у трески) составляют рыбные объекты, такие как сайка, мойва, песчанка Ammodytes hexapterus, молодь минтая (Датский, Андронов, 2007).
Рис. 12.
Размерный состав трески Gadus macrocephalus в траловых уловах в российских водах Чукотского моря: а – август 2007 г. (M = 6.6 см, n = 23 экз.), б – сентябрь 2018 г. (M = 24.4 см, n = 31 экз.), в – август 2019 г. (M = 24.0 см, n = 16 экз.); г – август–сентябрь 2020 г.: (◼) – донные научные траления (M = 13.1 см, n = 6 экз.), (–○–) – пелагические промысловые траления (M = 7.0 см, n = 2 экз.).

Рис. 13.
Размерный состав трески Gadus macrocephalus в донных траловых уловах в российских водах в 2001–2020 гг.: (◼) – Чукотское море (M = 20.0 см, n = 53 экз.), (◻) – Берингово море (M = 44.6 см, n = 593 экз.).

Рис. 14.
Размерный состав трески Gadus macrocephalus в донных траловых уловах в российских водах в 2001, 2018 и 2019 гг.: (‑ ‑) – Чукотское море (M = 23.0 см, n = 53 экз.); (—) – Берингово море: а–в – соответственно северная (M = 48.9 см, n = 58 экз.), центральная (M = 49.3 см, n = 12 экз.) и западная (M = 41.9 см, n = 93 экз.) части Анадырского залива; г – Корякский район (M = 44.3 см, n = 431 экз.).

Среди немногочисленных представителей трески неполовозрелые особи имели FL 6–18 см при массе 1–48 г (к примеру, рыбы FL 14 и 18 см в возрасте 1+ имели массу соответственно 22 и 48 г). Старшевозрастные рыбы, по данным 2018–2019 гг., были представлены самками FL 75 и 77 см массой тела соответственно 5305 и 5318 г и самцами FL 55, 71 и 78 см массой соответственно 270, 4790 и 4110 г. Все они, кроме особи FL 55 см, находились на 7-м году жизни. Соотношение полов было приблизительно равным. Размерно-весовая зависимость трески в пределах Чукотского шельфа следующая: W = 0.0053FL3.1915 (r = 0.99, n = 23 экз.).
Самки трески впервые достигают половой зрелости при FL 55–85 см, самцы – 48–80 см, соответственно в 3–8- и 4–9-годовалом возрасте (Ким Сен Ток, 1998; Фадеев, 2005). Массовое половое созревание рыб (≥50% особей) происходит при средней FL 70 см в 6-годовалом возрасте (Фадеев, 2005). В Беринговом море, в наиболее близкой акватории к району исследований, треска в массе созревает в возрасте 5–7 лет при FL самок и самцов соответственно 60–65 и 55–65 см (Вершинин, 1987; Witherell, 2000; Винников и др., 2013).
По мере готовности рыб к размножению нерест трески и последующее развитие икры и личинок в пределах ареала происходят с января по май, как правило, в период льдообразования (Моисеев, 1953). На севере Берингова моря сроки нереста смещаются к весне (с марта по май), причём в холодные по гидрологическим условиям годы его окончание возможно и в летний период (Датский, 2016). Это, по-видимому, верно и для чукотского шельфа, где большинство самок и самцов трески имело гонады, свидетельствующие о недавнем окончании нереста (стадия зрелости VI–II). У единичных особей (самки) половые продукты находились на стадии начала созревания.
Нерестовые участки трески в Чукотском море до настоящего момента не обнаружены, но, учитывая отсутствие в этой акватории большого числа производителей, можно предположить, что вид в небольших масштабах нерестится лишь в заливах и бухтах Чукотского п-ова южнее Берингова пролива (заливы Лаврентия, Мечигменский, Ткачен, бухты Пэнгигнгэй, Аболишева). На отсутствие (или незначительные площади) участков нереста в Чукотском море и прилегающих акваторий указывают и исследования в восточной части моря, когда среди многочисленных сборов икры, личинок и сеголеток рыб, принадлежащих к 11 семействам, включая тресковых, треска не обнаружена (Logerwell et al., 2020). В Беринговом море основные нерестилища трески расположены за пределами прибрежных вод, где икрометание приурочено к глубинам 10–250 м и температуре 0–3°С. Личинки трески встречаются в июне над глубинами 160–130 м при температуре воды 1.7–2.2°С. Количественные показатели невелики: максимальная плотность личинок составляет в Наваринском районе – 6, в восточной части моря – 5 экз/м2. В июне размеры личинок варьируют в пределах 10.0–15.6 мм (Булатов, 1986).
Список литературы
Аксютина З.М. 1968. Элементы математической оценки результатов наблюдений в биологических и рыбохозяйственных исследованиях. М.: Пищ. пром-сть, 289 с.
Андронов П.Ю., Датский А.В. 2019. Бентос // Экосистемы Берингова пролива и факторы антропогенного воздействия. М.: Всемир. фонд дикой природы (WWF). С. 101−111.
Антонов Н.П., Кузнецов В.В., Кузнецова Е.Н. и др. 2016. Сайка Boreogadus saida (Gadiformes, Gadidae) как ключевой вид и потенциальный объект рыбного промысла в Карском море // Вопр. рыболовства. Т. 17. № 2. С. 203–212.
Бенко Ю.К., Пономаренко В.П. 1972. Основные промысловые рыбы Баренцева, Норвежского и Гренландского морей (биология, уловы). Мурманск: Изд-во ПИНРО, 144 с.
Богданов Г.А. 2006. Тихоокеанская треска. Вопросы биологии и запасы. М.: ИПФ “Сашко”, 136 с.
Бондарев Б.М. 1970. Описание сайки // Сайка. Петропавловск-Камчатский: Камчат. отд. Дальневост. кн. изд-ва. С. 3–9.
Борисовец Е.Э., Вдовин А.Н., Панченко В.В. 2003. Оценки запасов керчаков по данным учетных траловых съемок залива Петра Великого // Вопр. рыболовства. Т. 4. № 1(13). С. 157–170.
Боркин И.В., Пономаренко В.П., Третьяк В.А., Шлейкин В.Н. 1987. Сайка Boreogadus saida (Lepechin) – рыба полярных морей (запасы и использование) // Биологические ресурсы Арктики и Антарктики. М.: Наука. С. 183–207.
Булатов О.А. 1986. Распределение икры и личинок тресковых в тихоокеанских водах Камчатки и западной части Берингова моря // Тресковые дальневосточных морей. Владивосток: Изд-во ТИНРО. С. 89–101.
Буслов А.В., Варкентин А.И. 2001. Сравнительная характеристика оценок возраста и некоторых популяционных параметров минтая при использовании чешуи и отолитов // Изв. ТИНРО. Т. 128. С. 164–176.
Великанов А.Я. 2018. Дальневосточная мойва: распределение, особенности биологии, динамика биомассы, проблемы и перспективы промыслового освоения // Вопр. рыболовства. Т. 19. № 3. С. 30–326.
Вершинин В.Г. 1987. О биологии и современном состоянии запасов трески северной части Берингова моря // Биологические ресурсы Арктики и Антарктики. М.: Наука. С. 207–224.
Винников А.В., Терентьев Д.А., Батанов Р.Л. 2013. Биологическое обоснование установления промысловой меры для тихоокеанской трески в Дальневосточном рыбохозяйственном бассейне // Тихоокеанская треска дальневосточных вод России. М.: Изд-во ВНИРО. С. 263−266.
Глебов И.И., Надточий В.А., Савин А.Б. и др. 2016. Результаты комплексных исследований в Восточно-Сибирском море в августе 2015 г. // Изв. ТИНРО. Т. 186. С. 81–92. https://doi.org/10.26428/1606-9919-2016-186-81-92
Горбатенко К.М., Кияшко С.И. 2019. Состав зоопланктона и трофический статус гидробионтов моря Лаптевых и Восточно-Сибирского моря // Океанология. Т. 59. № 6. С. 987–997. https://doi.org/10.31857/S0030-1574596987-997
Грицай Е.В. 2003. Межгодовая изменчивость пространственной дифференциации и функционирование восточноберинговоморской популяции минтая // Изв. ТИНРО. Т. 133. С. 80–93.
Датский А.В. 2004. Размножение минтая Theragra chalcogramma (Gadidae) в Анадырском заливе // Вопр. рыболовства. Т. 5. № 4(20). С. 597−617.
Датский А.В. 2016. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 1. Семейство Тресковые (Gadidae) // Вопр. ихтиологии. Т. 56. № 6. С. 705–725. https://doi.org/10.7868/S0042875216050039
Датский А.В. 2017а. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 2. Семейства Долгохвостовые (Macrouridae), Сельдевые (Clupeidae), Корюшковые (Osmeridae) // Там же. Т. 57. № 1. С. 66–81. https://doi.org/10.7868/S0042875217010039
Датский А.В. 2017б. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 4. Семейство Рогатковые (Cottidae) // Там же. Т. 57. № 3. С. 251–263. https://doi.org/10.7868/S0042875217030031
Датский А.В., Андронов П.Ю. 2007. Ихтиоцен верхнего шельфа северо-западной части Берингова моря. Магадан: Изд-во СВНЦ ДВО РАН, 261 с.
Датский А.В., Мазникова О.А. 2017. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 3. Семейство Камбаловые (Pleuronectidae) // Вопр. ихтиологии. Т. 57. № 2. С. 154–181. https://doi.org/10.7868/S0042875217020072
Датский А.В., Самойленко В.В. 2021. Сырьевая база водных биологических ресурсов в российских водах Берингова моря и ее стоимость // Вопр. рыболовства. Т. 22. № 1. С. 64–99. https://doi.org/10.36038/0234-2774-2021-22-1-64-99
Думанская И.О. 2017. Ледовые условия морей азиатской части России. М.: Обнинск: ИГ-СОЦИН, 640 с.
Згуровский К.А., Хен Г.В. 1988. Распределение скоплений углохвостой креветки в зависимости от гидрологических условий северо-западной части Берингова моря // Промыслово-биологические исследования морских беспозвоночных. М.: Изд-во ВНИРО. С. 98–107.
Золотов А.О. 2006. Сравнение оценок возраста желтоперой (Limanda aspera Pallas) и северной двухлинейной (Lepidopsetta polyxystra Orr et Matareze) камбал западной части Берингова моря и восточного побережья Камчатки по чешуе и отолитам // Исслед. вод. биол. ресурсов Камчатки и северо-западной части Тихого океана. № 8. С. 198–206.
Карамушко Л.И. 2020. Биоэнергетика и рост морских видов рыб Арктики. Апатиты: Изд-во ФИЦ КНЦ РАН, 110 с. https://doi.org/10.37614/978.5.91137.438.9
Ким Сен Ток. 1998. Особенности биологии и численность тихоокеанской трески в водах западного побережья Сахалина и Южных Курильских островов // Изв. ТИНРО. Т. 124. С. 212−235.
Ковалев С.А., Филиппова С.Г. 2010. “Арктика – 2010” – новый шаг России // Рыб. хоз-во. № 5. С. 16–17.
Кузнецов М.Ю., Басюк Е.О., Чульчеков Д.Н., Сыроваткин Е.В. 2013. Распределение и гидрологические условия обитания минтая в северо-западной части Берингова моря в летне-осенний период // Изв. ТИНРО. Т. 174. С. 104–124.
Кузнецова Н.А., Горбатенко К.М. 2021. Питание сайки, минтая и других пелагических рыб и их пищевая обеспеченность в Чукотском море в августе–сентябре 2019 г. // Там же. Т. 201. № 4. С. 765–783. https://doi.org/10.26428/1606-9919-2021-201-765-783
Лобода С.В., Жигалин А.Ю. 2017. Результаты исследований тихоокеанской сельди в северо-западной части Берингова моря в 2010–2015 гг. // Там же. Т. 188. С. 125–139. https://doi.org/10.26428/1606-9919-2017-188-125-139
Макрофауна пелагиали западной части Берингова моря: таблицы встречаемости, численности и биомассы, 1982–2009 гг. 2012. Владивосток: Изд-во ТИНРО-центр, 479 с.
Мантейфель Б.П. 1943. Сайка и ее промысел. Архангельск: ОГИЗ, 31 с.
Моисеев А.Р., Гринфельдт Ю.С. 2019. Общие сведения // Экосистемы Берингова пролива и факторы антропогенного воздействия. М.: Всемир. фонд дикой природы (WWF). С. 14–16.
Моисеев П.А. 1953. Треска и камбалы дальневосточных морей // Изв. ТИНРО. Т. 40. 288 с.
Москаленко Б.К. 1964. О биологии полярной трески (сайки) Boreogadus saida (Lepechin) // Вопр. ихтиологии. Т. 4. Вып. 3(32). С. 433–443.
Мусиенко Л.Н. 1970. Размножение и развитие рыб Берингова моря // Тр. ВНИРО. Т. 70. С. 166–225.
Николаев А.В., Кузнецов М.Ю., Сыроваткин Е.В. 2008. Акустические исследования сайки (Boreogadus saida) в российских водах Берингова и Чукотского морей в 1999–2007 гг. // Изв. ТИНРО. Т. 155. С. 131–143.
Новиков Н.П., Снытко В.А., Долгих И.П. 1992. Промысловый атлас Дальневосточных морей. Владивосток: Изд-во ТИНРО, 120 с.
Орлов А.М., Бензик А.Н., Ведищева Е.В. и др. 2019. Рыбохозяйственные исследования в Чукотском море на НИС “Профессор Леванидов” в августе 2019 г.: некоторые предварительные результаты // Тр. ВНИРО. Т. 178. С. 206–220. https://doi.org/10.36038/2307-3497-2019-178-206-220
Орлов А.М., Савин А.Б., Горбатенко К.М. и др. 2020. Биологические исследования в российских дальневосточных и арктических морях в трансарктической экспедиции ВНИРО // Там же. Т. 181. С. 102–143. https://doi.org/10.36038/2307-3497-2020-181-102-143
Плотников В.В., Вакульская Н.М., Мезенцева Л.И. и др. 2020. Изменчивость ледовых условий в Чукотском море и их связь с арктической осцилляцией // Изв. ТИНРО. Т. 20. № 1. С. 155–167. https://doi.org/10.26428/1606-9919-2020-200-155-167
Савин А.Б. 2021. Сайка (Boreogadus saida, Gadidae) Чукотского моря и прилегающих вод // Там же. Т. 201. № 4. С. 810–832. https://doi.org/10.26428/1606-9919-2021-201-810-832
Сафронов С.Н. 1986. Тихоокеанская навага // Биологические ресурсы Тихого океана. М.: Наука. С. 201–212.
Семененко Л.И. 1965. О локальных стадах тихоокеанской наваги и перспективах её промысла в северной части ареала // Изв. ТИНРО. Т. 59. С. 136–144.
Сиренко Б.И., Гагаев С.Ю. 2007. Необычное обилие макробентоса и тихоокеанские вселенцы в Чукотском море // Биология моря. Т. 3. № 6. С. 399–407.
Слабинский А.М., Фигуркин А.Л. 2014. Структура планктонного сообщества южной части Чукотского моря в летний период // Изв. ТИНРО. Т. 178. С. 135–147. https://doi.org/10.26428/1606-9919-2014-178-135-147
Степаненко М.А. 1997. Межгодовая изменчивость пространственной дифференциации минтая Theragra chalcogramma и трески Gadus macrocephalus Берингова моря // Вопр. ихтиологии. Т. 37. № 1. С. 19–26.
Степаненко М.А., Грицай Е.В. 2016. Состояние ресурсов, пространственная дифференциация и воспроизводство минтая в северной и восточной частях Берингова моря // Изв. ТИНРО. Т. 185. С. 16–30. https://doi.org/10.26428/1606-9919-2016-185-16-30
Степаненко М.А., Грицай Е.В. 2018. Межгодовая изменчивость экологических условий и пространственная дифференциация минтая в Беринговом море // Тр. ВНИРО. Т. 174. С. 6–20.
Удинцев Г.Б., Бойченко И.Г., Канаев В.Ф. 1959. Рельеф дна Берингова моря // Тр. ИО АН СССР. Т. 29. С. 17–64.
Фадеев Н.С. 1986. Берингово море // Биологические ресурсы Тихого океана. М.: Наука. С. 389–405.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Черкасова Л.Д. 1976. Размерный состав, рост и плодовитость дальневосточной сайки // Исследования по биологии рыб и промысловой океанографии. Вып. 7. Владивосток: Изд-во ТИНРО. С. 137–143.
Чикилев В.Г., Датский А.В. 2000. Дальневосточная многопозвонковая песчанка Ammodytes hexapterus (Ammodytidae) в Анадырском заливе и прилегающих водах // Вопр. ихтиологии. Т. 40. № 6. С. 772–779.
Шейко Б.А., Федоров В.В. 2000. Класс Cephalaspidomorphi – Миноги. Класс Chondrichthyes – Хрящевые рыбы. Класс Holocephali – Цельноголовые. Класс Osteichthyes – Костные рыбы // Каталог позвоночных животных Камчатки и сопредельных морских акваторий. Петропавловск-Камчатский: Камчат. печат. двор. С. 7–69.
Шлейник В.Н. 1979. Биологические основы рационального использования сайки Баренцева моря: Автореф. дис. … канд. биол. наук. М.: ВНИРО, 23 с.
Шунтов В.П., Волков А.Ф., Темных О.С., Дулепова Е.П. 1993. Минтай в экосистемах дальневосточных морей. Владивосток: Изд-во ТИНРО, 426 с.
Andrews A.G. III, Strasburger W.W., Farley E.V.Jr. et al. 2016. Effects of warm and cold climate conditions on capelin (Mallotus villosus) and Pacific herring (Clupea pallasii) in the eastern Bering Sea // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 134. P. 235–246. https://doi.org/10.1016/j.dsr2.2015.10.008
Baker M.R. 2021. Contrast of warm and cold phases in the Bering Sea to understand spatial distributions of Arctic and sub‑Arctic gadids // Polar Biol. V. 44. P. 1083–1105. https://doi.org/10.1007/s00300-021-02856-x
Baker M.R., Kivva K.K., Pisareva M.N. et al. 2020. Shifts in the physical environment in the Pacific Arctic and implications for ecological timing and conditions // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 177. Article 104802. https://doi.org/10.1016/j.dsr2.2020.104802
Basyuk E., Zuenko Y. 2020. Extreme oceanographic conditions in the northwestern Bering Sea in 2017–2018 // Ibid. V. 181–182. Article 104909. https://doi.org/10.1016/j.dsr2.2020.104909
Bowering W.R., Nedreaas K.H. 2001. Age validation and growth of Greenland halibut (Reinhardtius hippoglossoides (Walbaum)): A comparison of populations in the Northwest and Northeast Atlantic // Sarsia. V. 86. № 1. P. 53–68. https://doi.org/10.1016/j.fishres.2016.01.016
Brodziak J., Mikus R. 2000. Variation in life history parameters of Dover sole (Microstomus pacificus), off the coasts of Washington, Oregon, and northern California // Fish. Bull. V. 98. P. 661–673.
Carvalho K.S., Smith T.E., Wang S. 2021. Bering Sea marine heatwaves: Patterns, trends and connections with the Arctic // J. Hydrol. V. 600. Article 126462. https://doi.org/10.1016/j.jhydrol.2021.126462
Chilton D.E., Beamish R.J. 1982. Age determination methods for fishes studied by the groundfish program at the Pacific Biological Station // Can. Spec. Publ. Fish. Aquat. Sci. V. 60. 102 p.
Coad B.W., Reist J.D. 2004. Annotated list of the Arctic Marine Fishes of Canada // Can. MS Rep. Fish. Aquat. Sci. № 2674. 112 p.
Craig P.C., Griffiths W.B., Haldorson L., McElderry H. 1982. Ecological studies of Arctic cod (Boreogadus saida) in Beaufort Sea coastal waters // Can. J. Fish. Aquat. Sci. V. 39. № 3. P. 395–406. https://doi.org/10.1139/f82-057
Danielson S.L., Ahkinga O., Ashjian C. et al. 2020. Manifestation and consequences of warming and altered heat fluxes over the Bering and Chukchi Sea continental shelves // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 177. Article 104781. https://doi.org/10.1016/j.dsr2.2020.104781
Datsky A.V. 2015a. Fish fauna of the Chukchi Sea and perspectives of its commercial use // J. Ichthyol. V. 55. № 2. P. 185–209. https://doi.org/10.1134/S0032945215020022
Datsky A.V. 2015b. Ichthyofauna of the Russian exclusive economic zone of the Bering Sea: 1. Taxonomic diversity // Ibid. V. 55. № 6. P. 792–826. https://doi.org/10.1134/S0032945215060065
De Robertis A., Taylor K., Wilson C.D., Farley E.V. 2017. Abundance and distribution of Arctic cod (Boreogadus saida) and other pelagic fishes over the U.S. Continental Shelf of the Northern Bering and Chukchi Seas // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 135. P. 51–65. https://doi.org/10.1016/j.dsr2.2016.03.002
Eisner L.B., Zuenko Y.I., Basyuk E.O. et al. 2020. Environmental impacts on walleye pollock (Gadus chalcogrammus) distribution across the Bering Sea shelf // Ibid. V. 181–182. Article 104881. https://doi.org/10.1016/j.dsr2.2020.104881
Eschmeyer W.N., Herald E.S., Hammann H. 1983. A field guide to Pacific coast fishes of North America. Boston: Houghton Mifflin Co., 336 p.
Farley E., Cieciel K., Vollenweider J. et al. 2017. Arctic integrated ecosystem survey cruise report to the Arctic integrated research program. Anchorage: NPRB, 93 p.
Farley E.V., Jr., Murphy J.M., Cieciel K. et al. 2020. Response of Pink salmon to climate warming in the northern Bering Sea // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 177. Article 104803. https://doi.org/10.1016/j.dsr2.2020.104830
Fey D.P., Weslawski J.M. 2017. Age, growth rate, and otolith growth of polar cod (Boreogadus saida) in two fjords of Svalbard, Kongsfjorden and Rijpfjorden // Oceanologia. V. 59. № 4. https://doi.org/10.1016/j.oceano.2017.03.011
Frost K.J., Lowry L.F. 1983. Demersal fishes and invertebrates trawled in the northeastern Chukchi and western Beaufort seas, 1976–77 // NOAA Tech. Rept. NMPS SSRF. № 764. 22 p.
Grebmeier J.M., Cooper L.W., Ashjian C.A. et al. 2015. Pacific Marine Arctic Regional Synthesis (PacMARS) Final Report. Anchorage: NPRB, 259 p.
Helser T.E., Colman J.R., Anderl D.M., Kastelle C.R. 2017. Growth dynamics of saffron cod (Eleginus gracilis) and Arctic cod (Boreogadus saida) in the Northern Bering and Chukchi Seas // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 135. P. 66–77. https://doi.org/10.1016/j.dsr2.2015.12.009
ICES. 2017. Report of the workshop on age reading of Greenland halibut 2 (WKARGH2) // ICES CM 2016/SSGIEOM:16. Reykjavik: ICES, 40 p. https://doi.org/10.2960/S.v41.m1
Lamb A., Edgell P. 1986. Coastal fishes of the Pacific northwest. Madeira Park: Harbour Publ., 224 p.
Lear W.H., Ritt N.K. 1975. Otolith age validation of Greenland halibut (Reinhardtius hippoglossoides) // J. Fish. Res. Board Can. V. 32. № 2. P. 289–292. https://doi.org/10.1139/f75-027
Logerwell E.A., Busby M., Mier K.L. et al. 2020. The effect of oceanographic variability on the distribution of larval fishes of the northern Bering and Chukchi seas // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 177. Article 104784. https://doi.org/10.1016/j.dsr2.2020.104784
Matley J.K., Fisk A.T., Dick T.A. 2013. The foraging ecology of Arctic cod (Boreogadus saida) during open water (July–August) in Allen Bay, Arctic Canada // Mar. Biol. V. 160. № 11. P. 2993–3004. https://doi.org/10.1007/s00227-013-2289-2
Mecklenburg C.W., Mecklenburg T.A., Sheiko B.A., Steinke D. 2016. Pacific Arctic marine fishes. Conservation of Arctic flora and fauna. Akureyri: CAFF Internat. Secretariat, 406 p.
Morrow J.E. 1980. Freshwater fishes of Alaska. Anchorage: Alaska Northwest Publ. Co., 248 p.
Munk K.M. 2001. Maximum ages of groundfishes in waters off Alaska and British Columbia and consideration of age determination // Alaska Fish. Res. Bull. V. 8. № 1. P. 12–21.
Nishio S., Sasaki H., Waga H., Yamamura O. 2020. Effects of the timing of sea ice retreat on demersal fish assemblages in the northern Bering and Chukchi Seas // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 181–182. Article 104910. https://doi.org/10.1016/j.dsr2.2020.104910
Orlov A.M., Rybakov M.O., Vedishcheva E.V. et al. 2021. Walleye pollock Gadus chalcogrammus, a species with continuous range from the Norwegian Sea to Korea, Japan, and California: new records from the Siberian Arctic // J. Mar. Sci. Eng. V. 9. № 10. Article 1141. https://doi.org/10.3390/jmse9101141
Siddon E.C., Zador S.G., Hunt G.L.Jr. 2020. Ecological responses to climate perturbations and minimal sea ice in the northern Bering Sea // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 181–182. Article 104914. https://doi.org/10.1016/j.dsr2.2020.104914
Stevenson D.E., Lauth R.R. 2019. Bottom trawl surveys in the northern Bering Sea indicate recent shifts in the distribution of marine species // Polar Biol. V. 42. № 2. P. 407–421. https://doi.org/10.1007/s00300-018-2431-1
Witherell D. 2000. Groundfish of the Bering Sea and Aleutian Islands area: species profiles. Anchorage: NPFM. Counc. 15 p.
Wolotira R.J.Jr., Sample T.M., Morin M.Jr. 1977. Demersal fish and shelf fish resources of Norton Sound, the southeastern Chukchi Sea, and adjacent waters in the Baseline year 1976. Seattle: NMFS, 292 p.
Yasumiishi E.M., Cieciel K., Andrews A.G. et al. 2020. Climate-related changes in the biomass and distribution of small pelagic fishes in the eastern Bering Sea during late summer, 2002–2018 // Deep-Sea Res. II: Top. Stud. Oceanogr. V. 181–182. Article 104907. https://doi.org/10.1016/j.dsr2.2020.104907
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


