Вопросы ихтиологии, 2022, T. 62, № 4, стр. 466-475
Оценка эффективности воспроизводства атлантического лосося Salmo salar (Salmonidae) в реке Кола (Кольский полуостров) на основе данных о плотности молоди
А. В. Зубченко 1, *, М. Ю. Алексеев 1
1 Полярный филиал Всероссийского научно-исследовательского института
рыбного хозяйства и океанографии – ПИНРО
Мурманск, Россия
* E-mail: zav@pinro.ru
Поступила в редакцию 20.08.2021
После доработки 12.11.2021
Принята к публикации 15.11.2021
- EDN: HKSFEH
- DOI: 10.31857/S0042875222040312
Аннотация
В р. Кола (Кольский п-ов) на основе кластерного анализа многолетних данных плотности на выростных участках сеголеток, диких и диких + заводских пестряток атлантического лосося Salmo salar L. выделили в каждой из групп молоди по четыре кластера с высокой, средней, низкой и очень низкой плотностью. В нижнем и верхнем течении реки выявили участки, где состояние воспроизводства лосося можно оценить как критическое. Обсудили роль незаконного, несообщаемого, нерегулируемого рыболовства, ульцеративного дермального некроза и заводского воспроизводства как возможные причины снижения репродуктивного потенциала одной из наиболее значимых лососёвых рек региона.
Уже длительное время в странах, владеющих запасами атлантического лосося Salmo salar L., наблюдается тенденция снижения его численности. Многие популяции, несмотря на сокращение вылова, пребывают в депрессивном состоянии, а некоторые из них полностью утеряны или находятся на грани исчезновения (Klemetsen et al., 2003; Webb et al., 2007; Limburg, Waldman, 2009; Hindar et al., 2011; Chaput, 2012; Windsor et al., 2012; ICES, 2016). Это негативно сказывается на величине как национальных, так и мирового уловов лосося, которые в 2020 г. были ниже среднего показателя за предыдущие пять и десять лет и были одними из самых низких за весь период наблюдений с 1960 по 2020 гг. (ICES, 2021) при том, что данные статистики включают как дикого, так и пастбищного лосося, а также рыб, сбежавших из садков.
Не являются исключением и лососёвые реки Кольского п-ова, где в последние 10 лет (2011–2020) из-за ухудшения условий воспроизводства наблюдается не только снижение уловов лосося, но и резкий спад величины освоения выделенных объёмов добычи (вылова) с 71.6–74.7% в 2010–2012 гг. до 16.5–38.4% в 2017–2020 гг. при том, что рыболовные усилия в рассматриваемый период были довольно стабильными.
Река Кола – одна из наиболее значимых баренцевоморских лососёвых рек Кольского п-ова. Атлантический лосось (сёмга) является в ней доминирующим видом и важнейшим объектом рыболовства. Почти до конца 1950-х гг. промысел сёмги в реке не регулировался. Начиная с 1958 г. он был сконцентрирован на рыбоучётном заграждении (РУЗ), устанавливаемом ежегодно в ~ 25 км от устья. РУЗ полностью перекрывает реку и помимо рыболовства на нём в течение нерестового хода (май–август) осуществляли учёт производителей и сбор биологического материала, что позволяло оценивать состояние запаса, регулировать численность промысловой и воспроизводящей частей популяции лосося. В 1999 г. в связи с развитием рекреационного рыболовства промышленный лов лосося в реке был прекращён, однако РУЗ продолжали устанавливать для учёта нерестовых мигрантов, сбора биологических данных и отбора производителей в целях рыбоводства, которое осуществляли с 1934 по 2017 гг.
В 2017–2020 гг. из-за массовой гибели рыб от заболевания, диагностированного как УДН – ульцеративный дермальный некроз (Карасева, Мельник 2019), период работы РУЗ, как преграды, создающей условия для накапливания и контакта здоровых и больных рыб, был сокращён втрое. Полнота учёта лососей, идущих на нерест, и сбора биологических данных была нарушена. В результате эти сведения стало невозможно использовать для оценки состояния запасов. В то же время на индексных участках р. Кола, расположенных как в русле реки, так и в основных нерестовых притоках, уже длительное время проводится мониторинг плотности молоди лосося. Цель настоящей работы – определить возможность использования сведений по плотности молоди для контроля за состоянием воспроизводящей части популяции атлантического лосося р. Кола и оценки роли отдельных участков реки в воспроизводстве вида.
МАТЕРИАЛ И МЕТОДИКА
Река Кола берет начало из оз. Колозеро. Впадает в Кольский залив Баренцева моря в районе г. Кола. Имеет длину 83 км, площадь водосбора составляет 3846 км2. Нерестово-выростные угодья (НВУ), пригодные для нереста производителей и обитания молоди сёмги, расположены мозаично по всему бассейну – от устья до верховьев реки. Общий фонд НВУ составляет 135.46 га. Более подробная характеристика условий обитания лосося в реке Кола приведена Зубченко с соавторами (2003).
Молодь атлантического лосося отлавливали в конце августа– начале сентября 1992–2020 гг. с применением электролова Geomega FA4 (“Terik Technology AS”, Норвегия) на 17 индексных станциях (рис. 1). Параметры работы электролова определяли в зависимости от характеристик биотопа, используя стандартизированный метод (Bohlin et al., 1989). Площадь облавливаемых участков варьировала от 18 до 144 м2. Наименьшая суммарная площадь обловленных участков (511 м2) была в 2013 г., наибольшая (1350 м2) – в 1996 г. Облов одного участка проводили не менее трёх раз с паузой 10–15 мин. В общей сложности выполнили 1368 обловов. Камеральную обработку выполняли по стандартным методикам (Правдин, 1966; Мартынов, 1987). Для расчёта плотности молоди использовали метод удаления (Zippin, 1956; Rodriguez de Rivera, McCrea, 2021). Отдельные оценки были сделаны для молоди в возрасте 0+ (сеголетки), дикой и дикой + заводской молоди в возрасте ≥1+ (пестрятки). Если значение 95%-ного доверительного интервала для среднего (1.96 SE) было больше, чем расчётная величина плотности молоди, для оценки использовали данные по общему вылову.
Рис. 1.
Схема расположения станций лова (1–17) молоди атлантического лосося Salmo salar в бассейне р. Кола в 1992–2020 гг.
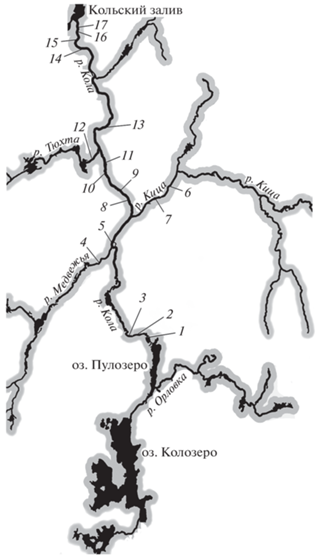
Для выявления станций со схожей плотностью использовали иерархический кластерный анализ данных (Niemela et al., 1999) по трём вышеуказанным группам молоди. Заводскую молодь определяли по отсутствию жирового плавника, который перед выпуском купируется. Данные наблюдений располагали в матрице с участками в строках и значениями плотности в качестве переменных в столбцах, так что каждый столбец представлен соответствующим рядом за 1992–2020 гг. Для объединения сходных участков с целью формирования матрицы сходства в качестве меры расстояния использовали Евклидово расстояние. В качестве правила объединения использовали метод Уорда, который минимизирует внутрикластерную вариацию относительно межкластерной (Боровиков, 2021). Результатом стало формирование дендрограмм, где расположение станций на ветвях определено средней плотностью молоди, и распределение мест отбора проб (станций) в порядке убывания плотности.
Для выявления тенденций значений плотности внутри кластеров участков применили регрессионный анализ, и выполнили автокорреляционный анализ для определения зависимости последующих значений ряда от предыдущих. В качестве переменных использовали среднегодовые значения плотности молоди в каждом кластере со сдвигом на один лаг (k = 1). Для проверки репрезентативности (значимости) коэффициентов автокорреляции при уровне 0.05 рассчитали доверительный интервал для каждого коэффициента и сравнили расчётную величину t-критерия Стьюдента с теоретическим значением. Изменения плотности дополнительно оценивали с применением метода локальных полиномиальных регрессий (Local regressions – “LOESS”) (Cleveland, 1979; Wilcox, 2017). Все расчёты выполняли в программе STATISTICA, Версия 13.3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате кластерного анализа плотности трёх категорий молоди сёмги (в возрасте 0+, дикой и дикой + заводской в возрасте ≥1+) на 17 индексных участках выделили четыре кластера с высокой (1), средней (2), низкой (3) и очень низкой (4) плотностью (рис. 2). Краткая характеристика выделенных кластеров приведена в таблице.
Рис. 2.
Результаты кластеризации индексных участков по средней плотности молоди атлантического лосося Salmo salar в бассейне р. Кола в 1992–2020 гг.: а – сеголетки, возраст 0+; б – дикая молодь, ≥1+; в – дикая + заводская, ≥1+.
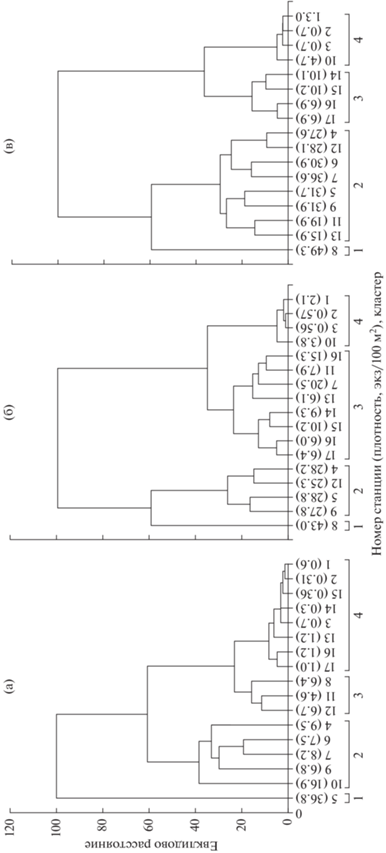
Характеристика кластеров молоди атлантического лосося Salmo salar в р. Кола
| Кластер | Число станций | Плотность, экз/100 м2 | p | ||
|---|---|---|---|---|---|
| № | Категория, возраст | M | SE | ||
| 1 | Сеголетки, 0+ | 1 | 36.8 | 0.8 | 0.00010 |
| Дикая, ≥1+ | 1 | 43.0 | 7.6 | 0.00270 | |
| Дикая + заводская, ≥1+ | 1 | 45.6 | 7.8 | 0.01680 | |
| 2 | Сеголетки, 0+ | 5 | 10.3 | 0.3 | 0.00440 |
| Дикая, ≥1+ | 4 | 27.2 | 3.7 | <0.00001 | |
| Дикая + заводская, ≥1+ | 9 | 22.8 | 2.5 | <0.00010 | |
| 3 | Сеголетки, 0+ | 3 | 5.8 | 0.1 | 0.00200 |
| Дикая, ≥1+ | 8 | 10.1 | 2.2 | <0.00001 | |
| Дикая + заводская, ≥1+ | 4 | 8.7 | 3.3 | 0.00120 | |
| 4 | Сеголетки, 0+ | 8 | 0.7 | 0.1 | 0.03880 |
| Дикая, ≥1+ | 4 | 1.9 | 0.4 | 0.77780 | |
| Дикая + заводская, ≥1+ | 4 | 2.3 | 0.4 | 0.52110 | |
У молоди в возрасте 0+ в 1-м кластере высокая плотность с максимумом (85 экз/100 м2) в 2008 г. приходилась на период с 2005 по 2015 гг. (рис. 3а). По данным регрессионного анализа, до 2010 г. она имела тенденцию роста, а в последующие годы направленность тренда изменилась в сторону уменьшения. В кластере 2 пик плотности сеголеток (30.6 экз/100 м2) пришёлся на 2013 г., однако регрессионный анализ не выявил какой-либо тенденции в колебаниях численности (рис. 3б). В 3-м и 4-м кластерах межгодовые различия плотности молоди были незначительны и какие-либо тенденции в её изменении отсутствовали (рис. 3в, 3г).
Рис. 3.
Динамика средней плотности молоди атлантического лосося Salmo salar р. Кола в 1992–2020 гг. в 1-м (а), 2-м (б), 3-м (в) и 4-м (г) кластерах и её аппроксимация
с применением регрессии LOESS: (△,  ) – сеголетки, возраст 0+; (⚪, ⁃ ⁃ ⁃) – дикая молодь, ≥1+; (◇,
) – сеголетки, возраст 0+; (⚪, ⁃ ⁃ ⁃) – дикая молодь, ≥1+; (◇,  ) – дикая + заводская, ≥1; (I) – доверительный интервал.
) – дикая + заводская, ≥1; (I) – доверительный интервал.
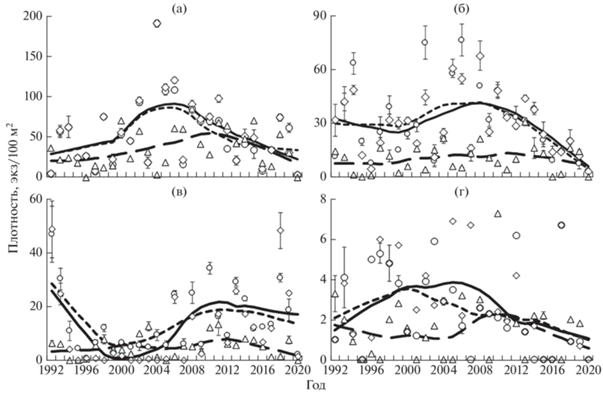
У дикой, а также дикой + заводской молоди в возрасте ≥1+ межгодовые изменения плотности в 1-м кластере оказались практически одинаковыми. Высокая плотность молоди с максимумом (191.3 экз/100 м2) в 2004 г. зарегистрирована в период с 2004 по 2006 гг. (рис. 3а). Тенденцию роста она имела до 2005 г., в последующие годы направленность тренда изменилась в сторону уменьшения. В кластере 2 пик плотности дикой молоди пришёлся на 2006-й, а у дикой + заводской молоди – на 2008-й, после чего начиная с 2008 г. в обеих группах отмечена тенденция снижения (рис. 3б). В 3-м кластере плотность дикой молоди в период с 1994 по 2005 гг. в основном не превышала 10 экз/100 м2, а у и дикой + заводской была близка к нулю. После 2006 г. в обеих группах она колебалась в значительных пределах, однако определенной тенденции не наблюдалось (рис. 3в). В 4-м кластере какие-либо изменения плотности молоди не прослеживались (рис. 3г).
Автокорреляционный анализ временны́х рядов плотности выборок, объединённых в кластеры, не показал статистически значимых результатов, что позволяет говорить о независимости их плотности в разные годы.
Как показали результаты анализа, роль различных участков реки в воспроизводстве лосося заметно различается. В нижнем течении реки расположено 33% НВУ и находятся основные нерестовые участки (Зубченко и др., 2003). Однако на этих НВУ за весь период исследований плотность дикой молоди в возрасте ≥1+ составила в среднем 7.9 (6.0–10.3), а сеголеток – 0.8 (0.3–1.2) экз/100 м2. По результатам кластерного анализа, у сеголеток индексные участки (13–17) нижнего течения (рис. 1) отнесены к 4-му кластеру, у старшевозрастной дикой молоди – к 3-му (рис. 2), что соответствует очень низкому и низкому уровням плотности.
В верхнем течении реки из-за большого количества плёсов и проточных озёр доля НВУ составляет ~ 9%. Как и в нижнем течении, на участках, пригодных для обитания разновозрастной молоди, её плотность у сеголеток в среднем составила 0.8 (0.3–1.2) и 1.2 (0.7–3.0) экз/100 м2 у молоди в возрасте ≥1+. Это соответствует 4-му кластеру с очень низким уровнем плотности и указывает на незначительную роль этих НВУ в воспроизводстве лосося.
Наиболее продуктивные НВУ расположены в притоках 1-го порядка (реки Кица и Медвежья) и в основном русле реки с 33.0 по 44.5 км от устья. Средняя плотность сеголеток на указанном участке основного русла реки составила 13.8 (6.4–36.8), а дикой молоди в возрасте ≥1+ – 26.8 (15.3–43.0) экз/100 м2 при том, что только по одному индексному участку для каждой группы молоди относятся к 1-му кластеру. Остальные – ко 2-му и 3-му кластерам.
По мнению Фридланда и др. (Friedland et al., 2009), изменение условий в пресной воде, а не в море, может быть более важным фактором в регулировании будущего распространения и жизнеспособности вида. В речной период выживаемость молоди на ранних и последующих стадиях зависит от таких природных факторов, как температура и уровень воды, скорость течения, сокращение речного стока, толщина льда зимой, кормовая база, наличие конкурентов других видов, плотность молоди и т.д. (Saltveit, 1990; Mills, 1991; Saltveit et al., 2001; Jensen, 2003; Baum et al., 2005; Jonsson B. , Jonsson N., 2006, 2009; Hedger et al., 2013). Эти факторы имеют временный характер, периодично повторяются и, как считают некоторые исследователи (Jonsson B., Jonsson N., 2004), не являются критичными.
Не меньшее влияние на выживаемость лососёвой молоди оказывают антропогенные факторы. По мнению Пэрриш и др. (Parrish et al., 1998), снижению продукции атлантического лосося способствует строительство опорных плотин, загрязнение окружающей среды (включая кислотные дожди), общее обезвоживание водотоков, перелов рыб. Среди причин, способствующих ухудшению состояния запасов лосося, значительную роль также играют болезни, интродуцированные паразиты, изменение климата, генетическая интрогрессия через нерестившегося в реках лосося, выращенного на фермах, и увеличение количества паразитов, связанное с выращиванием атлантического лосося.
Корреляционный анализ показал, что связь между численностью изученных групп молоди лосося и колебаниями температуры и уровня воды носит слабый характер (r ≤ 0.3). Однако ранее отмечалось (Зубченко, Алексеев, 2020), что популяция лосося из р. Кола уже длительное время испытывает сильное воздействие ряда антропогенных факторов. Среди них по степени негативного влияния на уровень воспроизводства были выделены три: незаконное, несообщаемое, нерегулируемое (ННН) рыболовство, УДН и заводское воспроизводство.
ННН-рыболовство, к сожалению, уже в течение многих десятков лет является “визитной карточкой” р. Кола (Азбелев, 1959, 1960; Прусов и др., 2021). Река протекает по густонаселённой местности и, как ещё в 1950-е годы отмечал Азбелев (1959. С. 43), в бассейне р. Кола “наблюдается чрезвычайно много случаев нарушения правил рыболовства. Достаточно сказать, что летом 1958 г. рыбоохраной было снято более 70 перегораживающих реку жаберных сетей”. Пресс браконьерства на р. Кола был настолько высок, что для борьбы с ним в 1959–1995 гг. на РУЗ полностью изымали идущих на нерест производителей, и воспроизводство на вышерасположенных НВУ поддерживалось лососями, мигрировавшими вверх по течению до установки РУЗ, и за счёт зарыбления заводской молодью.
Наряду с незаконным ловом или браконьерством для р. Кола характерна практика сокрытия уловов при легальном рыболовстве по лицензиям. Особенно это типично для нижнего течения реки, где расположены два из четырёх действующих рыболовных участков (РУ), выделенных Постановлением Правительства Мурманской области (https://docs.cntd.ru/document/913513010).
На этих участках рыболовство ведётся по принципу “поймал–изъял”. Лов наиболее интенсивен в мае–июне и базируется в основном на мигрирующих к местам нереста лососях в возрасте 2SW–4SW (от английского “sea winter” –2–4 года морского нагула), среди которых бóльшая часть – самки (~70–80%). Например, в 2015 г. для любительского рыболовства на этих участках за весь сезон было реализовано 20084 тыс. разовых лицензий, в том числе в период с 15 мая по 30 июня – 12247 тыс. лицензий или 61% от общего количества. Для сравнения: на двух других РУ, расположенных в среднем и верхнем течении, за весь сезон было реализовано 1432 тыс. лицензий. По опросным сведениям рыбаков-любителей, осуществляющих лов на легальной основе по разовым лицензиям, не декларируется примерно 2/3 уловов. Например, по данным Североморского территориального управления Росрыболовства, в 2007 г. для лова с изъятием было реализовано 5256 лицензий, а для лова по принципу “поймал-отпустил” – 391 лицензия, учтённый вылов составил соответственно 239 и 981 экз., т.е. при более чем 13-кратной разнице в количестве реализованных лицензий величина улова с изъятием была в четыре раза меньше, чем при лове по принципу “поймал-отпустил”. В 2015 г. при такой колоссальной нагрузке декларированный улов за весь сезон составил 274 (!) экз.
Похожую ситуацию описывает Никифоров (1958), когда в 1949 г. на ряде нерестовых сёмужьих рек Кольского п-ова, в том числе на р. Кола, был разрешён любительский лов сёмги на спиннинг. Производителей сёмги вылавливали в массовых количествах, а под видом легальных рыбаков сёмгу ловили браконьеры. Автор считает, что это в значительной степени было причиной того, что Тайбольским рыбоводным заводом, расположенным на р. Кола в 1955 г., не был выполнен план вылова производителей сёмги для целей воспроизводства. Как вывод: разрешение спиннингового лова на сёмужьих реках наносит чрезвычайно большой вред воспроизводству сёмги.
В результате высокого уровня ННН-рыболовства, особенно в нижнем течении реки, испытывается дефицит самок на нерестилищах. Это подтверждают данные учёта на РУЗ, где доля самцов, например, в 2020 г. составила 77%. В течение всего периода исследований плотность дикой молоди в большинстве случаев не превышала 20 экз/100 м2 или была близка к этому показателю (рис. 4), что характерно для рек, где уровень ННН-лова достигает 50–80% от численности нерестового стада (Зубченко и др., 2019).
Рис. 4.
Динамика средней плотности молоди атлантического лосося Salmo salar р. Кола в 1992–2020 гг. и её аппроксимация с применением регрессии LOESS, обозначения см. на рис. 3.

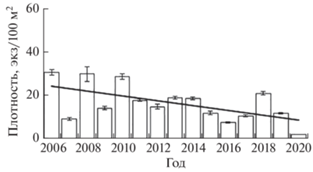
Ситуация усугубляется продолжающейся эпизоотией УДН, в результате которой начиная с 2015 г. в реке наблюдается массовая гибель производителей. Например, в 2015–2017 гг. от данного заболевания погибли все производители, отсаженные для рыбоводных целей (соответственно 209, 219 и 43 экз.). За период с 21.07. по 30.07.2015 г. из ловушки РУЗ были изъяты и утилизированы 209 экз. погибших от УДН производителей, с 20.06. по 07.07.2016 г. – 219 экз., с 10.07. по 04.08.2017 г. – 163 экз. Эпизоотия в совокупности с ННН-рыболовством привели к тому, что учтённая численность производителей в последние годы сократилась практически до величины сохраняющего лимита (1558 экз.) – с 7.671 тыс. экз. в 2015 г. до 1.678 тыс. экз. в 2020 г., а плотность дикой молоди за этот же период – соответственно с 11.9 до 2.0 экз/100 м2 (рис. 5). В результате роль различных участков р. Кола в воспроизводстве атлантического лосося уравнялась на очень низком уровне.
Рис. 5.
Средняя плотность молоди атлантического лосося Salmo salar в р. Кола в 2006–2020 гг.: (─) – линия тренда, (I) – доверительный интервал.
На р. Кола уже более 80 лет осуществляются рыбоводные работы. Вопрос об их негативном влиянии на популяционные характеристики лосося из этой реки рассмотрен довольно подробно (Салмов, 1981; Zubchenko, 1994; Зубченко и др., 2003; Алексеев и др., 2007, 2017; Николаев, Алексеев, 2016; Алексеев, Зубченко, 2021), и нет смысла вновь его обсуждать. В контексте статьи интерес представляет изучение экологического воздействия заводской молоди на дикую молодь в условиях совместного обитания.
На основе анализа литературных данных (Jonsson B., Jonsson N., 2011) отмечается, что заводская молодь за счёт более крупных размеров составляет конкуренцию дикой молоди и вытесняет её с привычных мест обитания. Это взаимодействие может вызвать усиление миграции дикой рыбы или её смертность. Повышенная плотность молоди может также снизить скорость индивидуального роста и косвенно повлиять на другие характеристики жизненного цикла, такие как возраст созревания, распределение на нерестилищах, биомасса и естественное воспроизводство. Молодь, имеющая заводское происхождение, может доминировать над дикими особями аналогичного возраста и размера в конкуренции за питание (Einum, Fleming, 1997).
С 1992 по 2002 гг. (1-й период) в р. Кола выпускали молодь в возрасте 2+ и 3+. С 2003 г. (2-й период) рыбоводные заводы Мурманской области перешли на выпуск годовиков (1.). Начиная с 2017 г. работы по заводскому воспроизводству были прекращены из-за гибели производителей, отбираемых в маточное стадо, от УДН. В 1-й период в среднем выпускали 144.3 (24.0–318.0) тыс. экз. в год. Во 2-м периоде – 472.0 (9.3–782.2) тыс. экз. Из представленного графика (рис. 6) видно, что, несмотря на постоянно растущее количество выпускаемой молоди, её аппроксимированная среднегодовая плотность варьировала на очень низком уровне (1–3 экз/100 м2) и её роль в воспроизводстве была незначительна в течение всего периода исследований.
Рис. 6.
Объёмы выпуска и динамика средней плотности заводской молоди атлантического лосося
Salmo salar в р. Кола в 1992–2016 гг. Аппроксимация значений проведена с применением регрессии
LOESS: (×,  ) – объём выпуска; (◇, ⁃ ⁃ ⁃) – плотность молоди.
) – объём выпуска; (◇, ⁃ ⁃ ⁃) – плотность молоди.

Сравнение данных по количеству выпускаемой молоди в возрасте 2+ и 1+ и среднегодовой плотности дикой молоди этих же возрастов (рис. 7) показало, что, когда в конце 1990-х гг. реку зарыбляли молодью в возрасте 2+, имело место снижение плотности диких 3-леток, однако нет оснований связать этот факт с чрезмерным обилием заводской молоди и, соответственно, вызванной этим конкуренцией за места обитания и пищу. В то же время с начала 2010-х гг. наблюдаемое снижение плотности дикой молоди в возрасте 1+, вероятно, связано с чрезмерным количеством выпускаемой заводской молоди, хотя несомненно какую-то роль в этом играет дефицит производителей на нерестилищах. В этой связи Пэрриш и др. (Parrish et al., 1998) отмечают, что большинство факторов, влияющих на численность лосося, действуют не поодиночке, но скорее согласованно, что маскирует относительный вклад каждого фактора. Тем не менее в 2010–2016 гг. в реку выпускали в год от 502.2 до 782.2 тыс. экз. заводской молоди. В пересчёте на 100 м2 известной площади НВУ это составляет от 37 до 58 экз/100 м2. Естественно, это только расчёты. В действительности за этот период из 4010 тыс. экз. заводской молоди 3563.6 тыс. экз. (около 89%) были выпущены на участке между 18 и 28 км от устья. На этом участке выявлено 40.6 га НВУ или 30% от всей площади НВУ. Выпуски заводской молоди проводят в апреле–мае в четырёх–пяти доступных для автотранспорта местах. То есть на этих участках реки плотность молоди даже в среднем значительно превышала 100 экз/100 м2.
Рис. 7.
Объёмы выпуска заводской и динамика средней плотности дикой молоди атлантического
лосося Salmo salar в р. Кола в 1992–2016 гг. Аппроксимация значений проведена с применением регрессии
LOESS: (×,  ) – объём выпуска заводской молоди; (◇, ⁃ ⁃ ⁃) – плотность дикой молоди.
) – объём выпуска заводской молоди; (◇, ⁃ ⁃ ⁃) – плотность дикой молоди.

Вполне очевидно, что по мере увеличения плотности молоди снижается доступность кормовых ресурсов, и эта зависимость в конечном счёте становится отрицательной. С одной стороны, это стимулирует расселение молоди: например, при высокой плотности выращиваемая в заводских условиях радужная форель Oncorhynchus mykiss способна вытеснять менее крупных диких сородичей из благоприятных мест обитания (Weber, Fausch, 2003). С другой стороны, приводит к высокой смертности, поскольку соотношение между ростом потерь и плотностью является компенсационным, т.е. число выживших особей уменьшается по мере увеличения плотности выше оптимального уровня (Gee et al., 1978).
В период выпуска в р. Кола масса заводской молоди заметно выше, чем дикой. Например, в 2015 г. средняя масса заводской молоди варьировала от 2.7 до 3.8 г, дикой – от 1.0 до 1.3 г. К началу сентября эти различия нивелировались, и масса дикой и заводской молоди составляла соответственно 4.2 и 4.3 г. Оптимальная плотность сеголеток и пестряток, исходя из результатов исследований (Зубченко и др., 2019), составляет 40–45 экз/100 м2. То есть выпуск на довольно ограниченном участке нескольких сотен тысяч годовиков атлантического лосося не может не сказаться на выживаемости как дикой, так и заводской молоди. В этой связи Гроссман и Саймон (Grossman, Simon, 2020) на основании анализа 199 опубликованных работ по 21 виду лососёвых, касающихся оценки частоты встречаемости различных процессов, которые зависят от плотности, отмечают, что 71% исследований показал зависимость роста, а 23% – смертности рыб от их плотности.
Таким образом, есть основания полагать, что ННН-рыболовство, эпизоотия, вызванная УДН, и чрезмерные по количеству объёмы выпускаемой заводской молоди оказывали и оказывают серьёзное влияние на естественное воспроизводство атлантического лосося в р. Кола. Это привело к тому, что в последние годы преднерестовая численность лосося этой реки снизилась практически до уровня сохраняющего лимита (1558 экз.) и, если не принять меры, прежде всего по борьбе с ННН-рыболовством, и не наладить эффективную охрану нерестилищ, популяция лосося р. Кола будет утеряна.
ЗАКЛЮЧЕНИЕ
В результате кластерного анализа многолетних данных по плотности молоди атлантического лосося в возрасте 0+, дикой и дикой + заводской в возрасте ≥1+ выделили четыре кластера с высокой (1), средней (2), низкой (3) и очень низкой (4) относительной численностью молоди на выростных участках р. Кола и её притоков.
В 1-м и 2-м кластерах для всех трёх групп молоди (сеголетки, дикая, дикая + заводская) в последние 10 лет характерна тенденция снижения изучаемого показателя. В 3-м и 4-м кластерах межгодовые вариации плотности молоди были незначительны и какие-либо тенденции в её изменении не отмечены.
Индексные участки в нижнем и верхнем течениях реки отнесены к 3-му и 4-му кластерам, что соответствует низкому и очень низкому уровням плотности. То есть роль этих НВУ в воспроизводстве лосося незначительна.
Более продуктивные НВУ локализуются в притоках 1-го порядка (реки Кица и Медвежья) и в основном русле реки с 33.0 по 44.5 км от устья, при этом только по одному индексному участку для каждой группы молоди относятся к 1-му кластеру. Остальные – ко 2-му и 3-му кластерам.
Среди антропогенных факторов, оказывающих негативное влияние на воспроизводство лосося в р. Кола, по-видимому, одним из наиболее значимых является крайне высокий уровень ННН-рыболовства. При этом наряду с незаконным ловом или браконьерством серьёзный урон запасам лосося наносят рыбаки-любители при легальном лове по лицензиям, которые не декларируют частично или полностью свой улов.
Ситуация усугубляется продолжающейся эпизоотией УДН, в результате которой начиная с 2015 г. в реке наблюдается массовая гибель производителей. В совокупности это привело к тому, что их учтённая численность в последние годы сократилась практически до величины сохраняющего лимита (1558 экз.) – с 7.671 тыс. экз. в 2015 г. до 1.678 тыс. экз. в 2020 г., а плотность дикой молоди за этот же период– соответственно с 11.9 до 2.0 экз/100 м2.
На р. Кола уже более 80 лет осуществляют работы по заводскому воспроизводству атлантического лосося; начиная с 2003 г. в реку в среднем в год выпустили 472.0 (9.3–782.2) тыс. экз. молоди. Поскольку по мере увеличения плотности снижается количество доступного корма, есть основания предполагать, что чрезмерное количество выпускаемой заводской молоди приводит к переуплотнению пестряток на НВУ, усилению пищевой конкуренции и, как результат, к их высокой смертности. Вполне вероятно, это стало причиной наблюдаемого с начала 2010-х гг. снижения плотности молоди в возрасте 1+.
ННН-рыболовство, эпизоотия, вызванная УДН, и чрезмерные по количеству объёмы выпускаемой заводской молоди, по-видимому, оказывали и оказывают серьёзное влияние на естественное воспроизводство атлантического лосося в р. Кола.
Список литературы
Азбелев В.В. 1959. О семужьем хозяйстве в реках Кольского залива // Бюл. ПИHPО. № 1(9). С. 43–45.
Азбелев В.В. 1960. Семга – жемчужина северных вод. Мурманск: Кн. изд-во, 28 с.
Алексеев М.Ю., Зубченко А.В. 2021. Эффективность искусственного воспроизводства атлантического лосося Salmo salar при выпуске молоди в разном возрасте на примере реки Кола (Кольский полуостров) // Вопр. ихтиологии. Т. 61. № 1. С. 109–118. https://doi.org/10.31857/S004287522101001X
Алексеев М.Ю., Донецков В.В., Зубченко А.В. 2007. Сравнительная характеристика физиологического состояния молоди семги (Salmo salar L.) естественного и искусственного происхождения в р. Умба // Там же. Т. 47. № 3. С. 399–405.
Алексеев М.Ю., Николаев А.М., Зубченко А.В. 2017. Адаптация к естественным условиям искусственно выращенных годовиков семги Salmo salar L. (Salmonidae) // Там же. Т. 57. № 5. С. 599–606. https://doi.org/10.7868/S0042875217050010
Боровиков В.П. 2021. Популярное введение в современный анализ данных и машинное обучение на Statistica. М.: Горячая линия-Телеком, 354 с.
Зубченко А.В., Алексеев М.Ю. 2020. Биологическое разнообразие популяции атлантического лосося (Salmo salar L.) р. Кола (Мурманская область) в условиях антропогенного воздействия // Матер. II Междунар. науч.-практ. конф. “Биологическое разнообразие: изучение, сохранение, восстановление, рациональное использование”. Симферополь: Ариал. С. 314–318.
Зубченко А.В., Долотов С.И., Крылова С.С., Лазарева Л.В. 2003. Лососевые реки Кольского полуострова. Река Кола. Мурманск: Изд-во ПИНРО, 66 с.
Зубченко, А.В., Прусов С.В., Алексеев М.Ю. 2019. Оценка состояния запасов атлантического лосося (Salmo salar L.) в реках Мурманской области по данным съемок плотности молоди // Тез. докл. ХII съезда Гидробиол. о-ва при РАН. Петрозаводск: Изд-во КарНЦ РАН. С. 172–174.
Карасева Т.А., Мельник В.С. 2019. Оценка здоровья диких и культивируемых рыб в бассейнах лососевых рек Кольского полуострова // Тез. докл. VII Всерос. науч. конф. с “Экологические проблемы северных регионов и пути их решения”. Апатиты: Изд-во КНЦ РАН. С. 129–130.
Мартынов В.Г. 1987. Сбор и первичная обработка биологических материалов из промысловых уловов атлантического лосося (методические рекомендации). Сыктывкар: Изд-во Коми НЦ, 36 с.
Никифоров Н.Д. 1958. Запретить спиннинговый лов на нерестовых семужьих реках // Рыб. хоз-во. № 8. С. 22.
Николаев А.М., Алексеев М.Ю. 2016. Динамика питания годовиков семги (Salmo salar L.), выращенных в искусственных условиях, после выпуска в приток реки Кола // Вестн. МГТУ. Т. 19. № 1/2. С. 312–317. https://doi.org/10.21443/1560-9278-2016-1/2-312-317
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 376 с.
Прусов С.В., Зубченко А.В., Алексеев М.Ю. и др. 2021. Состояние запасов и рыболовства анадромных рыб Мурманской области. Мурманск: Изд-во ПИНРО, 72 с.
Салмов В.З. 1981. Значение естественного и искусственного воспроизводства для стада семги р. Кола // Тр. ПИНРО. Вып. 45. С. 94–111.
Baum D., Laughton R., Armstrong J.D., Metcalfe N.B. 2005. The effect of temperature on growth and early maturation in a wild population of Atlantic salmon parr // J. Fish Biol. V. 67. № 5. P. 1370–1380. https://doi.org/10.1111/j.0022-1112.2005.00832.x
Bohlin T., Hamrin S., Heggberget T.G. et al. 1989. Electrofishing – theory and practice with special emphasis on salmonids // Hydrobiologia. V. 173. № 1. P. 9–43. https://doi.org/10.1007/BF00008596
Chaput G. 2012. Overview of the status of Atlantic salmon (Salmo salar) in the North Atlantic and trends in marine mortality // ICES J. Mar. Sci. V. 69. № 9. P. 1538–1548. https://doi.org/10.1093/icesjms/fss013
Cleveland W. 1979. Robust Locally Weighted Regression and Smoothing Scatterplots // J. Am. Stat. Assoc. V. 74. № 368. P. 829–836. https://doi.org/10.2307/2286407
Einum S., Fleming I.A. 1997. Genetic divergence and interactions in the wild among native, farmed and hybrid Atlantic salmon // J. Fish Biol. V. 50. № 3. P. 634–651. https://doi.org/10.1111/j.1095-8649.1997.tb01955.x
Friedland K.D., MacLea J.C., Hansen L.P. et al. 2009. The recruitment of Atlantic salmon in Europe. ICES J. Mar. Sci. V. 66. № 2. P. 289–304. https://doi.org/10.1093/icesjms/fsn210
Gee A.S., Milner N.J., Hemsworth R.J. 1978. Production of juvenile Atlantic salmon, Salmo salar in upper Wye, Wales // J. Fish Biol. V. 13. № 4. P. 439–451. https://doi.org/10.1111/j.1095-8649.1978.tb03453.x
Grossman G.D., Simon T.N. 2020. Density-dependent effects on salmonid populations: A review // Ecol. Freshw. Fish. V. 29. № 3. P. 400–418. https://doi.org/10.1111/eff.12523
Hedger R.D., Næsje T.F., Fiske P. et al. 2013. Ice-dependent winter survival of juvenile Atlantic salmon // Ecol. Evol. V. 3. № 3. P. 523–535. https://doi.org/10.1002/ece3.481
Hindar K., Hutchings J.A., Diserud O.H., Fiske P. 2011. Stock, recruitment and exploitation // Atlantic Salmon ecology. London: Wiley-Blackwell. P. 299–331. https://doi.org/10.1002/9781444327755.ch12
ICES. 2016. Report of the Working Group on North Atlantic salmon (WGNAS). ICES CM 2016/ACOM:10. Copenhagen: ICES Headquarters, 323 p.
ICES. 2021. Working Group on North Atlantic salmon (WGNAS) // ICES Sci. Rep. V. 3. № 29. 407 p. https://doi.org/10.17895/ices.pub.7923
Jensen A.J. 2003. Atlantic salmon (Salmo salar) in the regulated river Alta: Effects of altered water temperature on parr growth // River Res. Appl. V. 19. № 7. P. 733–747. https://doi.org/10.1002/rra.710
Jonsson B., Jonsson N. 2004. Factors affecting marine production of Atlantic salmon (Salmo salar) // Can. J. Fish Aquat. Sci. V. 61. № 12. P. 2369–2383. https://doi.org/10.1139/f04-215
Jonsson B., Jonsson N. 2006. Cultured Atlantic salmon in nature: a review of their ecology and interaction with wild fish // ICES J. Mar. Sci. V. 63. № 7. P. 1162–1181. https://doi.org/10.1016/j.icesjms.2006.03.004
Jonsson B., Jonsson N. 2009. A review of the likely effects of climate change on anadromous Atlantic salmon Salmo salar and brown trout Salmo trutta, with particular reference to water temperature and flow // J. Fish Biol. V. 75. № 10. P. 2381–2447. https://doi.org/10.1111/j.1095-8649.2009.02380.x
Jonsson B., Jonsson N. 2011. Farmed Atlantic Salmon in Nature // Ecology of Atlantic Salmon and Brown Trout. Fish and Fisheries Series. V. 33. Dordrecht: Springer. P. 517–566. https://doi.org/10.1007/978-94-007-1189-1_10
Klemetsen A., Amundsen P.-A., Dempson J.B. et al. 2003. Atlantic salmon Salmo salar L., brown trout Salmo trutta L. and Arctic charr Salvelinus alpinus L.: A review of aspects of their life histories // Ecol. Freshw. Fish. V. 12. № 1. P. 1–59. https://doi.org/10.1034/j.1600-0633.2003.00010.x
Limburg K.E., Waldman J.R. 2009. Dramatic Declines in North Atlantic Diadromous Fishes // BioScie. V. 59. № 11. P. 955–965. https://doi.org/10.1525/bio.2009.59.11.7
Mills D.H. 1991. Ecology and management of Atlantic salmon. London: Chapman and Hall, 351 p.
Niemela E., Julkunen M., Erkinaro J. 1999. Revealing trends in densities of juvenile Atlantic salmon, Salmo salar L., in the subarctic River Teno using cluster analysis on long-term sampling data // Fish. Manag. Ecol. V 6. № 3. P. 207–220. https://doi.org/10.1046/j.1365-2400.1999.00154.x
Parrish D.L., Behnke R.J., Gepphard S.R. et al. 1998. Why aren’t there more Atlantic salmon (Salmo salar)? // Can. J. Fish. Aquat. Sci. V. 55. № S1. P. 281–287. https://doi.org/10.1139/d98-012
Rodriguez de Rivera O., McCrea R. 2021. Removal modelling in ecology: A systematic review. // PLoS ONE. V. 16. № 3. Article e0229965. https://doi.org/10.1371/journal.pone.0229965
Saltveit S.J. 1990. Effect of decreased temperature on growth and smoltification of juvenile Atlantic salmon (Salmo salar) and brown trout (Salmo trutta) in a Norwegian regulated river // Regul. Rivers: Res. Mgmt. V. 5. № 4. P. 295–303. https://doi.org/10.1002/rrr.3450050402
Saltveit S.J., Halleraker J.H., Arnekleiv J.V., Harby A. 2001. Field experiments on stranding in juvenile Atlantic salmon (Salmo salar) and brown trout (Salmo trutta) during rapid flow decreases caused by hydropeaking // Ibid. V. 17. № 4–5. P. 609–622. https://doi.org/10.1002/rrr.652
Webb J., Verspoor E., Aubin-Horth N. et al. 2007. The Atlantic Salmon // The Atlantic salmon: genetics, conservation and management. Oxford: Blackwell. P. 17–56. https://doi.org/10.1002/9780470995846.ch2
Weber E.D., Fausch K.D. 2003. Interactions between hatchery and wild salmonids in streams: differences in biology and evidence for competition // Can. J. Fish. Aquat. Sci. V. 60. № 8. P. 1018–1036. https://doi.org/10.1139/f03-087
Wilcox R. 2017. The regression smoother LOWESS: A confidence band that allows heteroscedasticity and has some specified simultaneous probability coverage // J. Mod. Appl. Stat. Methods. V. 16. № 2. P. 29–38. https://doi.org/10.22237/jmasm/1509494580
Windsor M.L., Hutchinson P., Hansen L.P., Reddin D.G. 2012. Atlantic salmon at sea: Findings from recent research and their implications for management. NASCO document CNL(12)60. Edinburgh: NASCO, 20 p. (http://www.nasco.int/pdf/reports_other/Salmon_at_sea.pdf)
Zippin C. 1956. An evaluation of the removal method of estimating animal populations // Biometrics. V. 12. № 2. P. 163–189. https://doi.org/10.2307/3001759
Zubchenko A.V. 1994. Salmon rivers over the Kola Peninsula. Analysis of status and possible measures to manage the population structure of Atlantic salmon in the Kola River // ICES CM 1994/M:25. Copenhagen: ICES Headquarters, 18 p. (https://www.vliz.be/imisdocs/publications/ocrd/275292.pdf)
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


