Вопросы ихтиологии, 2022, T. 62, № 5, стр. 572-593
Особенности биологии массовых рыб в российских водах Чукотского моря. 2. Семейства камбаловые Pleuronectidae, рогатковые Cottidae
А. В. Датский 1, *, Е. В. Ведищева 1, А. О. Трофимова 1
1 Всероссийский научно-исследовательский институт рыбного
хозяйства и океанографии – ВНИРО
Москва, Россия
* E-mail: adatsky@vniro.ru
Поступила в редакцию 22.09.2021
После доработки 06.12.2021
Принята к публикации 06.12.2021
- EDN: AKENLF
- DOI: 10.31857/S0042875222050071
Аннотация
По материалам исследований 1995–2020 гг. выделены массовые и потенциально промысловые рыбы российских вод Чукотского моря. Из 72 видов, отмеченных в траловых уловах, 16 видов, принадлежащих шести семействам, являлись массовыми, среди которых семейства камбаловые (Pleuronectidae) и рогатковые (Cottidae) составляли в среднем соответственно 4.8 и 0.9% всей промысловой биомассы морских рыб. Основу запасов этих рыб формировала северная палтусовидная камбала Hippoglossoides robustus, уловы прочих видов были не столь значительны. Для массовых видов камбаловых и рогатковых проанализированы размерно-возрастные и весовые характеристики, особенности линейного и весового роста, сроки, масштабы и условия нереста. Проведено сравнение биологических показателей рыб из Чукотского и Берингова морей. Отмечено, что большинство видов (северная палтусовидная, желтопёрая Limanda aspera, сахалинская L. sakhalinensis и хоботная L. proboscidea камбалы, бородавчатый керчак Myoxocephalus verrucosus) в пределах чукотского шельфа имели меньшие размеры тела, нежели рыбы из северо-западной части Берингова моря. Среди отдельных представителей (желтобрюхая Pleuronectes quadrituberculatus и звёздчатая Platichthys stellatus камбалы, арктический шлемоносец Gymnocanthus tricuspis) присутствовали более крупные особи. Прочие виды (чёрный палтус Reinhardtius hippoglossoides, несколько видов бычков) были представлены исключительно молодью и неполовозрелыми особями.
В нашей предыдущей работе (Датский и др., 2022) были опубликованы многолетние материалы по промысловой биомассе морских рыб и особенностям биологии представителей доминирующего семейства тресковых (Gadidae) в пределах российских вод Чукотского моря. Для четырёх видов (минтай Gadus chalcogrammus, треска G. macrocephalus, навага Eleginus gracilis, сайка Boreogadus saida) проанализированы размерно-возрастные и весовые характеристики рыб, особенности их линейного и весового роста, сроки, масштабы и условия нереста в исследованном водоёме и прилегающей к нему акватории северо-западной части Берингова моря. В настоящей статье приведены аналогичные данные по массовым видам семейств камбаловых (Pleuronectidae) и рогатковых (Cottidae).
Информация о материале и методике, а также о промысловой биомассе массовых рыб в целом приведена нами ранее (Датский и др., 2022). Отметим, что основой послужили материалы девяти комплексных траловых съёмок с 1995 по 2020 гг., проведённых на научно-исследовательских судах Базы исследовательского флота ВНИРО (до 2018 г. БИФ ТИНРО), в ходе которых выполнено 366 тралений. Исследованиями в летне-осенний период была охвачена значительная акватория российского сектора Чукотского моря, за исключением его прибрежной мелководной части с глубинами <26 м. Траловые съёмки в 2003, 2007 и 2008 гг. были пелагическими, в прочие годы – донными (в начале сентября 2020 г. помимо донных проведены также пять пелагических тралений). Результаты исследования биологии рыб чукотского шельфа сопоставляли с материалами траловых съёмок в северо-западной части Берингова моря, ранее приведёнными в отдельных публикациях (Датский, Андронов, 2007; Datsky, 2015; Датский, Мазникова, 2017), а также с данными по прочим арктическим морям.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Семейство камбаловые Pleuronectidae
Северная палтусовидная камбала Hippoglossoides robustus в северной части Тихого океана достигает длины тела по Смитту (FL) 58 см, массы 1.8 кг и возраста 27 лет, в уловах преобладают особи FL 27–40 см и массой 0.23−0.88 кг (Фадеев, 1987; Munk, 2001). Данный вид камбал, наряду с минтаем и сайкой, входит в список рыб, наиболее многочисленных в российских водах Чукотского моря (Датский и др., 2022. Табл. 2). Его основные скопления приурочены к юго-западной части моря (Mecklenburg et al., 2016; Орлов и др., 2019). Уловы были представлены рыбами FL 4–46 см с преобладанием (до 88%) в разные годы особей FL 10–23 см (рис. 1). Более крупные камбалы, а также молодь FL 4–7 см, отмеченная в основном в пелагиали (рис. 1б, 1в), встречались в значительно меньших количествах. Наибольшие размеры рыб отмечены в сравнительно тёплые годы: в 1997, 2018–2020 гг.
Рис. 1.
Размерный состав северной палтусовидной камбалы Hippoglossoides robustus из траловых уловов в российских водах Чукотского моря: а – август–сентябрь 1997 г. (M = 16.6 см, n = 513 экз.), б – август 2007 г. (M = 14.6 см, n = 33 экз.), в – сентябрь 2008 г. (M = 15.7 см, n = 194 экз.), г – сентябрь 2010 г. (M = 14.3 см, n = 341 экз.), д – сентябрь 2018 г. (M = 17.4 см, n = 3103 экз.), е – август 2019 г. (M = 16.4 см, n = 4533 экз.), ж – август–сентябрь 2020 г. (M = 17.2 см, n = 5244 экз.).

В целом северная палтусовидная камбала, пойманная на чукотском шельфе, была значительно мельче рыб из прилегающей к нему акватории Берингова моря. Так, в Чукотском море преобладали особи FL 12–22 см в возрасте 5–9 лет, в то время как в северо-западной части Берингова моря доминировала камбала FL 14–29 см в возрасте 8–15 лет (рис. 2). Ещё более заметно увеличение доли рыб меньших размеров в направлении с юга на север. Наиболее крупные представители вида отмечены в Корякском районе и западной части Анадырского залива, сходные размерно-возрастные ряды характерны для смежных районов – чукотского шельфа и бассейна Чирикова (рис. 3).
Рис. 2.
Размерный (а) и возрастной (б) состав северной палтусовидной камбалы Hippoglossoides robustus из донных траловых уловов в российских водах в 1997–2020 гг.: (◼), (◻) – Чукотское море (M = 16.4 см, средний возраст – 5.8 года, n = 13 734 экз.); (–⚪–) – Берингово море (M = 20.9 см, 9.6 года, n = 5875 экз.).

Рис. 3.
Размерный (а–д) и возрастной (е–к) состав северной палтусовидной камбалы Hippoglossoides robustus в донных траловых уловах из российских вод в 1997–2020 гг.: (а–к), (‑ ‑), (◼) – Чукотское море (M = 17.4 см, средний возраст – 5.8 года, n = 3103 экз.); (—), (◻) – Берингово море: а, е – бассейн Чирикова (M = 19.8 см, 8.7 года, n = 90 экз.); б, ж – северная (M = 21.0 см, 9.4 года, n = 1604 экз.); в, з – центральная (M = 20.7 см, 9.2 года, n = 3823 экз.); г, и – западная части Анадырского залива (M = 23.1 см, 10.1 года, n = 263 экз.); д, к – Корякский район (M = 25.0 см, 10.7 года, n = 95 экз.).

Масса неполовозрелых особей северной палтусовидной камбалы FL 4–18 см в районе исследований составляла 1–43 г. Среди половозрелых рыб самки были крупнее самцов: соответственно 9–46 см, 7–813 г и 11–21 см, 4–90 г (табл. 1). При этом первые численно преобладали над последними, что весьма характерно для данного вида и в других районах его обитания (Золотов, 2007; Датский, Мазникова, 2017). Зависимость массы (W, г) от длины (FL, см) описывается уравнением: W = = 0.005FL3.1942 (r = 0.97, n = 711 экз.).
Таблица 1.
Длина, масса и соотношение полов у северной палтусовидной камбалы Hippoglossoides robustus из уловов в российских водах Чукотского моря
| Сроки работ |
n, экз. | Длина (FL), см | Масса, г | Соотно-шение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполо- возрелые |
Половозрелые | Неполо- возрелые |
Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| 09.2010 | 233 | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 16.2}}{{10.8}}$ | $\frac{{10.0{\kern 1pt} --{\kern 1pt} 29.0}}{{17.9}}$ | $\frac{{12.0{\kern 1pt} --{\kern 1pt} 20.8}}{{14.5}}$ | $\frac{{10.0{\kern 1pt} --{\kern 1pt} 29.0}}{{16.8}}$ | $\frac{{3.0{\kern 1pt} --{\kern 1pt} 35.0}}{{12.3}}$ | $\frac{{15.0{\kern 1pt} --{\kern 1pt} 200.0}}{{66.7}}$ | $\frac{{15.0{\kern 1pt} --{\kern 1pt} 90.0}}{{29.6}}$ | $\frac{{15.0{\kern 1pt} --{\kern 1pt} 200.0}}{{54.6}}$ | 2.1 : 1.0 |
| 08–09.2018 | 235 | $\frac{{7.3{\kern 1pt} --{\kern 1pt} 17.7}}{{11.1}}$ | $\frac{{11.2{\kern 1pt} --{\kern 1pt} 45.5}}{{21.6}}$ | $\frac{{11.1{\kern 1pt} --{\kern 1pt} 19.9}}{{16.7}}$ | $\frac{{11.1{\kern 1pt} --{\kern 1pt} 45.5}}{{20.1}}$ | $\frac{{2.0{\kern 1pt} --{\kern 1pt} 43.0}}{{11.7}}$ | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 813.0}}{{106.9}}$ | $\frac{{11.0{\kern 1pt} --{\kern 1pt} 78.0}}{{37.0}}$ | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 813.0}}{{86.5}}$ | 2.6 : 1.0 |
| 08.2019 | 272 | $\frac{{4.3{\kern 1pt} --{\kern 1pt} 12.5}}{{9.1}}$ | $\frac{{8.4{\kern 1pt} --{\kern 1pt} 29.3}}{{19.2}}$ | $\frac{{10.5{\kern 1pt} --{\kern 1pt} 19.2}}{{13.7}}$ | $\frac{{8.4{\kern 1pt} --{\kern 1pt} 29.3}}{{17.5}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 16.0}}{{5.3}}$ | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 235.0}}{{75.4}}$ | $\frac{{4.0{\kern 1pt} --{\kern 1pt} 55.0}}{{20.2}}$ | $\frac{{4.0{\kern 1pt} --{\kern 1pt} 235.0}}{{57.3}}$ | 2.0 : 1.0 |
| 08–09.2020 | 75 | – | – | – | $\frac{{7.8{\kern 1pt} --{\kern 1pt} 29.7}}{{17.5}}$ | – | – | – | $\frac{{4.0{\kern 1pt} --{\kern 1pt} 308.0}}{{65.5}}$ | – |
Наибольшие приросты камбал в пределах чукотского шельфа отмечены у 2–7-годовалых особей с максимумом в возрасте 3–4 года (до 3.7 см в год). Масса рыб начинала ускоренно возрастать несколько позже, по достижению 5-го года жизни, при этом у 6–7-годовалых особей прирост массы был наибольшим – до 50 г в год (табл. 2). Учитывая, что самцы северной палтусовидной камбалы массово созревают в возрасте 3–5 лет при FL 14–19 см, а самки – 7–9 лет при FL 21–24 см (Золотов, 2007; Датский, Мазникова, 2017), можно предположить, что ускоренные приросты массы тела рыб обусловлены процессом полового созревания. В целом данному виду при его преимущественном обитании в холодоводных акваториях в отличие от прочих видов камбал характерна низкая скорость роста при более раннем половом созревании (Золотов, 2007).
Таблица 2.
Длина и масса северной палтусовидной камбалы Hippoglossoides robustus разного возраста из уловов в российских водах Чукотского моря, по данным 2018 г.
| Возраст, годы | Длина (FL), см | Масса, г | n, экз. | ||
|---|---|---|---|---|---|
| min–max | М | min–max | М | ||
| 2 | 7.0–10.0 | 8.8 | 2–7 | 5 | 7 |
| 3 | 11.1–12.6 | 11.9 | 11–17 | 13 | 10 |
| 4 | 13.5–17.4 | 15.6 | 18–40 | 28 | 15 |
| 5 | 15.7–20.8 | 17.9 | 25–94 | 45 | 55 |
| 6 | 18.2–24.3 | 21.0 | 42–134 | 83 | 38 |
| 7 | 22.1–25.8 | 24.2 | 71–220 | 133 | 30 |
| 8 | 23.8–28.3 | 25.9 | 128–234 | 162 | 14 |
| 9 | 26.4–29.0 | 27.4 | 180–229 | 204 | 5 |
| 10 | – | – | – | – | 0 |
| 11 | 30.6–32.7 | 31.6 | 274–365 | 320 | 2 |
| 27 | – | 45.5 | – | 813 | 1 |
Палтусовидные камбалы относятся к весенненерестующим видам: в северо-западной части Берингова моря нерестятся с середины апреля до середины июня на глубинах <100 м при температуре придонного слоя воды –1.7–2.4°C (Перцева-Остроумова, 1961; Фадеев, 1987), в Чукотском море – с мая по сентябрь (Дьяков, 2011). Наибольшие скопления икры северной палтусовидной камбалы (до 71 шт/м2) отмечены в юго-западной части Анадырского залива, на траверзе б. Угольная, над глубиной 65 м (Перцева-Остроумова, 1961). К сожалению, в Чукотском море и прилегающих акваториях Берингова моря до сих пор не обнаружены места массового размножения вида и последующего обитания личинок и мальков. При этом нахождение некоторых рыб (до 23% самок и 8% самцов) в посленерестовом состоянии (гонады VI–II стадий зрелости) в августе 2019 г. (табл. 3) позволяет предположить, что вид в пределах чукотского шельфа может нереститься летом. Косвенным подтверждением этого можно считать присутствие в августе–сентябре икры и личинок северной палтусовидной камбалы в северо-восточной части Чукотского моря (Logerwell et al., 2020), что может быть результатом их выноса в эту акваторию течениями. Увеличение средней продолжительности сроков нереста и его смещение на более поздние сроки в Чукотском море, вероятно, представляют собой адаптации камбал к суровым условиям среды (Дьяков, 2006). У большинства производителей в конце лета–начале осени проходил процесс формирования новых половых продуктов с ускоренным их созреванием у самцов (табл. 3).
Таблица 3.
Распределение северной палтусовидной камбалы Hippoglossoides robustus по стадиям зрелости гонад в российских водах Чукотского моря в августе–сентябре 2007–2019 гг., %
| Месяц, год | Пол | Стадия зрелости гонад | n, экз. | ||||
|---|---|---|---|---|---|---|---|
| II | III | IV | V | VI–II | |||
| Август, 2007 | Самки | 100.0 | 0 | 0 | 0 | 0 | 1 |
| Самцы | 0 | 0 | 0 | 0 | 0 | 0 | |
| Сентябрь, 2010 | Самки | 54.6 | 23.7 | 20.6 | 1.1 | 0 | 97 |
| Самцы | 44.7 | 38.3 | 17.0 | 0 | 0 | 47 | |
| Сентябрь, 2018 | Самки | 43.1 | 51.0 | 5.9 | 0 | 0 | 153 |
| Самцы | 11.7 | 36.7 | 43.3 | 8.3 | 0 | 63 | |
| Август, 2019 | Самки | 40.4 | 51.3 | 0 | 0 | 8.3 | 156 |
| Самцы | 65.8 | 7.6 | 3.8 | 0 | 22.8 | 76 | |
Желтобрюхая камбала Pleuronectes quadrituberculatus является крупным видом, достигая наибольших FL 66 см, массы 3.8 кг и возраста 30 лет в северо-западной части Берингова моря. При этом основу уловов составляют половозрелые рыбы FL 25–51 см и массой 0.3–1.4 кг в возрасте 8–17 лет (Датский, Андронов, 2007). В Чукотском море она не столь многочисленна, как северная палтусовидная камбала, однако в отдельные годы может формировать локальные промысловые скопления (Датский и др., 2022. Табл. 2).
Желтобрюхая камбала на чукотском шельфе была представлена рыбами FL 19–45 см с преобладанием размерной группы 26–29 см (39%). Учитывая, что массовое половое созревание самцов и самок этого вида в пределах прилегающего к району исследований Берингова моря происходит при длине соответственно 23–24 и 27–30 см (Фадеев, 1987; Датский, Мазникова, 2017), доля неполовозрелых рыб FL < 23 см была весьма незначительна – 7.7% (рис. 4). В целом отсутствие в Чукотском море, в отличие от северо-западных беринговоморских вод, молоди камбал FL < 19 см и старшевозрастных особей FL > 45 см можно объяснить как особенностями биологии вида, так и малыми сборами первичного материала из траловых уловов. При этом присутствие на чукотском шельфе среднеразмерных рыб вполне закономерно. Они имеют наиболее широкое пространственное распределение (Датский, Андронов, 2007) и в разные годы формируют северную границу ареала вида в зависимости от гидрологических условий (Allen, Smith, 1988; Дьяков, 2011; Mecklenburg et al., 2018).
Рис. 4.
Размерный состав желтобрюхой камбалы Pleuronectes quadrituberculatus в донных траловых уловах на российском шельфе в 1996–2020 гг.: (j) – Чукотское море (M = 29.8 см, n = 39 экз.), (h) – Берингово море (M = 27.8 см, n = 9353 экз.).

Размерный состав желтобрюхой камбалы в уловах наглядно продемонстрирован на рис. 5. Наиболее крупные особи придерживались северной и центральной частей Анадырского залива. На чукотском шельфе, в западной части залива и акватории юго-западнее м. Наварин встречались преимущественно рыбы средних размерных классов. При этом в двух последних районах и частично на севере залива отмечена и молодь. В целом желтобрюхая камбала отдает предпочтение более солёным и тёплым водам Наваринского течения (Харитонова и др., 1999), по мере его выхолаживания и опреснения в северном направлении её численность снижается.
Рис. 5.
Размерный состав желтобрюхой камбалы Pleuronectes quadrituberculatus в донных траловых уловах из российских вод в 1996–2020 гг.: (а–г), (‑ ‑) – Чукотское море (M = 29.8 см, n = 39 экз.); (—) – Берингово море: а, б, в – соответственно северная (M = 38.9 см, n = 1115 экз.), центральная (M = 41.1 см, n = 980 экз.) и западная (M = 32.3 см, n = 920 экз.) части Анадырского залива; г – Корякский район (M = 27.7 см, n = 6339 экз.).

Средние линейно-весовые показатели у самок желтобрюхой камбалы выше, чем у самцов: обычно самые крупные особи были самками. К примеру, для северо-западной части Берингова моря разница в длине и массе между рыбами разных полов в среднем составляла соответственно 5.8 см и 570 г с численным преобладанием самок в траловых уловах (Датский, Мазникова, 2017). Для Чукотского моря данных для такого анализа недостаточно, можно лишь отметить, что две подвергнутые биологическому анализу камбалы FL 45 см были самками и имели массу тела 1190 и 2000 г.
В северо-западной части Берингова моря желтобрюхая камбала нерестится в мае–июне на глубинах 180–200 м. Вымет икры происходит как у дна при температуре воды –1.7–1.4°С, так и в поверхностных слоях при температуре –1.5–3.1°С (Фадеев, 1987). Личинки длиной 5.9–6.5 мм держатся на местах нереста или вблизи от них на глубинах 71–100 м, молодь длиной 5.8–8.7 см концентрируется в бухтах на глубине 9–10 м (Перцева-Остроумова, 1961). Данные по районам икрометания желтобрюхой камбалы в Чукотском море не найдены, вероятность их обнаружения невелика, если принимать во внимание отсутствие крупных половозрелых рыб и указанные выше глубины нереста этой камбалы. При этом личинки данного вида обнаружены в августе–сентябре 2012–2013 гг. в восточной части моря (Logerwell et al., 2020).
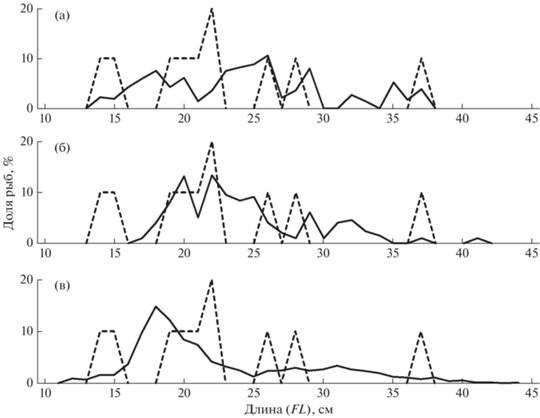
Желтопёрая камбала Limanda aspera – ещё один относительно крупный и массовый вид камбаловых рыб, ареал которого простирается практически до северной границы Чукотского моря (Allen, Smith, 1988; Линдберг, Федоров, 1993; Дьяков, 2011; Mecklenburg et al., 2016, 2018). Желтопёрая камбала в пределах своего ареала достигает максимальных FL 49 см, массы 1.7 кг и возраста 39 лет (Фадеев, 2005; Love et al., 2016). Основные скопления этого вида, помимо Охотского моря, отмечены в северо-западной части Берингова моря на корякском шельфе. В траловых уловах здесь встречаются камбалы FL 12–44 см с преобладанием рыб размерных групп 17–21 и 28–32 см. Отмечена в этом районе и поимка особи FL 45 см, массой 1.42 кг в возрасте 19 лет (Датский, Мазникова, 2017). В Чукотском море желтопёрая камбала зарегистрирована не во всех траловых съёмках, однако с потеплением водных масс она формировала локальные скопления в летне-осенний период 2018 и 2020 гг. (Датский и др., 2022. Табл. 2).
Материалы по этой камбале свидетельствуют о присутствии на чукотском шельфе рыб FL 14–37 см. Наибольшую встречаемость в районе исследований обнаруживали среднеразмерные особи FL 19–22 см, также составлявшие в прилегающей северо-западной части Берингова моря основу траловых уловов (рис. 6). При этом наиболее широкий спектр размеров камбал отмечен в пределах корякского шельфа, где рыбы в целом мельче за счёт присутствия молоди FL < 19 см. С продвижением на север размеры камбал возрастали, увеличивалась доля старшевозрастных особей, которые предпочитали придерживаться широкого и благоприятного в кормовом плане Анадырского залива (рис. 7). Лишь часть рыб смещалась к северной границе ареала, где их появлению, вероятно, благоприятствовало тёплое Наваринское течение, усиление которого отмечено в тёплые по климатическим условиям годы (2018–2020).
Рис. 6.
Размерный состав желтопёрой камбалы Limanda aspera в донных траловых уловах на российском шельфе в 1999–2020 гг.: (◼) – Чукотское море (M = 22.4 см, n = 10 экз.), (◻) – Берингово море (M = 22.5 см, n = 7047 экз.).

Рис. 7.
Размерный состав желтопёрой камбалы Limanda aspera в донных траловых уловах из российских вод в 1999–2020 гг.: (а–в), (‑ ‑) – Чукотское море (M = 22.4 см, n = 10 экз.); (—) – Берингово море: а, б – соответственно северная (M = 24.3 см, n = 71 экз.) и западная (M = 24.2 см, n = 99 экз.) части Анадырского залива; в – Корякский район, M = 22.5 см, n = 6877 экз.).
В северо-западной части Берингова моря желтопёрой камбале характерны бо́льшие размеры и масса самок. Самцы после наступления половой зрелости замедляли свой рост, разница между средними значениями длины и массы тела самцов и самок достигала 3.0 см и 220 г. С возрастом самки ещё больше перегоняли самцов по длине и массе, они численно преобладали в уловах (Датский, Мазникова, 2017).
Желтопёрая камбала довольно быстро растёт в первые два года, достигая FL 9–16 см в зависимости от района обитания. В последующем годовой прирост снижается до 3–6 см по достижению 5-годовалого возраста и до 1.5–2.0 см у рыб старших возрастов. Самцы впервые созревают в Беринговом море при FL 12–25 см, массово – при FL 17 см в возрасте 3–4 года. Самки – соответственно при FL 19–35 и 29 см в возрасте 8–9 лет (Фадеев, 1987). Аналогичных данных по Чукотскому морю собрать не удалось.
В западной части Берингова моря желтопёрая камбала размножается с июня по начало августа при температуре воды 1–4°С на глубинах <50 м, заканчивая нереститься иногда в конце августа–начале сентября (Перцева-Остроумова, 1961). Материалы из северо-западной части Берингова моря показали присутствие нерестующих и недавно отнерестившихся особей в августе в годы с развитием гидрологических условий по холодному типу (Датский, Мазникова, 2017). Сведений о местах нереста желтопёрой камбалы, количестве и распределении её икры на чукотском шельфе не обнаружено. Учитывая малое число производителей в районе исследований, с большой долей вероятности можно говорить о том, что вид здесь не нерестится. На это указывают и данные по распространению икры желтопёрой камбалы: её северное распространение ограничено м. Наварин (Дьяков, 2011). В то же время, как и в случае с желтобрюхой камбалой, личинки L. aspera обнаружены (причём в бо́льших количествах) в августе–сентябре 2012–2013 гг. в восточной части Чукотского моря (Logerwell et al., 2020).
Прочие камбалы (звёздчатая Platichthys stellatus, сахалинская L. sakhalinensis, хоботная L. proboscidea) были менее численными на чукотском шельфе по сравнению с вышеописанными видами. Звёздчатая камбала – крупный представитель семейства, достигающий в водах западной части Берингова моря FL 46 см, массы тела 1.97 кг и возраста 38 лет (Золотов, 2010), за счёт своих размеров может в отдельные годы формировать в районе исследований локальный промысловый запас (Датский и др., 2022. Табл. 2). При этом для уточнения этого запаса необходимо охватывать исследованиями малые глубины, учитывая, что эта камбала предпочитает мелководный шельф Чукотского полуострова (Дьяков, 2011; Chernova, 2011). Сборы по звёздчатой камбале минимальны: в водах Чукотского моря имеются сведения о поимке трёх рыб FL 24, 44 и 45 см (рис. 8а), масса наиболее мелкой 190 г. Скудности данных способствовало отсутствие тралений на глубинах <25 м, где в летне-осенний период в основном обитает этот вид (Золотов, 2010). В то же время крупные размеры пойманных особей указывают на постоянное обитание звёздчатой камбалы на мелководье чукотского шельфа, учитывая её кормовые миграции на бо́льшие глубины и то, что она не совершает протяжённых миграций в течение жизни.
Рис. 8.
Размерный состав сахалинской Limanda sakhalinensis, хоботной L. proboscidea и звёздчатой Platichthys stellatus камбал в донных траловых уловах из российских вод в 1996–2020 гг.: а – Чукотское море, б–г – Берингово море: б, в – соответственно северная часть и западная части Анадырского залива; г – Корякский район. Камбалы: (‑ ‑) – сахалинская (n = = 1079 экз.), (—) – хоботная (n = 856 экз.), (◻) – звёздчатая (n = 3 экз.).

Встречаемость на чукотском шельфе относительно мелких сахалинской и хоботной камбал сравнительно низкая, что вполне объяснимо, учитывая проходящую по нему северную границу их ареалов (Allen, Smith, 1988; Дьяков, 2011; Mecklenburg et al., 2018). Длина, масса и возраст первого вида достигают в западной части Берингова моря 34 см, 500 г и 17 лет (Золотов, 2010). Самые крупные рыбы зарегистрированы на корякском шельфе, с продвижением на север размеры вида снижались (рис. 8б–8г). В пределах района исследования в 2018, 2020 гг. отмечены поимки сахалинской камбалы FL 13, 15, 18 и 24 см, нахождению которых здесь с большой долей вероятности способствовало общее потепление водных масс, характерное для конца 2010-х гг. (Eisner, 2019). Принимая во внимание половое созревание самцов и самок этого вида при FL 13 и 16 см в возрасте соответственно 2 и 4 года (Золотов, 2010), можно предположить, что все камбалы на шельфе Чукотского моря были половозрелыми. Относительно хоботной камбалы, достигающей FL 42 см, массы 740 г и возраста 13 лет (Золотов, 2010), можно отметить поимку в 2018 г. лишь одного экземпляра FL 18 см. Основная масса рыб этого вида отмечена южнее Берингова пролива, для них выявлена тенденция к увеличению доли более крупных рыб в юго-западном направлении. В этой акватории самцы и самки впервые созревают при достижении FL 16 и 18 см на третьем–четвёртом году жизни (Золотов, 2010).
Звёздчатая и хоботная камбалы начинают нереститься в апреле, сахалинская – в мае (с пиком у всех видов в июле), заканчивают к сентябрю. Основные места нереста этих рыб располагаются в юго-западной части Берингова моря, икра и личинки не отмечены севернее м. Наварин (Дьяков, 2019). В российских водах Чукотского моря их нерест не зарегистрирован и, учитывая отсутствие большого числа производителей сахалинской и хоботной камбал, маловероятно, что и эти виды здесь нерестятся. Однако имеются сведения о нахождении личинок этих видов в восточной части моря (Logerwell et al., 2020). Звёздчатая камбала, по-видимому, может формировать на мелководье локальные нерестовые участки, однако для выяснения этого необходимо проводить специализированные исследования. При этом есть сведения о её размножении в арктических водах по достижению ими температуры 1.5–6.8°C (Coad et al., 1995).
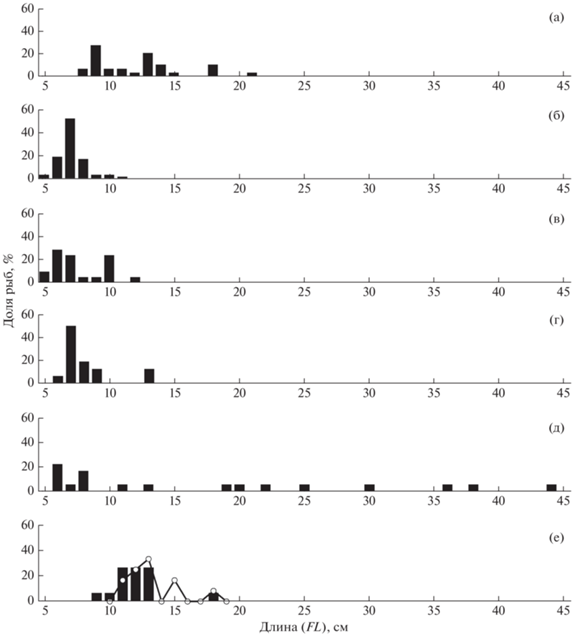
Тихоокеанский чёрный палтус Reinhardtius hippoglossoides наряду с белокорым палтусом Hippoglossus stenolepis является наиболее крупным представителем камбаловых рыб, достигая FL 130 см, массы 13 кг и возраста 24 лет (Новиков, 1974; Новиков и др., 1992). В траловых уловах молодь чёрного палтуса начинает встречаться в большом количестве при FL 10–15 см в возрасте 1 год. При достижении FL ~ 30 см и возраста 3 года молодь обитает в основном в пределах шельфа, переходя по мере роста на бо́льшие глубины. В пределах материкового склона (≥200 м) основу уловов составляют особи в возрасте 4–21 год при FL 30–90 см (Шунтов, 1971; Мазникова и др., 2015).
Учитывая закономерности батиметрического распределения чёрного палтуса, ожидаемым представляется присутствие на мелководном чукотском шельфе преимущественно молоди вида FL до 5–21 см в возрасте 0+–2+. Лишь в 2018 г. зафиксированы незначительные заходы рыб FL 22–44 см (рис. 9). Отметим, что единичные поимки палтуса FL 44–65 см на севере и северо-западе Чукотского моря в пределах его аваншельфа на глубинах 230–370 м описаны и ранее (Циновский, 1981; Mecklenburg et al., 2014), однако массовых скоплений вида обнаружено не было. Полученные данные свидетельствуют в пользу выноса молоди чёрного палтуса на чукотский шельф (вдоль побережья Аляски до м. Лисберн и в сторону Чукотского подводного плато) посредством тихоокеанских течений через Берингов пролив из Берингова моря, где находятся основные нерестилища и нагульные акватории тихоокеанской группировки вида (Дьяков, 1990, 2011; Шунтов и др., 1994; Barber et al., 1997; Mecklenburg et al., 2002; Чернова, 2017). Подобный вынос молоди из Баренцева моря с тёплыми водами атлантического происхождения в моря Карское и Лаптевых отмечен и для северо-восточного арктического чёрного палтуса R. hippoglossoides (Филина, Буданова, 2015; Глебов и др., 2016). В целом удалённость Чукотского моря от мест обитания взрослых особей тихоокеанского палтуса, малое их присутствие здесь (Датский и др., 2022. Табл. 2), а также тот факт, что половое созревание рыб происходит при FL 42–52 см (Фадеев, 2005), свидетельствуют о небольшом промысловом значении вида в районе исследований.
Рис. 9.
Размерный состав чёрного палтуса Reinhardtius hippoglossoides в траловых уловах из российских вод Чукотского моря: а – август–сентябрь 1997 г. (M = 12.1 см, n = 29 экз.), б – август 2007 г. (M = 7.2 см, n = 117 экз.), в – сентябрь 2008 г. (M = 7.6 см, n = 21 экз.), г – сентябрь 2010 г. (M = 8.1 см, n = 16 экз.), д – сентябрь 2018 г. (M = 17.4 см, n = 18 экз.); е – август–сентябрь 2020 г.: (◼) – донные научные траления (M = 12.1 см, n = 15 экз.), (−⚪−) – пелагические промысловые траления (M = 13.2 см, n = 12 экз.).
Особенности распространения молоди на шельфе Чукотского и Берингова морей наглядно отражены на рис. 10, 11. Если в Чукотском море доминировали особи FL 6–14 см (до 83% всех рыб), то в Беринговом преобладали более крупные рыбы FL 22–28 см (43%) с незначительными выходами на шельф крупноразмерного палтуса. В основном поимки крупных особей отмечены в Корякском районе, где относительно узкий шельф благоприятствует кормовым миграциям в эту акваторию половозрелых рыб с материкового склона. В северном направлении присутствие таких особей в траловых уловах закономерно снижается, отражаясь на средних размерах вида. Отметим, что траловые орудия лучше отлавливают мелкоразмерных рыб, что позволяет оценить урожайность отдельных поколений вида, в то время как в донные ярусы и жаберные сети преимущественно попадают старшевозрастные особи (Мазникова и др., 2015).
Рис. 10.
Размерный состав чёрного палтуса Reinhardtius hippoglossoides в донных траловых уловах на российском шельфе в 1997–2020 гг.: (◼) – Чукотское море (M = 12.5 см, n = 80 экз.), (◻) – Берингово море (M = 26.1 см, n = 94 экз.).

Рис. 11.
Размерный состав чёрного палтуса Reinhardtius hippoglossoides в донных траловых уловах из российских вод в 1997–2020 гг.: (а–в), (‑ ‑) – Чукотское море (M = 9.3 см, n = 238 экз.); (—) – Берингово море: а, б – соответственно центральная (M = 19.8 см, n = 39 экз.) и западная (M = 25.3 см, n = 31 экз.) части Анадырского залива; в – Корякский район (M = 37.3 см, n = 24 экз.).

В водах Чукотского моря неполовозрелые особи палтуса FL 6–21 см имели массу 1–100 г. Самки при бо́льших предельных размерах в среднем были мельче самцов, опережая последних по массе (табл. 4). С возрастом разница в одной возрастной группе между более крупными самками и самцами достигает 7 см, при этом в уловах среди рыб FL < 50 см преобладают самцы, у старшевозрастных рыб самок становится в два–три раза больше (Датский, Мазникова, 2017). В нашем случае самки незначительно преобладали над самцами, однако малочисленные сборы могут не отражать истинного соотношения полов. Сходное преобладание самок среди рыб FL 15–45 см, только в большем соотношении (2.8 : 1.0), отмечено у палтуса морей Восточно-Сибирского и Лаптевых (Чернова, 2017).
Таблица 4.
Длина, масса и соотношение полов у чёрного палтуса Reinhardtius hippoglossoides из уловов в российских водах Чукотского моря
| Сроки работ |
n, экз. | Длина (FL), см | Масса, г | Соотно-шение самки : самцы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Неполо- возрелые |
Половозрелые | Неполо- возрелые |
Половозрелые | |||||||
| самки | самцы | оба пола | самки | самцы | оба пола | |||||
| 08–09.1997 | 10 | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 21.0}}{{13.7}}$ | – | – | – | $\frac{{9.0{\kern 1pt} --{\kern 1pt} 100.0}}{{27.4}}$ | – | – | – | – |
| 09.2010 | 5 | $\frac{{7.0{\kern 1pt} --{\kern 1pt} 13.0}}{{8.8}}$ | – | – | – | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 12.0}}{{3.8}}$ | – | – | – | – |
| 08–09.2018 | 11 | $\frac{{5.5{\kern 1pt} --{\kern 1pt} 7.8}}{{6.5}}$ | $\frac{{19.4{\kern 1pt} --{\kern 1pt} 44.2}}{{30.3}}$ | $\frac{{24.7{\kern 1pt} --{\kern 1pt} 38.2}}{{31.0}}$ | $\frac{{19.4{\kern 1pt} --{\kern 1pt} 44.2}}{{30.6}}$ | $\frac{{1.0{\kern 1pt} --{\kern 1pt} 2.0}}{{1.3}}$ | $\frac{{38.0{\kern 1pt} --{\kern 1pt} 780.0}}{{312.0}}$ | $\frac{{103.0{\kern 1pt} --{\kern 1pt} 489.0}}{{262.0}}$ | $\frac{{38.0{\kern 1pt} --{\kern 1pt} 780.0}}{{291.0}}$ | 1.3 : 1.0 |
Для чёрного палтуса в пределах чукотского шельфа зависимость длина–масса следующая: W = 0.0022FL3.3793 (r = 0.98, n = 26 экз.).
Все проанализированные рыбы в конце лета находились преимущественно на стадии покоя половых продуктов (по 3 экз. самок и самцов), лишь у одной самки (FL 44.2 см, 780 г) гонады начали созревать. Полученные данные сопоставимы для этого периода со сведениями по рыбам северо-западной части Берингова и Карского морей (Филина, Буданова, 2015; Мазникова и др., 2018).
Места размножения чёрного палтуса в Чукотском море до настоящего времени не обнаружены, есть лишь гипотезы о возможном нересте рыб в прилегающих к району исследований Северном Ледовитом океане и море Бофорта (Чернова, 2017). Можно предположить, что условия для воспроизводства в исследованном нами районе Арктики неблагоприятны для данного вида и поимка единственной особи с созревающими половыми продуктами лишь подтверждает это. Сходная ситуация отмечена и в западном секторе Арктики, где общее потепление в 2007–2010 гг. привело к появлению в Карском море в небольшом количестве половозрелого палтуса в пред- и посленерестовом состоянии, указывающего на его возможный локальный нерест в этой в целом неблагоприятной для обитания вида акватории (Филина, Буданова, 2015).
В смежном с Чукотским Беринговом море палтус нерестится в октябре–декабре между прол. Унимак и о-вами Прибылова (Alton et al., 1988), а также вдоль корякского побережья и в южной части Анадырского залива, между м. Наварин и о-вом Св. Матвея на глубинах 100–680 м при температуре воды 1.0–3.5°С (Новиков, 1974). Икра созревает в толще воды на глубинах >550 м, личинки по мере развития сносятся в мелководные участки. Мальки чёрного палтуса FL 59–65 мм встречены в южной части Анадырского залива на глубинах 18–40 м (Мусиенко, 1957).
Семейство рогатковые Cottidae
Бородавчатый керчак Myoxocephalus verrucosus относится к крупным бычкам, достигая в пределах своего ареала FL 54 см, массы 2.2 кг и возраста 13 лет. Как правило, таких величин достигают самки данного вида, наибольшие длина и возраст самцов не превышают 26 см и 9 лет (Андрияшев, 1954; Токранов, 1986). В прилегающей к району исследования северо-западной части Берингова моря бородавчатый керчак придерживается шельфа с глубинами <70 м, абсолютно доминируя в сообществах рыб между мысами Чукотский и Дежнёва (Датский, Андронов, 2007). В Чукотском море распространён вдоль побережья Аляски до м. Лисберн (Allen, Smith, 1988), в российских водах его встречаемость также высока (Орлов и др., 2019).
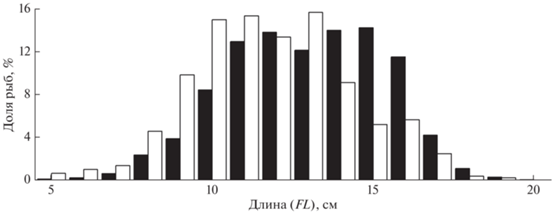
На чукотском шельфе в траловых уловах встречался бородавчатый керчак FL 6–50 см с преобладанием особей FL 30–42 см (~59% по численности). Последние в основном доминировали в придонных горизонтах, в то время как в пелагиали была высока доля молоди FL 6–20 см (рис. 12). В целом особи вида в районе исследований несколько мельче рыб из северо-западной части Берингова моря за счёт большего присутствия неполовозрелых рыб FL 9–14 см и отсутствия крупноразмерных бычков FL > 50 см (рис. 13) в возрасте 10–11 лет (Датский, Андронов, 2007).
Рис. 12.
Размерный состав бородавчатого керчака Myoxocephalus verrucosus из траловых уловов в российских водах Чукотского моря: а – август 2007 г. (M = 18.3 см, n = 39 экз.), б – сентябрь 2008 г. (M = 19.9 см, n = 51 экз.), в – сентябрь 2010 г. (M = 29.6 см, n = 213 экз.), г – сентябрь 2018 г. (M = 28.6 см, n = 29 экз.), д – август 2019 г. (M = 33.4 см, n = 34 экз.).
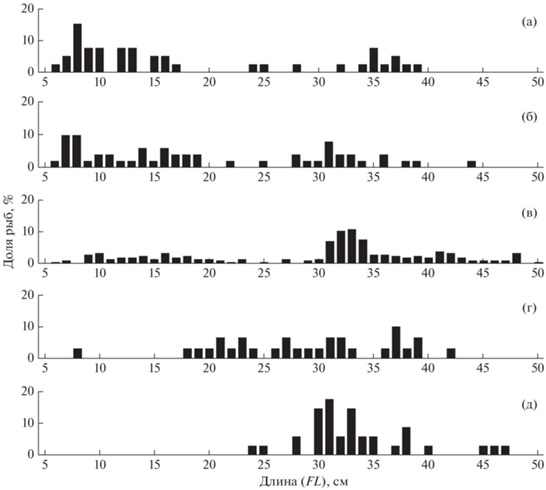
Рис. 13.
Размерный состав бородавчатого керчака Myoxocephalus verrucosus в донных траловых уловах на российском шельфе 2001–2019 гг.: (◼) – Чукотское море (M = 29.7 см, n = 280 экз.), (◻) – Берингово море (M = 30.0 см, n = 774 экз.).

Если рассматривать размеры бычков по отдельным районам шельфа в пределах российских вод Чукотского и Берингова морей, то в большинстве участков рыбам с чукотского шельфа был характерен широкий диапазон значений длины особей в модальной группе (рис. 14). Наиболее сходным с чукотским шельфом размерный состав рыб был в акватории южнее Берингова пролива (бассейн Чирикова). На севере Анадырского залива отмечены наиболее мелкие рыбы, крупноразмерные особи отсутствовали. В западной части залива и на корякском шельфе, напротив, доля крупных особей была больше, нежели в Чукотском море. Исключительно половозрелые рыбы придерживались центральной части Анадырского залива, в то время как основная масса бычков предпочитала прибрежные участки шельфа с глубинами <70 м (Датский, 2017). Особенностью распределения вида в пределах чукотского шельфа следует признать и нахождение здесь значительного количества молоди FL < 12 см, в то время как в южных районах, за исключением бассейна Чирикова, она практически не отмечена в траловых уловах.
Рис. 14.
Размерный состав бородавчатого керчака Myoxocephalus verrucosus из донных траловых уловов в российских водах в 2001–2019 гг.: (а–д), (‑ ‑) – Чукотское море (M = 29.7 см, n = 280 экз.); (—) – Берингово море: а – бассейн Чирикова (M = 31.3 см, n = 135 экз.); б, в, г – соответственно северная (M = 28.0 см, n = 41 экз.), центральная (M = 37.9 см, n = 12 экз.) и западная части (M = 31.8 см, n = 79 экз.) Анадырского залива; д – Корякский район (M = 29.4 см, n = 507 экз.).

Длина и масса молоди керчаков на чукотском шельфе варьировали в пределах соответственно 7–16 см и 4–79 г. Самки были крупнее самцов: их средние размеры и масса были больше на 8.8 см (41.0 против 32.2 см) и 638 г (1178 против 540 г). На это указывают и максимальные значения длины и массы бычков в траловых уловах: у самцов – 21–38 см и 140–820 г, у самок – 22–48 см и 145–1645 г. В целом эти данные подтверждают точку зрения о половом диморфизме керчаков, проявляющемся в разных размерах самцов и самок. Последние крупнее, быстрее растут, позже созревают и дольше живут (Токранов, 1986; Борец, 1997). К примеру, в северо-западной части Берингова моря самки с четырёх лет перегоняют самцов в линейном и весовом росте, а средняя разница достигает 10.9 см и 590 г (Датский, Андронов, 2007). Зависимость длина–масса для бородавчатого керчака в пределах чукотского шельфа следующая: W = 0.0109FL3.0934 (r = 0.99, n = 40 экз.).
В водах северо-западной части Берингова моря массовое созревание самок бородавчатого керчака происходит при FL 31 см в возрасте 5 лет, самцов – при FL 12 см в 3–4-летнем возрасте (Датский, Андронов, 2007). На чукотском шельфе у большей части самок (83.3%) половые продукты были на IV стадии зрелости, у 100% самцов гонады были III стадии. Керчаки обычно нерестятся поздней осенью на мелководных участках шельфа при температуре придонного слоя воды 1°С с численным преобладанием самок (Андрияшев, 1954).
Арктический шлемоносец Gymnocanthus tricuspis – арктический вид, южная граница ареала которого проходит в Анадырском заливе у м. Наварин (Chernova, 2011), северная – в основном в пределах шельфовой зоны арктических морей циркумполярно (Mecklenburg et al., 2016). В юго-западной части Чукотского моря этот относительно мелкий керчак встречается повсеместно (Mecklenburg et al., 2016; Орлов и др., 2019), обитание его приурочено преимущественно к глубинам <100 м при отрицательной или близкой к 0°С температуре воды (Андрияшев, 1954).
Размеры арктического шлемоносца в траловых уловах варьировали в пределах 5–20 см, в пелагических слоях преобладала молодь FL 6–8 см (58%), у дна доминировали особи FL 11–16 см (до 91%). Наиболее крупные рыбы отмечены в донных тралениях 2018–2019 гг., в 2020 г. основу скоплений формировали сравнительно мелкие керчаки FL 9–12 см (рис. 15). Отметим, что сходные, но несколько меньшие размеры зарегистрированы у этого вида в осенний период на шельфе Карского моря: уловы были представлены особями FL 4–17 см с преобладанием рыб FL 4–8 см (Токранов, Орлов, 2021). Вероятно, более подходящие для вида условия обитания на чукотском шельфе отразились в его бо́льших по сравнению с рыбами северо-западной части Берингова моря (рис. 16) размерах. Если в районе исследований преобладали особи FL 10–16 см, составившие около 87% всех уловов керчака, то на североберинговоморском шельфе основу скоплений представляли рыбы FL 9–14 см (около 78%). Масса особей FL 8–10 см составляла 10–19 г. В целом арктический шлемоносец является самым мелким из шести видов рода Gymnocanthus: длина, масса и возраст самцов и самок не превышают соответственно 14 и 25 см, 75 и 120 г, 7 и 8 лет (Токранов, Орлов, 2021). При этом для северо-восточной части Чукотского моря имеются сведения, что самки достигают возраста как минимум 9, самцы – 8 лет (Smith et al., 1997).
Рис. 15.
Размерный состав арктического шлемоносца Gymnocanthus tricuspis из донных траловых уловов в российских водах Чукотского моря: а – август 2007 г. (M = 8.6 см, n = 26 экз.), б – сентябрь 2018 г. (M = 13.5 см, n = 728 экз.), в – август 2019 г. (M = 13.4 см, n = 365 экз.), г – август–сентябрь 2020 г. (M = 12.2 см, n = 522 экз.).

Рис. 16.
Размерный состав совокупных выборок арктического шлемоносца Gymnocanthus tricuspis из донных траловых уловов в российских водах в 2005–2020 гг.: (◼) – Чукотское море (M = 13.0 см, n = 1615 экз.), (◻) – Берингово море (M = = 11.8 см, n = 605 экз.).
Самцы арктического шлемоносца, как и у других видов шлемоносцев, в отличие от самок значительно мельче, созревают в более раннем возрасте и имеют меньшую продолжительность жизни (Токранов, 2016). В течение первого года жизни данный вид достигает FL 4–5 см, второго – 7–8 см, далее самки растут быстрее самцов, достигая половозрелости к 4-му году жизни. К примеру, на шельфе Карского моря разница в длине и массе тела между рыбами разных полов достигает в возрасте 7 лет в среднем почти 1.7 см и 20 г (Токранов, Орлов, 2021).
Сроки и районы размножения арктического шлемоносца, так же, как и сроки эмбрионального периода, точно не установлены, однако он, вероятно, начиная с конца сентября нерестится в пределах мелководного шельфа (Андрияшев, 1954). Единичные поимки личинок данного вида отмечены в восточной части Чукотского моря (Logerwell et al., 2020).
Прочие бычки (многоиглый керчак M. polyacanthocephalus, бычок-бабочка Hemilepidotus papilio, белобрюхий получешуйник (получешуйник Джордена) H. jordani, узколобый шлемоносец G. galeatus) относятся к крупноразмерным представителям рогатковых рыб, имеющих высокую численность в Беринговом море и прилегающих южнее водах. Несмотря на довольно обширный ареал (Тупоногов, Кодолов, 2014; Mecklenburg et al., 2018), присутствие этих рыб в российских водах в массе ограничено юго-западной частью Анадырского залива (Датский, Андронов, 2007), на чукотском шельфе отмечены исключительно неполовозрелые особи (рис. 17). Так, один из самых крупных видов бычков – многоиглый, достигающий в северо-западной части Берингова моря FL 85 см, массы 9 кг и возраста 16 лет (Датский, 2017), в российских водах Чукотского моря был представлен особями FL 7–27 см с доминированием молоди FL 7–11 см (70.6% всех уловов). Учитывая, что самки и самцы этого вида начинают созревать соответственно при FL 36–40 и 25 см (Датский, Андронов, 2007), можно констатировать полное отсутствие половозрелых рыб в районе исследований, несмотря на большое количество проведённых здесь траловых съёмок (рис. 17а). Наиболее крупные особи вида отмечены юго-западнее м. Наварин (в этой акватории пределы длины рыб наибольшие) и на севере Анадырского залива (рис. 18), гидрологические условия которого ограничивают северное распространение половозрелых рыб. Молодь же, вероятно, посредством тёплого Наваринского течения выносится в северную часть Берингова моря и на чукотский шельф. Отметим, что почти все поимки керчаков в Чукотском море выполнены пелагическими тралами.
Рис. 17.
Размерный состав некоторых видов семейства рогатковых (Cottidae) из траловых уловов 2001–2020 гг. в российских водах Чукотского (◼) и Берингова (◻) морей: а – многоиглый керчак Myoxocephalus polyacanthocephalus (Чукотское море: M = 11.2 см, n = 17 экз.; Берингово море: M = 44.2 см, n = 2197 экз.), б – бычок-бабочка Hemilepidotus papilio (Чукотское море: M = 4.5 см, n = 387 экз.; Берингово море: M = 24.0 см, n = 915 экз.), в – белобрюхий получешуйник Hemilepidotus jordani (Чукотское море: M = 4.5 см, n = 387 экз.; Берингово море: M = 24.0 см, n = 915 экз.), г – узколобый шлемоносец Gymnocanthus galeatus (Чукотское море: M = 13.7 см, n = 250 экз.; Берингово море: M = 28.6 см, n = 2337 экз.).
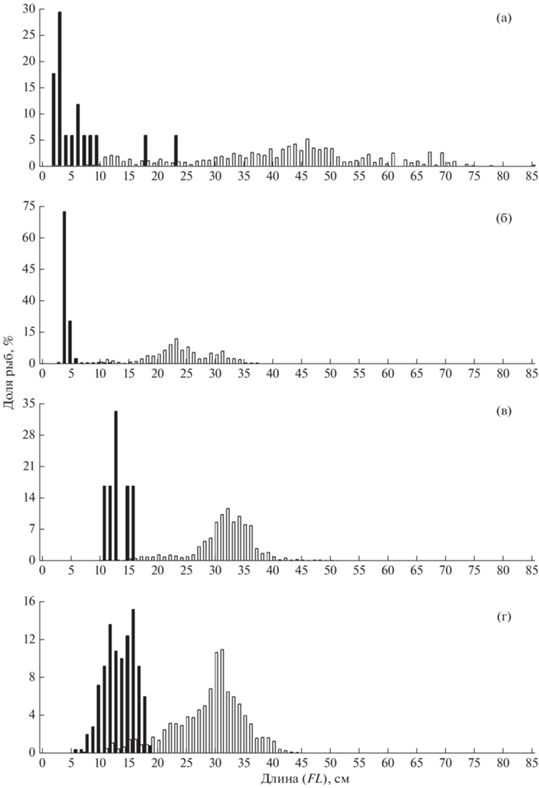
Рис. 18.
Размерный состав многоиглого керчака Myoxocephalus polyacanthocephalus из траловых уловов в российских водах в 2001–2020 гг.: (а–г), (‑ ‑) – Чукотское море (M = 11.2 см, n = 17 экз.); (—) – Берингово море: а, б, в – соответственно северная (M = 46.3 см, n = 154 экз.), центральная (M = 40.4 см, n = 259 экз.) и западная (M = 42.1 см, n = 1123 экз.) части Анадырского залива; г – Корякский район (M = 44.2 см, n = 661 экз.).
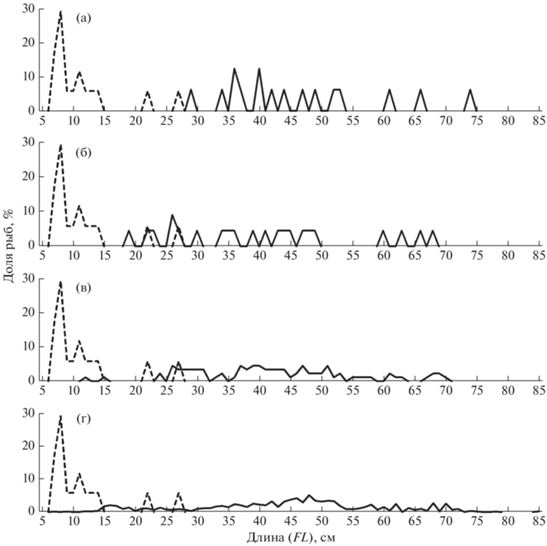
Свыше 98% особей бычка-бабочки выловлены в пелагиали чукотского шельфа. Этот вид получешуйных бычков, имеющий в северо-западной части Берингова моря предельные значения длины и массы тела 8–37 см и 0.05–1.66 кг (Датский, 2017), в районе исследования был представлен преимущественно молодью FL 3–12 модальной группы 4–5 см – 93.0% всех уловов (рис. 17б). Учитывая, что в ходе траловых работ отмечена лишь одна поимка особи FL 19 см, а половое созревание вида происходит в возрасте 4–8 лет при FL 18–28 см (Датский, 2017), все рыбы являлись неполовозрелыми и, скорее всего, их присутствие здесь (так же, как и молоди многоиглого керчака) обусловлено заносом тёплыми течениями Берингова моря. Отметим, что для молоди FL 4–5 см зарегистрировано оседание из пелагических в придонные слои как в северо-восточной части Чукотского моря (Mecklenburg et al., 2018), так и в его юго-западной части (у дна поймана молодь FL 4–7 см).
Ещё один вид получешуйных бычков – белобрюхий получешуйник – встречен в водах Чукотского моря в меньших количествах, нежели бычок-бабочка, что вполне объяснимо, учитывая его в целом менее северное распространение (Mecklenburg et al., 2018). Здесь также отмечены только неполовозрелые рыбы FL 11–16 см, присутствие которых, по-видимому, определяет северную границу ареала вида. К примеру, более благоприятные для обитания этого получешуйника условия в северо-западной части Берингова моря способствуют присутствию в акватории особей FL 8–53 см с модой 30–36 см – 65.2% (рис. 17в). Масса таких рыб варьирует в пределах 0.10–1.91 кг, а созревают они на 4–7-м году жизни при FL 26–40 см. При этом в других районах получешуйник Джордена может достигать FL 62 см, массы 2.8 кг и возраста 28 лет (Фадеев, 2005; Hutchinson, TenBrink, 2011; TenBrink, Buckley, 2013).
Узколобый шлемоносец, относящийся к массовым видам рогатковых рыб в Беринговом море, в пределах чукотского шельфа встречен исключительно в придонных слоях и был представлен неполовозрелыми рыбами FL 6–19 см модальной группы 12–16 см (62.0%). Сравнительные данные указывают на минимальные размеры вида на чукотском шельфе. К примеру, в северо-западной части Берингова моря (преимущественно южнее м. Наварин) шлемоносец имел предельные размеры 6–44 см при доминировании особей FL 25–35 см – 67.4% (рис. 17г). Соответственно этому, существенно различались и средние размеры рыб: 13.7 против 28.6 см. Отдельные особи бычков-шлемоносцев созревают на 4-м году жизни при FL 18–22 см, массовое созревание у самцов наступает в 5–6, у самок – в 6–7 лет при достижении FL 24–26 см (Борец, 1997). В целом данный вид является самым крупным из шести видов рода Gymnocanthus: длина, масса и возраст самцов и самок в западной части Тихого океана достигают соответственно 36 и 49 см, 640 и 1400 г, 11 и 17 лет (Токранов, Орлов, 2012, 2021).
Нерест вышеуказанных бычков в Чукотском море и в непосредственно прилегающих к нему водах не зарегистрирован. В прочих районах северо-западной части Тихого океана многоиглый керчак размножается осенью–зимой на глубинах 120–210 м при температуре придонного слоя воды 0.8–1.9°С. Сходные условия нереста отмечены и у шлемоносных бычков: в декабре–январе в диапазоне глубин 120–180 м при температуре воды у дна 1.3–1.8°С. Получешуйные бычки нерестятся в июне–сентябре на глубинах 10–30 м при температуре 5–10°С (Токранов, 1985, 1986, 1987; Черешнев и др., 2001). Значительные глубины, характерные для многоиглого и шлемоносных бычков, и высокая температура воды (для получешуйников) в период нереста, вероятно, не оставляют перспектив для обнаружения районов размножения этих видов на чукотском шельфе.
В целом отсутствие половозрелых рыб и их нерестилищ, низкие встречаемость и уловы указывают на неблагоприятные условия обитания для многоиглого керчака, бычка-бабочки, белобрюхого получешуйника и узколобого шлемоносца в российских водах Чукотского моря, что не позволяет говорить о перспективах их промыслового использования в этой акватории.
Список литературы
Андрияшев А.П. 1954. Рыбы северных морей СССР. М.; Л.: Изд-во АН СССР, 556 с.
Борец Л.А. 1997. Донные ихтиоцены российского шельфа дальневосточных морей: состав, структура, элементы функционирования и промысловое значение. Владивосток: Изд-во ТИНРО-центр, 217 с.
Глебов И.И., Надточий В.А., Савин А.Б. и др. 2016. Результаты комплексных биологических исследований в море Лаптевых в августе–сентябре 2015 г. // Изв. ТИНРО. Т. 187. С. 72–88. https://doi.org/10.26428/1606-9919-2016-187-72-88
Датский А.В. 2017. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 4. Семейство рогатковые (Cottidae) // Вопр. ихтиологии. Т. 57. № 3. С. 251–263. https://doi.org/10.7868/S0042875217030031
Датский А.В., Андронов П.Ю. 2007. Ихтиоцен верхнего шельфа северо-западной части Берингова моря. Магадан: Изд-во СВНЦ ДВО РАН, 261 с.
Датский А.В., Мазникова О.А. 2017. Особенности биологии массовых рыб в Олюторско-Наваринском районе и прилегающих водах Берингова моря. 3. Семейство камбаловые (Pleuronectidae) // Вопр. ихтиологии. Т. 57. № 2. С. 154–181. https://doi.org/10.7868/S0042875217020072
Датский А.В., Ведищева Е.В., Трофимова А.О. 2022. Особенности биологии массовых рыб в российских водах Чукотского моря. 1. Промысловая биомасса рыб. Семейство тресковые (Gadidae) // Там же. Т. 62. № 4. С. 384–412. https://doi.org/10.31857/S0042875222040075
Дьяков Ю.П. 1990. О распределении молоди тихоокеанского черного палтуса в Беринговом проливе и Чукотском море // Биологические ресурсы шельфовых и окраинных морей Советского Союза. М.: Наука. С. 177–180.
Дьяков Ю.П. 2006. Географическая изменчивость сезонно-нерестовой структуры фауны камбалообразных рыб (Pleuronectiformes) в морях северной части Тихого океана // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 8. С. 85–97.
Дьяков Ю.П. 2011. Камбалообразные (Pleuronectiformes) дальневосточных морей России (пространственная организация фауны, сезоны и продолжительность нереста, популяционная структура вида, динамика популяций). Петропавловск-Камчатский: Изд-во КамчатНИРО, 433 с.
Дьяков Ю.П. 2019. Распространение икры и личинок камбалообразных рыб (Pleuronectiformes) в северной части Тихого океана // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 52. С. 5–49. https://doi.org/10.15853/2072-8212.2019.52.5-49
Золотов А.О. 2007. О популяционной структуре палтусовидных камбал тихоокеанских вод Камчатки и западной части Берингова моря // Изв. ТИНРО. Т. 148. С. 113–129.
Золотов А.О. 2010. Камбалы западной части Берингова моря: динамика численности и особенности биологии: Автореф. дис. … канд. биол. наук. Владивосток: ТИНРО, 20 с.
Линдберг Г.У., Федоров В.В. 1993. Рыбы Японского моря и сопредельных частей Охотского и Желтого морей. Ч. 6. СПб.: Наука, 272 с.
Мазникова О.А., Афанасьев П.К., Датский А.В. и др. 2015. Распределение, биология и состояние запасов тихоокеанского чёрного палтуса Reinhardtius hippoglossoides matsuurae по данным различных орудий лова в западной части Берингова моря и у восточного побережья Камчатки // Тр. ВНИРО. Т. 155. С. 31–55.
Мазникова О.А., Новиков Р.Н., Датский А.В. и др. 2018. Современное состояние промысла чёрного палтуса Reinhardtius hippoglossoides matsuurae (сем. Pleuronectidae) в западной части Берингова моря и у восточного побережья Камчатки // Вопр. рыболовства. Т. 19. № 1. С. 42–57.
Мусиенко Л.Н. 1957. Молодь камбал (сем. Pleuronectidae) дальневосточных морей. 2. Распространение, возраст и рост // Тр. ИОАН СССР. Т. 20. С. 312–346.
Новиков Н.П. 1974. Промысловые рыбы материкового склона северной части Тихого океана. М.: Пищ. пром-сть, 308 с.
Новиков Н.П., Снытко В.А., Долгих И.П. 1992. Промысловый атлас Дальневосточных морей. Владивосток: Изд-во ТИНРО, 120 с.
Орлов А.М., Бензик А.Н., Ведищева Е.В. и др. 2019. Рыбохозяйственные исследования в Чукотском море на НИС “Профессор Леванидов” в августе 2019 г.: некоторые предварительные результаты // Тр. ВНИРО. Т. 178. С. 206–220. https://doi.org/10.36038/2307-3497-2019-178-206-220
Перцева-Остроумова Т.А. 1961. Размножение и развитие дальневосточных камбал. М.: Изд-во АН СССР, 484 с.
Токранов А.М. 1985. Биология массовых видов рогатковых (сем. Cottidae) прикамчатских вод: Автореф. дис. … канд. биол. наук. Владивосток: ДВНЦ АН СССР, 22 с.
Токранов А.М. 1986. Керчаки и получешуйные бычки // Биологические ресурсы Тихого океана. М.: Наука. С. 319–328.
Токранов А.М. 1987. О размножении рогатковых рыб рода Gymnacanthus (Cottidae) в прибрежных водах Камчатки // Вопр. ихтиологии. Т. 27. Вып. 6. С. 1026–1030.
Токранов А.М. 2016. О половом диморфизме у рогатковых рыб (Cottidae, Pisces) прикамчатских вод // Матер. XXX Любищевских чтений “Современные проблемы эволюции и экологии”. Ульяновск: Изд-во УлГПУ. С. 124–131.
Токранов А.М., Орлов А.М. 2012. Особенности распределения и экологии двух видов рогатковых рыб рода Gymnocanthus (Cottidae) в тихоокеанских водах северных Курильских островов и юго-восточной Камчатки // Вопр. ихтиологии. Т. 52. № 6. С. 658–671.
Токранов А.М., Орлов А.М. 2021. Биологическая характеристика арктического шлемоносца Gymnocanthus tricuspis (Cottidae) Карского моря // Матер. XII Нац. (Всерос.) науч.-практ. конф. “Природные ресурсы, их современное состояние, охрана, промысловое и техническое использование”. Ч. 1. Петропавловск-Камчатский: Изд-во КамчатГТУ. С. 76–80.
Тупоногов В.Н., Кодолов Л.С. 2014. Полевой определитель промысловых и массовых видов рыб дальневосточных морей России. Владивосток: Русский Остров, 336 с.
Фадеев Н.С. 1987. Северотихоокеанские камбалы. М.: Агропромиздат, 175 с.
Фадеев Н.С. 2005. Справочник по биологии и промыслу рыб северной части Тихого океана. Владивосток: Изд-во ТИНРО-центр, 366 с.
Филина Е.А., Буданова Л.К. 2015. О нахождении половозрелых особей чёрного палтуса Reinhardtius hippoglossoides (Pleuronectidae) в Карском море // Вопр. ихтиологии. Т. 55. № 1. С. 114–118. https://doi.org/10.7868/S0042875214060058
Харитонова Е.В., Батанов Р.Л., Датский А.В. 1999. Особенности распределения массовых видов камбал в Анадырском заливе в летний период // Изв. ТИНРО. Т. 126. Ч. 1. С. 285–295.
Циновский В.Д. 1981. Рыбы, пойманные на дрейфующей станции “Северный полюс-22” зимой 1978−79 и 1979−80 гг. // Рыбы открытого океана. М.: Изд-во ИО АН СССР. С. 110−112.
Черешнев И.А., Волобуев В.В., Хованский И.Е., Шестаков А.В. 2001. Прибрежные рыбы северной части Охотского моря. Владивосток: Дальнаука, 197 с.
Чернова Н.В. 2017. О поимках черного палтуса Reinhardtius hippoglossoides (Pleuronectidae) на кромке шельфа морей Лаптевых и Восточно-Сибирского // Вопр. ихтиологии. Т. 57. № 2. С. 144–153. https://doi.org/10.7868/S0042875217020060
Шунтов В.П. 1971. Некоторые закономерности распределения черного и стрелозубых палтусов в северной части Тихого океана // Изв. ТИНРО. Т. 75. С. 3–36.
Шунтов В.П., Лапко В.В., Надточий В.В., Самко Е.В. 1994. Межгодовые изменения в ихтиоценах верхней эпипелагиали западной части Берингова моря и тихоокеанских вод Камчатки // Вопр. ихтиологии. Т. 34. № 5. С. 642–648.
Allen M.J., Smith G.B. 1988. Atlas and zoogeography of common fishes in the Bering Sea and northeastern Pacific // NOAA Tech. Rept. NMFS. № 66. 151 p. https://doi.org/10.5962/bhl.title.62517
Alton M.S., Bakkala R.G., Walters G.E., Munro P.T. 1988. Greenland turbot Reinhardtius hippoglossoides of the Eastern Bering Sea and Aleutian Islands region // Ibid. № 71. 31 p.
Barber W.E., Smith R.L., Vallarino M., Meyer R.M. 1997. Demersal fish assemblages of the northeastern Chukchi Sea, Alaska // Fish. Bull. № 95. P. 195−209.
Chernova N.V. 2011. Distribution patterns and chorological analysis of fish fauna of the Arctic region // J. Ichthyol. V. 51. № 10. P. 825–924. https://doi.org/10.1134/S0032945211100043
Coad B.W., Waszczuk H., Labignan I. 1995. Encyclopedia of Canadian Fishes. Waterdown: CMN and Canad. Sportfish. Prod., 928 p.
Datsky A.V. 2015. Ichthyofauna of the Russian exclusive economic zone of the Bering Sea: 1. Taxonomic diversity // J. Ichthyol. V. 55. № 6. P. 792–826. https://doi.org/10.1134/S0032945215060065
Eisner L. 2019. The Bering Sea: Current status and recent trends // PICES Press. V. 27. № 1. P. 33–35. https://meetings.pices.int/publications/pices-press/volume27/PPJan2019.pdf#page=33
Hutchinson C.E., TenBrink T.T. 2011. Age determination of the yellow Irish lord: management implications as a result of new estimates of maximum age // N. Am. J. Fish. Manag. V. 31. P. 1116–1122. https://doi.org/10.1080/02755947.2011.646453
Logerwell E.A., Busby M., Mier K.L. et al. 2020. The effect of oceanographic variability on the distribution of larval fishes of the northern Bering and Chukchi seas // Deep-Sea Res. II. Top. Stud. Oceanogr. V. 177. Article 104784. https://doi.org/10.1016/j.dsr2.2020.104784
Love M.S., Elder N., Mecklenburg C.W. et al. 2016. Alaska Arctic marine fish species accounts // Alaska Arctic marine fish ecology catalog / Eds. Thorsteinson L.K., Love M.S. U.S. Geological Survey Scientific Investigations Report 2016–5038 (OCS Study, BOEM 2016–048). P. 41–615. https://doi.org/10.3133/sir20165038
Mecklenburg C.W., Mecklenburg T.A., Thorsteinson L.K. 2002. Fishes of Alaska. Bethesda, Maryland: Am. Fish. Soc., 1037 p.
Mecklenburg C.W., Byrkjedal I., Karamushko O.V., Møller P.R. 2014. Atlantic fishes in the Chukchi Borderland // Mar. Biodivers. V. 44. № 1. P. 127–150. https://doi.org/10.1007/s12526-013-0192-1
Mecklenburg, C.W., Mecklenburg T.A., Sheiko B.A., Steinke D. 2016. Pacific Arctic marine fishes. Akureyri: CAFF Internat. Secretariat, 406 p.
Mecklenburg C.W., Lynghammar A., Johannesen E. et al. 2018. Marine fishes of the Arctic Region. Akureyri: CAFF Internat. Secretariat, 454 p.
Munk K.M. 2001. Maximum ages of groundfishes in waters off Alaska and British Columbia and consideration of age determination // Alaska Fish. Res. Bull. V. 8. № 1. P. 12–21.
Smith R.L, Vallarino M., Barbour E. et al. 1997. Population biology of the Bering flounder in the northeastern Chukchi Sea // Fish ecology in Arctic North America. Bethesda: Am. Fish. Soc. P. 127–132.
TenBrink T.T., Buckley T.W. 2013. Life-history aspects of the yellow Irish lord (Hemilepidotus jordani) in the eastern Bering Sea and Aleutian Islands // Northwest. Nat. V. 94. P. 126–136. https://doi.org/10.1898/12-33.1
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


