Вопросы ихтиологии, 2022, T. 62, № 5, стр. 596-608
Рост и возраст клюворылой антиморы Antimora rostrata (Moridae) в водах банки Флемиш-Кап (Северо-Западная Атлантика)
Н. Б. Коростелев 1, Р. Баньон 3, 4, А. М. Орлов 1, 2, *
1 Институт проблем экологии и эволюции РАН ИПЭЭ РАН
Москва, Россия
2 Институт океанологии РАН ИО РАН
Москва, Россия
3 Служба планирования Регионального морского министерства,
Шунта-де-Галисия
Сантьяго-де-Компостела, Испания
4 Группа по изучению моря
Рибейра, Испания
* E-mail: orlov@vniro.ru
Поступила в редакцию 15.02.2022
После доработки 24.03.2022
Принята к публикации 25.03.2022
- EDN: YRLHVC
- DOI: 10.31857/S0042875222050113
Аннотация
Исследованы рост и возраст клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап (Северо-Западная Атлантика). Донные траловые уловы были представлены особями в возрасте 2–43 года общей длиной 112–680 мм, массой тела 6–2830 г. Преобладали рыбы в возрасте 14–26 лет (62% уловов). Темпы роста самцов и самок были сходными, но у самцов отмечены несколько меньшие продолжительность жизни (максимальный возраст соответственно 41 и 43 года) и средний возраст (соответственно 19.9 и 22.6 лет). Рост вида лучше всего описывается логистической функцией (коэффициенты: а = 61.9, b = 5.4, с = 0.1). Для сравнения с данными из других районов использовали уравнение Берталанфи, которое имело следующие параметры: L∞ = 142.9, k = 0.01, t0 = −2.9. В сравнении с клюворылой антиморой из других частей видового ареала особи из Северо-Западной Атлантики оказались самыми тугорослыми.
Род Antimora (Moridae, Gadiformes) включает два вида – мелкочешуйную A. microlepis Bean, 1890 и клюворылую A. rostrata (Günther, 1878) антимор (Small, 1981; Cohen et al., 1990; Priede, 2017; Орлов и др., 2018б). Представители рода практически повсеместно распространены в умеренных и холодных водах Мирового океана и считаются наиболее многочисленными среди современных глубоководных видов рыб (Kulka et al., 2003; Iwamoto, 2010; Priede, 2017; Орлов и др., 2018а).
A. rostrata встречается в Мировом океане повсеместно за исключением Северной Пацифики. При этом наблюдается разрыв в распространении между северной и южной частями Атлантики в тропической области. Кроме этого, данный вид до сих пор не отмечен на большей части открытых вод Атлантического и Индийского океанов, Южной Пацифики и восточной части индоокеанского сектора Южного океана (Cohen et al., 1990; Iwamoto, 2015; Orlov et al., 2020).
Клюворылая антимора ведёт придонно-пелагический глубоководный образ жизни, может формировать скопления с высокой концентрацией, её вылавливают в качестве прилова на различных промыслах донными тралами и ярусами (Kulka et al., 2003; Fossen, Bergstad, 2006; Horn, Sutton, 2015; Iwamoto, 2015; Priede, 2017), но в настоящее время не используют в качестве промыслового объекта, хотя вид считается перспективным для промысла (Новиков, Тимохин, 2009; Новиков и др., 2010). Недавние исследования мелкочешуйной антиморы (близкородственного вида) показали, что она может служить источником диетического рыбного сырья и использоваться для производства продукции как массового, так и специального назначения (Давлетшина и др., 2019).
Как и для большинства широкоареальных глубоководных рыб, для A. rostrata характерны различия в темпах роста в разных частях ареала. Опубликованные данные по возрасту и росту рассматриваемого вида из различных районов Мирового океана (Magnússon, 2001; Fossen, Bergstad, 2006; Horn, Sutton, 2015; Орлов и др., 2018а; Vedishcheva et al., 2019; Korostelev et al., 2020b) показывают, что кривые роста рыб из вод Новой Зеландии и Северной Атлантики значительно отличаются от таковых из других регионов. В этой связи исследования возраста и роста ещё не изученных популяций клюворылой антиморы представляют определённый интерес и позволяют сформировать более полное представление о биологических и экологических особенностях вида. Цель исследования – представить новые данные о росте и возрасте клюворылой антиморы из вод банки Флемиш-Кап (Северо-Западная Атлантика) в сравнении с таковыми из других частей видового ареала.
МАТЕРИАЛ И МЕТОДИКА
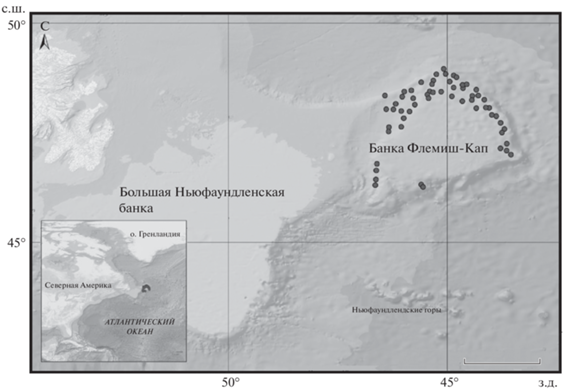
Материал собран в июне–июле 2016 г. в северо-западной части Атлантического океана в водах банки Флемиш-Кап (рис. 1) с глубин 588–1444 м (Gordeev et al., 2019) в ходе съёмок на испанском рыболовном судне “Playa Menduina Dos” донным тралом Campelen 1800 (горизонтальное раскрытие 26 м, вертикальное – 41 м, время учётных тралений 30 мин, скорость 3.0–3.5 узла). Всего было поймано 704 особи, которые на борту судна были подвергнуты полному биологическому анализу по стандартным методикам (Laevastu, 1965; Правдин, 1966) с измерением общей длины (TL) и массы тела и определением пола. Отолиты (сагитты) извлекали из свежепойманной рыбы. Взвешивание отолитов и определение возраста проводили в лабораторных условиях. Массу отолитов (Wo) определяли на электронных весах (“Sartorius GmbH”, Германия) с точностью до 0.001 г.
Рис. 1.
Места сбора проб (⚫) клюворылой антиморы Antimora rostrata в районе банки Флемиш-Кап. Масштаб: 100 км.
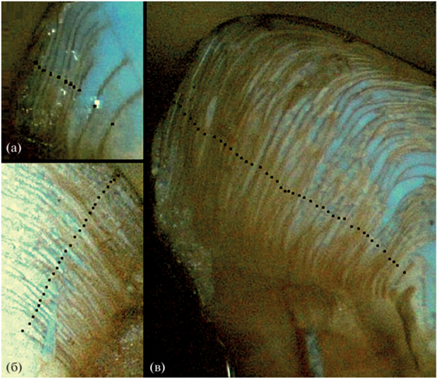
Клюворылая антимора, как и многие глубоководные рыбы, относится к долгоживущим видам (Magnússon, 2001; Fossen, Bergstad, 2006; Horn, Sutton, 2015; Орлов и др., 2018а; Vedishcheva et al., 2019; Korostelev et al., 2020b), поэтому её возраст определяли в соответствии с методиками, разработанными специально для некоторых долгоживущих глубоководных видов рыб (Beamish, Chilton, 1982; Rodríguez Mendoza, 2006). Отолиты разламывали в центральной части и прокаливали в пламени спиртовой горелки, при необходимости шлифовали. Для шлифовки отолитов использовали абразивные диски с алюминий-оксидным или силикон-карбидным покрытием зернистостью 0.1–0.9 мкм (“Buehler”, США). Возраст определяли путём подсчёта годовых колец на фотографиях сломов отолитов (рис. 2) в программе Adobe Photoshop CS6 ver. 13.0x64 (“Adobe System, Inc.”, СШA). Сломы фотографировали в глицерине под увеличением ×4–16 в зависимости от размера отолита с помощью встроенной камеры микроскопа Stemi 305 (“Zeiss”, Германия).
Рис. 2.
Сломы отолитов клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап: а – TL 23.1 см, возраст 11 лет; б – TL 41.3 см, 28 лет; в – TL 53.9 см, 43 года; (◼) – годовые зоны роста.
Определение возраста и массы отолитов производили выборочно, для чего отбирали по десять самцов и самок для каждой 5-сантиметровой размерной группы. Всего на анализ было отобрано 200 особей, из которых для 195 удалось определить возраст. На основании полученных определений возраста и длин тела составлен размерно-возрастной ключ (Морозов, 1929), при помощи которого возрастной состав пересчитан на весь улов.
Выбор наиболее подходящей функции для описания роста антиморы осуществляли с использованием критерия Акайке AIC (Katsanevakis, Maravelias, 2008), сравнивая линейную, степенную и логистическую зависимости, кривую Гомпертца и уравнение Берталанфи, которое ранее успешно использовали для описания роста представителей рода Antimora (Magnússon, 2001; Orlov, Abramov, 2001; Орлов, Абрамов, 2002; Fossen, Bergstad, 2006; Horn, Sutton, 2015; Frey et al., 2017; Орлов и др., 2018а; Vedishcheva et al., 2019; Korostelev et al., 2020b; Коростелев и др., 2020). Величину коэффициента детерминации (R2) определяли методом наименьших квадратов, приведя зависимость к линейному виду (Frey et al., 2017). Среднюю удельную скорость линейного роста оценивали по формуле (Мина, Клевезаль, 1976; Алимов, 1989): $C = \frac{{\ln ~\left( {{{L}_{n}} + 1} \right) - \ln {\kern 1pt} {{L}_{n}}}}{{{{t}_{n}} + 1 - {{t}_{n}}}}$, где Ln + 1 и Ln – средняя длина рыб в возрасте соответственно tn + 1 и tn. Статистическую обработку результатов проводили в программе MS Excel, коэффициенты уравнения роста Берталанфи рассчитывали с использованием компьютерной программы PAST ver. 3.14 (Hammer et al., 2001).
РЕЗУЛЬТАТЫ
Антиморы в улове были представлены широким размерным рядом: TL 112–680 (в среднем 353 ± 4) мм. Самки были несколько длиннее самцов: 112–680 (390 ± 6) против 128–660 (310 ± 5) мм. Неполовозрелые особи имели TL 136–171 (153 ± 4) мм. В уловах преобладали размерные группы 201–250, 251–300, 301–350 и 351–400 мм, доля каждой из которых составляла ~14% общей численности особей в улове (рис. 3а). Рыб TL 401–450 и 451–500 мм было немногим меньше – соответственно 11 и 10%, прочие размерные группы были немногочисленны.
Рис. 3.
Распределение по длине (а) и массе (б) тела клюворылой антиморы Antimora rostrata из траловых уловов в водах банки Флемиш-Кап.
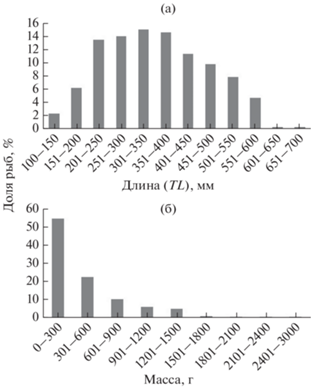
Масса тела антимор варьировала в пределах 6–2830 (в среднем 396.6 ± 15.6) г. Самки были в среднем почти вдвое тяжелее самцов: 6–2830 (533.1 ± ± 24) против 8–1490 (225.0 ± 11.4) г. Неполовозрелые особи имели массу 8–22 (15.7 ± 3.4) г. Наиболее многочисленными в улове были рыбы с массой тела <300 г (рис. 3б), на долю которых пришлось 54.5% уловов. Антимор с массой тела 301–600 г отмечено 22.4%, прочие размерные группы были менее многочисленны, а рыбы тяжелее 1800 г были представлены единичными особями.
Рыбы крупных размеров (≥600 мм) встречались на глубинах >1 км (рис. 4), а мелкие особи (<200 мм) – на всех исследованных глубинах.
Рис. 4.
Средняя, минимальная и максимальная длина тела клюворылой антиморы Antimora rostrata из траловых уловов на разных глубинах в водах банки Флемиш-Кап.

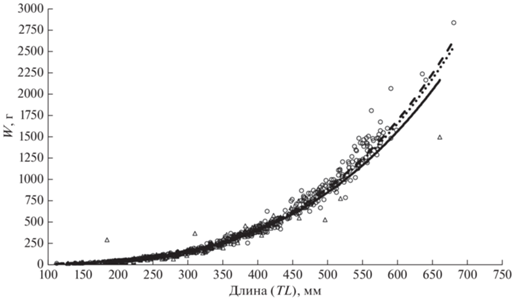
Зависимость массы (W, г) от длины (TL, мм) тела клюворылой антиморы хорошо описывается степенной функцией: W = 0.0012TL3.46 (R2 = 0.98) для совокупной выборки; W = 0.0015TL3.39 (R2 = = 0.96) для самцов и W = 0.001TL3.50 (R2 = 0.99) для самок (рис. 5).
Рис. 5.
Зависимость массы (W) от длины тела клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап: (△), (—) – самцы; (⚪), (- -) – самки; (···) – оба пола.
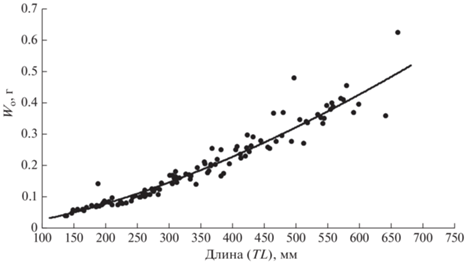
Масса исследованных отолитов варьировала в пределах 0.039–0.626 (в среднем 0.199 ± 0.011) г. Зависимость массы отолита (Wo, г) от длины тела (TL, мм) хорошо описывается (R2 = 0.96) степенной функцией: Wo = 0.00002TL1.5514 (рис. 6).
Рис. 6.
Зависимость массы отолита (Wo) от длины тела клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап.
Среди антимор больше половины оказались самками, на их долю пришлось 56.5% численности рыб в уловах, доля самцов составила 42.2%, неполовозрелых особей – 1.3%. Соотношение полов в разных размерных группах различалось. Так, среди рыб TL 100–150 и 150–200 мм преобладали самки (рис. 7а), среди рыб TL 200–450 мм доля самцов и самок была приблизительно одинаковой, среди крупных рыб TL > 450 мм самцы встречались единично.
Рис. 7.
Соотношение полов клюворылой антиморы Antimora rostrata в разных размерных группах (а) и на разных глубинах (б) в траловых уловах в водах
банки Флемиш-Кап: (◼) – неполовозрелые особи, ( ) – самки, (
) – самки, ( ) – самцы; над столбцами указано число особей в каждом обследованном диапазоне.
) – самцы; над столбцами указано число особей в каждом обследованном диапазоне.

Соотношение полов в уловах также изменялось с глубиной (рис. 7б). На глубинах <600 м доминировали самки, в диапазоне глубин 601–900 м соотношение полов было приблизительно равным; глубже 900 м, по мере увеличения глубины, возрастала доля самок, однако в самом глубоководном улове (1401–1463 м) самцов было значительно больше. Максимальная доля неполовозрелых особей в уловах отмечена на глубинах <700 м, глубже 1100 м неполовозрелые рыбы не отмечены.
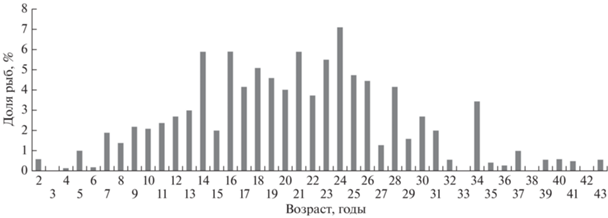
Возраст антимор обоих полов варьировал в пределах 2–43 (в среднем 19.8 ± 0.6) лет. Возраст самцов составил 2–41 (19.9 ± 0.8) год, самок – 2–43 (22.6 ± 0.9) года, неполовозрелых особей – 5–11 (8.0 ± 0.9) лет.
Минимальные значения критерия AIC были характерны для логистической функции (табл. 1). Следовательно, из опробованных моделей именно логистическая зависимость наилучшим образом подходит для описания роста антимор из вод банки Флемиш-Кап.
Таблица 1.
Значения критерия Akaike (AIC) для различных кривых роста клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап
| Кривая роста, уравнение | Критерий Akaike (AIC) |
|---|---|
| Линейная: $TL = at + b$ | 8372.5 |
| Степенная: $TL = a{{t}^{b}} + c$ | 8335.2 |
| Уравнение Берталанфи: $TL = {{L}_{\infty }}\left( {1 - {{e}^{{ - k\left( {t - {{t}_{0}}} \right)}}}} \right)$ | 8280.6 |
| Логистическая: $TL = \frac{a}{{1~\,\, + \,\,~b{{e}^{{ct}}}}}$ | 8053.0 |
| Кривая Гомпертца: $TL = a{{e}^{{b{{e}^{{ct}}}}}}$ | 8128.7 |
Коэффициенты логистической функции зависимости TL от возраста (t) рыб из исследуемой выборки были следующими: для всех особей: а = = 61.9, b = 5.4, с = 0.1; для самцов: а = 54.5, b = 4.9, с = 0.11; для самок: а = 61.6, b = 5.6, с = 0.1.
Несмотря на то что значение критерия AIC для уравнения Берталанфи оказалось выше такового для логистической модели ввиду использования первого в других исследованиях возраста антимор, мы решили для сравнения привести его коэффициенты для наших данных. Так параметры уравнения, описывающего рост, для совокупной выборки были следующими: L∞ = 142.9, k = 0.01, t0 = = −2.9 (R2 = 0.73). Кривые роста самцов и самок клюворылой антиморы, описанные уравнением Берталанфи, несколько различались. Так, для самцов параметры уравнения имели вид: L∞ = 201.9, k = = 0.008, t0 = −4.47 (R2 = 0.76); для самок: L∞ = 106.7, k = 0.019, t0 = −1.62 (R2 = 0.65).
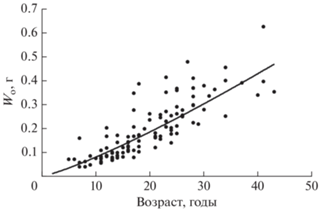
Сравнение кривых роста самцов и самок показывает одинаковые темпы роста особей обоих полов до 24 лет, затем самки начинают опережать самцов в росте (рис. 8). При этом расчёты удельной скорости роста (С) обоих полов принципиальных различий между ними не выявили (рис. 9). Удельная скорость роста антимор от 5-летнего возраста к 15-летнему снижается приблизительно в два раза, к 30 годам ещё в полтора раза, а затем остаётся практически на одном уровне. Функции, описывающие годовые приросты самцов и самок, сходны. Так, для самцов зависимость имела вид: С = 0.0236t−0.681 (R2 = 0.86), где t – возраст, годы; для самок: С = 0.0241t−0.699 (R2 = 0.77). Зависимость массы отолита (Wo, г) от возраста лучше всего (R2 = 0.70) описывается степенной функцией: Wo = 0.0049t1.2131 (рис. 10).
Рис. 8.
Линейный рост клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап, рассчитанный на основании логистической функции: (△), (–) – самцы; (⚪), (- -) – самки.

Рис. 9.
Удельная скорость роста клюворылой антиморы Antimora rostrata в водах банки Флемиш-Кап: (△), ( ) – самцы; (⚪), (- -) – самки.
) – самцы; (⚪), (- -) – самки.
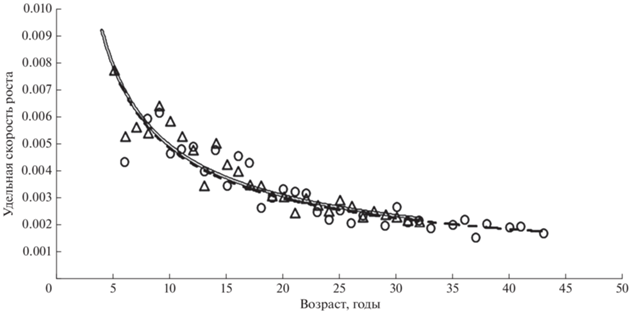
Рис. 10.
Зависимость массы отолита (Wo) от возраста клюворылой антиморы Antimora rostrata из вод банки Флемиш-Кап.
Анализ возрастной структуры всего улова (рис. 11), рассчитанной по размерно-возрастному ключу (Приложение) на основании выборочных определений возраста, показал, что самой многочисленной возрастной группой в улове были 24-летние особи, на долю которых пришлось 7.1% всего улова. Немного реже встречались рыбы в возрасте 14, 16, 21 и 23 года. На каждую указанную возрастную группу приходилось ~6% общей численности особей. Рыбы младших и старших возрастных классов встречались значительно реже.
ОБСУЖДЕНИЕ
Размерный состав клюворылой антиморы из уловов в водах банки Флемиш-Кап схож с таковым для представителей вида в траловых уловах из других районов Мирового океана (Fossen, Bergstad, 2006; Орлов и др., 2018а), которые характеризуются наличием мелко- и среднеразмерных рыб и незначительным количеством крупных особей. В нашей выборке в большом количестве присутствовали рыбы TL < 300 мм, а особи TL > 600 мм встречались единично. Такой размерный ряд не характерен для ярусных уловов, основу которых составляют более крупные особи (Fossen, Bergstad, 2006; Horn, Sutton, 2015; Vedishcheva et al., 2019; Korostelev et al., 2020b), что связано с различной селективностью тралов и ярусов по отношению к размерному составу облавливаемых популяций рыб. Этим же можно объяснить сходство минимальных и максимальных значений массы тела особей из траловых уловов в других частях ареала клюворылой антиморы (Magnússon, 2001; Орлов и др., 2018а), где минимальная масса тела составляет 10–20 г, а максимальная ~2700 г. В ярусных уловах соответствующие величины составляют ~400 и 3000 г (Horn, Sutton, 2015; Vedishcheva et al., 2019; Korostelev et al., 2020b).
Для рассматриваемого вида характерен половой диморфизм в размерах – средняя и максимальная длины и массы тела самцов меньше, чем у самок. Эта закономерность отмечена и в других частях ареала (Fossen, Bergstad, 2006; Орлов и др., 2018а). Однако, несмотря на разницу в размерах тела, зависимости длина–масса тела самцов и самок оказались очень схожими. Аналогичная ситуация описана для клюворылой антиморы из вод Исландии (Magnússon, 2001). Различия в максимальных и средних размерах самцов и самок можно объяснить тем, что продолжительность жизни первых в сравнении последними несколько меньше и среди крупных рыб преобладают самки.
Значение степенного коэффициента уравнения, описывающего зависимость массы тела от общей длины, для изученной нами выборки существенно превышало 3, что свидетельствует о положительном аллометрическом росте особей рассматриваемого вида в водах банки Флемиш-Кап. Сходными особенностями роста характеризуется клюворылая антимора также в водах Исландии и в некоторых районах Южного океана (Magnússon, 2001; Vedishcheva et al., 2019; Korostelev et al., 2020b).
Зависимость массы отолита от длины тела антиморы в водах банки Флемиш-Кап, так же, как и в водах Гренландии (Орлов и др., 2018а), лучше всего описывает степенная функция со значением R2 = 0.95. Такое высокое значение коэффициента детерминации свидетельствует о тесной связи между массой отолитов и размером особей.
Соотношение полов клюворылой антиморы различается в разных регионах и на различных глубинах. В изученной нами выборке отмечено преобладание самок на больших глубинах (900–1400 м), что в целом соответствует ранее опубликованным данным по большинству районов. В водах Гренландии на глубинах >900 м преобладали самки (Орлов и др., 2018а). В Северо-Западной Атлантике доля самок на глубинах <500 м составляла 30–40%, а на глубинах >700 м – 60–70% улова (Kulka et al., 2003). При этом у североатлантического побережья США самцы преобладали на глубинах <1500 м, но практически отсутствовали глубже 2000 м (Wenner, Musick, 1977). В водах Исландии в уловах глубже 1500 м преобладали самки (Magnússon, 2001). Наши данные из Северо-Западной Атлантики довольно схожи также с таковыми из вод моря Росса (Horn, Sutton, 2015) и о-вов Крозе и Кергелен (Korostelev et al., 2020b), где на глубинах соответственно 800–2000 м и 515–1745 м преобладали самки. В то же время наши данные отличаются от таковых из морей Уэдделла и Лазарева, где на глубинах 1109–1798 преобладали самцы (Vedishcheva et al., 2019). Преобладание самок на более мелких глубинах характерно также для Северо-Восточной Атлантики (Gordon, Duncan, 1985). Таким образом, преобладание самцов на глубине 1401–1463 м в водах банки Флемиш-Кап не является чем-то необычным. Исследования близкородственной мелкочешуйной антиморы в северо-восточной части Тихого океана (Frey et al., 2017) показали, что соотношение полов у этого вида подвержено сильным межгодовым колебаниям. Поэтому вполне вероятно, что обнаруженные нами различия половой структуры у клюворылой антиморы в различных частях видового ареала могут зависеть не только от района и глубины поимки, но и от времени сбора материала.
Результаты определений возраста клюворылой антиморы из вод банки Флемиш-Кап подтвердили долгожительство изучаемого вида. Высокие величины коэффициента детерминации зависимостей возраст–длина тела и возраст–масса отолита A. rostrata, опубликованные ранее (Орлов и др., 2018а; Vedishcheva et al., 2019; Korostelev et al., 2020b) и полученные нами для вод банки Флемиш-Кап, позволяют использовать длину тела и массу отолитов для описания возраста и роста изучаемого вида.
Следует отметить, что в отличие от большинства ранее опубликованных результатов изучения роста клюворылой антиморы, в которых рост описывается уравнением Берталанфи (Magnússon, 2001; Fossen, Bergstad, 2006; Horn, Sutton, 2015; Орлов и др., 2018а; Vedishcheva et al., 2019; Korostelev et al., 2020b), для описания роста её представителей из вод банки Флемиш-Кап более подходит логистическая функция. Известно, что у некоторых видов рыб рост лучше описывается именно этой функцией (Katsanevakis, Maravelias 2008).
Самцы и самки клюворылой антиморы, обитающие в водах банки Флемиш-Кап, имеют практически сходные темпы роста, но при этом самцы не достигают максимальных размеров и возраста. Почти полное отсутствие крупных самцов в выборках и незначительные различия в кривых роста самцов и самок отмечены и в предшествующих исследованиях роста рассматриваемого вида (Fossen, Bergstad, 2006; Horn, Sutton, 2015; Vedishcheva et al., 2019; Korostelev et al., 2020b). Бесспорно, уравнение Берталанфи, разработанное на основе биоэнергетических принципов (Bertalanffy, 1938), является одной из самых распространённых моделей для описания роста долгоживущих рыб. При этом многие авторы указывают (Parker, Larkin 1959; Paloheimo, Dickie, 1964; Ursin, 1967; Мина, Клевезаль, 1976; Roff, 1980; Schnute, 1981), что данное уравнение нельзя считать универсальным законом роста, а лишь моделью, которая подходит для описания частных случаев. Поэтому подбор модели, наилучшим образом подходящей для описания роста, необходимо проводить для каждого конкретного случая (Katsanevakis, Maravelias, 2008).
Использование различных моделей при описании роста разных популяций одного вида приводит к сложностям их сравнения. По этой причине для сравнения особенностей роста клюворылой антиморы в разных частях ареала мы использовали уравнение Берталанфи, параметры которого у разных авторов сильно варьируют (рис. 12, табл. 2). В ряде случаев, включая полученные нами данные, присутствуют сильно завышенные значения L∞: 201.1 см – для самцов в нашем исследовании и 2332.0 см – для вод Срединно-Атлантического хребта и Гренландии (Fossen, Bergstad, 2006), что может быть связано с особенностями роста конкретных популяций, различным размерным составом выборок или погрешностью определений возраста. Изученная нами выборка из вод Северо-Западной Атлантики имеет самые низкие в сравнении с опубликованными данными значения параметра, характеризующего скорость достижения предельной длины (k), что, возможно, свидетельствует о крайне медленном росте особей изученной популяции. Одной из возможных причин низких темпов роста клюворылой антиморы в Северо-Западной Атлантике может являться её повышенная численность в данном районе (Kulka et al., 2003; Orlov et al., 2020), поскольку известно, что плотностной фактор в популяции может оказывать существенное влияние на темпы роста её особей (Никольский, 1963).
Рис. 12.
Кривые роста, описанные уравнением Берталанфи, клюворылой антиморы Antimora rostrata в различных частях ареала: 1 – Срединно-Атлантический хребет и Гренландия (по: Fossen, Bergstad, 2006), 2 – Исландия (по: Magnússon, 2001), 3 – море Росса (по: Horn, Sutton, 2015), 4 – Новая Зеландия (по: Horn, Sutton, 2015), 5 – Юго-Западная Гренландия (по: Орлов и др., 2018а), 6 – моря Лазарева и Уэдделла (по: Vedishcheva et al., 2019), 7 – воды о-вов Кергелен и Крозе (по: Korostelev et al., 2020b), 8 – банка Флемиш-Кап (наши данные).
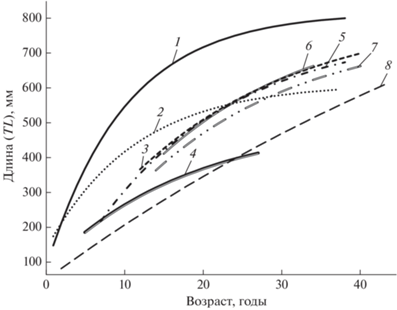
Таблица 2.
Параметры уравнений Берталанфи для выборок клюворылой антиморы A. rostrata из различных частей ареала
| Район (источник информации) | Пол | Число рыб, экз. | L∞, см | k | t0 |
|---|---|---|---|---|---|
| Срединно-Атлантический хребет и Гренландия (Fossen, Bergstad, 2006) | Самцы | 68 | 2332.00 | 0.0016 | −1.740 |
| Самки | 170 | 71.86 | 0.1400 | 1.520 | |
| Оба пола + ювенильные особи | 257 | 81.70 | 0.1000 | 0.980 | |
| Исландия (Magnússon, 2001) | Оба пола + ювенильные особи | 57 | 61.37 | 0.0890 | 0.205 |
| Море Росса (Horn, Sutton, 2015) | Оба пола | 192 | 82.20 | 0.0470 | −0.600 |
| Новая Зеландия (Horn, Sutton, 2015) | Оба пола + ювенильные особи | 48 | 50.80 | 0.0560 | −3.200 |
| Юго-западная Гренландия (Орлов и др., 2018а) | Самцы | 77 | 74.17 | 0.0620 | 1.140 |
| Самки | 92 | 82.58 | 0.0360 | 0.890 | |
| Оба пола + ювенильные особи | 200 | 76.82 | 0.0570 | 1.110 | |
| Моря Лазарева и Уэдделла (Vedishcheva et al., 2019) | Самцы | 38 | 79.90 | 0.0600 | 1.230 |
| Самки | 29 | 165.45 | 0.0120 | 0.870 | |
| Оба пола + ювенильные особи | 110 | 82.25 | 0.0500 | 1.090 | |
| Воды о-вов Кергелен и Крозе (Korostelev et al., 2020b) | Оба пола + ювенильные особи | 148 | 77.50 | 0.0530 | 1.290 |
| Банка Флемиш-Кап (наши данные) | Самцы | 96 | 201.10 | 0.0080 | −4.470 |
| Самки | 93 | 106.60 | 0.0180 | −1.620 | |
| Оба пола + ювенильные особи | 195 | 142.90 | 0.0120 | −2.960 |
Несмотря на ограниченную возможность полноценного использования уравнения Берталанфи для некоторых выборок клюворылой антиморы, существенные различия параметров этого уравнения для выборок из разных частей Атлантического, Индийского и Южного океанов и Юго-Западной Пацифики могут свидетельствовать о существовании у рассматриваемого вида в пределах ареала внутривидовых группировок с разными темпами роста. Однако для выяснения популяционной структуры вида и причин, обусловливающих указанные различия, необходимы дополнительные экологические и генетические исследования (Орлова и др., 2018; Orlov et al., 2020). Несомненно, что клюворылая антимора ввиду своего долгожительства представляет трудный объект для изучения возраста, на что указывают и другие исследователи (Fossen, Bergstad, 2006; Horn, Sutton, 2015; Орлов и др., 2018а). Сложности отмечаются как при подготовке сломов отолитов, так и при интерпретации полученных результатов. Кроме того, в опубликованной литературе отсутствует информация о личинках и ранней молоди клюворылой антиморы, что может сказываться на правильности определений её возраста. В нашей выборке подсчёт годовых колец оказался невозможен в 2.5% случаев, в аналогичных исследованиях возраста мелкочешуйной антиморы непригодных для определения отолитов было ~5% (Коростелев и др., 2020).
Для ряда глубоководных видов рыб, обитающих в относительно стабильных условиях, показано ежегодное формирование опаковых и гиалиновых зон роста на отолитах. Так, совпадение числа чередований зон на отолите и возраста у угольной рыбы Anoplopoma fimbria подтверждали мечением и повторным выловом (Beamish, McFarlane, 2000). Однако чаще для валидации возрастных определений применялись радиометрические методы на основе соотношения пары радиоизотопов 210Pb/226Ra в отолитах (Smith et al., 1991; Kastelle et al., 1994; Fenton, Short, 1995; Cailliet et al., 2001; Буслов, 2009). К сожалению, попытки подтвердить возраст A. rostrata по отолитам какими-либо другими методами до сих пор не предпринимались. Тем не менее, имеются данные о совпадении числа зон приростов на позвонках и отолитах мелкочешуйной антиморы (Korostelev et al., 2020a), в связи с чем определение возраста клюворылой антиморы помимо отолитов и позвонков ещё и с использованием плавниковых лучей, костей головы, плечевого, тазового поясов и других структур представляется перспективным. Важным в вопросе валидации возраста представляются поимки ранней молоди рассматриваемого вида с последующим определением её возраста. Недавними исследованиями (Коростелев, Орлов, 2020) показано наличие свинца в составе отолитов антимор, что открывает возможности использования соотношений пар радиоизотопов 210Pb/226Ra для определения и корректировки возраста антимор по отолитам.
Список литературы
Алимов А.Ф. 1989. Введение в продукционную гидробиологию. Л.: Гидрометеоиздат, 152 с.
Буслов А.В. 2009. Определение возраста тресковых (Gadidae) дальневосточных морей: теоретические положения и методические подходы (обзор) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 14. С. 32–46.
Давлетшина Т.А., Шульгина Л.В., Павель К.Г., Мальцев И.В. 2019. Технохимическая характеристика глубоководного объекта антиморы мелкочешуйной Antimora microlepis // Изв. ТИНРО. Т. 198. С. 230–238. https://doi.org/10.26428/1606-9919-2019-198-230-238
Коростелев Н.Б., Орлов А.М. 2020. Содержание микро- и ультрамикроэлементов в отолитах клюворылой Antimora rostrata и мелкочешуйной A. microlepis антимор (Moridae, Teleostei) // Океанология. Т. 60. № 6. С. 910–914. https://doi.org/10.31857/S003015742005010X
Коростелев Н.Б., Байталюк А.А., Мальцев И.В., Орлов А.М. 2020. Первые данные о возрасте и росте мелкочешуйной антиморы Antimora microlepis (Moridae) из вод подводного Императорского хребта (Северо-Западная Пацифика) // Вопр. ихтиологии. Т. 60. № 6. С. 689–697. https://doi.org/10.31857/S0042875220060028
Мина М.В., Клевезаль Г.А. 1976. Рост животных. М.: Наука, 291 с.
Морозов А.В. 1929. Методика собирания и обработки ихтиологических материалов // Тр. НИИРХ. Т. 5. № 1. Рыбное хозяйство Туркменистана. С. 172–189.
Никольский Г.В. 1963. Экология рыб. М.: Высш. шк., 368 с.
Новиков Н.П., Тимохин И.Г. 2009. Антимора Antimora rostrata (Moridae) подводных поднятий южной части Индийского океана // Рибне Господарство Україны. № 1. С. 2–5.
Новиков Н.П., Панов Б.Н., Ребик С.Т., Тимохин И.Г. 2010. Рыбы открытых вод Индийского океана. Керчь: Изд-во ЮгНИРО, 172 с.
Орлов А.М., Абрамов А.А. 2002. Новые данные о мелкочешуйной антиморе Antimora microlepis (Moridae) из северо-западной части Тихого океана // Вопр. ихтиологии. Т. 42. № 1. С. 65–73.
Орлов А.М., Ведищева Е.В., Трофимова А.О., Орлова С.Ю. 2018а. Возраст и рост клюворылой антиморы Аntimora rostrata (Мoridae) в водах юго-западной Гренландии // Там же. Т. 58. № 2. С. 192–200. https://doi.org/10.7868/S004287521802008X
Орлов А.М., Григоров И.В., Лазарева Н.И. 2018б. Сравнительный морфологический анализ антимор (Antimora spp., Moridae, Gadiformes) на основании ихтиологических коллекций // Зоол. исследования. № 20. С. 98–111.
Орлова С.Ю., Волков А.А., Гордеев И.И. и др. 2018. Разнообразие гена CO1 митохондриальной ДНК у представителей рода Antimora (Moridae, Gadiformes) Мирового океана // Докл. АН. Т. 482. № 6. С. 722–727. https://doi.org/10.31857/S086956520002949-6
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищ. пром-сть, 373 с.
Beamish R.J., Chilton D.E. 1982. Preliminary evaluation of a method to determine the age of sablefish (Anoplopoma fimbria) // Can. J. Fish. Aquat. Sci. V. 39. № 2. P. 277–287. https://doi.org/10.1139/f82-039
Beamish R.J., McFarlane G.A. 2000. Reevaluation of the interpretation of annuli from otoliths of a long-lived fish, Anoplopoma fimbria // Fish. Res. V. 46. № 1–3. P. 105–111. https://doi.org/10.1016/S0165-7836(00)00137-5
Bertalanffy L. 1938. A quantitative theory of organic growth (Inquiries on growth laws. II) // Hum. Biol. V. 10. P. 181–213.
Cailliet G.M., Andrews A.H., Burton E.J. et al. 2001. Age determination and validation studies of marine fishes: do deep-dwellers live longer? // Exp. Gerontol. V. 36. № 4–6. P. 739–764. https://doi.org/10.1016/S0531-5565(00)00239-4
Cohen D.M., Inada T., Iwamoto T., Scialabba N. 1990. Gadiform fishes of the world (Order Gadiformes). An annotated and illustrated catalogue of cods, hakes, grenadiers and other gadiform fishes known to date. FAO Fish. Synopsis. V. 10. № 125. FAO: Rome, 442 p.
Fenton G.E., Short S.A. 1995. Radiometric analysis of blue grenadier, Macrunonus novaezelandiae, otolith cores // Fish. Bull. V. 93. № 2. P. 391–396.
Frey P.H., Keller A.A., Simon V. 2017. Dynamic population trends observed in the deep-living Pacific flatnose, Antimora microlepis, on the US West Coast // Deep-Sea Res. I: Oceanogr. Res. Pap. V. 122. P. 105–112. https://doi.org/10.1016/j.dsr.2017.03.006
Fossen I., Bergstad O.A. 2006. Distribution and biology of blue hake Antimora rostrata (Pisces: Moridae), along the Mid-Atlantic Ridge and off Greenland // Fish. Res. V. 82. № 1–3. P. 19–29. https://doi.org/10.1016/j.fishres.2006.08.023
Gordeev I., Sokolov S., Bañon R. et al. 2019. Parasites of the blue antimora, Antimora rostrata and slender codling, Halargyreus johnsonii (Gadiformes: Moridae), in the Northwestern Atlantic // Acta Parasitol. V. 64. № 3. P. 489–500. https://doi.org/10.2478/s11686-019-00074-4
Gordon J.D.M., Duncan J.A.R. 1985. The biology of fish of the family Moridae in the deep-water of the Rockall Trough // J. Mar. Biol. Ass. UK. V. 65. № 2. P. 475–485. https://doi.org/10.1017/S0025315400050554
Hammer Ø., Harper D.A.T., Ryan P.D. 2001. PAST: Paleontological statistics software package for education and data analysis // Palaeontol. Electron. V. 4. № 1. P. 9. Available: http://palaeo-electronica.org/2001_1/past/issue1_01.htm
Horn P.L., Sutton C.P. 2015. An assessment of age and growth of violet cod (Antimora rostrata) in the Ross Sea, Antarctica // Polar Biol. V. 38. № 9. P. 1553–1558. https://doi.org/10.1007/s00300-015-1702-3
Iwamoto T. 2010. Antimora microlepis // The IUCN Red List of Threatened Species 2010. Article e.T155287A4766841. https://doi.org/10.2305/IUCN.UK.2010-4.RLTS.T155287A4766841.en
Iwamoto T. 2015 Antimora rostrata // The IUCN Red List of Threatened Species. 2015. Article e.T190385A15603090. https://doi.org/10.2305/IUCN.UK.2015-4.RLTS.T1903-85A15603090.en
Kastelle C.R., Kimura D.K., Nevissi A.E., Gunderson D.R. 1994. Using Pb-210/Ra-226 disequilibria for sablefish, Anoplopoma fimbria, age validation // Fish. Bull. V. 92. № 2. P. 292–301
Katsanevakis S., Maravelias C.D. 2008 Modelling fish growth: multi-model inference as a better alternative to a priori using von Bertalanffy equation // Fish Fish. V. 9. № 2. P. 178–187. https://doi.org/10.1111/j.1467-2979.2008.00279.x
Korostelev N.B., Frey P.H., Orlov A.M. 2020a. Using different hard structures to estimate the age of deep-sea fishes; a case study of the Pacific flatnose, Antimora microlepis (Moridae, Gadiformes, Teleostei) // Fish. Res. V. 232. Article 105731. 4 p. https://doi.org/10.1016/j.fishres.2020.105731
Korostelev N.B., Vedishcheva E.V., Orlov A.M. 2020b. Age and growth of Antimora rostrata (Moridae, Gadiformes, Teleostei) from the Kerguelen and Crozet Islands in the southern Indian Ocean // Polar Rec. V. 55. № 6. P. 452–459. https://doi.org/10.1017/S0032247420000157
Kulka D.W., Simpson M.R., Inkpen T.D. 2003. Distribution and biology of blue hake (Antimora rostrata Günther, 1878) in the Northwest Atlantic with comparison to adjacent areas // J. Northw. Atlant. Fish. Sci. V. 31. P. 299–318.
Laevastu T. 1965. Manual of methods in fisheries biology. Rome: FAO, 51 p.
Magnússon J.V. 2001. Distribution and some other biological parameters of two morid species Lepidion eques (Günther, 1887) and Antimora rostrata (Günther, 1878) in Icelandic waters // Fish. Res. V. 51. № 2–3. P. 267–281. https://doi.org/10.1016/S0165-7836(01)00251-X
Orlov A.M., Abramov A.A. 2001. New data on Pacific flatnose, Antimora microlepis (Moridae) from the northwestern Pacific Ocean // MTS/IEEE Oceans 2001. An Ocean Odyssey. Conference Proceedings. V. 2. P. 833–841. https://doi.org/10.1109/OCEANS.2001.968227
Orlov A.M., Bannikov A.F., Orlova S.Yu. 2020. Hypothesis of Antimora spp. (Moridae) dispersion in the world oceans based on data on modern distribution, genetic analysis, and ancient records // J. Ichthyol. V. 60. № 3. P. 399–410. https://doi.org/10.1134/S0032945220030108
Paloheimo J.E, Dickie L.M. 1965. Food and growth of fishes. 1. A growth curve derived from experimental data // J. Fish. Res. Board Can. V. 22. № 2. P. 521–542. https://doi.org/10.1139/f65-048
Parker R.R., Larkin P.A. 1959. A concept of growth in fishes // Ibid. V. 16. № 5. P. 721–745. https://doi.org/10.1139/f59-052
Priede I.G. 2017. Deep-sea fishes. Biology, diversity, ecology and fisheries. Cambridge: CUP, 492 p.
Rodríguez Mendoza R.P. 2006. Otoliths and their applications in fishery science // Ribarstvo. V. 64. № 3. P. 89–102.
Roff D.A. 1980 A motion for the retirement of the von Bertalanffy function // Can. J. Fish. Aquat. Sci. V. 37. № 1. P. 127–129. https://doi.org/10.1139/f80-016
Schnute J. 1981 A versatile growth model with statistically stable parameters // Ibid. V. 38. № 9. P. 1128–1140. https://doi.org/10.1139/f81-153
Small G.J. 1981. A review of the bathyal fish genus Antimora (Moridae: Gadiformes) // Proc. Calif. Acad. Sci. V. 42. № 13. P. 341–348.
Smith J.N., Nelson R., Campana S.E. 1991. The use of Pb-210/Ra-226 and Th-228/Ra-228 dis-equilibria in the ageing of otoliths of marine fish // Radionuclides in the study of marine processes. Dordrecht: Springer. P. 350–359. https://doi.org/10.1007/978-94-011-3686-0_37
Ursin E. 1967. A mathematical model of some aspects of fish growth respiration and mortality // J. Fish. Res. Board. Can. V. 24. № 11. P. 2355–2453. https://doi.org/10.1139/f67-190
Vedishcheva E.V., Korostelev N.B., Gordeev I.I., Orlov A.M. 2019. A first attempt to evaluate the age and growth of blue hake Antimora rostrata (Moridae, Gadiformes, Teleostei) from the Lazarev and Weddell seas (Antarctic) // Polar Rec. V. 55. № 1. P. 25–31. https://doi.org/10.1017/S0032247419000147
Wenner C.A., Musick J.A. 1977. Biology of the morid fish Antimora rostrata in the western North Atlantic // J. Fish. Res. Board. Can. V. 24. № 12. P. 2362–2368 https://doi.org/10.1139/f77-316
Дополнительные материалы
- скачать ESM_1.xlsx
- Приложение 1.
Размерно-возрастной ключ для определения возраста клюворылой антиморы Antimora rostrata из вод банки Флемиш-кап.
Инструменты
Вопросы ихтиологии