Вопросы ихтиологии, 2022, T. 62, № 5, стр. 541-555
“Пресноводные компоненты” в популяциях кунджи Salvelinus leucomaenis (Salmonidae) на севере ареала вида (Камчатка)
К. В. Кузищин 1, *, М. А. Груздева 1, А. М. Малютина 1, Д. С. Павлов 1, 2
1 Московский государственный университет
Москва, Россия
2 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: KK_office@mail.ru
Поступила в редакцию 13.05.2022
После доработки 17.05.2022
Принята к публикации 18.05.2022
- EDN: NNEVMU
- DOI: 10.31857/S0042875222050125
Аннотация
Рассматриваются разнообразие типов жизненной стратегии и структура популяций кунджи Salvelinus leucomaenis (Pallas, 1814) на Камчатке. Установлено, что на севере ареала вида популяции кунджи неоднородны. Основная роль в воспроизводстве принадлежит анадромной кундже, но в составе популяций существуют группировки, реализующие свой жизненный цикл исключительно в пресных водах. Выявлено, что в реках разного типа карликовые самцы обычны. В сложной по геоморфологии реке (Коль) обитает ещё и речная реодромная кунджа, представленная самцами и самками. Ключевыми параметрами, определяющими наличие речной реодромной кунджи, являются подходящие биотопы – завалы и заломы древесного материала на глубоких плёсах, которые есть только в реках предгорного типа. Показано, что на севере ареала у кунджи разнообразие особей с разными типами жизненной стратегии сопоставимо с таковым на юге – в бассейне Японского моря, который считается зоной экологического оптимума вида.
Кунджа Salvelinus leucomaenis – вид гольцов, приуроченный к азиатскому побережью Тихого океана. Его ареал охватывает водоёмы бассейнов Японского, Охотского и юго-западной части Берингова морей. По сравнению с другими видами гольцов рода Salvelinus кунджа остаётся слабо изученным видом (Kawanabe 1989; Yamamoto et al., 1999; Гриценко, 2002; Hosoya, 2002; Nakamura, 2003; Dunham et al., 2008; Рыбы …, 2012; Yamaguchi et al., 2016). Наибольшее разнообразие кунджи наблюдается в южной части ареала – на Японских о-вах Хоккайдо и Хонсю. Там, помимо номинального подвида S. l. leucomaenis, приуроченного к водоёмам о-ва Хоккайдо, выделяют ещё три подвида на о-ве Хонсю (S. l. imbrius, S .l. pluvius/pluvicus, S. l. japonicus), ведущих пресноводный образ жизни и различающихся по окраске и некоторым морфологическим и генетическим особенностям (Kawanabe 1989; Nakajima, Fujio, 1995; Hosoya, 2002; Yamamoto et al., 2004; Yamaguchi et al., 2010, 2016). В составе подвида S. l. leucomaenis на Хоккайдо в разных реках описаны симпатричные и аллопатричные экологические группировки кунджи с разной степенью выраженности анадромии и резидентости. В ряде случаев резидентные и анадромные особи являются взаимодействующими элементами одной популяционной системы, в других случаях они могут быть изолированы друг от друга физическими барьерами (Yamamoto et al., 1999, 2004; Morita, Yamamoto, 2002; Kikko et al., 2009; Morita et al., 2013). Таким образом, на юге ареала в настоящее время наблюдается широкий спектр внутривидовых группировок кунджи и имеются детальные описания разнообразных случаев сосуществования и взаимоотношений жилых и проходных рыб.
В то же время по кундже северной части ареала данных немного (Kawanabe 1989; Yamamoto et al., 1999; Yamamoto, Morita, 2002; Черешнев и др., 2002; Dunham et al., 2008; Morita et al., 2013). В литературе имеются сведения по структуре популяций анадромной кунджи и единичные описания озёрно-речных и речных группировок из некоторых рек материкового побережья Охотского моря (Волобуев, Никулин, 1975; Волобуев и др., 1985; Волобуев, 1987; Гудков, 1991; Гудков и др., 1991; Черешнев и др., 2002). Кунджа из рек Камчатки остаётся наименее изученной (Черешнев и др., 2002; Савваитова и др., 2007). По пресноводным группировкам кунджи на Камчатке имеется только несколько упоминаний о “речной кундже в бассейне крупных камчатских рек” (Черешнев и др., 2002; Есин, Маркевич, 2017). Единственное описание обоеполой ручьевой популяции относится к одному термальному ручью на восточном побережье Камчатки (Есин, Сорокин, 2012).
В связи с этим цель нашего исследования – изучить структуру локальных популяций кунджи на Камчатке из рек с разной геоморфологией и выявить пресноводные группировки в их составе.
МАТЕРИАЛ И МЕТОДИКА
Сбор полевого материала проводили по единой схеме с применением одинаковых подходов и методов на реках Коль в 2002–2008 гг. и Кехта в 2003–2008 гг. на западном побережье Камчатского п-ова. Работы в 2003–2006 гг. на обеих реках осуществляли непрерывно с мая по октябрь от истоков до устья.
Несмотря на близкое расположение (расстояние между устьями составляет ~8 км), реки Коль и Кехта сильно различаются по своему строению (табл. 1, рис. 1). Река Коль предгорного типа с разветвлённым руслом, большим уклоном ложа, быстрым течением; Кехта – тундрового типа с канальным руслом и слабым течением (Павлов и др., 2008, 2009; Кузищин, 2010).
Таблица 1.
Геоморфологические параметры бассейнов рек Коль и Кехта (по: Ресурсы …, 1973; Павлов и др., 2008, 2009; с дополнениями и изменениями)
| Параметр | Бассейн р. Коль | Бассейн р. Кехта |
|---|---|---|
| Длина реки, км | ~130 | ~60 |
| Площадь водосбора, км2 | 1580 | 657 |
| Уклон ложа, м/км | >5 | <3 |
| Тип реки | Разветвлённое русло, горный и предгорный характер | Русло канального типа, тундровый характер на всем протяжении |
| Притоки | Множество; тундрового и горного типов, последние преобладают; длина 5–30 км, бо́льшая часть – 5–10 км | Единичны, только тундрового типа; короткие – 1–3 км, узкие – примерно 1 м |
| Встречаемость древесного материала в русле | Повсеместно, множество завалов и заломов | Единично |
| Наличие глубоких проточных ям | Единичны | Многочисленны в нижнем и среднем течении реки |
| Строение плёсов | Длина 100–300 м, глубина до 3 м, скорость течения 0.6–0.7 м/с, на дне галька и гравий, всегда есть завалы деревьев | Длина 200–400 м, глубина до 2 м, скорость течения ~0.3 м/с, дно сложено песком, древесного материала почти нет |
| Наличие солоноватоводного лимана при впадении реки в море | Отсутствует. Река впадает в море единым устьем, глубина в устье 1.2–2.1 м, перед впадением в море в реке только пресная вода | Имеется, длина 1.0–1.3 км, ширина ~40–45 м, глубина до 4 м в прилив, солёность 5–12‰ |
Рис. 1.
Карта-схема района работ, места сбора материала: (▲) – в основном русле, (◇) – в боковых протоках, (⚪) – в притоках, (◻) – установленные нерестилища кунджи Salvelinus leucomaenis. Цифры, %: до черты – численность кунджи по отношению к суммарному количеству особей всех остальных видов лососёвых, после черты – численность карликовых самцов по отношению к суммарному количеству молоди кунджи. Масштаб: 4 км.
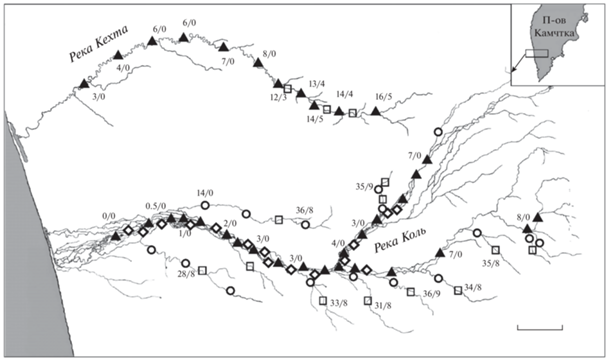
Отлов рыб проводили в основном русле рек, их притоках тундрового и горного типов, в водоёмах придаточной системы, в лимане р. Кехта, в море в приустьевой зоне закидными неводами, жаберными сетями, входящими в стандартный набор (шаг ячеи от 20 до 75 мм), и удебными снастями. Молодь, карликовых самцов и производителей на нерестилищах отлавливали с применением электролова Smith-Root 24L (“Smith-Root”, США) в щадящем режиме (Bird, Cowx, 1993) с переменным импульсным током (напряжение 350–400 В, частота 40–60 Гц, длительность импульса 2 мс). После отлова всех особей обездвиживали растворами MS-222 или гвоздичного масла (Kouřil et al., 2009; Микодина и др., 2011). Для оценки плотности молоди использовали метод трёхкратного облова (Zippin, 1956), показатели плотности и биомассы молоди рыб определяли для участков площадью не менее 150 м2 каждый. Сбор материала проведён на >50 участках р. Коль и >25 участках р. Кехта (рис. 1). Всего проанализировано >50 тыс. экз. разновозрастной молоди. Поведение рыб во время нереста изучали методом визуальных подводных наблюдений и с использованием камеры GoPro (GoPro, Inc, США) (Кузищин и др., 2008; Груздева и др., 2013, 2017).
Для >600 экз. половозрелых рыб и 10 тыс. экз. молоди выполнен биологический анализ (Правдин, 1966). У всех рыб определяли пол и стадию зрелости гонад (Мурза, Христофоров, 1991). Для части рыб выполнен морфометрический анализ по модифицированной схеме для лососёвых рыб (Павлов и др., 2001): оценивали 25 пластических и 10 меристических признаков. Возраст рыб определяли по отолитам (сагитта). При оценке возраста, выявлении пресноводного и морского периодов жизни учитывали рекомендации Гудкова (1991), Гудкова с соавторами (1991) и Тиллера (2007). Для уточнения периодизации пресноводного и морского периодов жизни параллельно проводили оценку соотношения ионов стронция и кальция на шлифах отолитов с использованием рентгенофлуоресцентного анализа – важнейшие результаты приведены ранее (Павлов и др., 2013, 2016; Павлов, Скоробогатов, 2014). Для оценки особенностей питания изучали состав пищевого комка счётно-весовым методом (Шорыгин, 1952; Руководство …, 1961). Конкретные объёмы выборок по разным видам анализа указаны в соответствующих разделах публикации. Статистический анализ результатов проводили стандартным унивариантным методом (Лакин, 1990).
РЕЗУЛЬТАТЫ
Структура популяции кунджи в реках Коль и Кехта установлена на основании изучения размерного, возрастного, полового составов; оценки численности и анализа сезонного распределения рыб в речной системе, лимане (для р. Кехта) и приустьевой части моря (для обеих рек).
В р. Коль популяция кунджи состоит из анадромной и резидентной (пресноводной) компонент. Первая представлена особями, выходящими на нагул в море в летнее время, вторая – разновозрастной речной молодью (пестрятками) и мигрирующей в море покатной молодью на разных этапах серебрения (смолтами). В речном бассейне также обнаружены особи, достигающие половой зрелости в реке, – карликовые самцы, по внешнему облику и окраске имеющие сходство с неполовозрелой молодью, и речные реодромные особи, которые имеют ряд отличий от молоди, карликовых самцов и анадромных рыб по пропорциям тела, размерам и окраске (табл. 2, рис. 2). Под “речными реодромными” (по: Павлов, Скоробогатов, 2014) мы понимаем рыб, жизненный цикл которых реализуется в пределах реки, где они совершают миграции между нерестовыми притоками и основным руслом, протяжённость их миграций составляет десятки километров. Популяция кунджи р. Кехта также состоит из анадромной и резидентной компонент. В составе резидентной обнаружены пестрятки, смолты и карликовые самцы.
Таблица 2.
Морфометрическая характеристика кунджи Salvelinus leucomaenis разных группировок из реки Коль
| Признак | Пестрятки, 3+ (n = 25) |
Смолты, 3+ (n = 25) |
Карликовые самцы (n = 25) |
Речные реодромные (n = 31) |
Анадромные (n = 50) |
|---|---|---|---|---|---|
| FL, мм | 172.1 (128–192) | 212.3 (201–221) | 219.6 (196–229) | 355.5 (324–427) | 516.8 (497–603) |
| в % FL | |||||
| c | 22.49 ± 0.18 (21.2–23.5) | 21.30 ± 0.17 (18.9–22.3) | 23.53 ± 0.39 (22.4–24.6) | 23.87 ± 0.31 (21.8–24.9) | 21.42 ± 0.24 (20.2–23.2) |
| ao | 5.44 ± 0.12 (4.4–6.2) | 5.14 ± 0.13 (4.3–6.1) | 6.64 ± 0.16 (5.3–7.0) | 5.98 ± 0.17 (5.5–7.3) | 7.01 ± 0.12 (6.4–8.2) |
| o | 5.31 ± 0.10 (4.5–5.8) | 4.32 ± 0.12 (3.9–5.0) | 4.87 ± 0.13 (4.1–5.1) | 5.16 ± 0.12 (4.5–6.0) | 2.61 ± 0.14 (2.1–3.8) |
| op | 12.42 ± 0.15 (11.8–13.5) | 12.65 ± 0.13 (11.3–13.1) | 13.29 ± 0.16 (12.3–14.3) | 14.37 ± 0.13 (12.7–15.1) | 12.39 ± 0.15 (11.5–12.8) |
| io | 6.48 ± 0.14 (5.6–7.4) | 6.18 ± 0.11 (5.3–7.0) | 6.88 ± 0.14 (6.1–7.7) | 7.42 ± 0.14 (6.9–8.1) | 7.45 ± 0.13 (6.7–8.3) |
| hcz | 14.56 ± 0.21 (12.8–16.0) | 13.04 ± 0.13 (12.4–14.6) | 16.42 ± 0.19 (16.1–17.9) | 15.26 ± 0.15 (13.2–17.3) | 13.15 ± 0.18 (12.0–14.7) |
| lm | 11.46 ± 0.19 (10.4–12.6) | 10.88 ± 0.12 (9.9–11.7) | 13.72 ± 0.18 (12.6–14.1) | 13.88 ± 0.17 (12.1–15.3) | 12.21 ± 0.13 (11.4–13.9) |
| Hm | 2.26 ± 0.05 (1.9–2.6) | 1.76 ± 0.09 (1.5–1.9) | 2.79 ± 0.11 (2.3–3.2) | 2.33 ± 0.12 (2.1–2.7) | 2.01 ± 0.09 (1.6–2.3) |
| lmd | 13.17 ± 0.17 (12.5–14.3) | 12.87 ± 0.12 (11.6–13.7) | 13.55 ± 0.18 (12.9–14.8) | 15.06 ± 0.15 (13.2–16.8) | 13.85 ± 0.18 (12.4–16.2) |
| H | 19.78 ± 0.48 (17.0–22.1) | 17.33 ± 0.20 (16.2–18.8) | 24.37 ± 0.32 (22.9–25.8) | 20.06 ± 0.21 (17.8–22.3) | 21.55 ± 0.20 (19.5–22.9) |
| h | 8.63 ± 0.14 (7.8–9.4) | 8.23 ± 0.17 (7.3–9.0) | 9.17 ± 0.16 (8.4–9.5) | 9.05 ± 0.18 (7.9–10.1) | 8.63 ± 0.12 (7.8–9.2) |
| pl | 17.71 ± 0.21 (17.2–18.9) | 18.22 ± 0.19 (17.3–20.1) | 17.13 ± 0.21 (16.1–17.5) | 16.56 ± 0.19 (15.7–17.2) | 16.81 ± 0.14 (15.9–18.1) |
| lD | 12.68 ± 0.29 (11.2–13.9) | 12.32 ± 0.12 (10.9–13.5) | 15.74 ± 0.25 (14.8–16.8) | 14.23 ± 0.18 (12.9–15.4) | 11.07 ± 0.13 (9.7–12.2) |
| hD | 16.25 ± 0.41 (13.5–18.0) | 13.12 ± 0.13 (12.0–14.0) | 17.04 ± 0.33 (14.2–18.7) | 16.76 ± 0.22 (15.3–17.7) | 11.14 ± 0.12 (9.6–13.6) |
| lA | 9.14 ± 0.15 (8.1–10.0) | 9.16 ± 0.11 (8.2–10.0) | 9.18 ± 0.16 (8.3–10.1) | 8.98 ± 0.17 (8.0–10.0) | 7.98 ± 0.10 (6.9–8.8) |
| hA | 14.51 ± 0.23 (13.1–16.2) | 12.11 ± 0.13 (11.7–13.8) | 14.77 ± 0.21 (13.6–16.2) | 13.71 ± 0.18 (11.9–14.3) | 11.85 ± 0.11 (10.5–13.1) |
| lP | 16.08 ± 0.33 (14.2–18.3) | 14.51 ± 0.14 (13.2–15.4) | 17.30 ± 0.35 (15.5–18.2) | 16.79 ± 0.16 (15.3–18.4) | 12.38 ± 0.13 (11.8–14.2) |
| lV | 12.73 ± 0.24 (10.5–13.6) | 11.46 ± 0.12 (10.9–12.6) | 12.05 ± 0.21 (11.0–13.8) | 12.57 ± 0.18 (11.3–14.2) | 11.56 ± 0.13 (10.7–12.6) |
| aD | 42.43 ± 0.48 (39.6–43.5) | 41.77 ± 0.19 (39.4–42.8) | 42.72 ± 0.52 (39.8–44.6) | 40.11 ± 0.23 (38.5–43.1) | 43.89 ± 0.22 (41.2–45.7) |
| pD | 38.65 ± 0.37 (36.7–40.9) | 39.37 ± 0.18 (37.2–41.8) | 36.75 ± 0.44 (35.0–38.2) | 38.72 ± 0.24 (36.5–40.8) | 41.18 ± 0.20 (39.6–42.5) |
| aV | 48.50 ± 0.42 (45.7–51.4) | 49.02 ± 0.22 (46.7–50.8) | 49.36 ± 0.52 (47.7–52.1) | 48.54 ± 0.25 (45.4–50.8) | 51.23 ± 0.25 (49.2–54.2) |
| aA | 67.22 ± 0.65 (65.4–69.3) | 69.37 ± 0.25 (66.9–71.2) | 64.55 ± 0.74 (63.3–68.9) | 64.67 ± 0.30 (62.3–68.2) | 70.14 ± 0.33 (68.1–72.2) |
| P–V | 30.08 ± 0.31 (25.8–35.0) | 30.29 ± 0.23 (26.1–33.6) | 30.37 ± 0.35 (26.3–34.5) | 27.54 ± 0.22 (25.3–29.2) | 29.53 ± 0.23 (26.7–31.6) |
| V–A | 20.07 ± 0.29 (18.4–23.1) | 21.42 ± 0.21 (18.9–23.8) | 19.65 ± 0.28 (18.6–21.4) | 17.66 ± 0.18 (15.3–20.3) | 19.69 ± 0.21 (18.9–21.9) |
Примечание. Перед скобками – среднее значение и его ошибка, в скобках – пределы варьирования признака. FL – длина по Смитту, c – длина головы, ao – длина рыла, o – горизонтальный диаметр глаза, op – заглазничное расстояние, io – межглазничное расстояние, hcz – высота головы на уровне затылка, lm – длина верхнечелюстной кости, Hm – ширина верхней челюсти, lmd – длина нижней челюсти, H – наибольшая высота тела, h – высота хвостового стебля, pl – длина хвостового стебля, lD – длина основания спинного плавника, hD – высота спинного плавника, lA – длина основания анального плавника, hA – высота анального плавника, lP –длина грудного плавника, lV – длина брюшного плавника; расстояния: aD – антедорсальное, pD – постдорсальное, aV – антевентральное, aA – антеанальное, P–V – пектовентральное и V–A – вентроанальное.
Рис. 2.
Внешний вид кунджи Salvelinus leucomaenis из бассейна р. Коль, Западная Камчатка: а – пестрятка FL 134 мм, возраст 2+, самка, II стадия зрелости гонад (руч. Симовый, 03.09.2004 г.); б – карликовый самец FL 194 мм, 3+, V (руч. Симовый, нерестилища кунджи, 03.09.2004 г.); в – речная реодромная особь FL 329 мм, 6+, самец, IV (основное русло р. Коль, 35 км от устья, 18.08.2007 г.); г – анадромная особь FL 636 мм, 9+, самка, IV (устье р. Коль, 28.08.2006 г.).

В бассейне р. Коль недифференцированная молодь кунджи – пестрятки – встречаются в основном в притоках горного и тундрового типов, где их численность может достигать >30% по отношению к суммарному количеству молоди всех остальных видов лососёвых рыб (рис. 1). Пестрятки кунджи в притоках потребляют широкий спектр кормовых объектов, с первого лета жизни они становятся хищниками и охотятся на молодь мальмы S. malma; в возрасте 1+ и старше, рыбная пища у них составляет >30% рациона (табл. 3). В основном русле и боковых протоках молодь кунджи встречается единично.
Таблица 3.
Характеристика питания внутрипопуляционных группировок кунджи Salvelinus leucomaenis (доля компонента, % массы пищи) в бассейнах рек Коль и Кехта (соответственно до черты и после)
| Показатель | Сеголетки 0+ | Пестрятки | Карликовые самцы* | Речные реодромные** | Анадромные*** | |
|---|---|---|---|---|---|---|
| 1+ | 2+ | |||||
| Личинки Chironomidae и мошек Simuliidae | 23/22 | 9/6 | 7/1 | 1/– | ||
| Личинки Ephemeroptera, Plecoptera, Trichoptera | 34/25 | 21/20 | 16/14 | 9/5 | 7 | |
| Икра тихоокеанских лососей Oncorhynchus spp. | 27/27 | 27/21 | 22/18 | 11/10 | 12 | |
| Имаго и личинки наземных насекомых | 12/21 | 14/20 | 13/21 | 8/5 | <1 | |
| Сеголетки мальмы Salvelinus malma FL < 50 мм | 4/5 | 16/18 | 21/20 | 23/26 | 15 | |
| Сеголетки кижуча O. kisutchFL < 70 мм | 13/15 | 18/18 | 18/23 | 11 | ||
| Пестрятки мальмы FL > 50 мм | 2/6 | 18/19 | 26 | |||
| Пестрятки кижуча FL > 70 мм | 1/1 | 12/12 | 23 | |||
| Покатная молодь горбуши O. gorbuscha и кеты O. keta | –/1 | 5 | 11/18 | |||
| Морские мизиды (Mysidae) | 12/27 | |||||
| Молодь звёздчатой камбалы Platichthys stellatus FL 70–130 мм | 56/43 | |||||
| Молодь желтопёрой камбалы Limanda aspera FL 80–90 мм | <1/– | |||||
| Молодь рогатковых (Cottidae) FL 80–110 мм | 8/10 | |||||
| Молодь наваги Eleginus gracilis FL 100–150 мм | 4/– | |||||
| Мойва Mallotus villosus catervarius FL 120–190 мм | 3/– | |||||
| Трёхиглая колюшка Gasterosteus aculeatus FL 60–90 мм | 3/<1 | |||||
| Девятииглая колюшка Pungitius pungitius FL 40–60 мм | <1/<1 | |||||
| Колючий люмпен Acantholumpenusmackayi FL 200–250 мм | <1/– | |||||
| Число рыб, экз. | 88/30 | 124/50 | 35/30 | 21/15 | 23/– | 28/30 |
В р. Кехта пестрятки кунджи обитают на значительном протяжении – от зоны влияния морского прилива до истоков (рис. 1). Наибольшие скопления и наиболее сложный возрастной состав молоди кунджи обнаружены в среднем и верхнем течении. Сеголетки кунджи обитают по всему сечению реки, прячась в расщелинах валунов и крупной гальке; пестрятки старшего возраста располагаются под крутыми берегами или среди россыпей крупных валунов, а также в небольших подперекатных ямах в зонах воротного течения. В основном русле р. Кехта кунджа занимает 4-е место по численности, уступая молоди мальмы, микижи Parasalmo mykiss и кижуча Oncorhynchus kisutch (36 контрольных обловов, восемь участков). Молодь кунджи в р. Кехта с возраста сеголетки, как и в р. Коль, начинает потреблять рыбную пищу, с возраста 1+ уже >30% её рациона составляет молодь других лососёвых рыб, а в более старшем возрасте рыбная пища становится доминирующей (табл. 3).
Карликовые самцы кунджи в бассейне р. Коль отличаются от неполовозрелых рыб массивной головой, верхняя челюсть у них слегка изогнута вверх (у неполовозрелых рыб прямая), профиль спины между головой и началом спинного плавника более крутой, больше высота тела (23.1–24.3 против 20.4–21.8% FL у неполовозрелой молоди), тело и хвостовой стебель почти округлые в сечении (у неполовозрелых рыб они отчётливо сжаты с боков), хвостовой стебель более короткий (16.2–17.1 против 17.3–18.2% FL у молоди) и высокий (8.4–9.5 против 7.4–8.5% FL), грудные плавники у карликовых самцов широкие, веерообразные, хвостовой плавник слабовыемчатый с закруглёнными лопастями (табл. 2, рис. 2).
У неполовозрелых рыб на боках тела всегда хорошо видны 9–10 мальковых пятен-полос, у карликовых самцов они имеют размытый край и становятся заметными только в боковом свете, а во время нереста сливаются с фоном тела. У карликовых самцов первый луч брюшных и анального плавников молочно-белый, резко контрастирует с тёмным фоном остальной части плавника; брюшко имеет хорошо выраженный оранжевый или красноватый цвет, которого никогда не бывает у неполовозрелых особей; пятна на боках тела в течение всего года светлые или со слабым жёлтым оттенком. Во время нереста карликовые самцы становятся более тёмными; их грудные, брюшные и анальный плавники – оранжевыми; брюшко менее яркое и покрывается чёрной пигментной сеточкой, цвет пятен на боках не меняется.
Карликовые самцы р. Коль обнаружены только в нерестовых притоках, где занимают участки среднего и верхнего течения. Их численность невысокая – обычно в июле–августе на плёсе длиной 20–30 м можно обнаружить только одного карликового самца (данные по 237 плёсам шести притоков). В нерестовых притоках численность карликовых самцов по отношению к суммарному количеству неполовозрелой молоди кунджи всех возрастных классов наименьшая по сравнению с другими видами лососёвых рыб (табл. 4). В пределах плёса карликовые самцы выбирают специфические биотопы – они располагаются в местах с наибольшей глубиной (в среднем 0.73 ± 0.10 м, но не менее 0.65 м, n = 38), где имеются разнообразные укрытия. Чаще всего это нависающий над водой участок дерновины или корни околоводных деревьев, реже – упавший в ручей ствол дерева. Обычно карликовые самцы обитают в нишах под подмытыми берегами, тем самым в подавляющем большинстве случаев выбирают на плёсе точку с укрытиями типа “крыша над головой”. Как правило, в месте расположения карликового самца скорость течения составляет 0.53 ± 0.11 м/с (n = 44). Донный субстрат не имеет решающего значения при выборе биотопа, примерно в 60% случаев обнаружения карликовых самцов дно было сложено песком и гравием, реже – крупной галькой (~35%) или на дне были валуны. Почти всегда карликовые самцы держались в среднем слое воды между дном и поверхностью. В притоках р. Коль карликовые самцы кунджи – одиночные хищники, >70% их рациона составляет молодь мальмы и кижуча (табл. 3). На основании наблюдений и целевых обловов удебными снастями установлено, что свою добычу карликовые самцы схватывают у берега, совершая броски из своего укрытия, и после успешной охоты стремятся немедленно вернуться обратно под нависающий берег. Карликовые самцы активно питаются в летний период, но прекращают питание в период нереста.
Таблица 4.
Параметры отдельных участков нерестовых притоков реки Коль и относительная численность на них карликовых самцов (до черты) и пестряток (после черты) кунджи Salvelinus leucomaenis, мальмы S. malma и симы Oncorhynchus masou
| Приток | Длина | Ширина | Глубина средняя | Площадь, м2 | Число рыб, экз. | ||
|---|---|---|---|---|---|---|---|
| м | кунджа | мальма | сима | ||||
| Река Красная | 271.8 | 3.6 | 0.33 | 993.6 | 3/583 | 72/825 | 24/552 |
| Ручей: | |||||||
| – Глинистый | 188.5 | 2.6 | 0.30 | 511.4 | 2/301 | 41/637 | 8/279 |
| – Сквичик | 201.5 | 3.5 | 0.36 | 734.8 | 2/469 | 55/751 | 11/412 |
| – Симовый | 233.5 | 2.6 | 0.32 | 642.6 | 4/388 | 48/722 | 22/433 |
В р. Кехта карликовые самцы кунджи обнаружены в участках среднего и верхнего течения. Из-за строения и больших размеров основного русла реки их биотоп несколько иной, чем в притоках р. Коль. В верхнем течении р. Кехта, где дно сложено крупнообломочным материалом (валуны размером до 60 см и глыбы с острыми краями), карликовые самцы располагаются в углублениях-“цирках” между крупных валунов на перекатах, будучи укрытыми со всех сторон. Однако как таковой “крыши над головой” у карликовых самцов нет, но над верхней границей валунов всегда имеется локальный водный вихрь. Обычно над биотопом глубина потока составляет 0.3–0.5 (в среднем 0.39) м, его скорость над верхней кромкой валунов – 0.6–0.8 (в среднем 0.73) м/с. На одном перекате шириной 15–17 м и длиной 10–12 м могут располагаться два–три карликовых самца кунджи, разобщённых расстояниями в 8–10 м. На плёсах р. Кехта карликовые самцы не обнаружены даже в том случае, когда имеются упавшие в воду небольшие стволы деревьев или подмытые берега. Численность карликовых самцов кунджи существенно ниже, чем таковых мальмы и симы O. masou – обычно на перекатах на одного карликового самца кунджи приходится 15–20 карликовых самцов мальмы и до десяти карликовых самцов симы. Как и в притоках р. Коль, в русле р. Кехта карликовые самцы кунджи потребляют в основном рыбную пищу. Перекаты верхнего течения р. Кехта, сложенные валунами, также населяет молодь разных видов лососёвых рыб (прежде всего, молодь мальмы и кижуча), которая является основным кормом для карликовых самцов кунджи. Примечательно, что ни разу не был установлен факт поедания карликовыми самцами кунджи сеголеток и пестряток микижи, которые по численности сопоставимы с молодью мальмы и кижуча.
Речные реодромные особи обнаружены только в бассейне р. Коль. Они имеют плоскую массивную голову (23–24% FL), изогнутую вверх верхнюю челюсть, цилиндрическое тело, овальный хвостовой стебель, усечённый или даже слегка овальный хвостовой плавник, широкие веерообразные грудные плавники, спинной и анальный плавники имеют выпуклый неровный наружный край. Окраска покровительственная – тело имеет серовато-оливковый фон, брюхо серое; пятна на боках тела светлые или светло-серые, слабо контрастные; червеобразные светлые пятна на спине (характерный признак проходных особей) выражены слабо, чаще встречаются слегка вытянутые пятна с неровным краем (рис. 2). Во время нереста тело речных реодромных рыб становится тёмно-серым; голова, включая нижнюю челюсть, чёрной; все плавники – почти чёрными с голубоватым отливом; первый луч грудных, брюшных и анального, а также нижние неветвистые лучи хвостового плавников становятся молочно-белыми и резко контрастируют с остальной их частью. Пятна на боках тела приобретают светло-розовый цвет. Речные реодромные самцы имеют более тёмную окраску в период нереста по сравнению с самками.
Речные реодромные особи кунджи обитают в основном русле реки и крайне редко в крупных боковых протоках. Типичный их биотоп – глубокий ламинарный участок крупного плёса (глубина 1.3–3.0, в среднем 1.7 ± 0.2 м), где скорость течения в межень (июль–сентябрь) составляет 0.5–0.6 м/с и где имеются упавшие в воду деревья или завалы деревьев. В таких местах было >95% поимок речной реодромной кунджи. Рыбы располагались в придонном слое воды под упавшими стволами или “в полводы” среди ветвей и стволов, почти всегда над рыбой была “крыша над головой”, как и у карликовых самцов в притоках. Речная реодромная кунджа ведёт одиночный и скрытный образ жизни, редко в крупных заломах держатся по две–три особи. Это хищник, из укрытий совершающий выходы в сторону высокого берега, где в межень потребляет молодь мальмы (~40% рациона), реже – кижуча (~30%) (табл. 3) и единично – молодь других видов лососёвых (чавыча O. tshawytscha, нерка O. nerka), стараясь находиться в зоне глубокой воды. В отличие от мальмы речная реодромная кунджа в русле реки переходит на питание икрой тихоокеанских лососей только в годы урожайного поколения горбуши, доля икры в пищевом комке составляет ~12% (в среднем по годам, данные для середины–конца августа).
Речная реодромная кунджа приурочена преимущественно к среднему течению реки, ~80% её поимок были отмечены в основном русле на участке 20–80 км от устья. В зоне предгорных участков, где широких и спокойных плёсов немного, она редка. Во все годы наблюдений речные реодромные особи кунджи не были встречены и в самых нижних участках реки. В летнее время в реке они не совершают значительных перемещений, почти в 100% случаев после вылова особи в конкретном месте обитания другая особь там не появлялась до осеннего паводка или появлялась только в следующем году. Перераспределение речных реодромных рыб в реке связано с паводками или нерестом: половозрелая часть этих рыб в конце августа–начале сентября заходит в притоки, а после нереста, в середине сентября, скатывается обратно в основное русло и занимает новые русловые биотопы. Таким образом, речная реодромная кунджа в бассейне р. Коль является типичным русловым хищником, приуроченным к относительно просторным (широким и глубоким) участкам речного русла.
Численность речной реодромной кунджи в р. Коль невысокая. По оценкам нерестовых ассоциаций в разных притоках реки в разные годы, доля речных реодромных особей составляет 3–5% производителей. По данным целевых обловов завалов на плёсах, численность речных реодромных особей составляет 1–2 экз. на плёсе длиной 120–170 м.
Анадромная кунджа р. Коль в период нагула приурочена к эстуарной зоне реки со стороны моря. В первой половине лета после ската из реки смолты кунджи нагуливаются в зоне стыка фронтов солёных и пресных вод. Они совершают периодические кочёвки в сторону реки и в сторону моря в зависимости от погодных условий и состояния приливно-отливной волны. Так, в хорошую тихую погоду, когда в море формируется шлейф пресной воды поверх более плотных и холодных морских вод, кунджу можно встретить на удалении до 3.5 км от устья реки, бо́льшая часть рыб нагуливается в ~1 км от устья. При этом отмечено, что кунджа держится под слоем пресной воды в придонной, более солёной (18–22‰) зоне, где питается морскими организмами, среди которых наибольшее значение имеет молодь камбал (Pleuronectidae), а также крупные мизиды (Mysidae) (табл. 3). При сильном волнении или шторме кунджа уходит в речной лиман и концентрируется преимущественно в устьевой зоне реки. Несколько иное распределение наблюдается в конце июня–начале июля. В этот короткий промежуток времени кунджа сосредоточена в устьевой зоне реки, где питается покатной молодью тихоокеанских лососей. Однако очень быстро по сравнению с другими видами (эстуарной и речной эстуарной микижей и мальмой) кунджа переходит на питание более крупными объектами – звёздчатой Platichthys stellatus и желтопёрой Limanda aspera камбалами и навагой Eleginus gracilis.
Анадромная кунджа р. Кехта приурочена преимущественно к солоноватоводному лиману, по которому совершает кочёвки в придонном слое воды. Её редко можно видеть вблизи берега, в летнее время она держится на глубине >1 м, наиболее крупные особи – в самых глубоких участках лимана на глубине 3–5 м. Её выход за пределы лимана отмечали редко и только в конце июня–начале июля, когда происходит скат молоди тихоокеанских лососей. Всего вероятнее, анадромная кунджа покидает лиман, преследуя стаи покатной молоди кеты O. keta и других видов лососёвых. Хотя в лимане кунджа ведёт бродячий образ жизни, не было установлено, чтобы она в течение лета покидала лиман и заходила непосредственно в реку. Зона обитания анадромной кунджи – придонный слой лимана с солёностью 12–18‰ в зависимости от фазы прилива, тогда как солёность поверхностного слоя (0–1 м) меняется от 1.5‰ в отлив до 23‰ в прилив. Основу питания кунджи в лимане р. Кехта составляет молодь рогатковых (Cottidae) и звёздчатой камбалы, а также морские мизиды (табл. 3). Во второй половине июня и до конца первой декады июля анадромная кунджа активно питается покатной молодью тихоокеанских лососей, при этом избирательности нет – это наиболее массовые виды, в основном кета. Существенную долю рациона составляют морские мизиды, которые в лимане в летнее время образуют значительные скопления. В то же время крупные особи анадромной кунджи FL > 400 мм потребляют почти только рыбу, мизиды в их желудках встречаются крайне редко.
Анадромная миграция кунджи из моря в сторону нерестилищ в обеих реках проходит в августе. В отличие от других видов проходных лососёвых рыб выраженного нерестового хода у кунджи в р. Коль не наблюдается. Проходные особи кунджи идут поодиночке или по 2–4 экз., как правило, вдоль обрывистого берега, стремясь двигаться в стороне от мигрирующей горбуши и кеты. Чаще всего идущую вверх по течению анадромную кунджу можно встретить вдоль обрывистых берегов, сильно захламлённых древесным материалом, она избегает мелководий вдоль пологого берега или русловых отмелей у речных осерёдков. На короткий период анадромная кунджа может концентрироваться в крупных глубоких и широких подперекатных ямах, но только тогда, когда в них нет скоплений тихоокеанских лососей. В целом мигрирующая вверх по течению анадромная кунджа в р. Коль ведёт весьма скрытный образ жизни. По данным подводных наблюдений, особи кунджи очень плотно ассоциированы с дном реки, особенно там, где низкая освещённость из-за завалов или свисающих над водой ветвей деревьев. Часто особи анадромной кунджи располагаются на плёсах среди завалов деревьев – там же, где обитает речная реодромная кунджа. Были установлены случаи, когда при движении анадромной кунджи от завалов вверх по течению за ними начинали мигрировать особи речной реодромной кунджи, образуя совместные стаи. В условиях подводного полумрака окраска обеспечивает ей высокоэффективную маскировку. Кунджа очень редко поднимается в средний слой воды. При преодолении мелководных перекатов она почти всегда стремится держаться среди валунов на дне. В конце августа анадромная и речная реодромная кунджа р. Коль концентрируются вблизи устьев нерестовых притоков, заход обеих в притоки происходит одновременно. При заходе в нерестовый приток анадромная и речная реодромная кунджа продолжают вести скрытный образ жизни, используют любые укрытия в ручье – подмытые берега, корни деревьев, завалы, нависающие дерновины. В целом обнаружить зашедших в нерестовые ручьи производителей очень трудно. В р. Коль и её притоках характер миграций и выбираемые кунджей биотопы во многом сходны с таковыми для симы, особенно в притоках. Однако к моменту анадромной миграции кунджи (середина августа) все производители симы уже гибнут после нереста.
В р. Кехта анадромная кунджа перемещается в сторону нерестилищ в течение всего августа. Выраженного хода производителей не установлено, кунджа образует группы по три–шесть разноразмерных особей, которые двигаются по самому стрежню реки на максимальной глубине в придонном слое воды. Места отдыха рыб – под крутыми подмытыми берегами или в глубоких русловых ямах. В р. Кехта анадромная кунджа всегда использует любые укрытия – упавшие в воду отдельные стволы деревьев, подмытый берег, крупные куски берега, сползшие в воду и другие. При достижении участков среднего течения, где расположены её нерестилища, анадромные особи кунджи размещаются в подперекатных ямах на максимальной глубине. В р. Кехта, которая по сравнению с р. Коль отличается меньшими размерами и глубиной, кунджа ведёт ещё более скрытный образ жизни.
Возрастной, размерно-весовой и половой состав кунджи. В р. Коль карликовые самцы кунджи принадлежат к двум возрастным классам 3+ и 4+, в р. Кехта обнаружены карликовые самцы только четырёхлетнего возраста. Речные реодромные рыбы вступают в нерестовое стадо в шестилетнем возрасте (5+), их максимальная продолжительность жизни не превышает восьми лет, большую часть группировки представляют рыбы возрастного класса 6+. Возрастной состав анадромных рыб наиболее сложный, половозрелая часть популяции представлена особями шести (в р. Коль) и семи (в р. Кехта) возрастных классов. Анадромные самцы и самки достигают половой зрелости после двух выходов в море (биографическая группа R.2+, где R – число полных лет в реке, 2+ – последующие два года жизни с выходами в летнее время в море), доживают до возраста 10–11 лет (табл. 5).
Таблица 5.
Возрастной состав группировок кунджи Salvelinus leucomaenis из рек Коль и Кехта (среднемноголетние данные, 2003–2008), %
| Возраст | Река Коль | Река Кехта |
|---|---|---|
| Карликовые самцы | ||
| 3+ | 41.6 | 100 |
| 4+ | 58.4 | |
| Число рыб, экз | 361 | 44 |
| Речные реодромные | ||
| 5+ | 43.5 | |
| 6+ | 48.2 | |
| 7+ | 8.3 | |
| Число рыб, экз. | 120 | |
| Анадромные | ||
| 5+ | 21.5 | 20.4 |
| 6+ | 28.8 | 23.3 |
| 7+ | 23.5 | 25.2 |
| 8+ | 14.3 | 15.7 |
| 9+ | 8.3 | 9.3 |
| 10+ | 3.6 | 3.9 |
| 11+ | 2.2 | |
| Число рыб, экз. | 302 | 209 |
Карликовые самцы в обеих реках имеют наименьшие среди производителей длину и массу тела, при этом в р. Кехта их размеры несколько больше, чем в р. Коль. Длина тела речных реодромных особей из р. Коль варьирует от 257 до 436 (в среднем 336) мм, масса тела – от 250 до 850 (в среднем 443) г. Для анадромных особей в одновозрастных классах характерны наибольшие длина и масса тела (табл. 6).
Таблица 6.
Длина (FL) и масса тела половозрелой кунджи Salvelinus leucomaenis разных группировок из рек Коль и Кехта
| Возраст | Река Коль | Река Кехта | ||||
|---|---|---|---|---|---|---|
| FL, мм | Масса, г | Число рыб, экз | FL, мм | Масса, г | Число рыб, экз | |
| Карликовые самцы | ||||||
| 3+ | 198.5 (188–217) | 103.6 (92–131) | 179 | 207.3 (190–222) | 122.3 (108–185) | 38 |
| 4+ | 232.8 (223–247) | 134.5 (105–155) | 156 | |||
| Речные реодромные | ||||||
| 5+ | 285.4 (257–374) | 260.5 (250–500) | 35 | |||
| 6+ | 327.1 (285–400) | 377.5 (284–704) | 32 | |||
| 7+ | 410.6 (380–436) | 660.7 (455–850) | 10 | |||
| Анадромные | ||||||
| 5+ | 380.5 (298–486) | 505.7 (304–1050) | 65 | 401.8 (355–461) | 661.0 (442–1000) | 42 |
| 6+ | 461.1 (386–590) | 902.8 (480–2000) | 52 | 471.7 (431–528) | 1063.4 (722–1631) | 45 |
| 7+ | 522.8 (430–564) | 1450.2 (933–2200) | 73 | 533.5 (442–623) | 1614.4 (720–2300) | 49 |
По оценкам скоплений производителей на нерестилищах, среди речных реодромных рыб доля самок варьирует от 28 до 36% в разные годы и в разных притоках. Среди анадромных производителей самки несколько преобладают, их доля варьирует от 58 до 63% в разные годы.
Плодовитость самок. В р. Коль у самок анадромной кунджи FL 410–613 мм плодовитость варьирует от 1472 до 3256 (в среднем 2234.2) икринок (n = 75), у речных реодромных самок FL 302–436 мм – от 356 до 1223 (в среднем 802.4) икринок (n = 25) (рис. 3). Плодовитость самок коррелирует с размерами особей: r = 0.82 ± 0.038, p < 0.01 у речных реодромных самок; r = 0.86 ± 0.041, p < 0.01 – у анадромных. Индивидуальная плодовитость речных реодромных самок существенно ниже, чем анадромных. Диаметр икринки у анадромных самок варьирует от 4.61 до 5.32 (в среднем 5.04 ± 0.08) мм, у речных реодромных самок – от 4.42 до 5.24 (в среднем 4.92 ± 0.07) мм, различия недостоверны (tst = 1.13, р > 0.95). Анадромные и речные реодромные самки различаются по цвету икринок – у первых они имеют оранжевый цвет, у вторых – бледно-жёлтый. Плодовитость самок анадромной кунджи р. Кехта FL 465–690 мм варьирует от 1432 до 3887 (в среднем 2763.3) икринок; плодовитость определяется размерами тела (r = 0.81 ± 0.054, p < 0.01). Диаметр икринки анадромных самок из р. Кехта варьирует от 4.74 до 5.96 (в среднем 5.76 ± ± 0.10) мм, икринки имеют более насыщенный оранжевый цвет по сравнению с таковыми у анадромных самок из р. Коль. Это может быть связано с особенностями питания – кунджа из р. Кехта в большей степени потребляет морских ракообразных (мизид) (табл. 3).
Рис. 3.
Плодовитость самок кунджи Salvelinus leucomaenis р. Коль: (⚪) – анадромные, n = 75; (◼) – речные реодромные, n = 25.

Взаимоотношения рыб разных внутрипопуляционных группировок. В летнее время в период нагула анадромные, речные реодромные и карликовые самцы разобщены в речных системах. Однако в период нереста наблюдается формирование единой нерестовой совокупности. Нерест кунджи в притоках р. Коль проходит во второй декаде сентября. На участках, где располагаются нерестилища кунджи, речные реодромные и карликовые самцы размножаются совместно с парой проходных производителей. Обычно с одной анадромной самкой размножается один анадромный самец, один речной реодромный и один (очень редко два) карликовый самец. По нашим наблюдениям (62 случая нереста, 3 притока, 3 года), анадромный самец нерестится только с одной самкой, тогда как речные реодромные и карликовые самцы могут менять партнёра-самку и размножаться с несколькими анадромными самками. Речная реодромная самка размножается с наиболее мелкими анадромными самцами, речными реодромными и карликовыми самцами. Таким образом, все компоненты локальной популяции кунджи составляют единую систему.
ОБСУЖДЕНИЕ
По данным литературы считалось, что к северу от Хоккайдо, на Камчатке и в реках материкового побережья Охотского моря внутривидовое разнообразие кунджи невысокое, а вид, за редким исключением, представлен “проходной формой” (Fausch et al., 1994; Yamamoto et al., 1999, 2000; Hosoya, 2002; Morita et al., 2013).
Результаты нашего исследования показывают, что на севере ареала в реках Камчатки локальные популяции кунджи имеют более сложную структуру, чем считалось ранее (Kawanabe, 1989; Черешнев и др., 2002). Помимо анадромных особей в популяциях присутствуют ещё и карликовые самцы, и речные реодромные рыбы, реализующие свой жизненный цикл в пресных водах. При этом карликовые самцы встречаются в обеих реках – Коль и Кехта, – как горного, так и тундрового типа. Карликовые самцы были обнаружены и в других реках Камчатки (Савваитова и др., 2007; Павлов и др., 2016). Очевидно, что карликовые самцы – универсальный пресноводный компонент структуры популяций кунджи на Камчатке в отличие от мелких “ручьевых” самок, созревающих в пресных водах в ювенильном облике, которые нами не были обнаружены. Единственная “ручьевая” популяция кунджи, представленная половозрелыми самцами и самками, обнаружена только в одном термальном ручье на восточном побережье Камчатки (Есин, Сорокин, 2012).
Анализ встречаемости в речной системе особей пресноводных группировок указывает на высокую степень мозаичности их распределения и приуроченность к специфическим биотопам. Так, карликовые самцы обнаружены только в нерестовых притоках (р. Коль) или в непосредственной близости от нерестовых участков (р. Кехта). Речные реодромные особи обнаружены только в р. Коль, причём они встречаются исключительно на глубоких плёсах, где имеются завалы и заломы. Зоной обитания анадромных рыб является устьевая зона реки и прилегающая часть моря. В результате в летнее время наблюдается пространственное разобщение рыб разных внутрипопуляционных группировок. Интегрирующим фактором становится их совместный нерест: карликовые самцы, реодромные и анадромные самцы и самки формируют единую репродуктивную совокупность, которая обеспечивает перекрёстное скрещивание.
Обращает на себя внимание то, что относительная численность рыб, реализующих свой жизненный цикл в пресных водах, в целом невелика по сравнению с анадромной группировкой, благодаря которой в основном обеспечивается воспроизводство локальной популяции. В то же время важно отметить, что в бассейне р. Коль среди речной реодромной группировки доля половозрелых самок составляет 30% и более. Наши данные говорят о том, что на севере ареала заметную долю в воспроизводство локальной популяции могут вносить самки с резидентным типом жизненной стратегии. Хотя вклад речных реодромных самок кунджи, созревающих в пресных водах, в воспроизводстве популяции существенно меньше, чем анадромных, первых можно рассматривать как важный резерв, обеспечивающий популяции дополнительную устойчивость в мозаичных условиях экосистем лососёвых рек.
Численность реодромной кунджи в р. Коль невысока, и скорее всего она является следствием ограниченности пригодных для её обитания специфических биотопов в речном бассейне. Поскольку это небольшая речная система и подходящие для обитания резидентной кунджи биотопы сосредоточены лишь на ограниченном участке среднего течения, где типичными элементами строения речного русла являются глубокие плёсы с завалами древесных стволов, которые образуют укрытия для рыб, есть все основания полагать, что именно наличие специфического биотопа – “древесный завал на глубоком плёсе” – является лимитирующим фактором для существования в р. Коль речных реодромных рыб. По нашим данным, речная реодромная кунджа по сравнению со всеми другими видами лососёвых рыб в р. Коль (микижа и мальма с резидентным типом жизненной стратегии, карликовые самцы мальмы и симы) характеризуется наиболее ярко выраженной приуроченностью к строго определённым биотопам. Ранее на выраженную тенденцию выбора биотопа “с укрытиями”, в том числе и “с крышей над головой”, для резидентной кунджи в реке неоднократно указывали японские исследователи (Yagyu, 2009; Hasegawa, Yamamoto, 2009; Nakamura, 2011; Miyamoto, Araki, 2019). Для некоторых рек о-вов Хоккайдо и Хонсю выявлена высокая корреляция между строением плёсов и численностью речных особей в реке (Hasegawa, Maekawa, 2008; Kikko et al., 2011).
То, что наличие биотопа “завал на плёсе” является критическим фактором для существования речной реодромной кунджи, подтверждается отсутствием рыб этой экологической группировки в р. Кехта, где таких завалов нет. Причиной тому – слабое развитие древесной растительности на берегах, менее выраженные процессы эрозии берегов за счёт слабого течения и меньшего уклона ложа. Примечательно, что и в некоторых других реках тундрового типа, сопоставимых по размерам и водности с р. Коль, речная реодромная кунджа не обнаружена, например, в р. Утхолок (Павлов и др., 2016) и р. Сопочная (наши наблюдения 1997–2002 гг.). Вероятно, именно отсутствие заломов на глубоких плёсах и является главной причиной отсутствия речной реодромной кунджи в реках тундрового типа. Таким образом, разнообразие на популяционном уровне организации у кунджи определяется геоморфологией рек, в которых обитает локальная популяция. Сходные закономерности были установлены и для микижи в реках Камчатки (Павлов и др., 2008; Кузищин, 2010).
В связи с этим есть все основания полагать, что в реках предгорного типа, где хорошо выражены русловые процессы эрозии берегов и имеются завалы древесного материала в русле, высока вероятность существования в составе локальных популяций кунджи речной реодромной группировки. Соответственно, на севере ареала “русловой” вариант жизненной стратегии у кунджи встречается более широко, чем это считалось ранее.
Полученные данные позволяют расширить представления о внутривидовой структуре кунджи в пределах ареала. Ранее считалось, что разнообразные внутрипопуляционные группировки (анадромные, речные реодромные, карликовые обоеполые ручьевые, карликовые самцы) у кунджи встречаются только в водоёмах бассейна Японского моря, который рассматривается зоной экологического оптимума. В частности, подчёркивалось, что наибольшее разнообразие кунджи в южных участках ареала обусловлено её теплолюбивостью (Kawanabe, 1989; Yamamoto et al., 1996; Morita et al., 2000; Morita, Morita, 2002; Morita, Yamamoto, 2002; Morita, Yokota, 2002; Рыбы …, 2012; Morita et al., 2019). Существование единственной (пока) ручьевой обоеполой популяции кунджи на Камчатке из термального ручья также обусловлено стабильными высокими температурами в течение года (Есин, Сорокин, 2012). Однако наши данные говорят о том, что на севере ареала, на Камчатке, несмотря на более суровый климат, чем в бассейне Японского моря, разнообразие кунджи сопоставимо с таковым на юге ареала. При этом необходимо отметить, что на севере ареала соотношение анадромных и резидентных рыб в составе популяций смещено в сторону анадромных. На юге ареала в популяциях кунджи соотношение анадромных и резидентных особей либо равное, либо резидентные преобладают. По-видимому, разное соотношение анадромных и резидентных рыб на ареале кунджи можно рассматривать как проявление клинальной изменчивости, выраженной в увеличении доли резидентных особей в зоне экологического оптимума вида.
Таким образом, и на севере ареала у вида кунджа наблюдаются те же локальные адаптации, что и на юге, в бассейне Японского моря – существуют анадромные и резидентные компоненты, благодаря которым происходит освоение потенциала речной системы и поддержание полиморфизма на популяционном уровне организации.
Список литературы
Волобуев В.В. 1987. О биологии кунджи Salvelinus leucomaenis (Pall.) материкового побережья Охотского моря // Биология пресноводных рыб Дальнего Востока. Владивосток: Изд-во ДВО АН СССР. С. 89–100.
Волобуев В.В., Никулин О.А. 1975. О биологии кунджи Salvelinus leucomaenis (Pall.) Мотыклейского залива // Гидробиологические исследования внутренних водоёмов Северо-Востока СССР. Владивосток: Изд-во ДВНЦ АН СССР. С. 354–375.
Волобуев В.В., Максимов В.А., Рогатных А.Ю. 1985. Жилая кунджа Salvelinus leucomaenis (Pall.) // Вопр. ихтиологии. Т. 25. № 4. С. 546–552.
Гриценко О.Ф. 2002. Проходные рыбы острова Сахалин. М.: Изд-во ВНИРО, 248 с.
Груздева М.А., Малютина А.М., Кузищин К.В. и др. 2013. Закономерности формирования жизненной стратегии у симы Oncorhynchus masou реки Коль (западная Камчатка) в связи с процессами роста и полового созревания // Вопр. ихтиологии. Т. 53. № 5. С. 587–602. https://doi.org/10.7868/S0042875213050056
Груздева М.А., Кузищин К.В., Павлов Е.Д. и др. 2017. Морфофизиологические закономерности формирования жизненных стратегий мальмы Salvelinus malma Камчатки // Там же. Т. 57. № 5. С. 534–552. https://doi.org/10.7868/S0042875217050101
Гудков П.К. 1991. Материалы по биологии кунджи Salvelinus leucomaenis Охотского моря // Там же. Т. 31. № 6. С. 898–909.
Гудков П.К., Скопец М.Б., Черешнев И.А. 1991. К биологии гольцов рода Salvelinus (Salmonidae) бассейна Охотского моря. Характеристика биологических параметров симпатрических проходных гольцов из рек залива Шелихова // Биология гольцов Дальнего Востока. Владивосток: Изд-во ДВО АН СССР. С. 21–36.
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus Азиатской части Северной Пацифики: происхождение, эволюция и современное разнообразие. Петропавловск-Камчатский: Камчатпресс, 188 с.
Есин Е.В., Сорокин Ю.В. 2012. Жилая кунджа Salvelinus leucomaenis из термального ручья, впадающего в Семлячикский лиман (Кроноцкий заповедник, Камчатка) // Вопр. ихтиологии. Т. 52. № 2. С. 207–214.
Кузищин К.В. 2010. Формирование и адаптивное значение внутривидового экологического разнообразия у лососёвых рыб (семейство Salmonidae): Автореф. дис. … докт. биол. наук. М.: МГУ, 49 с.
Кузищин К.В., Мальцев А.Ю., Груздева М.А. и др. 2008. Размножение микижи Parasalmo mykiss (Walb.) Камчатки и факторы среды, определяющие его особенности // Вопр. ихтиологии. Т. 48. № 1. С. 45–56.
Лакин Г.Ф. 1990. Биометрия. М.: Высш. шк., 347 с.
Микодина Е.В., Седова М.А., Пьянова С.В. и др. 2011. Руководство по применению анестетика “гвоздичное масло” в аквакультуре. М.: Изд-во ВНИРО, 64 с.
Мурза И.Г., Христофоров О.Л. 1991. Определение степени зрелости гонад и прогнозирование возраста достижения половой зрелости у атлантического лосося и кумжи. Л.: Изд-во ГосНИОРХ, 102 с.
Павлов Д.С., Скоробогатов А.М. 2014. Миграции рыб в зарегулированных реках. М.: Т-во науч. изд. КМК, 413 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2001. Тихоокеанские благородные лососи и форели Азии. М.: Научный мир, 200 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2008. Разнообразие жизненных стратегий и структура популяций камчатской микижи Parasalmo mykiss (Walb.) в экосистемах малых лососевых рек разного типа // Вопр. ихтиологии. Т. 48. № 1. С. 42–49.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2009. Состояние и мониторинг биоразнообразия лососёвых рыб и среды их обитания на Камчатке (на примере территории заказника “Река Коль”). М.: Т-во науч. изд. КМК, 152 с.
Павлов Д.С., Кузищин К.В., Груздева М.А. и др. 2013. Разнообразие жизненной стратегии мальмы Salvelinus malma (Walbaum) (Salmonidae, Salmoniformes) Камчатки: онтогенетические реконструкции по данным рентгенофлуоресцентного анализа микроэлементного состава регистрирующих структур // Докл. РАН. Т. 450. № 2. С. 240–244. https://doi.org/10.7868/S0869565213150267
Павлов Д.С., Кириллова Е.А., Кириллов П.И. и др. 2016. Состояние биоразнообразия лососёвых рыб и рыбообразных и среды их обитания в бассейне реки Утхолок. М.: Т-во науч. изд. КМК, 197 с.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищепромиздат, 322 с.
Ресурсы поверхностных вод СССР. 1973. Т. 20. Камчатка. Л.: Гидромеоиздат, 365 с.
Руководство по изучению питания рыб в естественных условиях. 1961. М.: Изд-во АН СССР, 263 с.
Рыбы Курильских островов. 2012. М.: Изд-во ВНИРО, 384 с.
Савваитова К.А., Кузищин К.В., Пичугин М.Ю. и др. 2007. Систематика и биология кунджи Salvelinus leucomaenis // Вопр. ихтиологии. Т. 47. № 1. С. 58–71.
Тиллер И.В. 2007. Проходная мальма (Salvelinus malma) Камчатки // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 9. С. 79–95.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. 2002. Лососевидные рыбы северо-востока России. Владивосток: Дальнаука, 496 с.
Шорыгин А.А. 1952. Питание и пищевые взаимоотношения рыб Каспийского моря. М.: Пищепромиздат, 268 с.
Bird D.J., Cowx I.G. 1993. The selection of suitable pulsed currents for electric fishing in fresh waters // Fish. Res. V. 18. № 3–4. P. 363–376. https://doi.org/10.1016/0165-7836(93)90163-2
Dunham J., Baxter C., Fausch K. et al. 2008. Evolution, ecology, and conservation of dolly varden, white-spotted char, and bull trout // Fisheries. V. 33. № 11. P. 537–550. https://doi.org/10.1577/1548-8446-33.11.537
Fausch K.D., Nakano S., Ishigaki K. 1994. Distribution of two congeneric charrs in streams of Hokkaido Island, Japan: considering multiple factors across scales // Oecologia. V. 100. № 1–2. P. 1–12. https://doi.org/10.1007/BF00317124
Hasegawa K., Maekawa K. 2008. Potential of habitat complexity for mitigating interference competition between native and non-native salmonid species // Can. J. Zool. V. 86. № 5. P. 386–393. https://doi.org/10.1139/Z08-015
Hasegawa K., Yamamoto S. 2009. Effects of competitor density and physical habitat structure on the competitive intensity of territorial white spotted charr Salvelinus leucomaenis // J. Fish Biol. V. 74. № 1. P. 213–219. https://doi.org/10.1111/j.1095-8649.2008.02133.x
Hosoya K. 2002. Salmonidae // Fishes of Japan with pictorial keys to the species. Tokyo: Tokai Univ. Press, P. 299–304.
Kawanabe H. 1989. Japanese char(r)s and masu salmon problems: a review // Physiol. Ecol. Japan. Spec. V. 1. P. 13–24.
Kikko T., Kai Y., Nakayama K. 2009. Relationships among tributary length, census population size and genetic variability of white-spotted charr (Salvelinus leucomaenis) in the Lake Biwa water system // Ichthyol. Res. V. 56. № 1. P. 100–104. https://doi.org/10.1007/s10228-008-0063-0
Kikko T., Kataoka Y., Nishimori K. et al. 2011. Size at maturity of fluvial white-spotted charr, Salvelinus leucomaenis, around the Lake Biwa water system varies with habitat size // Ibid. V. 58. № 4. P. 370–376. https://doi.org/10.1007/s10228-011-0229-z
Kouřil J., Mikodina E., Mikulin A. et al. 2009. Different sensitivity between adult salmonids fish species and grayling to an anaesthetic clove oil // Abstr. Internat. Conf. “Aquaculture Europe 2009”. Trondheim, Norway. P. 89.
Morita K., Morita S.H.M. 2002. Rule of age and size at maturity: individual variation in the maturation history of resident white-spotted charr // J. Fish Biol. V. 61. № 5. P. 1230–1238. https://doi.org/10.1006/jfbi.2002.2138
Morita K., Yamamoto S. 2002. Effects of habitat fragmentation by damming on the persistence of stream-dwelling charr populations // Conserv. Biol. V. 16. № 5. P. 1318–1323. https://doi.org/10.1046/j.1523-1739.2002.01476.x
Morita K., Yokota A. 2002. Population viability of stream-resident salmonids after habitat fragmentation: a case study with white-spotted charr (Salvelinus leucomaenis) by an individual-based model // Ecol. Modell. V. 155. № 1. P. 85–94. https://doi.org/10.1016/S0304-3800(02)00128-X
Morita K., Yamamoto S., Hoshino N. 2000. Extreme life history change of white-spotted char (Salvelinus leucomaenis) after damming // Can. J. Fish. Aquat. Sci. V. 57. № 6. P. 1300–1306. https://doi.org/10.1139/f00-050
Morita K., Morita S.H., Nagasawa T., Kuroki M. 2013. Migratory patterns of anadromous white-spotted charr Salvelinus leucomaenis in Eastern Hokkaido, Japan: the solution to a mystery? // J. Ichthyol. V. 53. № 10. P. 809–819. https://doi.org/10.1134/S0032945213100068
Morita K., Sahashi G., Miya M. et al. 2019. Ongoing localized extinctions of stream-dwelling whitespotted charr populations in small dammed-off habitats of Hokkaido Island, Japan // Hydrobiologia. V. 840. № 1. P. 207–213. https://doi.org/10.1007/s10750-019-3891-1
Miyamoto K., Araki H. 2019. Effects of water depth and structural complexity on survival and settlement of white-spotted charr (Salvelinus leucomaenis) // Ibid. V. 840. № 1. P. 103–112. https://doi.org/10.1007/s10750-019-3887-x
Nakajima M., Fujio Y. 1995. Genetic differentiation among local populations of Japanese char Salvelinus leucomaenis // Fish. Sci. V. 61. № 1. P. 11–15. https://doi.org/10.2331/fishsci.61.11
Nakamura T. 2003. Meristic and morphometric variations in fluvial Japanese charr between river systems and among tributaries of a river system // Environ. Biol. Fish. V. 66. № 2. P. 133–141. https://doi.org/10.1023/A:1023674523652
Nakamura T. 2011. Relationships between physical characteristics of pools and the residency of stream-dwelling white-spotted charr // Aquac. Sci. V. 59. № 3. P. 427–433. https://doi.org/10.11233/aquaculturesci.59.427
Yagyu M. 2009. Foraging microhabitat of Japanese charr, Salvelinus leucomaenis, in a mountain stream // Jpn. J. Ichthyol. V. 56. № 2. P. 111–118. https://doi.org/10.11369/jji.56.111
Yamaguchi K., Nakajima M., Taniguchi N. 2010. Loss of genetic variation and increased population differentiation in geographically peripheral populations of Japanese char Salvelinus leucomaenis // Aquaculture. V. 308. Suppl. 1. P. S20–S27. https://doi.org/10.1016/j.aquaculture.2010.07.032
Yamaguchi K., Nakajima M., Taniguchi N. 2016. Population structure and conservation genetics of anadromous white-spotted char (Salvelinus leucomaenis) on Hokkaido Island: detection of isolation-by-distance. // Environ. Biol. Fish. V. 99. № 6–7. 513–525. https://doi.org/10.1007/s10641-016-0494-9
Yamamoto S., Morita K. 2002. Interpopulation comparison of size and age at smolting of white-spotted charr, Salvelinus leucomaenis // Ecol. Freshw. Fish. V. 11. № 4. P. 281–284. https://doi.org/10.1034/j.1600-0633.2002.00021.x
Yamamoto S., Takahashi I., Kitano S., Goto A. 1996. Residual female parr in an anadromous population of white-spotted char Salvelinus leucomaenis in southern Hokkaido, Japan // Jpn. J. Ichthyol. V. 43. № 4. P. 101–104. https://doi.org/10.11369/jji1950.43.101
Yamamoto S., Morita K., Goto A. 1999. Geographic variations in life-history characteristics of white-spotted charr (Salvelinus leucomaenis) // Can. J. Zool. V. 77. № 6. P. 871–878. https://doi.org/10.1139/z99-055
Yamamoto S., Kuhara M., Sawamoto Y., Tsukisaka M. 2000. Variation of spots in Japanese char Salvelinus leucomaenis in the rivers of Nagano prefecture, Japan // Bull. Nagano Pref. Fish. Exp. Stn. № 4. P. 16–23.
Yamamoto S., Morita K., Koizumi I., Maekawa K. 2004. Genetic differentiation of white-spotted charr (Salvelinus leucomaenis) populations after habitat fragmentation: spatial-temporal changes in gene frequencies // Conserv. Genet. V. 5. № 4. P. 529–538. https://doi.org/10.1023/B:COGE.0000041029.38961.a0
Zippin C. 1956. An evaluation of the removal method of estimation animal populations // Biometrics. V. 12. № 2. P. 163–189. https://doi.org/10.2307/3001759
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


