Вопросы ихтиологии, 2022, T. 62, № 5, стр. 529-540
Ихтиофауна реки Падма в районе размещения АЭС “Руппур” (Народная Республика Бангладеш)
Ю. В. Сорокин 1, А. В. Панов 2, *
1 Всероссийский научно-исследовательский институт рыбного
хозяйства и океанографии – ВНИРО
Москва, Россия
2 Всероссийский научно-исследовательский институт радиологии
и агроэкологии – ВНИИРАЭ
Обнинск, Калужская область, Россия
* E-mail: riar@mail.ru
Поступила в редакцию 27.12.2021
После доработки 15.02.2022
Принята к публикации 16.02.2022
- EDN: JXAFWB
- DOI: 10.31857/S0042875222050253
Аннотация
На основе результатов исследований в рамках созданной в 2014–2017 гг. сети экологического мониторинга водных экосистем в районе размещения АЭС “Руппур” дана характеристика биоразнообразия ихтиофауны р. Падма (Ганг) в Бангладеш. В Падме идентифицировано 65 видов рыб из 12 отрядов и 22 семейств. Наиболее представительным отрядом ихтиофауны являются сомообразные (Siluriformes), включающие 22 вида из шести семейств. Вторым по численности является отряд карпообразных (Cypriniformes), насчитывающий 16 видов из семейства карповые (Cyprinidae). Состав ихтиофауны р. Падма изучали в разные периоды года, учитывая климатические особенности исследуемого региона. В сезон муссонов при паводке и разливе реки таксономический состав рыб достигает 51 вида, в межень снижается до 29. Наиболее бедный состав отмечен в засушливые периоды года (23–26 видов). Средняя масса изученных видов рыб варьирует от 0.7 ± 0.5 до 1053 ± 689 г, длина – от 4.0 ± 0.9 до 45.5 ± 14.1 см. На исследованном участке реки выявлены 17 редких и малочисленных видов рыб – объектов Красной книги Бангладеш. Отмечена важность контроля биоразнообразия ихтиофауны р. Падма как неотъемлемой части системы экологического мониторинга района размещения АЭС “Руппур”.
Народная Республика Бангладеш богата рыбными ресурсами. Она является третьим государством в мире по масштабам промышленного рыболовства во внутренних водоёмах. В них ежегодно вылавливается ~65% общего объёма добычи рыбной продукции страны (FAO, 2020). Рыба – значимый пищевой продукт населения Республики. Её потребление составляет >12 кг на душу населения в год и варьирует в пределах 7.5–17.2 кг для разных регионов страны. На долю рыбы приходится >50% животного белка в рационе питания жителей Бангладеш (FAO, 2014).
В реках Бангладеш зарегистрировано >260 пресноводных видов рыб из 154 родов, принадлежащих 55 семействам (Lowe-McConnell, 1987; Rahman, 2005; Status …, 2012). Промысел рыбных ресурсов осуществляется в основном рыболовами, ведущими натуральное хозяйство. На них приходится до 75% совокупного улова (de Graaf et al., 2001). Рыбная ловля для многих людей является единственным способом пропитания. Важность рыбных ресурсов особенно возрастает в сезон паводков, когда доходы населения из других источников существенно снижаются.
В связи с бурным ростом населения Бангладеш в последние годы значительно выросли объёмы вылова рыбы. Правительство страны проводит работу по сохранению рыбных ресурсов. Так, вводится десятидневный запрет на лов гильзы Tenualosa ilisha (Hamilton, 1822) в период её размножения в районе основных нерестилищ, охватывающих 7000 км2. Также происходит полное закрытие всех промыслов в водоёмах четырёх областей страны в марте–апреле. Тем не менее полного контроля над ловом рыбы установить не удаётся, поэтому потеря биоразнообразия экосистем внутренних водоёмов является важнейшей проблемой (Welcomme, 2008). Под угрозой исчезновения находятся 54 вида рыб (Red List …, 2015; Red book …, 2000). Снижение рыболовной нагрузки на водные экосистемы за счёт аквакультуры способствует сохранению численности редких и исчезающих видов ихтиофауны. Основными объектами искусственного разведения в Бангладеш являются катля Gibelion catla (Hamilton, 1822), роху Labeo rohita (Hamilton, 1822), циррина Cirrhinus mrigala (Hamilton, 1822) и толстолобик Hypophthalmichthys molitrix (Valenciennes, 1844). На них приходится 78% общего объёма производства прудовой аквакультуры в стране11.
Река Падма является главным водотоком р. Ганг, протекающей по территории Бангладеш. В стране это одна из самых длинных и крупных рек, которая впадает в Бенгальский залив Индийского океана. Водный режим в бассейне р. Падма существенно зависит от сезона дождей (муссонный период). Так, в створе Фаракка среднемноголетний годовой расход воды (1949–1973) составляет 12.1 тыс. м3/с. С июня по октябрь он увеличивается до 24.5 тыс. м3/с, а с января по май снижается до 2.2 тыс. м3/с. Из общего годового стока вод Падмы 80% относится к периоду муссонов (Rahman, Huda, 2012). В низовьях р. Падма видовое разнообразие ихтиофауны повышается в период муссонов (de Graaf, 2003; Craig et al., 2004). Напротив, на участке среднего течения Падмы (Ганг) в штате Бихар (Индия) отмечено увеличение числа видов в пик сухого сезона, что связано с преднерестовой миграцией рыб перед началом подъёма уровня воды (Choudhary et al., 2006). Например, T. ilisha, один из наиболее эксплуатируемых видов рыб, нерестится во время снижения уровня воды. Таким образом, рыбы с различной жизненной стратегией по-разному реагируют на подъём уровня воды в реке. Вследствие этого видовой состав ихтиофауны р. Падма существенно варьирует в зависимости от сезона года и гидрологического режима реки.
В 2011 г. подписано соглашение между Российской Федерацией и Народной Республикой Бангладеш о строительстве первой в стране атомной электростанции “Руппур” с двумя энергоблоками. Площадка АЭС (24°04′ с.ш. 89°03′ в.д.) расположена на берегу р. Падма рядом с населённым пунктом Руппур подокруга Ишварди. Анализ фондовых данных показал, что в районе АЭС “Руппур” ихтиофауна р. Падма может быть представлена 135 видами рыб, принадлежащими к двум классам, 16 отрядам, 33 семействам (Islam, Hossain, 1983; Bhuiyan et al., 1992; Hossain, Haque, 2005; Bhuiyan et al., 2008; Montaña et al., 2011; Mohsin et al., 2013). Доминируют отряды карпообразных (Cypriniformes) – 46 видов и сомообразных (Siluriformes) – 31 вид. В Красную книгу Бангладеш (Red List …, 2015; Red book …, 2000) включено 25 видов рыб, из которых пять находятся в критической опасности (категория CR), 11 – в опасности (EN) и девять – в уязвимом положении (VU).
Атомная станция будет использовать воды р. Падма для системы охлаждения реакторов и технических нужд. Рыбы относятся к высшему трофическому уровню в водных экосистемах, характеризуются относительно низкой радиоустойчивостью и служат пищей человеку. В районах размещения АЭС рыбы аккумулируют радионуклиды, поступающие по пищевой цепочке и непосредственно из воды (Трапезников, Трапезникова, 2006). Поэтому, изучение ихтиофауны в зонах влияния радиационно-опасных объектов представляет интерес с точки зрения выяснения радиоэкологических рисков как для самой рыбы за счёт её внутреннего и внешнего облучения, так и для населения, использующего рыбу в качестве продукта питания (Гудков и др., 2008; Impacts …, 2015). Поскольку АЭС “Руппур” потенциально может оказать негативное техногенное воздействие на экосистему р. Падма (сброс техногенных радионуклидов, тяжёлых металлов и других поллютантов), в 2014–2017 гг. создана система экологического мониторинга реки в районе размещения атомной станции (Микаилова и др., 2020).
Цель работы – оценить современное биоразнообразие ихтиофауны р. Падма в районе размещения АЭС “Руппур” на основе анализа результатов 4-летних (2014–2017) экспедиционных исследований.
МАТЕРИАЛ И МЕТОДИКА
Сбор материала в р. Падма проводили на расстоянии до 30 км от места расположения АЭС “Руппур” вверх и вниз по течению на базе созданной сети экологического мониторинга (Микаилова и др., 2020). В соответствии с программой22 мониторинга оба участка реки были условно разбиты на три зоны: 1–5, 5–15 и 15–30 км от площадки атомной станции. Ихтиофауну изучали по результатам качественно-количественных обловов выделенных зон. Вылов проводили на 20 станциях. Расположение и число облавливаемых участков реки (рисунок) устанавливали в зависимости от размера основного водотока, количества притоков Падмы и других факторов.
Карта-схема сети экологического мониторинга р. Падма в районе АЭС “Руппур” (по: Микаилова и др., 2020): (—) – 30-км радиус от места размещения АЭС; Т-1–Т-20 – контрольные точки отлова рыб.
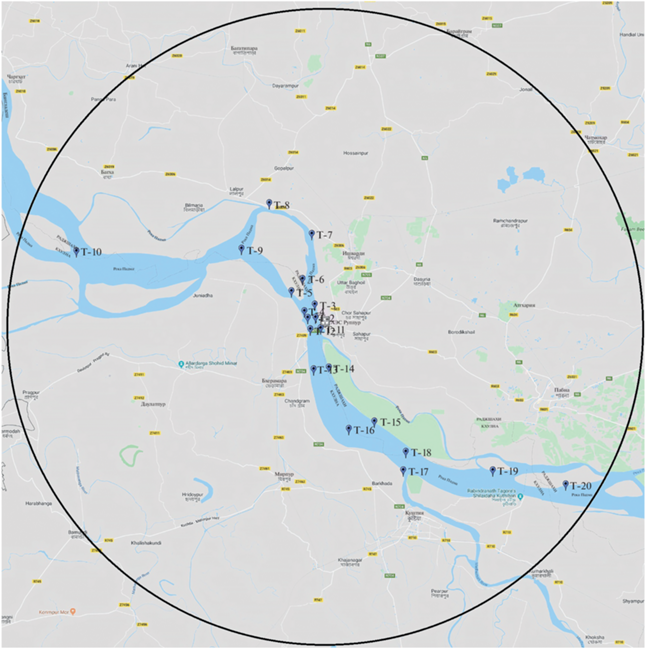
В период муссонов наблюдается максимальный разлив р. Падма и подъём уровня воды в реке более чем на 8 м от меженного. Учитывая значительные сезонные различия по климатическим характеристикам (муссонный сезон дождей в мае–сентябре и засушливый период в декабре–марте), проведение мониторинговых работ было организовано в различные периоды года: август (2014 г.), апрель (2015 г.), декабрь (2016 г.) и июнь (2017 г.).
Отлов рыб проводили неводами (длина 30 м, высота 3 м; ячея крыла – 7 мм, дель узловая; ячея кута – 5 мм, безузловая дель), ставными сетями (длина 50 м, высота 3 м, ячея 30, 40 и 50 мм; длина 30 м, высота 3 м, ячея 20, 30 и 40 мм), накидными (кастинговыми) сетями (диаметр до 5 м, ячея 20 мм), сачками-ловушками (длина 2 м, ширина 1.5 м, ячея 5, 10 и 15 мм), вершей, подъёмниками. Для получения более полной картины состава ихтиофауны в исследуемом районе, кроме собственных, анализировали уловы местных рыбаков. Из-за сложности гидрологического режима реки и разнообразия орудий лова основной задачей работы являлось исследование качественного состава ихтиофауны. Всех обнаруженных рыб разных видов фотографировали, взвешивали, некоторые экземпляры фиксировали в 10%-ном формалине для последующего определения видовой принадлежности в лаборатории. Измеряли общую длину рыбы (TL). Массу целой рыбы взвешивали ли на весах N3B110 (“Ohaus”, Швейцария). Всего проанализировано 3.9 тыс. экз. Всех рыб идентифицировали до вида, используя определители (Red List …, 2015; Nelson et al., 2016; Red book …, 2000) и Базу данных Бангладеш (https://www.bdfish.org. Version 07/2021). Статистическая обработка данных включала оценку среднего, стандартного отклонения, минимальных и максимальных значений с использованием Microsoft Excel.
РЕЗУЛЬТАТЫ
За четырёхлетний цикл мониторинговых исследований (2014–2017) на р. Падма в районе размещения АЭС “Руппур” идентифицировали 65 видов рыб из 12 отрядов и 22 семейств (табл. 1). Наиболее богат видами был отряд Siluriformes, включавший 22 вида из шести семейств (Bagridae, Heteropneustidae, Pangasiidae, Schilbeidae, Siluridae и Sisoridae). На втором месте по видовому богатству находился отряд Cypriniformes, насчитывавший 16 видов из одного семейства карповых (Cyprinidae). Девять видов (14% общего числа) – Gonialosa manmina (Hamilton, 1822), T. ilisha, Amblypharyngodon microlepis (Bleeker, 1853), Cirrhinus reba (Hamilton, 1822), Mystus cavasius (Hamilton, 1822), Wallago attu (Bloch et Schneider, 1801), Glossogobius giuris (Hamilton, 1822), Mastacembelus armatus (Lacepède, 1800), Channa striata (Bloch, 1793) – встречались в р. Падма во все годы наблюдений. Восемь видов (12%) отмечены в течение трёх лет; 21 вид (32%) выявлен дважды и 27 видов (42%) – один раз. Максимальное видовое разнообразие ихтиофауны (78% видов) отмечено в августе 2014 г. в период муссонов, минимальное (35%) – в июне 2017 г., в межень. В апреле обнаружено 45% общего числа видов, в декабре – немного меньше (42%).
Таблица 1.
Таксономический состав ихтиофауны р. Падма в районе АЭС “Руппур”
| Таксон | Период исследования | |||
|---|---|---|---|---|
| август 2014 г. | апрель 2015 г. | декабрь 2016 г. | июнь 2017 г. | |
| I. Отряд Osteoglossiformes (Араванообразные) | ||||
| 1. Семейство Notopteridae (Спинопёрые) | ||||
| 1. Chitala chitala (Hamilton, 1822)** | + | – | + | + |
| 2. Notopterus notopterus (Pallas, 1769)* | + | – | + | – |
| II. Отряд Clupeiformes (Сельдеобразные) | ||||
| 2. Семейство Clupeidae (Сельдевые) | ||||
| 3. Corica soborna Hamilton, 1822 | + | + | – | + |
| 4. Gudusia chapra (Hamilton, 1822) | + | – | – | – |
| 5. Gonialosa manmina (Hamilton, 1822) | + | + | + | + |
| 6. Tenualosa ilisha (Hamilton, 1822) | + | + | + | + |
| 3. Семейство Engraulidae (Анчоусовые) | ||||
| 7. Setipinna phasa (Hamilton, 1822) | + | + | – | – |
| III. Отряд Cypriniformes (Карпообразные) | ||||
| 4. Семейство Cyprinidae (Карповые) | ||||
| 8. Amblypharyngodon microlepis (Bleeker, 1853) | + | + | + | + |
| 9. Aspidoparia jaya (Hamilton, 1822) | – | + | – | + |
| 10. Chela cachius (Hamilton, 1822) | + | – | – | – |
| 11. Cirrhinus mrigala (Hamilton, 1822) | + | – | – | + |
| 12. Cirrhinus reba (Hamilton, 1822)* | + | + | + | + |
| 13. Ctenopharyngodon idella (Valenciennes, 1844) | + | – | – | – |
| 14. Gibelion catla (Hamilton, 1822) | + | – | – | – |
| 15. Gymnostomus ariza (Hamilton, 1807) | – | – | + | – |
| 16. Hypophthalmichthys molitrix (Valenciennes, 1844) | + | – | – | – |
| 17. Labeo bata (Hamilton, 1822)** | + | + | – | – |
| 18. Laubuka laubuca (Hamilton, 1822) | – | – | – | + |
| 19. Salmostoma phulo (Hamilton, 1822) | – | – | – | + |
| 20. Pethia conchonius (Hamilton, 1822) | + | + | – | – |
| 21. Puntius chola (Hamilton, 1822) | + | + | – | – |
| 22. Puntius sophore (Hamilton, 1822) | – | – | + | + |
| 23. Puntius stigma (Valenciennes, 1844) | + | + | – | – |
| IV. Отряд Siluriformes (Сомообразные) | ||||
| 5. Семейство Bagridae (Косатковые, или Багровые) | ||||
| 24. Batasio batasio (Hamilton, 1822) | + | – | – | – |
| 25. Batasio tengana (Hamilton, 1822) | + | – | – | – |
| 26. Clarias batrachus (Linnaeus, 1758) | – | – | – | + |
| 27. Hemibagrus menoda (Hamilton, 1822) | + | – | – | – |
| 28. Mystus bleekeri (Day, 1877) | + | – | – | – |
| 29. Mystus cavasius (Hamilton, 1822) | + | + | + | + |
| 30. Mystus tengara (Hamilton, 1822) | + | + | – | + |
| 31. Mystus vittatus (Bloch, 1794) | + | + | – | – |
| 32. Rita rita (Hamilton, 1822)*** | + | + | + | – |
| 33. Sperata aor (Hamilton, 1822)* | + | – | – | – |
| 34. Sperata seenghala (Sykes, 1839)** | + | – | – | – |
| 6. Семейство Heteropneustidae (мешкожаберные сомы) | ||||
| 35. Heteropneustes fossilis (Bloch, 1794) | + | – | + | – |
| 7. Семейство Pangasiidae (Пангасиевые) | ||||
| 36. Pangasius pangasius (Hamilton, 1822) | + | – | + | + |
| 8. Семейство Schilbeidae (Шильбовые) | ||||
| 37. Ailia coila (Hamilton, 1822) | + | – | + | – |
| 38. Ailiichthys punctata Day, 1872 | + | – | – | – |
| 39. Eutropiichthys vacha (Hamilton, 1822)*** | + | + | + | – |
| 40. Clupisoma garua (Hamilton, 1822)*** | + | + | – | – |
| 41. Pachypterus atherinoides (Bloch, 1794) | – | + | + | – |
| 9. Семейство Siluridae (Сомовые) | ||||
| 42. Ompok bimaculatus (Bloch, 1794)** | + | – | – | – |
| 43. Ompok pabda (Hamilton, 1822)** | + | + | + | – |
| 44. Wallago attu (Bloch et Schneider, 1801) | + | + | + | + |
| 10. Семейство Sisoridae (Горные сомы, или Багариевые) | ||||
| 45. Bagarius bagarius (Hamilton, 1822)*** | + | + | + | – |
| V. Отряд Gobiiformes (Бычкообразные) | ||||
| 11. Семейство Gobiidae (Бычковые) | ||||
| 46. Apocryptes bato (Hamilton, 1822) | – | + | – | – |
| 47. Glossogobius giuris (Hamilton, 1822) | + | + | + | + |
| 48. Lepidocephalichthys guntea (Hamilton, 1822) | – | – | – | + |
| VI. Отряд Mugiliformes (Кефалеобразные) | ||||
| 12. Семейство Mugilidae (Кефалевые) | ||||
| 49. Rhinomugil corsula (Hamilton, 1822) | + | + | – | – |
| VII. Отряд Beloniformes (Сарганообразные) | ||||
| 13. Семейство Belonidae (Саргановые) | ||||
| 50. Xenentodon cancila (Hamilton, 1822) | + | + | – | + |
| VIII. Отряд Synbranchiformes (Слитножаберникообразные) | ||||
| 14. Семейство Synbranchidae (Слитножаберниковые) | ||||
| 51. Monopterus cuchia (Hamilton, 1822) | – | + | – | – |
| 15. Семейство Mastacembelidae (Хоботнорыловые) | ||||
| 52. Macrognathus aculeatus (Bloch, 1786)* | + | + | – | – |
| 53. Macrognathus pancalus Hamilton, 1822 | + | – | – | – |
| 54. Mastacembelus armatus (Lacepède, 1800)** | + | + | + | + |
| IX. Отряд Anabantiformes (Анабасообразные) | ||||
| 16. Семейство Nandidae (Нандовые) | ||||
| 55. Nandus nandus (Hamilton, 1822)* | – | – | + | – |
| 17. Семейство Channidae (Змееголовые) | ||||
| 56. Channa marulius (Hamilton, 1822) | – | – | + | – |
| 57. Channa orientalis Bloch et Schneider, 1801* | – | – | – | + |
| 58. Channa punctata (Bloch, 1793) | + | – | + | – |
| 59. Channa striata (Bloch, 1793) | + | + | + | + |
| 18. Семейство Anabantidae (Ползуновые) | ||||
| 60. Anabas testudineus (Bloch, 1792) | + | – | + | – |
| 19. Семейство Osphronemidae (Макроподовые) | ||||
| 61. Trichogaster fasciata Bloch et Schneider, 1801 | + | – | – | – |
| X. Отряд Pleuronectiformes (Камбалообразные) | ||||
| 20. Семейство Paralichthyidae (Паралихтиевые) | ||||
| 62. Pseudorhombus arsius (Hamilton, 1822) | + | – | – | – |
| XI. Отряд Perciformes (Окунеобразные) | ||||
| 21. Семейство Ambassidae (Стеклянные окуни) | ||||
| 63. Chanda nama Hamilton, 1822* | – | – | + | + |
| XII. Отряд Acanthuriformes (Хирургообразные) | ||||
| 22. Семейство Sciaenidae (Горбылёвые) | ||||
| 64. Otolithoides pama (Hamilton, 1822) | + | – | – | – |
| 65. Panna microdon (Bleeker, 1849) | + | – | – | – |
| Всего видов | 51 | 29 | 26 | 23 |
В августе 2014 г. уловы были представлены 51 видом рыб из 19 семейств и 11 отрядов. По видовому составу доминировал отряд Siluriformes – 20 видов из шести семейств, причём 10 видов принадлежали семейству косатковые Bagridae. Меньшим числом видов ихтиофауны был представлен отряд Cypriniformes – 11 видов. В апреле 2015 г. видовой состав уловов был на 43% беднее по сравнению с августом 2014 г. В уловах были отмечены виды из 13 семейств и восьми отрядов. В 2016 г. (декабрь) ихтиофауна была представлена 26 видами, принадлежащими 15 семействам из восьми отрядов. В июне 2017 г. было идентифицировано 23 вида рыб из 11 семейств и девяти отрядов. По сравнению с зимним периодом видовое разнообразие и обилие уловов в июне 2017 г. в период завершения сезона засухи не существенно отличалось от декабря 2016 г. (начала сезона засухи). Так, количество пойманных видов сократилось на три, а число семейств – на четыре.
Анализ территориального распределения ихтиофауны в Падме показал, что 31 вид (48%) отмечен в разные периоды во всех шести выделенных зонах вверх и вниз по течению от АЭС “Руппур” (табл. 2). Шесть видов рыб (9%) отмечены в пяти зонах, восемь (12%) – в четырёх. Шесть видов рыб (9%) обитали в трёх, 11 видов (17%) – в двух зонах. Три вида (5%) – Sperata seenghala (Sykes, 1839), Apocryptes bato (Hamilton, 1822) и Lepidocephalichthys guntea (Hamilton, 1822) встречались лишь в одной выделенной зоне. В целом видовой состав ихтиофауны за весь период наблюдений был достаточно равномерно распределён по р. Падма в радиусе 30 км от площадки атомной станции.
Таблица 2.
Пространственное распределение ихтиофауны р. Падма в районе размещения АЭС “Руппур” в 2014–2017 гг.
| Вид | Выше по течению от АЭС, км | Ниже по течению от АЭС, км | ||||
|---|---|---|---|---|---|---|
| 1–5 | 5–15 | 15–30 | 1–5 | 5–15 | 15–30 | |
| Chitala chitala | + | + | + | + | ||
| Notopterus notopterus | + | + | + | + | + | |
| Corica soborna | + | + | + | + | + | + |
| Gudusia chapra | + | + | + | |||
| Gonialosa manmina | + | + | + | + | + | + |
| Tenualosa ilisha | + | + | + | + | + | + |
| Setipinna phasa | + | + | + | + | + | |
| Amblypharyngodon microlepis | + | + | + | + | + | + |
| Aspidoparia jaya | + | + | + | + | + | + |
| Gibelion catla | + | + | + | + | + | |
| Chela cachius | + | + | + | + | + | + |
| Cirrhinus mrigala | + | + | + | + | ||
| Cirrhinus reba | + | + | + | + | + | + |
| Hypophthalmichthys molitrix | + | + | + | |||
| Gymnostomus ariza | + | + | + | + | ||
| Labeo bata | + | + | + | + | + | + |
| Laubuka laubuca | + | + | ||||
| Salmostoma phulo | + | + | + | + | + | + |
| Pethia conchonius | + | + | + | + | + | + |
| Puntius chola | + | + | + | + | + | + |
| Puntius sophore | + | + | + | + | + | + |
| Puntius stigma | + | + | + | + | + | + |
| Ctenopharyngodon idella | + | + | ||||
| Batasio batasio | + | + | ||||
| Batasio tengana | + | + | + | |||
| Clarias batrachus | + | + | + | + | ||
| Hemibagrus menoda | + | + | + | |||
| Mystus bleekeri | + | + | + | + | ||
| Mystus cavasius | + | + | + | + | + | + |
| Mystus tengara | + | + | + | + | + | + |
| Mystus vittatus | + | + | + | + | + | + |
| Rita rita | + | + | + | + | + | + |
| Sperata aor | + | + | ||||
| Sperata seenghala | + | |||||
| Heteropneustes fossilis | + | + | + | + | + | + |
| Pangasius pangasius | + | + | + | + | + | |
| Ailia coila | + | + | + | + | + | + |
| Ailiichthys punctata | + | + | ||||
| Eutropiichthys vacha | + | + | + | + | + | + |
| Clupisoma garua | + | + | + | + | + | + |
| Pachypterus atherinoides | + | + | + | + | ||
| Ompok bimaculatus | + | + | ||||
| Ompok pabda | + | + | + | + | + | + |
| Wallago attu | + | + | + | + | + | + |
| Bagarius bagarius | + | + | + | |||
| Apocryptes bato | + | |||||
| Glossogobius giuris | + | + | + | + | + | + |
| Lepidocephalichthys guntea | + | |||||
| Rhinomugil corsula | + | + | + | + | + | + |
| Xenentodon cancila | + | + | + | + | + | + |
| Monopterus cuchia | + | + | + | + | ||
| Macrognathus aculeatus | + | + | ||||
| Macrognathus pancalus | + | + | + | + | + | + |
| Mastacembelus armatus | + | + | + | + | + | + |
| Nandus nandus | + | + | ||||
| Channa marulius | + | + | + | + | + | |
| Channa orientalis | + | + | ||||
| Channa punctatus | + | + | + | + | + | |
| Channa striata | + | + | + | + | + | + |
| Anabas testudineus | + | + | + | + | + | + |
| Trichogaster fasciata | + | + | + | |||
| Pseudorhombus arsius | + | + | ||||
| Chanda nama | + | + | + | + | + | + |
| Otolithoides pama | + | + | + | + | ||
| Panna microdon | + | + | ||||
| Всего видов | 53 | 43 | 47 | 49 | 49 | 50 |
За весь период наблюдений на изученном участке р. Падма было обнаружено 17 видов рыб из 25 занесённых в Красную книгу Бангладеш (табл. 1). Так, в уловах 2014 г. при максимальном разнообразии ихтиофауны обнаружено 14 видов, среди них четыре находятся в критической опасности (CR), шесть видов отнесено к категории “в опасности” (EN) и четыре находятся в уязвимом положении (VU). В 2015 г. обнаружено девять видов рыб, включённых в категорию наибольшей угрозы Красной книги Бангладеш: четыре вида – CR, три – EN и два – VU. В 2016 г. в уловах идентифицировано десять видов: по три CR, и EN и четыре – VU. В уловах 2017 г. обнаружено пять таких видов: два – EN и три – VU. В целом число обнаруженных краснокнижных видов рыб по годам коррелирует с общим видовым разнообразием ихтиофауны в исследуемые сезоны.
Наиболее крупными по массе были Gibelion catla (1053 ± 689 г.), Pangasius pangasius (Hamilton, 1822) (749 ± 588 г.) и Sperata aor (Hamilton, 1822) (641 ± 332 г.). Максимальную TL имели Sperata aor (45.5 ± 14.1 см) и Pangasius pangasius (40.6 ± 14.1 см). Самым многочисленным видом в уловах являлась наиболее мелкая рыба Corica soborna Hamilton, 1822 (табл. 3).
Таблица 3.
Длина (TL) и масса рыб р. Падма в районе АЭС “Руппур”
| Вид | TL, см | Масса, г | Число рыб, экз. | ||
|---|---|---|---|---|---|
| min–max | M ± σ | min–max | M ± σ | ||
| Chitala chitala | 12.9–60.9 | 29.5 ± 19.4 | 11.3–1650.0 | 472.0 ± 359.0 | 7 |
| Notopterus notopterus | 12.3–29.4 | 22.0 ± 4.5 | 57.0–220.0 | 114 ± 56.0 | 17 |
| Corica soborna | 2.5–5.7 | 4.0 ± 0.9 | 0.2–1.7 | 0.7 ± 0.5 | 1173 |
| Gudusia chapra | 5.6–18.5 | 10.7 ± 3.8 | 3.7–94.1 | 22.9 ± 18.4 | 17 |
| Gonialosa manmina | 4.5–15.6 | 11.2 ± 2.9 | 3.7–85.0 | 19.2 ± 8.9 | 57 |
| Tenualosa ilisha | 15.0–43.0 | 23.4 ± 7.6 | 75.5–850.0 | 203 ± 118 | 54 |
| Setipinna phasa | 15.8–31.5 | 22.2 ± 4.4 | 18.7–190.0 | 71.6 ± 31.8 | 24 |
| Amblypharyngodon microlepis | 1.9–8.7 | 5.8 ± 2.1 | 0.1–6.4 | 3.1 ± 2.0 | 197 |
| Aspidoparia jaya | 5.0–10.0 | 7.3 ± 1.5 | 2.0–24.5 | 5.9 ± 3.3 | 170 |
| Gibelion catla | 30.0–54.0 | 37.2 ± 7.8 | 480.0–2450.0 | 1053.0 ± 689.0 | 10 |
| Chela cachius | 2.8–6.0 | 4.4 ± 1.3 | 0.24–3.0 | 1.6 ± 1.1 | 321 |
| Cirrhinus mrigala | 17.5–50.3 | 32.8 ± 9.2 | 50.0–1400.0 | 476.0 ± 236.0 | 9 |
| Cirrhinus reba | 5.6–29.5 | 17.5 ± 5.7 | 2.9–120.7 | 53.0 ± 31.3 | 166 |
| Hypophthalmichthys molitrix | 11.2–33.6 | 22.2 ± 8.7 | 14.2–464.0 | 182.0 ± 77.3 | 13 |
| Gymnostomus ariza | 7.2–15.0 | 10.8 ± 2.5 | 12.0–25.5 | 16.1 ± 4.5 | 7 |
| Labeo bata | 11.2–34.0 | 22.8 ± 4.2 | 19.7–480.0 | 129.0 ± 78.6 | 34 |
| Laubuka laubuca | 15.5–18.0 | 16.8 ± 1.0 | 22.0–28.0 | 25.8 ± 2.9 | 3 |
| Salmostoma phulo | 5.5–7.0 | 6.4 ± 0.6 | 3.5–5.0 | 4.3 ± 0.6 | 38 |
| Pethia conchonius | 3.3–10.2 | 6.1 ± 2.2 | 0.3–11.0 | 2.4 ± 1.8 | 276 |
| Puntius chola | 5.0–10.8 | 7.9 ± 1.7 | 2.0–24.0 | 9.3 ± 5.4 | 88 |
| Puntius sophore | 6.5–12.0 | 8.8 ± 1.5 | 9.0–25.0 | 16.4 ± 4.2 | 39 |
| Puntius stigma | 4.8–18.1 | 9.8 ± 4.9 | 2.0–73.0 | 26.0 ± 18.3 | 157 |
| Ctenopharyngodon idella | 16.5–23.8 | 20.2 ± 5.2 | 45.5–585.0 | 315.0 ± 181.0 | 2 |
| Batasio batasio | 3.0–8.5 | 6.0 ± 2.3 | 0.5–14.1 | 6.7 ± 4.0 | 7 |
| Batasio tengana | 3.2–11.3 | 7.7 ± 2.4 | 0.4–18.4 | 9.6 ± 5.9 | 14 |
| Clarias batrachus | 18.0–31.0 | 24.0 ± 5.5 | 10.0–70.0 | 43.8 ± 25.6 | 4 |
| Hemibagrus menoda | 10.1–16.2 | 13.2 ± 3.1 | 23.9–71.1 | 42.8 ± 24.9 | 3 |
| Mystus bleekeri | 4.6–16.7 | 10.2 ± 2.9 | 2.1–54.3 | 18.8 ± 12.6 | 16 |
| Mystus cavasius | 6.5–26.5 | 13.2 ± 4.4 | 5.0–187.9 | 33.1 ± 20.4 | 101 |
| Mystus tengara | 3.2–50.5 | 10.2 ± 8.1 | 0.6–130.0 | 18.5 ± 13.2 | 98 |
| Mystus vittatus | 2.8–16.2 | 8.3 ± 3.6 | 0.8–51.1 | 11.2 ± 8.7 | 132 |
| Rita rita | 12.0–38.9 | 24.1 ± 7.7 | 18.4–1081.0 | 270.0 ± 169.0 | 26 |
| Sperata aor | 15.9–57.5 | 45.5 ± 14.1 | 118.0–1070.0 | 641.0 ± 332.0 | 7 |
| Sperata seenghala | 39.6 | 192.2 | 1 | ||
| Heteropneustes fossilis | 15.7–23.2 | 18.5 ± 2.1 | 26.6–55.5 | 41.5 ± 8.6 | 31 |
| Pangasius pangasius | 18.5–54.0 | 40.6 ± 14.1 | 38.5–1530.0 | 749.0 ± 588.0 | 8 |
| Ailia coila | 6.6–17.8 | 12.5 ± 2.7 | 2.3–38.0 | 20.0 ± 11.0 | 23 |
| Ailiichthys punctata | 4.5–10.1 | 8.2 ± 2.6 | 0.8–7.3 | 5.0 ± 3.0 | 4 |
| Eutropiichthys vacha | 8.5–27.0 | 15.7 ± 6.8 | 16.5–140.6 | 46.5 ± 32.4 | 12 |
| Clupisoma garua | 5.8–38.0 | 17.2 ± 7.7 | 1.5–549.0 | 91.2 ± 77.4 | 45 |
| Pachypterus atherinoides | 3.5–22.0 | 10.2 ± 6.7 | 3.0–140.3 | 32.2 ± 24.6 | 18 |
| Ompok bimaculatus | 23.0–35.2 | 28.6 ± 6.2 | 43.2–200.0 | 99.9 ± 56.9 | 3 |
| Ompok pabda | 3.0–35.2 | 17.4 ± 8.9 | 2.1–171.2 | 54.0 ± 36.4 | 74 |
| Wallago attu | 12.4–89.0 | 36.3 ± 17.2 | 10.0–4358.0 | 473.0 ± 365.0 | 28 |
| Bagarius bagarius | 6.0–75.8 | 30.7 ± 23.6 | 25.0–1530.0 | 512.0 ± 338.0 | 6 |
| Apocryptes bato | 8.0–9.0 | 8.5 ± 0.7 | 8.3–9.4 | 8.9 ± 0.8 | 2 |
| Glossogobius giuris | 7.2–22.0 | 12.6 ± 4.2 | 5.5–93.8 | 25.6 ± 11.8 | 63 |
| Lepidocephalichthys guntea | 5.5–7.0 | 6.3 ± 0.8 | 4.0–4.8 | 4.4 ± 0.4 | 12 |
| Rhinomugil corsula | 7.5–32.2 | 13.0 ± 4.8 | 9.2–81.9 | 25.8 ± 20.4 | 38 |
| Xenentodon cancila | 8.5–25.5 | 18.0 ± 5.3 | 7.3–26.7 | 16.8 ± 6.5 | 37 |
| Monopterus cuchia | 10.0–25.4 | 14.9 ± 4.6 | 2.0–42.7 | 16.2 ± 12.6 | 14 |
| Macrognathus aculeatus | 16.8–20.2 | 18.7 ± 1.6 | 15.1–30.5 | 22.6 ± 8.1 | 4 |
| Macrognathus pancalus | 6.0–17.8 | 10.3 ± 3.5 | 1.0–33.2 | 7.4 ± 4.2 | 17 |
| Mastacembelus armatus | 9.5–54.2 | 24.3 ± 10.6 | 12.5–345.0 | 105.0 ± 68.0 | 22 |
| Nandus nandus | 7.4–9.5 | 8.5 ± 1.5 | 30.5–34.5 | 32.5 ± 2.8 | 2 |
| Channa marulius | 5.8–9.5 | 7.5 ± 1.2 | 12.0–18.5 | 15.5 ± 2.1 | 7 |
| Channa orientalis | 18.0–24.0 | 21.0 ± 2.6 | 90.0–130.0 | 105.0 ± 19.1 | 3 |
| Channa punctatus | 7.0–23.9 | 14.5 ± 5.5 | 3.5–136.4 | 49.8 ± 22.3 | 35 |
| Channa striata | 10.5–45.0 | 29.1 ± 11.1 | 16.2–985.0 | 329.0 ± 201.0 | 14 |
| Anabas testudineus | 9.4–19.0 | 13.0 ± 3.2 | 15.0–152.6 | 57.7 ± 35.4 | 11 |
| Trichogaster fasciata | 4.4–10.0 | 8.0 ± 1.8 | 2.1–19.3 | 12.8 ± 5.9 | 15 |
| Pseudorhombus arsius | 22.8–26.9 | 24.9 ± 2.9 | 12.1–29.2 | 20.7 ± 12.1 | 2 |
| Chanda nama | 1.5–6.2 | 4.2 ± 1.8 | 2.0–6.5 | 3.9 ± 1.0 | 58 |
| Otolithoides pama | 9.0–42.1 | 23.0 ± 8.9 | 8.2–476.0 | 131.0 ± 126.0 | 29 |
| Panna microdon | 17.9–30.4 | 22.0 ± 5.7 | 48.0–184.1 | 91.0 ± 64.1 | 3 |
ОБСУЖДЕНИЕ
В межень (апрель) по сравнению с периодом паводка (август) отмечено существенное обеднение видового состава отряда сомообразных – с 20 до 10 видов (табл. 1). Также в сухой период не обнаружено семейств мешкожаберных сомов (Heteropneustidae) и пангасиевых (Pangasiidae). При этом если пангасиевые в сезон муссонов попадались единично, то мешкожаберные сомы были более многочисленны. Они отмечены на всех участках р. Падма в радиусе 30 км от АЭС “Руппур”.
Видовой состав уловов зависел от видоспецифичных сроков нереста рыб. Большая часть видов рыб относится к фитофилам и пелагофилам. Необходимо отметить, что по сравнению с августом (2014 г.) в апреле (2015 г.) в Падме не отмечен толстолобик. Местные рыбаки активно облавливают временные водоёмы с выращиваемым толстолобиком и торгуют им. По всей видимости, в августе в наши уловы попадал толстолобик из фермерских прудов, оказавшийся в русле Падмы при разливе реки. Результаты наших исследований хорошо коррелируют с данными, представленными в работе по изучению динамики уловов в низовьях реки Падма (de Graaf, 2003), где показано, что уловы в период муссонов больше, чем в сухой сезон.
Поимка большезубой камбалы Pseudorhombus arsius (Hamilton, 1822) в 2014 г. – скорее случайность. Поймано всего 2 экз. – один в 30 км ниже размещения АЭС “Руппур”, а второй на 1 км выше. Большезубая камбала предпочитает держаться в эстуарных зонах. Неполовозрелые особи встречаются и в солоноватых водах (Amaoka, Hensley, 2001). В 2015 г. отмечен моноптерус Monopterus cuchia (Hamilton, 1822) (отряд Synbranchiformes, семейство Synbranchidae), который не зарегистрирован в 2014 году.
Наиболее богатый состав ихтиофауны отмечен в муссонный период в 10–15 км выше по течению Падмы от атомной станции, где река делает поворот и образует большую излучину с множеством проток. Рост видового богатства ихтиофауны, по-видимому, совпадает с увеличением разнообразия биотопов. Подобная ситуация также отмечена ниже по течению в 10–20 км от АЭС, где река разливается и формирует множество мелководий. В то же время на суженных участках русла, в частности в ближней зоне (1–2 км) от АЭС “Руппур”, где над Падмой проходят два моста и берега реки укреплены, видовой состав ихтиофауны беднее. По сравнению с муссонным периодом зимой уровень воды в реке идёт на спад, а её температура снижается до годового минимума, что влечёт за собой снижение обилия ихтиофауны. Об этом свидетельствуют и наблюдения местных рыбаков.
Многие обнаруженные виды рыб совершают регулярные миграции, которые связаны с добычей пищи или размножением. Так, например, сельдевые (Clupeidae) относятся к анадромным, кефалевые (Mugilidae) – к катадромным видам рыб, которые осуществляют нерестовые миграции соответственно из морей в реки или из рек в моря. Некоторые сомообразные, анчоусовые (Engraulidae), окунеобразные (Perciformes) и другие являются амфидромными видами – перемещаются между пресными и солёными водами в течение жизненного цикла, совершая нагульные миграции. Согласно данным трофической экологии, среди обнаруженных видов рыб значительная часть является хищниками или всеядными (Lowe-McConnell, 1987; Rahman, 2005; Nelson et al., 2016). Это почти все сомообразные, бычковые (Gobiidae), змееголовые (Channidae), саргановые (Belonidae), горбылёвые (Sciaenidae) и другие.
Выявленный нами видовой состав рыб схож с данными исследований, полученными в более ранние годы наблюдений (Islam, Hossain, 1983; Bhuiyan et al., 1992; de Graaf, 2003). Это говорит о достаточно благополучной экологической обстановке в р. Падма в районе атомной станции до начала её эксплуатации. Ведение мониторинга биоразнообразия ихтиофауны должно являться неотъемлемой составляющей в общей системе экологической безопасности региона АЭС “Руппур”. При этом программа мониторинга должна учитывать сезонные особенности региона (паводковый и меженный периоды). Представленные результаты могут быть использованы не только для обеспечения радиационной и продовольственной (за счёт контроля биоресурсов) безопасности населения Бангладеш, но и для оценки экологических рисков от воздействия АЭС “Руппур” на референтные организмы водной биоты.
Список литературы
Гудков Д.И., Каглян А.Е., Киреев С.И. и др. 2008. Основные дозообразующие радионуклиды в рыбе зоны отчуждения Чернобыльской АЭС // Радиацион. биология. Радиоэкология. Т. 48. № 1. С. 48–58.
Микаилова Р.А., Курбаков Д.Н., Сидорова Е.В. и др. 2020. Комплексный радиационно-экологический мониторинг водных экосистем в регионе размещения АЭС “Руппур” (Народная Республика Бангладеш) // Мор. биол. журн. Т. 5. № 3. С. 30−54.
Трапезников А.В., Трапезникова В.Н. 2006. Радиоэкология пресноводных экосистем. Екатеринбург: Изд-во УрГСХА, 390 с.
Amaoka K., Hensley D.A. 2001. Paralichthyidae. Sand flounders // The living marine resources of the Western Central Pacific. V. 6. Bony fishes. Part 4. (Labridae to Latimeriidae), Estuarine Crocodiles, Sea Turtles, Sea Snakes and Marine Mammals. Rome: FAO. P. 3842–3862.
Bhuiyan A.S., Islam M.N., Hossain M.T. 1992. A check-list of the fishes of Rajshahi // The Rajshahi Univ. Stud. Part B. V. 20. P. 287–306.
Bhuiyan S.S., Joadder M.A.R., Bhuiyan A.S. 2008. Occurrence of fishes and non-fin fishes of the river Padma near Rajshahi, Bangladesh // Univ. J. Zool. Rajshahi Univ. V. 27. P. 99–100. https://doi.org/10.3329/ujzru.v27i0.1965
Choudhary S.K., Smith B.D., Dey S. et al. 2006. Conservation and biomonitoring in the Vikramshila Gangetic Dolphin Sanctuary, Bihar, India // Oryx. V. 40. № 2. P. 189–197. https://doi.org/10.1017/S0030605306000664
Craig J.F., Halls A.S., Barr J.J.F. et al. 2004. The Bangladesh floodplain fisheries // Fish. Res. V. 66. № 2–3. P. 271–286. https://doi.org/10.1016/S0165-7836(03)00196-6
de Graaf G. 2003. Dynamics of floodplain fisheries in Bangladesh, results of 8 years fisheries monitoring in the compartmentalization pilot project // Fish. Manag. Ecol. V. 10. № 3. P. 191–199. https://doi.org/10.1046/j.1365-2400.2003.00339.x
de Graaf G.J., Born B., Uddin K.A., Martin F. 2001. Floods, fish and fishermen. Dhaka: Univ. Press Ltd., 127 p.
FAO. 2014. The State of World Fisheries and Aquaculture 2014. Rome: FAO, 243 p.
FAO. 2020. The State of World Fisheries and Aquaculture 2020. Rome: FAO, 206 p. https://doi.org/10.4060/ca9229en
Hossain M.A., Haque M.A. 2005. Fish species composition in the river Padma near Rajshahi // J. Life Earth Sci. V. 1. № 1. P. 35–42.
Impacts of the Fukushima Nuclear Accident on Fish and Fishing Grounds. 2015. Tokyo et al.: Springer, 239 p. https://doi.org/10.1007/978-4-431-55537-7
Islam M.S., Hossain M.A. 1983. An account of the fishes of the Padma River near Rajshahi // Raj. Fish. Bull. V. 1. № 2. P. 1–31.
Red Book of threatened fishes of Bangladesh. 2000. Dhaka: IUCN Bangladesh, 116 p.
Red List of Bangladesh. 2015. Volume 5: Freshwater Fishes. Dhaka: IUCN Bangladesh, xvi + 360 p.
Lowe-McConnell R.H. 1987. Ecological Studies in Tropical Fish Communities. Cambridge: Cambridge Univ. Press, 392 p.
Mohsin A.B.M., Haque M.S.M., Galib S.M. et al. 2013. Seasonal Abundance of Fin Fishes in the Padma River at Rajshahi District, Bangladesh // World J. Fish Mar. Sci. V. 5. № 6. P. 680–685. https://www.idosi.org/wjfms/wjfms5%286%2913/18.pdf
Montaña C.G., Choudhary S.K., Dey S., Winemiller K.O. 2011. Compositional trends of fisheries in the River Ganges, India // Fish. Manag. Ecol. V. 18. № 4. P. 282–296. https://doi.org/10.1111/j.1365-2400.2010.00782.x
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the World. Hoboken: John Wiley and Sons, 752 p. https://doi.org/10.1002/9781119174844
Rahman A.K.A. 2005. Freshwater fishes of Bangladesh. Dhaka: Zool. Soc. Bangladesh, xviii+394 p.
Rahman M.A., Huda M. 2012. Study of the Seasonal Variations in physicochemical and biological aspects of the Padma River at Paturia Ghat, Manikganj // Jahangirnagar Univ. Env. Bull. V. 1. P. 55–66. https://doi.org/10.3329/jueb.v1i0.14548
Status of Fish and Fisheries of Ganga River. 2012. GRB EMP: Ganga River Basin Environment Management Plan. Bombay et al.: Indian Inst. Tech., 58 p. http://cganga.org/wp-content/uploads/sites/3/2018/11/030_ENB.pdf
Welcomme R.L. 2008. World prospects for floodplain fisheries // Ecohydrol. Hydrobiol. V. 8. № 2–4. P. 169–182. https://doi.org/10.2478/v10104-009-0013-0
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


