Вопросы ихтиологии, 2022, T. 62, № 5, стр. 654-663
Жирнокислотный профиль мышц молоди Leptoclinus maculatus (Stichaeidae) из заливов Конгсфьорд и Рипфьорд, архипелаг Шпицберген
С. Н. Пеккоева 1, *, В. П. Воронин 1, С. Фальк-Петерсен 2, Й. Берге 3, 4, 5, Н. Н. Немова 1, С. А. Мурзина 1
1 Институт биологии Карельского научного центра РАН – ИБ КарНЦ РАН
Петрозаводск, Россия
2 Акваплан-нива, Фрам-центр
Тромсё, Норвегия
3 Арктический университет Норвегии
Тромсё, Норвегия
4 Университетский центр архипелага Шпицберген
Лонгйир, Норвегия
5 Норвежский университет естественных и технических наук,
Центр автономных морских операций и систем
Трондхейм, Норвегия
* E-mail: pek-svetlana@mail.ru
Поступила в редакцию 09.11.2021
После доработки 06.12.2021
Принята к публикации 10.12.2021
- EDN: DTIVLI
- DOI: 10.31857/S0042875222050162
Аннотация
Исследован жирнокислотный состав общих липидов и их отдельных классов (фосфолипидов и триацилглицеринов) в мышцах молоди лептоклина пятнистого Leptoclinus maculatus на разных стадиях развития из заливов Конгсфьорд и Рипфьорд акватории архипелага Шпицберген в летний период. У молоди лептоклина из Конгсфьорда, в отличие от молоди из Рипфьорда, с возрастом повышается содержание жирных кислот 20:1n-9 и 22:1n-11, являющихся биомаркерными для веслоногих ракообразных рода Calanus. На переходной с пелагического к придонному образу жизни и придонной стадиях развития у молоди из Конгсфьорда уровень жирных кислот 18:1n-9, 18:1n-7 и 16:1n-7 снижается или остаётся неизменным, а у рыб из Рипфьорда, напротив, возрастает. Доминирование этих мононенасыщенных жирных кислот в составе триацилглицеринов подтверждает их пищевое происхождение, а их уровень отражает различия в кормовой базе рыб из исследованных заливов. Более высокое содержание полиненасыщенных жирных кислот в фосфолипидах молоди лептоклина из Рипфьорда может указывать на адаптивные изменения в биомембранах мышц в ответ на более низкую температуру воды.
Водные организмы арктических экосистем, в том числе рыбы, обитают в условиях постоянного воздействия комплекса специфических факторов среды (низкие значения температуры; экстремальные смены режима освещённости, связанные с чередованием полярного дня и ночи; изменение ледового покрова и др.), в связи с чем имеют ряд метаболических адаптивных особенностей для обитания в северных широтах (Falk-Petersen et al., 1986, 1990; Lee et al., 2006; Berge et al., 2015; Мурзина, 2019). Лептоклин пятнистый Leptoclinus maculatus (Stichaeidae) (Fries, 1838) широко распространён в Баренцевом и Норвежском морях, в акватории арх. Шпицберген и встречается далеко к северу от него (Нельсон, 2009; Mecklenburg et al., 2011). Это экологически важный представитель арктическо-бореальной ихтиофауны, который имеет высокие адаптивные возможности к росту и развитию в условиях Арктики, в первую очередь, за счёт энергетических запасов в форме липидов и их жирнокислотных компонентов (Мурзина, 2010; Пеккоева и др., 2017; Murzina et al., 2020; Pekkoeva et al., 2020). Липиды как незаменимые источники энергии, неотъемлемые структурные молекулы, а также биологически активные вещества особенно важны для успешного развития молоди рыб в условиях низкой температуры воды в высоких широтах (Кауфман, 2015; Мурзина, 2010, 2019). У молоди лептоклина пятнистого липиды локализованы в форме отдельных капель между мышечными волокнами и в значительных количествах сосредоточены в специальном органе – липидном мешке (до 92% сухой массы мешка) (Falk-Petersen et al., 1986; Мурзина, 2010; Пеккоева, 20188). Такое тканеспецифическое аккумулирование липидов у лептоклина (в отличие от других видов арктических рыб), по-видимому, обеспечивает длительный период развития (до 5 лет) его молоди с последовательным прохождением стадий развития от L1 до L5 (согласно классификации Мейер Оттесен с соавторами) и дальнейшим переходом к придонному образу жизни половозрелых особей (Meyer Ottesen et al., 2011; Пеккоева и др., 2017; Немова и др., 2018).
Адаптивные механизмы трансформации веществ и энергии в раннем онтогенезе гидробионтов арктических экосистем практически не изучены. Исследования в этой области важны для понимания роли липидов и жирных кислот, в том числе физиологически ценных полиненасыщенных и мононенасыщенных, поступающих в организм при питании, в процессе развития рыб в специфических условиях высоких широт. Ранее в наших исследованиях были получены данные о содержании жирных кислот и их значении в постэмбриональном развитии (стадии развития L1–L5) молоди лептоклина пятнистого из Конгсфьорда в полярную ночь (Пеккоева и др., 2019; Pekkoeva et al., 2020).
Цель данной работы – изучить в сравнительном аспекте изменения жирнокислотного состава общих липидов, а также состава структурных и запасных липидных классов в мышцах молоди лептоклина пятнистого из арктическо-бореального зал. Конгсфьорд и высокоарктического зал. Рипфьорд акватории арх. Шпицберген в летний период.
МАТЕРИАЛ И МЕТОДИКА
Материал собран в августе 2018 г. в научной экспедиции на борту научно-исследовательского судна “Helmer Hanssen” (Арктический университет Норвегии) в рамках обучающего курса “AB320/820 – Zooplankton in Svalbard waters” Университетского центра на Шпицбергене. Отлов рыб проводили с использованием пелагического и донного тралов в акватории арх. Шпицберген, в заливах Конгсфьорд (78°57′ с.ш. 11°56′ в.д) и Рипфьорд (80°17′ с.ш. 22°15′ в.д), относимых соответственно к арктическо-бореальному и арктическому доменам. Заливы различались температурой поверхностных (Конгсфьорд – 4, Рипфьорд – 5.4°С) и глубинных (Конгсфьорд – 1.5, Рипфьорд – 0–0.5°С) слоёв воды. Солёность воды в заливах была одинакова и составляла в среднем 34.7‰.
Молодь лептоклина разделяли на стадии развития (L1, L2, L3, L4, L5) на основе морфофизиологических характеристик – размерно-весовых показателей, окраски и пигментации тела, наличия и параметров липидного мешка согласно классификации Мейер Оттесен с соавторами (Meyer Ottesen et al., 2011) и данных нашей предыдущей работы (Пеккоева и др., 2017). На стадии развития L1 молодь пелагическая с прозрачным телом и развивающимся липидным мешком; на стадии L2 – образ жизни пелагический, тело прозрачное с несколькими меланофорами, липидный мешок развит, некрупный; L3 – молодь также ведёт пелагический образ жизни, тело молочно-белого цвета с меланофорами, липидный мешок более крупный; L4 – молодь начинает переходить к придонному образу жизни, тело светло-жёлтое c меланофорами, липидный мешок крупный; L5 – в большей степени ведёт придонный образ жизни (как взрослые особи), липидный мешок в состоянии резорбции (Meyer Ottesen et al., 2011; Пеккоева и др., 2017). В нашей работе в соответствии с возможностями сбора материала проводили анализ молоди лептоклина из Конгсфьорда на стадиях развития L1–L4 и Рипфьорда на стадиях L1–L5. Анализировали жирнокислотный состав общих липидов (ОЛ) и их отдельных классов – структурных фосфолипидов (ФЛ) и запасных триацилглицеринов (ТАГ) в мышечной ткани молоди (по 7 экз. на каждой стадии развития в двух повторностях) из соответствующих заливов. Детальное описание процесса анализа представлено нами ранее (Воронин и др., 2021).
Экстракцию ОЛ из материала проводили по методу Фолча (Folch et al., 1957) смесью хлороформ–метанол (2 : 1 по объёму) с помощью ротационного испарителя Hei-VAP Advantage МL/G3 (“Heidolph”, Германия). Индивидуальные классы липидов ФЛ и ТАГ выделяли на специальных пластинах HPTLC Silicagel 60 F254 Premium Purity (“Merck”, Германия) с использованием комплекса оборудования для высокоэффективной тонкослойной хроматографии CAMAG (“CAMAG”, Швейцария), включающего полуавтоматический аппликатор Linomat 5 для нанесения проб на пластину, автоматическую камеру ADC 2 для разделения общих липидов на классы, дериватизатор Derivatizer для автоматического опрыскивания пластин, нагреватель TLC Plate Heater 3 для проявления пятен липидных классов, спектроденситометр Camag TLC Scanner для сканирования пятен и проведения расчётно-измерительных процедур. Определение профиля жирных кислот (ЖК) проводили методом газожидкостной хроматографии на хроматографе “Хроматэк – Кристалл-5000.2” (Россия) с капиллярными колонками Zebron FFAP. В качестве внутреннего стандарта использовали бегеновую ЖК (22 : 0) (“Sigma Aldrich”, США). Для анализа применяли метиловые эфиры ОЛ, ФЛ и ТАГ, которые получали с использованием кислотного катализатора (ацетилхлорид) (Цыганов, 1971). Обработку хроматограмм проводили с применением компьютерной программы “Хроматек Аналитик” (ЗАО “Хроматек” Россия).
Статистическая обработка данных проведена в открытой программируемой среде R (R Core Team, 2021). Достоверность различий данных определяли с использованием непараметрического критерия Уилкоксона−Манна−Уитни (Кабаков, 2014). Различия между значениями жирнокислотных показателей считали достоверными при p ≤ 0.05. Биохимический анализ выполнен на базе лаборатории экологической биохимии Института биологии Карельского научного центра РАН (КарНЦ РАН) с использованием оборудования Центра коллективного пользования Федерального исследовательского центра КарНЦ РАН.
РЕЗУЛЬТАТЫ
Жирные кислоты общих липидов
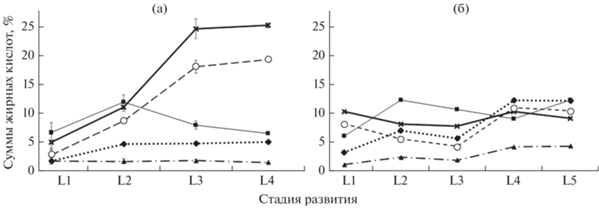
В жирнокислотном профиле лептоклина пятнистого можно выделить ряд преобладающих в количественном отношении ЖК. Среди насыщенных ЖК (НЖК) доминируют 14:0, 16:0, 18:0 и 20:0; в группе мононенасыщенных ЖК (МНЖК) – 16:1n-7, 18:1n-7, 18:1n-9, 20:1n-9 и 22:1(n-11; среди полиненасыщенных ЖК (ПНЖК) – 18:4n-3, 20:5n-3, 22:5-3 и 22:6n-3. В мышцах лептоклина на ранних стадиях постэмбрионального развития по количественному содержанию преобладают ПНЖК, при этом у молоди из Конгсфьорда на стадиях развития L1–L2 их уровень составляет до 43% суммы ЖК, а из Рипфьорда на стадиях L1–L3 – до 47%. У рыб старшего возраста как из Конгсфьорда, так и из Рипфьорда начинают доминировать МНЖК – соответственно до 49 и 45% (рис. 1).
Рис. 1.
Содержание групп жирных кислот общих липидов в мышцах молоди лептоклина пятнистого Leptoclinus maculatus на разных стадиях развития (L1–L5) из заливов Конгсфьорд (а) и Рипфьорд (б) акватории арх. Шпицберген в августе 2018 г.: НЖК, МНЖК, ПНЖК – насыщенные, мононенасыщенные, полиненасыщенные жирные кислоты; (│) – пределы варьирования показателя (25–75% данных заключены в прямоугольники), (─) – медиана, (⚫) – выбросы.

Достоверное повышение содержания МНЖК в мышцах лептоклина из Конгсфьорда в процессе развития происходит за счёт 20:1n-9 (с 8 до 20%), 22:1n-11 (с 5 до 13%) и 16:1n-7 (с 3 до 4%). При этом содержание олеиновой ЖК (18:1n-9) достоверно понижается с 11 (на стадиях развития L1 и L2) до 6% (L3 и L4). Другие идентифицированные МНЖК составляют не более 2% для каждой ЖК. У рыб из Рипфьорда, наоборот, содержание 18:1n-9 повышается с 8 до 11% суммы ЖК от стадии развития L1 к L5 (p ≤ 0.05). Достоверный рост содержания МНЖК у молоди от стадии L3 к L5 происходит также за счёт 16:1n-7 (с 5 до 11%) и 18:1n-7 (с 2 до 5%). Значимых изменений содержания 20:1n-9 (7–10%) и 22:1n-11 (3–8%) у молоди из Рипфьорда не выявлено.
Понижение содержания ПНЖК в процессе развития молоди лептоклина в двух исследованных фьордах происходит за счёт доминирующих на всех стадиях развития ЖК семейства n-3, в частности 20:5n-3 – эйкозапентаеновой кислоты (ЭПК) и 22:6n-3 – докозагексаеновой кислоты (ДГК). У молоди из Конгсфьорда установлено понижение содержания ЭПК и ДГК соответственно с 11 до 8% и с 20 до 9%, а у рыб из Рипфьорда – с 14 до 10% и с 21 до 8% (p ≤ 0.05). Содержание других незаменимых жирных кислот – 18:2n-6, 18:3n-3 и физиологически значимой 20:4n-6 – составляет для каждой не более 2% и не имеет значительных вариаций по стадиям развития лептоклина. У молоди лептоклина на стадиях развития L1 и L2 выявлен наиболее высокий показатель соотношения ПНЖК n-3/n-6 в мышцах (до 12 у рыб из Конгсфьорда и до 16 – из Рипфьорда).
У рыб из Конгсфьорда отмечено снижение содержания НЖК в процессе развития (28.4 и 25.7% суммы ЖК соответственно на стадиях L1 и L2 и 18.4 и 17.9% – на стадиях L3 и L4) в основном за счёт пальмитиновой ЖК (16:0) (с 17 до 10% суммы ЖК) (p ≤ 0.05). У особей из Рипфьорда содержание НЖК в мышцах также достоверно выше у рыб на стадиях развития L1 и L2 (26% суммы ЖК), чем у молоди на других стадиях (22–24%) за счёт понижения содержания ЖК 16:0 с 16 до 13%.
Жирные кислоты фосфолипидов и триацилглицеринов
Установлено, что НЖК и ПНЖК доминируют в составе ФЛ, а МНЖК – в ТАГ молоди лептоклина пятнистого на всех исследованных стадиях развития, за исключением рыб на стадии L1, которые отличаются наиболее высоким содержанием НЖК (в основном за счёт 16:0). При этом в процессе дальнейшего развития начиная со стадии L2 содержание НЖК снижается, а содержание ПНЖК возрастает в ФЛ, а МНЖК – в ТАГ. Среди ПНЖК в мышцах молоди преобладают ЖК семейства n-3 за счёт ДГК и ЭПК. Содержание этих кислот выше в ФЛ, чем в ТАГ, на всех стадиях развития (таблица).
Профиль ЖК ТАГ мышц лептоклина из исследованных фьордов имеет значимые различия по МНЖК. Содержание в ТАГ ЖК 20:1n-9 и 22:1n-11 у рыб на стадии развития L1 из Рипфьорда (соответственно 10 и 8% суммы ЖК) выше, чем у рыб из Конгсфьорда (5 и 3%) (таблица). В процессе развития лептоклина из Конгсфьорда содержание этих ЖК значительно повышается со стадии развития L2 к стадии L4 (соответственно до 25 и 19%), а у рыб из Рипфьорда тренд на повышение этих кислот не выявлен (рис. 2). При этом содержание других ЖК (18:1n-9, 18:1n-7, 16:1n-7) более высокое у молоди лептоклина из Рипфьорда, особенно на стадиях развития L4 и L5. Показатель соотношения 22:1n-11/20:1n-9 в ТАГ у рыб из Конгсфьорда и Рипфьорда на стадиях L1–L3 составляет соответственно 0.6 и 0.8. При этом у молоди из Рипфьорда на стадиях L4 и L5 он выше – 1.1.
Рис. 2.
Содержание доминирующих в составе триацилглицеринов мононенасыщенных жирных кислот
в мышцах молоди лептоклина пятнистого Leptoclinus maculatus на разных стадиях развития из заливов Конгсфьорд (а) и Рипфьорд (б) акватории арх.
Шпицберген в августе 2018 г. Кислота: ( ) – 16:1n-7, (
) – 16:1n-7, ( ) – 18:1n-9, (
) – 18:1n-9, ( ) – 18:1n-7, (
) – 18:1n-7, ( ) – 20:1n-9, (
) – 20:1n-9, ( ) – 22:1n-11. ($ \bot - $) – ошибка среднего арифметического.
) – 22:1n-11. ($ \bot - $) – ошибка среднего арифметического.
В мышцах лептоклина из обоих исследованных заливов среди НЖК в ФЛ и ТАГ преобладают 16:0 и 20:0. Содержание НЖК более высокое в составе ФЛ по сравнению с ТАГ, при этом оно выше в мышцах молоди из Конгсфьорда, чем из Рипфьорда. В ФЛ мышц молоди из Рипфьорда отмечено более высокое содержание ПНЖК (таблица). Содержание физиологически ценных ДГК и ЭПК в ФЛ на стадии развития L1 более чем в два раза выше у рыб из Рипфьорда, чем из Конгсфьорда.
Содержание жирных кислот (ЖК) фосфолипидов и триацилглицеринов (% суммы ЖК) в мышцах молоди лептоклина пятнистого Leptoclinus maculatus на разных стадиях развития из заливов Конгсфьорд и Рипфьорд акватории арх. Шпицберген в августе 2018 г. (среднее значение и его стандартная ошибка M ± SE)
| Кислота, сумма и соотношение кислот | Стадия развития | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| L1 | L2 | L3 | L4 | L5 | L1 | L2 | L3 | L4 | L5 | |
| Фосфолипиды | Триацилглицерины | |||||||||
| 14:0 | $\frac{{3.0 \pm 0.6}}{{3.1 \pm 0.2}}$ | $\frac{{3.1 \pm 0.1}}{{3.0 \pm 0.2}}$ | $\frac{{3.4 \pm 0.2}}{{2.9 \pm 0.2}}$ | $\frac{{3.1 \pm 0.2}}{{1.9 \pm 0.4}}$ | $\frac{ - }{{1.4 \pm {{{0.1}}^{{{\text{a,b,c}}}}}}}$ | $\frac{{4.6 \pm 1.0}}{{5.0 \pm 0.5}}$ | $\frac{{5.4 \pm 0.2}}{{5.8 \pm 0.5}}$ | $\frac{{5.0 \pm 0.1}}{{5.5 \pm 0.3}}$ | $\frac{{5.2 \pm 0.1}}{{4.5 \pm 0.4}}$ | $\frac{{--~}}{{3.6 \pm {{{0.4}}^{{{\text{b,c}}}}}}}$ |
| 16:0 | $\frac{{23.1 \pm 4.5}}{{18.4 \pm 1.3}}$ | 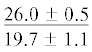 |
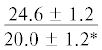 |
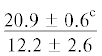 |
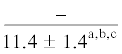 |
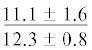 |
 |
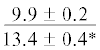 |
$\frac{{9.1 \pm {{{0.2}}^{{\text{c}}}}}}{{11.1 \pm 0.9}}$ | $\frac{ - }{{10.7 \pm {{{0.5}}^{{\text{c}}}}}}$ |
| 18:0 | $\frac{{10.2 \pm 1.3}}{{6.9 \pm 0.3}}$ |  |
 |
 |
$\frac{ - }{{5.9 \pm 0.6}}$ |  |
 |
 |
$\frac{{2.2 \pm {{{0.1}}^{{{\text{a,c}}}}}}}{{3.5 \pm {{{0.5}}^{{\text{a}}}}}}$ | $\frac{ - }{{3.2 \pm {{{0.3}}^{{\text{a}}}}}}$ |
| 20:0 | $\frac{{29.7 \pm 6.9}}{{22.6 \pm 2.5}}$ |  |
 |
 |
$\frac{ - }{{15.3 \pm 2.0}}$ | 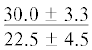 |
 |
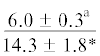 |
$\frac{{4.2 \pm {{{0.5}}^{{{\text{a,c}}}}}}}{{8.0 \pm {{{1.5}}^{{{\text{a,c}}}}}}}$ | $\frac{ - }{{4.8 \pm {{{0.8}}^{{{\text{a,b,c}}}}}}}$ |
| ∑НЖК | $\frac{{67.4 \pm 4.5}}{{53.9 \pm 2.1{\kern 1pt} *}}$ |  |
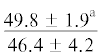 |
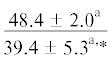 |
$\frac{ - }{{37.6 \pm {{{0.8}}^{{\text{a}}}}}}$ |  |
 |
 |
$\frac{{22.1 \pm {{{0.8}}^{{\text{a}}}}}}{{30.1 \pm {{{3.1}}^{{{\text{a,}}}}}{\kern 1pt} *}}$ | $\frac{ - }{{24.6 \pm {{{1.59}}^{{{\text{a,b,c}}}}}}}$ |
| 16:1n-7 | $\frac{{1.7 \pm 0.2}}{{2.6 \pm 0.7}}$ | 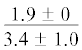 |
 |
$\frac{{2.0 \pm 0.1}}{{3.5 \pm 0.5}}$ | 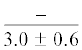 |
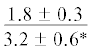 |
 |
 |
$\frac{{5.1 \pm {{{0.2}}^{{\text{a}}}}}}{{12.2 \pm {{{2.1}}^{{\text{a}}}}}}$ | $\frac{ - }{{12.2 \pm {{{2.9}}^{{{\text{a,c}}}}}}}$ |
| 18:1n-9 | $\frac{{6.8 \pm 0.5}}{{7.2 \pm 1.2}}$ |  |
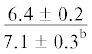 |
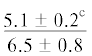 |
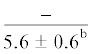 |
 |
 |
 |
$\frac{{6.6 \pm {{{0.2}}^{{\text{c}}}}}}{{9.0 \pm {{{0.9}}^{{\text{a}}}}}}$ | $\frac{ - }{{12.2 \pm {{{2.5}}^{{\text{a}}}}}}$ |
| 18:1n-7 | $\frac{{2.4 \pm 0.2}}{{1.8 \pm 0.4}}$ | 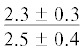 |
 |
 |
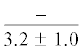 |
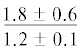 |
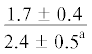 |
 |
$\frac{{1.5 \pm {{{0.03}}^{{\text{c}}}}}}{{4.2 \pm {{{0.9}}^{{{\text{a,}}}}}{\kern 1pt} *}}$ | $\frac{ - }{{4.3 \pm {{{1.1}}^{{{\text{a,c}}}}}}}$ |
| 20:1n-9 | $\frac{{3.5 \pm 1.0}}{{4.5 \pm 0.9}}$ | $\frac{{4.9 \pm 0.2}}{{3.9 \pm 0.6}}$ |  |
$\frac{{5.5 \pm 0.4}}{{2.8 \pm 0.9}}$ | $\frac{ - }{{3.1 \pm 0.9}}$ | . . .
|
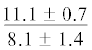 |
 |
$\frac{{25.2 \pm {{{0.4}}^{{\text{a}}}}}}{{10.3 \pm 4.0{\kern 1pt} *}}$ | $\frac{ - }{{9.1 \pm 3.0}}$ |
| 22:1n-11 | $\frac{{0.7 \pm 0.7}}{{1.8 \pm 0.6}}$ | $\frac{{1.0 \pm 0.2}}{{1.3 \pm 0.5}}$ |  |
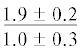 |
$\frac{ - }{{1.2 \pm 0.3}}$ | 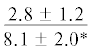 |
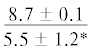 |
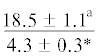 |
$\frac{{19.3 \pm {{{0.3}}^{{\text{a}}}}}}{{11.0 \pm 4.1{\kern 1pt} *}}$ | $\frac{ - }{{10.4 \pm 4.9}}$ |
| ∑ МНЖК | $\frac{{16.2 \pm 2.6}}{{20.0 \pm 3.0}}$ | 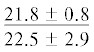 |
 |
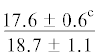 |
.$\frac{ - }{{19.4 \pm 1.4}}$ | 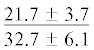 |
 |
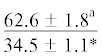 |
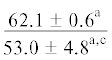 |
$\frac{ - }{{55.2 \pm {{{4.0}}^{{{\text{b,c}}}}}}}$ |
| 18:2n-6 | $\frac{{0.9 \pm 0.2}}{{1.2 \pm 0.1}}$ |  |
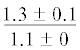 |
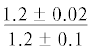 |
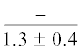 |
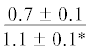 |
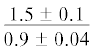 |
 |
 |
$\frac{ - }{{1.4 \pm 0.5}}$ |
| 20:4n-6 | $\frac{0}{{0.1 \pm 0.1}}$ | 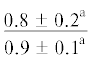 |
 |
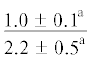 |
 |
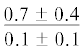 |
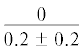 |
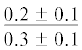 |
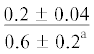 |
$\frac{ - }{{0.9 \pm 0.3}}$ |
| ∑ n-6 ПНЖК | $\frac{{0.9 \pm 0.2}}{{2.6 \pm 0.4{\kern 1pt} *}}$ |  |
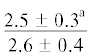 |
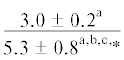 |
. |
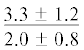 |
 |
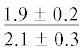 |
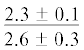 |
$\frac{ - }{{3.2 \pm 0.5}}$ |
| 18:3n-3 | $\frac{{0.4 \pm 0.2}}{{0.7 \pm 0.2}}$ | 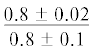 |
$\frac{{0.6 \pm 0.1}}{{0.8 \pm 0.1}}$ | 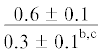 |
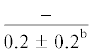 |
$\frac{0}{{0.5{\text{ }} \pm {\text{ }}0.1}}$ | 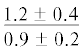 |
 |
 |
$\frac{ - }{{0.4 \pm {{{0.1}}^{{{\text{b,c}}}}}}}$ |
| 18:4n-3 | $\frac{{1.0 \pm 0.5}}{{1.1 \pm 0.1}}$ | 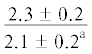 |
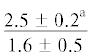 |
 |
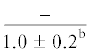 |
 |
 |
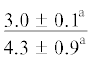 |
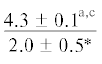 |
$\frac{ - }{{2.2 \pm 0.6}}$ |
| 20:5n-3 | $\frac{{2.5 \pm 1.5}}{{5.4 \pm 0.5*}}$ | 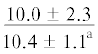 |
 |
 |
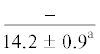 |
 |
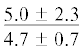 |
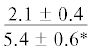 |
$\frac{{2.8 \pm 0.2}}{{4.8 \pm 1.1}}$ | $\frac{ - }{{7.0 \pm 1.8}}$ |
| 22:5n-3 | $\frac{{7.3 \pm 2.1}}{{5.1 \pm 1.2{\kern 1pt} *}}$ |  |
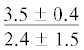 |
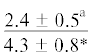 |
$\frac{ - }{{4.6 \pm 0.8}}$ | 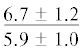 |
 |
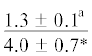 |
$\frac{{0.9 \pm {{{0.2}}^{{\text{a}}}}}}{{1.7 \pm {{{0.4}}^{{{\text{a,b,c}}}}}}}$ | $\frac{ - }{{1.2 \pm {{{0.2}}^{{{\text{a,b,c}}}}}}}$ |
| 22:6n-3 | $\frac{{4.2 \pm 2.7}}{{11.0 \pm 1.2{\kern 1pt} *}}$ |  |
 |
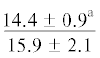 |
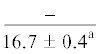 |
 |
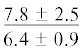 |
 |
$\frac{{3.7 \pm {{{0.2}}^{{\text{c}}}}}}{{3.6 \pm {{{0.6}}^{{\text{c}}}}}}$ | $\frac{ - }{{4.4 \pm {{{0.6}}^{{\text{c}}}}}}$ |
| ∑ n-3 ПНЖК | $\frac{{15.5 \pm 4.3}}{{23.5 \pm 1.9{\kern 1pt} *}}$ |  |
 |
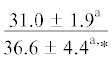 |
 |
 |
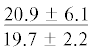 |
 |
$\frac{{12.8 \pm 0.5}}{{17.0 \pm {{{1.8}}^{{\text{c}}}}}}$ | $\frac{ - }{{15.8 \pm {{{2.4}}^{{\text{c}}}}}}$ |
| ∑ ПНЖК | $\frac{{16.5 \pm 4.3}}{{26.1 \pm 1.8{\kern 1pt} *}}$ | 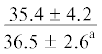 |
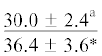 |
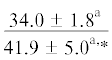 |
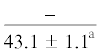 |
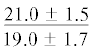 |
 |
 |
$\frac{{15.7 \pm {{{0.5}}^{{\text{a}}}}}}{{17.0 \pm {{{1.8}}^{{\text{c}}}}}}$ | $\frac{ - }{{20.3 \pm 2.9}}$ |
| ∑ n-3/∑ n-6 | $\frac{{11.2 \pm 2.7}}{{10.3 \pm 2.5}}$ | $\frac{{12.2 \pm 2.3}}{{11.2 \pm 0.8}}$ | 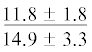 |
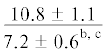 |
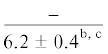 |
 |
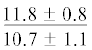 |
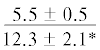 |
$\frac{{5.7 \pm 0.3}}{{5.0 \pm {{{0.3}}^{{{\text{b,c}}}}}}}$ | $\frac{ - }{{5.0 \pm {{{0.4}}^{{{\text{b,c}}}}}}}$ |
| 18:3n-3/18:2n-6 | $\frac{{0.3 \pm 0.1}}{{0.6 \pm 0.2}}$ | $\frac{{0.7 \pm 0.2}}{{0.7 \pm 0.03}}$ |  |
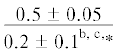 |
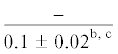 |
 |
 |
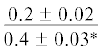 |
$\frac{{0.2 \pm 0.02}}{{0.5 \pm 0.07}}$ | $\frac{ - }{{0.5 \pm 0.2}}$ |
| 16:0/18:1n-9 | $\frac{{3.3 \pm 0.4}}{{2.7 \pm 0.3}}$ | $\frac{{2.7 \pm 0.04}}{{2.3 \pm 0.3}}$ | $\frac{{3.9 \pm 0.2}}{{2.8 \pm 0.2{\kern 1pt} *}}$ | 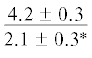 |
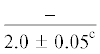 |
 |
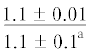 |
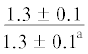 |
$\frac{{1.4 \pm 0.03}}{{1.3 \pm {{{0.04}}^{{{\text{a,}}}}}{\kern 1pt} *}}$ | $\frac{ - }{{0.9 \pm {{{0.1}}^{{{\text{a,c,d}}}}}}}$ |
| 22:1n-11/20:1n-9 | $\frac{{0.2 \pm 0.02}}{{0.4 \pm 0.08}}$ | $\frac{{0.2 \pm 0.04}}{{0.3 \pm 0.07}}$ | $\frac{{0.3 \pm 0.02}}{{0.14 \pm 0.02}}$ | $\frac{{0.3 \pm 0.02}}{{0.4 \pm 0.1}}$ | $\frac{ - }{{0.4 \pm 0.1}}$ | $\frac{{0.6 \pm 0.1}}{{0.8 \pm 0.2}}$ | $\frac{{0.8 \pm 0.1}}{{0.7 \pm 0.1}}$ | $\frac{{0.8 \pm 0.1}}{{0.6 \pm 0.1}}$ | $\frac{{0.8 \pm 0.1}}{{1.1 \pm {{{0.1}}^{{{\text{b,c,*}}}}}}}$ | $\frac{ - }{{1.1 \pm {{{0.1}}^{{{\text{b,c}}}}}}}$ |
Примечание. НЖК, МНЖК, ПНЖК – ненасыщенные, мононенасыщенные и полиненасыщенные жирные кислоты; над чертой – значения показателей у рыб из Конгсфьорда, под чертой – у рыб из Рипфьорда. Отличия достоверны при p ≤ 0.05 от молоди на стадии развития: aL1, bL2, cL3, dL4; *в сравнении с Конгсфьордом. “–” – данные отсутствуют.
ОБСУЖДЕНИЕ
Результаты исследования показали понижение содержания НЖК и ПНЖК и повышение МНЖК в процессе роста и развития молоди L. maculatus в Конгсфьорде и Рипфьорде в летний период. Сходная тенденция в динамике ЖК ОЛ была ранее выявлена для молоди лептоклина из Конгсфьорда, выловленной в зимний период (Пеккоева и др., 2019), что позволяет выделить онтогенетические закономерности изменения данных групп ЖК в раннем развитии лептоклина в акватории арх. Шпицберген. Установленное высокое содержание НЖК и ПНЖК в составе ФЛ подтверждает их важное значение на ранних стадиях развития молоди лептоклина как структурных молекул в составе биомембран. ПНЖК участвуют в регуляции биофизических свойств – обеспечивают их морфологическую стабильность и способствуют повышению текучести, тем самым поддерживают работу мембраносвязанных белков и их комплексов, обеспечивая их транспортную и рецепторную активность при понижении температуры окружающей среды. В то же время НЖК наряду с холестерином, наоборот, способствуют повышению микровязкости биомембран (Sargent et al., 1995, 2002; Tocher, 2003). Более высокий уровень ПНЖК в ФЛ у молоди лептоклина из Рипфьорда может указывать на адаптивные изменения в биомембранах мышц в ответ на более низкие значения температуры. ПНЖК необходимы для развития нервной и зрительной систем, пигментации молодого организма, могут выступать в качестве источника метаболической энергии в раннем онтогенезе рыб (Шатуновский, 1980; Sargent et al., 2002; Tocher, 2003; Parrish, 2009; Antonny et al., 2015). Определение спектра ЖК липидов и динамики их содержания у молоди рыб представляется важным для понимания их роли в метаболических процессах в ходе роста и развития организма (Мурзина и др., 2009; Мурзина, 2010; Немова и др., 2015).
Высокое содержание ПНЖК семейства n-3 в мышцах молоди лептоклина за счёт ДГК и ЭПК является отличительной эколого-биохимической характеристикой морских холодноводных рыб, к которым относится и исследуемый вид. Выявленное более высокое содержание ПНЖК семейства в ФЛ, чем в ТАГ, на всех стадиях развития лептоклина в исследованных фьордах указывает на специфичность жирнокислотного состава классов липидов согласно выполняемой ими функции в определённых условиях среды. При этом следует отметить более высокий показатель соотношения суммарных ПНЖК n-3/n-6 (до 12 у лептоклина из Конгсфьорда и до 16 – из Рипфьорда) по сравнению с другими видами морских рыб, например из Тихого океана, у которых он варьирует от 5 до 8 (Murillo et al., 2014).
Повышение содержания МНЖК у молоди лептоклина на поздних стадиях развития (L3 и L4) связано с накоплением в процессе питания рыб запасных липидов (ТАГ) (Немова и др., 2021), в которые, как правило, включаются эти ЖК и могут быть использованы в качестве источников энергии (Sargent et al., 1995; Lloret et al., 2014). Следует отметить, что изменение в составе ЖК (доминирование МНЖК) у лептоклина пятнистого из Конгсфьорда происходит со стадии развития L3, тогда как у рыб из Рипфьорда – только со стадии L4. Различия в сравнительно более медленном накоплении запасных липидов (Немова и др., 2021) и их жирнокислотных компонентов (показано в этой работе) у молоди лептоклина изученных стадий развития из Рипфьорда могут быть связаны с вероятной ограниченной доступностью их кормовых объектов (зоопланктона), присутствие и обилие которых зависят от влияния водных масс, ледового покрова, периодов вегетации фитопланктона и развития зоопланктона в этом высокоарктическом заливе. Конгсфьорд, являясь модельным фьордом для проведения многих биологических исследований, находится под влиянием как арктических водных масс и пресных вод его ледников, так и тёплых солёных атлантических вод (Cottier, 2005). В то время как высокоарктический Рипфьорд подвергается сильному влиянию холодных и пресных арктических вод, и потому может быть покрыт льдом до восьми месяцев в году (Wang et al., 2013).
Сравнительный анализ содержания отдельных МНЖК у молоди лептоклина из Рипфьорда и Конгсфьорда позволил выявить некоторые трофоэкологические взаимоотношения вида со средой обитания. В мышцах рыб из Конгсфьорда в летний период показано значительное повышение 20:1n-9, 22:1n-11 со стадии развития L2 к стадии L5. Сходный тренд был отмечен для молоди в зимний период (Pekkoeva et al., 2020). Также установлено, что 20:1n-9 и 22:1n-11 включаются в основном в структуру ТАГ, как и другие, имеющие пищевое происхождение ЖК. Известно, что поступающие с кормом МНЖК преобладают в ТАГ у морских рыб (Thunnus spp., Salmo spp.), занимая позиции sn-1 и sn-3 (Zhang et al., 2018). Полученные нами данные указывают на питание лептоклина веслоногими ракообразными (Copepoda) рода Calanus, которые способны синтезировать 20:1n-9 и 22:1n-11 de novo (Kattner, Hagen, 1995; Lee et al., 2006; Graeve et al., 2008). По данным отчёта зоопланктонологов (Arctic Marine Zooplankton, 2018), работавших параллельно в научном рейсе, в точках сбора проб в Конгсфьорде и Рипфьорде одними из массовых среди веслоногих ракообразных рода Calanus были арктический C. glacialis и атлантический C. finmarchicus. Глубоководный вид C. hyperboreus встречался в небольших количествах.
В мышцах молоди лептоклина из Рипфьорда в отличие от рыб из Конгсфьорда в процессе роста и развития в составе ТАГ не происходит значительного повышения содержания 20:1n-9 и 22:1n-11 и, кроме того, показано более высокое содержание других кислот – 18:1n-9, 18:1n-7 и 16:1n-7 (особенно у молоди на стадиях развития L4 и L5). Следует отметить, что показатель соотношения 22:1n-11/20:1n-9 в ТАГ изменяется в процессе роста и развития молоди из Рипфьорда. На стадиях L1–L3 он составляет 0.6–0.8, а на L4 и L5 – 1.1. Значения соотношения этих кислот у представителей рода Calanus различаются следующим образом: C. finmarchicus (<1) < C. glacialis (≤1) < C. hyperboreus (>1) (Scott et al., 2002). Полученные нами данные могут указывать на присутствие копепод C. hyperboreus в питании придонной молоди лептоклина в Рипфьорде в отличие от молоди в Конгсфьорде, у которой вышеуказанное соотношение не превышало 0.8. Повышение содержания ЖК 22:1n-11 и 20:1n-9 в процессе развития только у молоди лептоклина из Конгсфьорда может свидетельствовать о возможной избирательности в отношении объектов питания (Copepoda), их доступностью и обилием в этом заливе в отличие от Рипфьорда. Идентификация корма рыбами обычно происходит по особым химическим или визуальным раздражителям. Некоторые метаболиты – свободные аминокислоты, нуклеотиды, нуклеозиды и основания аммония, выделяемые организмами, являющимися добычей молодых морских и пресноводных рыб, – считаются мощными индукторами их пищевого поведения (Kolkovski, 2008).
Более высокое содержание жирных кислот 18:1n-9, 18:1n-7 и 16:1n-7 у молоди лептоклина из Рипфьорда, особенно на переходной (L4) и придонной (L5) стадиях развития, может быть связано с их дополнительным поступлением при питании. Так, ЖК 18:1n-9 может синтезироваться в организме рыб, но значимые её количества также поступают и с кормовыми объектами, в том числе с зоопланктоном (Tocher, 2003; Dalsgaard et al., 2003). Наряду с веслоногими ракообразными рода Calanus массовыми в точках сбора проб в летний период также были веслоногие ракообразные Oithona similis (Oithonidae). Эти мелкие ракообразные из акватории арх. Шпицберген в течение всего года характеризуются высоким содержанием кислоты 18:1n-9 (Lischka, Hagen, 2007). Взрослые особи лептоклина пятнистого, ведущие придонный образ жизни, имеют высокое содержание МНЖК 18:1n-9, 18:1n-7 и 16:1n-7 (Мурзина, 2010) за счёт питания преимущественно мелкими ракообразными и полихетами, характеризующимися высоким количеством этих кислот, которые поступают с планктоном и бактериями при питании (Dalsgaard et al., 2003). Для морских полихет холодных вод, например Pectinaria gouldii, показано повышенное содержание ЖК 16:1n-7, поступающей по пищевой цепи от диатомовых водорослей (Copeman, Parrish, 2003). Высокое содержание 16:1n-7 обнаружено у ледовых диатомовых водорослей Nitzschia frigida в Конгсфьорде (McMahon et al., 2006). Соответственно ЖК 18:1n-9, 16:1n-7 и 18:1n-7 могут поступать дополнительно в организм молоди лептоклина в Рипфьорде по пищевой цепи с зоопланктоном или в составе бактериальной массы. Можно также предположить, что уже на стадиях развития L4 и L5 молодь лептоклина из Рипфьорда (как и взрослые особи) начинает питаться полихетами, с которыми поступают указанные ЖК.
Таким образом, полученные данные по содержанию ЖК ОЛ, а также структурных ФЛ и запасных ТАГ на разных стадиях развития молоди лептоклина пятнистого позволили выявить динамику содержания ЖК в раннем постэмбриональном развитии вида в летний период, а также установить специфические особенности жирнокислотного профиля молоди из Конгсфьорда и Рипфьорда в зависимости от условий окружающей среды (температуры и, в особенности, кормовой базы). У молоди лептоклина из Рипфьорда по сравнению с рыбами из Конгсфьорда в процессе роста и развития не повышается содержание жирных кислот 20:1n-9 и 22:1n-11, биомаркерных для калянусов. Также у молоди из Рипфьорда на стадиях развития L4 и L5 отмечено более высокое содержание других кислот – 18:1n-9, 18:1n-7 и 16:1n-7. Полученные данные указывают на различия в питании молоди лептоклина в исследованных заливах и отражают трофоэкологические взаимоотношения вида со средой обитания.
Список литературы
Воронин В.П., Мурзина С.А., Нефедова З.А. и др. 2021. Сравнительно-видовая характеристика липидов и их динамика в процессе эмбрионального и раннего постэмбрионального развития атлантического лосося (Salmo salar L.) и кумжи (Salmo trutta L.) // Онтогенез. Т. 52. № 2. С. 108–119. https://doi.org/10.31857/S0475145021020099
Кабаков Р.И. 2014. R в действии. Анализ и визуализация данных в программе R. М.: ДМК Пресс, 588 с.
Кауфман З.С. 2015. Адаптация гидробионтов к существованию в условиях высоких широт // Тр. КарНЦ РАН. № 1. С. 3–19. https://doi.org/10.17076/eco6
Мурзина С.А. 2010. Роль липидов и их жирнокислотных компонентов в биохимических адаптациях люмпена пятнистого Leptoclinus maculatus F. северо-западного побережья о. Шпицберген: Автореф. дис. … канд. биол. наук. Петрозаводск: КГПА, 26 с.
Мурзина С.А. 2019. Роль липидов и их жирнокислотных компонентов в эколого-биохимических адаптациях рыб северных морей: Автореф. дис. … докт. биол. наук. М.: ИПЭЭ РАН, 46 с.
Мурзина С.А., Нефедова З.А., Руоколайнен Т.Р. и др. 2009. Динамика содержания липидов в процессе раннего развития пресноводного лосося Salmo salar L. // Онтогенез. Т. 40. № 3. С. 208–214.
Нельсон Дж.С. 2009. Рыбы мировой фауны. М.: Либроком, 880 с.
Немова Н.Н., Нефедова З.А., Мурзина С.А. и др. 2015. Влияние экологических условий обитания на динамику жирных кислот у молоди атлантического лосося (Salmo salar L.) // Экология. № 3. С. 206–206. https://doi.org/10.7868/S0367059715030087
Немова Н.Н., Рендаков Н.Л., Пеккоева С.Н. и др. 2018. Динамика уровня эстрадиола в ходе метаморфоза люмпена пятнистого (Leptoclinus maculatus, Fries, 1838), о-в Западный Шпицберген // Докл. РАН. Т. 482. № 2. С. 228–230. https://doi.org/10.31857/S086956520003209-2
Немова Н.Н., Пеккоева С.Н., Воронин В.П. и др. 2021. Сравнительное исследование содержания липидов у молоди Leptoclinus maculatus из Конгсфьорда и Рипфьорда арх. Шпицберген // Там же. Т. 501. С. 563–568. https://doi.org/10.31857/S2686738921060135
Пеккоева С.Н. 2018. Изменение липидного состава мышц и липидного мешка представителя арктической ихтиофауны люмпена пятнистого Leptoclinus maculatus в постэмбриональном развитии: Автореф. дис. … канд. биол. наук. СПб.: ИЭФБ РАН, 23 с.
Пеккоева С.Н., Мурзина С.А., Нефедова З.А. и др. 2017. Экологическая роль липидов и жирных кислот в раннем постэмбриональном развитии люмпена пятнистого Leptoclinus maculatus (Fries, 1838) из Конгсфьорда (о. Западный Шпицберген) в зимний период // Экология. № 3. С. 186–190. https://doi.org/10.7868/S0367059717030131
Пеккоева С.Н., Мурзина С.А., Нефедова З.А. и др. 2019. Жирнокислотный состав структурных и энергетических липидов мышц молоди люмпена пятнистого Leptoclinus maculatus (Fries, 1838) из Конгсфьорда (арх. Шпицберген) // Журн. эвол. биохимии и физиологии. Т. 55. № 2. С. 97–103. https://doi.org/10.1134/S0044452919020086
Цыганов Э.П. 1971. Метод прямого метилирования липидов после ТСХ без элюирования с силикагелем // Лаб. дело. № 8. С. 490–493.
Шатуновский М.И. 1980. Экологические закономерности обмена веществ морских рыб. М.: Наука, 283 с
Antonny B., Vanni S., Shindou H., Ferreira T. 2015. From zero to six double bonds: phospholipid unsaturation and organelle function // Trends Cell Biol. V. 25. № 7. P. 427–436. https://doi.org/10.1016/j.tcb.2015.03.004
Arctic Marine Zooplankton. 2018. AB320/820 Cruise report 2018 / Ed. Daase M. Svalbard: UNIS, 116 p.
Berge J., Daase M., Renaud P.E. et al. 2015. Unexpected levels of biological activity during the polar night offer new perspectives on a warming Arctic // Curr. Biol. V. 25. № 19. P. 2555–2561. https://doi.org/10.1016/j.cub.2015.08.024
Copeman L.A., Parrish C.C. 2003. Marine lipids in a cold coastal ecosystem: Gilbert Bay, Labrador // Mar. Biol. V. 143. №. 6. P. 1213–1227. https://doi.org/10.1007/s00227-003-1156-y
Cottier F. 2005. Water mass modification in an Arctic fjord through cross-shelf exchange: the seasonal hydrography of Kongsfjorden, Svalbard // J. Geophys. Res. Oceans. V. 110. № C12. Article C12005. https://doi.org/10.1029/2004JC002757
Dalsgaard J., St John M., Kattner G. et al. 2003. Fatty acid trophic markers in the pelagic marine environment // Adv. Mar. Biol. V. 46. P. 225–340. https://doi.org/10.1016/S0065-2881(03)46005-7
Falk-Petersen S., Falk-Petersen I.-B., Sargent J.R. 1986. Structure and function of an unusual lipid storage organ in the Arctic fish Lumpenus maculatus Fries // Sarsia. V. 71. № 1. P. 1–6. https://doi.org/10.1080/00364827.1986.10419666
Falk-Petersen S., Hopkins C.E., Sargent J.R. 1990. Trophic relationships in the pelagic, arctic food web // Proc. 24th European Mar. Biol. Symp. “Trophic relationships in the Marine Environment”. Aberdeen: AUP. P. 315–333.
Folch J., Lees M., Sloan-Stanley G.H. 1957. A simple method for the isolation and purification of total lipids animal tissue (for brain, liver and muscle) // J. Biol. Chem. V. 226. № 1. P. 497–509. https://doi.org/10.1016/s0021-9258%2818%2964849-5
Graeve M., Lundberg M., Boer M. et al. 2008. The fate of dietary lipids in the Arctic ctenophore Mertensia ovum (Fabricius, 1780) // Mar. Biol. V. 153. № 4. P. 643–651. https://doi.org/10.1007/s00227-007-0837-3
Kattner G., Hagen W. 1995. Polar herbivorous copepods – different pathways in lipid biosynthesis // J. Mar. Sci. V. 52. № 3–4. P. 329–335. https://doi.org/10.1016/1054-3139(95)80048-4
Kolkovski S. 2008. Advances in marine fish larvae diets // Proc. IX Simposio Internacional de Nutrición Acuícola “Avances en Nutrición Acuícola IX”. Monterrey: Universidad Autónoma de Nuevo León. P. 20–45.
Lee R., Hagen W., Kattner G. 2006. Lipid storage in marine zooplankton // Mar. Ecol. Prog. Ser. V. 307. P. 273–306. https://doi.org/10.3354/meps307273
Lischka S., Hagen W. 2007. Seasonal lipid dynamics of the copepods Pseudocalanus minutus (Calanoida) and Oithona similis (Cyclopoida) in the Arctic Kongsfjorden (Svalbard) // Mar. Biol. V. 150. № 3. P. 443–454. https://doi.org/10.1007/s00227-006-0359-4
Lloret J., Shulman G., Malcolm Love R. 2014. Conditions and health indicators of exploited marine fish. Oxford: Wiley Blackwell, 262 p.
McMahon K.W., Ambrose Jr.W.G., Johnson B.J. et al. 2006. Benthic community response to ice algae and phytoplankton in Ny Ålesund, Svalbard // Mar. Ecol. Prog. Ser. V. 310. P. 1–14. https://doi.org/10.3354/meps310001
Mecklenburg C.W., Møller P.R., Steinke D. 2011. Biodiversity of arctic marine fishes: taxonomy and zoogeography // Mar. Biodivers. V. 41. № 1. P. 109–140. https://doi.org/10.1007/s12526-010-0070-z
Meyer Ottesen C.A., Haakon H., Schou Christiansen J., Falk-Petersen S. 2011. Early life history of the daubed shanny (Teleostei: Leptoclinus maculatus) in Svalbard waters // Ibid. V. 41. № 3. P. 383–394. https://doi.org/10.1007/s12526-010-0079-3
Murzina S.A., Pekkoeva S.N., Kondakova E.A. et al. 2020. Tiny but Fatty: Lipids and Fatty Acids in the Daubed Shanny (Leptoclinus maculatus), a Small Fish in Svalbard Waters // Biomolecules. V. 10. № 3. Article 368. https://doi.org/10.3390/biom10030368
Murillo E., Rao K.S., Armando A.D. 2014. The lipid content and fatty acid composition of four eastern central Pacific native fish species // J. Food Compos. Anal. V. 33. № 1. P. 1–5. https://doi.org/10.1016/j.jfca.2013.08.007
Parrish C.C. 2009. Essential fatty acids in aquatic food webs // Lipids in aquatic ecosystems. N.Y.: Springer. P. 309–326.
Pekkoeva S.N., Murzina S.A., Nefedova Z.A. et al. 2020. Fatty acid composition of the postlarval daubed shanny (Leptoclinus maculatus) during the polar night // Polar Biol. V. 43. № 6. P. 657–664. https://doi.org/10.1007/s00300-020-02669-4
R Core Team. 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria. http://www.r-project.org/index.html. Version 12/2021
Sargent J.R., Bell J.G., Bell M.V. et al. 1995. Dietary origins and functions of longchain (n–3) polyunsaturated fatty acids in marine fish // J. Mar. Biotechnol. V. 3. № 1. P. 26–28
Sargent J.R., Tocher D.R., Bell J.G. 2002. The lipids // Fish Nutrition. San Diego: Academic Press. P. 181–257.
Scott C.L., Kwasniewski S., Falk-Petersen S., Sargent J.R. 2002. Species differences, origins and functions of fatty alcohols and fatty acids in the wax esters and phospholipids of Calanus hyperboreus, C. glacialis and C. finmarchicus from Arctic waters // Mar. Ecol. Prog. Ser. V. 235. P. 127–134. https://doi.org/10.3354/meps235127
Tocher D.R. 2003. Metabolism and functions of lipids and fatty acids in teleost fish // Rev. Fish. Sci. V. 11. № 2. P. 107–184. https://doi.org/10.1080/713610925
Wang C., Shi L., Gerland S. et al. 2013. Spring sea-ice evolution in Rijpfjorden (80 N), Svalbard, from in situ measurements and ice mass-balance buoy (IMB) data // Ann. Glaciol. V. 54. № 62. P. 253–260. https://doi.org/10.3189/2013AoG62A135
Zhang H., Zhao H., Zhang Y. et al. 2018. Characterization of positional distribution of fatty acids and triacylglycerol molecular compositions of marine fish oils rich in omega-3 polyunsaturated fatty acids // BioMed Res. Int. V. 2018. Article ID 3529682. https://doi.org/10.1155/2018/3529682
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


