Вопросы ихтиологии, 2022, T. 62, № 5, стр. 610-620
Эмбрионально-личиночное развитие и некоторые данные по репродуктивной биологии Cantherhines pardalis (Monacanthidae) из Южно-Китайского моря (Центральный Вьетнам)
А. М. Шадрин 1, *, Н. Г. Емельянова 1
1 Московский государственный университет
Москва, Россия
* E-mail: shadrin-mail@mail.ru
Поступила в редакцию 13.10.2021
После доработки 08.11.2021
Принята к публикации 09.11.2021
- EDN: NXEZKH
- DOI: 10.31857/S0042875222050216
Аннотация
Исследованы биологические характеристики и состояние гонад половозрелых Cantherhines pardalis. Для получения зрелых половых продуктов использовали двукратные гормональные инъекции. В преднерестовом состоянии самки имели низкие значения гонадосоматического индекса (3.2%). Описана ультраструктура яйцевых оболочек. Представлено иллюстрированное детальное морфологическое описание раннего развития C. pardalis от конца бластуляции до стадий, близких к переходу в личиночное состояние. Оплодотворённые яйца имеют сферическую форму, диаметр ~0.51 (0.50–0.53) мм, узкое перивителлиновое пространство, гомогенный, прозрачный, окрашенный в зелёный цвет желток. Желток содержит ~20 почти бесцветных жировых капель размером от ~0.01 до ~0.13 мм. Продолжительность инкубационного периода при температуре ~ 25°C составляет ~33 ч. При вылуплении предличинки имеют длину 1.70–1.75 мм. Появление перистальтики и начало подвижного состояния челюстного аппарата и грудных плавников отмечено в начале 4-х сут (76 ч) после вылупления.
Сотовый кантерин Cantherhines pardalis (Rüppell, 1837) распространён в Индо-Пацифике (на западе от Красного моря до Южной Африки и на восток до Южной Японии и Юго-Восточной Океании) и в Восточной Атлантике (Гвинейский залив, остров Аннобон, южное побережье Африки) (Froese, Pauly, 2021). C. pardalis – один из 11 видов рода, входящего в семейство Monacanthidae отряда Tetraodontiformes. Это семейство таксономически разнообразно, включает 27 родов и 108 видов и является вторым по числу в отряде, включающем 10 семейств, 105 родов, 435 видов (Fricke et al., 2021).
Изучению особенностей нерестового поведения представителей семейства посвящено значительное число работ. Однако данные по раннему онтогенезу опубликованы только для девяти видов, представляющих меньше трети родов семейства: Thamnaconus modestus (Kitajima et al., 1964 – цит. по: Kawase, Nakazono, 1994a), Stephanolepis cirrhifer (Fujita, 1955 – цит. по: Kawase, Nakazono, 1994a), Aluterus monoceros (Imura et al., 1986 – цит. по: Kawase, Nakazono, 1994a), Oxymonacanthus longirostris (Barlow, 1987), Paramonacanthus japonicus (Nakazono, Kawase, 1993; Kawase, Nakazono, 1994a), Brachaluteres ulvarum (Akagawa et al., 1995), B. jacksonianus (Kawase, 2005), Rudarius ercodes (Kawase, Nakazono, 1994a), Eubalichthys bucephalus (Kawase, 2008). В некоторых из этих публикаций данные о раннем развитии ограничены описанием деталей строения яиц исследованных видов. Учитывая значительный объём семейства, имеющихся данных недостаточно для формирования полного представления о закономерностях протекания раннего развития Monacanthidae.
Данные об ультраструктуре яйцевых оболочек у представителей Monacanthidae и полноценные сведения по раннему развитию представителей рода Cantherhines отсутствуют, за исключением краткого текстового описания одной стадии развития эмбрионов C. pardalis из фиксированных яиц, собранных на естественных нерестилищах (Kawase, Nakazono, 1994b).
Цель работы – выяснить особенности эмбрионально-личиночного развития и репродуктивной биологии C. pardalis, провести оценку состояния гонад взрослых особей, изучить ультраструктуру оболочек зрелых ооцитов.
МАТЕРИАЛ И МЕТОДИКА
Исследования выполнены в марте 2007 г. на базе Приморского отделения Российско-вьетнамского тропического центра (г. Нячанг, СРВ). Половозрелых особей C. pardalis покупали у местных рыбаков, отлавливавших их в заливе Нячанг (Южно-Китайское море). Время от отлова до доставки рыбы в лабораторию составляло несколько часов. Рыб содержали в садках размером 80 × 80 × 100 см, установленных в бетонных бассейнах объёмом 3 м3. Вода в каждом бассейне циркулировала через биофильтр (4–8 м3/ч). Температура воды в бассейнах составляла 25–27°C, солёность ~ 33‰.
Всем особям (20 экз.) в качестве гормонального препарата, стимулирующего созревание половых продуктов, вводили сурфагон (LH-RH-a) – синтетический аналог гипоталамического рилизинг-гормона млекопитающих (люлиберина). Инъекции сурфагона в сочетании с нейролептиком эглонилом проводили в полость тела под грудным плавником двукратно с интервалом 17 ч. В 1-й (предварительной) инъекции доза сурфагона составляла 5 мкг/кг, эглонила – 5 мг/кг; во 2-й (разрешающей) – соответственно 20 и 15 мг/кг. От четырёх самок овулировавшие ооциты были получены через 22 ч, от трёх – через 25 ч. Искусственное осеменение проводили, смешивая ооциты с измельчёнными семенниками двух самцов и эякулятом, полученным от одного из них. Через несколько минут полученную смесь заливали морской водой солёностью ~ 33‰ и температурой ~25°C.
Биологический анализ, проведённый на инъецированных рыбах, от которых не удалось получить зрелые половые продукты, включал измерение стандартной (SL) и полной (TL) длины, массы тела (W), массы тела без внутренностей (w) и массы гонад (g). Для гистологического исследования фрагменты яичников фиксировали в смеси Буэна. Срезы окрашивали по Маллори, обработку и подготовку материала проводили в соответствии со стандартными рекомендациями (Роскин, Левинсон, 1957). Для электронной микроскопии фиксировали фрагменты яичников и овулировавшие ооциты смесью 2.5%-ного раствора глутарового альдегида и 2%-ного параформальдегида на фосфатном буфере при pH 7.4 с добавлением NaСl концентрацией 2.5%. Постфиксацию осуществляли в 1%-ном растворе четырёхокиси осмия. Дальнейшую обработку для сканирующей электронной микроскопии (СЭМ) и трансмиссионной электронной микроскопии (ТЭМ) проводили, используя общепринятые методы (Уикли, 1975). Объекты для СЭМ напыляли сплавом золота с палладием и исследовали в сканирующем электронном микроскопе CamScan S-4 (“Cambridge Instruments”, Великобритания) при ускоряющем напряжении 20 кВ. Ультратонкие срезы просматривали в трансмиссионном электронном микроскопе JEM-1011 (“Jeol”, Япония) при ускоряющем напряжении 80 кВ. Для получения изображений использовали цифровую камеру ES-500W с программным обеспечением Digital Micrograph (“Gatan”, США). Измерения ооцитов проведены по их изображениям с применением программы ImageJ (Wayne Rasband (NIH), США).
Инкубацию оплодотворённых яиц и содержание предличинок и личинок проводили в натуральной морской воде солёностью ~ 33‰ и при температуре 25 ± 1°C. Исследуемый живой материал помещали в стеклянные цилиндрические стаканы объёмом ~ 250 мл с диаметром дна ~70 мм, наполненные водой на 50–60% объёма, которые в период проведения исследования были размещены в полупогруженном состоянии в термостатируемой ёмкости с водой. Плотность посадки составляла ~ 30–50 яиц или предличинок на сосуд. Во время инкубации икры воду меняли один раз в 6–8 ч. После вылупления в течение первых 1–2 ч предличинок пересаживали в сосуд с чистой водой и повторяли такую же операцию каждые последующие сутки.
Описание стадий развития C. pardalis начато через 5 ч после осеменения. В наблюдениях за ранним развитием использована икра, полученная от трёх самок. Сбор материала для описания раннего онтогенеза C. pardalis проведен методом прижизненного наблюдения. Зарисовку живых зародышей и личинок выполняли с использованием рисовального аппарата Карл Цейс (“Carl Zeiss”, Германия). Возраст стадий представлен в минутах и часах. Стадией развития в данной работе считается любой момент развития, обладающий конкретными морфологическими характеристиками, отличающими его от других моментов развития. Ориентирами для определения этапа бластуляции служили результаты исследования Ленца и Тринкауса (Lentz, Trinkaus, 1967). За начало гаструляции принят момент направленных индивидуальных миграций глубоких клеток, приводящих к формированию зародышевого кольца и зародышевого щитка (Ballard, 1973a, 1973b). Периоды развития выделены в соответствии с представлениями Расса (1946).
РЕЗУЛЬТАТЫ
Биологические показатели и состояние гонад половозрелых особей
Самки, от которых не удалось получить овулировавшие ооциты, имели яичники IV–V стадии зрелости и низкие значения гонадосоматического индекса (ГСИ), остальные показатели были ниже, чем у самцов (табл. 1). Ооцитов, находившихся на стадии созревания, было очень мало. В яичниках также присутствовали ооциты разных фаз периодов пре- и вителлогенеза. В клетках, вступивших в период вителлогенеза, размер которых составлял 70–145 мкм, присутствовали липидные капли. В мелких ооцитах они были распределены преимущественно в околоядерной цитоплазме, в более крупных – значительно шире и занимали больший объем (рис. 1а). Ооциты, находившиеся в процессе активного накопления желтка, имели размер 166–190 мкм, а завершающие вителлогенез – 224–289 мкм. Диаметр ооцитов периода созревания, у которых начиналась гомогенизация цитоплазмы, слияние гранул желтка и липидосодержащих вакуолей, составлял 298–350 мкм.
Таблица 1.
Биологические показатели Cantherhines pardalis
| Пол (число рыб, экз.) |
Длина, мм | Масса, г | ГСИ, % |
|||
|---|---|---|---|---|---|---|
| TL | SL | W | w | g | ||
| Самки (5) |  |
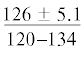 |
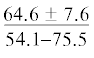 |
$\frac{{55.3 \pm 6.4}}{{47.9{\kern 1pt} - {\kern 1pt} 65.5}}$ | $\frac{{1.71 \pm 0.25}}{{1.34{\kern 1pt} - {\kern 1pt} 2.0}}$ | $\frac{{3.12 \pm 0.48}}{{2.50{\kern 1pt} - {\kern 1pt} 3.64}}$ |
| Самцы (5) | $\frac{{162 \pm 3.8}}{{157{\kern 1pt} - {\kern 1pt} 167}}$ | $\frac{{142 \pm 3.4}}{{137{\kern 1pt} - {\kern 1pt} 145}}$ | $\frac{{87.5 \pm 4.4}}{{81.1{\kern 1pt} - {\kern 1pt} 92.5}}$ | $\frac{{77.7 \pm 5.6}}{{70.6{\kern 1pt} - {\kern 1pt} 84.5}}$ | $\frac{{0.15 \pm 0.03}}{{0.12{\kern 1pt} - {\kern 1pt} 0.19}}$ | $\frac{{0.19 \pm 0.03}}{{0.16{\kern 1pt} - {\kern 1pt} 0.22}}$ |
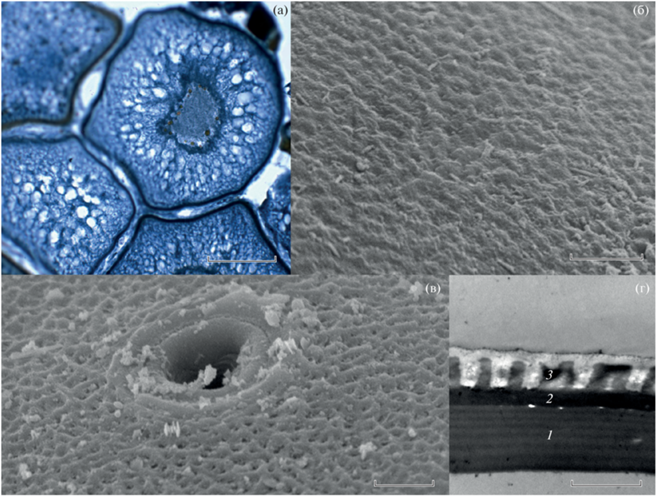
Рис. 1.
Фрагмент яичника с ооцитами в процессе накопления липидных включений (TL 145 мм, стадия зрелости гонад IV−V, ГСИ 3.6%, окраска по Маллори) (а); ультраструктура яйцевых оболочек (поверхности хориона) Cantherhines pardalis (б) и поверхности овулировавшего ооцита (в области микропиле видны кольцевые валики и образования, напоминающие поры) (в); поперечный срез яйцевой оболочки (г): 1 – внутренний слой лучистой оболочки, 2 – наружный слой, 3 – хорион. Масштаб, мкм: а – 30 (световая микроскопия); б, в – 3 (сканирующая электронная микроскопия); г – 2 (трансмиссионная электронная микроскопия).
Гонады четырёх из пяти обследованных самцов находились на IV стадии зрелости, у одного – на IV–V. При помещении фрагментов семенников IV стадии в воду сперматозоиды, выделяющиеся из них, оставались неподвижными, а эякулят не был сформирован. В эякуляте более зрелого самца присутствовали сперматозоиды, которые активировались водой и сохраняли подвижность в течение ~30 с.
Ультраструктура оболочек овулировавших ооцитов
Сканирующая электронная микроскопия. Поверхность хориона овулировавшего ооцита имеет слабовыраженную складчатость (рис. 1б). Входное отверстие микропиле составляет в диаметре ~ 3 мкм, его наружный край представлен слабо выраженным кольцевым валиком шириной ~ 1 мкм. Снаружи к нему примыкает ещё одно аналогичное образование. На электронограмме видно, что в верхней части канал микропиле заметно расширен и суживается примерно к средней части до ~ 2 мкм. Вокруг микропиле в радиусе ~ 3–5 мкм присутствуют образования, напоминающие поры, которые отсутствуют на остальных участках поверхности ооцита (рис. 1в).
Трансмиссионная электронная микроскопия. Яйцевые оболочки представлены лучистой оболочкой (zona radiata) и хорионом. Zona radiata имеет толщину ~ 2.5 мкм и состоит из наружного (толщиной ~ 0.6 мкм) и внутреннего (~1.9 мкм) слоёв. На электронограмме поперечного среза оболочки яйца (рис. 1г) наружный слой представлен как значительно более электронно-плотный и почти однородный, а внутренний – как имеющий отчётливую структурированность, выраженную в виде перемежающихся полос (шесть с высокой электронной плотностью и семь с более низкой).
Хорион, имеет толщину ~ 1.3 мкм. В его гомогенном слое с очень низкой электронной плотностью с внутренней стороны имеются участки нерегулярной прямоугольной формы, отличающиеся значительно более высокой электронной плотностью. Они расположены на расстоянии 0.5–0.6 мкм друг от друга.
Эмбриональный период развития
Яйца C. pardalis имеют сферическую форму. Яйцевые оболочки прозрачные; наружная – хорион – клейкая, толстая, с неструктурированной внешней поверхностью, обладает рассеивающими оптическими свойствами. Желток прозрачный, гомогенный, с хорошо выраженным зеленоватым оттенком, содержащий ~ 20 почти бесцветных с едва заметным желтовато-розовым оттенком жировых капель разного размера (три–четыре крупных диаметром до ~ 0.13 мм и несколько более мелких, до ~ 0.01 мм). Перивителлиновое пространство узкое. После завершения кортикальной реакции и начала процесса агрегации плазмы на анимальном полюсе диаметр яиц в среднем составлял 0.51 ± 0.0024 мм (0.50–0.53 мм, n = 16). Клейкие свойства хориона теряются через несколько часов после оплодотворения. Оплодотворённые яйца приклеиваются друг к другу и к субстрату. После разъединения хорион в местах контактов сохраняет следы деформации, которые влияют на оптические свойства яйцевых оболочек, затрудняя исследование мелких деталей строения зародышей.
Возраст 5 ч 20 мин (рис. 2а). Завершение бластулы и начало гаструляции. Основание бластодиска ровное, плоское, дифференцированный желточный синцитий не выступает за пределы эпителизировавшегося покровного слоя. При механическом разрушении бластодиска глубокие клетки большинства яиц легко диспергируются в отличие от других, у которых взаимная адгезивность значительно выше.
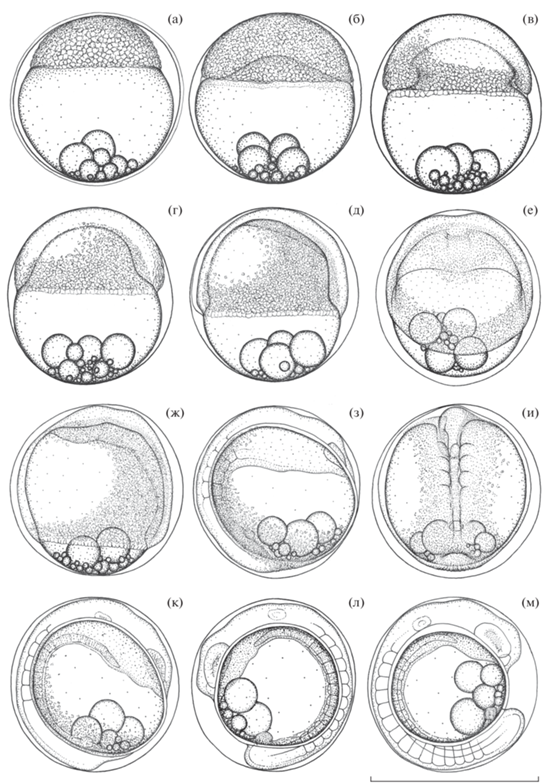
Рис. 2.
Эмбриональное развитие Cantherhines pardalis от завершения бластуляции до начала обособления хвостовой почки: а − поздняя бластула, начало перехода к гаструляции, возраст ~ 5 ч 20 мин; б − гаструляция; в − начало эпиболии; г − эпиболия перидермы ~35−40%; д − эпиболия перидермы ~ 60%, формирование осевого зачатка; е − то же, вид передней части осевого зачатка сверху; ж − эпиболия перидермы ~75%; з − завершение эпиболии, 3–4 пары сомитов; и − то же, вид средней и задней части формирующегося тела зародыша сверху; к − 5–6 пар сомитов, сохраняется остаток зародышевого кольца; л − 10–11 пар сомитов, начало обособления хвостовой почки, максимальное развитие Купферова пузырька; м − 14–15 пар сомитов, начало редукции Купферова пузырька. Масштаб здесь и на рис. 3: 0.5 мм.
Возраст 5 ч 40 мин. Основание зародышевого диска начало прогибаться внутрь. Вершина этого поднятия смещена от центра в вентральный сектор, что является показателем начавшихся центробежных и конвергентных миграций популяции клеток гипобласта к периферии и в дорсальный сектор зародышевого диска. Слой желточного синцития выступает за пределы бластодиска очень узкой полоской.
Возраст 6 ч 00 мин (рис. 2б). Смещённое в вентральный сектор поднятие основания зародышевого диска стало более выраженным. Полоса выступающей на желток части желточного синцития стала шире.
Возраст 7 ч 20 мин (рис. 2в). Продолжается перераспределение клеточного материала внутри зародышевого диска. Отчётливо сформировались зародышевое кольцо и зародышевый щиток. В покровном слое дифференцировались краевые клетки. Началась эпиболия перидермы. Под зародышевым диском скрыто 25–30% поверхности желтка. Край обрастания синцития полностью совпадает с границей распространения покровного слоя.
Возраст 8 ч 00 мин (рис. 2г). Под клеточным материалом зародыша скрыто 35–40% поверхности желтка. Вершина зародышевого щитка расположена примерно в центре зародышевого диска.
Возраст 9 ч 00 мин (рис. 2д, 2е). Органогенезы. Эпиболия перидермы ~ 60%. Клеточный материал в области формирования передней и средней части осевого зачатка заметно продавливает под собой желток. На поверхности его передней части образовались два пологих продольных гребня, соответствующих латеральным утолщениям формирующейся центральной нервной системы.
Возраст 10 ч 30 мин (рис. 2ж). Под перидермой скрыто ~75% поверхности желтка. Бóльшая часть клеточного материала переместилась в область формирования тела зародыша. Осевой зачаток продавливает желток на всем своём протяжении. Вокруг головного отдела и вдоль формирующегося тела зародыша наблюдается большое количество конвергентно мигрирующих клеток. В переднем отделе они создают узкий ореол, который переходит в расширяющийся в каудальном направлении шлейф из активно мигрирующего в направлении осевого зачатка клеточного материала. Вентральная часть зародышевого кольца стала заметно ỳже. Дорсальный и вентральный рельеф головного отдела зародыша определён дифференцировкой трёх первичных отделов головного мозга: переднего, среднего и заднего.
Возраст 12 ч 10 мин (рис. 2з, 2и). Завершение эпиболии, под перидермой скрыта вся поверхность желтка. Зародышевое кольцо сомкнулось, образовав на анимальном полюсе кольцевой валик из клеточного материала вокруг точки смыкания клеток покровного слоя с глубоким воронковидным углублением в центре. Продолжается дифференцировка структур осевого комплекса. Заложился зачаток хорды. Непосредственно над визуально дифференцированным участком зачатка хорды расположены задний первичный отдел головного мозга и спинной мозг. Дифференцировались глазные плакоды. Зачаток хорды и расположенные непосредственно над ним отделы центральной нервной системы охватываются с боков агрегатами латеральной мезодермы, достигающими наибольшей высоты и дифференцировки в проксимальных отделах. В теле зародышей выделились три–четыре пары сомитов. Под задним отделом, немного краниальнее точки смыкания зародышевого кольца, заложился Купферов пузырёк.
Возраст 13 ч 40 мин (рис. 2к). В теле зародыша выделились пять–шесть пар сомитов. В области заднего отдела сохраняется остаток материала зародышевого кольца, который ещё не вошёл в состав тела зародыша. На уровне средней части продолговатого мозга дифференцировались слуховые плакоды. У некоторых зародышей в них начали формироваться полости. Визуально дифференцировались обонятельные плакоды.
Возраст 17 ч 00 мин (рис. 2л). В теле зародыша насчитываются 10–11 пар сомитов. Клеточный материал остатка зародышевого кольца полностью перешёл в состав тела зародыша. Началось обособление хвостовой почки. Купферов пузырёк достиг максимального размера.
Возраст 19 ч 30 мин (рис. 2м). В теле зародыша выделились 14–15 пар сомитов, три–четыре передних начали приобретать шевронообразную форму. Размер Купферова пузырька большинства зародышей стал уменьшаться. В глазных бокалах начали формироваться хрусталиковые плакоды.
Возраст 21 ч 00 мин. Начало подвижного состояния. Туловищная мускулатура стала совершать едва заметные подрагивания. В теле зародыша выделились 16–17 мускульных сегментов. Хрусталиковые плакоды приобрели округлую форму. У всех эмбрионов Купферов пузырёк редуцирован полностью.
Возраст 23 ч 30 мин (рис. 3а). В теле эмбриона насчитываются 19–20 мускульных сегментов. Движения мускулатуры тела усложнились, примерно один раз в минуту наблюдается серия плавных подрагиваний, сопровождаемая слабыми боковыми отклонениями хвостового отдела. На поверхности головного и передней части туловищного отделов появились железы вылупления. Каждая из них выглядит как плотное скопление мелких пузыревидных образований. На разных участках поверхности тела и желточного мешка появились немногочисленные меланофоры, окрашенные в очень бледный серый цвет. Число жировых капель уменьшилось, крупные стали заметно крупнее.
Рис. 3.
Завершение эмбрионального и начало личиночного развития Cantherhines pardalis: а − подвижный эмбрион, 19–20 мускульных сегментов, дифференцировались железы вылупления; б − эмбрион за ~3 ч до вылупления; в − предличинка TL 1.70–1.75 мм через 2−3 ч после вылупления; г − предличинка TL 2.3−2.4 мм, появление перистальтики, начало подвижного состояния челюстного аппарата, грудных плавников.
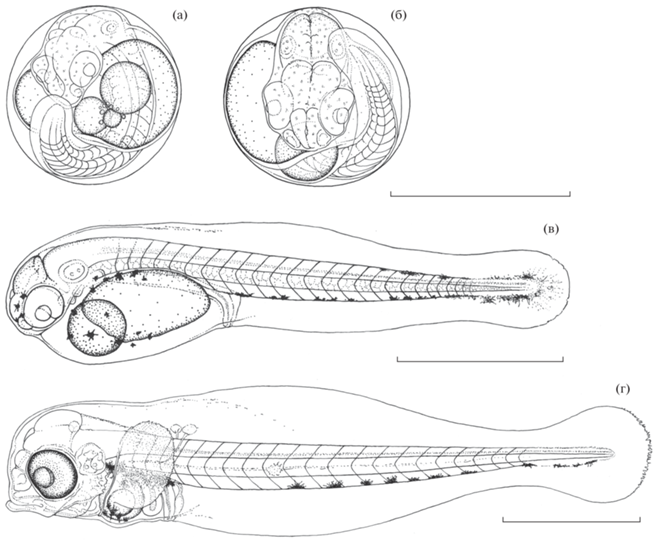
Возраст 29 ч 30 мин (рис. 3б). Интенсивность движений туловищной мускулатуры возросла незначительно, но их характер стал более сложным. Железы вылупления стали видны более отчётливо. Характер пигментации не изменился. В желточном мешке подавляющего большинства эмбрионов содержится только одна крупная жировая капля, изредка две–одна большая и одна заметно меньшего размера.
Возраст 31 ч 35 мин. Начало вылупления, первые случаи. В возрасте 32 ч 00 мин вылупилось ~30% эмбрионов, в возрасте 33 ч 00 мин – >80%.
Личиночный период развития (предличиночный подпериод)
Возраст 34 ч 30 мин (2–3 ч после вылупления (п.в.)) (рис. 3в). Длина предличинок (TL) составляет 1.70–1.75 мм. В теле насчитываются 24–25 сегментов: семь–восемь туловищных и 17–18 хвостовых. В желточном мешке подавляющего большинства предличинок содержится только одна жировая капля диаметром ~ 0.186 мм. Умеренно развитый гидросинус охватывает дорсолатеральные области задней части головного, туловищного и переднюю часть хвостового отделов. Немногочисленные тёмно-серые или чёрные меланофоры присутствуют на передней части головного отдела, на передней, дорсальной и вентральной части желточного мешка, на дорсальной стороне задней части хвостового отдела, а также имеется отчётливо сформированный непарный подхвостовой ряд.
В пищеварительном тракте выделяется немного расширенный в краниальном направлении отдел, соответствующий глотке. Другие отделы визуально не дифференцированы. Выводящие протоки почек вливаются в слабо дифференцированный мочевой пузырь. Предличинки малоподвижны, имеют слабо положительную плавучесть, располагаются под поверхностью воды жировой каплей вверх, периодически проплывают 3–5 см прямо или по кругу, после чего следует длительный период покоя.
Возраст 76 ч п.в. (рис. 3г). TL 2.3–2.4 мм. В теле насчитываются 22–23 сегмента: четыре–пять туловищных и 17–19 хвостовых. У всех предличинок в желточном мешке содержится только одна жировая капля диаметром ~ 0.099 мм. Вокруг неё сохраняется остаток желтка, окрашенного в зелёный цвет. Гидросинус стал более выраженным, охватывает дорсолатеральные области головного, туловищного и переднюю часть хвостового отделов. В пигментации участвуют только чёрные меланофоры. Нижнебоковые ряды состоят из шести–восьми сильно разветвлённых клеток, а непарный подхвостовой из 12–15 и начинается на 4–6-м сегменте хвостового отдела. На желточном мешке вблизи нижнебоковых рядов располагаются по три–пять меланофоров и шесть–девять на его вентральной стороне.
Глотка преобразуется в пищевод, направляющийся вниз, и переходит в желудок, который представлен объёмным, с более расширенным просветом, участком пищеварительного тракта. В нижней части брюшной полости он изгибается вверх и переходит в короткий кишечник. Наблюдаются слабые волны перистальтики. Челюстной аппарат и грудные плавники периодически слабо подрагивают.
Плавучесть нейтральная или слабо положительная. Бóльшую часть времени предличинки находятся в толще воды вниз головой, во взвешенном состоянии, периодически (раз в 10–20 с) проплывая в сторону или вверх.
ОБСУЖДЕНИЕ
Для многих представителей сем. Monacanthidae характерен продолжительный период нереста с многопорционным икрометанием, во время которого самки имеют низкие значения ГСИ. В частности, у S. hispida, размножающихся с мая по октябрь, ГСИ самок составляет 2–7% (Mancera-Rodrıguez, Castro-Hernandez, 2015), у Meuschenia scaber с нерестовым периодом с августа по декабрь – 8–12% (Visconti et al., 2018). Исследованные самки C. pardalis имели низкие значения ГСИ, а состав половых клеток на IV–V стадии зрелости был близок тому, что описано для M. scaber (Visconti et al., 2018). Это позволяет предполагать, что C. pardalis, скорее всего, также имеет многопорционный нерест.
Исключительная способность активироваться у сперматозоидов, находящихся только в эякуляте, также была обнаружена и у других рыб, в частности, из семейства Mullidae. При этом показано, что у представителей семейств Pomacentridae и Acanthuridae хорошо активируются и сперматозоиды, выделенные из фрагментов семенников (Emel’yanova, Pavlov, 2012; Павлов, Емельянова, 2016). Короткий период подвижности сперматозоидов, возможно, связан с тем, что вымет половых продуктов во время естественного нереста у C. Pardalis происходит в течении 2–3 с, после чего пара сразу покидает нерестилище (Kawase, Nakazono, 1994b).
На световом уровне исследования поверхность яиц C. pardalis выглядит гладкой и неструктурированной. Однако на изображениях, полученных с применением СЭМ, внешняя сторона яиц имеет структурированность в виде множества неглубоких складок. Размер и глубина элементов этой рельефности, вероятно, определяется наличием неоднородности строения в глубине слоя хориона, отражённой в электронограмме. В пользу этого свидетельствует то, что размер этих структур и расстояние между ними примерно соответствуют размерным характеристикам складок на поверхности.
Ультраструктурные исследования поперечных срезов оболочки C. pardalis с применением ТЭМ показали, что в лучистой оболочке отчётливо выделяются два слоя: внешний, более электронно-плотный, и внутренний, менее плотный. Такое разделение является наиболее распространённым у яиц костистых рыб. При этом известны и другие варианты: однослойное строение (Sohn et al., 2016; Kim, 2020), трёхслойное (Микодина, 1980; Schindler, Vries, 1989) и более (Kudo et al., 1988). Однако данных о том, что эти характеристики имеют отчётливую связь с особенностями размножения видов, нет.
Строение внешней части микропиле C. pardalis и участка оболочки вокруг него не имеет ярко выраженных морфологических особенностей, как это, например, описано для других Tetraodontiformes из семейства Ostraciidae (Leis, Moyer, 1985).
Оплодотворённые и развивающиеся яйца C. pardalis имеют существенное сходство с яйцами других Monacanthidae и отличаются только в деталях. Они также имеют маленький размер, и среди изученных к настоящему времени видов являются самыми мелкими (табл. 2). Представленные в литературе описания эмбриогенеза видов семейства не очень детальны, но по косвенным признакам можно определить, что в пределах этой группы в соотношении скоростей процесса морфологической дифференцировки зародыша и процесса эпиболии покровного слоя имеется существенное сходство. Предличинки C. pardalis выходят из яйцевых оболочек примерно на таком же уровне морфологического развития, что и другие виды семейства. Все представители Monacanthidae при вылуплении имеют малые размеры, но исследованный вид мельче всех.
Таблица 2.
Характеристика оплодотворённых яиц и предличинок представителей семейства Monacanthidae сразу после вылупления
| Вид | Размер яиц, мм | Длина (TL) предличинок, мм | Сегментная формула | Источник информации |
|---|---|---|---|---|
| T. modestus | 0.60–0.64 | 1.80 | 4 + 17 | Kitajima et al., 1964 – цит. по: Kawase, Nakazono, 1994a |
| S. cirrhifer | 0.61–0.66 | 1.80–2.07 | 6 + 14 | Fujita, 1955 – цит. по: Kawase, Nakazono, 1994a |
| A. monoceros | 0.68 | 2.47 | Imura et al., 1986 – цит. по: Kawase, Nakazono, 1994a | |
| O. longirostris | 0.70 | 2.50 | Barlow, 1987 | |
| P. japonicus | 0.56 | 1.80–2.06 | 5 + 18 | Nakazono, Kawase, 1993; Kawase, Nakazono, 1994a |
| B. ulvarum | 0.82 | 2.47 | Akagawa et al., 1995 | |
| B. jacksonianus | 0.74 | – | Kawase, 2005 | |
| R. ercodes | 0.53 | 1.84–1.90 | 5 + 18 | Kawase, Nakazono, 1994a |
| 0.52 | 1.80 | Nakamura, 1942 – цит. по: Akagawa et al., 1995 | ||
| E. bucephalus | 0.73 | Kawase, 2008 | ||
| C. pardalis | 0.51 | 1.70–1.75 | Наши данные |
В желтке яиц C. pardalis, как и у всех изученных видов, присутствует по несколько жировых капель. Различия состоят в их числе и размерах (минимальном и максимальном).
Кавазе и Наказоно (Kawase, Nakazono, 1994b) исследовали развивающуюся икру C. pardalis в возрасте ~ 25 ч. Отмеченное ими число и размер жировых капель на этой стадии соответствовало тому, что наблюдалось в нашем исследовании приблизительно в таком же возрасте. В процессе эмбриогенеза C. pardalis жировые капли постепенно сливались, их средний размер увеличивался, а число уменьшалось, а к началу вылупления у подавляющего большинства эмбрионов в желточном мешке находилась только одна жировая капля. Подобный процесс наблюдали и в развитии других видов Monacanthidae: O. longirostris (Barlow, 1987), B. ulvarum (Akagawa et al., 1995), R. ercodes, P. japonicus (Kawase, Nakazono, 1994b). Кавазе и Наказоно (Kawase, Nakazono, 1994b) не отметили наличия зелёной окраски желтка яиц C. pardalis, возможно, это объясняется тем, что они исследовали объект после предварительной фиксации раствором формальдегида. Представленные в этой работе размеры икры C. pardalis (0.53 мм) были немного больше результатов наших измерений (0.51 мм). Из числа исследованных представителей семейства зелёная окраска желтка была отмечена только у O. longirostris (Barlow, 1987).
Эмбриональный период у C. pardalis является одним из самых коротких среди Monacanthidae. Его продолжительность лишь немного больше, чем у P. japonicus (Kawase, Nakazono, 1994a), почти равна той, что представлена для R. ercodes (Nakamura, 1942 – цит. по: Akagawa et al., 1995) и немного короче описанной для T. modestus (Kitajima et al., 1964 – цит. по: Kawase, Nakazono, 1994a). У остальных видов этот показатель больше примерно в полтора раза, а у B. ulvarum более чем в три (Akagawa et al., 1995).
Предличинки C. pardalis являются пелагическими, что вполне соответствует сложившимся представлениям о том, что предположительно все Balistoidei имеют демерсальную икру и пелагических личинок (Aboussouan, Leis, 1984). Предличинки C. pardalis вскоре после вылупления имеют эмбриональные черты, что обычно более характерно для пелагофилов. У них сохраняется довольно большой желточный мешок, пищеварительная система находится в зачаточном состоянии, кровеносная система не функционирует, они малоподвижны.
Самое малое число позвонков среди всех рыб имеют Tetraodontiformes (Brainerd, Patek, 1998), в частности, у представителей Monacanthidae их чаще всего 19 (обычно 7 + 12, иногда 6 + 13), реже больше – до 30: (7–8) + (13–23) (Hutchins, 1977; Tyler, 1980). Данные о позвонковой формуле C. pardalis в литературе отсутствуют, но исследовано значительное число других видов этого рода (Hutchins, Randall, 1982), у которых этот показатель составляет 19–20 (7 + (12–13)). Учитывая эти данные, вызывает интерес то, что в момент вылупления в теле предличинок C. pardalis насчитывается 24–25 ((7–8) + (17–18) мускульных сегментов, а через 3 сут п.в. – 22–23 ((4–5) + (17–19). У большинства исследованных видов костистых рыб в первое время после вылупления особь имеет максимальное число туловищных сегментов, которое постепенно сокращается и приближается к дефинитивному. В наблюдаемом случае уже у предличинок туловищных сегментов меньше, чем позвонков в соответствующем отделе у взрослых рыб. В теле только что вылупившихся предличинок P. japonicas и R. ercodes (Kawase, Nakazono, 1994a) насчитываются 23 сегмента, из них только пять туловищных, что даёт основания предположить наличие в раннем онтогенезе Monacanthidae другой закономерности в изменении сегментной формулы.
Меланофоры с начавшим формироваться в них меланином впервые были обнаружены на поздних стадиях эмбрионального развития. Пигментация предличинок C. pardalis не интенсивна, характер распределения пигментных клеток отличается от всех описанных в литературе для Monacanthidae вариантов, т.е. значительно варьирует у представителей разных родов. В биологии размножения C. pardalis и других видов семейства есть определённые особенности. Среди представителей фауны коралловых рифов превалируют два основных репродуктивных типа: демерсальный нерест с заботой родителей о потомстве и пелагический нерест без неё (Thresher, 1984). При этом Барлоу (Barlow, 1987) считает, что демерсальные яйца являются гораздо менее обычными для этих экосистем. Balistoidei, включающие в себя семейства Monacanthidae и Balistidae (Nelson et al., 2016), скорее всего, все являются демерсальными (Aboussouan, Leis, 1984), многие или большинство из которых проявляют заботу о потомстве (Kawase, 2002). Яйца демерсальных видов обычно крупнее и содержат большее количество полезных веществ, личинки большинства таких видов вылупляются в более продвинутом морфологически состоянии и более крупными, чем у рыб с пелагическим нерестом, а у пелагофильных особей обычно всё наоборот (Thresher, 1984; Barlow, 1987; Leis et al., 2013). Вопреки ожиданиям, C. pardalis, как и другие изученные Monacanthidae, имеет икру, близкую по размерам к самой мелкой из массовых пелагофильных видов (Ahlstrom, Moser, 1980), а его личинки вылупляются мелкими и слаборазвитыми.
Результаты исследования показали, что в характеристиках эмбрионально-личиночного развития C. pardalis на фоне значительного сходства в общих чертах с другими изученными представителями Monacanthidae имеются определенные различия в деталях. Полученные данные дополнили представления о раннем периоде жизни Monacanthidae, однако для более глубокого сравнительного анализа особенностей раннего развития в пределах этого достаточно объёмного семейства в настоящее время имеется слишком мало сведений по развитию его представителей.
Список литературы
Микодина Е.В. 1980. Структура яйцевых оболочек зрелых яиц некоторых костистых рыб // Онтогенез. № 1. С. 101–106.
Павлов Д.А., Емельянова Н.Г. 2016. Особенности размножения Upeneus margarethae (Mullidae) – вида, впервые обнаруженного в прибрежной зоне Вьетнама // Вопр. ихтиологии. Т. 56. № 4. С. 474–486. https://doi.org/10.7868/S0042875216040135
Расс Т.С. 1946. Ступени онтогенеза костистых рыб // Зоол. журн. Т. 46. Вып. 2. С. 137–149.
Роскин Г.И., Левинсон Л.Б. 1957. Микроскопическая техника. М.: Сов. наука, 467 с.
Уикли Б. 1975. Электронная микроскопия для начинающих. М.: Мир, 324 с.
Aboussouan A., Leis J.M. 1984. Balistoidei: Development // Ontogeny and systematics of fishes. Lawrence: Allen Press. P. 450–459.
Ahlstrom E.H., Moser H.G. 1980. Characters useful in identification of pelagic marine fish eggs // Calif. Coop. Oceanic Fish. Invest. Rep. V. 21. P. 121–131.
Akagawa I., Tsukamoto Y., Okiyama M. 1995. Sexual dimorphism and pair spawning into a sponge by the filefish, Brachaluteres ulvarum, with a description of the eggs and larvae // Jpn. J. Ichthyol. V. 41. № 4. P. 397–407. https://doi.org/10.11369/jji1950.41.397
Ballard W.W. 1973a. A new fate map for Salmo gairdneri // J. Exp. Zool. V. 184. № 1. P. 49–73. https://doi.org/10.1002/jez.1401840105
Ballard W.W. 1973b. Morphogenetic movements in Salmo gairdneri Richardson // Ibid. V. 184. № 1. P. 27–48. https://doi.org/10.1002/jez.1401840104
Barlow G.W. 1987. Spawning, eggs and larvae of the longnose file fish Oxymonacanthus longirostris, a monogamous coralivore // Env. Biol. Fishes V. 20. № 3. P. 183–194. https://doi.org/10.1007/BF00004953
Brainerd E.L., Patek S.N. 1998. Vertebral column morphology, C-start curvature, and the evolution of mechanical defenses in tetraodontiform fishes // Copeia. V. 1998. № 4. P. 971–984. https://doi.org/10.2307/1447344
Emel’yanova N.G., Pavlov D.A. 2012. From oocyte to larva: hormonal induction of oocyte maturation and initial development of coral reef fishes. Moscow: KMK Sci. Press, 170 p.
Fricke R., Eschmeyer W.N., Van der Laan R. (eds.). 2021. Eschmeyer’s catalog of fishes: genera, species, references. http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp. Version 02/2021.
Froese R., Pauly D. (eds.). 2021. FishBase. World Wide Web electronic publication. www.fishbase.org. Version 02/2021.
Hutchins J.B. 1977. Descriptions of three new genera and eight new species of monacanthid fishes from Australia // Rec. West. Aust. Mus. V. 5. № 1. P. 3–58.
Hutchins J.B., Randall J.E. 1982. Cantherines longicaudus, a new filefish from Oceania, with a review of the species of the C. fronticinctus Complex // Pac. Sci. V. 36. № 2. P. 175–185.
Kawase H. 2002. Simplicity and diversity in the reproductive ecology of triggerfish (Balistidae) and filefish (Monacanthidae) // Fish. Sci. V. 68. № Sup1. P. 119–122. https://doi.org/10.2331/fishsci.68.sup1_119
Kawase H. 2005. Spawning behaviour of the pygmy leatherjacket Brachaluteres jacksonianus (Monacanthidae) in south-eastern Australia // Ichthyol. Res. V. 52. № 2. P. 194–197. https://doi.org/10.1007/s10228-005-0272-8
Kawase H. 2008. Reproductive ecology of the black reef leatherjacket, Eubalichthys bucephalus (Monacanthidae) in temperate Australia // Ibid. V. 55. № 3. P. 294–298. https://doi.org/10.1007/s10228-007-0028-8
Kawase H., Nakazono A. 1994a. Embryonic and pre-larval development and otolith increments in two filefishes, Rudarius ercodes and Paramonacanthus japonicus (Monacanthidae) // Jpn. J. Ichthyol. V. 41. № 1. P. 57–63. https://doi.org/10.11369/jji1950.41.57
Kawase H., Nakazono A. 1994b. Reproductive behavior of the honeycomb leatherjacket, Cantherhines pardalis (Monacanthidae), at Kashiwajima, Japan // Ibid. V. 41. № 1. P. 80–83. https://doi.org/10.11369/jji1950.41.80
Kim D.H. 2020. Ultrastructure of the fertilized egg envelopes in Ancistrus cirrhosus, Loricariidae, Teleostei // Appl. Microsc. V. 50. Article 13. https://doi.org/10.1186/s42649-020-00034-7
Kudo S., Sato A., Inoue M. 1988. Chorionic peroxidase activity in the eggs of the fish Tribolodon hakonensis // J. Exp. Zool. V. 245. № 1. P. 63–70. https://doi.org/10.1002/jez.1402450110
Leis J.M., Moyer J.T. 1985. Development of eggs, larvae and pelagic juveniles of three Indo-Pacific ostraciid fishes (Tetraodontiformes): Ostracion meleagris, Lactoria fornasini and L. diaphana // Jpn. J. Ichthyol. V. 32. № 2. P. 189–202. https://doi.org/10.11369/jji1950.32.189
Leis J.M., Caselle J.E., Bradbury I.R. et al. 2013. Does fish larval dispersal differ between high and low latitudes? // Proc. R. Soc. B. V. 280. № 1759. Article 20130327. https://doi.org/10.1098/rspb.2013.0327
Lentz T.L., Trinkaus J.P. 1967. A fine structural study of cytodifferentiation during cleavage, blastula, and gastrula stages of Fundulus heteroclitus // J. Cell Biol. V. 32. № 1. P. 121–138. https://doi.org/10.1083/jcb.32.1.121
Mancera-Rodriguez N.J., Castro-Hernandez J.J. 2015. Reproductive biology of the planehead filefish Stephanolepis hispidus (Pisces: Monacanthidae), in the Canary Islands area // Ichthyol. Res. V. 62. № 3. P. 258–267. https://doi.org/10.1007/s10228-014-0435-6
Nakazono A., Kawase H. 1993. Spawning and biparental egg-care in a temperate filefish, Paramonacanthus japonicus (Monacanthidae) // Environ. Biol. Fishes. V. 37. № 3. P. 245–256. https://doi.org/10.1007/BF00004632
Nelson J.S., Grande T.C., Wilson M.V.H. 2016. Fishes of the World. Hoboken: John Wiley and Sons, 752 p. https://doi.org/10.1002/9781119174844
Schindler J.F., de Vries U. 1989. Polarized distribution of binding sites for concanavalin A and wheat-germ agglutinin in the zona pellucida of goodeid oocytes (Teleostei) // Histochemistry. V. 91. № 5. P. 413–417. https://doi.org/10.1007/BF00493828
Sohn J.H., Kwon O., Kim D.H. 2016. Ultrastructure of the fertilized egg envelopes from Pseudobagrus fulvidraco, Bagridae, Teleostei // Appl. Microsc. V. 46. № 3. P. 150–154. https://doi.org/10.9729/AM.2016.46.3.150
Thresher R.E. 1984. Reproduction in reef fishes. Neptune City: T.F.H. Pubns., 399p.
Tyler J.C. 1980. Osteology, phylogeny, and higher classification of the fishes of the order Plectognathi (Tetraodontiformes) // NOAA Tech. Rept. NMFS Circ. V. 434. 422 p.
Visconti V., Trip E.D.L., Griffiths M.H., Clements K.D. 2018. Reproductive biology of the leatherjacket, Meuschenia scaber (Monacanthidae) (Forster 1801) in the Hauraki Gulf, New Zealand // N. Z. J. Mar. Freshwat Res. V. 52. №. 1. P. 82–99. https://doi.org/10.1080/00288330.2017.1331919
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


