Вопросы ихтиологии, 2022, T. 62, № 6, стр. 790-796
Выживаемость и уровень тиреоидных гормонов и ионов у кольчужных сомов (Loricariidae) при повышении солёности воды
Чан Дык Зьен 1, 2, Е. В. Ганжа 3, Е. Д. Павлов 3, *, К. Ю. Самойлов 4, Д. С. Павлов 1, 4
1 Приморское отделение Российско-вьетнамского тропического
научно-исследовательского и технологического центра
Нячанг, Вьетнам
2 Высший научно-технический университет Вьетнамской академии наук и технологий
Ханой, Вьетнам
3 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
4 Московский государственный университет
Москва, Россия
* E-mail: p-a-v@nxt.ru
Поступила в редакцию 29.05.2022
После доработки 01.06.2022
Принята к публикации 01.06.2022
- EDN: NMAHDG
- DOI: 10.31857/S0042875222060066
Аннотация
Представлены результаты изучения выживаемости, содержания тиреоидных гормонов и ионов у особей кольчужных сомов рода Pterygoplichthys при повышении солёности воды. Ступенчатое (через каждые двое суток) увеличение солёности воды от 0 до 12.5‰ приводит к заметному повышению содержания ионов Na+, K+, Cl–, Ca2+ в крови рыб, но не влияет на уровень тиреоидных гормонов (свободный и общий трийодтиронин, тироксин) и расчётные показатели соотношения этих гормонов. Полученные данные свидетельствуют о низком вовлечении щитовидной железы в осморегуляцию кольчужных сомов. Подтверждено, что отдельные особи кольчужных сомов способны в течение 2 сут выдерживать солёность воды вплоть до 15‰. Обсуждается возможность расселения кольчужных сомов по эстуариям в соседние речные системы.
Кольчужные сомы рода Pterygoplichthys в течение многих лет успешно заселяют внутренние водоёмы центральной части Индо-Тихоокеанского региона (Orfinger, Goodding, 2018). В водоёмах Южного Вьетнама они впервые были зарегистрированы в 2003–2004 гг. (Welcomme, Vidthayanom, 2003; Serov, 2004), а к 2010 г. обнаружены в Центральном (Zworykin, Budaev, 2013) и Северном Вьетнаме (Levin et al., 2008). В настоящее время в центральной и южной частях Вьетнама кольчужные сомы встречаются в бассейнах многих рек, обнаружены в некоторых водохранилищах (Столбунов, Чан Дык Зьен, 2019; Stolbunov et al., 2020).
Есть основание полагать, что расселение кольчужных сомов во Вьетнаме не ограничено сугубо пресными водами, а может осуществляться и по прибрежным участкам моря между устьями рек. Ряд авторов (Capps et al., 2011; Brion et al., 2013; Kumar et al., 2018) придерживаются сходной гипотезы по другим регионам расселения этого вида. Кольчужные сомы, считающиеся, как правило, пресноводными представителями отряда Siluriformes (Myers, 1949), тем не менее способны заходить в солоноватые воды (Stevens et al., 2006; Barletta, Blaber, 2007) и выдерживать повышение солёности воды до 16‰ (Capps et al., 2011). Принимая во внимание широкое распространение кольчужных сомов во Вьетнаме и их возможное влияние на аборигенную ихтиофауну, представляется актуальным получить сведения об их толерантности к солоноватой воде.
У проходных рыб переход из пресной воды в морскую запускает компенсаторный гипоосмолярный механизм, направленный на выведение излишков солей, прежде всего натрия (McCormick, 1995). Регуляция этого процесса осуществляется в том числе тиреоидными гормонами (Peter et al., 2000; Klaren et al., 2007). Таким образом, уровень тиреоидных гормонов и ряда ионов в крови дают представление о толерантности рыб к воде повышенной солёности. Мы не обнаружили информации о том, свойственна ли осморегуляторная модификация кольчужным сомам при их выходе в солоноватую воду.
Цель работы – оценить влияние повышенной солёности воды на выживаемость особей кольчужных сомов рода Pterygoplichthys, концентрацию тиреоидных гормонов и уровень ионов Na+, K+, Ca2+, Cl– в их крови.
МАТЕРИАЛ И МЕТОДИКА
Работа выполнена в январе‒феврале 2020 и 2022 гг. в Приморском отделении Российско-вьетнамского тропического научно-исследовательского и технологического центра (Нячанг, Вьетнам). Объект исследования – кольчужные сомы рода Pterygoplichthys. В Южном Вьетнаме обитают предположительно два вида – P. disjunctivus и P. pardalis (Zworykin, Budaev, 2013; Столбунов, Чан Дык Зьен, 2019; Stolbunov et al., 2020). Однако таксономический статус кольчужных сомов не выяснен. Предложенные ранее (Armbruster, Page, 2006) ключи по паттернам окраски вентральной поверхности тела сомов не позволяют с уверенностью установить их видовую принадлежность в связи со значительной изменчивостью окраски и ряда других морфологических признаков в различных условиях среды (Zworykin, Budaev, 2013).
Рыб отлавливали, используя ловушки, в нижнем течении р. Зинь (Dinh River) (12°29′45′′ с.ш. 109°07′41′′ в.д.). Это относительно крупная река уезда Ниньхоа провинции Кханьхоа; её протяжённость ~ 50 км, площадь бассейна – 985 км2, впадает в Восточное море. Рыб перевозили в аквариальную, где их примерно в равных долях (по 18–23 экз.) помещалили в бассейны объёмом по 170 л с пресной водой. Воду в бассейнах постоянно аэрировали, раз в сутки меняли; температура воды была 25–26°C. Рыб кормили один раз в сутки гранулированным кормом для сомообразных Inve P16 (Таиланд).
Для создания требуемой солёности воды использовали соль Red Sea Salt (“Red Sea”, Израиль), которую предварительно растворяли в подготовленной воде с низким уровнем минерализации (4–7 мг/л). Солёность полученной воды определяли и контролировали с применением оптического рефрактометра RHS-10ATC (“Kelilong Electron”, Китай). Полученный раствор аэрировали в течение ≥4 ч для полного растворения соли, затем его переливали в аквариумы и перемещали туда рыб.
Было проведено три серии опытов. В первой оценивали пороговую солёность, при которой в течение 2 сут выживает ≥2/311 использованных в опытах кольчужных сомов. В начале опыта особей индивидуально рассаживали по аэрируемым аквариумам с пресной водой объёмом 12 л. Частичную замену воды в аквариумах (2/3 объёма) осуществляли ежедневно. Всего было использовано 24 аквариума – по шесть аквариумов с водой солёностью 5.0, 10.0, 12.5 и 15.0‰. Каждую особь (всего 36 экз.) последовательно через каждые двое суток пересаживали в аквариум с водой повышенной солёности. Таким образом, в этой серии опытов для рыб происходило ступенчатое повышение солёности воды, которое в отличие от резкого изменения солёности уменьшает у рыб осмотический стресс и даёт им время для акклимации в новой среде (Kefford et al., 2004). В течение этой и последующих серий опытов фиксировали поведение рыб и их смертность, по окончании опыта измеряли стандартную длину и массу их тела. Длина тела рыб, участвовавших в первой и второй сериях опытов, составила 201.5 ± ± 6.722 мм, масса – 148.4 ± 11.6 г.
Во второй серии опытов оценивали изменение уровня тиреоидных гормонов и ионов у 23 особей (не принимавших участия в предыдущей серии опытов) при их содержании в воде со ступенчато возрастающей солёностью вплоть до порогового значения, величину которого определили в первой серии опытов. В начале опыта у рыб, содержавшихся в пресной воде, отбирали кровь, затем их помещали в индивидуальные аквариумы объёмом 12 л также с пресной водой. Через сутки после первого отбора крови, так же как и в первой серии опытов, особей ступенчато (через каждые двое суток) пересаживали в аквариумы с водой повышенной солёности. Через двое суток после пересадки в воду с пороговой солёностью у выживших рыб (16 экз.) повторно отбирали кровь.
В третьей серии оценивали влияние манипуляционного стресса на уровень тиреоидных гормонов и ионов в крови кольчужных сомов, вызванного непосредственно отбором крови, пересадкой особей и заменой воды в аквариумах. Отсутствие значимых изменений в гормональном статусе и ионном обмене при указанных манипуляциях даёт возможность оценить влияние солёности на биохимические показатели рыб в сложившихся условиях эксперимента. Для оценки влияния условий содержания выполняли те же манипуляции с рыбами, что и в опыте второй серии, но рыб (18 экз.) пересаживали каждый раз снова в пресную воду. У каждой особи отбирали кровь по 500 мкл в начале и в конце (через 8 сут) опыта. Продолжительность опытов третьей и второй серий совпадала. Длина тела рыб в третьей серии опытов составила 253.6 ± 6.6 мм, масса – 189.6 ± 9.9 г.
Кровь у рыб, использованных во второй и третьей сериях опытов, отбирали утром (7:30–10:30) из хвостовой вены шприцом объёмом 1 см3. Затем кровь центрифугировали при 2000 об/мин (300 g), полученную сыворотку замораживали при −20°C. Смертность и изменения в поведении рыб после отбора крови не отмечены. Методом иммуноферментного анализа на приборе MR 96A (“Mindray”, Китай) в сыворотке определяли концентрации общего тироксина (Т4), общего (Т3) и свободного (не связанного с белками плазмы крови) трийодтиронина (FT3). Бóльшая часть Т3 в крови связана с белками плазмы, а оставшаяся доля (<1%) является биологически активной фракцией гормона (Comeau, Campana, 2006). Рассчитывали долю FT3 относительно T3 (FT3/T3) (Eales, Shostak, 1985) и соотношение T4/T3 для оценки дейодирования – превращения Т4 в Т3. Каждую пробу исследовали на содержание гормонов в двух повторностях.
Концентрацию ионов Na+, K+, Cl– и Ca2+ в сыворотке крови определяли индивидуально для каждой особи у контрольных рыб (серия 3) с использованием биохимического анализатора iMagic-S7 (“iCubio BioMedical Technology”, Китай), а у опытных (серия 2) ‒ портативным прибором i-STAT 1 (“Abbott Point-of-Care Inc.”, США) с набором одноразовых картриджей CHEM 8+.
Анализ концентраций тиреоидных гормонов и ионов в сыворотке крови проводили по индивидуальным и обобщённым данным. Статистическую обработку данных проводили с применением параметрического (ANOVA) и непараметрического (H-критерий Краскела−Уоллиса) дисперсионных анализов, t-критерия Стьюдента, U-критерия Манна−Уитни и критерия Вилкоксона для связанных выборок, ранговой корреляции Спирмена. Нормальность распределения выборок оценивали по одновыборочному критерию Колмогорова–Смирнова.
РЕЗУЛЬТАТЫ
Оценка выживаемости рыб в воде с повышенной солёностью
После пересадки рыб в воду повышенной солёности (вне зависимости от её абсолютных значений) они в первые 5–10 с проявляли беспокойство: содрогания тела и активные перемещения по аквариуму, но затем замирали на дне. После пересадки рыб из пресной воды в пресную такой реакции не наблюдали.
В первой серии опытов смертность рыб, которых содержали в течение 2 сут в воде солёностью 5‰, не отмечена. При содержании в воде солёностью 10‰ выявлена 13.9%-ная гибель рыб, а при 12.5‰ она составила 23.5% пересаженных особей (кумулятивная смертность – 33.3%). К концу экспозиции в воде солёностью 15‰ выжила только одна из опытных рыб, т.е. смертность составила 95.8%. Это указывает на то, что солёность воды 12.5‰ близка к пороговым значениям для выживания большей части кольчужных сомов. Эта величина и была принята в качестве пороговой.
Во второй серии опытов погибло 4 экз. рыб (17.4%): по 1 экз. в воде солёностью 5 и 12.5‰ и 2 экз. в воде солёностью 10‰. В течение третьей серии опытов при содержании кольчужных сомов в пресной воде смертность особей не отмечали.
Концентрация тиреоидных гормонов и ионов у кольчужных сомов при содержании в пресной воде
Уровень тиреоидных гормонов (Т4, Т3 и FT3) и расчётных показателей их соотношения (Т4/Т3 и FT3/T3) не зависел (H-критерий Краскела–Уоллиса, p $ \gg $ 0.05) от длительности содержания рыб в пресной воде. Концентрации трёх изученных гормонов и значения показателей их соотношения при содержании рыб в пресной воде изменялись незначительно (табл. 1), различия недостоверны ни по обобщённому U-критерию Манна–Уитни, ни по критерию Вилкоксона для связанных выборок (p > 0.05).
Таблица 1.
Уровень тиреоидных гормонов и значения их соотношения у кольчужных сомов рода Pterygoplichthys на 1-е и 8-е сут содержания особей в пресной воде
| Продолжительность содержания, сут | Т4, мкг/дл | Т3, нг/мл | FT3, пг/мл | FT3/T3, % | Т4/Т3 |
|---|---|---|---|---|---|
| 1 | $\frac{{1.59 \pm 0.157}}{{0.64{\kern 1pt} --{\kern 1pt} 3.22}}$ | $\frac{{0.64 \pm 0.049}}{{0.32{\kern 1pt} --{\kern 1pt} 1.04}}$ | $\frac{{2.38 \pm 0.081}}{{1.81{\kern 1pt} --{\kern 1pt} 3.04}}$ | $\frac{{0.41 \pm 0.035}}{{0.20{\kern 1pt} --{\kern 1pt} 0.84}}$ | $\frac{{26.4 \pm 3.24}}{{12.5{\kern 1pt} --{\kern 1pt} 71.9}}$ |
| 8 | $\frac{{1.76 \pm 0.202}}{{0.82{\kern 1pt} --{\kern 1pt} 3.92}}$ | $\frac{{0.71 \pm 0.060}}{{0.36{\kern 1pt} --{\kern 1pt} 1.23}}$ | $\frac{{2.43 \pm 0.099}}{{1.62{\kern 1pt} --{\kern 1pt} 3.22}}$ | $\frac{{0.38 \pm 0.036}}{{0.15{\kern 1pt} --{\kern 1pt} 0.73}}$ | $\frac{{26.5 \pm 3.11}}{{8.1{\kern 1pt} --{\kern 1pt} 63.1}}$ |
Примечание. Здесь и в табл. 3: Т4 – тироксин; Т3, FT3 – общий и свободный трийодтиронин. Здесь и в табл. 2, 3: над чертой – среднее значение и его ошибка, под чертой – пределы варьирования показателя.
Уровень исследованных ионов не зависел (ANOVA, p > 0.05) от длительности содержания рыб в пресной воде. Концентрация ионов в крови особей незначительно изменялась с течением времени (табл. 2). Разность начальных и конечных значений концентрации ионов статистически не отличалась от нуля (t-критерий Стьюдента, p > 0.05).
Таблица 2.
Содержание ионов в крови кольчужных сомов рода Pterygoplichthys на 1-е и 8-е сут содержания особей в пресной воде, ммоль/л
| Продолжительность содержания, сут | Na+ | K+ | Cl– | Ca2+ |
|---|---|---|---|---|
| 1 | $\frac{{115 \pm 1.1}}{{106{\kern 1pt} --{\kern 1pt} 128}}$ | $\frac{{4.3 \pm 0.10}}{{3.6{\kern 1pt} --{\kern 1pt} 5.2}}$ | $\frac{{107 \pm 0.8}}{{102{\kern 1pt} --{\kern 1pt} 115}}$ | $\frac{{3.3 \pm 0.10}}{{2.7{\kern 1pt} --{\kern 1pt} 4.1}}$ |
| 8 | $\frac{{114 \pm 0.7}}{{110{\kern 1pt} --{\kern 1pt} 120}}$ | $\frac{{4.4 \pm 0.08}}{{3.7{\kern 1pt} --{\kern 1pt} 5.0}}$ | $\frac{{109 \pm 1.1}}{{98{\kern 1pt} --{\kern 1pt} 118}}$ | $\frac{{3.1 \pm 0.07}}{{2.3{\kern 1pt} --{\kern 1pt} 3.5}}$ |
Концентрация тиреоидных гормонов в солоноватой воде
Уровень тиреоидных гормонов (Т4, Т3 и FT3) и расчётных показателей их соотношения (Т4/Т3 и FT3/T3) не зависел (H-критерий Краскела–Уоллиса, p > 0.05) от содержания рыб в воде повышенной солёности. Средние концентрации трёх изученных гормонов и значения показателей их соотношения при содержании рыб в воде повышенной солёности несколько снижались (табл. 3), но различия недостоверны (критерий Вилкоксона, p > 0.05). Разность начальных и конечных значений концентраций гормонов статистически не отличалась от нуля (t-критерий Стьюдента, p > 0.05).
Таблица 3.
Уровень тиреоидных гормонов и значения их соотношения у кольчужных сомов рода Pterygoplichthys при содержании особей в воде разной солёности
| Солёность воды, ‰ | Т4, мкг/дл | Т3, нг/мл | FT3, пг/мл | FT3/T3, % | Т4/Т3 |
|---|---|---|---|---|---|
| 0 | $\frac{{1.04 \pm 0.046}}{{0.80{\kern 1pt} --{\kern 1pt} 1.33}}$ | $\frac{{1.44 \pm 0.151}}{{0.46{\kern 1pt} --{\kern 1pt} 2.49}}$ | $\frac{{0.61 \pm 0.080}}{{0.21{\kern 1pt} --{\kern 1pt} 1.06}}$ | $\frac{{0.09 \pm 0.015}}{{0.01{\kern 1pt} --{\kern 1pt} 0.23}}$ | $\frac{{8.5 \pm 1.04}}{{4.0{\kern 1pt} --{\kern 1pt} 19.4}}$ |
| 12.5 | $\frac{{0.91 \pm 0.051}}{{0.56{\kern 1pt} --{\kern 1pt} 1.40}}$ | $\frac{{1.32 \pm 0.109}}{{0.52{\kern 1pt} --{\kern 1pt} 2.14}}$ | $\frac{{0.58 \pm 0.073}}{{0.13{\kern 1pt} --{\kern 1pt} 1.27}}$ | $\frac{{0.07 \pm 0.009}}{{0.02{\kern 1pt} --{\kern 1pt} 0.14}}$ | $\frac{{7.4 \pm 0.59}}{{5.2{\kern 1pt} --{\kern 1pt} 13.9}}$ |
Концентрация ионов в солоноватой воде
Уровень исследованных ионов зависел (ANOVA, p $ \ll $ 0.001 для Na+, Cl–, Ca2+ и p = 0.018 для K+) от того, в пресной или солоноватой воде содержали кольчужных сомов. Концентрации всех изученных ионов заметно повышались после пересадки кольчужных сомов из пресной воды и их содержания в солоноватой воде (рисунок). Так, средний уровень (перед скобками – среднее значение, в скобках – пределы варьирования показателя) ионов Na+ возрос в 1.38 (1.21–1.60) раза, K+ – в 1.13 (0.91–1.46) раза, Cl– – в 1.32 (1.20–1.67) раза, Ca2+ – в 1.96 (1.41–4.08) раза. Уровень ионов Cl– у всех изученных рыб в солоноватой воде достиг максимального детектируемого картриджами прибора iStat значения – 140 мг/л. Вероятно, концентрации этого иона у опытных рыб превышали максимальное детектируемое значение.
Средние значения концентраций ионов (мг/л) Na+ (а), K+ (б), Cl– (в), Ca2+ (г) в сыворотке крови кольчужных сомов рода Pterygoplichthys при содержании их в воде пресной (1) и солоноватой (12.5‰) (2): ($ \bot - $) – стандартная ошибка. Различия (пресная–солоноватая вода) достоверны (t-критерий Стьюдента) при p $ \ll $ 0.001 (Na+, Cl–, Ca2+) и p = 0.018 (K+).
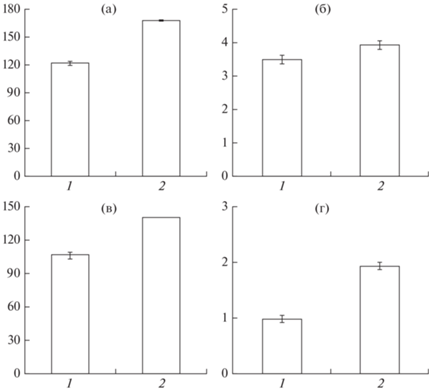
Не выявлено (ранговая корреляция Спирмена, p > 0.05) корреляционной связи между уровнями ионов и концентрациями тиреоидных гормонов у кольчужных сомов как в пресной, так и в солоноватой воде. Между содержанием ионов Cl– и Ca2+ в крови при содержании рыб в пресной воде установлена корреляция средней силы (rs = 0.59 при p = 0.016, где rs – коэффициент корреляции). Других корреляционных связей между концентрациями изученных ионов не обнаружено.
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о том, что 76.5% кольчужных сомов в течение 2 сут способны переносить солёность воды в 12.5‰, однако в воде солёностью 15.0‰ наблюдается смертность рыб, приближающаяся при той же экспозиции к 100%. Следовательно, при ступенчатом повышении солёности воды пороговая солёность для кольчужных сомов находится в пределах 12.5–15.0‰.
При наличии достаточного времени для акклимации/адаптации к солоноватой воде рыбы могут переносить более высокое содержание солей в воде, чем при резком изменении солёности (осмотическом стрессе) (Kay et al., 2001; Kefford et al., 2004). Толерантность к солёности связана и с тем, обитали ли рыбы до этого в районе с солоноватой водой (Kay et al., 2001). Для нашего эксперимента кольчужных сомов отлавливали на пресноводном участке реки в 10 км от устья, но при этом давали им возможность акклимироваться в течение 2 сут к воде повышенной солёности. Этот подход не учитывает смену места обитания (локальные миграции) рыб до их отлова, так как часть из них ранее могла перемещаться в солоноватые воды и соответственно иметь бóльшую толерантность к воде повышенной солёности. Мы предполагаем, что толерантность к повышенной солёности воды у разных представителей изучаемого рода заметно различается. В частности, на это указывает и разная кумулятивная смертность рыб при достижении уровня солёности воды в 12.5‰ в первой и второй сериях опытов (33.3 против 17.4%). В то время как часть рыб не способна акклимироваться к воде солёностью 10.0–12.5‰, отдельные особи (в воде солёностью 15.0‰ выжила одна рыба) могут переживать ограниченное время и бóльшую солёность воды, что отмечали ранее (до 16.0‰) и другие авторы (Capps et al., 2011; Kumar et al., 2018).
В нашем эксперименте при содержании рыб в воде солёностью > 10‰ заметно повышается их смертность, что согласуется с данными Бриона с соавторами (Brion et al., 2013), которые в эксперименте на молоди кольчужных сомов средней длиной 6.9 см выявили 50%-ную выживаемость/смертность рыб при содержании их в течение 96 ч в воде солёностью 10‰ (LC50 при 10‰). В другой работе (Kumar et al., 2018) при содержании в течение 10 сут производителей сомов Pterygoplichthys spp. (длина и масса которых сходны с таковыми у рыб, участвовавших в нашем эксперименте) в воде солёностью 12‰ смертности особей не отмечали. Расхождения в толерантности кольчужных сомов к солёности могут быть связаны с их обитанием в удалённых друг от друга водоёмах, характеризующихся разными условиями и возможностями для локальных миграций рыб.
Толерантность к солоноватой воде (LC50 при 15.8‰) была показана и на другом представителе Siluriformes – Pylodictis olivaris (семейство Ictaluridae) (Bringolf et al., 2005), что, как указывают авторы, потенциально даёт возможность представителям этого вида выходить в солоноватые воды и расселяться в соседние реки. Такой тип расселения (по эстуарию) вполне может быть присущ и кольчужным сомам. Например, в эстуарии (на 20 км южнее эстуария р. Зинь) р. Кай, сходной по гидрологии с р. Зинь, солёность варьирует от 3.0 до 12.0‰. Солёность поверхностного слоя опреснённого участка зал. Нячанг между эстуариями двух соседних рек Кай и Бе имеет мозаичный характер – концентрация соли в воде может быть как крайне низкой (0.5‰), так и высокой (27.0‰) (Нездолий и др., 2014).
Солеустойчивость многих пресноводных гидробионтов ограничена барьером 5.0–8.0‰ (Хлебович, 1974; Карпевич, 1976; Константинов, 1979). По обе стороны от этой границы развиваются различные сообщества видов, у которых по-разному протекают обменные процессы. Очевидно, что выдерживание кольчужными сомами солёности > 8‰ даёт им ряд преимуществ над другими пресноводными рыбами (бóльшая территория для расселения и доступа к пище).
Содержание кольчужных сомов в пресной воде в течение 8 сут не оказывает влияния на уровень ионов в крови, изменения происходят только после пересадки рыб в солоноватую воду. Осмотический ответ при содержании сомов в воде солёностью до 12.5‰ выражается в увеличении в крови концентраций всех исследованных ионов: Na+, K+, Cl–, Ca2+. Модификация уровней ионов Na+, K+ и Cl– и их соотношения может указывать на изменение активности фермента Na+/K+-АТФазы, отвечающего за осморегуляцию. Такая перестройка происходит при миграции проходных рыб из реки в море (McCormick, 1995; Madsen, 2009; Judd, 2012). При попадании проходных рыб в морскую воду запускается механизм активного транспорта ионов Na+, K+ и Cl– через цитоплазматическую мембрану против градиента концентрации (Karnaky, 1986; Tipsmark et al., 2002). У кольчужных сомов при повышении солёности воды наблюдается значительный рост концентрации всех трёх вовлечённых в этот механизм ионов, однако степень этого роста у ионов различна. Особо отметим, что в солоноватой воде значительно (примерно в два раза) возрастает уровень ионов Ca2+, что, учитывая небольшое содержание этого иона в морской воде (~1%), также указывает на ограниченную толерантность кольчужных сомов к солоноватой воде. По всей видимости, заметное увеличение концентраций ионов в крови обусловлено отсутствием возможностей у организма снизить избыток солей. Соответственно неспособность выведения избытка ионов приводит к гибели особей. Выявленные в нашей работе концентрации ионов Na+ и Cl– у кольчужных сомов, находившихся в воде солёностью 12.5‰, могут быть близки к критическим для выживания. Результаты показали слабую связь концентраций ионов между собой, в частности, отсутствует корреляция между ионами Na+ и K+, что указывает на низкий уровень клеточного транспорта этих ионов.
Содержание кольчужных сомов в пресной воде в течение 8 сут не оказывает влияния на уровень исследуемых тиреоидных гормонов в крови. Пересадка рыб в солоноватую воду и постепенное повышение её солёности до 12.5‰ также не влияет на содержание FT3, T3, T3 и величины расчётных показателей их соотношения (FT3/T3 и T4/T3).
Не выявлено и значимых корреляционных зависимостей уровней тиреоидных гормонов в крови рыб от концентраций ионов, что в совокупности указывает на слабое участие щитовидной железы в осморегуляции. Есть данные (De et al., 1987; McCormick, 1995; Peter et al., 2000), указывающие на то, что изменение уровня T3 влияет на активность Na+/K+-АТФазы у рыб. На радужной форели Oncorhynchus mykiss было показано (Kelly, Wood, 2001), что при наличии связи концентрации T3 с активностью Na+/K+-АТФазы не наблюдается связи концентрации этого гормона с трансэпителиальным транспортом ионов Na+ и Cl–, который осуществлялся пассивно. Возможно, что при повышении определённого порога солёности воды (при 12.5‰) у кольчужных сомов разрушается и связь уровня T3 с концентрациями ионов в организме – нарушается регуляторный механизм компенсации избытка солей.
Таким образом, при ступенчатом повышении солёности воды до 12.5‰ у кольчужных сомов заметно увеличивается содержание ионов Na+, K+, Cl– и Ca2+ в крови. Не выявлены изменения в концентрациях тиреоидных гормонов и показателях их соотношения. То есть при содержании рыб в воде указанной солёности не отмечено значимой модификации их осморегуляции – ионы из организма практически не выводятся, а регуляторное участие щитовидной железы в процессе осморегуляции не проявляется. Тем не менее экспериментальные данные указывают на то, что кольчужные сомы имеют возможность расселяться из одной речной системы в другую через эстуарий при солёности воды ≤15‰ (небольшая доля рыб переносит 15‰). Очевидно, что успешность такого варианта расселения также зависит от длительности пребывания особей в солоноватой воде и их способности перемещаться по градиенту солёности. Доказательство этой гипотезы станет предметом наших исследований в будущем.
Список литературы
Карпевич А.Ф. 1976. Методические указания по изучению выносливости рыб и беспозвоночных при изменении солености среды и методика ее определения. М.: Изд-во ВНИРО, 55 с.
Константинов А.С. 1979. Общая гидробиология. М.: Высшая школа, 480 с.
Нездолий В.К., Павлов Д.С., Нго Чи Тхьен и др. 2014. Покатная миграция молоди рыб в р. Кай // Экология внутренних вод Вьетнама. М.: Т-во науч. изд. КМК. С. 298–319.
Столбунов И.А., Зьен Чан Дык. 2019. Массовые чужеродные виды в рыбном населении внутренних вод Центрального Вьетнама // Биология внутр. вод. № 4–1. С. 101–104. https://doi.org/10.1134/S0320965219040351
Хлебович В.В. 1974. Критическая солёность биологических процессов. Л.: Наука, 117 с.
Armbruster J.W., Page L.M. 2006. Redescription of Pterygoplichthys punctatus and description of a new species of Pterygoplichthys (Siluriformes: Loricariidae) // Neotrop. Ichthyol. V. 4. № 1. P. 401–409. https://doi.org/10.1590/S1679-62252006000400003
Barletta M., Blaber S.J.M. 2007. Comparison of fish assemblages and guilds in tropical habitats of the Embley (Indo-west Pacific) and Caeté (Western Atlantic) estuaries // Bull. Mar. Sci. V. 80. № 3. P. 647–680.
Bringolf R.B., Kwak T.J., Cope W.G., Larimore M.S. 2005. Salinity tolerance of flathead catfish: implications for dispersal of introduced populations // Trans. Am. Fish. Soc. V. 134. № 4. P. 927–936. https://doi.org/10.1577/T04-195.1
Brion M.A., Guillermo J.G.Jr., Uy C. et al. 2013 Salinity tolerance of introduced South American sailfin catfishes (Loricariidae: Pterygoplichtys GILL 1858) // Philipp. J. Sci. V. 142. № 1. P. 13–19.
Capps K.A., Nico L.G., Mendoza-Carranza M. et al. 2011. Salinity tolerance of non-native suckermouth armoured catfish (Loricariidae: Pterygoplichthys) in south-eastern Mexico: implications for invasion and dispersal // Aquat. Conserv. Mar. Freshw. Ecosyst. V. 21. № 6. P. 528–540. https://doi.org/10.1002/aqc.1210
Comeau L.A., Campana S.E. 2006. Correlations between thyroidal and reproductive endocrine status in wild Atlantic cod // Can. Techn. Rept. Fish. Aquat. Sci. № 2682. 14 p.
De S., Ray A.K., Medda A.K. 1987. Nuclear activation by thyroid hormone in liver of Singi fish: changes in different ion-specific adenosine triphosphatases activities // Horm. Metab. Res. V. 19. № 8. P. 367–370. https://doi.org/10.1055/s-2007-1011826
Eales J.G., Shostak S. 1985. Free T4 and T3 in relation to total hormone, free hormone indices, and protein in plasma of rainbow trout and arctic charr // Gen. Comp. Endocrinol. V. 58. № 2. P. 291–302. https://doi.org/10.1016/0016-6480(85)90345-4
Judd S. 2012. Na+/K+-ATPase isoform regulation in three-spine stickleback (Gasterosteus aculeatus) during salinity acclimation: M.S. Thesis. Chicago: DePaul Univ., 91 p.
Karnaky K.J.Jr. 1986. Structure and function of the chloride cell of Fundulus heteroclitus and other teleosts // Am. Zool. V. 26. № 1. P. 209–224. https://doi.org/10.1093/icb/26.1.209
Kay W.R., Halse S.A., Scanlon M.D., Smith M.J. 2001. Distribution and environmental tolerances of aquatic macroinvertebrate families in the agricultural zone of southwestern Australia // J. North Am. Benthol. Soc. V. 20. № 2. P. 182–199. https://doi.org/10.2307/1468314
Kefford B.J., Papas P.J., Metzeling L., Nugegoda D. 2004. Do laboratory salinity tolerances of freshwater animals correspond with their field salinity? // Environ. Pollut. V. 129. № 3. P. 355–362. https://doi.org/10.1016/j.envpol.2003.12.005
Kelly S.P., Wood C.M. 2001. The physiological effects of 3,5',3'-triiodo-L-thyronine alone or combined with cortisol on cultured pavement cell epithelia from freshwater rainbow trout gills // Gen. Comp. Endocrinol. V. 123. № 3. P. 280–294. https://doi.org/10.1006/gcen.2001.7679
Klaren P.H.M., Geven E.J.W., Flik G. 2007. The involvement of the thyroid gland in teleost osmoregulation // Fish Osmoregulation. Boca Raton: CRC Press. P. 35–65. https://doi.org/10.1201/9780429063909
Kumar A.B., Schofield P.J., Raj S., Satheesh S. 2018. Salinity tolerance of non-native suckermouth armoured catfish (Loricariidae: Pterygoplichthys sp.) from Kerala, India // Manag. Biol. Invasions. V. 9. № 1. P. 49–57. https://doi.org/10.3391/mbi.2018.9.1.05
Levin B.A., Phuong P.H., Pavlov D.S. 2008. Discovery of the Amazon sailfin catfish Pterygoplichthys pardalis (Castelnau, 1855) (Teleostei: Loricariidae) in Vietnam // J. Appl. Ichthyol. V. 24. № 6. P. 715–717. https://doi.org/10.1111/j.1439-0426.2008.01185.x
Madsen S.S., Kiilerich P., Tipsmark C.K. 2009. Multiplicity of expression of Na+,K+-ATPase α-subunit isoforms in the gill of Atlantic salmon (Salmo salar): cellular localisation and absolute quantification in response to salinity change // J. Exp. Biol. V. 212. № 1. P. 78–88. https://doi.org/10.1242/jeb.024612
McCormick S.D. 1995. 11 Hormonal control of gill Na+,K+-ATPase and chloride cell function // Fish Physiol. V. 14. P. 285–315. https://doi.org/10.1016/S1546-5098(08)60250-2
Myers G.S. 1949. Salt-tolerance of fresh-water fish groups in relation to zoogeographical problems // Bijdr. Dierkd. V. 28. № 1. P. 315–322. https://doi.org/10.1163/26660644-02801038
Orfinger A.B., Goodding D.D. 2018. The global invasion of the suckermouth armored catfish genus Pterygoplichthys (Siluriformes: Loricariidae): annotated list of species, distributional summary, and assessment of impacts // Zool. Stud. V. 57. Article 7. https://doi.org/10.6620/ZS.2018.57-07
Peter M.C.S., Lock R.A.C., Bonga S.E.W. 2000. Evidence for an osmoregulatory role of thyroid hormones in the freshwater Mozambique tilapia Oreochromis mossambicus // Gen. Comp. Endocrinol. V. 120. № 2. P. 157–167. https://doi.org/10.1006/gcen.2000.7542
Serov D.V. 2004. Harnischwelse in Südostasien // Die Aquarium- und Terrariumzeitschrift. № 2. P. 18–19.
Stevens P.W., Blewett D.A., Casey J.P. 2006. Short-term effects of a low dissolved oxygen event on estuarine fish assemblages following the passage of Hurricane Charley // Estuaries and Coasts. J ERF. V. 29. № 6. P. 997–1003. https://doi.org/10.1007/BF02798661
Stolbunov I.A., Tran Duc Dien, Armbruster J.W. 2020. Suckermouth-armored catfish (Siluriformes: Loricariidae) of Central and Southern Vietnam // Inland Water Biol. V. 13. № 4. P. 626–639. https://doi.org/10.1134/S1995082920040100
Tipsmark C.K., Madsen S.S., Seidelin M. et al. 2002. Dynamics of Na+, K+, 2Cl– cotransporter and Na+, K+ -ATPase expression in the branchial epithelium or brown trout (Salmo trutta) and Atlantic salmon (Salmo salar) // J. Exp. Zool. V. 293. № 2. P. 106–118. https://doi.org/10.1002/jez.10118
Welcomme R.L., Vidthayanom C. 2003. The impacts of introductions and stocking of exotic species in the Mekong Basin and policies for their control // MRC Tech. Pap. № 9. 37 p. https://doi.org/10.52107/mrc.akbo77
Zworykin D.D., Budaev S.V. 2013. Non-indigenous armoured catfish in Vietnam: invasion and systematics // Ichthyol. Res. V. 60. № 4. P. 327–333. https://doi.org/10.1007/s10228-013-0356-9
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


