Вопросы ихтиологии, 2022, T. 62, № 6, стр. 783-788
Гидравлическая структура биотопа влияет на риск заражения рыб трематодами
В. Н. Михеев 1, *, А. Ф. Пастернак 2, Й. Таскинен 3
1 Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
2 Институт океанологии РАН – ИО РАН
Москва, Россия
3 Университет Ювяскюля
Ювяскюля, Финляндия
* E-mail: vicnikmik@gmail.com
Поступила в редакцию 25.04.2022
После доработки 17.05.2022
Принята к публикации 18.05.2022
- EDN: GFABPT
- DOI: 10.31857/S0042875222060224
Аннотация
Представлены результаты изучения изменчивости заражённости сеголеток микижи Oncorhynchus mykiss трематодами Diplostomum pseudospathaceum при разных гидравлических режимах в экспериментальной установке с возможностью регулирования скорости течения и неоднородности среды. Средняя заражённость рыб в условиях течения снижалась в 1.5 раза по сравнению со стоячей водой. Увеличение скорости потока от 3.2 до 11.3 см/с не приводило к дальнейшему снижению заражённости, тогда как межиндивидуальная изменчивость заражённости (коэффициент вариации) монотонно возрастала от опытов в стоячей воде (20%) к условиям с быстрым течением (40%). Уменьшение средней заражённости и возрастание изменчивости в неоднородном потоке воды свидетельствует о том, что некоторые рыбы успешно избегают заражения паразитами. Это может достигаться за счёт перераспределения взвешенных в толще воды церкарий между участками с разной скоростью течения и поведения рыб, позволяющего им выбирать участки с низкой концентрацией паразитов.
Мелкомасштабная структура течений наряду с другими абиотическими факторами формирует мозаику физической неоднородности среды, влияющую на многие стороны жизнедеятельности гидробионтов и их взаимодействия (Hughes, Dill, 1990; Wiens, 2002; Михеев, 2006). В многочисленных исследованиях, посвящённых экологии и поведению молоди лососёвых рыб (Salmonidae) в пресноводный период их жизни, наибольшее внимание уделяли гидравлической и топографической структуре биотопов, наличию убежищ, доступности корма, внутри- и межвидовой конкуренции, прессу хищников (Chapman, 1966; Parker, Barnes, 2014; Lusardi et al., 2018). Рассматривая взаимодействие биотических и абиотических факторов, исследователи чаще всего обращали внимание на роль течений в миграционном и пищевом поведении (Fausch, 1984; Grant, 1990; Pavlov, Mikheev, 2017), а также на роль физических убежищ, обеспечивающих защиту от хищников (Wilzbach, 1985; Anholt, Werner, 1995; Михеев и др., 2010).
Паразитов, как важный фактор, влияющий на поведение и биотические взаимодействия, стали рассматривать сравнительно недавно (Barber et al., 2000; Moore, 2002). Наряду с хищниками паразитов в экологии относят к категории “естественных врагов” (natural enemies ecology) (Raffel et al., 2008; Koprivnikar, Penalva, 2015), но влияние хищников и паразитов рассматривают чаще всего по отдельности, хотя есть веские причины учитывать их взаимодействие. Под влиянием паразитов животное может быть более (Lafferty, Morris, 1996; Seppälä et al., 2004; Mikheev et al., 2010) или менее (Weinreich et al., 2013; Gopko et al., 2015) доступным для хищника. В присутствии хищника, затрачивая время и энергию на защитное поведение, животное может становиться более доступным для паразитов (Гопко, Михеев, 2017).
Течения – важнейший фактор распространения мелких гидробионтов со слабыми плавательными возможностями. Исследователей экологии и поведения рыб их пассивное перемещение, или “дрифт”, интересует как фактор, влияющий на доступность кормовых объектов для рыб, в том числе для молоди лососёвых (Hughes, Dill, 1990; Fausch, 1993). Не удивительно, что подавляющее большинство работ на эту тему связано с реками и ручьями.
Ранее мы показали, что церкарии трематод Diplostomum pseudospathaceum, которым рыбы служат вторым промежуточным хозяином, используют создаваемые рыбами вентиляционные токи внутрь ротовой полости и проникают в хозяина преимущественно через жабры (Mikheev et al., 2014). Для паразита этот механизм крайне важен, поскольку активные движения к рыбе и попытки проникновения церкарии предпринимают, если они оказываются от неё на расстоянии не более 3–8 мм (Haas et al., 2008). Вентиляционные токи эффективно работают как механизм направленного переноса паразитов к рыбе в стоячей воде. Будет ли его эффективность меняться в условиях течения? Играет ли при этом роль скорость потока и его неоднородность, вызванная присутствием препятствий?
Для поиска ответов на эти вопросы были поставлены эксперименты в установке с регулируемой скоростью потока воды и возможностью манипулирования доступностью убежищ для рыб (сеголетки микижи Oncorhynchus mykiss). В качестве паразита использовали церкарий D. pseudospathaceum. Рабочие гипотезы предусматривали возможности изменения заражённости в условиях течения: 1) повышения заражённости за счёт образования скоплений паразитов в затишных участках, используемых рыбами как убежища; 2) снижения заражённости, если рыбы выбирают участки с повышенной скоростью течения, где концентрация и локомоторные возможности паразитов ниже.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили на биологической станции Конневеси Университета Ювяскюля (Финляндия). Сеголетки O. mykiss (средняя длина по Смиту ± SD 6.97 ± 0.71 см) были получены с рыбной фермы, где их содержали в артезианской воде, что предотвращало заражение паразитами до экспериментов. Рыб содержали в 150-литровом проточном бассейне при температуре 14–15°С и фотопериоде 15 : 9 ч (свет : темнота). Кормили рыб два раза в день гранулированным кормом соответствующего размера. Церкарии D. pseudospathaceum были получены от 20 моллюсков Lymnaea stagnalis из озера Конневеси. Моллюсков держали в темноте в холодильнике при температуре 7°C. За 3–4 ч до экспериментов моллюсков выставляли на свет при температуре 20°C, что стимулировало выделение церкарий. Концентрация церкарий во всех экспериментах равнялась 150 экз/л. В каждой повторности использовали трёх случайно выбранных рыб, которых акклимировали к условиям эксперимента в течение 15 мин в воде без паразитов, а затем добавляли церкарий, распределяя их равномерно по всей площади бассейна. Эту процедуру проводили как в опытах со стоячей водой, так и с течением. В последнем случае паразитов добавляли в стоячую воду непосредственно перед инициацией течения. Более подробно экспериментальные процедуры при изучении взаимодействий в системе “O. mykiss–D. pseudospathaceum” изложены ранее (Seppälä et al., 2004; Mikheev et al., 2010).
Эксперименты проводили в течение 15 мин в замкнутых кольцевых каналах длиной 78 см, шириной 20 см и глубиной 13 см. Они были не проточными, и в каждой экспериментальной повторности их заполняли 24 л озёрной воды, профильтрованной через планктонное сито (размер ячеи 150 мкм). Дно и стенки канала были тёмно-серого цвета. В половине экспериментов на дно канала помещали убежище – тёмную керамическую пластину 12 × 12 см, опиравшуюся углами на округлые камни диаметром ~ 4 см. Два скоростных режима течения воды (3.2 и 11.3 см/с) обеспечивали с помощью регулируемого вентилятора, расположенного в 5 см над поверхностью воды. Скорость течения на поверхности измеряли с использованием дрейфующего поплавка. В предварительных наблюдениях с устоявшимся течением (для этого требовалось ~ 5 мин) мы оценивали градиенты скорости течения на качественном уровне. Наблюдали два наиболее отчётливых градиента: 1) от поверхности до дна (с минимумом у дна); 2) от внешней к внутренней стенке канала (у внутренней стенки течение замедлялось и практически исчезало у дна). В опытах с наличием убежища образовывались участки с почти неподвижной водой, расположенные вниз по течению от камней. Таким образом, гидравлическая неоднородность имела место в обоих вариантах экспериментов, но при наличии убежища она заметно усложнялась.
Всего выполнено шесть экспериментов с разными сочетаниями гидравлических условий и наличия/отсутствия убежища: в стоячей воде, при слабом течении 3.2 см/с, при сильном течении 11.3 см/с. При каждом режиме были варианты с убежищем и без него. После экспериментов группы рыб из каждой повторности содержали в отдельных проточных аквариумах, где их кормили в прежнем режиме. Через двое суток, когда все паразиты достигали места локализации (хрусталики глаз) в рыбах, последних усыпляли раствором MS-222 и под бинокуляром подсчитывали число метацеркарий. В каждом из шести экспериментов было выполнено по шесть повторностей. В сумме было исследовано 108 рыб. В ходе экспериментов все рыбы оказались заражёнными, но с разной интенсивностью инвазии (заражённостью). Для каждой из шести экспериментальных групп распределение средней интенсивности инвазии (суммарное число метацеркарий в обоих глазах в среднем на одну рыбу) было проверено на нормальность с применением W-теста Шапиро–Уилка. Все выборки удовлетворяли критерию нормальности, что позволило использовать для дальнейшего анализа двухфакторный параметрический дисперсионный анализ (Two-way ANOVA) с последующим попарным сравнением выборок (тест Тьюки).
РЕЗУЛЬТАТЫ
Средняя интенсивность инвазии рыб как при низкой, так и при высокой скорости течения снижалась по сравнению с экспериментами в стоячей воде в 1.5 раза (рис. 1). Различия между заражённостью рыб в стоячей воде и на течении были высоко достоверными (Two-way ANOVA: F = 34.5, p < 0.0001). Влияние убежища было недостоверным (p = 0.63), но между этими факторами (течение и убежище) обнаружено достоверное взаимодействие (p = 0.012). Это означает, что влияние убежища на интенсивность инвазии рыб в стоячей и проточной воде было разнонаправленным. Попарные сравнения заражённости во всех вариантах “убежище–нет убежища” при разных гидравлических условиях не выявили достоверных различий (тест Тьюки).
Рис. 1.
Средняя интенсивность инвазии метацеркариями Diplostomum pseudospathaceum сеголеток микижи Oncorhynchus mykiss в условиях течения и в стоячей воде: ( ) – без убежища, (
) – без убежища, (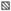 ) – с убежищем, ($ \bot - $) – стандартная ошибка.
) – с убежищем, ($ \bot - $) – стандартная ошибка.
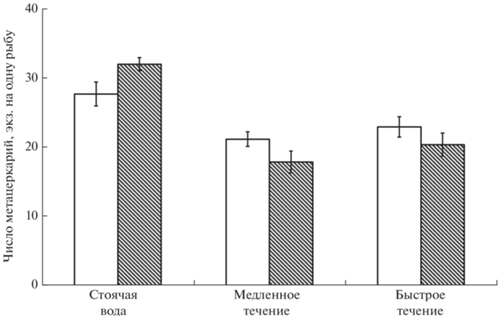
Наряду с результатами анализа средних значений заражённости не менее интересными и неожиданными оказались изменения показателя вариабельности интенсивности инвазии рыб в зависимости от гидравлических условий (рис. 2). Самые низкие значения коэффициентов вариации (~20%) зарегистрированы у рыб, контактировавших с паразитами в стоячей воде. С увеличением скорости течения вариабельность интенсивности инвазии возрастала: ~30% при слабом течении и ~40% –при сильном. При столь значительном разбросе значений и относительно низком среднем уровне интенсивности инвазии часть рыб в условиях довольно высокой скорости течения была заражена совсем слабо – одна–семь метацеркарий на рыбу при средних значениях ~ 20 (рис. 1).
Рис. 2.
Коэффициенты вариации (CV) средней интенсивности инвазии метацеркариями Diplostomum pseudospathaceum сеголеток микижи Oncorhynchus mykiss в условиях течения и в стоячей воде. Обозначения см. на рис. 1.
ОБСУЖДЕНИЕ
На течении интенсивность инвазии сеголеток O. mykiss метацеркариями D. pseudospathaceum была значительно ниже, чем в стоячей воде. От скорости течения этот эффект не зависел: как на медленном (3.2 см/с), так и на быстром (11.3 см/с) течении среднее число паразитов в хрусталиках глаз рыб снижалось в 1.5 раза. Иная зависимость обнаружена для другого важного популяционного показателя – индивидуальной изменчивости по заражённости. Увеличение скорости течения вызывало монотонное возрастание коэффициента вариации интенсивности инвазии – от 20 до 40% соответственно в стоячей воде и на быстром течении.
Рассмотрим два возможных механизма, объясняющих эти результаты. Первый из них предполагает нарушение под влиянием течения вентиляционных токов воды, создаваемых рыбой и направляющих взвешенных в воде паразитов к жабрам. Ведущая роль поступления церкарий D. pseudospathaceum в рыбу через жабры была установлена нами ранее (Mikheev et al., 2014). Если бы нарушение вентиляционных токов играло главную роль в формировании картины заражённости, то этот эффект скорее всего зависел бы от скорости течения. Другой возможный механизм снижения заражённости рыб в условиях течения связан с формированием неоднородной гидравлической структуры потока, в котором образуются зоны с высокой и низкой скоростью течения, вплоть до появления у дна устойчивых застойных участков. В них могут накапливаться взвешенные в воде паразиты, что снижает их концентрацию на других участках с более высокой скоростью течения. Молодь рыб, добывающая корм в потоке воды, выбирает участки с оптимальной скоростью течения, где проносится сравнительно много потенциальных жертв (Fausch, 1984; Hughes, Dill, 1990; Михеев, 2006). Выбирая такие участки, рыбы могут не только получать больше корма, но и избегать слишком высокой заражённости паразитами.
С увеличением скорости течения гидравлическая неоднородность среды возрастает, что делает картину распределения участков с разной скоростью более контрастной. Этим можно объяснить значительное повышение индивидуальной изменчивости интенсивности инвазии рыб с увеличением скорости потока. В зависимости от социального статуса, пресса хищников или пищевой мотивации одни рыбы могут проводить больше времени в местах с более высокой, а другие – с более низкой скоростью течения, где накапливаются паразиты. Средняя заражённость будет зависеть от числа рыб в группе, использующих те или иные участки биотопа.
Другой важный аспект физической неоднородности биотопа – наличие ориентиров и убежищ, существенно влияющих на поведение рыб (Михеев, 2006; Михеев и др., 2010), что, в свою очередь, может влиять на уязвимость рыб для паразитов (Mikheev et al., 2020). Достоверных различий в заражённости рыб при сравнении ситуаций с убежищем и без него не отмечено ни при одном из исследованных нами гидравлических режимов. Вероятно, это связано с небольшой продолжительностью экспериментов (15 мин), в то время как территориальные отношения среди рыб, влияющие на заражение паразитами, развиваются в течение более длительного времени (не менее 30 мин) (Mikheev et al., 2020). Тем не менее достоверный эффект взаимодействий между факторами “течение” и “убежище” указывает на некоторую роль убежищ в отношениях рыбы-паразиты даже в наших кратковременных экспериментах. Повышение заражённости в стоячей воде при наличии убежища позволяет предположить, что в этой ситуации рыбы быстрее обследуют обстановку и начинают конкурировать за убежище, что усиливает вентиляционные токи и перенос паразитов к рыбе. Ранее было показано, что конкуренция за убежище в стоячей воде приводит к повышению заражённости (Mikheev et al., 2020). Обследование новой обстановки в более сложных и изменчивых условиях в потоке и начало конкурентных отношений, по-видимому, требуют большего времени. Для проверки этого предположения необходимы продолжительные эксперименты с бóльшим числом повторностей.
Полученные результаты позволяют считать, что мелкомасштабная неоднородность водной среды, в формировании которой значительную роль играет структура течений, важна не только в миграционном, оборонительном и пищевом поведении рыб. При взаимодействиях паразит–хозяин гидравлическая структура биотопа может влиять на заражённость рыб через: 1) модификации поведения и распределения рыб и 2) неоднородное размещение паразитов, что даёт рыбам возможность выбирать участки с меньшим риском заражения. Избегать скопления паразитов могут как одиночные рыбы, так и рыбы в группе, но последние делают это с гораздо большим успехом (Mikheev et al., 2013). Эффекты, связанные с гидравлической неоднородностью среды, могут играть роль в отношениях “паразит–хозяин” не только в лотических (Hockley et al., 2014), но и в лимнических экосистемах, например, на мелководье озёр и водохранилищ, где нередки ветровые течения. Хотя течениям в прибрежных биотопах водоёмов озёрного типа внимания уделяется несравнимо меньше, чем в реках, мы считаем, что их экологическая роль явно недооценена. Это относится не только к отношениям типа “хищник–жертва”, но и, возможно, “паразит–хозяин”. Последнее может быть особенно важно, поскольку прибрежные биотопы озёр и водохранилищ отличаются высоким обилием и разнообразием беспозвоночных, прежде всего моллюсков, служащих промежуточными хозяевами многих макропаразитов.
ЗАКЛЮЧЕНИЕ
Поиск и выбор рыбой оптимального участка среды, обеспечивающего максимальную приспособленность, включает в себя соотношение между затратами и получением энергии, а также надёжную защиту от хищников. Результаты нашей работы позволяют считать, что минимизация риска заражения паразитами также важна при выборе оптимального биотопа. Мелкомасштабная неоднородность среды, которая наиболее отчётливо выражена в условиях течения, даёт рыбам возможность выбирать оптимальный участок, учитывая своё состояние и потребности, а также размещение ресурсов и угроз в биотопе. Кроме избегания повышенного риска заражения паразитами в отдельных участках среды проблема выбора оптимального участка также возникает для уже заражённых рыб. Многие паразиты, включая D. pseudospathaceum, способны манипулировать поведением хозяина, делая его более доступным для следующего своего хозяина – рыбоядной птицы. Заметность и доступность заражённых рыб для птиц в гидравлически неоднородном биотопе может зависеть от выбора рыбой участка с той или иной скоростью потока и наличия убежища. При проверке этого предположения надо учитывать степень заражённости рыбы, а также возраст метацеркарий, от которого зависит их способность к манипулированию поведением хозяина.
Список литературы
Гопко М.В., Михеев В.Н. 2017. Паразитические манипуляции фенотипом хозяина: эффекты во внутренней и внешней среде // Журн. общ. биологии. Т. 78. № 6. С. 16–48.
Михеев В.Н. 2006. Неоднородность среды и трофические отношения у рыб. М.: Наука, 191 с.
Михеев В.Н., Афонина М.О., Павлов Д.С. 2010. Неоднородность среды и поведение рыб: элементы неоднородности как ресурс и как источник информации // Вопр. ихтиологии. Т. 50. № 3. С. 378–387.
Anholt B.R., Werner E.E. 1995. Interaction between food availability and predation mortality mediated by adaptive behavior // Ecology. V. 76. № 7. P. 2230−2234. https://doi.org/10.2307/1941696
Barber I., Hoare D., Krause J. 2000. Effects of parasites on fish behaviour: a review and evolutionary perspective // Rev. Fish Biol. Fish. V. 10. № 2. P. 131–165. https://doi.org/10.1023/A:1016658224470
Chapman D.W. 1966. Food and space as regulators of salmonid populations in streams // Am. Nat. V. 100. № 913. P. 345–357. https://doi.org/10.1086/282427
Fausch K.D. 1984. Profitable stream positions for salmonids: relating specific growth rate to net energy gain // Can. J. Zool. V. 62. № 3. P. 441–445. https://doi.org/10.1139/z84-067
Fausch K.D. 1993. Experimental analysis of microhabitat selection by juvenile steelhead (Oncorhynchus mykiss) and coho salmon (O. kisutch) in a British Columbia stream // Can. J. Fish. Aquat. Sci. V. 50. № 6. P. 1198–1207. https://doi.org/10.1139/F93-136
Gopko M.V., Mikheev V.N., Taskinen J. 2015. Changes in host behaviour caused by immature larvae of the eye fluke: evidence supporting the predation suppression hypothesis // Behav. Ecol. Sociobiol. V. 69. № 10. P. 1723–1730. https://doi.org/10.1007/s00265-015-1984-z
Grant J.W.A. 1990. Aggressiveness and foraging behavior of young-of-the-year brook charr, Salvelinus fontinalis // Can. J. Fish. Aquat. Sci. V. 47. № 5. P. 915–920. https://doi.org/10.1139/F90-105
Haas W., Beran B., Loy C. 2008. Selection of the host’s habitat by cercariae: from laboratory experiments to the field // J. Parasitol. V. 94. № 6. P. 1233–1238. https://doi.org/10.1645/GE-1192.1
Hockley F.A., Wilson C.A.M.E., Graham N., Cable J. 2014. Combined effects of flow condition and parasitism on shoaling behaviour of female guppies Poecilia reticulate // Behav. Ecol. Sociobiol. V. 68. № 9. P. 1513–1520. https://doi.org/10.1007/s00265-014-1760-5
Hughes N.F., Dill L.M. 1990. Position choice by drift-feeding salmonids: model and test for Arctic grayling (Thymallus arcticus) in subarctic mountain streams, interior Alaska // Can. J. Fish. Aquat. Sci. V. 47. № 10. P. 2039–2048. https://doi.org/10.1139/F90-228
Koprivnikar J., Penalva L. 2015. Lesser of two evils? Foraging choices in response to threats of predation and parasitism // PLoS One. V. 10. № 1. Article e0116569. https://doi.org/10.1371/journal.pone.0116569
Lafferty K.D., Morris A.K. 1996. Altered behaviour of parasitized killifish increases susceptibility to predation by bird final hosts // Ecology. V. 77. № 5. P. 1390–1397. https://doi.org/10.2307/2265536
Lusardi R.A., Jeffres C.A., Moyle P.B. 2018. Stream macrophytes increase invertebrate production and fish habitat utilization in a California stream // River Res. Applic. V. 34. № 8. P. 1003–1012. https://doi.org/10.1002/rra.3331
Mikheev V., Pasternak A., Taskinen J., Valtonen E.T. 2010. Parasite induced aggression and impaired contest ability in a fish host // Parasites Vectors. V. 3. № 1. Article 17. https://doi.org/10.1186/1756-3305-3-17
Mikheev V.N., Pasternak A.F., Taskinen J., Valtonen E.T. 2013. Grouping facilitates avoidance of parasites by fish // Ibid. V. 6. https://doi.org/10.1186/1756-3305-6-301
Mikheev V.N., Pasternak A.F., Taskinen J., Valtonen E.T. 2014. Increased ventilation by fish leads to a higher risk of parasitism // Ibid. V. 7. Article 281. https://doi.org/10.1186/1756-3305-7-281
Mikheev V.N., Pasternak A.F., Morozov A.Yu., Taskinen J. 2020. Innate antipredator behavior can promote infection in fish even in the absence of predators // Behav. Ecol. V. 31. № 1. P. 267–276. https://doi.org/10.1093/beheco/arz188
Moore J. 2002. Parasites and the behaviour of animals. Oxford: Oxford Univ. Press, 295 p.
Parker T.M., Barnes M.E. 2014. Rearing velocity impacts on landlocked fall Chinook Salmon (Oncorhynchus tshawytscha) growth, condition, and survival // Open J. Anim. Sci. V. 4. № 5. P. 244–252. https://doi.org/10.4236/OJAS.2014.45031
Pavlov D.S., Mikheev V.N. 2017. Downstream migration and mechanisms of dispersal of young fish in rivers // Can. J. Fish. Aquat. Sci. V. 74 № 8. P. 1312–1323. https://doi.org/10.1139/cjfas-2016-0298
Raffel T.R., Martin L.B., Rohr J.R. 2008. Parasites as predators: unifying natural enemy ecology // Trends Ecol. Evol. V. 23. № 11. P. 610–618. https://doi.org/10.1016/j.tree.2008.06.015
Seppälä O., Karvonen A., Valtonen E.T. 2004. Parasite-induced change in host behaviour and susceptibility to predation in an eye fluke–fish interaction // Anim. Behav. V. 68. № 2. P. 257–263. https://doi.org/10.1016/j.anbehav.2003.10.021
Weinreich F., Benesh D.P., Milinski M. 2013. Suppression of predation on the intermediate host by two trophically-transmitted parasites when uninfective // Parasitology. V. 140. № 1. P. 129–135. https://doi.org/10.1017/S0031182012001266
Wiens J.A. 2002. Riverine landscapes: taking landscape ecology into the water // Freshw. Biol. V. 47. № 4. P. 501–515. https://doi.org/10.1046/j.1365-2427.2002.00887.x
Wilzbach M.A. 1985. Relative roles of food abundance and cover in determining the habitat distribution of stream-dwelling cutthroat trout (Salmo clarki) // Can. J. Fish. Aquat. Sci. V. 42. № 10. P. 1668–1672. https://doi.org/10.1139/F85-208
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


