Вопросы ихтиологии, 2023, T. 63, № 6, стр. 704-722
О расширении зоны гибридизации гольцов рода Salvelinus – кунджи S. leucomaenis и северной мальмы S. malma (Salmonidae) – в реках Камчатского полуострова
К. В. Кузищин 1, *, М. А. Груздева 1, А. В. Семенова 1
1 Московский государственный университет
Москва, Россия
* E-mail: KK_office@mail.ru
Поступила в редакцию 20.04.2023
После доработки 16.05.2023
Принята к публикации 17.05.2023
- EDN: AKSQAR
- DOI: 10.31857/S0042875223060140
Аннотация
Приведены данные, подтверждающие расширение зоны гибридизации гольцов рода Salvelinus – кунджи S. leucomaenis и северной мальмы S. malma на Камчатке. Если ранее гибриды кунджа × северная мальма встречались только в р. Утхолок на северо-западе полуострова, то начиная с 2009 г. массовая гибридизация между этими видами происходит ещё в двух соседних с Утхолоком реках – Квачине и Снатолвееме. Микросателлитный анализ показал, что гибридные особи характеризуются промежуточными значениями аллельного разнообразия по сравнению с представителями родительских видов, а значения средней ожидаемой гетерозиготности гибридов выше, чем мальмы и кунджи. Результаты анализа материнского наследования у гибридных особей из р. Квачина совпадают с результатами исследований, проведёнными ранее в р. Утхолок, – у всех гибридных особей обнаружен один гаплотип, специфичный для кунджи, что указывает на то, что гибриды происходят от самок кунджи и самцов мальмы. Внешний облик и окраска гибридов кунджа × северная мальма из рек Квачина и Снатолвеем подобны таковым особей из р. Утхолок. Весьма сходные характеристики гибридных особей во всех трёх реках дают основания полагать, что механизм их появления в реках Квачина и Снатолвеем сходен с таковым в р. Утхолок – икру кунджи осеменяют карликовые самцы мальмы. В качестве возможной причины нарушения межвидовой изоляции рассматривается повышение локальной продуктивности рек в результате увеличения численности нерестовых стад горбуши Oncorhynchus gorbuscha и масштабных изменений климата Северной Пацифики. Весьма вероятно, что эти два фактора привели к улучшению условий нагула мальмы в речной период жизни и как частный результат – к росту численности созревающих в реке самцов мальмы.
Выявление закономерностей и путей протекания микроэволюционных процессов у рыб и других животных является актуальной задачей современной фундаментальной биологии. Существенный интерес представляют случаи быстрого видообразования в природных условиях, особенно когда возможно выявление начальных стадий процесса дивергенции и установление его механизма и закономерностей адаптаций новых форм/видов. Одним из путей быстрого (сальтационного) видообразования у рыб является межвидовая гибридизация, лежащая в основе ретикулярного механизма появления новых видов (Arnold, 1992, 1997; Dowling, DeMarais, 1993; Harrison, 1993; Wilson, Bernatchez, 1998; Jiggins, Mallet, 2000; Taylor, 2004; Bougas et al., 2013). Случаи гибридизации между разными видами с последующей интрогрессией чужеродных генов известны у лососёвых рыб семейства Salmonidae (Avise, 1994; Sloss et al., 2008; Hansen, Mensberg, 2009; Hansen et al., 2009; Cooper et al., 2010; Marie et al., 2010, 2011, 2012; Winkler et al., 2011). Среди лососёвых рыб чаще всего межвидовая гибридизация возникает у гольцов рода Salvelinus в водоёмах Северной Пацифики и сопредельных регионов, что обусловлено сложными путями постгляциальной колонизации ими водоёмов высоких широт (Hammar et al., 1991; Verspoor, Hammar, 1991; Bernatchez et al., 1995; Baxter et al., 1997; Glémet et al., 1998; Гудков, 2002; Kanda et al., 2002; Радченко, 2004; Davidson et al., 2010; May-McNally et al., 2015). Важнейшей общей чертой большинства описанных случаев гибридизации гольцов является, по сути, интрогрессия, когда само событие межвидового скрещивания происходило тысячи и десятки тысяч лет назад (Wilson, Bernatchez, 1998; Redenbach, Taylor, 2002). Случаи обнаружения гибридов первого поколения (F1), возникших в наши дни, редки благодаря действию презиготических механизмов изоляции в природных водоёмах у симпатричных видов гольцов (Baxter et al., 1997; Glémet et al., 1998; Yamamoto et al., 2006; Popowich et al., 2011; May-McNally et al., 2015).
На сегодняшний день уникальным случаем межвидового скрещивания у гольцов в дикой природе является масштабная перманентная гибридизация между северной мальмой S. malma и кунджей S. leucomaenis в р. Утхолок на северо-западе Камчатки. Впервые упоминание о существовании вероятных гибридных особей относится к 1970-му г., однако их достоверное описание не было выполнено (Груздева и др., 2018). Начиная с 2003 г. и по настоящее время гибриды кунджа × северная мальма поколения F1 в р. Утхолок регистрируют каждый год, они составляют значительную долю в выборках, представлены половозрелыми и неполовозрелыми рыбами разного возраста (Груздева и др., 2018, 2020). Вместе с тем в соседних реках Квачина и Снатолвеем, в которых начиная с 1970-го г. также проводили исследования с той же интенсивностью, что и в р. Утхолок, гибриды до последнего времени не были выявлены. Однако в конце 2010-х гг. особи с фенотипическими чертами гибридов стали встречаться и в этих реках. Таким образом, к настоящему времени появились данные, что р. Утхолок уже не единственная на Камчатке, где происходит массовая гибридизация между кунджей и северной мальмой. В связи с этим цель исследования – охарактеризовать гибридных особей из рек Квачина и Снатолвеем (северо-запад Камчатки) и провести их сравнительный анализ с гибридами из р. Утхолок.
МАТЕРИАЛ И МЕТОДИКА
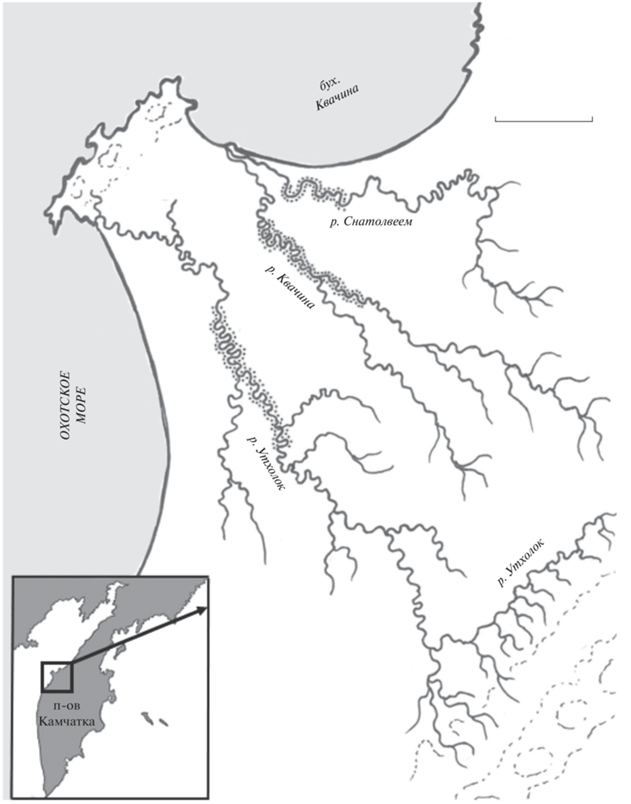
Материал собирали ежегодно в 1994–2022 гг. в трёх реках Северо-Западной Камчатки – Снатолвеем, Квачина и Утхолок (рис. 1). Авторы настоящей публикации принимали непосредственное участие во всех полевых работах во все годы. Указанные три реки расположены недалеко друг от друга и на некотором отдалении от соседних рек. Устье р. Утхолок (57°42ʹ45.42ʺ с.ш., 156°51ʹ37.75ʺ в.д.) расположено у южного основания прибрежного хребта Мыс Утхолок, устье р. Квачина (57°47ʹ05.88ʺ с.ш., 157°06ʹ44.06ʺ в.д.) – у северной оконечности этого хребта. Река Снатолвеем протекает севернее р. Квачина и имеет с ней общее устье. Все три реки принадлежат к так называемому тундровому типу (табл. 1).
Таблица 1.
Характеристика рек и участков сбора материала
| Параметр | Утхолок | Квачина | Снатолвеем |
|---|---|---|---|
| Тип речной системы | Предгорный в верхнем течении, тундровый в среднем и нижнем; есть много притоков в верхнем и среднем течении | Тундровый на всём протяжении, есть несколько коротких ручьёв-притоков в верхнем течении | Тундровый на всём протяжении, крупных притоков нет |
| Расположение истоков* | В отрогах Медвежьего хребта, в гористой местности | Среди стланниковых каменно-берёзовых увалов (высота до 200 м), в тундровой местности | Распадки между низкотравными каменно-берёзовыми холмами (высота 50–100 м), среди заболоченной мокрой тундры |
| Длина реки, км | ~ 140 | ~ 90 | ~ 55 |
| Ширина в устье, м** | 50–55 | 25–30 | 20–25 |
| Расход воды в устье, м3/с** | 12.3–13.4 | 3.2–3.6 | 2.3–2.5 |
| Скорость течения, м/с** | 0.48–0.52 | 0.31–0.41 | 0.26–0.32 |
| Уклон ложа, м/км | 4.2–4.7 | 3.6–3.9 | 3.1–3.5 |
| Участок сбора материала: | |||
| – расположение | Среднее течение | Среднее течение | Среднее и нижнее течение реки |
| – удалённость нижней точки от устья реки, км | 27.8 | 8.1 | 7.6 |
| – длина участка: | |||
| – в км*** | 18.2 | 17.8 | 7.6 |
| – в % длины реки по основному руслу*** | 12.9 | 19.8 | 13.8 |
| – типы биотопов и их доля по площади**** | Плёсы (~49%), перекаты (~22%), эрозионные котлы ниже перекатов (“подперекатные ямы”) (~17%), участки циркуляционного течения вдоль высокого берега (водоворотки) (~12%) на ямах и плёсах | Длинные плёсы (~60–61%) и короткие перекаты (~18%), подперекатные ямы (~12%) и водоворотки (~9–10%) на крутых поворотах реки | Длинные плёсы (~67%) и короткие перекаты (~15%), небольшие подперекатные ямы (~11%), редкие водоворотки (~7%) |
| – состав грунтов | Гравий и песчано-гравийная смесь на плёсах, галька и валуны на перекатах | Песчано-гравийная смесь на плёсах, гравий и галька, реже валуны на перекатах | Песок на плёсах, гравий на перекатах |
Наиболее крупной и разветвлённой из них является р. Утхолок, которая имеет много притоков, наибольшие уклон ложа, скорость течения и мозаичность биотопов в русле (табл. 1). Реки Квачина и Снатолвеем являются типичными малыми тундровыми реками, характерными для западного побережья Камчатского полуострова (Ресурсы поверхностных вод …, 1966). Все три реки сильно меандрируют, формируя резкие (90°–180°) изгибы, протекают единым руслом канального типа, параллельные боковые протоки единичны и имеют слабую проточность в межень (Утхолок и Квачина) или отсутствуют (Снатолвеем). В приустьевой зоне, где действует морской прилив, для всех рек характерна пойменная многорукавность. Для всех рек характерны сравнительно длинные и глубокие плёсы (длина 200–500 м, глубина по стрежню 1.4–1.8 м в межень), короткие мелководные перекаты (глубина 0.3–0.6 м в межень) и подперекатные ямы – эрозионные котлы ниже перекатов (глубина 2.0–2.5 м), в которых формируется устойчивая система циркуляционных воротных и встречных течений. В межень вода во всех реках прозрачная, коричневого цвета с красноватым оттенком.
В то же время, несмотря на ряд различий, связанных прежде всего с размером и водностью, строение русла и типы биотопов во всех трёх реках сходные. Участки, на которых проводились работы, охватывают значительные пространства русла рек (13–20% его протяжённости) (рис. 1), в них присутствуют все типичные для рек элементы геоморфологического строения. Существенных различий в строении участков разных рек не выявлено (табл. 1). Таким образом, участки рек, где проводили сбор первичного материала, в полной мере охватывают все типичные биотопы, встречающиеся в каждой из речных систем, тем самым объективно отражают распределение рыб разных видов и их гибридов.
Работы по обследованию рек и отлову рыб осуществляли с конца августа по середину октября, в преднерестовый период, во время нереста и постнерестового расселения гольцов по руслу рек. Материал собирали в строгом соответствии с протоколом, разработанным в 1994 г. и применяемым по настоящее время, которым регламентируется подход к облову участков рек, процедуре отлова рыб и методам сбора биологических проб.
На протяжении всего периода наблюдений отлов рыб осуществляли преимущественно нахлыстовыми удочками. Такой способ позволяет выполнять сбор данных по принципу “поймал–отпусти” и оценить частоты встречаемости разных видов без умерщвления рыб. Применяли жёсткие снасти 8–9 класса по классификации American Fishing Tackle Manufacturers Association (https://acronyms.thefreedictionary.com) в сочетании с искусственными мушками, смонтированными на крючках размерного класса 1/0 и 2/0. Такие снасти позволяют сократить время вываживания рыбы до 1–2 мин, что резко снижает уровень стресса и минимальную вероятность нанесения рыбе травм (Jenkins, 2003; Bartholomew, Bohnsak, 2005; Cooke et al., 2013; Arlinghaus et al., 2017; Twardek et al., 2018). Практика использования такого рода снасти полностью подтвердила свою высокую эффективность при отлове всех видов лососёвых рыб, встречающихся в реке (проходная микижа Parasalmo (= Oncorhynchus) mykiss, кижуч Oncorhynchus kisutch, северная мальма (далее по тексту – мальма), кунджа, гибриды кунджа × северная мальма (далее по тексту – гибриды кунджа × мальма) длиной тела по Смитту (FL) от 250 до 1000 мм. Отлов проводили силами специально подготовленных инженеров-рыболовов под наблюдением учёных, как правило, группами из трёх–четырёх человек (два–три рыболова и один учёный). Общее усилие составляло пять–шесть рыболовов в день на реках Утхолок и Квачина и три рыболова в день на р. Снатолвеем. Обловы проводили ежедневно в течение 8–10 ч в зависимости от длительности светового дня. Применяли метод подвижного последовательного облова реки по направлению вниз по течению. Таким образом несколько групп рыболовов за световой день облавливали весь предусмотренный протоколом участок на каждой реке. При поимке каждой рыбы учёный проводил осмотр, определял вид, тем самым фиксируя число пойманных рыб каждого вида и выявляя особей с нетипичным обликом. Применяемая методика облова позволяет с высокой точностью оценивать присутствие рыб, их видовой состав, точно выявлять биотоп, в котором они находятся, относительную численность и выявлять гибридов.
Таким образом, участки рек, охваченные исследованиями, техника лова и рыболовное усилие оставались неизменным с 1994 по 2022 гг. Соответственно материал в разные годы был максимально возможно стандартизован, а полученные результаты можно рассматривать как отражающие реальную ситуацию в динамике в каждой из речных систем.
Часть выловленных особей кунджи и мальмы использовали для полного биологического анализа и морфометрии по модифицированной схеме Правдина (1966; Павлов и др., 2001). Исследовали меристические признаки, используемые в систематике гольцов рода Salvelinus (Савваитова, 1989; Черешнев и др., 2002). Также были взяты пробы тканей (кусочек брюшного плавника размером ~1 см2), которые фиксировали в 96%-ном спирте для генетического анализа. Всех особей, имеющих облик гибридов, изымали и подвергали полному биологическому анализу, морфометрии пластических и меристических признаков; у большинства рыб брали пробы тканей для генетических исследований. Возраст мальмы, кунджи и гибридов определяли по отолитам в соответствии с общепринятой методикой с учётом рекомендаций Гудкова и Скопеца (1989), стадии зрелости гонад – по шкале циприноидного типа (Мурза, Христофоров, 1991). Объёмы конкретных выборок на разные виды анализа приведены в соответствующих таблицах и рисунках. Материал обработан методами стандартного унивариантного анализа (Лакин, 1990), для статистических расчётов использована программа Statistica 10.0.
Выборки мальмы и кунджи, а также особи, имеющие облик гибридов, проанализированы методами популяционно-генетического анализа с помощью микросателлитных маркеров ядерной ДНК. Анализ был проведён по девяти локусам, используемым в мировой практике для исследований полиморфизма лососёвых рыб: Smm-3, Smm-10, Smm-17, Smm-21, Omy301, SSOSL456, Sco202, Sco211, Sle6 (Estoup et al., 1993; Slettan et al., 1993; Crane et al., 2004; Dehaan, Arden, 2005; Yamaguchi et al., 2008; Mavarez et al., 2009). Для определения материнской линии гибридов анализировали митохондриальный ген CO1, используя универсальный праймер для рыб (Ivanova et al., 2007). Методики выделения ДНК, амплификации и разделения продуктов полимерной цепной реакции (ПЦР), статистической обработки митохондриальных данных были опубликованы ранее (Груздева и др., 2018).
С помощью программы Micro-Checker 2.2.3 данные были исследованы на возможные ошибки генотипирования, а также присутствие нуль-аллелей (Van Oosterhout et al., 2004; Woram et al., 2004). Основные статистики аллельного разнообразия (число аллелей, число видоспецифичных аллелей (учитывали только аллели, частота встречаемости которых >0.05); аллельное разнообразие, скорректированное по минимальному объёму выборки; наблюдаемая и ожидаемая гетерозиготность), отклонение от равновесия Харди–Вайнберга, коэффициенты инбридинга и популяционной дифференциации были получены в программах GENEPOP (http://genepop.curtin.edu.au) и FSTAT (http://www2.unil.ch/popgen/softwares/fstat.htm).
Число проанализированных особей из р. Снатолвеем было небольшим, а достоверные генетические различия между мальмой, кунджей и гибридами соответственно из рек Квачина и Снатолвеем отсутствуют. В связи с этим выборки разных рек были объединены для дальнейшего анализа.
Для расположения образцов по степени их генетического родства в многомерном пространстве изменчивости на основании многолокусных генотипов был проведён факторный анализ (Factorial Correspondence Analysis) в программе Genetix 4.0 (Belkhir et al., 2004).
РЕЗУЛЬТАТЫ
Впервые гибриды кунджа × мальма в р. Квачина были обнаружены в октябре 2017 г. – две самки FL 476 и 424 мм в возрасте 7+ с гонадами VI–II стадии зрелости. У обеих обнаружены невыметанные икринки в полости тела. Доля гибридов в объединённой выборке гольцов (n = 187) составила ~1%. В сентябре–октябре 2018 г. было поймано уже 11 гибридов, самцов и самок, что составило 6.4% объединённой выборки гольцов (n = 173). В последующие годы гибридов в р. Квачина отлавливали регулярно, и их доля составляла ~4–5% в объединённой выборке гольцов. В р. Снатолвеем первое указание на вероятное обнаружение гибрида относится к 2018-му г. К сожалению, пойманную рыбу не удалось удержать в руках. С формальной точки зрения она не должна была учитываться, тем не менее данный факт заслуживает внимания. Первая достоверная поимка гибрида в р. Снатолвеем состоялась в 2019 г., их отмечали в последующем (табл. 2).
Таблица 2.
Частота встречаемости гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma (ЧВГ) в объединённых выборках гольцов из рек Северо-Западной Камчатки в разные годы
| Год | Квачина | Снатолвеем | ||||
|---|---|---|---|---|---|---|
| Улов, экз | ЧВГ, % | Соотношение в выборке, экз Г : К : М |
Улов, экз | ЧВГ, % | Соотношение в выборке, экз Г : К : М |
|
| 2017 | 187 | 1.1 | 2 : 179 : 6 | 113 | 0 | 0 : 105: 8 |
| 2018 | 173 | 6.4 | 11 : 133 : 29 | 125 | 0* | 0 : 118 : 7 |
| 2019 | 146 | 4.8 | 7 : 127 : 12 | 107 | 0.9 | 1 : 97 : 9 |
| 2021 | 152 | 3.9 | 6 : 128 : 18 | 116 | 3.4 | 4 : 103 : 9 |
Локализация поимок. В реках Квачина и Снатолвеем все особи-гибриды были пойманы в специфических биотопах. Гибриды приурочены к местам, где рядом с основным потоком образуется эрозионный котёл с системой циркуляционных противотечений. Рыбы держатся непосредственно на границе циркуляционного и основного течения. Такие биотопы в реках Квачина и Снатолвеем образуются в местах резкого перехода длинного переката в подперекатный эрозионный котёл, по кромкам небольших речных затонов или в участках асимметричных врезанных излучин речного русла. Из-за разницы в геоморфологии изученных рек количество таких биотопов наибольшее в р. Утхолок, несколько меньше в р. Квачина и относительно невелико в р. Снатолвеем (табл. 1). Вероятнее всего, меньшее число пойманных гибридов в р. Снатолвеем может быть следствием меньшего количества биотопов, предпочитаемых ими.
Диагностические признаки. По внешнему облику и, в первую очередь, по окраске гибриды кунджа × мальма хорошо отличались от родительских видов (рис. 2). Голова тёмно-коричневая, иногда почти чёрная, без пятен; верхняя и нижняя челюсти тёмные, нижняя челюсть по бокам оранжевая; межжаберный промежуток в передней части почти чёрный, в задней – белый; жаберная крышка коричневая или тёмная, жаберные лучи и пасть чёрные. Спина и брюхо бурые или коричневые с округлыми красно-оранжевыми пятнами выше и ниже боковой линии. Эти пятна больше, чем диаметр зрачка, но меньше, чем диаметр глаза, с более светлым по тону ореолом, размытым по краю; ближе к спине пятна мельче. Радужная оболочка глаз коричневато-оранжевая. Плавники серо-коричневые; неветвистые лучи в грудных, брюшных и анальном плавниках утолщённые, белые. По окраске гибридные особи кунджа × мальма из рек Квачина и Снатолвеем сходны с таковыми из р. Утхолок (Груздева и др., 2018).
Рис. 2.
Внешний вид гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma р. Квачина: а – самец длиной тела по Смитту (FL) 455 мм, массой 620 г, VI–II стадия зрелости гонад, пойман 03.10.2019 г.; б – самец FL 448 мм, 602 г, VI–II, 07.10.2019 г.; в – самка FL 435 мм, 525 г, VI–II, 01.10.2021 г.; р. Снатолвеем: г – самка FL 445 мм, 590 г, VI–II, 04.10.2021 г.; д – самец FL 727 мм, 2250 г, VI–II, 12.10.2021 г. а, б, г – прижизненная окраска; в, д – посмертная.

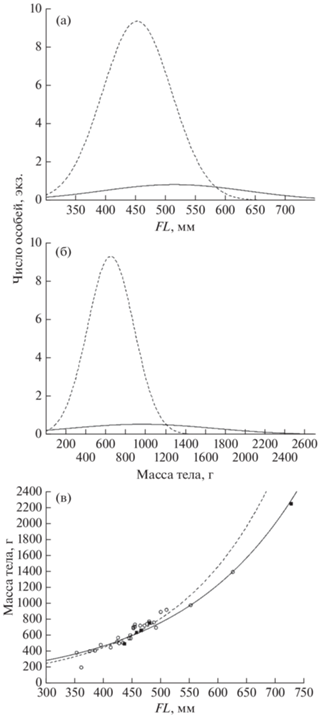
Длина и масса тела. Половой состав. В уловах разных лет средняя длина тела гибридов из рек Квачина и Снатолвеем была сходная, бо́льшая часть особей имела FL 400–550 мм; масса тела варьировала в большей степени – от 400 до 1000 г (рис. 3а, 3б). По соотношению длина–масса тела гибриды из обеих рек в целом сходны (рис. 3в). В то же время максимальные значения длины и массы тела установлены у гибридов из р. Снатолвеем (рис. 3).
Рис. 3.
Распределение гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma из уловов по длине по Смитту (FL) (а) и массе тела (б) и соотношение длина–масса тела (в): (${\text{ - }}^\circ {\text{ - }}^\circ {\text{ - }}$, $\bigcirc $) – р. Квачина (n = = 26), (⸺, $\blacksquare $) – р. Снатолвеем (n = 5). Коэффициент детерминации (R2) для уравнения зависимости массы тела от его длины для особей из р. Квачина – 0.95, р. Снатолвеем – 0.89.
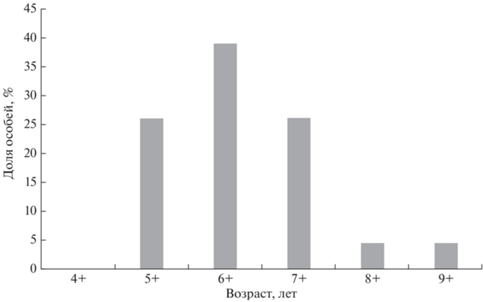
Возрастной и половой состав. Возраст гибридных особей из р. Квачина варьировал от 5+ до 9+ с модальным классом 6+ (рис. 4). Впервые в 2017 г. были пойманы две особи в возрасте 7+, особи в возрасте 5+ и 6+ попадались начиная с 2018 г., а особь самого старшего возраста (9+) была поймана в 2021 г. Гибриды из р. Снатолвеем имели возраст 6+ (модальный класс, 3 экз.), 7+ (1 экз.) и 9+ (1 экз.). Особь в возрасте 9+ была поймана в 2019 г. Возрастной состав гибридов в обеих реках указывает на то, что, вероятнее всего, межвидовая гибридизация началась в 2009 г.
Рис. 4.
Возрастной состав гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma из р. Квачина (объединённая выборка за все годы, n = 23).
В выборке из р. Квачина соотношение полов среди гибридных особей было 1 : 1 (по 13 самок и самцов), в р. Снатолвеем пойманы три самки и два самца. Все особи из обеих рек были половозрелыми. В р. Квачина рыбы имели половые железы VI–II стадии зрелости, лишь у одной особи гонады были на III стадии. В полости тела у всех самок с гонадами VI–II стадии зрелости обнаружены остатки невыметанной икры (от 4 до 112 шт., чаще 12–18 шт.), средний диаметр икринок 5.70 (5.54–6.00) мм. Все особи из р. Снатолвеем (и самцы, и самки) имели гонады на стадии зрелости VI–II. В полости тела самок обнаружены невыметанные икринки – от 16 до 34 (чаще 23–25) шт. средним диаметром 5.81 (5.61–6.21) мм. Таким образом, практически все гибридные особи из обеих рек представляли собой постпроизводителей, то есть рыб, которые нерестились в год поимки. Семенники в передней части были наполнены невыметанной семенной жидкостью, в задней части – спавшиеся, без семенной жидкости. Это указывает на то, что гибридные особи достигают половой зрелости и участвуют в нересте.
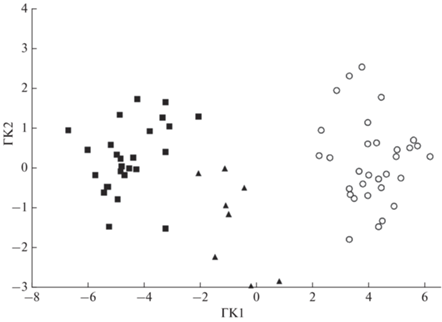
Меристические признаки. Гибриды кунджа × мальма из рек Квачина и Снатолвеем по меристическим признакам сходны между собой. По основным диагностическим признакам, используемым в систематике гольцов рода Salvelinus – числу чешуй в боковой линии, жаберных тычинок, пилорических придатков и позвонков, гибриды занимают промежуточное положение между родительскими видами. Анализ распределений значений меристических признаков показал существенную трансгрессию рядов изменчивости между выборками из рек Квачина и Снатолвеем по всем показателям (табл. 3). Анализ отношений родительских видов и гибридов из р. Квачина, выполненный методом главных компонент по совокупности меристических признаков показал, что факторная область гибридов занимает промежуточное положение между мальмой и кунджей (рис. 5).
Таблица 3.
Меристические признаки гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma из рек Квачина и Снатолвеем
| Признак | Квачина | Снатолвеем | ||||
|---|---|---|---|---|---|---|
| Кунджа (n = 31) |
Гибриды (n = 19) |
Мальма (n = 26) |
Кунджа (n = 25) |
Гибриды (n = 4) |
Мальма (n = 11) |
|
| ll | $\frac{{123.5 \pm 0.28}}{{120{\kern 1pt} --{\kern 1pt} 126}}$ | $\frac{{129.1 \pm 0.11}}{{127{\kern 1pt} --{\kern 1pt} 133}}$ | $\frac{{131.6 \pm 0.35}}{{129{\kern 1pt} --{\kern 1pt} 135}}$ | $\frac{{122.8 \pm 0.21}}{{118{\kern 1pt} --{\kern 1pt} 125}}$ | $\frac{{128.5 \pm 0.24}}{{123{\kern 1pt} --{\kern 1pt} 131}}$ | $\frac{{131.9 \pm 0.25}}{{125{\kern 1pt} --{\kern 1pt} 134}}$ |
| D | $\frac{{10.3 \pm 0.08}}{{10{\kern 1pt} --{\kern 1pt} 11}}$ | $\frac{{10.3 \pm 0.12}}{{10{\kern 1pt} --{\kern 1pt} 11}}$ | $\frac{{10.4 \pm 0.10}}{{10{\kern 1pt} --{\kern 1pt} 11}}$ | $\frac{{10.3 \pm 0.10}}{{10{\kern 1pt} --{\kern 1pt} 11}}$ | $\frac{{10.1 \pm 0.20}}{{9{\kern 1pt} --{\kern 1pt} 11}}$ | $\frac{{10.3 \pm 0.17}}{{9{\kern 1pt} --{\kern 1pt} 11}}$ |
| A | $\frac{{8.0 \pm 0.05}}{{7{\kern 1pt} --{\kern 1pt} 9}}$ | $\frac{{8.3 \pm 0.12}}{{8{\kern 1pt} --{\kern 1pt} 9}}$ | 8.00 | $\frac{{8.1 \pm 0.10}}{{7{\kern 1pt} --{\kern 1pt} 9}}$ | $\frac{{8.4 \pm 0.18}}{{8{\kern 1pt} --{\kern 1pt} 9}}$ | $\frac{{8.1 \pm 0.14}}{{8{\kern 1pt} --{\kern 1pt} 9}}$ |
| P | $\frac{{13.2 \pm 0.08}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.8 \pm 0.17}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{13.1 \pm 0.10}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.9 \pm 0.11}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.8 \pm 0.25}}{{12{\kern 1pt} --{\kern 1pt} 15}}$ | $\frac{{13.3 \pm 0.21}}{{12{\kern 1pt} --{\kern 1pt} 15}}$ |
| V | $\frac{{7.8 \pm 0.07}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{7.7 \pm 0.09}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{7.5 \pm 0.10}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{7.8 \pm 0.10}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{7.9 \pm 0.18}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ | $\frac{{7.8 \pm 0.14}}{{7{\kern 1pt} --{\kern 1pt} 8}}$ |
| rb1 | $\frac{{12.4 \pm 0.09}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.4 \pm 0.13}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.3 \pm 0.09}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.5 \pm 0.12}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.3 \pm 0.22}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ | $\frac{{12.6 \pm 0.19}}{{12{\kern 1pt} --{\kern 1pt} 14}}$ |
| rb2 | $\frac{{12.1 \pm 0.09}}{{11{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.2 \pm 0.12}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{11.9 \pm 0.10}}{{11{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.2 \pm 0.12}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.1 \pm 0.20}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ | $\frac{{12.4 \pm 0.18}}{{12{\kern 1pt} --{\kern 1pt} 13}}$ |
| sp.br. | $\frac{{18.6 \pm 0.21}}{{17{\kern 1pt} --{\kern 1pt} 21}}$ | $\frac{{21.9 \pm 0.18}}{{20{\kern 1pt} --{\kern 1pt} 24}}$ | $\frac{{24.6 \pm 0.27}}{{23{\kern 1pt} --{\kern 1pt} 26}}$ | $\frac{{18.4 \pm 0.22}}{{16{\kern 1pt} --{\kern 1pt} 22}}$ | $\frac{{22.1 \pm 0.25}}{{20{\kern 1pt} --{\kern 1pt} 25}}$ | $\frac{{24.8 \pm 0.33}}{{23{\kern 1pt} --{\kern 1pt} 29}}$ |
| pc | $\frac{{20.2 \pm 0.36}}{{17{\kern 1pt} --{\kern 1pt} 23}}$ | $\frac{{24.2 \pm 0.26}}{{21{\kern 1pt} --{\kern 1pt} 26}}$ | $\frac{{26.2 \pm 0.27}}{{23{\kern 1pt} --{\kern 1pt} 29}}$ | $\frac{{20.8 \pm 0.41}}{{18{\kern 1pt} --{\kern 1pt} 23}}$ | $\frac{{25.6 \pm 1.03}}{{20{\kern 1pt} --{\kern 1pt} 27}}$ | $\frac{{27.1 \pm 0.48}}{{22{\kern 1pt} --{\kern 1pt} 30}}$ |
| vert. | $\frac{{61.3 \pm 0.15}}{{60{\kern 1pt} --{\kern 1pt} 63}}$ | $\frac{{63.1 \pm 0.15}}{{62{\kern 1pt} --{\kern 1pt} 64}}$ | $\frac{{63.9 \pm 0.19}}{{62{\kern 1pt} --{\kern 1pt} 66}}$ | $\frac{{61.6 \pm 0.18}}{{60{\kern 1pt} --{\kern 1pt} 63}}$ | $\frac{{63.3 \pm 0.42}}{{62{\kern 1pt} --{\kern 1pt} 64}}$ | $\frac{{{\text{ }}63.9 \pm 0.27}}{{62{\kern 1pt} --{\kern 1pt} 66}}$ |
Примечание. Над чертой – среднее значение и его ошибка, под чертой – пределы варьирования значений признака. D, A, P, V – число ветвистых лучей соответственно в спинном, анальном, грудных и брюшных плавниках; rb1, rb2 – число жаберных лучей слева и справа. Здесь и в табл. 5: ll – число прободённых чешуй в боковой линии; sp.br. – число жаберных тычинок, pc – число пилорических придатков, vert. – число позвонков. Здесь и в табл. 4, 5: n – число изученных особей, экз.
Рис. 5.
Фенетические отношения гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma ($\blacktriangle $), кунджи ($\blacksquare $) и северной мальмы (○) из р. Квачина, оценённые методом главных компонент (ГК1, 2) по совокупности 10 меристических признаков.
Генетическая характеристика. Внешний облик гибридных особей из рек Квачина и Снатолвеем хорошо соответствует таковому гибридов, обнаруженных ранее в р. Утхолок. В связи с этим есть основания полагать, что их происхождение и генетическая характеристика также будут иметь промежуточный характер. Однако необходимо принять во внимание, что в каждой из рек (Утхолок, Квачина и Снатолвеем) обитают самостоятельные популяции мальмы и кунджи, отличающиеся по комплексу морфологических признаков (Савваитова, 1989; Гриценко и др., 1998; Савваитова и др., 2007). В связи с этим представляется важным провести анализ генетических особенностей гибридов между кунджей и мальмой из новых водоёмов.
Возможных ошибок генотипирования при анализе микросателлитных локусов обнаружено не было. Выборка фенотипически гибридных особей была полиморфна по всем изученным маркерам. Диапазон размеров аллелей в видоспецифичных локусах Sco202 и SSOSL456 (с неперекрывающимся диапазоном размеров аллелей у мальмы и кунджи) варьировал от минимальных значений, характерных для кунджи, до почти максимальных, описанных у мальмы. Коэффициент инбридинга имел отрицательные значения по большинству локусов, что свидетельствует об избытке гетерозиготных генотипов. В четырёх локусах из девяти избыток гетерозигот был достоверно значим (p < 0.05). Гибридные особи характеризуются промежуточными значениями аллельного разнообразия по сравнению с представителями родительских видов в выборках, а значения средней ожидаемой гетерозиготности гибридов выше, чем у мальмы и кунджи (табл. 4).
Таблица 4.
Генетическая изменчивость северной мальмы Salvelinus malma, кунджи S. leucomaenis и их гибридов в объединённых выборках рек Квачина и Снатолвеем
| Локус | Северная мальма (n = 58) | Кунджа (n = 59) | Гибриды (n = 15) | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A | AR | APR | Длина гена, п.н | HO | HE | FIS | A | AR | APR | Длина гена, п.н | HO | HE | FIS | A | AR | APR | Длина гена, п.н | HO | HE | FIS | |
| Smm-3 | 5 | 2.73 | – | 116–138 | 0.561 | 0.527 | –0.06 | 2 | 1.42 | – | 116–120 | 0.034 | 0.033 | −0.01 | 4 | 3.93 | – | 116–124 | 1.000 | 0.650 | –0.56 |
| Smm-10 | 22 | 13.70 | 2 | 146–204 | 0.844 | 0.908 | 0.07 | 2 | 1.24 | – | 158–170 | 0.016 | 0.016 | 0.00 | 11 | 10.59 | – | 146–184 | 0.667 | 0.806 | 0.18 |
| Smm-17 | 13 | 6.51 | 1 | 109–137 | 0.293 | 0.469 | 0.37 | 1 | 1.00 | – | 121 | 0.000 | 0.000 | 0.00 | 3 | 2.93 | – | 115–129 | 0.733 | 0.503 | °0.48 |
| Smm-21 | 13 | 9.18 | 2 | 115–149 | 0.827 | 0.839 | 0.01 | 2 | 1.99 | – | 113–115 | 0.322 | 0.316 | −0.01 | 7 | 6.80 | – | 113–147 | 1.000 | 0.779 | –0.29 |
| Sco202 | 3 | 2.16 | 1 | 80–132 | 0.172 | 0.160 | –0.07 | 1 | 1.00 | – | 76 | 0.000 | 0.000 | 0.00 | 2 | 2.00 | – | 76–80 | 0.933 | 0.514 | –0.86 |
| Sco211 | 43 | 20.00 | – | 113–213 | 0.965 | 0.971 | 0.00 | 27 | 15.05 | – | 121–201 | 0.881 | 0.935 | 0.05 | 17 | 16.40 | – | 117–231 | 0.866 | 0.949 | 0.09 |
| SSOSL456 | 15 | 8.76 | 1 | 170–204 | 0.793 | 0.746 | –0.06 | 3 | 2.24 | – | 156–168 | 0.457 | 0.512 | 0.10 | 6 | 5.86 | – | 156–190 | 0.933 | 0.763 | –0.23 |
| Sle6 | 9 | 5.86 | – | 85–107 | 0.586 | 0.655 | 0.10 | 2 | 1.99 | – | 91–93 | 0.237 | 0.326 | 0.27 | 5 | 4.86 | – | 91–101 | 0.400 | 0.491 | 0.19 |
| Omy301 | 10 | 6.03 | – | 66–92 | 0.672 | 0.665 | –0.01 | 4 | 3.71 | 1 | 62–74 | 0.356 | 0.421 | 0.15 | 7 | 7.00 | – | 62–90 | 1.000 | 0.714 | –0.42 |
| Все локусы | 14.7 | 8.32 | 7 | 0.635 | 0.660 | 0.03 | 4.8 | 3.29 | 1 | 0.256 | 0.284 | 0.10 | 6.8 | 6.70 | – | 0.837 | 0.686 | –0.23 | |||
Примечание. A – число аллелей, APR – число приватных аллелей, п.н. – число пар нуклеотидов, FIS – коэффициент инбридинга, “–” – приватные аллели не обнаружены. Полужирным шрифтом выделены статистически значимые отклонения от равновесия Харди–Вайнберга. Здесь и в табл. 5: HO, HE – наблюдаемая и ожидаемая гетерозиготность; AR – число аллелей, скорректированное по минимальному объёму выборки.
Выборки кунджи и мальмы сильно генетически дифференцированы и достоверно различаются по частотам аллелей и генотипов по всем локусам (p < 0.0001). Между родительскими видами и гибридами различия достоверны в большинстве попарных сравнений, кроме различий между мальмой и гибридами по Sco211.
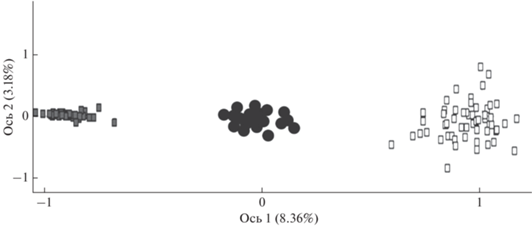
Результаты факторного анализа генотипов представлены на рис. 6. Генотипы мальмы и кунджи формируют две обособленные факторные области. Гибриды занимают в пространстве промежуточное положение, обособленное от родительских видов.
Рис. 6.
Результаты факторного анализа в координатах двух осей особей мальмы Salvelinus malma ($\square $), кунджи S. leucomaenis ( ) и их гибридов ($ \bullet $) из рек Квачина и Снатолвеем на основе генотипов по девяти микросателлитным локусам.
) и их гибридов ($ \bullet $) из рек Квачина и Снатолвеем на основе генотипов по девяти микросателлитным локусам.
Результаты анализа материнского наследования у гибридных особей из р. Квачина совпадают с результатами проведённых ранее исследований (Груздева и др., 2020) гибридов из р. Утхолок. У всех исследованных гибридных особей обнаружен один гаплотип, специфичный для кунджи.
ОБСУЖДЕНИЕ
Проведение мониторинговых исследований на реках Северо-Западной Камчатки позволило установить, что описанный нами ранее случай массовой межвидовой гибридизации у гольцов в р. Утхолок уже не является уникальным. Полученный материал указывает на то, что в реках Квачина и Снатолвеем в последние годы на контрольных участках появились гибриды между кунджей и мальмой, которые стали составным элементом ихтиофауны этих рек. Частота встречаемости гибридов в этих реках в 2019–2022 гг. оказалась сравнимой с таковой в р. Утхолок. Более того, применение молекулярно-генетических методов показало, что их важнейшие генетические параметры аналогичны выявленным ранее (Груздева и др., 2020) у особей р. Утхолок, в том числе и их происхождение от самок кунджи (табл. 4, 5; рис. 6). Анализ регистрации поимок гибридов и их возрастного состава указывает на то, что начало межвидовой гибридизации в реках Квачина и Снатолвеем приходится на 2009 г. Нахождение гибридов между кунджей и мальмой в реках Квачина и Снатолвеем означает, что нарушение презиготических механизмов межвидовой изоляции произошло буквально здесь и сейчас.
Таблица 5.
Сравнительная характеристика гибридов кунджа Salvelinus leucomaenis × северная мальма S. malma из рек Северо-Западной Камчатки
| Показатель | Утхолок* | Квачина | Снатолвеем |
|---|---|---|---|
| Сбор данных, гг. | 2003–2022 | 2017–2021 | 2019–2021 |
| Длина по Смитту, мм | 242–598 (396) | 353–625 (452) | 437–727 (513) |
| Масса тела, г | 191–1790 (672) | 200–1390 (649) | 495–2250 (958) |
| Возраст, лет | 4+…9+ (6+) | 6+…9+ (6+) | 6+…9+ (6+) |
| Соотношение полов | 1 : 1 | 1 : 1 | ~1 : 1** |
| Окраска (фон тела) | Тёмно-коричневый или чёрный; брюхо грязно-коричневое | Тёмно-коричневый с красноватым отливом, брюхо тёмное | Тёмно-коричневый с красноватым или зеленоватым отливом, брюхо тёмное |
| Форма и окраска пятен | Округлые, контрастные красно-оранжевые, больше диаметра зрачка, меньше диаметра глаза. На спине нет мраморовидного рисунка | ||
| Стадия зрелости гонад | VI–II (⁓90%) | VI–II | VI–II |
| ll | 122–142 (129) | 127–133 (129) | 123–131 (128) |
| sp.br. | 18–25 (22) | 20–24 (22) | 20–25 (22) |
| pc | 21–30 (24) | 21–26 (24) | 20–27 (26) |
| vert. | 59–65 (63) | 62–64 (63) | 62–64 (63) |
| Материнское происхождение | Кунджа | Кунджа | Нет данных |
| НЕ/HO | 0.696/0.841 | 0.656/0.787 | 0.667/0.740 |
| AR | 3.3 | 3.2 | 3.0 |
Новые данные о поимках многочисленных гибридов между кунджей и мальмой в р. Квачина хорошо соответствуют ситуации в р. Утхолок. Сравнительный анализ гибридных особей из рек Квачина и Утхолок показал, что в разных реках они происходят от самок кунджи и самцов мальмы, очень схожи по окраске и габитусу, а по меристическим признакам и аллельному разнообразию микросателлитных локусов занимают промежуточное положение между родительскими видами (табл. 5). Существенным является факт почти полного совпадения биотопов, в которых обнаружены гибридные особи во всех трёх реках, причём частота встречаемости гибридов в целом соответствует числу потенциальных биотопов в реках (табл. 1, 2). Показатели генетической изменчивости (средней гетерозиготности и аллельного разнообразия) гибридов из трёх рек очень сходны (табл. 4, 5).
Представляется важным отметить, что в реках Квачина и Снатолвеем, так же как и в р. Утхолок, гибриды достигают половой зрелости и принимают участие в нересте. Интересен факт, что в реках Квачина и Снатолвеем гибридные особи в районах проведения мониторинговых работ были, как и в р. Утхолок, представлены рыбами, совершившими нерест в данном году. Это говорит о том, что биологические особенности гибридов в трёх реках сходные – после нереста гибриды расселяются вниз по течению реки и стремятся занять пространство вплоть до участков приливного подпора. Это указывает на агрессивное освоение жизненного пространства рек гибридными особями.
Весьма сходные характеристики гибридных особей в двух новых реках – Квачине и Снатолвееме – дают основания полагать, что механизм их появления также сходен с таковым в р. Утхолок. Нарушение межвидовой изоляции и массовая гибридизация в р. Утхолок осуществляются за счёт сочетания нескольких уникальных природных факторов. Так, в её притоках нерестилища мальмы и кунджи расположены в непосредственной близости друг от друга (Пичугин и др., 2008; Пичугин, 2015; Павлов и др., 2016; Груздева и др., 2018, 2020), и на этих участках выявлены значительные скопления карликовых самцов мальмы (Павлов и др., 2016). Поэтому наиболее вероятным механизмом межвидового скрещивания мальмы и кунджи в бассейне р. Утхолок является активность карликовых самцов мальмы, осеменяющих икру кунджи (Груздева и др., 2018, 2020). В связи с этим представляется важным более подробно рассмотреть биологические особенности карликовых самцов мальмы и их потенциальные возможности по осеменению икры самок своего вида и самок другого вида – кунджи.
Карликовые самцы (mature male parr) – типичный компонент популяций проходной мальмы в реках Северной Пацифики, их численность, плотность и распределение варьируют в разных реках (Maekawa, Hino, 1986; Kitano, 1996; Черешнев и др., 2002; Behnke, 2002; Павлов и др., 2009, 2016; Груздева и др., 2017; Есин, Маркевич, 2017). На Камчатке, как правило, в реках предгорного типа карликовые самцы мальмы более многочисленны, чем в реках тундрового типа (Павлов и др., 2009, 2016; Груздева и др., 2011а, 2011б, 2014а, 2014б). В малых реках тундрового типа число карликовых самцов мальмы существенно меньше, чем в более крупных реках, например, в р. Квачина карликовых самцов мальмы в 2004–2007 гг. отмечали единично. В малой тундровой р. Кехта карликовые самцы мальмы также весьма малочисленны по сравнению с рядом расположенной предгорной р. Коль (Павлов и др., 2009; Кузищин и др., 2022).
Карликовые самцы могут участвовать в нересте с проходными самками, используя репродуктивную тактику подкрадывания (sneaking) или подскока (streaking) (Hino et al., 1990; Maekawa et al., 1994; Koseki, 2004; Dodson et al., 2013). По мнению ряда исследователей, репродуктивный успех карликовых самцов ниже, чем у проходных самцов. Известно, что крупные самцы отгоняют мелких от гнезда, более того, известны случаи, когда даже самки проявляли агрессию по отношению к мелким карликовым самцам (Maekawa, 1983; Maekawa et al., 1993; Koseki, 2004). В то же время даже с учётом агонистического поведения крупных самцов по отношению к карликовым доля вклада последних в воспроизводство популяции оценивается по разным источникам от 8 до 30% (Maekawa, Hino, 1986; Nakano, 1995; Kitano, 1996; Koseki, 2004).
Способность карликовых самцов осеменять спермой икру крупных самок обусловлена несколькими факторами: 1) их высокой численностью и активностью на нерестилищах (Maekawa, 1983; Nakano, 1995; Koseki, 2004; Dodson et al., 2013); 2) переходом в текучее состояние за 3–4 нед. до начала нереста проходных особей и возможностью вымётывать семенную жидкость и осеменять икру в течение 3–8 нед. после нереста проходных рыб (Daye, Glebe, 1984; Hino et al., 1990; Gage et al., 1995; Taborsky, 1998; Koseki, 2004) и 3) свойством одновременно поедать (склёвывать – pecking) икру проходных самок в гнезде или рядом с гнездом и, как показали подводные наблюдения, одновременно вымётывать сперму, что не отмечено у крупных проходных самцов: такой тип поведения позволяет карликовым самцам, вымётывая сперму, образовывать “облако гамет”, оплодотворяющих икру самок (Hino et al., 1990; Maekawa et al., 1994; Kitano, 1996; Koseki, 2004). В конечном счёте репродуктивный успех карликовых самцов зависит от их численности в водоёме (Maekawa, Ozonato, 1986; Maekawa, Hino, 1990; Hino et al., 1990; Nakano, 1995; Koseki, 2004; Dodson et al., 2013). Карликовые самцы мальмы ведут ярко выраженный оседлый и территориальный образ жизни, занимая биотопы, расположенные вблизи своих нерестилищ (Maekawa, 1983; Maekawa, Hino, 1986; Maekawa et al., 1993; Kitano, 1996; Koseki et al., 2002; Koseki, 2004). В то же время для таких видов, как мальма и сима O. masou, было показано, что при возрастании численности самцов-карликов зона их обитания в реках заметно расширяется и они могут встречаться на значительном удалении от своих нерестилищ (Maekawa, 1983; Maekawa et al., 1993; Morita, Nagasawa, 2010).
Таким образом, учитывая особенности биологии карликовых самцов мальмы, есть все основания полагать, что в реках Квачина и Снатолвеем межвидовая гибридизация также связана с деятельностью карликовых самцов мальмы. Представляется вероятным, что нарушение механизма презиготической изоляции между разными видами гольцов обусловлено произошедшим в конце первого десятилетия XXI в. увеличением численности карликовых самцов мальмы и перекрыванием зоны их обитания с нерестилищами кунджи. Наиболее вероятной причиной увеличения численности карликовых самцов мальмы в реках Квачина и Снатолвеем представляется улучшение условий обитания и нагула мальмы в речных экосистемах, вызванное масштабными изменениями климата в Северной Пацифике и приходом так называемой “тёплой эпохи” (Overland et al., 2008; Bryant, 2009; Abdul-Aziz et al., 2011; Mauger et al., 2017), из-за которой наблюдаются сдвиги абиотических параметров морских и континентальных экосистем и даже изменения в биологических параметрах разных видов лососёвых рыб (Isaak et al., 2012; Wainwright, Weitkamp, 2013; Isaak et al., 2018; Cline et al., 2019; Zhang et al., 2019).
Весьма вероятно, что небольшое количество карликовых самцов мальмы в малых тундровых реках обусловлено, помимо прочих факторов, относительно низкой продуктивностью рек из-за небольшой численности заходящих в них на нерест тихоокеанских лососей рода Oncorhynchus. Известно, что у разных видов лососёвых рыб, и мальмы в частности, численность карликовых самцов и их доля в популяции напрямую зависят от условий нагула в первые годы жизни (Utoh, 1976; Maekawa, Goto, 1982; Maekawa, Onozato, 1986; Thorpe, 1987; Nakano et al., 1996; Morita, Fukuwaka, 2006; Olsen et al., 2006).
Однако, по нашим данным, начиная с 2010 г. в р. Квачина наблюдается заход многочисленных поколений горбуши O. gorbuscha, в том числе и в нечётные годы, которые считаются неурожайными для западного побережья Камчатки. По нашим оценкам, в 1994–2000 гг. численность горбуши в р. Квачина была невелика, для размножения она использовала участки среднего течения на удалении > 15 км от устья, нерест заканчивался до начала сентября. Начиная с 2010 г. для нереста горбуша уже использовала всё пространство реки вплоть до участков, где действует приливной подпор, численность её кратно увеличилась, а нерестовый сезон продолжается до 20-х чисел сентября. Сходная картина наблюдается и в р. Снатолвеем. Кроме того, наши наблюдения выявили и сдвиги в термическом режиме рек. В 1994–2000 гг. температура воды в р. Квачина составляла ~ 8°С в начале сентября и снижалась до 4–5°С к середине сентября. Начиная с 2010 г. температура воды в этой реке уже не опускалась ниже 8°С до конца сентября, а охлаждение до 4–5°С наблюдалось не ранее конца первой недели октября. Таким образом, в первой декаде XXI в. произошли и сохраняются до настоящего времени существенные изменения в экосистеме рек Квачина и Снатолвеем: 1) резко увеличилась численность заходящей на нерест горбуши и 2) изменилась динамика температуры воды в реке в сторону увеличения продолжительности тёплого периода.
Весьма вероятно, что эти два фактора привели к улучшению условий нагула мальмы в речной период жизни и, как частный результат, к повышению доли созревающих в реке самцов мальмы. Известно, что созревание части молоди в пресных водах и формирование резидентных карликовых самцов является результатом интенсивного роста в первые годы жизни и достижения половой зрелости в ювенильной стадии развития при небольших размерах – 140–200 мм (Груздева и др., 2013, 2017; Кузищин и др., 2022). Более того, у симы доля карликовых самцов тесно коррелирует с численностью подходов горбуши (Груздева и др., 2013). Разные исследователи показали, что при повышении среднегодовой температуры воды в реках у симы и мальмы наблюдается раннее созревание молоди в пресных водах (Nakano, 1995; Koseki, 2004; Morita, Nagasawa, 2010). Наибольший эффект для созревания в пресных водах и увеличения доли карликовых самцов даёт сочетание повышенной продуктивности речных биотопов и увеличение температуры воды (Takami, Sato, 1998; Jobling, 2002; Morita, Nagasawa, 2010; Morita et al., 2014).
Есть все основания полагать, что в реках Квачина и Снатолвеем на фоне повышения продуктивности рек и удлинения периода нагула произошло увеличение численности карликовых самцов мальмы, что и подтолкнуло их к более широкому расселению по реке. В результате случилось перекрывание зоны обитания карликовых самцов мальмы и нерестилищ кунджи в реках Квачина и Снатолвееми, как следствие, нарушение изолирующих механизмов между кунджей и мальмой и гибридизация между ними. Не исключено, что изменение температурного режима рек также могло способствовать выживанию гибридных особей – ранее было показано, что гибриды между арктическим S. alpinus и ручьевым S. fontinalis гольцами демонстрируют более высокий темп роста в широком диапазоне температуры по сравнению с родительскими видами (Dumas et al., 1996, 2007).
Таким образом, расширение зоны межвидовой гибридизации гольцов на Северо-Западной Камчатке и появление гибридов в значительном количестве ещё в двух смежных реках могут служить индикатором перестроек структурно-функциональной организации экосистем лососёвых рек Камчатки и являться реакцией на масштабные изменения факторов внешней среды. Полученные нами данные не противоречат существующим представлениям о том, как могли возникать межвидовые гибриды. Большинство исследователей связывают случаи интрогрессивной гибридизации у гольцов со сложной историей постгляциального расселения, когда разные виды проникали в новые экосистемы с неустоявшимися структурно-функциональными связями (Haas, McPhail, 1991; Redenbach, 2000; Taylor et al., 2001; Redenbach, Taylor, 2002; Oleinik et al., 2007). По нашему мнению, основной причиной и предпосылкой к массовой межвидовой гибридизации в реках Северо-Западной Камчатки стали крупномасштабные возмущения структурно-функциональной организации экосистем малых лососёвых рек под влиянием изменений климата.
Пример гольцов из рек Квачина и Снатолвеем и массовое появление гибридов в них являются иллюстрацией быстрых ответных реакций видов и активизации микроэволюционных процессов, происходящих в меняющейся природной среде. Несомненно, вопрос о гибридизации гольцов в реках Утхолок, Квачина и Снатолвеем требует дополнительных исследований, мониторинга и пристального внимания к проблеме, которая затрагивает не только гибридизацию двух видов, но и состояние экосистем рек на Камчатке. Обращает на себя внимание вопрос успешности существования гибридов в ненарушенных экосистемах рек Северо-Западной Камчатки. Одно из направлений анализа причин экологического успеха гибридов видится в привлечении геномных и транскриптомных методов – требуют решения вопросы о том, какие из аллельных вариантов транскрибируются, какова новая архитектура консервативных частей генома и тому подобное. Уже сейчас есть данные, что среди гибридов кунджа × мальма из р. Утхолок выявлены особи поколения F2, Fn > 2 (Груздева и др., 2020). В связи с этим, а также с расхождением гибридов и родительских видов по разным биотопам можно предположить, что в настоящее время происходят активные микроэволюционные процессы и есть вероятность свершения самых начальных этапов ретикулярного видообразования.
Список литературы
Гриценко О.Ф., Савваитова К.А., Груздева М.А., Кузищин К.В. 1998. О таксономическом положении гольцов рода Salvelinus северных Курильских островов // Вопр. ихтиологии. Т. 38. № 2. С. 189–198.
Груздева М.А., Кузищин К.В., Малютина А.М. 2011а. Видовой состав и распределение молоди лососевых рыб и рыбообразных в продольном континууме основного русла реки Коль (Западная Камчатка) // Матер. XII Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 215–218.
Груздева М.А., Кузищин К.В., Малютина А.М. 2011б. О значении придаточной системы лососевой реки как нагульного пространства для молоди лососевых рыб // Там же. С. 94–97.
Груздева М.А., Малютина А.М., Кузищин К.В. и др. 2013. Закономерности формирования жизненной стратегии у симы Oncorhynchus masou реки Коль (Западная Камчатка) в связи с процессами роста и полового созревания // Вопр. ихтиологии. Т. 53. № 5. С. 587–602. https://doi.org/10.7868/S0042875213050056
Груздева М.А., Кузищин К.В., Малютина А.М. 2014а. Особенности распределения молоди лососёвых рыб в мозаике речных местообитаний в период летнего нагула: к вопросу о динамике группировок // Тез. докл. XV Междунар. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 259–263.
Груздева М.А., Кузищин К.В., Малютина А.М. 2014б. Предпочитаемые стации молоди лососёвых рыб в русле реки Коль (Западная Камчатка) // Там же. С. 255–258.
Груздева М.А., Кузищин К.В., Павлов Е.Д. и др. 2017. Морфофизиологические закономерности формирования жизненных стратегий мальмы Salvelinus malma Камчатки // Вопр. ихтиологии. Т. 57. № 5. С. 534–552. https://doi.org/10.7868/S0042875217050101
Груздева М.А., Кузищин К.В., Семенова А.В. и др. 2018. Редкий случай перманентной интрогрессивной гибридизации у гольцов рода Salvelinus (Salmonidae, Salmoniformes) в реке Утхолок, Западная Камчатка // Биология моря. Т. 44. № 6. С. 381–389. https://doi.org/10.1134/S0134347518060025
Груздева М.А., Семенова А.В., Кузищин К.В. и др. 2020. Генетическая изменчивость мальмы (Salvelinus malma), кунджи (S. leucomaenis) и межвидовых гибридов из реки Утхолок (Северо-Западная Камчатка) // Генетика. Т. 56. № 1. С. 78–88. https://doi.org/10.31857/S0016675819090066
Гудков П.К. 2002. Гибрид гольца рода Salvelinus (Salmonidae) из района Тауйской Губы Охотского моря // Тр. СахНИРО. Т. 4. С. 270–276.
Гудков П.К., Скопец М.Б. 1989. К методике определения возраста первого ската в море и обратного расчисления роста проходных гольцов рода Salvelinus (Salmonidae) // Вопр. ихтиологии. Т. 29. № 4. С. 601–608.
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus азиатской части Северной Пацифики: происхождение, эволюция и современное разнообразие. Петропавловск-Камчатский: Камчатпресс, 188 с.
Кузищин К.В., Груздева М.А., Малютина А.М., Павлов Д.С. 2022. “Пресноводные компоненты” в популяциях кунджи Salvelinus leucomaenis на севере ареала вида (Камчатка) // Вопр. ихтиологии. Т. 62. № 5. С. 541–555. https://doi.org/10.31857/S0042875222050125
Лакин Г.Ф. 1990. Биометрия. М.: Высш. шк., 347 с.
Любимова Е.Л. 1961. Камчатка. Физико-географический очерк. М.: Географгиз, 190 с.
Мурза И.Г., Христофоров О.Л. 1991. Определение степени зрелости гонад и прогнозирование возраста достижения половой зрелости у атлантического лосося и кумжи. Л.: Изд-во ГосНИОРХ, 102 с.
Нешатаева В.Ю. 2009. Растительность полуострова Камчатка. М.: Т-во науч. изд. КМК, 537 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2001. Тихоокеанские благородные лососи и форели Азии. М.: Науч. мир, 200 с.
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. 2009. Состояние и мониторинг биоразнообразия лососёвых рыб и среды их обитания на Камчатке (на примере территории заказника “Река Коль”). М.: Т-во науч. изд. КМК, 156 с.
Павлов Д.С., Кириллов П.И., Кириллова Е.А. и др. 2016. Состояние и мониторинг биоразнообразия рыб, рыбообразных и среды их обитания в бассейне реки Утхолок. М.: Т-во науч. изд. КМК, 197 с.
Пичугин М.Ю. 2015. Особенности роста и развития скелета ранней молоди северной мальмы Salvelinus malma malma из рек Западной Камчатки в связи с температурным режимом нерестилищ // Вопр. ихтиологии. Т. 55. № 4. С. 435–452. https://doi.org/10.7868/S0042875215040128
Пичугин М.Ю., Кириллова Е.А., Кириллов П.И. 2008. Особенности нерестовых участков кунджи и описание ее личинок из рек Западной Камчатки // Матер. IX Междунар. науч. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс. С. 103–106.
Правдин И.Ф. 1966. Руководство по изучению рыб. М.: Пищепромиздат, 322 с.
Радченко О.А. 2004. Интрогрессивная гибридизация гольцов рода Salvelinus по данным об изменчивости митохондриальной ДНК // Генетика. Т. 40. № 12. С. 1678–1685.
Ресурсы поверхностных вод СССР: гидрологическая изученность. 1966. Т. 20. Камчатка. Л.: Гидрометеоиздат, 260 с.
Савваитова К.А. 1989. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат, 224 с.
Савваитова К.А., Кузищин К.В., Пичугин М.Ю. и др. 2007. Систематика и биология кунджи Salvelinus leucomaenis // Вопр. ихтиологии. Т. 47. № 1. С. 58–71.
Чалов Р.С. 2008. Русловедение: теория, география, практика. Т. 1. М.: ЛКИ, 608 с.
Черешнев И.А., Волобуев В.В., Шестаков А.В., Фролов С.В. 2002. Лососевидные рыбы Северо-Востока России. Владивосток: Дальнаука, 496 с.
Abdul-Aziz O.I., Mantua N.J., Myers K.W. 2011. Potential climate change impacts on thermal habitats of Pacific salmon (Oncorhynchus spp.) in the North Pacific Ocean and adjacent seas // Can. J. Fish. Aquat. Sci. V. 68. № 9. P. 1660–1680. https://doi.org/10.1139/f2011-079
Arlinghaus R., Alós J., Beardmore B. et al. 2017. Understanding and managing freshwater recreational fisheries as complex adaptive social-ecological systems // Rev. Fish. Sci. Aquac. V. 25. № 1. P. 1–41. https://doi.org/10.1080/23308249.2016.1209160
Arnold M.L. 1992. Natural hybridization as an evolutionary process // Annu. Rev. Ecol. Syst. V. 23. P. 237–261. https://doi.org/10.1146/annurev.es.23.110192.001321
Arnold M.L. 1997. Natural hybridization and evolution. Oxford: Oxford Univ. Press, 231 p.
Avise J.C. 1994. Molecular markers, natural history and evolution. N.Y.: Springer, 511 p. https://doi.org/10.1007/978-1-4615-2381-9
Bartholomew A., Bohnsack J.A. 2005. A review of catch-and-release angling mortality with implications for no-take reserves // Rev. Fish Biol. Fish. V. 15. № 1–2. P. 129–154. https://doi.org/10.1007/s11160-005-2175-1
Baxter J.S., Taylor E.B., Devlin R.H. et al. 1997. Evidence for natural hybridization between Dolly Varden (Salvelinus malma) and bull trout (S. confluentus) in a northcentral British Columbia watershed // Can. J. Fish. Aquat. Sci. V. 54. № 2. P. 421–429. https://doi.org/10.1139/f96-289
Behnke R.J. 2002. Trout and Salmon of North America. N.Y.: Free Press, 360 p.
Belkhir K., Borsa P., Chikhi L. et al. 2004. GENETIX 4.05: population genetics software for Windows TM. Montpellier: Univ. Montpellier II (http://www.genetix.univ-montp2.fr /genetix/intro.htm. Version 04/2023).
Bernatchez L., Glémet H., Wilson C.C., Danzmann R.G. 1995. Introgression and fixation of Arctic char (Salvelinus alpinus) mitochondrial genome in an allopatric population of brook trout (S. fontinalis) // Can. J. Fish. Aquat. Sci. V. 52. № 1. P. 179–185. https://doi.org/10.1139/f95-018
Bougas B., Normandeau E., Audet C., Bernatchez L. 2013. Linking transcriptomic and genomic variation to growth in brook charr hybrids (Salvelinus fontinalis, Mitchill) // Heredity. V. 110. № 5. P. 492–500. https://doi.org/10.1038/hdy.2012.117
Bryant M.D. 2009. Global climate change and potential effects on Pacific salmonids in freshwater ecosystems of southeast Alaska // Clim. Change. V. 95. № 1–2. P. 169–193. https://doi.org/10.1007/s10584-008-9530-x
Cline T.J., Ohlberger J., Schindler D.E. 2019. Effects of warming climate and competition in the ocean for life-histories of Pacific salmon // Nat. Ecol. Evol. V. 3. № 6. P. 935–942. https://doi.org/10.1038/s41559-019-0901-7
Cooke S.J., Donaldson M.R., O’connor C.M. et al. 2013. The physiological consequences of catch-and-release angling: perspectives on experimental design, interpretation, extrapolation and relevance to stakeholders // Fish. Manag. Ecol. V. 20. № 2–3. P. 268–287. https://doi.org/10.1111/j.1365-2400.2012.00867.x
Cooper A.M., Miller L.M., Kapuscinski A.R. 2010. Conservation of population structure and genetic diversity under captive breeding of remnant coaster brook trout (Salvelinus fontinalis) populations // Conserv. Genet. V. 11. № 3. P. 1087–1093. https://doi.org/10.1007/s10592-009-9841-0
Crane P.A., Lewis C.J., Kretschmer E.J. et al. 2004. Characterization and inheritance of seven microsatellite loci from Dolly Varden, Salvelinus malma, and cross-species amplification in Arctic char, S. alpinus // Ibid. V. 5. № 5. P. 737–741. https://doi.org/10.1007/s10592-004-1853-1
Davidson W.S., Koop B.F., Jones S.J.M. et al. 2010. Sequencing the genome of the Atlantic salmon (Salmo salar) // Genome Biol. V. 11. № 9. Article 403. https://doi.org/10.1186/gb-2010-11-9-403
Daye P.G., Glebe B.D. 1984. Fertilization success and sperm motility of Atlantic salmon (Salmo salar L.) in acidified water // Aquaculture. V. 43. № 1–3. P. 307–312. https://doi.org/10.1016/0044-8486(84)90031-0
Dehaan P.W., Ardren W.R. 2005. Characterization of 20 highly variable tetranucleotide microsatellite loci for bull trout (Salvelinus confluentus) and cross-amplification in other Salvelinus species // Mol. Ecol. Notes. V. 5. № 3. P. 582–585. https://doi.org/10.1111/j.1471-8286.2005.00997.x
Dodson J.J., Aubin-Horth N., Thériault V., Páez D.J. 2013. The evolutionary ecology of alternative migratory tactics in salmonid fishes // Biol. Rev. V. 88. № 3. P. 602–625. https://doi.org/10.1111/brv.12019
Dowling T.E., DeMarais B.D. 1993. Evolutionary significance of introgressive hybridization in fishes // Nature. V. 362. № 6419. P. 444–446. https://doi.org/10.1038/362444a0
Dumas S., Blanc J.M., Vallée F. et al. 1996. Survival, growth, sexual maturation and reproduction of brook charr, Salvelinus fontinalis (Mitchill), Arctic charr, Salvelinus alpinus L., and their hybrids // Aquac. Res. V. 27. № 4. P. 245–253. https://doi.org/10.1111/j.1365-2109.1996.tb00991.x
Dumas A., France J., Bureau D.P. 2007. Evidence of three growth stanzas in rainbow trout (Oncorhynchus mykiss) across life stages and adaptation of the thermal-unit growth coefficient // Aquaculture. V. 267. № 1–4. P. 139–146. https://doi.org/10.1016/j.aquaculture.2007.01.041
Estoup A., Presa P., Krieg F. et al. 1993. (CT)n and (GT)n microsatellites: a new class of genetic markers for Salmo trutta L. (brown trout) // Heredity. V. 71. № 5. P. 488–496. https://doi.org/10.1038/hdy.1993.167
Gage M.J.G., Stockley P., Parker G.A. 1995. Effects of alternative male mating strategies on characteristics of sperm production in the Atlantic salmon (Salmo salar): theoretical and empirical investigations // Phil. Trans. R. Soc. Lond. B. V. 350. № 1334. P. 391–399. https://doi.org/10.1098/rstb.1995.0173
Glémet H., Blier P., Bernatchez L. 1998. Geographical extent of Arctic char (Salvelinus alpinus) mtDNA introgression in brook char populations (S. fontinalis) from eastern Québec, Canada // Mol. Ecol. V. 7. № 12. P. 1655–1662. https://doi.org/10.1046/j.1365-294x.1998.00494.x
Haas G.R., McPhail J.D. 1991. Systematics and distributions of Dolly Varden (Salvelinus malma) and bull trout (Salvelinus confluentus) in North America // Can. J. Fish. Aquat. Sci. V. 48. № 11. P. 2191–2211. https://doi.org/10.1139/f91-259
Hammar J., Dempson J.B., Verspoor E. 1991. Natural hybridization between Arctic char (Salvelinus alpinus) and brook trout (S. fontinalis): evidence from Northern Labrador // Ibid. V. 48. № 8. P. 1437–1445. https://doi.org/10.1139/f91-171
Hansen M.M., Mensberg K.-L.D. 2009. Admixture analysis of stocked brown trout populations using mapped microsatellite DNA markers: indigenous trout persist in introgressed populations // Biol. Lett. V. 5. № 5. P. 656–659. https://doi.org/10.1098/rsbl.2009.0214
Hansen M.M., Fraser D.J., Meier K., Mensberg K.-L.D. 2009. Sixty years of anthropogenic pressure: a spatio-temporal genetic analysis of brown trout populations subject to stocking and population declines // Mol. Ecol. V. 18. № 12. P. 2549–2562. https://doi.org/10.1111/j.1365-294X.2009.04198.x
Harrison R.G. 1993. Hybrid zones and the evolutionary process. Oxford: Oxford Univ. Press, 222 p.
Hino T., Maekawa K., Reynolds J.B. 1990. Alternative male mating behaviors in landlocked Dolly Varden (Salvelinus malma) in south-central Alaska // J. Ethol. V. 8. № 1. P. 13–20. https://doi.org/10.1007/BF02350124
Isaak D.J., Wollrab S., Horan D., Chandler G. 2012. Climate change effects on stream and river temperatures across the northwest U.S. from 1980–2009 and implications for salmonid fishes // Clim. Change. V. 113. № 2. P. 499–524. https://doi.org/10.1007/s10584-011-0326-z
Isaak D.J., Luce C.H., Horan D.L. et al. 2018. Global warming of salmon and trout rivers in the Northwestern U.S.: road to ruin or path through purgatory? // Trans. Am. Fish. Soc. V. 147. № 3. P. 566–587. https://doi.org/10.1002/tafs.10059
Ivanova N.V., Zemlak T.S., Hanner R.H., Hebert P.D.N. 2007. Universal primer cocktails for fish DNA barcoding // Mol. Ecol. Notes. V. 7. № 4. P. 544–548. https://doi.org/10.1111/j.1471-8286.2007.01748.x
Jenkins T.M. Jr. 2003. Evaluating recent innovations in bait fishing tackle and technique for catch and release of rainbow trout // N. Am. J. Fish. Manag. V. 23. № 4. P. 1098–1107. https://doi.org/10.1577/M02-040
Jiggins C.D., Mallet J. 2000. Bimodal hybrid zones and speciation // Trends Ecol. Evol. V. 15. № 6. P. 250–255. https://doi.org/10.1016/S0169-5347(00)01873-5
Jobling M. 2002. Environmental factors and rates of development and growth // Handbook of fish biology and fisheries. V. 1. N.Y.: Wiley-Blackwell. P. 97–122. https://doi.org/10.1002/9780470693803.ch5
Kanda N., Leary R.F., Allendorf F.W. 2002. Evidence of introgressive hybridization between bull trout and brook trout // Trans. Am. Fish. Soc. V. 131. № 4. P. 772–782. https://doi.org/10.1577/1548-8659(2002)131<0772:EO-IHBB>2.0.CO;2
Kitano S. 1996. Size-related factors causing individual variation in seasonal reproductive success of fluvial male Dolly Varden (Salvelinus malma) // Ecol. Freshw. Fish. V. 5. № 2. P. 59–67. https://doi.org/10.1111/j.1600-0633.1996.tb00037.x
Koseki Y. 2004. Reproductive characteristics of precocious male parr in salmonids: morphology, physiology, and behavior // Eurasian J. For. Res. V. 7. № 2. P. 87–108.
Koseki Y., Koizumi I., Kobayashi H., Maekawa K. 2002. Does the refuge availability influence the spawning behavior of mature male parr in salmonids? A test in the Miyabe charr // Environ. Biol. Fish. V. 64. № 1–3. P. 87–93. https://doi.org/10.1023/A:1016096701472
Maekawa K. 1983. Streaking behaviour of mature male parrs of the Miyabe charr, Salvelinus malma miyabei, during spawning // Jpn. J. Ichthyol. V. 30. № 3. P. 227–234. https://doi.org/10.11369/jji1950.30.227
Maekawa K., Goto A. 1982. Two possible ways in the fluvial land-locking from anadromous fish, with special reference to heterochrony and r-K selection theory // Biol. Sci. V. 34. № 2. P. 76–84.
Maekawa K., Hino T. 1986. Spawning behaviour of Dolly Varden in southeastern Alaska, with special reference to the mature male parr // Jpn. J. Ichthyol. V. 32. № 4. P. 454–458. https://doi.org/10.11369/jji1950.32.454
Maekawa K., Hino T. 1990. Spawning tactics of female Miyabe charr (Salvelinus malma miyabei) against egg cannibalism // Can. J. Zool. V. 68. № 5. P. 889–894. https://doi.org/10.1139/z90-129
Maekawa K., Onozato H. 1986. Reproductive tactics and fertilization success of mature male Miyabe charr, Salvelinus malma miyabei // Environ. Biol. Fish. V. 15. № 2. P. 119–129. https://doi.org/10.1007/BF00005427
Maekawa K., Kitano S., Takeyama S. 1993. Type-assortative mating of Miyabe charr // Jpn. J. Ichthyol. V. 39. № 4. P. 401–403. https://doi.org/10.11369/jji1950.39.401
Maekawa K., Nakano S., Yamamoto S. 1994. Spawning behaviour and size-assortative mating of Japanese charr in an artificial lake-inlet stream system // Environ. Biol. Fish. V. 39. № 2. P. 109–117. https://doi.org/10.1007/BF00004927
Marie A.D., Bernatchez L., Garant D. 2010. Loss of genetic integrity correlates with stocking intensity in brook charr (Salvelinus fontinalis) // Mol. Ecol. V. 19. № 10. P. 2025–2037. https://doi.org/10.1111/j.1365-294X.2010.04628.x
Marie A.D., Bernatchez L., Garant D. 2011. Empirical assessment of software efficiency and accuracy to detect introgression under variable stocking scenarios in brook charr (Salvelinus fontinalis) // Conserv. Genet. V. 12. № 5. P. 1215–1227. https://doi.org/10.1007/s10592-011-0224-y
Marie A.D., Bernatchez L., Garant D. 2012. Environmental factors correlate with hybridization in stocked brook charr (Salvelinus fontinalis) // Can. J. Fish. Aquat. Sci. V. 69. № 5. P. 884–893. https://doi.org/10.1139/f2012-027
Mauger S., Shaftel R., Leppi J.C., Rinella D.J. 2017. Summer temperature regimes in southcentral Alaska streams: watershed drivers of variation and potential implications for Pacific salmon // Ibid. V. 74. № 5. P. 702–715. https://doi.org/10.1139/cjfas-2016-0076
Mavarez J., Audet C., Bernatchez L. 2009. Major disruption of gene expression in hybrids between young sympatric anadromous and resident populations of brook charr (Salvelinus fontinalis Mitchill) // J. Evol. Biol. V. 22. № 8. P. 1708–1720. https://doi.org/10.1111/j.1420-9101.2009.01785.x
May-McNally S.L., Quinn T.P., Taylor E.B. 2015. Low level of hybridization between sympatric Arctic char (Salvelinus alpinus) and Dolly Varden char (S. malma) highlights their genetic distinctiveness and ecological segregation // Ecol. Evol. V. 5. № 15. P. 3031–3045. https://doi.org/10.1002/ece3.1583
Morita K., Fukuwaka M.-A. 2006. Does size matter most? The effect of growth history on probabilistic reaction norm for salmon maturation // Evolution. V. 60. № 7. P. 1516–1521. https://doi.org/10.1111/j.0014-3820.2006.tb01230.x
Morita K., Nagasawa T. 2010. Latitudinal variation in the growth and maturation of masu salmon (Oncorhynchus masou) parr // Can. J. Fish. Aquat. Sci. V. 67. № 6. P. 955–965. https://doi.org/10.1139/F10-028
Morita K., Tamate T., Kuroki M., Nagasawa T. 2014. Temperature-dependent variation in alternative migratory tactics and its implications for fitness and population dynamics in a salmonid fish // J. Anim. Ecol. V. 83. № 6. P. 1268–1278. https://doi.org/10.1111/1365-2656.12240
Nakano S. 1995. Individual differences in resource use, growth and emigration under the influence of a dominance hierarchy in fluvial red-spotted masu salmon in a natural habitat // Ibid. V. 64. № 1. P. 75–84. https://doi.org/10.2307/5828
Nakano S., Kitano F., Maekawa K. 1996. Potential fragmentation and loss of thermal habitats for charrs in the Japanese archipelago due to climatic warming // Freshw. Biol. V. 36. № 3. P. 711–722. https://doi.org/10.1046/j.1365-2427.1996.d01-516.x
Oleinik A.G., Skurikhina L.A., Brykov V.A. 2007. Divergence of Salvelinus species from northeastern Asia based on mitochondrial DNA // Ecol. Freshw. Fish. V. 16. № 1. P. 87–98. https://doi.org/10.1111/j.1600-0633.2006.00187.x
Olsen J.B., Wuttig K., Fleming D. et al. 2006. Evidence of partial anadromy and resident-form dispersal bias on a fine scale in populations of Oncorhynchus mykiss // Conserv. Genet. V. 7. № 4. P. 613–619. https://doi.org/10.1007/s10592-005-9099-0
Overland J., Rodionov S., Minobe S., Bond N. 2008. North Pacific regime shifts: definitions, issues and recent transitions // Prog. Oceanogr. V. 77. № 2–3. P. 92–102. https://doi.org/10.1016/j.pocean.2008.03.016
Popowich R.C., Venturelli P.A., Stelfox J.D., Taylor E.B. 2011. Validation of morphological characteristics used for field identification of Bull Trout × Brook Trout hybrids // N. Am. J. Fish. Manag. V. 31. № 3. P. 548–553. https://doi.org/10.1080/02755947.2011.595279
Redenbach Z. 2000. Molecular evidence of current and historical introgressive hybridization between bull trout (Salvelinus confluentus) and Dolly Varden (S. malma): MS Thesis. Vancouver: Univ. British Columbia, 149 p.
Redenbach Z., Taylor E.B. 2002. Evidence for historical introgression along a contact zone between two species of char (Pisces: Salmonidae) in Northwestern North America // Evolution. V. 56. № 5. P. 1021–1035. https://doi.org/10.1111/j.0014-3820.2002.tb01413.x
Slettan A., Olsaker I., Lie Ø. 1993. Isolation and characterization of variable (GT)n repetitive sequences from Atlantic salmon, Salmo salar L. // Anim. Genet. V. 24. № 3. P. 195–197. https://doi.org/10.1111/j.1365-2052.1993.tb00287.x
Sloss B.L., Jennings M.J., Franckowiak R., Pratt D.M. 2008. Genetic identity of brook trout in Lake Superior south shore streams: potential for genetic monitoring of stocking and rehabilitation efforts // Trans. Am. Fish. Soc. V. 137. № 4. P. 1244–1251. https://doi.org/10.1577/T05-206.1
Taborsky M. 1998. Sperm competition in fish: “bourgeois” males and parasitic spawning // Trends Ecol. Evol. V. 13. № 6. P. 222–227. https://doi.org/10.1016/S0169-5347(97)01318-9
Takami T., Sato H. 1998. Influence of high water temperature on feeding responses and thermal death of juvenile masu salmon under aquarium settings // Sci. Rep. Hokkaido Fish Hatchery. V. 52. P. 79–82.
Taylor E.B. 2004. Evolution in mixed company – evolutionary influences from studies of natural hybridization in Salmonidae // Evolution illuminated: salmon and their relatives. Oxford: Oxford Univ. Press. P. 232–263.
Taylor E.B., Redenbach Z.A., Costello A.B. et al. 2001. Nested analysis of genetic diversity in northwestern North American char, Dolly Varden (Salvelinus malma) and bull trout (Salvelinus confluentus) // Can. J. Fish. Aquat. Sci. V. 58. № 2. P. 406–420. https://doi.org/10.1139/f00-262
Thorpe J.E. 1987. Smolting versus residency: developmental conflict in salmonids // Proc. Int. Symp. “Common strategies of anadromous and catadromous fishes”. V. 1. Bethesda: Am. Fis. Soc. P. 244–252.
Twardek W.M., Gagne T.O., Elmer L.K. et al. 2018. Consequences of catch-and-release angling on the physiology, behaviour and survival of wild steelhead Oncorhynchus mykiss in the Bulkley River, British Columbia // Fish. Res. V. 206. P. 235–246. https://doi.org/10.1016/j.fishres.2018.05.019
Utoh H. 1976. Study of the mechanism of differentiation between the stream resident form and seaward migratory form in masu salmon Oncorhynchus masou Brevoort. I. Growth and sexual maturity of the precocious masu salmon parr // Bull. Fac. Fish. Hokkaido Univ. V. 26. P. 321–326.
Van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. 2004. MICRO-CHECKER: software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. V. 4. № 3. P. 535–538. https://doi.org/10.1111/j.1471-8286.2004.00684.x
Verspoor E., Hammar J. 1991. Introgressive hybridization in fishes: the biochemical evidence // J. Fish Biol. V. 39. № sA. P. 309–334. https://doi.org/10.1111/j.1095-8649.1991.tb05094.x
Wainwright T.C., Weitkamp L.A. 2013. Effects of climate change on Oregon Coast coho salmon: habitat and life-cycle interactions // Northwest Sci. V. 87. № 3. P. 219–242. https://doi.org/10.3955/046.087.0305
Wilson C.C., Bernatchez L. 1998. The ghost of hybrids past: fixation of arctic charr (Salvelinus alpinus) mitochondrial DNA in an introgressed population of lake trout (S. namaycush) // Mol. Ecol. V. 7. № 1. P. 127–132. https://doi.org/10.1046/j.1365-294x.1998.00302.x
Winkler K.A., Pamminger-Lahnsteiner B., Wanzenböck J., Weiss S. 2011. Hybridization and restricted gene flow between native and introduced stocks of Alpine whitefish (Coregonus sp.) across multiple environments // Ibid. V. 20. № 3. P. 456–472. https://doi.org/10.1111/j.1365-294X.2010.04961.x
Woram R.A., McGowan C., Stout J.A. et al. 2004. A genetic linkage map for Arctic char (Salvelinus alpinus): evidence for higher recombination rates and segregation distortion in hybrid versus pure strain mapping parents // Genome. V. 47. № 2. P. 304–315. https://doi.org/10.1139/g03-127
Yamaguchi K., Nakajima M., Taniguchi N. 2008. Development of microsatellite markers in the Japanese char Salvelinus leucomaenis and its application to closely related species // Fish Genet. Breed. Sci. V. 38. P. 123–130.
Yamamoto S., Kitano S., Maekawa K. et al. 2006. Introgressive hybridization between Dolly Varden Salvelinus malma and white-spotted charr Salvelinus leucomaenis on Hokkaido Island, Japan // J. Fish Biol. V. 68. № A. P. 68–85. https://doi.org/10.1111/j.0022-1112.2006.00994.x
Zhang X., Li H.-Y., Zhiqun D., Deng Z.D. et al. 2019. On the variable effects of climate change on Pacific salmon // Ecol. Model. V. 397. P. 95–106. https://doi.org/10.1016/j.ecolmodel.2019.02.002
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии