Вопросы ихтиологии, 2023, T. 63, № 6, стр. 724-730
Личинки трематод Diplostomum pseudospathaceum (Diplostomidae), проникая в сеголеток Oncorhynchus mykiss (Salmonidae), манипулируют их поведением
В. Н. Михеев *
Институт проблем экологии и эволюции РАН – ИПЭЭ РАН
Москва, Россия
* E-mail: vicnikmik@gmail.com
Поступила в редакцию 24.07.2023
После доработки 28.07.2023
Принята к публикации 31.07.2023
- EDN: ALTEQS
- DOI: 10.31857/S0042875223060164
Аннотация
Эксперименты с сеголетками Oncorhynchus mykiss и церкариями трематод Diplostomum pseudospathaceum показали, что первые проникающие в рыбу паразиты оказывают на неё возбуждающее воздействие и в три раза увеличивают скорость поступления церкарий с токами воды через ротовую полость и жабры. Этот эффект рассматривается как манипулирование поведением рыбы на стадии передачи паразита от первого промежуточного хозяина (моллюска) ко второму (рыба). Получены экспериментальные данные о влиянии запаха рыбы на двигательную активность и вертикальное распределение церкарий. Анализ полученных данных позволил определить комплекс условий, обеспечивающих успешное поступление личинок диплостомума в рыбу.
Гетероксенные паразиты, сменяющие в жизненном цикле нескольких хозяев, при каждой смене должны искать и выбирать нового хозяина и проникать в него. Сложность этих задач различна. Например, у трематод попадание личинок (мирацидиев) в первого промежуточного хозяина, моллюска, происходит сравнительно легко. Моллюски малоподвижны и взаимодействие паразит–хозяин происходит, как правило, в придонном слое, где концентрация личинок и моллюсков довольно высока. Гораздо труднее приходится выходящим из моллюска церкариям (расселительные личинки), которые должны попасть во второго промежуточного (у триксенных трематод) или окончательного (у диксенных) хозяина. Таким хозяином для трематод часто служат рыбы, в которых попасть несравнимо труднее, чем в моллюсков. Рыбы быстро двигаются, защищены слизью и чешуёй; они обитают в трёхмерной подвижной среде, что ещё больше усложняет паразиту их поиск.
В рыбе церкарии превращаются в метацеркарий, которые, достигнув инвазионного состояния, должны попасть в окончательного хозяина (чаще всего это рыбоядные птицы). Процент заражённых рыб обычно невысок, и их может съесть не только птица, но и другой хищник, например рыба-ихтиофаг. Паразит при этом погибает. Сложность для паразита на этом этапе заключается в необходимости попасть в “правильного” окончательного хозяина. Что делает заражённую рыбу более заметной и доступной для хищника, пригодного в качестве окончательного хозяина? Согласно гипотезе манипулирования поведением (фенотипом) хозяина (host manipulation) (Bethel, Holmes, 1977; Parker et al., 2009; Poulin, 2010) готовый к заражению (инвазионный) паразит влияет на фенотип промежуточного хозяина, повышая свой успех передачи. Паразит попадает в окончательного хозяина при поедании последним заражённой рыбы.
Этот этап жизненного цикла привлёк наибольшее внимание эволюционных экологов и паразитологов, что обусловлено несколькими обстоятельствами. Во-первых, манипулирование происходит на той стадии жизненного цикла паразита, когда он уже близок к периоду полового размножения и, следовательно, его репродуктивная ценность особенно высока. Во-вторых, эта гипотеза (Bethel, Holmes, 1973, 1977) хорошо согласуется с теоретическими работами (Dawkins, 1999; Parker et al., 2009). Явление манипулирования фенотипом хозяина служит одной из наиболее ярких иллюстраций идеи расширенного фенотипа (extended phenotype – по: Dawkins, 1999), а стимулирование хищничества (predation enhancement) и избегание хищничества (predation suppression) (Parker et al., 2009) раскрывают механизмы и адаптивное значение явления. Появилось множество работ, подтверждающих гипотезу манипулирования, и обзоров, в которых рассматривают механизмы и эволюционные аспекты этого явления.
Успешное завершение жизненного цикла трематод, промежуточным хозяином которым служат рыбы, зависит не только от финальной стадии, но также и от предшествующей, на которой расселительные личинки, церкарии, – мелкие, обычно малоподвижные существа со слабым сенсорным оснащением – должны попасть в рыбу. Известны две основных тактики: 1) одиночные или объединённые в группу личинки напоминают пищевой объект и попадают в рыбу через пищеварительный тракт (Hendrickson, Kingston, 1974; Odening, Bockhardt, 1976; Combes et al., 1994); 2) одиночные свободно плавающие церкарии сталкиваются с рыбой и проникают в неё через кожные покровы или жабры (Whyte et al., 1991). Могут ли церкарии повлиять на рыбу и повысить вероятность встречи с ней? В первом случае довольно крупные, хотя и немногочисленные, церкарии или их колонии привлекают рыб яркой окраской и движениями, делающими их похожими на объекты питания рыб. Рыбы их легко обнаруживают и проглатывают (Combes et al., 1994). Гораздо труднее приходится мелким одиночным парящим в толще воды личинкам, таким как церкарии Diplostomum pseudospathaceum. Целенаправленно они реагируют на рыбу с расстояния всего в несколько миллиметров (Haas et al., 2002), а их концентрация в водной толще мала. После выхода из моллюска они быстро разносятся токами воды и опускаются в придонные слои. Можно предположить, что их привлекает запах рыб, но в ряде работ показано (Smyth, 1966; Combes et al., 2002; Haas et al., 2008), что церкарии D. pseudospathaceum при поиске хозяина не реагируют на запах рыбы. Это объясняют тем, что церкарии не могут угнаться за проплывающей рыбой, даже если они почувствовали её запах (Combes et al., 2002).
Задача попадания свободно плавающих церкарий в рыбу представляется крайне сложной. В этой ситуации трудно представить себе какие-то варианты манипулирования поведением рыбы. Однако сравнительно недавно мы обнаружили весьма эффективный способ проникновения церкарий в рыбу (Mikheev et al., 2014). Он связан с вентиляционными токами воды, с помощью которых личинки попадают в ротовую и жаберные полости. Интенсивность вентиляции сильно зависит от различных воздействий на рыбу. Такими воздействиями могут быть снижение концентрации кислорода в воде, появление хищника и другое. Возбуждённая рыба может в разы увеличивать интенсивность вентиляции, что приводит к возрастанию потока паразитов. Могут ли сами паразиты, проникая через покровы или жабры, возбуждать рыбу и тем самым усиливать вентиляцию и соответственно транспорт паразитов? Чтобы этот механизм работал, необходимы следующие условия: 1) существование скоплений паразитов, 2) продолжительное нахождение рыбы в месте скопления.
Основная задача настоящей работы связана с экспериментальной проверкой гипотезы о возможности манипулирования поведением рыб церкариями трематоды D. pseudospathaceum на этапе передачи от моллюска (первый промежуточный хозяин) к рыбе (второй промежуточный хозяин). Кроме того, исследованы условия, способствующие образованию скоплений паразитов в толще воды, что делает их доступными для вентиляционных токов рыб, а также рассмотрены ситуации, в которых рыбы особенно уязвимы для паразита.
МАТЕРИАЛ И МЕТОДИКА
Исследования проводили на биологической станции Конневеси Университета Ювяскюля (Финляндия) в августе 2018 г. Сеголетки Oncorhynchus mykiss (средняя длина по Смитту ± стандартное отклонение 10.8 ± 0.65 см) были получены с рыбной фермы, где их содержали в артезианской воде, что предотвращало их заражение паразитами до экспериментов. Рыб содержали в 150-литровом проточном бассейне при температуре 15–16°С и фотопериоде 14 : 10 ч (свет : темнота). Кормили рыб два раза в день гранулированным кормом соответствующего размера. Церкарии D. pseudospathaceum были получены от 12 моллюсков Lymnaea stagnalis из оз. Конневеси. Моллюсков содержали в темноте в холодильнике при температуре 7°C. За 3–4 ч до экспериментов моллюсков выставляли на свет при температуре 20°C, что стимулировало выделение церкарий. Всех церкарий объединяли в одной ёмкости, взвесь тщательно перемешивали и в десяти пробах по 10 мл подсчитывали под бинокуляром число паразитов. Все эксперименты проходили в пределах 5 ч, в течение которых способность паразитов к заражению оставалась высокой.
Эксперименты по влиянию продолжительности экспозиции на скорость поступления церкарий и заражённость сеголеток O. mykiss проводили в 5-литровых аквариумах с профильтрованной озёрной водой при температуре 15–16°С и освещённости 150 лк. В каждый аквариум добавляли по 200 церкарий. Одиночных рыб акклимировали к условиям экспериментального аквариума в течение 30 мин, после чего добавляли воду с церкариями.
Идея этого эксперимента возникла после знакомства с работой (Laitinen et al., 1996), в которой представлены результаты реагирования рыб на различные стрессирующие воздействия, среди которых были церкарии диплостомума. Через несколько минут после добавления паразитов в ёмкость с рыбой у неё наблюдалось резкое увеличение интенсивности вентиляции. Учитывая роль вентиляции в регулировании потока в рыбу взвешенных в воде паразитов (Mikheev et al., 2014), мы предположили, что проникающие в рыбу церкарии могут увеличивать этот поток. Однако этот эффект должен наблюдаться не сразу после добавления взвеси паразитов, а с некоторой задержкой, связанной со временем, необходимым для встречи рыбы с паразитом и его проникновения. Мы ожидали, что по крайней мере при самой короткой экспозиции (5 мин) возбуждающее воздействие проникающих в рыбу церкарий ещё не проявится. Задачи этого эксперимента – оценить продолжительность этой задержки и величину воздействия первых проникающих в рыбу паразитов на последующую скорость их поступления.
После экспериментов рыб содержали индивидуально в проточных аквариумах, где их кормили в прежнем режиме. Через двое суток, когда все паразиты достигали места локализации (хрусталики глаз) в рыбах, последних усыпляли раствором MS-222 и под бинокуляром подсчитывали число метацеркарий. При каждой экспозиции (5, 10, 20 и 30 мин) было исследовано 10 рыб, т.е. всего 40 экз.
Для предварительной оценки условий, при которых предполагаемый механизм “самоактивации” потока паразитов в рыбу может быть эффективным, были выполнены эксперименты по влиянию запаха рыбы на двигательную активность и вертикальное распределение в толще воды церкарий диплостомума. Противоречивые данные о влиянии запаха рыбы на успех передачи церкарий (Smyth, 1966; Combes et al., 2002) могут быть связаны с тем, что исследователи пытались оценить эффективность целенаправленного перемещения паразита к рыбе. Учитывая различия в локомоторных возможностях церкарий и рыб, трудно представить, что паразит может активно двигаться в направлении рыбы, даже если он почувствовал её запах. Воздействие запаха может приводить к изменению частоты стереотипных вертикальных перемещений, что в свою очередь может повлиять на вертикальное распределение церкарий и накопление их в слое воды, где встреча с рыбой более вероятна.
Двигательную активность индивидуальных церкарий D. pseudospathaceum наблюдали в 5-миллилитровой камере под бинокуляром, подсчитывая число “прыжков” за 2 мин. Наблюдения проводили в профильтрованной озёрной воде (контроль) и в такой же воде с добавлением 2 мл воды из 1-литрового аквариума, в котором в течение 15 мин находилась одна особь O. mykiss длиной по Смитту 13–15 см при температуре 15°С. В контроле и в опыте было протестировано по 20 экз. церкарий.
Влияние запаха рыбы на вертикальное распределение церкарий изучали в четырёх колонках высотой 60 см и диаметром 10 см, в которых на трёх уровнях (5, 25 и 55 см над дном) находились трубки с кранами, через которые брали пробы воды для подсчёта церкарий. Средняя концентрация церкарий в колонках составляла 17.5 экз/мл. В первой серии опытов регистрировали изменения распределения церкарий в течение 70 мин (10, 25, 40, 70 мин) в профильтрованной озёрной воде. Учитывая результаты этих экспериментов, во второй серии оценивали вертикальное распределение церкарий через 30 мин после выпуска их в колонки с озёрной водой и последующего добавления воды (100 мл): чистой озёрной (контроль) и из аквариума с рыбой (тест). Воду добавляли через 20 мин после выпуска церкарий через воронку с трубкой, плавно перемещая конец трубки по вертикали.
Статистическую обработку экспериментальных данных проводили с применением следующих тестов: однофакторного дисперсионного анализа, теста Краскела–Уоллиса и U-теста Манна–Уитни.
РЕЗУЛЬТАТЫ
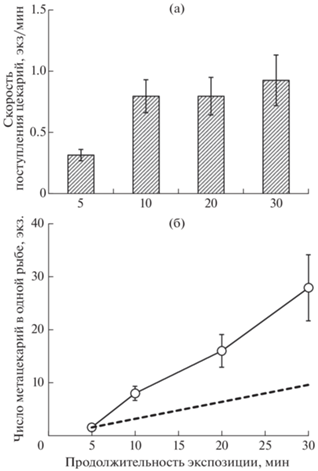
В течение 5 мин после выпуска церкарий в аквариум с рыбой средняя скорость поступления паразитов в рыбу была невысокой (не более 0.3 экз/мин). Начиная с экспозиции в 10 мин скорость резко возрастала и оставалась в диапазоне 0.8–1.0 экз/мин (рисунок, а). Эффект продолжительности экспозиции был достоверным (тест Краскела–Уоллиса: H (3, n = 40) = 14.58, p = 0.002). Расчёт накопленных рыбой за 30 мин паразитов с учётом скорости поступления церкарий в рыбу, наблюдавшуюся при 5-минутной экспозиции (до активации вентиляционной активности проникающими паразитами), показал, что их численность не должна превышать 10 экз. (рисунок, б). Однако в эксперименте средняя величина достигала почти 30 экз.
Скорость поступления церкарий трематоды Diplostomum pseudospathaceum в сеголеток Oncorhynchus mykiss (а) и число метацеркарий в рыбе (б) при разной продолжительности пребывания рыб (n = 10) в среде с паразитами (продолжительность экспозиции): ( ), ($\bigcirc $) – средние значения; (
), ($\bigcirc $) – средние значения; ( ) – стандартная ошибка, (‑‑‑) – расчётные данные, полученные на основе исходной скорости
поступления церкарий (до взаимодействия с паразитами) и продолжительности экспозиции.
) – стандартная ошибка, (‑‑‑) – расчётные данные, полученные на основе исходной скорости
поступления церкарий (до взаимодействия с паразитами) и продолжительности экспозиции.
В эксперименте по оценке влияния запаха рыбы на двигательную активность церкарий обнаружено, что при добавлении воды из аквариума с особью O. mykiss частота “прыжков” парящего в толще воды паразита достоверно возрастала более чем на 20% (U-тест Манна–Уитни, p = 0.03). Может ли такое сравнительно небольшое увеличение активности церкарий под влиянием запаха рыбы привести к существенному изменению их вертикального распределения в водной толще?
В первой серии экспериментов по вертикальному распределению церкарий было обнаружено, что со временем всё большее число церкарий погружается в придонный слой (однофакторный дисперсионный анализ, p < 0.001). В интервале от 25 до 40 мин около половины общего числа церкарий находилось на глубине. Регистрация вертикального распределения церкарий во второй серии экспериментов показала, что через 30 мин после выпуска паразитов 52% их общего числа в контроле находилось в придонном слое. Добавление воды с запахом рыбы дало существенно иную картину вертикального распределения – в придонном слое оказалось всего лишь 25% церкарий; более 60% концентрировались в среднем слое (~ 25 см ото дна). Влияние запаха на вертикальное распределение было высоко достоверным (однофакторный дисперсионный анализ, p = 0.001).
ОБСУЖДЕНИЕ
Рыбы, несмотря на их подвижность и защищённость от паразитов (Poulin, FitzGerald, 1989; Barber et al., 2000; Karvonen et al., 2004; Stumbo et al., 2012; Mikheev et al., 2013), часто служат окончательными или промежуточными хозяевами различным паразитам, среди которых трематоды занимают одно из ведущих мест. Не последнюю роль в освоении трематодами столь ценного ресурса играет их способность манипулировать поведением рыб (Barber et al., 2000; Seppälä et al., 2005; Mikheev et al., 2010; Poulin, 2010), что повышает успех их передачи к следующему хозяину и, следовательно, приспособленность. Подавляющее большинство исследований манипулирования в системе “рыбы–трематоды” выполнено на этапе жизненного цикла паразита, когда он передаётся следующему хозяину при поедании предыдущего. Широко распространённая трематода D. pseudospathaceum, хорошо известный манипулятор индивидуальным и групповым поведением рыб (Karvonen et al., 2004; Seppälä et al., 2005; Mikheev et al., 2010), лучше всего изучена на стадии инвазионных метацеркарий, готовых к заражению окончательного хозяина – рыбоядных птиц. Однако приспособленность паразита зависит не только от этого, безусловно, важного отрезка, но и от всех прочих этапов жизненного цикла. Например, преждевременное (для паразита) поедание любым хищником рыбы с незрелыми метацеркариями прерывает жизненный цикл паразита (Шигин, 1986). Отсутствие подходящих условий для попадания свободно плавающих церкарий в подвижных рыб может привести к столь низким показателям экстенсивности и интенсивности заражения промежуточного хозяина, что эффективность передачи диплостомума к окончательному хозяину будет слишком низкой. Для успешного манипулирования в рыбу должно попасть достаточно большое число паразитов. Чем больше паразитов окажется в рыбе, тем быстрее они достигнут инвазионного состояния и с большей вероятностью попадут в следующего хозяина (Gopko et al., 2017).
Идея о более широком диапазоне манипулирования поведением хозяина, чем только повышение его доступности хищнику, привела к гипотезе о манипулировании, направленном на предотвращение преждевременного поедания (защиту) хозяина (predation suppression) на этапе, когда паразит ещё не достиг инвазионности (Parker et al., 2009; Dianne et al., 2011; Weinreich et al., 2012). Рассматриваемая в настоящей статье гипотеза о манипулировании поведением рыбы, повышающем успех передачи паразита на этапе свободно плавающей расселительной личинки, расширяет представления о манипуляторных возможностях паразита в направлении ещё более ранних стадий его жизненного цикла.
Полученные результаты о резком повышении скорости поступления церкарий D. pseudospathaceum в рыбу после того, как в неё проникли первые паразиты, позволяют считать, что внедрившиеся в кожные покровы церкарии возбуждают рыбу и повышают её активность. Проникновение паразитов вызывает увеличение частоты движения жаберных крышек (Laitinen et al., 1996) и усиление потока воды через ротовую и жаберные полости (Mikheev et al., 2014). Этот эффект может быть связан с выделением вещества тревоги (alarm substance) (Poulin et al., 1999) при повреждении паразитом колбочковых клеток (club cells) (Chivers, Smith, 1998). Такой поведенческий механизм возник у рыб для защиты от хищников. Вещество тревоги от повреждённой хищником рыбы служит сигналом опасности для соседей, которые быстро на него реагируют. Паразиты “воспользовались” этим механизмом и, провоцируя сигнал об опасности, вынуждают рыбу усиливать свою активность. Однако больше паразитов попадает в рыбу с усилением потока воды лишь при условии, что их концентрация вблизи рыбы довольно высока. Такие условия могут возникать в прибрежье рек и озёр, где все потенциальные хозяева диплостомума – брюхоногие моллюски, рыбы и птицы – находят подходящие биотопы.
При манипулировании поведением хозяина метацеркариями, которые сначала защищают его от хищников, а затем повышают его доступность для птиц-ихтиофагов, паразиты находятся в постоянном и длительном контакте с рыбой. Для манипулирования на этапе передачи свободно плавающих церкарий должны совпасть следующие обстоятельства: 1) продолжительное нахождение рыбы на небольшом участке; 2) высокая концентрация паразитов на этом участке. Как могут возникать скопления церкарий в толще воды, обеспечивающие эффективную работу механизма “самоактивации” потока паразитов в рыбу с вентиляционными токами воды?
Полученные результаты по оценке влияния запаха рыбы на двигательную активность и вертикальное распределение церкарий показали, что без ольфакторной стимуляции церкарии довольно быстро опускаются в придонный слой. У дна церкарии при низкой активности снижают расход энергии (Sukhdeo, Sukhdeo, 2004). В придонном слое течения слабы и вероятность разноса паразитов и снижения их локальной концентрации невелика. В экспериментах также обнаружено увеличение частоты вертикально ориентированных движений церкарий под влиянием запаха рыбы, что вызывало их подъём из придонного слоя/задержку опускания и накопление в слое ~20–30 см ото дна.
Чтобы значительное число паразитов попало в рыб, запах которых повлиял на активность первых, эти рыбы должны довольно длительное время оставаться на небольшом участке. Причинами такой задержки могут быть питание в скоплении кормовых объектов или конкуренция за индивидуальную территорию с убежищем (Grant, 1997; Johnsson et al., 2000; Михеев, 2006). В последнем случае риск получить большое количество паразитов особенно велик (Mikheev et al., 2020). При определённых условиях продолжительная борьба за привлекательный участок среды, обеспечивающий победителя обильным кормом и убежищем от хищников, может привести к высокому риску заражения церкариями диплостомума. Сильно заражённые особи через 1.0–1.5 мес. становятся особенно уязвимыми для хищников (Шигин, 1986). Неудивительно, что часть рыб, обнаружив присутствие паразитов, отказывается от борьбы за территорию и, объединившись в стаю, покидает опасный участок (Mikheev et al., 2013), тогда как другие продолжают борьбу, несмотря на риски (Mikheev et al., 2010). Эти сведения об экологической роли паразитов позволяют считать их существенным фактором, вызывающим поведенческую дифференциацию в популяциях рыб.
ЗАКЛЮЧЕНИЕ
Гетерогенность среды разного масштаба и связанное с ней неоднородное распределение ресурсов и рисков могут инициировать поведенческий полиморфизм в популяциях рыб. Высокопродуктивные, но населённые многочисленными хищниками и паразитами низовья рек привлекают на нерест лишь часть популяций многих видов рыб. Другая часть, преодолевая значительные расстояния и препятствия, поднимается в верховья, где риск заразиться паразитами существенно ниже (Михеев и др., 2013). Разделение на группировки оседлых и более подвижных рыб наблюдается и в гораздо меньшем масштабе (Grant, Noakes, 1987). С точки зрения уязвимости для паразитов, личинки которых парят в толще воды, рыбы в постоянно перемещающихся стаях им почти недоступны. Даже почувствовав запах проплывающей рыбы, церкарии не в состоянии за ней угнаться (Sukhdeo, Sukhdeo, 2004). Однако, избегая одних паразитов, рыбы-кочевники могут заражаться другими, получая их при посещении новых биотопов и при питании. Они часто оказываются в незнакомых местах, где размещение ресурсов и рисков им неизвестно. Многие рыбы стремятся использовать другую тактику, поддерживая оседлый образ жизни в высокопродуктивных гетерогенных биотопах, где, конкурируя за участки с кормом и убежищами, они рискуют получить солидный груз паразитов. В такой ситуации даже парящие в воде церкарии трематод со слабыми сенсорными и локомоторными возможностями способны успешно проникать в рыбу вместе с вентиляционными токами. В настоящей работе приведены экспериментальные результаты, подтверждающие гипотезу о манипулировании поведением рыбы проникающими в неё церкариями. Возбуждая рыбу, первые внедрившиеся церкарии усиливают вентиляцию и повышают скорость проникновения в рыбу других церкарий. Подобная “кооперация” и манипулирование, вероятно, способствуют агрегированному распределению паразитов среди рыб.
Трематоды D. pseudospathaceum в качестве второго промежуточного хозяина используют рыб разных видов, но их показатели заражённости сильно различаются. Некоторые виды рыб совсем не заражаются диплостомумом (Шигин, 1986). Причины такой изменчивости могут быть связаны с защитными механизмами, включающими морфологические, физиологические и поведенческие адаптации рыб. Какую роль в этом играют рассмотренные в настоящей работе механизмы, предстоит выяснить в будущих исследованиях.
Список литературы
Михеев В.Н. 2006. Неоднородность среды и трофические отношения у рыб. М.: Наука, 191 с.
Михеев В.Н., Жохов А.Е., Сливко В.М. 2013. Может ли риск заражения паразитами служить причиной экологической дифференциации в популяции плотвы, Rutilus rutilus (Cyprinidae)? // Вопр. ихтиологии. Т. 53. № 5. С. 613–620. https://doi.org/10.7868/S004287521305007X
Шигин А.А. 1986. Трематоды фауны СССР. Род Diplostomum. Метацеркарии. М.: Наука, 253 с.
Barber I., Hoare D., Krause J. 2000. Effects of parasites on fish behaviour: a review and evolutionary perspective // Rev. Fish Biol. Fish. V. 10. № 2. P. 131–165. https://doi.org/10.1023/A:1016658224470
Bethel W.M., Holmes J.C. 1973. Altered evasive behavior and responses to light in amphipods harboring acanthocephalan cystacanths // J. Parasitol. V. 59. № 6. P. 945–956. https://doi.org/10.2307/3278623
Bethel W.M., Holmes J.C. 1977. Increased vulnerability of amphipods to predation owing to altered behavior induced by larval acanthocephalans // Can. J. Zool. V. 55. № 1. P. 110–115. https://doi.org/10.1139/z77-013
Chivers D.P., Smith R.J.F. 1998. Chemical alarm signaling in aquatic predator-prey systems: a review and prospectus // Écoscience. V. 5. № 3. P. 338–352. https://doi.org/10.1080/11956860.1998.11682471
Combes C., Fournier A., Moné H., Théron A. 1994. Behaviours in trematode cercariae that enhance parasite transmission: patterns and processes // Parasitology. V. 109. Suppl. 1. P. S3–S13. https://doi.org/10.1017/S0031182000085048
Combes C., Bartoli P., Théron A. 2002. Trematode transmission strategies // The behavioural ecology of parasites. Wallingford: CABI Publ. P. 1–12. https://doi.org/10.1079/9780851996158.0001
Dawkins R. 1999. The extended phenotype: the long reach of the gene. Oxford: Oxford Univ. Press, 336 p.
Dianne L., Perrot-Minnot M.-J., Bauer A. et al. 2011. Protection first then facilitation: a manipulative parasite modulates the vulnerability to predation of its intermediate host according to its own developmental stage // Evolution. V. 65. № 9. P. 2692–2698. https://doi.org/10.1111/j.1558-5646.2011.01330.x
Gopko M.V., Mikheev V.N., Taskinen J. 2017. Positive density-dependent growth supports costs sharing hypothesis and population density sensing in a manipulative parasite // Parasitology. V. 144. № 11. P. 1511–1518. https://doi.org/10.1017/S0031182017001020
Grant J. 1997. Territoriality // Behavioural ecology of teleost fishes. Oxford: Oxford Univ. Press. P. 81–103.
Grant J.W.A., Noakes D.L.G. 1987. Movers and stayers: foraging tactics of young-of-the-year brook charr, Salvelinus fontinalis // J. Anim. Ecol. V. 56. № 3. P. 1001–1013. https://doi.org/10.2307/4962
Haas W., Stiegeler P., Keating A. et al. 2002. Diplostomum spathaceum cercariae respond to a unique profile of cues during recognition of their fish host // Int. J. Parasitol. V. 32. № 9. P. 1145–1154. https://doi.org/10.1016/s0020-7519(02)00089-9
Haas W., Beran B., Loy C. 2008. Selection of the host’s habitat by cercariae: from laboratory experiments to the field // J. Parasitol. V. 94. № 6. P. 1233–1238. https://doi.org/10.1645/GE-1192.1
Hendrickson G.L., Kingston N. 1974. Cercaria laramiensis sp. n., a freshwater zygocercous cercaria from Physa gyrina Say, with a discussion of cercarial aggregation // Ibid. V. 60. № 5. P. 777–781. https://doi.org/10.2307/3278899
Johnsson J.I., Carlsson M., Sundström L.F. 2000. Habitat preference increases territorial defence in brown trout (Salmo trutta) // Behav. Ecol. Sociobiol. V. 48. № 5. P. 373–377. https://doi.org/10.1007/s002650000244
Karvonen A., Seppälä O., Valtonen E.T. 2004. Parasite resistance and avoidance behaviour in preventing eye fluke infections in fish // Parasitology. V. 129. № 2. P. 159–164. https://doi.org/10.1017/S0031182004005505
Laitinen M., Siddall R., Valtonen E.T. 1996. Bioelectronic monitoring of parasite-induced stress in brown trout and roach // J. Fish Biol. V. 48. № 2. P. 228–241. https://doi.org/10.1111/j.1095-8649.1996.tb01115.x
Mikheev V.N., Pasternak A.F., Taskinen J., Valtonen E.T. 2010. Parasite-induced aggression and impaired contest ability in a fish host // Parasit. Vectors. V. 3. Article 17. https://doi.org/10.1186/1756-3305-3-17
Mikheev V.N., Pasternak A.F., Taskinen J., Valtonen E.T. 2013. Grouping facilitates avoidance of parasites by fish // Ibid. V. 6. Article 301. https://doi.org/10.1186/1756-3305-6-301
Mikheev V.N., Pasternak A.F., Taskinen J., Valtonen E.T. 2014. Increased ventilation by fish leads to a higher risk of parasitism // Ibid. V. 7. Article 281. https://doi.org/10.1186/1756-3305-7-281
Mikheev V.N., Pasternak A.F., Morozov A.Yu., Taskinen J. 2020. Innate antipredator behavior can promote infection in fish even in the absence of predators // Behav. Ecol. V. 31. № 1. P. 267–276. https://doi.org/10.1093/beheco/arz188
Odening K., Bockhardt I. 1976. On the seasonal occurrence of Azygia lucii (Trematoda) in Esox lucius (Pisces) // Zool. Anzeiger. V. 196. № 3–4. P. 182–188.
Parker G.A., Ball M.A., Chubb J.C. et al. 2009. When should a trophically transmitted parasite manipulate its host? // Evolution. V. 63. № 2. P. 448–458. https://doi.org/10.1111/j.1558-5646.2008.00565.x
Poulin R. 2010. Parasite manipulation of host behaviour: an update and frequently asked questions // Adv. Stud. Behav. V. 41. P. 151–186. https://doi.org/10.1016/S0065-3454(10)41005-0
Poulin R., FitzGerald G.J. 1989. Risk of parasitism and microhabitat selection in juvenile sticklebacks // Can. J. Zool. V. 67. № 1. P. 14–18. https://doi.org/10.1139z89-003
Poulin R., Marcogliese D.J., McLaughlin J.D. 1999. Skin-penetrating parasites and the release of alarm substances in juvenile rainbow trout // J. Fish. Biol. V. 55. № 1. P. 47–53. https://doi.org/10.1111/j.1095-8649.1999.tb00655.x
Seppälä O., Karvonen A., Valtonen E.T. 2005. Impaired crypsis of fish infected with a trophically transmitted parasite // Anim. Behav. V. 70. № 4. P. 895–900. https://doi.org/10.1016/j.anbehav.2005.01.021
Smyth J.D. 1966. The physiology of trematodes. Edinburgh; London: Oliver and Boyd, 256 p.
Stumbo A.D., James C.T., Goater C.P., Wisenden B.D. 2012. Shoaling as an antiparasite defence in minnows (Pimephales promelas) exposed to trematode cercariae // J. Anim. Ecol. V. 81. № 6. P. 1319–1326. https://doi.org/10.1111/j.1365-2656.2012.02012.x
Sukhdeo M.V.K., Sukhdeo S.C. 2004. Trematode behaviours and the perceptual worlds of parasites // Can. J. Zool. V. 82. № 2. P. 292–315. https://doi.org/10.1139/z03-212
Weinreich F., Benesh D.P., Milinski M. 2012. Suppression of predation on the intermediate host by two trophically-transmitted parasites when uninfective // Parasitology. V. 140. № 1. P. 129–135. https://doi.org/10.1017/S0031182012001266
Whyte S.K., Secombes C.J., Chappell L.H. 1991. Studies on the infectivity of Diplostomum spathaceum in rainbow trout (Oncorhynchus mykiss) // J. Helminthol. V. 65. № 3. P. 169–178. https://doi.org/10.1017/s0022149x0001066x
Дополнительные материалы отсутствуют.
Инструменты
Вопросы ихтиологии


