Известия РАН. Серия биологическая, 2019, № 3, стр. 265-272
Действие СВЧ-излучения на метацеркарий описторхисов и личинок трихинелл
А. Н. Пельгунов 1, *, И. М. Одоевская 2, А. В. Хрусталев 2, О. П. Курносова 2
1 Центр паразитологии Института проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
2 Всероссийский научно-исследовательский институт фундаментальной и прикладной паразитологии животных
и растений – филиал ФГБНУ “ФНЦ – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко РАН”
117218 Москва, ул. Б. Черемушкинская, 28, Россия
* E-mail: apelgunov@list.ru
Поступила в редакцию 17.08.2017
После доработки 26.12.2017
Принята к публикации 01.02.2018
Аннотация
Приведены обобщенные данные о влиянии сверхвысокочастотного излучения на метацеркарий описторхид Opistorchis felineus (Rivolta, 1884) и личинок трихинелл р. Trichinella Railliet, 1895 трех видов. Показана высокая эффективность воздействия СВЧ-облучения на жизнеспособность личинок этих видов. Отмечено, что даже незначительное по времени облучение приводит к гибели личинок гельминтов в мышечной ткани. Обсуждаются механизм воздействия СВЧ-облучения на этих личинок и возможность использования бытовых микроволновых печей для профилактики этих паразитарных заболеваний.
Источник заражения людей описторхозом – карповые виды рыб (сем. Cyprinidae), содержащие живых инвазионных личинок описторхисов. Как правило, это свежепосоленная, малосоленая или недостаточно термически обработанная рыба, причем такая рыба может быть приобретена и в специализированных торговых точках.
Ежегодно в Российской Федерации выявляется до 30 тыс. случаев заболевания людей описторхозом. Описторхоз остается важной социально значимой проблемой для РФ. Две трети мирового ареала возбудителя приходится на территорию РФ. За последние 20 лет произошло расширение ареала возбудителя описторхоза с активным включением человека в качестве источника циркуляции этой инвазии. Основные причины распространения описторхоза следующие: недостаток производственных мощностей низкотемпературных камер, несоблюдение технологического режима обеззараживания рыбы от личинок описторхоза на предприятиях, занятых переработкой рыбы (Постановление…, 2016). Поэтому одно из важнейших направлений профилактики заболевания описторхозом у населения – обработка рыбы из неблагополучных по описторхозу районов, обеспечивающая обезвреживание метацеркарий, не только в промышленных масштабах, но и в домашних условиях.
В дикой природе трихинеллез распространен повсеместно, от Северного полюса до южной оконечности Африканского континента, синантропные очаги трихинеллеза также зарегистрированы во многих странах мира. Возбудители трихинеллеза – нематоды рода Trichinella Railliet, 1895. Эти нематоды способны паразитировать у трех классов позвоночных: млекопитающих, птиц и рептилий (Pozio, Murrell, 2006). В последние годы число генотипов, возведенных в ранг вида, значительно возросло. В настоящее время общепризнано существование 12 генотипов трихинелл (T1-T12), из них 9 признаны валидными видами (Pozio et al., 2009).
В РФ в 2001–2008 гг. было зарегистрировано 3042 случая трихинеллеза. Из общего числа зарегистрированных случаев источником заражения было инвазированное трихинеллами мясо: свиньи – 32%, бурого медведя – 21.9%, собак – 19%, барсуков – 9.9%, кабанов – 16%, ондатры, рыси, волка, белого медведя, моржа – 1.2% (Гузеева, 2011). При обнаружении личинок трихинелл по результатам ветеринарно-санитарной экспертизы туша животного подлежит утилизации (уничтожение или захоронение в скотомогильнике) (Санитарные…, 1997). Таким образом, заражение происходит в результате использования в пищу мяса домашней свиньи или диких животных, преимущественно хищников, а также мяса собак. Однако истинная распространенность трихинеллеза среди населения, проживающего на эндемичных в отношении этой инвазии территориях РФ, значительно превышает официально регистрируемые статистические данные, поскольку у значительной части людей трихинеллезная инвазия протекает субклинически, без выраженных симптомов заболевания. В 2010 г. при проведении сероэпидемиологических исследований в приморских поселках зверобоев-охотников на Чукотке было зарегистрировано наличие специфических антител у 24.32% респондентов, что свидетельствовало о напряженности очага трихинеллеза на территории Чукотского автономного округа (Букина, Одоевская, 2012, 2013).
Поэтому актуальна разработка новых форм обеззараживания рыбы от метацеркарий описторхид и мяса от личинок трихинелл. При этом способы обработки данной продукции должны быть доступны в домашних условиях. Один из современных способов – обеззараживание с помощью сверхвысокочастотного-излучения (СВЧ-излучения).
МАТЕРИАЛЫ И МЕТОДЫ
Для воздействия на образцы СВЧ-излучением использовали бытовую микроволновую печь максимальной мощностью 800 Вт.
Описторхоз. Для опытов использовали свежих (пойманных в течение нескольких часов) язей Leuciscus idus L., 1758, спонтанно зараженных метацеркариями O. felineus, которые были отловлены в месте впадения р. Бартак (приблизительно в 100 км от Тобольска вниз по течению Иртыша) (Пельгунов и др., 2005). Перед обработкой в СВЧ-печи рыбу чистили (снимали чешую, удаляли внутренние органы), отделяли голову и хвост. От каждой подготовленной таким образом рыбы брали пробы мышц для выделения метацеркарий, которые служили контролем. После этого от этой тушки язей отрезали кусок необходимой массы (вместе с костями) и обрабатывали в СВЧ-печи в заданном режиме. После обработки вновь брали пробы мышц для выделения метацеркарий. Всего было проведено 17 опытов.
Метацеркарий O. felineus выделяли методом искусственного переваривания (Глазков, 1977). Жизнеспособность метацеркарий описторхид определяли несколькими способами: по сохранению морфологической структуры метацеркарий; по их подвижности; по выходу личинок под действием трипсина; методом биологической пробы, для чего было проведено экспериментальное заражение золотистых хомячков. В каждом опыте использовали одного язя. В опыте с заражением у каждой рыбы вырезали центральную часть тушки, из которой методом искусственного переваривания выделяли метацеркарий описторхисов для заражения хомяков (что служило контролем). Потом кусок массой 400 г обрабатывали в СВЧ-печи в заданном режиме. После обработки также методом искусственного переваривания выделяли метацеркарий и заражали животных. Через 2 нед хомяков усыпляли эфиром и подсчитывали число описторхисов в печени и поджелудочной железе. Было проведено 3 опыта, в которых использовали 21 экз. хомяков.
Трихинеллез. Опыты проводили с двумя капсулообразующими видами трихинелл T. spiralis (Owen, 1835) и T. nativа (Britov et Boev, 1972), первоначально выделенными из мышц домашней свиньи Sus scrofa domesticus Linnaeus, 1758 и из мышц бурого медведя Ursus arctos Linnaeus, 1758 соответственно, и с одним бескапсульным видом T. pseudospiralis (Garkavi, 1972), первоначально выделенным из мышц домашней кошки Felis catus domestica Erxleben, 1777. Культуру этих видов трихинелл поддерживали на лабораторных грызунах в условиях вивария института. Экспериментально инвазированных белых крыс и мышей усыпляли диэтиловым эфиром, у тушек удаляли шкуру и внутренние органы, а мышечную ткань измельчали и подвергали биохимическому перевариванию в искусственном желудочном соке (ИЖС), содержащем 1% соляной кислоты (уд. масса 1.175) и 3% пепсина. Свежеприготовленный ИЖС нагревали до 40 ± 2°С в аппарате “Гастрос” (завод “Петролазер”, Санкт-Петербург, Россия), и в течение 2 ч осуществляли протеолиз мышечной ткани. Декапсулированных личинок трихинелл помещали в подогретый до 37°С физиологический раствор, подсчитывали их число, а затем проводили заражение per os. беспородных кроликов в дозе 2 личинки на 1 г массы тела животного. В эксперименте были сформированы 3 группы кроликов, по 5 особей в каждой. Продолжительность инвазирования составила 90 сут.
От экспериментально инвазированных кроликов брали пласт мышц (массой 150–160 г, толщиной 1.5–2 см) с бедра и подвергали его СВЧ-облучению мощностью 800 Вт в течение 2 и 4 мин в бытовой микроволновой печи. Степень деструктивных изменений внутренних органов личинок трихинелл после обработки СВЧ-излучением изучали методом световой микроскопии. Жизнеспособность личинок определяли методом биопробы, скармливая обработанное мясо белым лабораторным крысам. В каждой опытной группе было по 10 белых беспородных крыс, а в трех контрольных – по 3. Положительным контролем для каждой группы служили животные, питавшиеся сырым зараженным трихинеллами мясом. Учет результатов опыта проводили через 45 сут методом протеолиза в ИЖС мышц тушек крыс опытных и контрольных групп (Pelgunov et al., 2016).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Описторхоз. По данным руководства по приготовлению рыбы в СВЧ-печах бытового применения большое значение имеют время обработки, масса продукта и мощность излучения, причем три этих параметра не связаны линейной зависимостью. Так, например, если мы увеличиваем массу обрабатываемого продукта в 2 раза, то время обработки увеличивается только в 1.5 раза (Микроволновая…, 2002). Три параметра, связанные нелинейной зависимостью, приводят к определенным сложностям в постановке опыта, поэтому единственный критерий эффективности СВЧ-облучения при обеззараживании рыбной продукции – гибель метацеркарий.
Проведенные опыты показали высокую эффективность СВЧ-излучения при обеззараживании рыбы от личинок описторхисов. Так, при обработке 800 г рыбы в рабочем режиме 800 Вт в течение 4 мин все метацеркарии описторхисов погибали, причем рыба еще не была готова к употреблению. При меньшей массе рыбы можно использовать меньшую мощность СВЧ-излучения или сокращать время обработки, что даст возможность далее использовать другие методы приготовления рыбы (табл. 1).
Таблица 1.
Выживаемость метацеркарий Opistorchis felineus при обработке рыбы СВЧ-излучением
| Масса куска рыбы, г | Рабочий режим, Вт | Время обработки, мин | К/О* | Число метацеркарий | Число аномаль ных метацеркарий** | Эксцистированные/ подвижные в цисте | Выживаемость, % | t*** |
|---|---|---|---|---|---|---|---|---|
| 66 | 800 | 1 | К | 15 | 0 | 8/5 | 87 ± 8.7 | 5.11 (0.001) |
| О | 17 | 4 | 0 | 0 ± 5 | ||||
| 180 | 400 | 2 | К | 29 | 0 | 17/8 | 100 ± 2.5 | 4.74 (0.001) |
| О | 24 | 2 | 10/6 | 55 ± 7.2 | ||||
| 407 | 400 | 4 | К | 20 | 0 | 20/0 | 100 ± 4.3 | 3.0 (0.01) |
| О | 36 | 1 | 23/0 | 64 ± 8 | ||||
| 399 | 480 | 5 | К | 77 | 0 | 0/77 | 100 ± 1.3 | 10.63 (0.001) |
| О | 36 | 25 | 0 | 0 ± 2.5 | ||||
| 370–410 | 800 | 2 | К | 30 | 0 | 30 | 100 ± 3.5 | 8.95 (0.001) |
| О | 63 | 23 | 3 | 5 ± 2.7 | ||||
| 3 | К | 75 | 0 | 21/52 | 97 ± 2 | 13.57 (0.001) | ||
| О | 129 | 44 | 0/3 | 2 ± 1.2 | ||||
| 4 | К | 40 | 0 | 36/2 | 95 ± 3.4 | 8.79 (0.001) | ||
| О | 45 | 36 | 0 | 0 ± 2.1 | ||||
| 497–512 | 800 | 2 | К | 47 | 0 | 28/16 | 94 ± 3.5 | 5.05 (0.001) |
| О | 41 | 18 | 17/2 | 46 ± 7.8 | ||||
| 4 | К | 67 | 0 | 65 | 97 ± 2 | 12.27 (0.001) | ||
| О | 94 | 25 | 0 | 0 ± 1 | ||||
| 740–815 | 800 | 4 | К | 53 | 0 | 30/23 | 100 ± 1.8 | 10.75 (0.001) |
| О | 63 | 32 | 0/0 | 0 ± 1.5 |
Примечание. * – К – контроль; О – опыт, после обработки в СВЧ-печи; для табл. 1 и 2. ** – Метацеркарии с желтым экскреторным пузырем или с крупными черными гранулами в экскреторном пузыре. *** – t – достоверность разницы (уровень значимости – Р).
Метацеркарии описторхисов, обработанные при небольших мощностях СВЧ-излучения и в течение непродолжительного времени, несмотря на то что эксцистировались, были значительно менее жизнеспособны, чем в контроле. Например, после воздействия в течение 2 мин СВЧ-излучением в рабочем режиме (800 Вт) на кусок рыбы массой 392 г эксцистировались три метацеркарии (из 63), которые погибли в течение 40 мин в физрастворе при комнатной температуре. В контроле все эксцистированные метацеркарии были подвижны >1 сут. Также необходимо отметить, что вышедшие из цист метацеркарии после обработки СВЧ-излучением имеют низкую активность по сравнению с контролем.
Наиболее точный критерий жизнеспособности метацеркарий O. felineus – постановка биопробы. Мы провели экспериментальное заражение золотистых хомячков метацеркариями описторхисов, полученных от спонтанно-зараженных язей. Было поставлено три опыта, во всех опытах масса обрабатываемого куска рыбы была одинаковой – 400 г, мощность СВЧ-печи – 800 Вт, время облучения – 2, 4 и 6 мин (табл. 2).
Таблица 2.
Результаты экспериментального заражения золотистых хомячков метацеркариями Opistorchis felineus до и после обработки рыбы в микроволновой печи
| № опыта | Режим работы, Вт | Время обработки, мин | К/О* | Число животных | Число мета-церкарий | Найдено описторхисов | Приживаемость, % |
|---|---|---|---|---|---|---|---|
| 1 | 800 | 2 | К | 3 | 142 | 64 | 45 ± 4.2 |
| О | 3 | 120 | 20 | 17 ± 3.4 | |||
| 2 | 800 | 4 | К | 3 | 110 | 43 | 39 ± 4.7 |
| О | 6 | 242 | 0 | 0 ± 0.4 | |||
| 3 | 800 | 6 | К | 3 | 122 | 36 | 30 ± 4.1 |
| О | 3 | 121 | 0 | 0 ± 0.8 |
Навеска для порционного блюда, наиболее часто встречающаяся в руководствах по приготовлению рыбы в СВЧ-печах, 400–500 г рыбы.
Экспериментальное заражение животных метацеркариями описторхисов, прошедших обработку СВЧ-излучением, подтвердило высокую эффективность данного воздействия на жизнеспособность и инвазионность личинок. Так, при обработке рыбы в течение 4 мин при мощности 800 Вт рыба была не готова, но ни одно животное не заразилось описторхидами. При шестиминутной обработке и рабочем режиме СВЧ-печи 800 Вт рыба была готова к употреблению. Разброс данных по приживаемости метацеркарий описторхисов в контроле во многом объясняется тем, что для опытов брали разных язей, спонтанно-зараженных личинками описторхисов (табл. 2).
Трихинеллез. По результатам экспериментальных исследований трихинеллами заразились все крысы из контрольных групп, которым давали сырое мясо, инвазированное личинками трихинелл, с интенсивностью инвазии в среднем 725.3 (T. spiralis), 237.8 (T. Pseudospiralis), 65.1 (T. nativa) личинки на 1 г мышечной ткани. Интенсивность инвазии T. spiralis у крыс, питавшихся зараженным мясом после двухминутного его СВЧ-облучения (800 Вт), составила 0.02–0.03 личинки на 1 г, причем заразились только 3 крысы из 10. Для T. nativa был получен аналогичный результат – 0.03–0.05 личинки на 1 г, при этом заразились 3 крысы из 10, а в опыте с T. pseudospiralis зараженных трихинеллами крыс выявлено не было. Крысы из групп, питавшихся мясом после четырехминутного воздействия на него СВЧ-излучения (800 Вт), были свободны от трихинеллезной инвазии.
Морфологический анализ личинок, выделенных из мышц после обработки их СВЧ-излучением, показал следующее:
при двухминутной обработке у большинства T. spiralis были разрушены капсулы и внутренние органы, у T. pseudospiralis – кутикула и внутренние структуры, у T. nativа произошла деструкция клеточной структуры, отслоение кутикулы;
при четырехминутной обработке у T. spiralis, T. pseudospiralis и T. nativa было отмечено полное разрушение личинок (рис. 1).
Рис. 1.
Личинки трихинелл после воздействия СВЧ-излучением (микрофото). а – T. spiralis (2 мин), б – T. spiralis (4 мин), в – T. pseudospiralis (2 мин), г – T. pseudospiralis (4 мин), д – T. nativa (2 мин), е – T. nativa (4 мин).
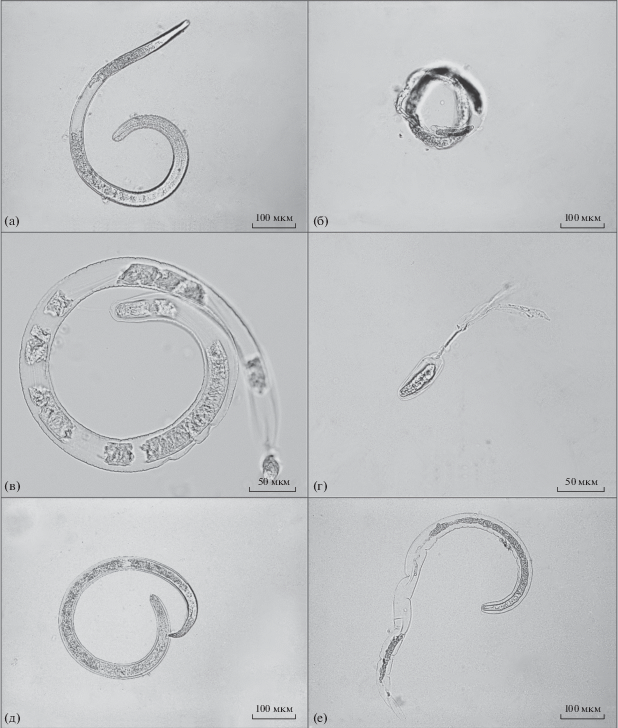
Бескапсульная форма трихинелл T. pseudospiralis оказалась более чувствительной к СВЧ-излучению, чем капсульные формы T. spiralis и T. nativa. Можно предположить, что капсула защищает от СВЧ-излучения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Среди электромагнитного излучения (ЭМИ) радиоволнового (неионизирующего) диапазона выраженным биологическим действием обладают сверхвысокочастотные ЭМИ или микроволны. Наиболее хорошо изучен тепловой эффект микроволн, связанный с повышением температуры облучаемой ткани. Наряду с тепловым воздействием микроволны вызывают в биологических объектах и нетепловые, например резонансные, эффекты, наблюдаемые экспериментально не только на фоне повышения температуры, но и без существенного нагрева (Исмаилов, 1987).
Наиболее наглядно нетепловое действие микроволн проявляется на организменном и частично клеточном уровне; в меньшей мере на молекулярном уровне. По мнению Пресмана, это обстоятельство объясняется тем, что действие электромагнитный полей на живую ткань носит не только энергетический, но и информационный характер (Пресман, 1968).
В механизмах поглощения СВЧ-энергии биологическими объектами существенную роль играет вода. Она вносит определяющий вклад в диэлектрические потери СВЧ-энергии в биологической ткани.
Релаксация дипольных молекул воды и колебания свободных зарядов в СВЧ-поле наиболее наглядно определяют тепловой эффект ЭМИ. При этом в результате нагревания клеток и тканей организма происходит изменение физико-химических свойств биологических структур. В мощных полях эти изменения приобретают необратимый характер и вызывают гибель организма.
По нормам СанПиН 3.2.3215-14 (2015), созданных на основании результатов многочисленных работ разных авторов, карповые рыбы из неблагополучных по описторхозу районов должны проходить определенную обработку. Это промораживание рыбы (минимальная температура – 28°С в течение 32 ч), горячая термическая обработка рыбопродуктов (проваривание порционных кусков рыбы не менее 20 мин с момента закипания, крупные куски рыбы необходимо жарить в распластованном виде не менее 20 мин), просаливание рыбы при условии достижения массовой доли соли в мясе рыбы 14%. В домашних условиях это, в частности промораживание, выполнить практически невозможно. Более того, рыбопродукция из карповых видов рыб, прошедшая технологическую обработку на рыбозаводах и официально реализуемая населению, в ряде случаев содержит жизнеспособные личинки описторхид (Гузеева, Ключников, 2002). Поэтому актуальной остается разработка новых методов обеззараживания рыбы в домашних условиях от метацеркарий описторхиса и других личинок паразитов.
Личинки T. nativa сохраняют жизнеспособность и инвазионность в трупах плотоядных животных в природных условиях длительное время. Так, в замороженном состоянии личинки остаются инвазионными в течение 4–5 лет. В естественных условиях при нахождении трупа инвазированного животного в зоне морской литорали личинки трихинелл сохраняют жизнеспособность в течение года и более, перенося условия арктической зимы. Проведенные эксперименты показали, что в традиционном на Чукотке продукте “Копальхен” при –12…–14°С трихинеллы сохраняют инвазионность на протяжении 4.5 лет (Букина и др., 2013). В мясе, подвергнутом традиционному вялению (высушиванию при потере массы 60–70%), часть инкапсулированных личинок трихинелл также сохраняют свою жизнеспособность. Слабое соление, горячее и особенно холодное копчение мясных продуктов не гарантируют обеззараживания мяса от трихинелл.
Ранее были выполнены большие объемы работ по влиянию СВЧ-излучения при приготовлении в бытовых микроволновых печах мяса, зараженного личинками трихинелл (Carlin et al., 1982; Kotula et al., 1982, 1983; Zimmermann, 1983, 1984; Редькин, Боровков, 2007). В основном авторы уделяли внимание степени готовности мяса, температуре внутри обрабатываемого мяса и влиянию температуры на жизнеспособность личинок. При этом они не учитывали влияние СВЧ-излучения на самих личинок трихинелл и часто не указывали мощность СВЧ-печи, при которой работали.
Эффект воздействия СВЧ-излучения на биологические объекты определяется количеством проникающей и поглощаемой ими электромагнитной энергии. Значительная часть энергии микроволн превращается в тепло, а колебания ионов и дипольных молекул воды в тканях приводят к разрушению внутренних органов и даже разрыву тела личинок трихинелл. При обработке зараженного трихинеллами мяса и рыб, пораженных метацеркариями описторхисов, необходимо учитывать проникающую способность СВЧ-излучения, время и мощность облучения, массу облучаемого объекта. Температурный фактор нагревания окружающей среды (мышечная ткань) вокруг паразита носит вторичный характер. Это полностью согласуется с ранее опубликованными данными (Пресман, 1968; Рогов, Адаменко, 1971) о влиянии СВЧ-излучения на микроорганизмы.
Важно отметить, что капсульные трихинеллы более устойчивы к СВЧ-излучению, чем бескапсульные, но это предположение нуждается в дальнейшей проверке.
По нормам СанПиНа термическая обработка рыб карповых пород из неблагополучных по описторхозу районов – проваривание не менее 20 мин с момента закипания небольшими кусками (СанПиН 3.2.3215-14, 2015).
Сравнивая время обработки (4 и 20 мин), мы предполагаем, что эта разница обусловлена тем, что при проваривании метацеркарии нагреваются снаружи (от окружающей ткани), а при СВЧ-облучении нагревается сам организм метацеркарий (изнутри), что и приводит к такой разнице в длительности обработки.
Таким образом, бытовые микроволновые печи могут эффективно обеззараживать продукты животного происхождения от возбудителей инвазионных болезней, и прежде всего таких актуальных зоонозных гельминтозов, как описторхоз и трихинеллез, а следовательно, могут быть эффективным средством профилактики этих гельминтозов у человека. Данные исследования нуждаются в продолжении.
Работа выполнена при финансовой поддержке Программы Президиума РАН № 41 “Биоразнообразие природных систем и биологические ресурсы России”.
Список литературы
Букина Л.А., Одоевская И.М. Сероэпидемиологическое обследование на трихинеллез коренных жителей Чукотского автономного округа (ЧАО) // Мед. паразитология и паразитар. болезни. 2012. № 3. С. 17–20.
Букина Л.А., Одоевская И.М. Особенности эпидемиологии трихинеллеза на арктических побережьях Чукотки в условиях традиционного природопользования // Мед. паразитология и паразитар. болезни. 2013. № 2. С. 8–13.
Букина Л.А., Ермолина С.А., Сюткина А.С., Одоевская И.М. Влияние процесса ферментации на сохранение инвазионных свойств личинок трихинелл в традиционном продукте питания “Копальхен” коренного населения Чукотки // Рос. паразитол. журн. 2013. № 1. С. 29–33.
Глазков Г.А. К методике выделения метацеркариев сибирской двуустки из мышечной ткани пораженной рыбы // Сб. науч. тр. “Проблемы описторхоза в Западной Сибири”. Л., 1977. С. 53–54.
Гузеева Т.М. Эпидемиологический надзор за трихинеллезом в Российской Федерации // Уч. зап.: электронный научный журнал Курс. гос. ун-та. Биол. науки. 2011. № 3(10). Т. 1. URL: http://scientific-notes.ru/ pdf/020-004.pdf (дата обращения: 07.10.2011). № государственной регистрации 0421100068\0077.
Гузеева Т.М., Ключников С.И. Заболеваемость описторхозом на территории г. Нижневартовска // Мед. паразитология и паразитар. болезни. 2002. № 2. С. 13–15.
Исмаилов Э.Ш. Биофизическое действие СВЧ-излучений М.: Энергоатомиздат, 1987. 144 с.
Микроволновая кулинария / Авт.-сост. Макаревич А.Н. М.: Юнипресс, 2002. 400 с.
Пельгунов А.Н., Рябов И.Н., Филиппова А.Ю. Использование микроволновых печей в профилактике описторхоза // Мед. паразитология и паразитар. болезни. 2005. № 3. С. 42–45.
Постановление Главного государственного санитарного врача Российской Федерации: “О предупреждении распространения паразитозов, передающихся через рыбу и рыбную продукцию в Российской Федерации”. № 179 от 12.12.2016.
Пресман А.С. Электромагнитные поля и живая природа М.: Наука, 1968. 288 с.
Редькин С.В., Боровков М.Ф. Применение СВЧ-энергии для обеззараживания мяса, инвазированного личинками Trichinella spiralis и контаминированного бактериями, вызывающими пищевые токсикоинфекции // Ветеринар. медицина. 2007. № 4. С. 5–8.
Рогов И.А., Адаменко В.Я. Современные методы и оборудование для сверхвысокочастотной обработки пищевых продуктов в промышленности (обзор). М.: ЦНИИТЭИлегпищемаш, 1971. 54 с.
Санитарные правила и нормы СанПиН 3.2.569-96. Профилактика паразитарных болезней на территории Российской Федерации. М.: Информационно-издательский центр Минздрава России, 1997. 168 с.
Санитарно-эпидемиологические правила и нормативы СанПиН 3.2.3215-14 “Профилактика паразитарных болезней на территории Российской Федерации” Санитарно-эпидемиологические правила и нормативы СанПиН 3.2.3215-14 (с изменениями на 29 декабря 2015 г.) – Официальный интернет-портал правовой информации www.pravo.gov.ru, 03.02.2016, № 0001201602030029.
Carlin F., Zimmermann W., Sundberg A. Destruction of trichinella larvae in beef-pork loaves cooked in microwave ovens // J. Food Sci. 1982. V. 47. P. 1096–1099.
Kotula A.W., Murrell K.D., Acosta-Stein L., Tennent I. Influence of rapid cooking methods on the survival of Trichinella spiralis in pork chops from experimentally infected pigs // J. Food Sci. 1982. V. 47. P. 1006–1007.
Kotula A.W., Murrell K.D., Acosta-Stein L., Lamb L., Douglass L. Destruction of Trichinella spiralis during cooking // J. Food Sci. 1983. V. 48. P. 765–768.
Pelgunov A.N., Odoevskaya I.M., Khrustalev A.V., Kurnosova O.P. The influence of microwave radiation on the juvenile stages of Trichinella // Rus. J. Nematol. 2016. V. 24(2). P. 131–133.
Pozio E., Murrell K.D. Systematics and epidemiology of Trichinella // Adv. Parasitol. 2006. V. 63. P. 367–439.
Pozio E., Hoberg E., La Rosa G., Zarlenga D.S. Molecular taxonomy, phylogeny and biogeography of nematodes belonging to the Trichinella genus // Infect. Gen. Evol. 2009. V. 9. P. 606–616.
Zimmermann W.J. An approach to safe microwave cooking of pork roasts containing Trichinella spiralis // J. Food Sci. 1983. V. 48. P. 1715–1722.
Zimmermann W.J. Power and cooking time relationdhips for devitalization of trichinae in pork roasts cooked in microwave ovens // J. Food Sci. 1984. V. 49. P. 824–826.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


