Известия РАН. Серия биологическая, 2019, № 3, стр. 312-320
Влияние засоленных почв Приэльтонья на функциональное состояние представителей рода Artemisia
О. А. Розенцвет 1, *, В. Н. Нестеров 1, Е. С. Богданова 1, Г. Н. Табаленкова 2, И. Г. Захожий 2, А. В. Попов 3
1 Институт экологии Волжского бассейна РАН
445003 Тольятти, ул. Комзина, 10, Россия
2 Институт биологии Коми УроРАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
3 Волгоградский государственный социально-педагогический университет
400131 Волгоград, просп. В.И. Ленина, 27, Россия
* E-mail: olgarozen55@mail.ru
Поступила в редакцию 07.02.2017
После доработки 02.11.2018
Принята к публикации 15.11.2018
Аннотация
Исследовано влияние засоленных почв на функциональное состояние гликогалофитов рода Artemisia (A. santonica, A. pauciflora и A. lerchiana), произрастающих в бассейне оз. Эльтон (Приэльтонье). Установлено, что более высокие показатели содержания воды и Na+ в листьях A. santonica коррелировали с повышенным содержанием пигментов, углеводов и фенольных соединений на фоне более интенсивных окислительных процессов. Отмечено, что для видов A. pauciflora и A. lerchiana характерно накопление значительного количества свободных аминокислот. На уровне структурных компонентов мембран в листьях A. pauciflora и A. lerchiana обнаружены высокий уровень дигалактозилдиацилглицерина и линоленовой кислоты в составе липидов мембран тилакоидов, а также повышенная концентрация фосфатидилхолина в непластидных мембранах.
Засоленные почвы – обязательный компонент как естественных, так и антропогенных ландшафтов аридных территорий (Панкова, 2016). Природные комплексы с засоленными почвами характерны для полупустынного зонального экотона Северного Прикаспия, включая территорию, прилегающую к оз. Эльтон (Приэльтонье). Для региона характерны высокая степень засушливости с резким дефицитом и неустойчивостью выпадения осадков, мозаичность строения растительного покрова, распространение галофитных растительных сообществ (Водно-болотные…, 2005).
Растения рода Artemisia – типичные представители засоленных экотопов. Эти многолетние травы или полукустарники различаются по своим биологическим и морфологическим свойствам, заселяют территории с разным типом растительности и экологических условий (Watson et al., 2002). В условиях Приэльтонья фитоценозы, включающие в себя A. pauciflora и A. lerchiana, характерны для суглинистых сильно засоленных почв – солонцов и черноземных и каштановых солонцеватых почв. В отличие от них A. santonica предпочитает селиться на мокрых солончаках вдоль берегов рек, питающих оз. Эльтон (Лысенко, 2013).
Засоление почвы – один из неблагоприятных экологических факторов, лимитирующих рост и продуктивность растений во влажных, аридных и полуаридных условиях произрастания (Munns, Tester, 2008). Главное условие выживания растений при действии засоления – противостояние дефициту воды, токсическому действию избытка ионов, развитию осмотического и окислительного стрессов (Dajic, 2006). Принято считать, что галофиты в отличие от гликофитов способны контролировать поступление солей, поддерживать осмотический баланс и транспорт воды в клетках, более эффективно обезвреживать свободные радикалы (Балнокин и др., 2005; Labudda, 2013). Высокое осмотическое давление клеточного сока галофитов создается и поддерживается за счет большой интенсивности фотосинтеза и накопления растворимых метаболитов. Универсальные компоненты, позволяющие стабилизировать осмотический потенциал растений, – аминокислоты (АК), бетаиновые соединения, растворимые сахара (Франко, Мелоф, 2000; Heuer, 2003), а универсальные антиокисиданты – фенольные соединения (Ksouri et al., 2012).
Эффективность механизмов, защищающих от избыткa соли, во многом связана с состоянием мембран (Parida, Das, 2005). Структурные компоненты матрикса мембран – липиды, обеспечивающие функциональность белковых комплексов. Установлено, что изменение соотношения ненасыщенных и насыщенных жирных кислот (ННЖК/НЖК) (Wu et al., 2005), фосфолипидов (ФЛ) и стеринов (СТ) (Mansour et al., 2002), индивидуальных классов гликолипидов (ГЛ) (Sui et al., 2010) важно для солеустойчивости растений. Перекисное окисление липидов (ПОЛ), индуцированное образованием активных форм кислорода (АФК), – одна из ранних ответных реакций растений на действие повреждающих факторов, включая засоление, а содержание малонового дипальдегида (МДА) – интегральная характеристика соотношения процессов анаболизма и катаболизма биополимеров (Тарчевский, 2001).
Большинство растений рода Artemisia относятся к гликогалофитам и занимают промежуточное положение между истинными галофитами (эугалофитами) и гликофитами (Flowers, Colmer, 2008). Особенность гликогалофитов заключается в их способности ограничивать поступление солей за счет низкой проницаемости мембран клеток корней для неорганических ионов. Это означает, что эти растения могут существенно отличаться как от галофитов, так и от гликофитов по конститутивному или стрессиндуцируемому уровню известных адаптивных реакций. Следует отметить, что при сравнительных исследованиях солеустойчивости растений, как правило, используются виды из разных таксонов или с разными типами галофильности. Изучение филогенетически родственных видов позволяет получить более объективную характеристику механизмов, обеспечивающих успешное произрастание растений на засоленных почвах (Ishikawa, Kachi, 2000).
Цель работы – исследование влияния засоленных почв на функциональное состояние трех видов рода Artemisia с одинаковым типом накопления солей в условиях Приэльтонья, а также определение водного статуса, содержания макроэлементов, фотосинтетических пигментов, липидного и антиоксидантного профиля.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования – многолетние полукустарники Artemisia santonica L., A. pauciflora Web., A. lerchiana Dumort. (Asteraceae Dumort., Asteroideae, Artemideae Cass.). Растительный материал отбирали в середине дня в июне 2013 г. Для анализов использовали листья 15–20 растений, собранных на экспериментальных площадках размером 20 × 20 м в пределах одного фитоценоза. Из объединенной биомассы составляли 3–4 независимых биологических пробы с соответствующей навеской для каждого анализа (0.5–2 г сырой массы). Одновременно отбирали образцы почвы в корнеобитаемой среде на глубине 15–20 см для определения влажности и солености. Анализ водной вытяжки из 100 г почвы проводили в соответствии с рекомендациями (Аринушкина, 1970).
Содержание ионов определяли в сухом размолотом материале после минерализации проб (Методические…, 2005) с использованием метода оптической эмиссионной спектроскопии с индуктивно связанной плазмой на приборе SPECTRO CIROS-ССD (США).
Оводненность тканей рассчитывали после высушивания образцов до постоянной массы и выражали в процентах от сырой массы (% сыр. м.). Содержание пигментов определяли в ацетоновой вытяжке (90%) на УФ-спектрофотометре ПЭ-3000 (Россия) при λ = 662, 645 и 470 нм. Концентрации хлорофиллов (Хл) а, b и каротиноидов (Кар), доли Хл в светособирающем комплексе (ССК) рассчитывали методом Лихтенталера (Lichtenthaler, 1987).
Экстракцию, разделение и анализ липидов осуществляли так же, как описано ранее (Rozentsvet et al., 2014). Суммарное содержание липидов (СЛ) рассчитывали как сумму проанализированных отдельно нейтральных липидов (НЛ), ГЛ и ФЛ. Интенсивность ПОЛ определяли по содержанию МДА после реакции с тиобарбитуровой кислотой (ТБК) с помощью спектрофотометра ПЭ-3000 УФ (Лукаткин, Голованова, 1988).
Содержание и состав растворимой фракции низкомолекулярных сахаров определяли методом ВЭЖХ (Хроматография…, 1986) с модификациями (Гляд, 2002). Суммарное содержание растворимых фенольных соединений определяли спектрофотометрически с использованием реактива Фолина–Дениса (ISO) 14502-1, оптическую плотность измеряли при λ = 725 нм (Методы…, 1972). При построении градуировочной зависимости в качестве стандарта применяли галловую кислоту. Содержание фенолов выражали в эквивалентах галловой кислоты в пересчете на единицу сухой массы (ед. сух. м.) растительного материала. Содержание флавоноидов определяли спектрофотометрически при λ = 510 нм (Pekal, Pyrzynska, 2014) с использованием в качестве стандарта катехина. Содержание флавоноидов выражали в эквивалентах катехина на ед. сух. м.
Суммарное содержание и состав АК определяли в воздушно-сухом материале после гидролиза навески в 6Н НCl при 105°С в течение 24 ч на анализаторе Т-339 (Чехия), свободные АК – в лиофильно-высушенном материале после извлечения их 70%-ным этанолом на анализаторе ААА-400 (Чехия) в системе литиевых буферов.
Анализ каждого компонента проводили трижды в каждой биологической пробе. Статистическая обработка данных была выполнена с использованием программ Microsoft Excel 2010. Данные в таблицах и на рисунках представлены как среднее арифметическое со стандартной ошибкой.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследованные растения произрастали в условиях, различающихся по степени засоления почвы и режиму увлажнения (табл. 1). Для растений A. santonica влажность и соленость почвы были в 3 раза выше таковых в местах произрастания A. pauciflora и A. lerchiana. Исследованные виды полыней отличались по содержанию воды и накоплению ионов в надземной части. Листья A. santonica были более оводнены по сравнению с листьями A. pauciflora и A. lerchiana и характеризовались более высокой концентрацией Na+, в то время как по содержанию Ca+2 и K+ виды различались незначительно (табл. 2). Соответственно изменялось отношение К+ : Na+, которое составляло для A. pauciflora и A. lerchiana ~3, а для A. santonica ~1. Наблюдается прямая корреляция между аккумуляцией Na+ в тканях и соленостью почвы. Кроме того, содержание азота и фосфора в листьях A. santonica было на 20–30% выше, чем в листьях других видов.
Таблица 1.
Характеристика почвы в местах произрастания трех видов Artemisia
| Вид | Тип почвы | Влажность, % | Соленость, мг/мл | рН |
|---|---|---|---|---|
| A. lerchiana | Солонцы | 9 | 0.31 | 8.4 |
| A. pauciflora | Солонцы | 9 | 0.31 | 8.4 |
| A. santonica | Солончаки | 26.6 | 0.92 | 8.8 |
Таблица 2.
Содержание воды (% сырой массы) и главных макроэлементов (мг/г сухой массы) в листьях трех видов Artemisia
| Элемент | A. lerchiana | A. pauciflora | A. santonica |
|---|---|---|---|
| Н2О | 55.2 ± 5.5 | 54 ± 5.4 | 75.2 ± 7.5 |
| Ca+2 | 5.6 ± 1.7 | 5.2 ± 1.6 | 6.8 ± 2 |
| N | 19 ± 3 | 23 ± 4 | 28 ± 1.9 |
| C | 388 ± 12 | 424 ± 14 | 426 ± 14 |
| P | 1.9 ± 0.6 | 1.9 ± 0.6 | 2.4 ± 0.7 |
| K+ | 11 ± 4 | 11 ± 4 | 13.5 ± 4.8 |
| Na+ | 3.9 ± 1.6 | 3.5 ± 1.4 | 35 ± 14 |
| К+ : Na+ | 2.8 | 3.1 | 0.4 |
Степень почвенного засоления и увлажнения оказывала влияние на пигментный комплекс растений – главный показатель активности фотосинтетического аппарата. Содержание пигментов в листьях исследованных видов варьировало от 2.7 до 4.9 мг/г сух. м. (табл. 3). Для A. pauciflora и A. lerchiana, произрастающих на почвах с меньшим содержанием воды и соли, отмечалось достоверно более низкое накопление пигментов, в основном за счет Хл.
Таблица 3.
Состав фотосинтетических пигментов в листьях трех видов Artemisia (мг/г сухой массы)
| Состав пигментов | A. lerchiana | A. pauciflora | A. santonica |
|---|---|---|---|
| Хл а | 2.2 ± 0.3 | 2 ± 0.2 | 3.6 ± 0.6 |
| Хл b | 0.7 ± 0.2 | 0.6 ± 0.1 | 1.2 ± 0.4 |
| (Σ Хл а + Хл b) | 2.9 ± 0.4 | 2.6 ± 0.3 | 4.8 ± 0.5 |
| Кар | 0.7 ± 0.1 | 0.7 ± 0.3 | 0.8 ± 0.2 |
| Хл а/b | 3 ± 0.4 | 3.1 ± 0.4 | 2.9 ± 0.1 |
| Хл/Кар | 3.8 ± 0.3 | 3.6 ± 0.2 | 5.6 ± 0.4 |
| ССК, % | 55.4 | 54.2 | 56.6 |
Примечание. Значения представлены как среднее арифметическое ± стандартная ошибка (n = 3, где n – число биологических проб); ± – границы интервала абсолютной погрешности при р = 0.95. Обозначения: Кар – каротиноиды, Хл – хлорофилл, ССК – светособирающий комплекс. Относительное содержание [%] Хл в ССК рассчитано по формуле ССК = (1.2 Хл b + + Хл b)/∑(Хл a + Хл b).
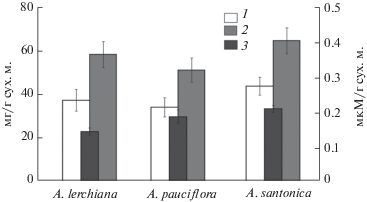
Один из первых ответов клетки на воздействия стрессовых абиотических факторов связывают с процессами ПОЛ. Анализ содержания МДА – конечного продукта ПОЛ – показал, что в листьях A. santonica его концентрация в 1.2–1.4 раза выше, чем в листьях других видов (рис. 1). При этом содержание суммарных и мембранных липидов, рассчитанное как сумма ГЛ, ФЛ и СТ, у этого вида было также выше в среднем в 1.2 раза. По-видимому, поступление Na+ в листья A. santonica индуцирует образование АФК и, как следствие, инициирует активность липопероксидации.
Рис. 1.
Содержание липидов и малонового диальдегида (МДА) в листьях трех видов Artemisia. 1 – мембранные липиды; 2 – суммарные липиды; 3 – МДА; ось ординат слева – содержание липидов, справа – содержание МДА; ось абсцисс – виды растений.
В клетках растений окислительным превращениям подвергаются ННЖК полярных липидов. Анализ липидного профиля растений показал, что полярные липиды включали в себя моно- и дигалактозилдиацилглицерины (МГДГ и ДГДГ соответственно), сульфохиновозилдиацилглицерин (СХДГ), фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилглицерин (ФГ), фосфатидилинозитол (ФИ). Фосфатидная кислота и дифосфатидилглицерин были обнаружены в следовых количествах. НЛ, кроме СТ, включали в себя три- и диацилглицерины (ТАГ и ДАГ), свободные жирные кислоты (СЖК), воски (В) и спирты (СП) (рис. 2а–в). В составе ГЛ – главных структурных компонентов тилакоидных мембран – у A. santonica доминировал МГДГ, у других видов были отмечены более высокие количества ДГДГ.
Рис. 2.
Состав липидов и жирных кислот (ЖК) в листьях Artemisia lerchiana (1), A. pauciflora (2) и A. santonica (3): данные представлены как среднее арифметическое значение ± ошибка средней (n = 3, где n – число биологических проб). а – гликолипиды: МГДГ – моногалактозилдиацилглицерин, ДГДГ – дигалактозилдиацилглицерин, СХДГ – сульфохиновозилдиацилглицерин; б – ЖК гликолипидов; в – фосфолипиды: ФХ – фосфатидилхолин, ФЭ – фосфатидилэтаноламин, ФГ– фосфатидилглицерин, ФИ – фосфатидилинозитол; г – ЖК фосфолипидов; д – нейтральные липиды: В – воски, ТАГ – триацилглицерины, СП – спирты, СТ – стерины, ДАГ – диацилглицерины; е – ЖК нейтральных липидов; 16:0 – пальмитиновая, 18:0 – стеариновая, 18:1n9 – олеиновая, 18:2n6 – линолевая, 18:3n3 – линоленовая кислоты.
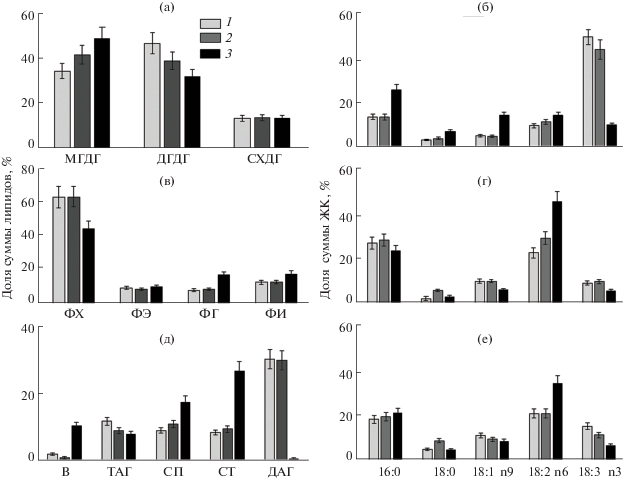
Фосфолипидами образуются в основном мембраны плазмалеммы и нефотосинтезирующих эндомембран. Состав липидов в этих мембранах также различался у исследованных видов, особенно по отношению к ФХ. Вклад ФХ в пул ФЛ у A. lerchiana и A. pauciflora был более высоким (67.5%) по сравнению с таковым у A. santonica (47.6%). У A. santonica отмечено более высокое содержание ФГ – липида, входящего в состав мембран тилакоидов. В составе НЛ в листьях A. santonica было найдено в 2–3 раза большее содержание СТ по сравнению с таковым у A. pauciflora и A. lerchiana, но следовые количества ДАГ. Кроме того, у A. santonica отмечено существенно большее (10‑кратное) содержание восков. Другие компоненты НЛ были примерно равны у всех исследованных видов.
Состав ЖК полярных липидов исследовали отдельно в каждой фракции (рис. 2г–е). Большую часть составляли ЖК с длиной цепи 16–18 атомов углерода. Наибольшее количество пальмитиновой кислоты (16:0) было сконцентрировано во фракции ФЛ. Доля ННЖК во всех фракциях липидов составляла 17–83% суммы ЖК. Наиболее ненасыщенными были фракции ГЛ, ННЖК/НЖК = 2.9–4.8. В других фракциях этот показатель был ниже (1–1.7). Во фракции ГЛ в листьях A. santonica преобладала олеиновая кислота (18:1n9), у растений A. pauciflora и A. lerchiana – линоленовая кислота (18:3n3). Фракции ФЛ и НЛ у A. santonica отличались более высоким содержанием линолевой кислоты (18:2n6).
Данные о составе компонентов, позволяющих осуществлять антиоксидантную защиту и стабилизировать осмотический потенциал растений, представлены на рис. 3. Суммарное содержание фенолов у исследованных растений варьировало в широких пределах (17.3–51.7 мг/г сух. м.) (рис. 3а). Доля флавоноидов в листьях составляла 63–70%. В листьях A. santonica суммарное содержание фенолов было в 2.5, а флавоноидов – в 2 раза выше такового у A. pauciflora и A. lerchiana.
Рис. 3.
Содержание фенольных соединений и флавоноидов (а), моно- и дисахаров (б) в листьях трех видов Artemisia. 1 – сумма фенолов в перерасчете на галловую кислоту, 2 – сумма флавоноидов в перерасчете на катехин, 3– моносахара, 4 – дисахара.
Углеводы, синтезируемые растениями в процессе фотосинтеза, являются исходным материалом для пластического и энергетического обмена. Содержание растворимых углеводов у исследованных видов варьировало от 18.8 до 23.9 мг/г сух. м. Моносахара представлены в основном фруктозой и глюкозой, дисахара – сахарозой и мальтозой. Сумма растворимых углеводов была достоверно выше у растений A. santonica (рис. 3б). Высокая концентрация растворимых углеводов в листьях A. santonica приводит к увеличению осмотического давления клеточного сока, тем самым способствуя выживаемости вида в условиях сильного засоления.
Анализ состава АК листьев растений показал, что содержание белковых АК варьировало от 66 до 113 мг/г сух. м. (табл. 4). В составе свободных АК идентифицировано 14 компонентов, из них доминируют 5 соединений, среднее содержание которых превышает 1%. Это так называемые стрессовые АК – пролин, аланин, γ-аминомасляная кислота, а также валин и аргинин. При этом содержание белковых АК в растениях A. santonica более чем в 1.5 раза выше такового у A. pauciflora и A. lerchiana при низкой концентрации свободных АК. Доля пролина в пуле свободных АК гликогалофитов составляет 75–81%. Концентрация пролина в расчете на сухую массу у A. santonica в 1.5 раза ниже таковой у A. pauciflora и A. lerchiana, однако доля его в пуле свободных АК больше.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как показали наши исследования, условия произрастания определяют физиологическое состояние растений. Листья A. santonica были более оводнены по сравнению с листьями A. pauciflora и A. lerchiana, накапливали существенно больше Na+. При более высоком накоплении Na+ в листьях A. santonica отношение Na+ : К+ было более низким, чем у A. pauciflora и A. lerchiana. Вероятно, один из механизмов адаптации к высоким концентрациям солей у A. pauciflora и A. lerchiana – поддержание внутриклеточного содержания К+ на определенном уровне, что позволяет видам выдерживать засоление.
По содержанию Хл а и Хл b растения аридной территории Приэльтонья не отличались от галофитов прибрежной зоны приливных арктических морей, подвергавшихся ежедневному заливанию (3.9–5.1 мг/г сух. м.) (Марковская и др., 2012). Доля Хл, локализованного в ССК, у исследованных видов составляла 54–56%, что сравнимо с ССК травянистых растений на незасоленных почвах (Dymova, Fiedor, 2014). В то же время растения A. santonica имеют более высокие значения содержания Хл по сравнению со своими филогенетическими родственниками, что свидетельствует о высокой функциональной активности фотосинтетического аппарата. Следовательно, значительное варьирование содержания пигментов у растений разных экотопов в определенной степени определяется физико-химическими свойствами почвенного субстрата.
Почвенные условия отразились и на составе макроэлементов в надземных органах растений. Более высокое содержание N и P, обнаруженное в листьях A. santonica, может свидетельствовать об усиленном первичном метаболизме, направленном на синтез белков и липидов. Повышенное содержание липидов в растениях данного вида подтверждает данное предположение (рис. 1). Однако у этого же вида наблюдается и усиление вторичного метаболизма, что проявляется в биосинтезе флавоноидов. Полагают, что их содержание может служить показателем стрессированного состояния растения (Франко, Мелоф, 2000).
Особое место среди показателей стрессового состояния растений занимает инициация ПОЛ. Отмечено, что продукты ПОЛ могут рассматриваться как вторичные посредники, вовлеченные в трансдукцию стрессового сигнала в геном клетки (Kaur, Gupta, 2005), участвуют в модификации состояния ионных каналов, в том числе кальцевых (Droge, 2002). Повышенная липопероксидация, отмеченная в листьях A. santonica, произрастающего на более засоленных местах, по-видимому, необходима для нормальной жизнедеятельности вида. Виды A. pauciflora и A. lerchiana, произрастающие в условиях меньшей солености и влажности, накапливают в 2.5–3 раза меньше фенолов, чем A. santonica, при практически равной доле флавоноидов. Высокое содержание фенолов у A. santonica коррелировало со значительным количеством Na+ в надземной массе, т.е. наблюдается NaCl-зависимое накопление низкомолекулярных фенольных соединений. По-видимому, антирадикальная защита у растений этого вида эффективнее осуществляется с участием фенольных соединений.
Принято считать, что плазматическая мембрана клеток корня гликогалофитов малопроницаема для солей (Mansour et al., 2002). Однако, как показывают наши результаты, определенная часть Na+ может поступать в надземные органы растений. Повреждающий эффект избыточной концентрации солей объясняется как осмотическими эффектами, так и специфическим влиянием отдельных ионов. Высокая осмотическая концентрация в листьях A. santonica создается за счет интенсивного фотосинтеза и накопления растворимых углеводов, способствуя выживаемости вида в условиях сильного засоления.
Свободные АК представляют собой азотные соединения, активно включающиеся в метаболические процессы и реагирующие на изменения условий окружающей среды. Анализ данных показал, что в отличие от количества белковых АК содержание свободных АК у растений A. santonica значительно ниже, чем у A. pauciflora и A. lerchiana (табл. 4). Таким образом, этот тип защитных механизмов в большей степени характерен для растений A. pauciflora и A. lerchiana. Несмотря на разницу в абсолютном содержании стрессовых АК, доли их в пуле свободных АК различаются незначительно.
Для поддержания водного гомеостаза между основными внутриклеточными компартментами – цитоплазмой и вакуолью – в условиях засоления важную роль играет пролин. Известно, что пролин реализует защитное действие, выступая в качестве “химического” шаперона (Yan, Zhou, 2006), стабилизируя функциональные мембранные комплексы, поддерживая нативную конформацию макромолекул, а также вовлекаясь в тушение АФК (Heuer, 2003). По нашим данным, весьма вероятно, что исследуемые растения предотвращают деградацию Хл при засолении за счет интенсивной аккумуляции пролина (табл. 4).
Анализ липидного профиля показал, что, несмотря на присутствие Na+ в тканях растений, состав ГЛ у A. santonica был наиболее близок к классическому составу с доминированием МГДГ. У других видов отмечены более высокие или равные количества ДГДГ по сравнению с МГДГ. Известно, что ДГДГ – компонент, участвующий в упаковке гран с помощью водородных связей между полярными головками соседних бислоев (Deme et al., 2014). На основании полученных данных можно предполагать, что разница в соотношении индивидуальных ГЛ свидетельствует о различиях в ультраструктуре гран (длина и плотность упаковки), что может отразиться на эффективности фотосинтеза. Фракция ГЛ у A. santonica отличается и по составу ЖК (рис. 3г). ЖК мембранных липидов – основные мишени действия АФК, а хлоропласт представляет собой одно из главных мест их образования. В этой связи более низкое содержание линоленовой кислоты 18:3n3 и высокое содержание МДА (рис. 1) можно рассматривать как результат усиленного процесса ПОЛ в данном виде растений.
В отношении ФЛ известно, что с увеличением солености повышается отношение ФХ/ФЭ (Sui et al., 2010). Более высокое содержание ФХ расценивается как протекторный механизм, направленный на предотвращение нарушения целостности мембраны (Wu et al., 2005). Этот механизм в большей степени проявляется у растений A. pauciflora и A. lerchiana.
Особый интерес представляют выявленные различия в составе НЛ, в частности в содержании СТ и ДАГ. Известно, что почти все фитостерины – предшественники брассиностероидов – растительных гормонов, непосредственно влияющих на структуру и эффективность функционирования тилакоидов (Krumova et al., 2013). Было показано, что снижение коэффициента полезного действия фотосинтеза в результате окислительного стресса может быть компенсировано путем обработки брассиностероидами. Повышенное содержание СТ у A. santonica хорошо согласуется с данными о содержании пигментов, ответственных за эффективность фотосинтеза. Можно отметить, что содержание другого резервного липида – ДАГ – у A. pauciflora и A. lerchiana существенно выше, чем у A. santonica. Поскольку ДАГ – предшественник синтеза липидов, входящих в мембраны тилакоидов (МГДГ, ДГДГ, СХДГ и ФГ), то эти различия могут быть связаны со скоростью обмена липидов.
ЗАКЛЮЧЕНИЕ
Исследование влияния засоленных почв на функциональное состояние гликогалофитов рода Artemisia показало, что растения A. santonica, произрастающие в условиях сильного засоления, осуществляют осморегуляцию с помощью накопления в листьях Na+ и растворимых сахаров. Увеличение содержания Na+ способствовало возрастанию фенолов и флавоноидов, а также увеличению активности ПОЛ. Виды A. pauciflora, A. lerchiana, произрастающие на менее засоленных почвах, характеризовались накоплением значительного количества свободных, в том числе стрессовых, АК. На уровне структурных компонентов мембран для растений A. pauciflora и A. lerchiana обнаружено более высокое содержание ДГДГ по сравнению с содержанием МГДГ и триеновых ЖК в составе липидов, отвечающих за структуру тилакоидов, а также повышенное содержание ФХ в составе нефотосинтезирующих мембран. Следовательно, несмотря на филогенетическое родство, механизмы адаптации к высоким концентрациям солей у этих видов различаются. Различное сочетание протекторных механизмов свидетельствует о высокой функциональной активности физиолого-биохимических процессов. Занимая сходные засоленные экотопы в условиях Приэльтонья (солонцы, солончаки и солонцеватые почвы), исследованные виды в силу различий механизмов, позволяющих растениям реализовать их солеустойчивость в естественных условиях произрастания, существенно различаются и по своим экоценотическим позициям и экологическим нишам.
Работа выполнена при финансовой поддержке РФФИ (гранты 12-04-01110а, 14-04-1018914-к “Механизмы регуляции устойчивости растений в сообществах аридных экосистем”) и частично в рамках темы ГР АААА-А18-118012290132-0 “Фототрофные организмы как компонент живой природы и индикатор климатических изменений”.
Список литературы
Аринушкина Е.В. Руководство по химическому анализу почв. М.: Изд-во МГУ, 1970. 487 с.
Балнокин Ю.В., Мясоедов Н.А., Шамсутдинов З.Ш., Шамсутдинов Н.З. Роль Na+ и K+ в поддержании оводненности тканей органов у галофитов сем. Chenopodiaceae различных экологических групп // Физиология растений. 2005. № 6. С. 882–890.
Водно-болотные угодья Приэльтонья. Волгоград: Региональный центр по изучению и сохранению биоразнообразия, 2005. 27 с.
Гляд В.М. Определение моно-, ди- и олигосахаридов в одной растительной пробе методом высокоэффективной жидкостной хроматографии // Физиология растений. 2002. № 3. С. 311–316.
Лукаткин А.С., Голованова В.С. Интенсивность перекисного окисления липидов в охлажденных листьях теплолюбивых растений // Физиология растений. 1988. № 4. С. 773–780.
Лысенко Т.М. Характеристика растительного покрова солонцовых почв особо охраняемых природных территорий – озер Эльтон и Баскунчак // Вектор науки Тольяттинского гос. ун-та, 2013. № 2. С. 47–53.
Марковская Е.Ф., Сергиенко Л.А., Стародубцева А.А. Пигментный аппарат некоторых видов высших растений прибрежной зоны приливных арктических морей // Фундамен. исследования. 2012. № 1. С. 160–163.
Методические указания по проведению разрушения органических веществ в природных, питьевых, сточных водах и пищевых продуктах на микроволновой системе “Минотавр-2". СПб.: Люмекс, 2005. 20 с.
Методы биохимического исследования растений / Под ред. Ермакова А.И. Л.: Колос, 1972. 456 с.
Панкова Е.И. Засоление орошаемых почв среднеазиатского региона: старые и новые проблемы // Арид. экосистемы. 2016. № 4. С. 21–29.
Тарчевский И.А. Метаболизм растений при стрессе. Казань: Фэн, 2001. 448 с.
Франко О., Мелоф Р. Осмопротекторы: ответ растений на осмотический стресс // Физиология растений. 2000. № 1. С. 152–159.
Хроматография: Практическое приложение метода. Ч. 2 / Под ред. Хефтман Э. М.: Мир, 1986. 336 с.
Dajic Z. Salt stress. Eds Madhava Rao K.V., Raghavendra A.S., Janardhan Reddy K. // Physiology and molecular biology of stress tolerance in plant. Netherlands: Springer, 2006. P. 41–101.
Deme B., Cataye C., Block M.A., Marechal E., Jouhet J. Contribution of galactoglycerolipids to the 3-dimensional architecture of thylakoids // FASEB J. Res. Comm. 2014. V. 28. P. 3373–3383.
Droge D. Free radical in physiological control of cell function // Physiol. Rev. 2002. V. 82. P. 47–95.
Dymova O., Fiedor L. Chlorophylls and their role in photosynthesis / Eds Golovko T.K., Gruszeski W.I., Prasad M.N.V., Strzalka K. Photosynthetic pigments – chemical structure, biological function and ecology. Syktyvkar: Komi Sci. Centre Ural Branch RAS, 2014. P. 140–160.
Flowers T.J., Colmer T.D. Salinity tolerance in halophytes // New Phytologist. 2008. V. 179. P. 945–95.
Heuer B. Influence of exogenous application of proline and glycinebetaine on growth of salt stressed tomato plants // Plant Sci. 2003. V. 165. P. 693–699.
Ishikawa S.-I., Kachi N. Differential salt tolerance of two Artemisia species growing in contrasting coastal habitats // Ecol. Res. 2000. V. 15. P. 241–247.
Kaur N., Gupta A.K. Signal transduction pathways under abiotic stresses in plant // Curr. Sci. 2005. V. 88. № 11. P. 1771–1780.
Krumova S., Zhiponova M., Dankov K., Velikova V., Balashev K., Andreeva T., Russinova E., Taneva S. Brassinosteroids regulate the thylakoid membrane architecture and the photosystem II function // J. Photochem. Photobiol. B: Biol. 2013. V. 126. P. 97–104.
Ksouri R., Smaoui A., Isoda H., Abdelly C. Utilization of halophyte species as new sources of bioactive substances // J. Arid Land Stud. 2012. V. 22. P. 41–44.
Labudda M. Lipid peroxidation as a biochemical marker for oxidative stress during drought. An effective tool for plant breeding. E-wydawnictwo, Poland. 2013. http:// www.e-wydawnictwo.eu/Document/DocumentPre-view/3342. P. 1–12.
Lichtenthaler H.K. Chlorophyll and carotinoids: pigments of photosyntethetic biomembranes // Meth. Enzimol. 1987. V. 48. P. 331–382.
Mansour M.M.F., Salama K.H.A., Al-Mutawa M.M., Abou Hadid A.F. Effect of NaCl and polyamines on plasma membrane lipids of wheat roots // Biol. Plantarum. 2002. V. 45. P. 235–239.
Munns R., Tester M. Mechanisms of salinity tolerance // Ann. Rev. Plant Biol. 2008. P. 651–681.
Parida A.K., Das A.B. Salt tolerance and salinity effects on plants: a review // Ecotoxic. Envir. Safety. 2005. V. 60. P. 324–349.
Pekal A., Pyrzynska K. Valuation of aluminium complexation reaction for flavonoid content assay // Food Analyt. Meth. 2014. V. 60. P. 324–349.
Rozentsvet O.A., Nesterov V.N., Bogdanova E.S. Membrane-forming lipids of wild halophytes growing under the conditions of Prieltonie of South Russia // Phytochemistry. 2014. V. 105. P. 37–42.
Sui N., Li M., Li K., Song J., Wang B.-S. Increase in unsaturated fatty acids in membrane lipids of Suaeda salsa L. enhances protection of photosystem II under high salinity // Photosynthetica. 2010. V. 48. P. 623–629.
Watson L.E., Bates P.L., Evans T.M., Unwin M.M., Estes J.R. Molecular phylogeny of Subtribe Artemisiinae (Asteraceae), including Artemisia and its allied and segregate genera // BMC Evol. Biol. 2002. V. 2. P. 1–12.
Wu J., Seliskar D.M., Gallagher J.L. The response of plasma membrane lipid composition in callus of the halophyte Spartina patens (Poaceae) to salinity stress // Am. J. Bot. 2005. V. 92. P. 852–858.
Yan S.H., Zhou H.M. Role of osmolytes as cheperones during the refolding of aminoacylase // Biochem. Cell Biol. 2006. V. 84. P. 30–38.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


