Известия РАН. Серия биологическая, 2019, № 4, стр. 419-428
Морфология и состав клеток периферической крови при спячке у летучих мышей (Chiroptera, Vespertilionidae) Северо-Запада России
Л. Б. Узенбаева 1, А. Г. Кижина 1, *, В. А. Илюха 1, В. В. Белкин 1, Е. А. Хижкин 1
1 Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
* E-mail: golubewa81@yandex.ru
Поступила в редакцию 30.10.2017
После доработки 19.06.2018
Принята к публикации 19.06.2018
Аннотация
Исследованы состав и морфология клеток периферической крови во время спячки у пяти видов отряда рукокрылых Chiroptera – водяной ночницы Myotis daubentonii, ночницы Брандта M. brandtii, усатой ночницы M. mystacinus, бурого ушана Plecotus auritus и северного кожанка Eptesicus nilssonii. Отмечено, что для этих видов характерны невысокий уровень лейкоцитов и преобладание в лейкоформуле нейтрофилов над лимфоцитами. Установлены межвидовые различия в морфологии нейтрофилов, общем количестве, абсолютном и относительном содержании отдельных типов лейкоцитов, а также в размерах площади поверхности эритроцитов. Обнаружено, что особенно отчетливо они выражены между редко встречающимися видами P. auritus и M. mystacinus и более распространенными видами M. daubentonii и M. brandtii, а также доминирующим видом E. nilssonii.
Изучение эколого-физиологических особенностей у летучих мышей – представителей многочисленного и процветающего отряда рукокрылых Chiroptera – имеет важное значение. Летучие мыши, обитающие в холодном и умеренном климате, зимуют, впадая в спячку, а в активном состоянии хорошо приспособлены к длительному и устойчивому полету. Повышенный интерес вызывает относительно высокая продолжительность жизни некоторых видов летучих мышей. По имеющимся в нашем распоряжении данным в среднем она в 3.5 раза больше, чем у нелетающих плацентарных млекопитающих соответствующего размера. Рекорд продолжительности жизни – 38 лет – зарегистрирован у самца Myotis brandtii (Wilkinson, South, 2002; Becker et al., 2013).
У зимоспящих млекопитающих при гипотермии обнаружено экстремальное снижение значений многих физиолого-биохимических параметров, и в частности температуры тела, потребления кислорода, метаболизма, частоты дыхания, ритма сердца, артериального давления, скорости кровотока. Кроме того, при спячке отмечено изменение иммунного статуса – уменьшение содержания лейкоцитов, комплемента, снижение фагоцитарной активности, ответа на липополисахариды (ЛПС), а также пролиферации лимфоцитов и продукции цитокинов и антител (Bouma et al., 2010a). Более того, предположено, что иммунная система влияет на гибернацию (Carey et al., 2003). Так как стратегия выживания при гибернации уникальна, она была предложена в качестве модели для изучения гомеостатических механизмов при низких температурах (Bouma et al., 2010a, 2010b).
Зимняя спячка описана у всех палеарктических и неоарктических видов Chiroptera (Экологическая…, 1979; Geiser, 2004). У летучих мышей, как и у других зимоспящих, зимой для минимизации ежедневных затрат энергии используется чередование продолжительных периодов гипотермии (96–97% времени спячки) и кратковременных (2–3% времени спячки) пробуждений (Ануфриев, 2008а). В торпидном состоянии они не принимают пищу, но для пополнения водного баланса слизывают воду. Это отличает летучих мышей, как от видов зимоспящих, которые довольствуются только метаболической водой, так и от тех, которые не обладают способностью накопления достаточных запасов жира и просыпаются для потребления воды и пищи (Экологическая…, 1979; Ben-Hamo et al., 2013).
Исследование особенностей патогенеза WNS (white-nose syndrome) и анализ причин высокой смертности у летучих мышей при этом заболевании привели к заключению, что изучение иммунитета у зимоспящих только начинается (Wibbelt et al., 2010; Frank et al., 2014). Насколько велика степень отличия иммунитета летучих мышей от иммунитета других видов млекопитающих, остается невыясненным (Stockmaier et al., 2015). Установлено, что в периферической крови у малой бурой ночницы Myotis lucifugus количество лейкоцитов и уровень IL-4 (интерлейкин-4) не изменяются на протяжении спячки, тогда как содержание иммуноглобулинов выше в середине гибернационного периода по сравнению с таковым в его начале и конце (Moore et al., 2013).
У некоторых видов летучих мышей при введении ЛПС отсутствуют лихорадка и лейкоцитоз (Stockmaier et al., 2015). Было предположено, что процессы воспаления у зимующей M. lucifugus при WNS не возникают вследствие сокращения содержания нейтрофилов, а возможно, и снижения синтеза одного из провоспалительных цитокинов – TNF (tumor necrosis factor) (Bouma et al., 2010a). Летучие мыши, как показало изучение факторов регуляции воспаления у большого бурого кожана Eptesicus fuscus, могут иметь уникальный механизм для подавления чрезмерной реакции организма на патоген. При этом у видов могли сформироваться различные стратегии или их комбинации для предотвращения усиления воспалительного ответа (Banerjee et al., 2017).
По некоторым данным основные причины смертности летучих мышей умеренной зоны – травматические повреждения и инфекционные болезни (Mühldorfer et al., 2011). Комплексными исследованиями, проведенными на 19 европейских видах в 2002–2009 гг., выявлено, что ~12% особей умерли в результате бактериальных, вирусных и паразитарных инфекций. Существует предположение, что риск их распространения возрастает с начала зимнего сезона в связи с увеличением контакта с другими особями, а в конце спячки может быть обусловлен ослаблением иммунитета и голоданием (Mühldorfer et al., 2011).
Гематологические параметры – в определенной мере “зеркало” физиологического состояния организма. Их можно использовать для оценки степени воздействия среды обитания и составления экологического портрета (Козинец и др., 2007). Поэтому целесообразно провести сравнительно-видовые исследования состава и морфологии клеток периферической крови у летучих мышей. В настоящее время сведения о биологии и физиологии летучих мышей, обитающих в условиях Северо-Западной России, немногочисленны. На зимовках в Карелии в подзоне средней тайги встречаются ночницы M. daubentonii, M. brandtii, M. mystacinus, а также Plecotus auritus и E. nilssonii (Белкин и др., 2015). Период гибернации продолжается >6 мес. – от начала октября до первой половины апреля. В сообществах летучих мышей как на зимовках, так и в период летней активности установлено абсолютное доминирование E. nilssonii. Виды, представляющие род Myotis, отличаются от P. auritus и особенно от E. nilssonii широким выбором микроукрытий, большей конгрегацией особей, узким диапазоном предпочитаемых микроклиматических условий зимовок.
Цель работы – изучение при спячке состава и морфологии клеток периферической крови у пяти видов летучих мышей сем. Vespertilionidae из родов Myotis (M. daubentonii, M. brandtii и M. mystacinus), Plecotus (P. auritus) и Eptesicus (E. nilssonii).
МАТЕРИАЛЫ И МЕТОДЫ
Выборочный сбор летучих мышей из искусственных подземных сооружений проведен в Республике Карелия (61–63° с.ш., 30–36° в.д.) по разрешениям Управления охотничьего хозяйства РК (№ 0002-2010, 0001-2011, 00008-2013, 00009-2015, 00011-2015, 00013-2017) с соблюдением международных принципов Хельсинской декларации о гуманном отношении к животным (Этическая…, 2005). Отлов животных, находящихся в спячке, проводили с начала октября до середины апреля. Были исследованы образцы крови 60 особей, из которых 10 относились к M. daubentonii (6 самок и 4 самца), 5 – к M. mystacinus (3 самки и 2 самца), 13 – к M. brandtii (7 самок и 6 самцов), 25 – к E. nilssonii (18 самок и 7 самцов) и 7 – к P. auritus (6 самок и 1 самец). Количественный и качественный объем выборок зависел от разнообразия и соотношения видов на зимовках (Белкин и др., 2015).
Летучих мышей перевозили в лабораторию в отдельных контейнерах при 5°С и относительной влажности воздуха 95% и через 24 ч забивали. Количество лейкоцитов определяли в камере Горяева, лейкоцитарную формулу – на мазках крови, окрашенных по Паппенгейму красителем-фиксатором Мая–Грюнвальда и красителем Романовского (MiniMed, Россия). Исследование проведено с помощью светового микроскопа Axioscop 40 (Carl Zeiss, Германия) с цветной цифровой видеокамерой (Pixera 150ES) и программным обеспечением “Видеотест”. Для подсчета лейкоцитарной формулы на мазках крови визуально определяли типы лейкоцитов, создавали базу их изображений и после сортировки осуществляли передачу данных в MS Excel. Абсолютное количество различных типов лейкоцитов вычисляли, исходя из общего и процентного их содержания. Площадь поверхности эритроцитов измеряли с помощью методики NCR (nuclear-cytoplasmic ratio), позволяющей определять параметры клеток и внутриклеточных структур. Проводили микроскопическую съемку 10 полей зрения препарата, в автоматическом режиме выделяли изображения эритроцитов, которые попали в кадр, и передавали измерения площади поверхности в MS Excel.
Полученные материалы были обработаны общепринятыми методами вариационной статистики. Оценку достоверности различий статистических показателей выборок проводили по критериям Стьюдента и Вилкоксона–Манна–Уитни в зависимости от размера групп и нормальности распределения. Работа выполнена с использованием научного оборудования Центра коллективного пользования ФИЦ “КарНЦ РАН”.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Данные о количестве и составе лейкоцитов, а также о размерах площади поверхности эритроцитов в периферической крови у пяти видов летучих мышей во время зимней спячки представлены в табл. 1 и на рис. 1–3.
Таблица 1.
Гематологические параметры у летучих мышей при спячке
| Показатель | Myotis daubentonii | M. mystacinus | M. brandtii | Eptesicus nilssonii | Plecotus auritus | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| самки | самцы | самки | самцы | самки | самцы | самки | самцы | самки | самцы | |
| Лейкоциты, 109/л | ||||||||||
| M | 3.37 | 5.43 | 1.02 | 1.48 | 3.4 | 2.05 | 3.34 | 3.38 | 4.02 | 2.7 |
| m | 0.52 | 0.88 | 0.39 | 0.33 | 1.12 | 0.77 | 0.56 | 0.82 | 0.82 | – |
| Нейтрофилы, 109/л | ||||||||||
| палочкоядерные | ||||||||||
| M | 0.14 | 0.06 | 0.06 | 0.04 | 0.2 | 0.09 | 0.21 | 0.04 | 0.19 | 0.08 |
| m | 0.03 | 0.04 | 0.05 | 0.01 | 0.1 | 0.05 | 0.06 | 0.02 | 0.09 | – |
| сегментоядерные | ||||||||||
| M | 1.88 | 3.01 | 0.52 | 0.76 | 1.7 | 1.43 | 1.77 | 2.13 | 3.09 | 1.98 |
| m | 0.33 | 0.46 | 0.2 | 0.03 | 0.52 | 0.68 | 0.32 | 0.82 | 0.59 | – |
| Лимфоциты, 109/л | ||||||||||
| M | 1.07 | 1.95 | 0.37 | 0.48 | 1.68 | 0.41 | 1.04 | 0.97 | 0.62 | 0.3 |
| m | 0.2 | 0.67 | 0.13 | 0.13 | 0.62 | 0.11 | 0.29 | 0.12 | 0.41 | – |
| Моноциты, 109/л | ||||||||||
| M | 0.18 | 0.26 | 0.06 | 0.13 | 0.23 | 0.09 | 0.23 | 0.13 | 0.1 | 0.32 |
| m | 0.05 | 0.1 | 0.04 | 0.09 | 0.08 | 0.04 | 0.05 | 0.02 | 0.05 | – |
| Эозинофилы, 109/л | ||||||||||
| M | 0.01 | 0.04 | 0.01 | 0.05 | 0.06 | 0.01 | 0.02 | 0.02 | 0 | 0.01 |
| m | 0.01 | 0.03 | 0.01 | 0.05 | 0.06 | 0.01 | 0.01 | 0.01 | 0 | – |
| Базофилы, 109/л | ||||||||||
| M | 0.09 | 0.03 | 0.003 | 0.02 | 0 | 0.01 | 0.07 | 0.09 | 0 | 0 |
| m | 0.03 | 0.03 | 0.003 | 0.01 | 0 | 0 | 0.03 | 0.02 | 0 | – |
| Нейтрофилы сегментоядерные/ лимфоциты, усл.ед. | ||||||||||
| M | 1.76 | 2.73 | 1.1 | 1.69 | 1.49 | 3.56 | 4.75 | 2.74 | 14.75 | 6.68 |
| m | 0.22 | 1.13 | 0.31 | 0.42 | 0.38 | 1.17 | 2.21 | 1.24 | 6.75 | – |
| Площадь поверхности эритроцита, мкм2 | ||||||||||
| M | 28.74 | 28.16* | 27.47 | 25.46 | 26.67 | 25.43* | 25.51 | 25.43* | 23.48 | 21.62 |
| m | 0.05 | 0.08 | 0.07 | 0.07 | 0.05 | 0.05 | 0.03 | 0.05 | 0.04 | 0.09 |
Рис. 1.
Эритроциты Plecotus auritus (а), Myotis daubentonii (б), M. mystacinus (в) и Eptesicus nilssonii (г); палочкоядерные нейтрофилы M. daubentonii (д), M. brandtii (е) и E. nilssonii (ж); сегментоядерные нейтрофилы M. daubentonii (з), P. auritus (и) и M. mystacinus (к); эозинофилы M. daubentonii (л), M. mystacinus (м) и E. nilssonii (н); базофилы M. daubentonii (о) и E. nilssonii (п); лимфоциты M. daubentonii (р, т) и E. nilssonii (с); моноциты M. daubentonii (у) и E. nilssonii (ф). Масштаб: 10 мкм.
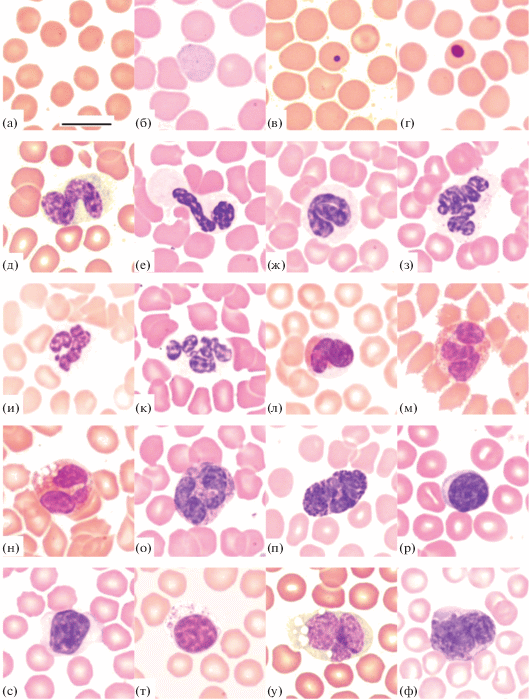
Рис. 2.
Распределение эритроцитов по площади поверхности у самок и самцов различных видов летучих мышей при спячке. 1 – Myotis daubentonii, 2 – M. mystacinus, 3 – M. brandtii, 4 – Eptesicus nilssonii, 5 – Plecotus auritus.
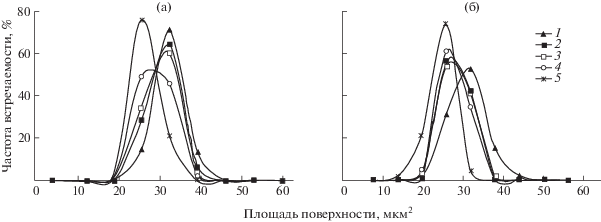
Рис. 3.
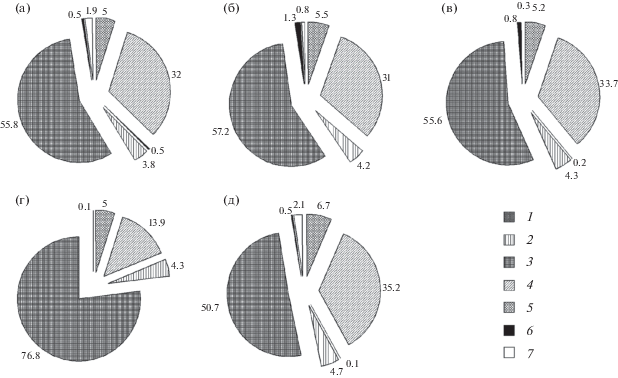
Относительное содержание различных типов лейкоцитов периферической крови при спячке у летучих мышей. а – Myotis daubentonii, б – M. mystacinus, в – M. brandtii, г – Plecotus auritus, д – Eptesicus nilssonii. 1 – юные нейтрофилы, 2 – палочкоядерные нейтрофилы, 3 – сегментоядерные нейтрофилы, 4 – лимфоциты, 5 – моноциты, 6 – эозинофилы, 7 – базофилы.
На светомикроскопическом уровне форменные элементы крови у летучих мышей имеют свойственную большинству видов млекопитающих морфологию (рис. 1). Эритроциты в основном принадлежат к зрелым формам (рис. 1а), а полихроматофильные (рис. 1б) и с тельцами Жолли (рис. 1в), а также нормобласты (рис. 1г) встречаются очень редко. Из проведенного морфометрического анализа следует, что виды различаются по размерам площади поверхности эритроцитов (табл. 1, рис. 2). Наибольшая площадь поверхности обнаружена у M. daubentonii, наименьшая – у P. auritus. Между самками и самцами M. daubentonii, M. brandtii и E. nilssonii установлены статистически значимые отличия: у самок площадь поверхности эритроцитов больше, чем у самцов. Для M. mystacinus и P. auritus достоверность различий не удалось подтвердить в связи с недостаточным числом самцов для проведения статистического анализа.
Палочкоядерные нейтрофилы встречаются редко (рис. 1д–1ж). В сегментоядерных нейтрофилах иногда наблюдаются базофилия цитоплазмы и полисегментированные ядра (рис. 1з), а у самок – половой хроматин (рис. 1и). Доли ядра в сегментоядерных нейтрофилах могут быть соединены между собой очень тонкими филаментами гетерохроматина (рис. 1к).
В морфологии нейтрофилов летучих мышей, несмотря на общие черты, можно отметить межвидовые различия. Они касаются размера цитоплазматической зернистости, ядерно-цитоплазматического соотношения и конфигурации клеточной поверхности. Для M. daubentonii характерны крупные нейтрофилы с отчетливо видимой зернистостью (рис. 1з), а у E. nilssonii она менее заметна (рис. 1ж). У M. brandtii (рис. 1е), M. mystacinus (рис. 1к) и P. auritus (рис. 1и) редкие и пылевидные гранулы просматриваются не во всех нейтрофилах. У видов из рода Myotis нейтрофилы, как правило, имеют обильную цитоплазму и эксцентрично расположенное ядро, а у M. brandtii – довольно часто эллипсовидную или неправильную форму и цитоплазматические выросты (рис. 1е).
В эозинофилах присутствуют мелкие гранулы розовато-красного оттенка (рис. 1л–1н), в них часто просматриваются участки дегранулированной цитоплазмы (рис. 1н). Для базофилов характерны крупные светло- и темно-фиолетовые гранулы (рис. 1о, 1п), особенно многочисленные и интенсивно окрашенные у E. nilssonii (рис. 1п). Лимфоциты мелкие или средние (рис. 1р–1т), очень редко с азурофильными гранулами (рис. 1т). Моноциты – клетки крупных размеров, иногда с вакуолями, которые в норме обычно не встречаются. Ядро в моноцитах, как и у других видов млекопитающих, полиморфно (рис. 1у, 1ф).
Количество лейкоцитов в крови у исследованных видов низкое, в лейкоформуле преобладают нейтрофилы (табл. 1, рис. 3). Относительное содержание моноцитов находится на достаточно высоком уровне, базофилы и эозинофилы представляют собой самую малочисленную популяцию. Существенных половых различий в количестве лейкоцитов и в содержании отдельных их типов не выявлено. У P. auritus по сравнению с остальным видами установлено особенно высокое нейтрофильно-лимфоцитарное соотношение вследствие изменения клеточных пропорций в сторону повышения содержания нейтрофилов и уменьшения лимфоцитов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гематологические параметры зависят от вида, пола, возраста, физиологического состояния, а также условий среды обитания животных. В периферической крови у исследованных видов летучих мышей при гибернации крайне редко встречаются молодые клетки эритроидного ряда, что свидетельствует об отсутствии существенной активации эритропоэза. В отличие от этого у золотистых хомячков Mesocricetus auratus естественный и искусственный гипобиоз сопровождается раздражением костного мозга и появлением в крови эритробластов (Ломако, Пироженко, 2010). Полученные нами данные соответствуют результатам исследования, в котором установлено, что эритропоэз в костном мозге у летучих мышей, в частности у M. mystacinus и у P. auritus, угасает при спячке. Усиление его отмечено в периоды весеннего пробуждения и активной жизни (Иванян, 1966).
У летучих мышей выявлены межвидовые различия в размерах площади поверхности эритроцитов, что может влиять на скорость оборота крови (табл. 1, рис. 2). Так, у лабораторных крыс и мышей меньшему по сравнению с человеком среднему объему эритроцитов соответствуют повышенная микроваскулярная скорость и пониженная вязкость крови (Казеннов и др., 1999). Видовые вариации параметров эритроцитов у летучих мышей можно рассматривать как адаптивные, направленные на эффективное снабжение тканей кислородом. Известно, что с уменьшением массы тела снижается объем эритроцитов и что более мелкие клетки свойственны млекопитающим с высокой интенсивностью тканевого метаболизма (Экологическая…, 1981; Казеннов и др., 1999). При рассмотрении взаимосвязи реологических свойств эритроцитов с другими физиологическими показателями необходимо учитывать, что исследованные виды летучих мышей при спячке имеют разные массы и температуры тела (Lilley et al., 2014). При этом у них наблюдается свойственная гибернантам депрессия метаболизма (Ануфриев, 2008б), а энергетические потребности резко возрастают в связи с полетами в активные периоды жизни.
Распределение эритроцитов по площади поверхности неодинаково у разных видов и различается у самок и самцов (рис. 2). У M. daubentonii кривая распределения сдвинута вправо в сторону увеличения площади, у P. auritus она смещена влево вследствие ее уменьшения. Существенные половые различия в площади поверхности эритроцитов обнаружены у M. daubentonii, M. brandtii и у E. nilssonii. Преобладание у самцов M. daubentonii большего количества, но более мелких эритроцитов по сравнению с таковыми у самок также описано польскими авторами (Wołk, Bogdanowicz, 1987).
У зимоспящих к концу длительной спячки, несмотря на резкое снижение потребления кислорода и угнетение костно-мозгового эритропоэза, артериовенозная разница остается неизменной и признаки анемии отсутствуют (Экологическая…, 1979). Этому, по-видимому, способствует увеличение продолжительности жизни эритроцитов и сокращение их деструкции (Ануфриев, 2008б). Замедление старения эритроцитов отмечено у вида с нерегулярной короткой спячкой – монгольского хомячка Allocricetulus сurtatus (Кузнецова и др., 2016). В литературе рассматривался вопрос об удлинении при спячке времени жизни не только эритроцитов, но и лейкоцитов (Inkovaara, Suomalainen, 1973).
Особенности лейкопоэза у летучих мышей, обитающих в умеренном и холодном климате, изучены недостаточно, и поэтому сравнивать полученные нами данные с представленными в других работах сложно (Иванян, 1966; Узенбаева и др., 2015; Albayrak et al., 2016). Согласно результатам наших исследований в содержании лейкоцитов имеются межвидовые различия (табл. 1). Меньше всего лейкоцитов зарегистрировано у M. mystacinus, которая среди исследованных видов обладает самой маленькой массой тела (Lilley et al., 2014). Наибольшее их количество выявлено у M. daubentonii. Сходные значения содержания лейкоцитов обнаружены у M. daubentonii, зимующей в Западной Польше (Wołk, Bogdanowicz, 1987). У прудовой ночницы M. dasycneme количество лейкоцитов возрастает от лета к осени (Kovalchuk et al., 2017), а у бодрствующей большой ночницы M. myotis оно увеличено по сравнению со спящей (Jaeger, 1963). У M. mystacinus и P. auritus пониженный уровень лейкоцитов сохраняется в течение всего года (Иванян, 1966). В определенной степени это может быть связано со способностью летучих мышей даже летом после прекращения двигательной активности снижать температуру тела и впадать в оцепенение.
У многих видов мелких млекопитающих при спячке, а также при искусственном гипобиозе содержание лейкоцитов в периферической крови низкое (Ломако, Пироженко, 2010; Bouma et al., 2010a, b, 2013). Установлено, что снижение количества лейкоцитов, ассоциированное с гипотермией, происходит вследствие уникального процесса “исчезновения” их из циркуляции, депонирования в тканях и органах и последующего возвращения в кровеносное русло после пробуждения. Зрелые нейтрофилы преимущественно сохраняются в селезенке, печени, легких, лимфоидных органах или сосудах, а лимфоциты – в лимфоидных органах (Bouma et al., 2010a, 2010b; Havenstein et al., 2016). У M. mystacinus и P. auritus большое количество крови, депонированное в селезенке в октябре–декабре, уменьшается в феврале, задолго до весеннего пробуждения (Иванян, 1966). Особо важную роль в снижении в периферической крови уровня лейкоцитов у зимоспящих играют обратимая маргинация и адгезия нейтрофилов к стенке сосудов, а не их апоптоз и снижение высвобождения из костного мозга или удержание в селезенке. Эта гипотеза была подтверждена в экспериментах с предварительной обработкой дексаметазоном, который оказывает ингибирующее влияние на маргинацию (Bouma et al., 2010a, 2010b, 2013).
Механизм обратимого возвращения лейкоцитов в периферическую кровь при переходе от гипотермии к нормотермному состоянию недостаточно выяснен. У европейского суслика Spermophilus citellus при искусственной гипотермии их уровень снижается примерно на 90%, но уже через 1.5 ч после пробуждения почти полностью возвращается к таковому у активных животных летом (Bouma et al., 2010b). До нормотермного уровня быстро восстанавливается содержание нейтрофилов и моноцитов, а содержание лимфоцитов запаздывает и составляет лишь половину наблюдаемого у животных летом (Bouma et al., 2013). На примере M. daubentonii показано, что количество лимфоцитов может зависеть от возрастного состава животных – в шестимесячном возрасте оно выше, чем у взрослых (Wołk, Bogdanowicz, 1987). Кроме того, выявлено, что у млекопитающих содержание лимфоцитов снижается при хроническом стрессе и в течение осенне-зимнего периода при инволюции тимуса. Ингибирующее влияние на пролиферацию лимфоцитов в тимусе у спящих животных оказывает 5'-AMP из бурой жировой ткани (Atanassov et al., 1995).
В некоторых работах установлено, что существуют видоспецифические различия в реакции на гибернацию. В частности, нет разницы между гибернационным и постгибернационным периодами в количестве лейкоцитов у суслика даурского S. dauricus (Hu et al., 2017). У сони-полчка Glis glis, грызуна из сем. сониевых, восстановление запасов фагоцитов в крови (нейтрофилов и моноцитов) происходит сравнительно медленно. При этом врожденная иммунная система, представляющая собой первую линию защиты от патогенов, истощается не только при спячке, но и после выхода из нее (Havenstein et al., 2016).
Существует мнение, что, несмотря на то что летучие мыши являются резервуаром для многих патогенов, при спячке возрастание смертности обусловлено истощением жировых запасов, а не хищничеством или паразитарной инфекцией (Kоkurewicz, Speakman, 2006). Следовательно, большую роль в поддержании жизнеспособности может играть продолжительность глубокого оцепенения. У E. nilssonii в среднем она намного выше (214.8 ± 23.9 ч) по сравнению с таковой у M. daubentonii (182.21 ± 25.95 ч) и особенно у P. auritus (152.1 ± 9.8 ч) (Ануфриев, 2008а). Интересно, что при WNS, вызываемом Geomyces destructans, нарушаются паттерны оцепенения, что приводит к частым пробуждениям и преждевременному расходу запасенного жира. Среди видов из рода кожанов высокой устойчивостью к этой патологии обладает большой бурый кожан E. fuscus. У европейских видов из рода ночниц – у M. daubentonii и M. brandtii – инфекция ограничивается наружным эпидермисом, причем смертельных случаев не отмечено (Frank et al., 2014).
Известно, что длительная экспозиция низкой температуры оказывает стрессирующее влияние на клетки, действуя на стабильность белка, синтез АТФ, активность ключевых регуляторных ферментов, функции мембран и целостность цитоскелета (Carey et al., 2003). При спячке регулярно чередуются периоды чрезвычайного снижения температуры и последующего быстрого разогревания, однако повреждения органов у животных не обнаружено (Bouma et al., 2013). Предполагается, что ослаблению травматического поражения тканей при спячке способствует индукция лейкоцитопении (Yasuma et al., 1997).
В периферической крови летучих мышей небольшая часть нейтрофилов имеет неправильную форму, увеличенный объем цитоплазмы, эксцентрично расположенное ядро, а иногда и псевдоподии. Некоторые из перечисленных признаков, в частности перераспределение органелл и деформированность контура, относятся к морфологическим критериям активации (Тузлуков, 2004). Вероятно, подобные изменения отражают видовые особенности или обусловлены гибернацией. В частности, на морфофункциональное состояние нейтрофилов при спячке может влиять их способность к миграции и депонированию в органах и тканях. Установлено, что нейтрофилы маргинального пула обладают повышенной активностью, отличающейся от возникающей при воспалении (Yasuma et al., 1997). Полисегментированные нейтрофилы (>5 сегментов в ядре) могут появляться в результате увеличения времени пребывания их в крови и при дефиците В12 или фолиевой кислоты.
Для лейкоформулы летучих мышей характерно преобладание нейтрофилов над лимфоцитами (табл. 1, рис. 3). По соотношению различных типов лейкоцитов наиболее близки между собой ночницы M. daubentonii, M. mystacinus, M. brandtii, а также E. nilssonii. От них отличается P. auritus, представитель рода Plecotus, у которого выявлен в среднем наиболее высокий относительный уровень нейтрофилов и низкий уровень лимфоцитов. Объяснить причины этих различий можно с помощью данных об интенсивности гранулоцитопоэза. У P. auritus в период ухода на зимовку (октябрь) жировые клетки в костном мозге встречаются редко, в то время как у M. mystacinus зафиксированы признаки перерождения (Иванян, 1966).
У летучих мышей обнаружены эозино- и базопении (Экологическая…, 1979; Wołk, 1985; Wołk, Bogdanowicz, 1987). У E. nilssonii и M. daubentonii частота появления базофилов выше таковой у других видов, и их даже больше, чем эозинофилов. Возможно, в условиях повышения вязкости и понижения скорости кровотока функциональная активность базофилов возрастает. Значительное уменьшение количества всех типов циркулирующих лейкоцитов, за исключением базофилов, при понижении температуры тела отмечено у крыс Wistar (Bouma et al., 2013).
Хотя нет прямых доказательств того, что базофилы оказывают большое влияние на состояние свертывающей системы во время спячки благодаря наличию в гранулах гепарина, их наряду с тучными клетками можно отнести к факторам, обеспечивающим создание гипокоагулянтности в условиях значительного замедления скорости кровотока. Кроме этого базофилы участвуют в регуляции обмена липидов, которые у гибернантов являются основной формой сохранения энергетических ресурсов (Ануфриев, 2008а). Зависимость количества базофилов от содержания триглицеридов и активация липазы гепарином были описаны ранее (Алмазов и др., 1979). Вероятно, имеются и другие причины, обусловливающие присутствие базофилов в крови летучих мышей при спячке.
Полученные результаты свидетельствуют об общих чертах и видовых особенностях состава периферической крови у летучих мышей при минимализации физиологических функций во время гибернации. Известно, что лейкоциты играют важную роль в поддержании устойчивости организма при действии различных факторов внешней среды. В частности, на снижение иммунологической реактивности, по-видимому, указывают низкие уровни лейкоцитов всех типов у M. mystacinus и лимфоцитов у P. auritus. Это соответствует крайне малой численности M. mystacinus и P. auritus, характерной для северных сообществ. На зимовках относительное обилие E. nilssonii составило 64.3%, M. daubentonii – 9.4%, M. brandtii – 8.9%, P. auritus – 6.1%, M. mystacinus – 3.8%, ночниц условной группы M. brandtii/M. mystacinus – 5.6%, а у других ночниц (видовую принадлежность которых точнее определить не удалось) – 1.9% (Белкин и др., 2015; Ильина и др., 2017).
В Карелии по численности лидирует E. nilssonii, который по ряду гематологических показателей существенно отличается от редко встречающихся M. mystacinus и P. auritus. По-видимому, соотношение различных типов лейкоцитов у E. nilssonii оптимально для сохранения гомеостаза и устойчивости организма, что способствует продвижению этого вида на Север.
Таким образом, впервые получены сравнительные данные о морфологии и составе клеток периферической крови при гибернации у видов гладконосых летучих мышей M. daubentonii, M. brandtii, M. mystacinus, P. auritus и E. nilssonii. У исследованных видов отмечены невысокий уровень лейкоцитов и нейтрофильный профиль лейкоформулы. Особенно низкое содержание лейкоцитов наблюдается у M. mystacinus, а лимфоцитов, а также наименьшая площадь поверхности эритроцитов – у P. auritus, относящихся к редко встречающимся видам в Республике Карелия.
Работа выполнена на средства федерального бюджета (тема № 0221-2017-0052 и № 0221-2017-0046) и программы Президиума РАН № 41 (проект № 0221-2018-0002).
Список литературы
Алмазов В.А., Афанасьев Б.В., Зарицкий А.Ю., Мамаев Н.Н., Рудакова Т.Л., Фрейдлин И.С., Цвейбах А.С., Шишков А.Л. Физиология лейкоцитов человека. Л.: Наука, 1979. 232 с.
Ануфриев А.И. Зимовка и зимняя спячка летучих мышей в Якутии // Вестн. ЯГУ. 2008а. Т. 5. № 2. С. 5–8.
Ануфриев А.И. Механизмы зимней спячки мелких млекопитающих Якутии. Новосибирск: Изд-во СО РАН, 2008б. 158 с.
Белкин В.В., Панченко Д.В., Тирронен К.Ф., Якимова А.Е., Федоров Ф.В. Экологический статус (Chiroptera) на зимовках в восточной Фенноскандии // Экология. 2015. № 5. С. 1–8.
Иванян А.К. Сезонная периодика кроветворения у летучих мышей // Журн. эволюц. биохимии и физиологии. 1966. Т. 2. № 4. С. 340–346.
Ильина Т.Н., Баишникова И.В., Белкин В.В., Якимова А.Е. // Тр. КарНЦ РАН. Эксперим. биология. 2017. № 5. С. 79–88.
Казеннов А.М., Катюхин Л.Н., Маслова М.Н., Барвитенко Н.Н., Скверчинская Е.А., Рустамов Ф.А., Тавровская Т.В. Содержание 2,3-дифосфоглицерата в эритроцитах млекопитающих: межвидовая взаимосвязь с гематологическими и реологическими параметрами клеток // Журн. эволюц. биохимии и физиологии. 1999. Т. 35. № 4. С. 332–334.
Козинец Г.И., Высоцкий В.В., Захаров В.В., Оприщенко С.А., Погорелов В.М. Кровь и экология. М.: Практическая медицина, 2007. 432 с.
Кузнецова E.В., Найденко С.В., Суров А.В., Тихонова Н.Б., Козловский Ю.Е., Феоктистова Н.Ю. Сезонные изменения показателей крови у монгольского хомячка Allocricetulus сurtatus // Изв. РАН. Сер. биол. 2016. № 4. С. 405–411.
Ломако В.В., Пироженко Л.Н. Лейкоциты при гипометаболических состояниях // Вiсник проблем бiол. i мед. 2010. Вип. 3. С. 61–65.
Тузлуков И.И. Особенности морфологии нейтрофильных лейкоцитов в послеродовом периоде // Рос. мед.-биол. вестн. им. академика И.П. Павлова. 2004. № 3–4. С. 113–118.
Узенбаева Л.Б., Белкин В.В., Илюха В.А., Кижина А.Г., Якимова А.Е. Особенности состава и морфологии клеток периферической крови у трех видов летучих мышей Карелии в период зимней спячки // Журн. эволюц. биохимии и физиологии. 2015. Т. 51. № 4. С. 299–304.
Экологическая физиология животных. Ч. I. Общая экологическая физиология и физиология адаптаций. Л.: Наука, 1979. 440 с.
Экологическая физиология животных. Ч. II. Физиологические системы в процессе адаптации и факторы среды обитания. Л.: Наука, 1981. 528 с.
Этическая экспертиза биомедицинских исследований. Практические рекомендации // Ред. Белоусова Ю.Б. М.: Рос. об-во клин. исследований, 2005. 156 с.
Albayrak İ., Özcan H.B., Baydemir M. Some hematological parameters in Myotis myotis and Myotis blythii (Mammalia: Chiroptera) in Turkey // Turk. J. Zool. 2016. V. 40. P. 388–391.
Atanassov C., Naegeli H.-U., Zenke G., Schneider C., Kramarova L.I., Bronnikov G.E., van Regenmortel M.H.V. // Anti-lymphoproliferative activity of brown adipose tissue of hibernating ground squirrels is mainly caused by AMP // Comp. Biochem. Physiol. 1995. V. 112C. P. 93–100.
Banerjee A., Rapin N., Bollinger T., Misra V. Lack of inflammatory gene expression in bats: a unique role for a transcription repressor // Sci. Rept. 2017. V. 7. P. 1–14.
Becker N.I., Encarnação J.A., Tschapka M., Kalko E.K.V. Energetics and life-history of bats in comparison to small mammals // Ecol. Res. 2013. V. 28. P. 249–258.
Ben-Hamo M., Muñoz-Garcia A., Williams J.B., Korine C., Pinshow B. Waking to drink: rates of evaporative water loss determine arousal frequency in hibernating bats // J. Exp. Biol. 2013. V. 216. P. 573–577.
Bouma H.R., Carey H.V., Kroese F.G.M. Hibernation: the immune system at rest? // J. Leukoc. Biol. 2010a. V. 88. P. 619–624.
Bouma H.R., Strijkstra A.M., Boerema A.S., Deelman L.E., Epema A.H., Hut R.A. Kroese F.G.M., Henning R.H. Blood cell dynamics during hibernation in the European Ground Squirrel // Vet. Immunol. Immunopathol. 2010b. V. 136. P. 319–323.
Bouma H.R., Dugbartey G.J., Boerema A.S., Talaei F., Herwig A., Goris M., van Buiten A., Strijkstra A.M., Carey H.V., Henning R.H., Kroese F.G.M. Reduction of body temperature governs neutrophil retention in hibernating and nonhibernating animals by margination // J. Leukoc. Biol. 2013. V. 94. № 3. P. 431–437.
Carey H.V., Andrews M.T., Martin S.L. Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature // Physiol. Rev. 2003. V. 83. P. 1153–1181.
Frank C.L., Michalski A., McDonough A.A., Rahimian M., Rudd R.J., Herzog C. The resistance of a North American bat species (Eptesicus fuscus) to White-nose Syndrome (WNS) // PLoS One. 2014. V. 9. № 12. e113958.
Geiser F. Metabolic rate and body temperature reduction during hibernation and daily torpor // Annu. Rev. Physiol. 2004. V. 66. P. 239–274.
Havenstein N., Langer F., Stefanski V., Fietz J. It takes two to tango: Phagocyte and lymphocyte numbers in a small mammalian hibernator // Brain Behav. Immun. 2016. V. 52. P. 71–80.
Hu H., Du F., Fu W., Jiang S., Cao J., Hu S., Wang H.P., Chang H., Goswami N., Gao Y.F. A dramatic blood plasticity in hibernating and 14-day hindlimb unloading Daurian ground squirrels (Spermophilus dauricus) // J. Comp. Physiol. B. 2017. V. 187. P. 869–879.
Inkovaara P., Suomalainen P. Studies on the physiology of the hibernating hedgehog. 18. On the leukocyte counts in the hedgehog’s intestine and lungs // Ann. Acad. Sci. Fenn. 1973. V. 200. P. 1–21.
Jaeger R. Serologisch-hämatologische und immunologische Untersuchungen an winter-schlafenden Fledermäusen (Myotis myotis S.) // Experientia. 1963. Bd XIX. № 11. S. 596–598.
Kokurewicz T., Speakman J.R. Age related variation in the energy costs of torpor in Daubenton’s bat: effects on fat accumulation prior to hibernation // Acta Chiropterol. 2006. V. 8. № 2. P. 509–521.
Kovalchuk L., Mishchenko V., Chernaya L., Snitko V., Mikshevich N. Haematological parameters of pond bats (Myotis dasycneme Boie, 1825 Chiroptera: Vespertilionidae) in the Ural Mountains // Zool. Ecol. 2017. V. 27. № 2. P. 168–175.
Lilley T.M., Stauffer J., Kanerva M., Eeva T. Interspecific variation in redox status regulation and immune defence in five bat species: the role of ectoparasites // Oecologia. 2014. V. 175. P. 811–823.
Moore M.S., Reichard J.D., Murtha T.D., Nabhan M.L., Pian R.E., Ferreira J.S., Kunz T.H. Hibernating little brown Myotis (Myotis lucifugus) show variable immunological responses to white-nose syndrome // PLoS One. 2013. V. 8. № 3. P. 1–8.
Mühldorfer K., Speck S., Kurth A., Lesnik R., Freuling C., Müller T., Kramer-Schadt S., Wibbelt G. Diseases and Causes of Death in European Bats: Dynamics in Disease Susceptibility and Infection Rates // PLoS One. 2011. V. 6. № 12. e29773.
Stockmaier S., Dechmann D.K.N., Page R.A., O’Mara M.T. No fever and leucocytosis in response to a lipopolysaccharide challenge in an insectivorous bat // Biol. Lett. 2015. V. 11. P. 1–4.
Wibbelt G., Kurth A., Hellmann D., Weishaar M., Barlow A., Veith M., Prüger J., Görföl T., Grosche L., Bontadina F., Zöphel U., Seidl H.P., Cryan P.M., Blehert D.S. White-nose syndrome fungus (Geomyces destructans) in bats, Europe // Emerg. Infect. Dis. 2010. V. 16. № 8. P. 1237–1242.
Wilkinson G.S., South J.M. Life history, ecology and longevity in bats // Aging Cell. 2002. V. 1. P. 124–131.
Wołk E. Hematology of a hibernating rodent – the northern birch mouse // Acta Theriol. 1985. V. 30. № 22. P. 337–348.
Wołk E., Bogdanowicz W. Hematology of the hibernating bat: Myotis daubentonii // Comp. Biochem. Physiol. 1987. V. 88A. № 4. P. 637–639.
Yasuma Y., McCarron R.M., Spatz M., Hallenbeck J.M. Effects of plasma from hibernating ground squirrels on monocyte-endothelial cell adhesive interactions // Am. J. Physiol. 1997. V. 273. P. 1861–1869.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


