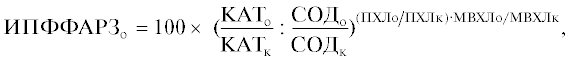Известия РАН. Серия биологическая, 2019, № 6, стр. 572-576
Изменение показателей прооксидантно-антиоксидантной системы в крови и головном мозге крыс в условиях моделирования острой гипоксии при потреблении питьевого рациона, обедненного дейтерием
А. А. Басов 1, 2, *, С. В. Козин 3, И. М. Быков 2, К. А. Попов 2, А. В. Моисеев 4, А. А. Елкина 1, 3, С. С. Джимак 1, 3
1 Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
2 Кубанский государственный медицинский университет МЗ РФ
350063 Краснодар, ул. Седина, 4, Россия
3 Федеральный исследовательский центр южный научный центр РАН
344006 Ростов-на-Дону, просп. Чехова, 41, Россия
4 Кубанский государственный аграрный университет
350004 Краснодар, ул. Калинина, 13, Россия
* E-mail: son_sunytch@mail.ru
Поступила в редакцию 01.02.2018
После доработки 17.10.2018
Принята к публикации 17.05.2019
Аннотация
При моделировании у крыс гипоксии, на основании сравнительного анализа показателя функционирования ферментов антирадикальной защиты, подтверждено наличие дисбаланса в их работе с недостаточной дисмутазной активностью в крови, сопровождающееся формированием окислительного стресса, более выраженного у животных, получавших естественный питьевой рацион. Отмечено, что острая гипоксия в тканях головного мозга характеризуется формированием недостаточности каталазной активности и риском избыточной продукции пероксида водорода. Показано, что снижение соотношения D/H (дейтерий/водород) в крови и головном мозге уменьшает выраженность нарушений функционирования антиокислительных ферментов при гипоксическом воздействии.
Нередко изменение активности ферментов первой линии антиокислительной защиты (АОЗ) – один из ключевых механизмов, способствующих неконтролируемой продукции свободных радикалов и реактивных молекул в организме при многих патологических состояниях, вызывающих в том числе повреждение нервных клеток головного мозга в условиях развития острой гипоксии, поэтому поиск и разработка новых способов нейропротекции остаются актуальными и в настоящее время (Шурыгина и др., 2015; Esmaeelpanah et al., 2015; Mehri et al., 2016). При этом современные способы диагностики нарушений функционирования ферментов АОЗ позволяют достаточно точно разграничивать их адаптивную напряженность, связанную с регуляторными изменениями активности (Байляк и др., 2008) и патологическим дисбалансом в работе этих ферментов, приводящим к формированию окислительного стресса (Басов и др., 2011).
Описанный ниже разработанный интегральный показатель позволяет определять выраженность дисбаланса ферментов АОЗ в условиях окислительного стресса и своевременно назначать рациональную антиоксидантную терапию, а также контролировать ее эффективность в процессе лечения, что сделало возможным изучение влияния обедненного дейтерием питьевого рациона на состояние тканей головного мозга при моделировании острой гипоксии. Последнее особенно актуально, так как в ряде исследований были показаны различные биологические эффекты, возникающие при снижении концентрации дейтерия в организме (Dzhimak et al., 2015a; Rehakova et al., 2016), в том числе было продемонстрировано ее влияние на нервную систему, связанное с улучшением долговременной памяти и уменьшением тревожности у крыс, потреблявших воду с пониженным содержанием дейтерия (Mladin et al., 2014). Также было установлено, что число депрессий у населения прямо коррелирует с концентрацией дейтерия в питьевой воде (Strekalova et al., 2015).
Цель работы – изучение особенностей функционирования ферментов антиокислительной защиты в крови и головном мозге крыс в условиях моделирования острой гипоксии при потреблении воды, обедненной по дейтерию.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было проведено на 24 крысах-самцах Wistar массой от 253 до 286 г, полученных из филиала “Андреевка” ФГБУН НЦБМТ ФМБА (Московская обл., Солнечногорский р-н, пос. Андреевка) и разделенных на три группы: A – 8 крыс, получавших в течение всего эксперимента воду с концентрацией дейтерия –11‰ и моделированием острой гипоксии через 8 нед; Б – 8 крыс, получавших в течение всего эксперимента воду с концентрацией дейтерия –664‰ и моделированием острой гипоксии через 8 недель; В – 8 интактных крыс, получавших в течение всего эксперимента воду с концентрацией дейтерия –11‰ без моделирования у них острой гипоксии через 8 нед. На протяжении всего эксперимента животные потребляли стандартный концентрированный комбикорм (ГОСТ Р 50258). Воду со сниженным содержанием дейтерия получали методом электролитического разделения (Фролов и др., 2012). Минерализация (144–180 мг гидрокарбонатов, <1 мг сульфатов, 60–76 мг хлоридов, 6 мг натрия, 3 мг калия, 50–58 мг кальция и 50–58 мг магния) была идентична таковой у воды с содержанием дейтерия –664 и –11‰. Определение концентрации дейтерия в воде и плазме крови проводили на импульсном ЯМР спектрометре JEOL JNM-ECA 400MHz (Dzhimak et al., 2015b).
Острую гипоксию с гиперкапнией моделировали, помещая крыс в герметично закрытый сосуд объемом 1 л, в котором крысы находились от 22 до 24 мин под непрерывным мониторингом до появления первого агонального вздоха, после чего головной мозг извлекали и помещали в жидкий азот, забор крови осуществляли из шейной артерии в пробирку, содержащую гепарин.
Метод определения активности каталазы был основан на регистрации скорости утилизации пероксида водорода (Н2О2) в реакционной смеси, в которую вносили 200 мкл плазмы крови или супернатанта из гомогената головного мозга (Beers, Sizer, 1952), активность фермента выражали в миллимолях Н2О2, разрушенного за 1 мин в 1 л биосубстрата. Активность супероксиддисмутазы (СОД) определяли с помощью метода, основанного на торможении аутоокисления кверцетина, инициируемого внесением N,N,N1,N1-тетраметилэтилендиамином в присутствии О2, в результате присутствия СОД в биосубстрате (Костюк и др., 1990).
Интенсивность свободнорадикального окисления (СРО) определяли с помощью хемилюминесценции (ХЛ) на хемилюминометре Lum-5773 (Россия) с использованием лицензионного программного обеспечения PowerGraph 3.3 (Владимиров, Проскурина, 2009). Интегральную оценку дисбаланса функционирования ферментов АОЗ осуществляли в плазме крови и гомогенате головного мозга по формуле (Басов и др., 2011)
где ИПФФАРЗo – интегральный показатель функционирования ферментов антирадикальной защиты (опыт) в единицах соотношения каталаза/супероксиддисмутаза, ед. соотношения КАТ/СОД, 100 – расчетный коэффициент, КATо – активность каталазы (опыт), в единицах активности (ед. акт.), КATк – активность каталазы (контроль) в ед. акт., СОДо – активность супероксиддисмутазы (опыт) в ед. акт., COДк – активность супероксиддисмутазы (контроль) в ед. акт., ПХЛо – площадь хемилюминесценции (опыт) в единицах площади (ед. пл.), ПХЛк – площадь хемилюминесценции (контроль) в ед. пл., MBXЛо – максимум вспышки хемилюминесценции (опыт) в условных единицах (усл. ед.), MBXЛк – максимум вспышки хемилюминесценции (контроль) в усл. ед.При статистической обработке рассчитывали средние значения в полученных выборках (М), среднеквадратичное отклонение (σ); достоверным считали различие между группами при р < 0.05 (U‑критерий Манна–Уитни).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам исследования установлено, что в крови крыс из групп А и Б после моделирования гипоксии наблюдалось развитие дисбаланса в работе ферментов АОЗ (катализирующих превращение продуктов неполного одно- и двухэлектронного восстановления кислорода), которое характеризовалось повышением активности каталазы в 4.1 и 2.4 раза, а также снижением активности СОД в 1.5 и 1.2 раза соответственно по сравнению с контрольной группой В (табл. 1). Выявленное изменение активности ферментов АОЗ, вероятно, было обусловлено повышенной продукцией активных форм кислорода, что подтверждалось достоверным увеличением МВХЛ и ПХЛ в группе А на 49 и 27% соответственно. При этом в группе Б, получавшей питьевой рацион с пониженной концентрацией дейтерия, выраженных изменений интенсивности СРО не было установлено, что позволяет сделать вывод об адаптивном характере изменений активности каталазы и СОД у этих животных. Содержание дейтерия в плазме крови животных из группы Б колебалось от –319 до –297‰, что было достоверно меньше значений показателей дейтерия в плазме крови крыс в группах А и В (от –8 до +6‰) и свидетельствует о достоверном влиянии питьевого рациона с пониженным содержанием дейтерия на соотношение D/H в организме крыс на восьмой неделе эксперимента. На основании анализа комплексного показателя ИПФФАРЗ при моделировании у крыс гипоксии было подтверждено наличие существенного дисбаланса в работе антиокислительных ферментов с недостаточной дисмутазной активностью, сопровождающееся формированием окислительного стресса на системном уровне, более выраженное у животных в группе А (в 7.8 раза выше по сравнению с группой Б, p < 0.05), что также указывает на определенное значение сниженного соотношения D/H в крови для уменьшения окислительного повреждения организма за счет адаптивной перестройки функционирования энзимов первой линии АОЗ, связанное, вероятно, со способностью дейтерия и протия по-разному модифицировать конформацию активного и аллостерического центра биомолекул белковой природы (Zrelov et al., 2015; Fedulova et al., 2017).
Таблица 1.
Изменение показателей прооксидантно-антиоксидантной системы в крови и гомогенатах головного мозга крыс, употреблявших воду с различной концентрацией дейтерия
| Показатель | Группа А | Группа Б | Группа В |
|---|---|---|---|
| В крови | |||
| ПХЛ, ед. пл. | 52 614 ± 7146* | 47 362 ± 6857 | 41 583 ± 7529 |
| MBXЛ, усл. ед. | 0.367 ± 0.092* | 0.308 ± 0.076 | 0.246 ± 0.063 |
| Каталаза, ед. акт. | 116 ± 24* | 68 ± 9*,# | 28 ± 6 |
| СОД, ед. акт. (кровь) | 46 ± 5* | 57 ± 6*, # | 69 ± 8 |
| ИПФФАРЗ, ед. соотн. КАТ/СОД | 4348 ± 3054* | 560 ± 342*, # | 98 ± 11 |
| В головном мозге | |||
| ПХЛ, ед. пл. | 562 ± 69* | 489 ± 60# | 454 ± 56 |
| MBXЛ, усл. ед. | 0.031 ± 0.004* | 0.024 ± 0.003*, # | 0.017 ± 0.002 |
| Каталаза, ед. акт. | 10 996 ± 1719* | 15 581 ± 2436# | 15003 ± 2553 |
| СОД, ед. акт. | 55 ± 12 | 47 ± 9 | 42 ± 11 |
| ИПФФАРЗ, ед. соотн. КАТ/СОД | 34 ± 28* | 93 ± 44# | 106 ± 37 |
Примечание.* – p < 0.05 по сравнению с показателями группы В; # – p < 0.05 по сравнению с показателями группы А. ПХЛ – площадь хемилюминесценции, MBXЛ – максимум вспышки хемилюминесценции, СОД – активность супероксиддисмутазы, ИПФФАРЗ – интегральный показатель функционирования ферментов антирадикальной защиты, ед. пл. – единица площади, ед. акт. – единица активности, усл. ед. – условная единица, ед. соотн. – единица соотношения.
В то же время в ткани головного мозга отмечена несколько иная картина нарушений окислительного метаболизма, характеризующаяся в отличие от изменений на системном уровне преобладанием недостаточности каталазной активности (табл. 1), которая по данным ИПФФАРЗ была выражена в большей мере у крыс в группе А (на 63 и 68% соответственно по сравнению с данными в группах Б и В). Последнее свидетельствует о высоком риске накопления в нервной ткани пероксида водорода, способного в присутствии металлов переменной степени окисления разлагаться с образованием гидроксильного радикала – наиболее реакционноспособного радикала, вызывающего окислительное повреждение биомолекул в нейроцитах. При этом у крыс, получавших питьевой рацион с пониженной концентрацией дейтерия, достоверных нарушений функционирования антиокислительных ферментов не было выявлено, что свидетельствует об устойчивости тканей головного мозга к гипоксическому воздействию в условиях снижения соотношения D/H в организме.
Следует подчеркнуть существенно большее влияние свободнорадикальных процессов на клеточные компоненты нервной ткани при гипоксии и отсутствии коррекции по сравнению с эритроцитами при окислительном повреждении, причинами которого являются нарушение энергетического обмена на местном уровне (Dzhimak et al., 2017) и, по-видимому, компенсаторное истощение низкомолекулярных антиоксидантных факторов со снижением общей антиокислительной активности нейроцитов. При этом потребление крысами обедненного дейтерием питьевого рациона приводит к достоверному уменьшению большинства указанных патологических биохимических сдвигов и повышению адаптационного потенциала как на тканевом (Rasooli et al., 2016), так и на организменном уровнях (Bila et al., 2017), повышая резистентность нервной ткани и эритроцитов к острому гипоксическому повреждению.
ЗАКЛЮЧЕНИЕ
В целом проведенное исследование свидетельствует о возможности уменьшения дисбаланса в работе ферментов антиокислительной защиты в крови и тканях головного мозга у крыс при моделировании острой гипоксии путем снижения D/H-соотношения в организме и мониторинге эффективности корригирующих мероприятий с помощью разработанного интегрального показателя. Выявлено, что содержание дейтерия в плазме крови животных, потреблявших питьевой рацион с пониженным содержанием дейтерия (–664‰) колебалось от –319 до –297‰, что достоверно меньше значений показателей дейтерия в плазме крови крыс, получавших естественный питьевой рацион (от –8 до +6‰), и свидетельствует о достоверном влиянии питьевого рациона с пониженным содержанием дейтерия на соотношение D/H в организме крыс на восьмой неделе эксперимента.
По данным, установленным с помощью разработанного интегрального показателя (ИПФФАРЗ), острая гипоксия характеризуется различными механизмами развития окислительного стресса у крыс в крови (с формированием недостаточности дисмутазной активности и риском избыточной продукции супероксидного анион-радикала) и тканях головного мозга (с формированием недостаточности каталазной активности и риском избыточной продукции пероксида водорода), что требует применения нейропротекторов, способных нивелировать дисбаланс в работе ферментов первой линии АОЗ, катализирующих превращение продуктов неполного одно- и двухэлектронного восстановления кислорода в организме.
Снижение соотношения D/H в организме привело к уменьшению окислительного стресса за счет адаптивного изменения функциональной активности антиокислительных ферментов на местном и системном уровнях в организме животных, что позволяет рассматривать питьевой рацион с пониженной концентрацией дейтерия в качестве одного из факторов комплексной нейропротекции.
Исследование выполнено при поддержке государственного задания Министерства образования и науки РФ (проект № 6.5882.2017/БЧ), а также РФФИ (грант 19-44-233005) и государственного задания ЮНЦ РАН (№ АААА-А19-119040390083-6).
Список литературы
Байляк М., Господарев Д., Семчишин Г., Лущак В. Ингибирование каталазы аминотриазолом in vivo приводит к снижению активности глюкозо-6-фосфатдегидрогеназы в клетках Saccharomyces cerevisiae // Биохимия. 2008. Т. 73. № 4. С. 515–523.
Басов А.А., Быков И.М., Губарева Е.А., Павлюченко И.И., Федосов С.Р. Способ диагностики нарушений метаболизма в организме в условиях окислительного стресса: Патент РФ на изобретение № 2436101, Российская Федерация, МПК G01N 33/573. Заявл. 25.06.2010; опубл. 10.12.2011. Бюл. № 34.
Владимиров Ю.А., Проскурина Е.В. Свободные радикалы и клеточная хемилюминесценция // Успехи биол. химии. 2009. Т. 49. С. 341–388.
Костюк B.A., Потапович A.И., Ковалева Ж.И. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина // Вопр. мед. химии. 1990. Т. 36. Вып. 2. С. 88–91.
Фролов В.Ю., Барышев М.Г., Болотин С.Н., Джимак С.С. Способ получения биологически активной питьевой воды с пониженным содержанием дейтерия: Патент РФ на изобретение № 2438765, МПК B01D 59/40; C01B 4/00; C02F 1/461. Заявл. 25.05.2010; опубл. 10.01.2012. Бюл. № 1.
Шурыгина Л.В., Злищева Э.И., Хаблюк В.В., Кравцова А.Н., Абрамова Н.О., Злищева Л.И., Кравцов А.А. Сравнительное исследование антиоксидантных свойств коменовой кислоты и комената калия на модели иммобилизационного стрессового воздействия // Бюл. эксперим. биологии. 2015. Т. 159. № 4. С. 457–459.
Beers R., Sizer I. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase // J. Biol. Chem. 1952. V. 195. P. 133–140.
Bila W.C., Mariano R.M.S., Silva V.R., dos Santos M.E.M., Lamounier J.A., Ferriolli E., Galdino A.S. Applications of deuterium oxide in human health // Isotopes Environ. Health Stud. 2017. V. 53. № 4. P. 327–343.
Dzhimak S.S., Basov A.A., Volchenko N.N., Samkov A.A., Fedulova L.V., Baryshev M.G. Changes in the functional activity of mitochondria isolated from the liver of rat that passed the preadaptation to ultra-low deuterium concentration // Dokl. Biochem. Biophys. 2017. V. 476. P. 323–325.
Dzhimak S.S., Basov A.A., Fedulova L.V., Didikin A.S., Bikov I.M., Arcybasheva O.M., Naumov G.N., Baryshev M.G. Correction of metabolic processes in rats during chronic endotoxicosis using isotope (D/H) exchange reactions // Biol. Bull. 2015a. V. 42. № 5. P. 440–448.
Dzhimak S.S., Basov A.A., Kopytov G.F., Kashaev D.V., Sokolov M.E., Artsybasheva O.M., Sharapov K.S., Baryshev M.G. Application of NMR spectroscopy to the determination of low concentrations of nonradioactive isotopes in liquid media // Russ. Phys. J. 2015b. V. 58. № 7. P. 923–929.
Esmaeelpanah E., Rahmatkhah A., Poormahmood N., Razavi B.M., Hasani F.V., Hosseinzadeh H. Protective effect of green tea aqueous extract on acrylamide induced neurotoxicity // Jundishapur J. Nat. Pharm. Prod. 2015. V. 10. № 2. P. e18406.
Fedulova L.V., Vasilevskaya E.R., Kotenkova E.A., Elkina A.A., Baryshev M.G., Lisitsyn A.B. Influence of different polypeptides fractions derived from Sus scrofa immune organs on the rats immunological reactivity // J. Pharm. Nutrition Sci. 2017. V. 7. № 2. P. 35–40.
Mehri S., Dadesh Q., Tabeshpour J., Hassani F.V., Karimi G., Hosseinzadeh H. Evaluation of the neuroprotective effect of silymarin on acrylamide-induced neurotoxicity // Jundishapur J. Nat. Pharm. Prod. 2016. V. 11. № 4. P. e37644.
Mladin C., Ciobica A., Lefter R., Popescu A., Bild W. Deuterium-depleted water has stimulating effects on long-term memory in rats // Neurosci. Lett. 2014. V. 583. P. 154–158.
Rasooli A., Fatemi F., Akbarzadeh K., Dini S., Bahremand S. Synergistic protective activity of deuterium depleted water (DDW) and satureja rechingeri essential oil on hepatic oxidative injuries induced by acetaminophen in rats // J. Essential Oil Bearing Plants. 2016. V. 19. № 5. P. 1086–1101.
Rehakova R., Klimentova J., Cebova M., Barta A., Matúsková Z., Kreber Labaš P., Pechanova O. Effect of deuterium-depleted water on selected cardiometabolic parameters in fructose-treated rats // Physiol. Res. 2016. V. 65. № 3. P. S401–S407.
Strekalova T., Evans M., Chernopiatko A., Couch Y., Costa-Nunes J., Cespuglio R., Chesson L., Vignisse J., Steinbusch H.W., Anthony D.C., Pomytkin I., Lesch K.P. Deuterium content of water increases depression susceptibility: the potential role of a serotonin-related mechanism // Behav. Brain Res. 2015. V. 277. P. 237–244.
Zrelov O.Y., Syroeshkin A.V., Uspenskaya E.V., Titorovich O.V., Pleteneva T.V. Effect of water isotopic composition on galactose mutarotation kinetics // Pharmaceutical Chem. J. 2015. V. 49. № 6. P. 413–416.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая