Известия РАН. Серия биологическая, 2020, № 1, стр. 85-95
Крупные древесные остатки как микростации обитания почвенной мезофауны на загрязненных территориях
Е. Л. Воробейчик a, *, А. И. Ермаков a, Д. В. Нестеркова a, М. Е. Гребенников a
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, ул. 8 Марта, 202, Россия
* E-mail: ev@ipae.uran.ru
Поступила в редакцию 06.05.2018
После доработки 25.08.2019
Принята к публикации 01.09.2019
Аннотация
Построена карта распределения обилия дождевых червей (как группы) в хвойных лесах в районе воздействия многолетних выбросов Среднеуральского медеплавильного завода. Установлено, что вблизи завода сформировалась “люмбрицидная пустыня” площадью ~65 км2, где в лесной подстилке и минеральных горизонтах почвы дождевые черви отсутствуют из-за экстремально высокого содержания тяжелых металлов. Однако отмечено, что на этой территории дождевые черви (только Dendrodrilus rubidus tenuis) заселяют валежные стволы на поздних стадиях разложения. Обилие червей в них сопоставимо с обилием в почве на фоновой территории; единично черви (включая коконы) обнаружены также в почве непосредственно под стволами. Брюхоногие моллюски, которые в стандартных почвенных пробах на этой территории отсутствуют, также встречены здесь в валежных стволах (пять видов). Предположено, что наличие таких “микросайтов выживания” может быть одним из механизмов реколонизации загрязненных участков чувствительными к загрязнению группами в случае сокращения выбросов и последующего снижения токсичности почвы.
Вблизи крупных длительно действующих предприятий цветной металлургии загрязнение почвы может быть экстремально высоким: концентрации ряда металлов и металлоидов, включая особо токсичные (Cd, Pb, Ni, Cu, Zn, Hg, As и др.), превышают фоновые значения в десятки и сотни раз (Dudka, Adriano, 1997). Столь сильное загрязнение, особенно в сочетании с подкислением почвы, губительно для почвенной фауны, вызывает снижение численности, а затем и полное исчезновение ряда чувствительных групп – дождевых червей, энхитреид, моллюсков, диплопод и др. (Bengtsson et al., 1983; Spurgeon, Hopkin, 1996; Воробейчик, 1998; Воробейчик и др., 2012, 2019). В непосредственной близости от крупных предприятий процесс деградации экосистем завершается формированием техногенных пустошей – специфических “лунных ландшафтов”, почти лишенных высшей растительности и верхних почвенных горизонтов (Kozlov, Zvereva, 2007).
Изучение почвенной фауны на сильно загрязненных территориях, особенно на окраинах распространения чувствительных групп, позволяет лучше понять “внутреннее устройство” сообществ педобионтов, закономерности их функционирования и устойчивости. В этом отношении такие работы аналогичны исследованиям в других экстремальных местообитаниях, например арктических пустынях и высокогорьях, внесших заметный вклад в почвенную зоологию и экологию сообществ.
Сокращение атмосферных выбросов, происходящее в последние годы повсеместно (Pacyna et al., 2009), дает возможность анализировать еще один важный аспект – естественное восстановление почвенной фауны. В результате проведенных нами работ вблизи Среднеуральского медеплавильного завода (СУМЗ), выбросы которого резко сократились в последнее десятилетие, выявлен неожиданный феномен – неправдоподобно высокая скорость реколонизации загрязненной территории дождевыми червями и моллюсками. Так, сравнение материалов за два последовательных учета позволило оценить скорость продвижения этих групп ближе к заводу – 2 км за 10 лет (Воробейчик и др., 2019). Такое ее значение не вызывало бы удивления, например, для активно летающих жесткокрылых, однако обсуждаемые группы малоподвижны: скорость колонизации дождевыми червями ранее незаселенной территории обычно составляет 4–6, максимально – 14–28 (Eijsackers, 2011), наземными моллюсками – 2–5, максимально – 20 м/год (Крамаренко, 2014). Другими словами, можно было бы ожидать, что документированное нами смещение техногенной границы распространения этих групп произойдет за 100, а не за 10 лет.
Мы предположили, что объяснением обнаруженного феномена может быть реколонизация ранее дефаунированной территории не только извне, но также изнутри – из неких “микросайтов выживания”, существующих на сильно загрязненных участках. По-видимому, основной “кандидат” на роль таких микросайтов – крупные древесные остатки (КДО) на поздних стадиях разложения, поскольку почвенные беспозвоночные могут их активно заселять, используя как убежища и трофический ресурс (Harmon et al., 1986). Нам не известны публикации с анализом заселенности КДО педобионтами в условиях сильного промышленного загрязнения.
Цель работы – проверка гипотезы о возможности обитания дождевых червей и моллюсков внутри КДО на участках с экстремально высоким содержанием тяжелых металлов, где в лесной подстилке и минеральных горизонтах почвы эти группы отсутствуют.
МАТЕРИАЛЫ И МЕТОДЫ
Материал собран на территории вблизи СУМЗ, подверженной многолетнему загрязнению, которое затронуло почву (Кайгородова, Воробейчик, 1996; Коркина, Воробейчик, 2016; Воробейчик, Кайгородова, 2017; Korkina, Vorobeichik, 2018), почвенный микробоценоз (Воробейчик, 2007; Mikryukov et al., 2015; Mikryukov, Dulya, 2017), растительность (Воробейчик и др., 2014; Бергман, Воробейчик, 2017), обитающих на поверхности (Ермаков, 2004; Бельская, Золотарев, 2017) и внутри почвы беспозвоночных (Воробейчик, 1998; Воробейчик и др., 2012, 2019), а также трофически связанных с ними млекопитающих (Воробейчик, Нестеркова, 2015). Техногенная трансформация почв, помимо накопления тяжелых металлов и увеличения кислотности (Воробейчик, Пищулин, 2016; Korkina, Vorobeichik, 2018), проявляется в усилении элювиально-глеевого процесса, разрушении почвенных агрегатов, уменьшении содержания обменных кальция и магния (Кайгородова, Воробейчик, 1996), формировании мощной подстилки из-за подавления крупных почвенных сапрофагов и торможения микробиальной деструкции органического вещества (Воробейчик, 2007; Коркина, Воробейчик, 2016; Korkina, Vorobeichik, 2018).
Район исследований. СУМЗ расположен на окраине г. Ревда Свердловской обл. (в 50 км к западу от Екатеринбурга). Основные ингредиенты его выбросов – газообразные соединения S, F и N, а также пылевые частицы с сорбированными тяжелыми металлами (Cu, Pb, Zn, Cd, Fe, Hg и др.) и металлоидами (As). Предприятие функционирует с 1940 г. и до недавнего времени было крупнейшим источником промышленного загрязнения в России. В 1980 г. его выбросы составляли 225, в 1990 г. – 148, в 1994 г. – 96, в 2000 г. – 63, в 2004 г. – 28, а после кардинальной реконструкции предприятия в 2010 г. – 3–5 тыс. т поллютантов/год (Воробейчик, Кайгородова, 2017).
Несмотря на снижение выбросов СУМЗ в последние годы, на наиболее загрязненных участках пока не происходит ни восстановления растительности (Воробейчик и др., 2014), ни снижения содержания тяжелых металлов в верхних почвенных горизонтах (Воробейчик, Кайгородова, 2017). В то же время для чувствительных к атмосферному загрязнению групп, жизнь которых не связана с почвой, например эпифитных лишайников, хорошо заметны признаки восстановления (Михайлова, 2017).
Вблизи завода современное содержание металлов в лесной подстилке очень высокое: Cu – 3500–5500, Pb – 1400–2500, Cd – 17–20, Zn – 600–900 мкг/г, что превышает фоновые значения в 100, 40, 7 и 3 раза соответственно; pH подстилки (4.5–4.9) снижен по сравнению с фоновым уровнем более чем на единицу (Воробейчик, Пищулин, 2016; Korkina, Vorobeichik, 2018).
Завод расположен в подзоне южной тайги на границе западного и восточного макросклонов Урала. До начала промышленного освоения района (~300 лет назад) на западном макросклоне преобладали елово-пихтовые леса с участием видов неморальной флоры, на восточном – сосновые. Сейчас помимо них на обоих макросклонах значительные площади занимают производные березовые и осиновые леса. Почвенный покров сформирован литоземами, ржавоземами, буроземами, серыми и дерново-подзолистыми почвами. Вблизи завода представлены елово-пихтовые или березовые фрагменты леса с маловидовыми сообществами (Equisetum sylvaticum, Deschampsia cespitosa, Tussilago farfara, Agrostis capillaris и др.) и одновидовым моховым покровом (Pohlia nutans), которые перемежаются открытыми пространствами с луговой растительностью (Воробейчик и др., 2014).
Картирование распределения обилия дождевых червей. Его выполнили на основе учетов на 179 временных пробных площадях (ПП) размером 25 × 25 м, относительно равномерно размещенных на участке 40 × 50 км, в центре которого расположен завод. Каждую ПП обследовали однократно в июле–сентябре 2013–2016 гг., исключая периоды во время засух и после заморозков. Обилие червей (экз./м2) оценивали путем подсчета числа особей на 10 площадках размером 1 × 1 м, случайно размещенных в пределах каждой ПП. Подсчет проводили в верхних 7–10 см (лесная подстилка и верхний слой гумусового горизонта) путем ручного разбора субстрата (без видовой идентификации и дифференциации червей по размерам, а также без учета коконов). Таким образом, оценки касаются всей группы подстилочных и почвенно-подстилочных видов. Карту построили путем пространственных интерполяций в программе Surfer 13 (методом кригинга: точный интерполятор, линейная вариограмма, шаг сетки 0.2 км).
Заселенность КДО беспозвоночными. Ее оценивали на участках, расположенных в 1–2 км к западу от завода, которые по результатам картирования были отнесены к территории “люмбрицидной пустыни” (рис. 1). Провели два обследования: качественные сборы дождевых червей и моллюсков 25 августа 2016 г. в шести валежных стволах, расположенных в пойме малой лесной реки (р. Ельчовка) и прилегающих местах; количественные сборы беспозвоночных 29 августа и 2, 5 и 15 сентября 2016 г. в 10 валежных стволах, найденных вне поймы (рис. 2).
Рис. 1.
Распределение обилия дождевых червей в импактном регионе. Плотность: 1 – 0, 2 – 0.1–1.0, 3 – 1.1–10.0, 4 – >10 экз./м2. 5 – водоемы, 6 – населенные пункты, 7 – временные пробные площади, 8 – участок, на котором оценена заселенность валежных стволов почвенной мезофауной (рис. 2).
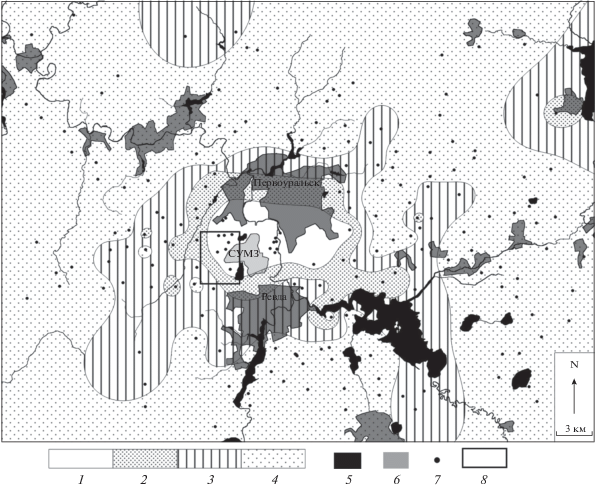
Рис. 2.
Встречаемость дождевых червей и моллюсков вблизи пролегания современной границы “люмбрицидной пустыни”. Положение участка в масштабе импактного региона показано на рис. 1. Маркеры: 1 – временные пробные площади (ПП), на которых оценено обилие дождевых червей (соответствуют точкам на рис. 1), 2 – постоянные ПП для учетов почвенной мезофауны; 3 – валежные стволы, в которых выполнены количественные учеты беспозвоночных; 4 – валежные стволы, в которых выполнены качественные сборы беспозвоночных. Заливка маркера: наличие (черная) или отсутствие (белая) дождевых червей (левая половина) и наземных моллюсков (правая половина). Схема построена на основе спутникового снимка из Google Earth.

В обоих случаях стволы выбирали случайно с учетом следующих критериев:
вида дерева – липа Tilia cordata Mill. или береза Betula pendula Roth или B. pubescens Ehrh.;
диаметра в комлевой части не менее 20 см, длины не менее 3 м (фактический диаметр составил 31.4 ± 8.2 см, среднее ± ошибка, n = 10);
ствола, частично погруженного в подстилку и минеральные горизонты почвы, но не более чем на половину диаметра;
четвертой стадии разложения по 5-балльной шкале (Бергман, Воробейчик, 2017), т.е. когда кора сохранилась частично, древесина расслаивается, с измененным цветом, легко поддается проникновению ножа, но сердцевина ствола относительно крепкая;
отсутствия видимых следов пожара;
отсутствия тотального заселения муравьями хотя бы на участке длиной не менее 2 м.
Для количественных учетов педобионтов аккуратно выпиливали фрагмент ствола длиной ~1 м, измеряли его длину, больший и меньший диаметры (с точностью 1 см); объем фрагмента определяли по формуле для усеченного конуса. Пробы разбирали вручную в два этапа: вначале в полевых условиях на полотне из полиэтилена с помощью ножа и пинцета снимали отстающую кору и отделяли древесные волокна, затем всю древесину складывали в пластиковый пакет и повторно просматривали в лаборатории. В трех стволах сердцевина была очень прочной и ее не разбирали; в этом случае определяли объем только разобранной части (как разницу исходного объема фрагмента и объема сердцевины).
Одновременно отбирали стандартные почвенные пробы размером 20 × 20 см и до глубины встречаемости крупных беспозвоночных (как правило, до 25 см). Часть из них располагали непосредственно в “ложе” ствола (для двух стволов было отобрано по три пробы, для остальных – по одной), часть – на расстоянии 3–5 м от ствола (по одной пробе). Эти пробы отбирали в пластиковые пакеты и вручную разбирали в лаборатории.
Всех найденных беспозвоночных длиной >2 мм фиксировали в 70%-ном спирте (не учитывали муравьев, пустые коконы червей и экзувии). Обилие беспозвоночных рассчитывали с учетом объема разобранного фрагмента ствола и выражали в экз./дм3; в этой же размерности выражено обилие беспозвоночных при учетах почвенными пробами (глубина пробы принята равной 25 см).
Учеты на постоянных пробных площадях. Они были выполнены 11.07–20.08.2014 г. (Воробейчик и др., 2019) и использованы для сравнения с обилием беспозвоночных в КДО. В анализ включили материалы по семи постоянным ПП 10 × 10 м на территории “люмбрицидной пустыни” (рис. 2) и пяти площадям в фоновой зоне (20–30 км к западу от СУМЗ). На каждой ПП было отобрано по 10 проб, размещенных случайно под пологом леса; размер пробы 20 × 20 × 20–30 см. Выборку беспозвоночных (>2 мм) осуществляли вручную в лаборатории, куда пробы доставляли в пластиковых пакетах. Для увеличения точности учетов при отборе и разборе пробы делили на два слоя – лесную подстилку и минеральный горизонт, затем данные по слоям были объединены (в тексте обозначены как “почва”). Обилие беспозвоночных также выражено в экз./дм3 (глубина принята равной 25 см).
Ординацию выполнили методом главных координат по абсолютному обилию таксономических групп с использованием коэффициента Брэя–Кертиса в пакете vegan v.2.4-5 среды R v.3.4.3.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Граница распространения дождевых червей в рассматриваемом районе пролегает на удалении 3–5 км (максимально 10 км) от источника выбросов, оконтуривая территорию “люмбрицидной пустыни” (рис. 1). В настоящее время ее площадь ~65 км2.
В ходе качественных сборов все валежные стволы, приуроченные к пойме малой лесной реки на внешней периферии “любрицидной пустыни”, оказались заселенными дождевыми червями (взрослые особи и коконы) и брюхоногими моллюсками (рис. 2). Черви были представлены Dendrodrilus rubidus tenuis (Eisen, 1874), моллюски – Nesovitrea hammonis (Strøm, 1765), Discus ruderatus (W. Hartmann, 1821), Euconulus fulvus (O.F. Müller, 1774), Zonitoides nitidus (O.F. Müller, 1774), Arion subfuscus (O.F. Müller, 1774).
В стволах вне поймы в ходе количественных учетов моллюски не были обнаружены, но часть стволов оказалась заселена дождевыми червями (также только D. rubidus tenuis). Были найдены как половозрелые, так и ювенильные особи (60%) и коконы. Обилие червей в стволах достигало высоких значений, лишь в 2 раза меньших по сравнению с почвой фоновой зоны (табл. 1). Черви (только половозрелые) и коконы были также обнаружены в почве под стволами, но с минимальными обилием и встречаемостью. В почве возле стволов и на постоянных ПП на территории “люмбрицидной пустыни” черви и моллюски отсутствовали (ближайшее место их обнаружения расположено на 1 км дальше от завода (рис. 2)).
Таблица 1.
Обилие (экз./дм3) и встречаемость (%) беспозвоночных в разных микростациях на загрязненной и фоновой территориях
| Группа (стадия развития) |
Территория (удаление от источника выбросов, км), микростация | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| «люмбрицидная пустыня» (1–2) | фоновая (20–30) | |||||||||
| разлагающаяся древесина (SP = 1, n =10) |
почва под стволом (SP = 1, n = 14) |
почва рядом со стволом (SP = 1, n = 10) | почва на постоянных пробных площадях (SP = 7, n = 70) |
почва на постоянных пробных площадях (SP = 5, n = 50) |
||||||
| X ± SE* [max] | F | X ± SE* [max] | F | X ± SE* [max] | F | X ± SE** [max] | F | X ± SE** [max] | F | |
| Lumbricidae (черви) | 0.50 ± 0.37 [3.5] | 60 | 0.01 ± 0.01 [0.1] | 14 | – | – | – | – | 1.10 ± 0.16 [3.2] | 100 |
| Lumbricidae (p) | 0.75 ± 0.79 [7.5] | 20 | 0.04 ± 0.03 [0.3] | 21 | – | – | – | – | 0.60 ± 0.08 [2.3] | 98 |
| Enchytraeidae | – | – | – | – | – | – | 0.01 ± 0.003 [0.1] | 6 | 4.93 ± 0.63 [21.5] | 100 |
| Aranei | 0.20 ± 0.10 [0.9] | 80 | 0.45 ± 0.14 [2.0] | 93 | 0.49 ± 0.16 [1.5] | 80 | 0.17 ± 0.04 [1.3] | 63 | 1.05 ± 0.19 [3.8] | 100 |
| Opiliones | – | – | – | – | – | – | 0.003 ± 0.002 [0.1] | 3 | 0.05 ± 0.01 [0.3] | 30 |
| Lithobiidae | 0.10 ± 0.05 [0.4] | 70 | 0.11 ± 0.05 [0.5] | 50 | 0.06 ± 0.04 [0.4] | 30 | 0.15 ± 0.08 [1.0] | 44 | 1.09 ± 0.26 [3.3] | 98 |
| Geophilidae | – | – | 0.02 ± 0.02 [0.2] | 14 | 0.01 ± 0.01 [0.1] | 10 | 0.02 ± 0.01 [0.2] | 16 | 0.46 ± 0.11 [2.8] | 98 |
| Diplopoda | – | – | – | – | 0.01 ± 0.01 [0.1] | 10 | 0.01 ± 0.01 [0.4] | 6 | 0.07 ± 0.04 [2.2] | 16 |
| Heteroptera (im + l) | 0.04 ± 0.02 [0.2] | 50 | 0.06 ± 0.03 [0.3] | 35 | 0.02 ± 0.02 [0.2] | 10 | 0.01 ± 0.01 [0.1] | 11 | 0.03 ± 0.01 [0.2] | 24 |
| Coccodea (im + l) | – | – | – | – | – | – | 0.09 ± 0.05 [1.6] | 13 | 0.13 ± 0.06 [2.0] | 40 |
| Lepidoptera (l + p) | 0.02 ± 0.02 [0.2] | 10 | 0.03 ± 0.01 [0.1] | 29 | 0.04 ± 0.04 [0.4] | 10 | 0.02 ± 0.01 [0.2] | 17 | 0.04 ± 0.01 [0.4] | 28 |
| Diptera (l + p) | 0.08 ± 0.04 [0.3] | 70 | 0.11 ± 0.05 [0.6] | 46 | 0.04 ± 0.02 [0.2] | 30 | 0.22 ± 0.07 [1.2] | 60 | 1.34 ± 0.25 [8.0] | 100 |
| Carabidae (im + l) | 0.01 ± 0.01 [0.1] | 20 | 0.04 ± 0.02 [0.2] | 36 | 0.11 ± 0.04 [0.4] | 60 | 0.02 ± 0.01 [0.2] | 14 | 0.11 ± 0.05 [0.8] | 48 |
| Staphylinidae (im + l) | 0.43 ± 0.16 [1.3] | 90 | 0.50 ± 0.09 [1.0] | 100 | 0.40 ± 0.14 [1.3] | 80 | 0.2 ± 0.06 [0.8] | 69 | 0.85 ± 0.07 [1.9] | 100 |
| Elateridae (l + p) | 0.10 ± 0.05 [0.3] | 40 | 0.16 ± 0.05 [0.5] | 57 | 0.05 ± 0.02 [0.2] | 40 | 0.34 ± 0.1 [2.5] | 83 | 0.29 ± 0.04 [1.6] | 88 |
| Прочие Coleoptera (im + l) | 0.16 ± 0.08 [0.7] | 80 | 0.32 ± 0.18 [1.9] | 50 | 0.11 ± 0.07 [0.7] | 40 | 0.16 ± 0.03 [2.0] | 57 | 0.56 ± 0.04 [1.3] | 100 |
| Прочие Insecta | 0.004 ± 0.004 [0.04] | 10 | 0.09 ± 0.03 [0.4] | 43 | 0.02 ± 0.01 [0.1] | 20 | 0.01 ± 0.003 [0.1] | 9 | 0.13 ± 0.05 [0.7] | 62 |
| Mollusca | – | – | – | – | – | – | 0.001 ± 0.002 [0.1] | 1 | 1.34 ± 0.08 [5.1] | 100 |
| Всего | 2.39 ± 1.45 [14.5] | 100 | 1.94 ± 0.32 [4.6] | 100 | 1.36 ± 0.32 [3.0] | 100 | 1.43 ± 0.23 [3.5] | 100 | 14.17 ± 0.83 [29.8] | 100 |
Примечание. Стадии развития: im – имаго, l – личинки, p – коконы или куколки; SP – число пробных площадей (ПП), n – число проб; X – среднее арифметическое, SE – ошибка среднего, max – максимальное значение в пробе, F – встречаемость (доля непустых проб, %); учетные единицы: * – проба, ** – ПП; прочерк – отсутствие группы.
Неравномерность заселения КДО дождевыми червями очень высока: хотя они встречены только в половине стволов, их максимальное обилие сопоставимо с таковым в почве фоновой зоны. Еще более показательна картина для коконов: из 10 обследованных стволов они обнаружены только в двух, но в одном из них обилие превышало максимальное значение в почве фоновой территории в 3 раза. В отличие от загрязненных участков в почве фоновой зоны черви и коконы встречаются практически в каждой пробе.
На территории “люмбрицидной пустыни” в стволах отсутствуют некоторые типичные педобионты (энхитреиды, геофилиды, диплоподы, червецы), хотя с минимальным обилием они зарегистрированы в почве на постоянных ПП. Обилие в стволах других групп сопоставимо с таковым в почве на постоянных ПП, но существенно ниже фоновых значений.
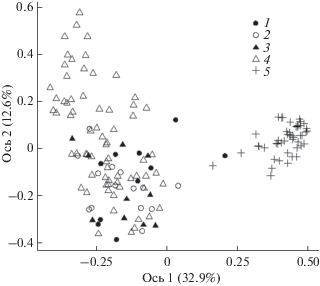
Две первые главные координаты объясняют около половины изменчивости состава мезофауны на уровне крупных таксонов (рис. 3). В большинстве случаев населения КДО и почвы загрязненных участков сходны между собой, но в двух стволах приближены к таковым в почве фоновой зоны. На территории “люмбрицидной пустыни” пробы почвы под стволами, рядом с ними и на ПП образуют единое облако, которое четко отделено от фоновой зоны.
Рис. 3.
Ординация проб в пространстве первой и второй главной координат (в скобках приведена доля объясняемой дисперсии). Участки и микростации: 1 – внутри стволов, 2 – почва под стволами, 3 – почва рядом со стволами, 4 – почва на постоянных пробных площадях на территории “люмбрицидной пустыни”, 5 – почва на фоновой территории.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хотя наш подход к картированию не учитывает сезонную и межгодовую изменчивость обилия дождевых червей, грубость использованной шкалы в значительной степени нивелирует влияние этих факторов на итоговую картину распространения рассматриваемой группы в районе воздействия СУМЗ. На рис. 1 хорошо виден градиентный характер снижения обилия червей по мере приближения к заводу: области с высокими значениями обилия на периферии района сменяются участками со средним и низким обилием, которые затем переходят в “люмбрицидную пустыню”. Такой характер распределения червей фактически визуализирует основную причину их исчезновения в рассматриваемом районе – трансформацию среды обитания под воздействием выбросов медеплавильного завода, в первую очередь за счет приобретения субстратами высокой токсичности. Снижение обилия дождевых червей типично для загрязненных районов, но не во всех случаях завершается их исчезновением (Bengtsson et al., 1983; Spurgeon, Hopkin, 1996). Образование вблизи СУМЗ обширной “люмбрицидной пустыни” вероятнее всего связано с сочетанным действием длительного загрязнения почвы тяжелыми металлами и ее подкисления (Воробейчик, 1998).
Вопрос о механизмах реколонизации – один из ключевых в анализе устойчивости экосистем (Bengtsson, 2002). Идея о том, что заселение нарушенной территории происходит не только с прилегающих ненарушенных участков, но также из находящихся внутри нее микросайтов, неоднократно возникала в разных предметных областях. В теории метапопуляций система объединенных донорно-акцепторными связями микроместообитаний обеспечивает стабильность популяции за счет быстрых репарационных процессов (Hanski, 1999). В палеоэкологии и биогеографии концепция микрорефугиумов объясняет “моментальное” в историческом масштабе времени расселение на обширных территориях видов, исчезнувших на них в ходе оледенений (Rull, 2009). Сходная концепция перфугиумов – случайно сохранившихся при лесных пожарах фрагментов биотопов – предложена как механизм быстрого постпирогенного восстановления почвенной фауны (Гонгальский, 2014). По аналогии с этими воззрениями мы и предположили существование “микросайтов выживания” на дефаунированной в результате загрязнения территории, которые могут обусловить ее реколонизацию в случае снижения токсичности субстратов. Специфика таких микросайтов по сравнению, в частности, c перфугиумами определяется неслучайным характером микросайтов и значительной длительностью их существования.
Насколько нам известно, заселенность КДО почвенными беспозвоночными никогда специально не изучали для районов, подверженных воздействию промышленных выбросов. Наша работа, безусловно, носит рекогносцировочный и в большей степени качественный, а не количественный характер. Тем не менее ее результаты важны, поскольку впервые свидетельствуют об обитании наиболее чувствительных к загрязнению таксонов почвенных беспозвоночных (по крайней мере, на уровне группы) далеко за пределами техногенной границы их распространения, на территории с экстремально высокими концентрациями тяжелых металлов. О принципиальной возможности реализации обсуждаемого механизма реколонизации свидетельствуют находки, пусть и единичные, червей и коконов не только в валежных стволах, но и в почве под ними.
С одной стороны, полученные результаты неожиданны, поскольку дождевые черви были обнаружены на территории, которую по результатам стандартных почвенно-зоологических обследований всегда относили к “люмбрицидной пустыне” (Воробейчик, 1998; Воробейчик и др., 2012, 2019). С другой стороны, обитание почвенных беспозвоночных внутри разлагающихся стволов деревьев хорошо известно (Harmon et al., 1986; Гончаров и др., 2015; Гераськина, 2016). Заселение КДО типичными педобионтами происходит вследствие как бóльших трофических ресурсов из-за развития в них грибного мицелия, так и более стабильного режима температуры и влажности по сравнению с таковыми в верхних слоях почвы (Harmon et al., 1986). Последнее особенно важно на сильно загрязненных территориях, где велика контрастность микроклимата (Kozlov, Zvereva, 2007).
На загрязненных участках могут быть и специфические причины преимущественного обитания педобионтов в КДО. Низкие концентрации тяжелых металлов в живой древесине даже в условиях загрязнения (Копцик и др., 2008), экранирующее действие коры и высокое содержание дефрагментированного органического вещества позволяют предположить меньшее содержание металлов в КДО или по крайней мере их меньшую токсичность по сравнению с таковыми в лесной подстилке и минеральных горизонтах почвы. К сожалению, для сильно загрязненных территорий отсутствуют прямые сопоставления содержания металлов в КДО и в почве. Хотя в условиях загрязнения концентрации металлов в КДО могут быть несколько выше фоновых (Esenin, Ma, 2000), их содержание явно существенно меньше, чем в подстилке.
Обнаруженный в стволах вид червя D. rubidus tenuis – типичный обитатель мертвой древесины, о чем даже свидетельствует его латинское родовое и одно из английских тривиальных названий (tree worm). В северной тайге на Урале он с одинаково высоким обилием встречается как в КДО, так и в почве (Гераськина, 2016); в нашем районе в почве он встречается редко (Воробейчик и др., 2012). Пока не ясно, могут ли заселять КДО на загрязненных участках другие местные виды, для которых характерно обитание в мертвой древесине, в частности Dendrobaena octaedra (Savigny, 1826) и Lumbricus rubellus Hoffmeister, 1843. Такая же неопределенность существует и в отношении доминирующего в нашем районе почвенно-подстилочного Perelia diplotetratheca (Perel, 1976), который в северной тайге также встречен в мертвой древесине (Гераськина, 2016).
Известно, что D. rubidus tenuis относительно толерантен к действию металлов и металлоидов: это показано для Cu (Arnold et al., 2008), As (Langdon et al., 2003), Ni (Płytycz et al., 2010) и Pb (Terhivuo et al., 1994). Впрочем, отмеченные другими авторами переносимые концентрации, например для Cu 790 мкг/г почвы (Arnold et al., 2008), существенно меньше зарегистрированных вблизи рассматриваемого нами источника выбросов. Для этого вида продемонстрировано относительно быстрое приобретение резистентности к металлам (Arnold et al., 2008; Płytycz et al., 2010). Другие свойства D. rubidus tenuis, которые могут объяснять успешное заселение им КДО на загрязненной территории, – способность к партеногенетическому размножению, широкий спектр занимаемых биотопов и микростаций, космополитное распространение (Гераськина, 2016). Обсуждаемый вид даже может обитать в куполообразных муравейниках, причем защиту от поедания муравьями ему обеспечивает репеллентное действие слизи (Laakso, Setälä, 1997); соответственно, такой механизм можно предположить и в отношении совместного обитания с муравьями в КДО. Впрочем, все, что касается толерантности к токсикантам и экологической пластичности D. rubidus tenuis, можно отнести и к видам D. octaedra и L. rubellus, которые, однако, не были обнаружены нами в стволах на территории “люмбрицидной пустыни”. Поэтому пока не ясны причины успеха именно и только D. rubidus tenuis.
Разнообразие моллюсков в КДО (5 видов, включая 1 вид слизня), было больше зарегистрированного нами ранее в стандартных почвенных пробах в 4 км от завода (3 вида), но меньше, чем в 7 км (6 видов) и в 20–30 км (11 видов) (Воробейчик и др., 2012). Большинство обитающих в стволах видов ранее были отмечены и в почвенных пробах: в 4 км (N. hammonis, D. ruderatus, E. fulvus) или в 7 км (слизень A. subfuscus) от завода (Воробейчик и др., 2012). Только Z. nitidus, предпочитающий влажные местообитания, ранее не встречался в почвенных пробах, но был зарегистрирован в травостое в 4 км от завода (Нестерков, 2013).
Высокая неравномерность заселения КДО червями, как и в целом неоднородность состава мезофауны стволов, может быть следствием многих причин. Возможными источниками изменчивости могут быть положение ствола в микрорельефе и характер биотического окружения, его возраст, степень фрагментации, физические и химические свойства, включая кислотность и токсичность, присутствие других дереворазрушающих агентов и т.д. Сильная пространственная неоднородность типична для загрязненных территорий. В частности, она показана для почвенной микрофлоры (Воробейчик, 2007; Mikryukov et al., 2015), травянистых растений (Трубина, Воробейчик, 2012), мелких млекопитающих (Мухачева и др., 2012). Однако вопрос о том, какие именно факторы детерминируют обилие педобионтов в КДО, пока открыт.
Также открыт вопрос о возможных путях заселения КДО дождевыми червями, который на данном этапе можно обсуждать лишь умозрительно. Хотя скорость разложения мертвой древесины сильно варьирует (Harmon et al., 1986), частично захороненные в почве крупные стволы на последних стадиях разложения могут сохраняться в течение нескольких столетий (McFee, Stone, 1966). Наши косвенные данные свидетельствуют о торможении деструкции древесины на загрязненных территориях (Бергман, Воробейчик, 2017). Исходя из этого, не столь фантастично предположение о заселении КДО дождевыми червями до начала активной деятельности завода (т.е. >75 лет назад). Другой возможный сценарий – неоднократные заселения в относительно недавнее время благодаря активной или пассивной миграции червей с менее загрязненных участков. Известно, что почвенные беспозвоночные, в том числе дождевые черви, могут активно избегать участки с локально повышенным уровнем загрязнения (Lukkari, Haimi, 2005; Gongalsky et al., 2009), на чем даже базируются экотоксикологические тесты (Kim et al., 2017). В этом случае КДО могут быть своеобразными “островками безопасности”, агрегирующими беспозвоночных с прилегающих пространств. Кроме того, возможна пассивная миграция червей и моллюсков с водотоками в периоды избыточного увлажнения. Нельзя исключить также и потенциальную возможность форезии птицами, значительная роль которой в распространении почвенных беспозвоночных была продемонстрирована не только для микроартропод (Лебедева, Криволуцкий, 2003), но и для ряда групп мезофауны (Матюхин, 2004).
ЗАКЛЮЧЕНИЕ
На сильно загрязненных участках вблизи завода дождевые черви и моллюски могут заселять валежные стволы на поздних стадиях разложения, хотя в лесной подстилке и минеральных горизонтах почвы в этих условиях они отсутствуют. Тем самым подтверждена наша гипотеза о существовании на территории “люмбрицидной пустыни” “микросайтов выживания”, что может рассматриваться как один из возможных механизмов реколонизации загрязненных участков в случае сокращения выбросов и последующего снижения токсичности почвы.
Обычно почвенные зоологи “проходят мимо” нетипичных микростаций педобионтов. Когда же спектр обследуемых микростаций расширяется, существенно дополняются представления о разнообразии и структуре сообществ почвенных беспозвоночных. Еще более справедливо для почвенно-зоологических исследований на загрязненных территориях то, что расширение спектра обследуемых микростаций не только дополняет, но и сильно меняет устоявшиеся представления о функционировании почвенной фауны в экстремальных местообитаниях.
Результаты нашей работы в большей степени носят качественный, а не количественный характер, а вопросов в ходе ее выполнения возникло больше, чем получено ответов. Тем не менее мы считаем результаты важными, поскольку продемонстрирована принципиальная возможность обитания чувствительных к загрязнению групп педобионтов на участках с экстремально высоким содержанием поллютантов. Очевидна перспективность дальнейшего изучения закономерностей микростациального распределения почвенных беспозвоночных на загрязненных территориях.
Мы признательны А.В. Нестеркову за помощь при проведении полевых работ, Е.В. Головановой за определение дождевых червей, В.С. Микрюкову, О.В. Дуле, М.Р. Трубиной и К.Б. Гонгальскому за обсуждение и комментарии к тексту рукописи. Материал собран в рамках государственного задания Института экологии растений и животных УрО РАН, анализ данных и подготовка рукописи завершены при финансовой поддержке РФФИ (грант 18–04–00160).
Список литературы
Бельская Е.А., Золотарев М.П. Размерная структура сообществ жужелиц в природных и техногенно трансформированных лесных экосистемах // Экология. 2017. № 2. С. 107–115.
Бергман И.Е., Воробейчик Е.Л. Влияние выбросов медеплавильного завода на формирование запаса и разложение крупных древесных остатков в елово-пихтовых лесах // Лесоведение. 2017. № 1. С. 24–38.
Воробейчик Е.Л. Население дождевых червей (Lumbricidae) лесов Среднего Урала в условиях загрязнения выбросами медеплавильных комбинатов // Экология. 1998. № 2. С. 102–108.
Воробейчик Е.Л. Сезонная динамика пространственного распределения целлюлозолитической активности почвенной микрофлоры в условиях атмосферного загрязнения // Экология. 2007. № 6. С. 427–437.
Воробейчик Е.Л., Кайгородова С.Ю. Многолетняя динамика содержания тяжелых металлов в верхних горизонтах почв в районе воздействия медеплавильного завода в период снижения его выбросов // Почвоведение. 2017. № 8. С. 1009–1024.
Воробейчик Е.Л., Нестеркова Д.В. Техногенная граница распространения крота в районе воздействия медеплавильного завода: смещение в период сокращения выбросов // Экология. 2015. № 4. С. 308–312.
Воробейчик Е.Л., Пищулин П.Г. Промышленное загрязнение снижает роль деревьев в формировании структуры полей концентраций тяжелых металлов в лесной подстилке // Экология. 2016. № 5. С. 323–334.
Воробейчик Е.Л., Ермаков А.И., Гребенников М.Е. Начальные этапы восстановления сообществ почвенной мезофауны после сокращения выбросов медеплавильного завода // Экология. 2019. № 2. С. 133–148.
Воробейчик Е.Л., Ермаков А.И., Золотарев М.П., Тунева Т.К. Изменение разнообразия почвенной мезофауны в градиенте промышленного загрязнения // Rus. Entomol. J. 2012. V. 21. № 2. P. 203–218.
Воробейчик Е.Л., Трубина М.Р., Хантемирова Е.В., Бергман И.Е. Многолетняя динамика лесной растительности в период сокращения выбросов медеплавильного завода // Экология. 2014. № 6. С. 448–458.
Гераськина А.П. Население дождевых червей (Lumbricidae) в основных типах темнохвойных лесов Печоро-Илычского заповедника // Зоол. журн. 2016. Т. 95. № 4. С. 394–405.
Гонгальский К.Б. Лесные пожары и почвенная фауна. М.: КМК, 2014. 169 с.
Гончаров А.А., Храмова Е.Ю., Алейников А.А. Роль микромозаичной организации лесных экосистем в формировании структуры почвенной мезофауны на примере пихто-ельника высокотравного в верховьях реки Печора // Труды Печоро-Илычского заповедника. Сыктывкар: Коми НЦ УрО РАН, 2015. С. 62–68.
Ермаков А.И. Изменение структуры населения жужелиц лесных экосистем под действием токсической нагрузки // Экология. 2004. № 6. С. 450–455.
Кайгородова С.Ю., Воробейчик Е.Л. Трансформация некоторых свойств серых лесных почв под действием выбросов медеплавильного комбината // Экология. 1996. № 3. С. 187–193.
Копцик Г.Н., Лукина Н.В., Копцик С.В., Щербенко Т.А., Ливанцова С.Ю. Поглощение макроэлементов и тяжелых металлов елью при атмосферном загрязнении на Кольском полуострове // Лесоведение. 2008. № 2. С. 3–12.
Коркина И.Н., Воробейчик Е.Л. Индекс форм гумуса – перспективный инструмент для экологического мониторинга // Экология. 2016. № 6. С. 434–440.
Крамаренко С.С. Активная и пассивная миграция наземных моллюсков: обзор // Ruthenica. 2014. V. 24. № 1. P. 1–14.
Лебедева Н.В., Криволуцкий Д.А. Распространение почвенных микроартропод птицами на островах Арктики // Докл. РАН. 2003. Т. 391. № 1. С. 138–141.
Матюхин А.B. Эктопаразиты птиц в условиях мегаполиса: Автореф. дис. канд. биол. наук. М.: Ин-т паразитологии РАН, 2004. 21 с.
Михайлова И.Н. Начальные этапы восстановления сообществ эпифитных лишайников после снижения выбросов медеплавильного завода // Экология. 2017. № 4. С. 277–281.
Мухачева С.В., Давыдова Ю.А., Воробейчик Е.Л. Роль гетерогенности среды в сохранении биоразнообразия мелких млекопитающих в условиях промышленного загрязнения // Докл. РАН. 2012. Т. 447. № 1. С. 106–109.
Нестерков А.В. Реакция моллюсков луговых сообществ на выбросы Среднеуральского медеплавильного завода // Сиб. экол. журн. 2013. № 6. С. 891–899.
Трубина М.Р., Воробейчик Е.Л. Сильное промышленное загрязнение увеличивает β-разнообразие растительных сообществ // Докл. РАН. 2012. V. 442. № 1. С. 139–141.
Arnold R.E., Hodson M.E., Langdon C.J. A Cu tolerant population of the earthworm Dendrodrilus rubidus (Savigny, 1862) at Coniston Copper Mines, Cumbria, UK // Environ. Pollut. 2008. V. 152. № 3. P. 713–722.
Bengtsson G., Nordstrom S., Rundgren S. Population density and tissue metal concentration of Lumbricids in forest soils near a brass mill // Environ. Pollut. Ser. A. 1983. V. 30. № 2. P. 87–108.
Bengtsson J. Disturbance and resilience in soil animal communities // Eur. J. Soil Biol. 2002. V. 38. № 2. P. 119–125.
Dudka S., Adriano D.C. Environmental impacts of metal ore mining and processing: a review // J. Environ. Quality. 1997. V. 26. № 3. P. 590–602.
Eijsackers H. Earthworms as colonizers of natural and cultivated soil environments // Appl. Soil Ecol. 2011. V. 50. № 1. P. 1–13.
Esenin A.V., Ma W.C. Heavy metals (Cd, Cu, Zn) in wood and wood-feeding insects and other invertebrates associated with decaying pine trees // Bull. Environ. Contam. Toxicol. 2000. V. 64. № 2. P. 242–249.
Gongalsky K.B., Belorustseva S.A., Kuznetsova D.M., Matyukhin A.V., Pelgunova L.A., Savin F.A., Shapovalov A.S. Spatial avoidance of patches of polluted chernozem soils by soil invertebrates // Insect Sci. 2009. V. 16. № 1. P. 99–105.
Hanski I. Habitat connectivity, habitat continuity, and metapopulations in dynamic landscapes // Oikos. 1999. V. 87. № 2. P. 209–219.
Harmon M.E., Franklin J.F., Swanson F.J., Sollins P., Gregory S.V., Lattin J.D., Anderson N.H., Cline S.P., Aumen N.G., Sedell J.R., Lienkaemper G.W., Cromack Jr.K., Cummins K.W. Ecology of coarse woody debris in temperate ecosystems // Adv. Ecol. Res. 1986. V. 15. P. 133–302.
Kim S.W., Kim D., Moon J., Chae Y., Kwak J.I., Park Y., Jeong S.W., An Y.J. Earthworm dispersal assay for rapidly evaluating soil quality // Environ. Toxicol. Chem. 2017. V. 36. № 10. P. 2766–2772.
Korkina I.N., Vorobeichik E.L. Humus Index as an indicator of the topsoil response to the impacts of industrial pollution // Appl. Soil Ecol. 2018. V. 123. P. 455–463.
Kozlov M.V., Zvereva E.L. Industrial barrens: Extreme habitats created by non-ferrous metallurgy // Rev. Environ. Sci. Biotechnol. 2007. V. 6. № 1–3. P. 231–259.
Laakso J., Setälä H. Nest mounds of red wood ants (Formica aquilonia): hot spots for litter-dwelling earthworms // Oecologia. 1997. V. 111. № 4. P. 565–569.
Langdon C.J., Piearce T.G., Feldmann J., Semple K.T., Meharg A.A. Arsenic speciation in the earthworms Lumbricus rubellus and Dendrodrilus rubidus // Environ. Toxicol. Chem. 2003. V. 22. № 6. P. 1302–1308.
Lukkari T., Haimi J. Avoidance of Cu- and Zn-contaminated soil by three ecologically different earthworm species // Ecotoxicol. Environ. Safety. 2005. V. 62. № 1. P. 35–41.
McFee W.W., Stone E.L. The persistence of decaying wood in the humus layers of northern forests // Soil Sci. Soc. Am. J. 1966. V. 30. № 4. P. 513–516.
Mikryukov V.S., Dulya O.V. Contamination-induced transformation of bacterial and fungal communities in spruce-fir and birch forest litter // Appl. Soil Ecol. 2017. V. 114. P. 111–122.
Mikryukov V.S., Dulya O.V., Vorobeichik E.L. Diversity and spatial structure of soil fungi and arbuscular mycorrhizal fungi in forest litter contaminated with copper smelter emissions // Water, Air, Soil Pollut. 2015. V. 226. № 4. Art. 114. P. 1–14.
Pacyna J.M., Pacyna E.G., Aas W. Changes of emissions and atmospheric deposition of mercury, lead, and cadmium // Atmos. Environ. 2009. V. 43. № 1. P. 117–127.
Płytycz B., Kielbasa E., Grebosz A., Duchnowski M., Morgan A.J. Riboflavin mobilization from eleocyte stores in the earthworm Dendrodrilus rubidus inhabiting aerially-contaminated Ni smelter soil // Chemosphere. 2010. V. 81. № 2. P. 199–205.
Rull V. Microrefugia // J. Biogeogr. 2009. V. 36. № 3. P. 481–484.
Spurgeon D.J., Hopkin S.P. The effects of metal contamination on earthworm populations around a smelting works: Quantifying species effects // Appl. Soil Ecol. 1996. V. 4. № 2. P. 147–160.
Terhivuo J., Pankakoski E., Hyvarinen H., Koivisto I. Pb uptake by ecologically dissimilar earthworm (Lumbricidae) species near a lead smelter in south Finland // Environ. Pollut. 1994. V. 85. № 1. P. 87–96.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


