Известия РАН. Серия биологическая, 2020, № 3, стр. 259-265
Содержание метаболитов оксида азота и уровень транскриптов генов NOS2 и NOS3 у пациентов с эссенциальной артериальной гипертензией
Л. В. Топчиева 1, *, О. В. Балан 1, В. А. Корнева 2, И. Е. Малышева 1, К. А. Панкрашова 2
1 Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
185910 Петрозаводск, ул. Пушкинская, 11, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Петрозаводский государственный университет”
185910 Петрозаводск, просп. Ленина, 33, Россия
* E-mail: topchieva67@mail.ru
Поступила в редакцию 03.04.2018
После доработки 16.05.2018
Принята к публикации 08.06.2018
Аннотация
Показано, что содержание метаболитов оксида азота в плазме крови людей с эссенциальной артериальной гипертензией (ЭАГ) значительно выше, чем у здоровых доноров. Отмечено, что данная закономерность не зависела от стадии заболевания, но зависела от возраста испытуемых, а также от того, принимают или не принимают больные кардиоселективные блокаторы β-адренорецепторов. Установлено, что повышение содержания нитритов и нитратов в крови пациентов с ЭАГ сопровождалось увеличением уровня транскриптов гена NOS2 в лейкоцитах периферической крови (ЛПК), при этом содержание мРНК гена NOS3 в ЛПК больных людей было несколько ниже, чем этот показатель у здоровых доноров.
Оксид азота − один из основных биологических медиаторов, который вовлечен во множество физиологических и патофизиологических процессов в организме (Lowenstein et al., 1994; Mоkuno et al., 2001; Levy et al., 2009; Förstermann, Sessa, 2012). Прежде всего это важный сосудорасширяющий фактор. Участвуя в регуляции функций эндотелия и защите сосудов от атеросклеротического повреждения (Förstermann, Sessa, 2012), в физиологических условиях оксид азота ингибирует адгезию и агрегацию тромбоцитов, а также пролиферацию гладкомышечных клеток сосудов. При заболеваниях, сопровождающихся повышением кровяного давления, таких как диабет и гипертензия, наблюдается ухудшение эндотелийзависимых дилататорных функций, что может быть обусловлено снижением доступности базального NO в сосудах кровяного русла (Levy et al., 2009). Биодоступность оксида азота определяется в основном тремя факторами: уровнем его продукции, инактивацией активными формами кислорода, в частности супероксид-радикалом, и чувствительностью ткани-мишени. Основная причина снижения биодоступности этого важного вазодилататора − его утилизация при взаимодействии с супероксид-радикалом или другими активными формами кислорода, которые генерируются в большом количестве при ряде сердечно-сосудистых патологий (Levy et al., 2009). В то же время в других работах показано, что гипертензия может сопровождаться изменением активности аргиназы, способствующей снижению базальной и стимулированной продукции NO (Heusch et al., 2010). К сожалению, анализ опубликованных ранее данных пока не позволяет однозначно ответить на вопрос: как изменяется уровень оксида азота в сосудах при артериальной гипертензии? В некоторых работах показано как снижение содержания метаболитов оксида азота, так и его значительное повышение в крови больных с артериальной гипертензией (Lyamina et al., 2003; Higashino et al., 2007; Люсов и др., 2011).
Синтез оксида азота катализируется тремя изоформами синтазы оксида азота: нейрональной (NOS1/nNOS), индуцибельной (NOS2/iNOS), эндотелиальной (NOS3/eNOS). Наиболее важный фермент для продукции оксида азота в сосудах − эндотелиальная синтаза оксида азота. При гипертензии содержание NOS3 по одним данным снижается (Crabos et al., 1997; Bauersachs et al., 1998), по другим − повышается (Rush et al., 2005). В то же время эндотелийзависимая дилатация может сохраняться у нокаутных по гену eNOS (eNOS−/−) мышей (Godecke et al., 1998), что свидетельствует о включении компенсаторных механизмов регуляции тонуса сосудов у этих животных. Потеря продукции монооксида азота, синтезируемого посредством NOS3, может быть компенсирована за счет оксида азота, синтез которого катализируется другими изоформами NO-синтазы, NOS1 и NOS2. Экспрессия NOS2 не обнаруживается в сосудистой системе в нормальных физиологических условиях и, вероятно, не участвует в регуляции базального уровня сосудистого тонуса и давления крови (de Vera et al., 1996). Однако при ряде патологий, когда усиливается выработка провоспалительных белков, например фактора некроза опухоли (TNFα), можно наблюдать индукцию экспрессии гена NOS2 и повышение содержания кодируемого им белка (Förstermann, Sessa, 2012). В то же время данные об изменении содержания и активности NOS2 при развитии гипертензии противоречивы. В одних исследованиях зарегистрировано повышение содержания и активности этого белка в разных тканях, в том числе и в миокарде у крыс со спонтанной гипертензией (SHR) (Vaziri et al., 2000). В других работах не обнаружено различий в активности данного фермента в нормальных физиологических условиях и при экспериментально вызванной гипертонии (Nava et al., 1995; Piech et al., 2002). Таким образом, роль индуцибельной NOS в изменении продукции NO при гипертензии до конца не понятна.
Цель работы − изучение содержания нитритов и нитратов оксида азота, а также анализ экспрессии генов, кодирующих индуцибельную (NOS2) и эндотелиальную (NOS3) формы NO-синтазы у людей с эссенциальной артериальной гипертензией (ЭАГ).
МАТЕРИАЛЫ И МЕТОДЫ
В качестве материала для исследований использовали образцы венозной крови пациентов с диагнозом ЭАГ (I−II стадии и III стадия с ишемической болезнью сердца (ИБС)), а также доноров контрольной группы. Диагноз ЭАГ был установлен врачами (Больница скорой медицинской помощи г. Петрозаводска) с учетом клинических рекомендаций Всероссийского научного общества кардиологов (Диагностика…, 2010). Обследование доноров, включенных в дальнейшем в контрольную группу, проводилось также врачами этой больницы в ходе диспансеризации. Критерии исключения из исследования: наличие сахарного диабета, перенесенные в последний месяц инфекционно-воспалительные заболевания, курение табака, беременность и лактация, алкогольная зависимость, индекс массы тела ≥28 кг/м2.
Определение содержания метаболитов NO (NOx) в плазме крови. Для определения нитритов и нитратов использовано 167 образцов плазмы крови. В контрольную группу вошло 49 доноров: 40 – возрастом 37 ± 0.57 и 9 возрастом 53 ± 0.46 года. Группа пациентов с ЭАГ (I−II стадии) включала в себя 58 человек: 25 – возрастом 35 ± 1.02; 33 – возрастом 55 ± 0.47 года. Группу пациентов с ЭАГ (III стадия) и ИБС составили 36 доноров, средний возраст которых 57 ± 1.5 лет. Здесь и далее возраст доноров представлен в виде средних значений и ошибки среднего. Возраст доноров в группах сравнения статистически не различался. Отдельно анализировали содержание метаболитов оксида азота (NOx) в плазме крови пациентов с ЭАГ возрастом от 20 до 45 лет, принимающих кардиоселективные блокаторы β1-адренорецепторов без внутренней симпатомиметическая активности (ВСМА) (метапролол, бисопролол) (24 человека), и больных на гипотензивной терапии без этих препаратов (18 человек). Плазму крови подвергали депротеинизации 96%-ным этиловым спиртом в соотношении 1 : 2. Уровень метаболитов NO, т.е. суммарную концентрацию нитратов $\left( {{\text{NO}}_{3}^{ - }} \right)$ и нитритов $\left( {{\text{NO}}_{2}^{ - }} \right)$, определяли колориметрическим методом по развитию окраски в реакции диазотирования нитритом сульфаниламида, входящего в состав реактива Грисса (Ленреактив, Россия) (Метельская, Гуманова, 2005). Поскольку реактив Грисса, с помощью которого проводятся определения, позволяет детектировать только нитрит-ион, необходимым условием анализа был перевод нитрата в нитрит-ион. Для этого к 100 мкл образца депротеинизированной плазмы добавляли 1−2 гранулы металлического цинка (Ленреактив) и 100 мкл реактива Грисса. Смесь инкубировали 30 мин при 37°С. Каждый раствор серии готовили в трех повторностях. Оптическую плотность раствора измеряли при λ = 540 нм на микропланшетном ридере CLARIOstar (BMGLabtech, США). Содержание NOx рассчитывали по калибровочной кривой.
Синтез комплементарной ДНК (кДНК) и полимеразная цепная реакция с обратной транскрипцией (ОT-ПЦР). Для определения уровня транскриптов генов NOS2 и NOS3 был использован 21 образец крови доноров с диагнозом ЭАГ (III стадия) возрастом 45.46 ± 2.3 года и 16 образцов крови доноров контрольной группы возрастом 41.75 ± 3.9 года.
Тотальную РНК (тотРНК) выделяли из лейкоцитов периферической крови (ЛПК) с помощью набора Extract RNA (Евроген, Россия). ЛПК выделяли из цельной крови методом, основанным на способности изотонического раствора хлорида аммония гемолизировать эритроциты. Количество и качество тотРНК определяли методом капиллярного электрофореза на системе Experion (Bio-Rad, США). тотРНК обрабатывали ДНКазой (1 ед. акт.) (СибЭнзим, Россия). Для синтеза первой цепи использовали набор MMLVRT kit (Евроген). Количество и качество выделенной комплементарной ДНК определяли спектрофотометрически на приборе SmartSpecPlus (Bio-Rad). Уровень экспрессии гена NOS2 оценивали с помощью ПЦР в режиме реального времени на приборе iCycler с оптической приставкой iQ5 (Bio-Rad). В качестве референсного гена использовали ген Glyceraldehyde 3-phosphate dehydrogenase (GAPDH). Праймеры (Евроген) для проведения ПЦР представлены в табл. 1. Смесь для ПЦР объемом 25 мкл содержала 50 нг кДНК, по 0.2 мкМ прямого и обратного праймеров, 5 мкл реакционной смеси Screen-Mix (Евроген) и 16 мкл деионизованной свободной от нуклеаз воды. Протокол ПЦР: денатурация кДНК 5 мин при 95°С; 40 циклов: денатурация при 95°С 30 с; отжиг при 60°С 30 с; элонгация при 72°С 30 с. Специфичность продуктов амплификации проверяли плавлением ПЦР-фрагментов. Эффективность ПЦР (98%) оценивали по стандартной кривой. Уровень транскриптов генов вычисляли по формуле: уровень транскриптов = 2^Ct (референсный) – Ct(тестовый образец), где Ct – значение пороговых циклов. ПЦР повторяли не менее 3 раз.
Таблица 1.
Праймеры для проведения полимеразной цепной реакции в режиме реального времени
| Ген | Праймер | Нуклеотидная последовательность праймера 5'…3' |
|---|---|---|
| NOS3 | Прямой | GCTGGTACATGAGTTCAGAGATTG |
| Обратный | TTCCACCGCTGCCTTGTC | |
| NOS2 | Прямой | GTGGTCCAACCTGCAGGTCT |
| Обратный | CATAGCGGATGAGCTGAGCATT | |
| GAPDH | Прямой | GAAGGTGAAGGTCGGAGTC |
| Обратный | GAAGATGGTGATGGGATTTC |
Статистическую обработку данных проводили c использованием программного обеспечения StatGraphics 2.1. Для оценки различий в содержании метаболитов оксида азота и транскриптов генов в группе здоровых доноров и пациентов с ЭАГ применялся U-критерий Манна−Уитни−Вилкоксона (р ≤ 0.05 было принято как статистически значимое). В таблицах и на рис. 1 данные представлены в виде средних значений с указанием среднеквадратичной ошибки.
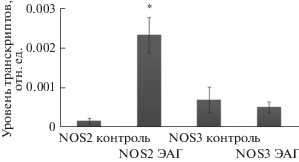
Рис. 1.
Относительный уровень транскриптов генов NOS2 и NOS3 в лейкоцитах периферической крови здоровых людей (контроль) и больных ЭАГ (III стадия) + ИБС. * – различия значимы (p < 0.05) по сравнению с контролем.
Исследования были выполнены на оборудовании центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Показано, что содержание метаболитов оксида азота в плазме крови пациентов с ЭАГ достоверно выше, чем в плазме здоровых доноров (табл. 2, 3). Суммарная концентрация нитритов и нитратов в плазме крови с возрастом изменялась в контрольной группе, но не в группе пациентов с ЭАГ. У пациентов с ЭАГ возрастом 20−45 лет содержание нитритов и нитратов в плазме крови было существенно выше, чем у здоровых людей того же возраста (р = 0.007) (табл. 2). Однако у лиц старше 45 лет в контрольной группе и группе больных существенных различий в концентрации NOx не было обнаружено (р = 0.26). В возрастной группе 20−45 лет высокое содержание метаболитов оксида азота по сравнению с контрольной группой было отмечено у пациентов как с ЭАГ (I−II стадии), так и с ИБС и III стадией гипертонии (р = 0.001 и 0.003 соответственно). Однако содержание NOx в плазме крови больных с разной тяжестью заболевания было одинаковым (р = 0.7) (табл. 3). Аналогичные данные были получены и для больных возрастом старше 45 лет (р = 0.08).
Таблица 2.
Содержание метаболитов оксида азота NOx в плазме крови здоровых людей и пациентов с эссенциальной артериальной гипертензией (ЭАГ) (I−II стадии) в зависимости от возраста
| Возрастная группа | Группа | Содержание NOx, мкмоль/л | |||
|---|---|---|---|---|---|
| среднее значение | min | max | медиана | ||
| 20−45 лет | Контроль (N = 40) |
34.95 ± 2.30 | 18.08 | 66.87 | 31.19 |
| ЭАГ (N = 25) |
68.06 ± 8.16* | 25.32 | 190.39 | 57.64 | |
| Старше 45 лет | Контроль (N = 9) |
70.20 ± 10.38* | 44.66 | 197.51 | 62.61 |
| ЭАГ (N = 33) |
58.04 ± 2.15* | 38.06 | 76.47 | 56.78 | |
Примечание. * – различия значимы (p < 0.05) при сравнении с контрольной группой возрастом 20−40 лет. N – число обследованных лиц; для табл. 2 и 3.
Таблица 3.
Содержание метаболитов оксида азота NOx в плазме крови пациентов с эссенциальной артериальной гипертензией (ЭАГ)
| Возрастная группа | Группы | Содержание NOx, мкМ/мл | |||
|---|---|---|---|---|---|
| среднее | min | max | медиана | ||
| 20−45 лет | ЭАГ (I−II стадии) (N = 25) |
72.79 ± 10.85 | 25.32 | 190.39 | 64.15 |
| ЭАГ (III стадия) + ИБС (N = 13) |
56.22 ± 2.53 | 47.57 | 71.62 | 52.85 | |
| Старше 45 лет | ЭАГ (I–II стадии) (N = 10) |
72.2 ± 2.71 | 61.63 | 84.76 | 70.85 |
| ЭАГ (III стадия) + ИБС (N = 23) |
69.74 ± 6.74 | 44.66 | 197.51 | 59.91 | |
| 20−45 лет | ЭАГ блокаторы
β-адренорецепторов (N = 24) |
44.83 ± 4.00 | 26.37 | 119.48 | 42.15 |
| 20−45 лет | ЭАГ без блокаторов
β-адренорецепторов (N = 18) |
60.80 ± 7.40* | 32.52 | 172.71 | 56.33 |
Наблюдаемое нами высокое содержание нитритов и нитратов оксида азота в плазме пациентов с ЭАГ до 45 лет независимо от тяжести (стадии) заболевания позволяет предположить, что не только недостаток, но и избыток продукции оксида азота может быть причиной развития сердечно-сосудистых заболеваний, в том числе и артериальной гипертензии. В пользу этого свидетельствуют ранее опубликованные данные (Higashino et al., 2007; Люсов и др., 2011). Отсутствие значимых различий количества нитратов и нитритов у больных и здоровых лиц старше 45 лет можно объяснить тем, что с возрастом их содержание, согласно нашим данным, существенно повышается независимо от наличия или отсутствия диагноза ЭАГ. Возрастные особенности изменения концентрации NOx в плазме крови больных и здоровых людей отмечены и другими авторами (Higashino et al., 2007; Ghasеmi et al., 2008; Люсов и др., 2011). Одна из причин повышения содержания оксида азота с возрастом может быть связана с увеличением количества катехоламинов, стимулирующих β-адреногенные рецепторы, которые в свою очередь активируют эндотелиальную синтазу оксида азота и способствуют повышению выхода эндотелиального NO (Santulli et al., 2013). В то же время у пожилых людей наблюдается увеличение содержания ряда провоспалительных факторов, которые могут стимулировать экспрессию индуцибельной синтазы оксида азота и таким образом способствовать повышению уровня оксида азота в кровяном русле (Schulz et al., 2004).
Возникает вопрос о причине наблюдаемого нами и другими авторами повышения содержания нитритов и нитратов в крови больных артериальной гипертензией. В интактном русле источник вазоактивного азота – эндотелий сосудов, где он вырабатывается за счет активности эндотелиальной синтазы оксида азота. При гипертонии наблюдается снижение содержания эндотелиальной синтазы оксида азота и ее разобщение как следствие уменьшения содержания аргинина или кофактора BH4 (Levy et al., 2009). Однако данные по содержанию и активности NOS3 у гипертензивных животных и людей противоречивы. Наряду со свидетельством снижения экспрессии данного белка (Crabos et al., 1997; Bauersachs et al., 1998) имеются и данные о ее повышении в коронарных сосудах и системных артериях, таких как аорта (Rush et al., 2005), при развитии гипертензии. Помимо этого при ряде кардиоваскулярных патологий у больных наблюдаются пониженная чувствительность к катехоламинам и повышенный их уровень в плазме крови (Santulli, 2014), что должно приводить к сверхактивации β1-адренорецепторов и увеличению активности NOS3. Блокирование этих рецепторов, по всей вероятности, может снижать количество оксида азота, чей синтез катализируется эндотелиальной NO-синтазой. Действительно, применение кардиоселективных блокаторов β-адренорецепторов способствовало снижению содержания нитритов и нитратов в кровяном русле гипертоников. Содержание метаболитов NO в плазме крови пациентов, принимающих лекарственные препараты на основе кардиоселективных блокаторов β1-адренорецепторов, было ниже, чем у больных, которым назначалась гипотензивная терапия без них (р = 0.009).
Эти данные казалось бы свидетельствуют в пользу того, что повышенное содержание оксида азота у лиц с ЭАГ может быть обусловлено повышенной активностью эндотелиальной синтазы оксида азота. Однако полученные нами результаты анализа транскрипционной активности гена NOS3 в лейкоцитах периферической крови противоречат этому предположению. Значимых различий в уровне экспрессии гена NOS3 в лейкоцитах периферической крови здоровых людей и больных ЭАГ не обнаружено (р = 0.40) (рис. 1).
Это свидетельствует о том, что повышенный уровень метаболитов оксида азота в крови последних обусловлен, скорее всего, не усилением транскрипционной активности гена NOS3 и увеличения содержания кодируемого им белка, а активацией других изоформ NO-синтазы, в частности индуцибельной синтазы оксида азота. Так, содержание транскриптов гена NOS2 в ЛПК пациентов с ЭАГ (III стадия) + ИБС оказалось выше по сравнению с таковым в контрольной группe (р = 0.000032) (рис. 1). Повышение транскрипционной активности гена NOS2 может быть причиной изменения содержания NOS2 и активности самого фермента, что в свою очередь может привести к значительному росту количества оксида азота. Так, у крыс со спонтанной гипертензией повышение экспрессии индуцибельной синтазы оксида азота в кровяном русле почек сопровождалось двукратным повышением содержания нитритов (Kumar et al., 2005).
Таким образом, можно предположить, что недостаток монооксида азота в кровяном русле при гипертонии может быть компенсирован за счет других форм синтазы оксида азота, в том числе и индуцибельной формы (NOS2), которая вырабатывается в больших количествах в макрофагах. Вероятность этого весьма высока, поскольку известно, что содержание и активность NOS2 регулируются провоспалительными цитокинами, содержание которых у людей c ЭАГ значительно выше, чем у здоровых людей (Bautista et al., 2005).
Считается, что повышение содержания оксида азота за счет стимулирования активности индуцибельной синтазы оксида азота может носить компенсаторный характер. Однако большинство исследователей склоняются к мнению, что избыток оксида азота при развитии ряда сердечно-сосудистых заболеваний может вызвать или усилить повреждение сосудов и способствовать формированию высокого давления крови (Ginnan et al., 2008; Dias et al., 2010; Smith et al., 2011). Очевидно, основной механизм повреждающего эффекта высокой концентрации оксида азота – способность этой молекулы под действием супероксид-радикала или других активных форм кислорода образовывать пероксинитрит, который представляет собой мощный окислитель и агент нитрозилирования белков и повреждения ДНК (Pacher et al., 2007; Habib, Ali, 2011). Другой механизм негативных эффектов NOS2 на сосудистую систему опосредован ее стимулирующим влиянием на активность аргиназы, которая лимитирует продукцию оксида азота, катализируемую эндотелиальной изоформой фермента (Heusch et al., 2010).
При артериальной гипертензии повышение в крови уровня оксида азота, синтез которого катализируется NOS2, вероятно, вносит значительный вклад в патогенез данного заболевания. Об этом свидетельствуют данные Хонга с савт. (Hong et al., 2000). Оказалось, ингибиторы индуцибельной синтазы оксида азота способны подавлять развитие артериальной гипертензии у крыс с SHR.
ЗАКЛЮЧЕНИЕ
Показано, что содержание нитритов и нитратов в плазме крови пациентов с диагнозом ЭАГ значительно выше, чем у здоровых людей, и зависит от их возраста. Это, на наш взгляд, может косвенно указывать на потенциальную возможность увеличения уровня образования оксида азота, которое, по-видимому, участвует в патогенезе данного заболевания. Вероятно, избыточное количество оксида азота в крови гипертоников продуцируется в основном индуцибельной синтазой оксида азота, а не образуется за счет усиления активности эндотелиальной NOS. Об этом свидетельствует тот факт, что уровень транскриптов гена эндотелиальной синтазы оксида азота в лейкоцитах периферической крови больных был несколько ниже этого показателя в ЛПК здоровых людей, а содержание мРНК гена NOS2 в ЛПК пациентов с ЭАГ оказалось достоверно выше по сравнению с таковым в контрольной группе людей. В целом представленные результаты свидетельствуют о том, что индуцибeльная синтаза оксида азота играет значительную роль в развитии ЭАГ.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственного задания ФИЦ КарНЦ РАН (0221-2017-0049).
Список литературы
Диагностика и лечение артериальной гипертензии. Российские рекомендации (IV пересмотр) / Российское медицинское общество по артериальной гипертонии. Всероссийское научное общество кардиологов // Системные гипертензии. 2010. № 3. С. 5–26.
Люсов В.А., Метельская В.А., Оганов Р.Г., Евсиков Е.М., Теплова Н.В. Уровень оксида азота в сыворотке периферической крови больных с различной тяжестью артериальной гипертензии // Кардиология. 2011. № 12. С. 23−28.
Метельская В.А., Гуманова Н.Г. Скрининг-метод определения уровня метаболитов оксида азота в сыворотке крови // Клин. лаб. диагностика. 2005. № 6. С. 15−18.
Bauersachs J., Bouloumie A., Mulsch A., Wiemer G., Fleming I., Busse R. Vasodilator dysfunction in aged spontaneously hypertensive rats: changes in NO synthase III and soluble guanylyl cyclase expression, and in superoxide anion production // Cardiovasc. Res. 1998. V. 37. P. 772–779.
Bautista L.E., Vera L.M., Arenas I.A., Gamarra G. Independent association between inflammatory markers (C-reactive protein, interleukin-6, and TNF-α) and essential hypertension // J. Hum. Hypert. 2005. V. 19. P. 149−154.
Crabos M., Coste P., Paccalin M., Tariosse L., Daret D., Besse P., Bonoron-Adele S. Reduced basal NO-mediated dilation and decreased endothelial NO-synthase expression in coronary vessels of spontaneously hypertensive rats // J. Mol. Cell. Cardiol. 1997. V. 29. P. 55–65.
de Vera M.E., Shapiro R.A., Nussler A.K., Mudgett J.S., Simmons R.L., Morris S.M., Jr, Billiar T.R., Geller D.A. Transcriptional regulation of human inducible nitric oxide synthase (NOS2) gene by cytokines: initial analysis of the human NOS2 promoter // Proc. Natl Acad. Sci. USA. 1996. V. 93. P. 1054–1059.
Dias F.A., Urboniene D., Yuzhakova M.A., Biesiadecki B.J., Pena J.R., Goldspink P.H., Geenen D.L., Wolska B.M. Ablation of iNOS delays cardiac contractile dysfunction in chronic hypertension // Front. Biosci. (Elite Ed.). 2010. V. 2. P. 312−324.
Förstermann U., Sessa W. Nitric oxide synthases: regulation and function // Eur. Heart J. 2012. V. 33. P. 829−837.
Ginnan R., Guekema B.J., Halligan K.E., Singer H.A., Jourd’heuil D. Regulation of smooth muscle by inducible nitric oxide synthase and NADPH oxidase in vascular proliferative disease // Free Radic. Biol. Med. 2008. V. 44. P. 1232−1245.
Ghasemi A., Zahedi Asl S., Mehrabi Y., Saadat N., Azizi F. Serum nitric oxide metabolite levels in a general healthy population: Relation to sex and age // Life Sci. 2008. V. 83. P. 326–331.
Godecke A., Decking U.K., Ding Z., Hirchenhain J., Bidmon H.J., Gödecke S., Schrader J. Coronary hemodynamics in endothelial NO synthase knockout mice // Circ. Res. 1998. V. 82. P. 186–194.
Habib S., Ali A. Biochemistry of nitric oxide // Ind. J. Clin. Biochem. 2011. V. 26. P.3−17.
Heusch P., Aker S., Boengler K., Deindl E., van de Sand A., Klein K., Rassaf T., Konietzka I., Sewell A., Menazza S., Canton M., Heusch G., Di Lisa F., Schulz R. Increased inducible nitric oxide synthase and arginase II expression in heart failure: no net nitrite/nitrate production and protein S-nitrosylation // Am. J. Physiol. Heart Circ. Physiol. 2010. V. 299. H. 446−453.
Higashino H., Miya H., Mukai H., Miya Y. Serum nitric oxide metabolite (NOx) levels in hypertensive patients at rest: a comparison of age, gender, blood pressure and complications using normotensive controls // Clin. Exp. Pharmacol. Physiol. 2007. V. 34. P. 725–731.
Hong H.-J., Loh S.-H., Yen M.-H. Supression of the development of hypertension by the inhibitor of inducible nitric oxide synthase // British J. Pharmacol. 2000. V. 131. P. 631−632.
Kumar U., Chen J., Sapoznikhov V., Canteros G., White B.H., Sidhu A. Overexpression of inducible nitric oxide synthase in the kidney of the spontaneously hypertensive rat // Clin. Exp. Hypertens. 2005. V. 27. P. 17–31.
Levy A.S., Chung J.C.S., Kroetsch J.T., we Rush J. Nitric oxide and coronary vascular endothelium adaptations in hypertension // Vascular Health Risk Manag. 2009. V. 5. P. 1075–1087.
Lowenstein C.J., Dinerman J.L., Snyder S.H. Nitric oxide: a physiologic messenger // Ann. Intern. Med. 1994. V. 120. P 227−237.
Lyamina N.P., Dolotovskaya P.V., Lyamina S.V., Malyshev I.Y., Manukhina E.B. Nitric oxide production and intensity of free radical processes in young men with high normal and hypertensive blood pressure // Med. Sci. Monit. 2003. V. 9. CR304-310
Mokuno S., Ito T., Numaguchi Y., Matsui H., Toki Y., Okumura K., Hayakawa T. Impaired nitric oxide production and enhanced autoregulation of coronary circulation in young spontaneously hypertensive rats at prehypertensive stage // Hypertens. Res. 2001. V. 24. P. 395–401.
Nava E., Noll G., Luscher T.F. Increased activity of constitutive nitric oxide synthase in cardiac endothelium in spontaneous hypertension // Circulation. 1995. V. 91. P. 2310–2313.
Pacher P., Beckman J.S., Liaudet L. Nitric oxide and peroxynitrite in health and disease // Physiol. Rev. 2007. V. 87. P. 315−424.
Piech A., Massart P.E., Dessy C., Feron O., Havaux X., Morel N., Vanoverschelde J.L., Donckier J., Balligand J.L. Decreased expression of myocardial eNOS and caveolin in dogs with hypertrophic cardiomyopathy // Am. J. Physiol. Heart Circ. Physiol. 2002. V. 282. H219–H231.
Rush J.W., Denniss S.G., Graham D.A. Vascular nitric oxide and oxidative stress: determinants of endothelial adaptations to cardiovascular disease and to physical activity // Can. J. Appl. Physiol. 2005. V. 30. P. 442–474.
Santulli G. Adrenal signaling in heart failure something more than a distant ship’s smoke on the horizon // Hypertension. 2014. V. 63. P. 215–216.
Santulli G., Ciccarelli M., Trimarco B., Iaccarino G. Physical activity ameliorates cardiovascular health in elderly subjects: the functional role of the b adrenergic system // Front. Physiol. 2013. V.4: 209.
Schulz S., Schagdarsurengin U., Suss T., Müller-Werdan U., Werdan K., Gläser C. Relation between the tumor necrosis factor-a (TNF-a) gene and protein expression, and clinical, biochemical, and genetic markers: age, body mass index and uric acid are independent predictors for an elevated TNF-a plasma level in a complex risk model // Eur. Cytokine Netw. 2004. V. 15. P. 105–111.
Smith C.J., Santhanam L., Bruning R.S., Stanhewicz A., Berkowitz D.E., Holowatz L.A. Upregulation of iNOS contributes to attenuated cutaneous vasodilation in essential hypertensive humans // Hypertension. 2011. V. 58. P. 935–942.
Vaziri N.D., Ni Z., Oveisi F., Trnavsky-Hobbs D.L. Effect of antioxidant therapy on blood pressure and NO synthase expression in hypertensive rats // Hypertension. 2000. V. 36. P. 957–964.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


