Известия РАН. Серия биологическая, 2020, № 3, стр. 325-336
Потоки диоксида углерода, тепла и влаги между еловым насаждением и атмосферой на европейском северо-востоке России
С. В. Загирова 1, *, О. А. Михайлов 1, В. В. Елсаков 1
1 Институт биологии КомиНЦ УрО РАН
167982 Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: zagirova@ib.komisc.ru
Поступила в редакцию 18.10.2017
После доработки 03.04.2018
Принята к публикации 28.05.2018
Аннотация
Обсуждаются результаты измерений потоков СО2 и теплообмена методом микровихревых пульсаций между старовозрастным ельником и атмосферой. Показана суточная и сезонная динамика нетто-обмена СО2, экосистемного дыхания и гросс-фотосинтеза. Установлена тесная связь среднесуточных значений нетто-обмена СО2 и радиационного баланса в годичном цикле. Рассчитана эффективность использования воды на продукцию органического вещества в еловом фитоценозе.
Бореальные леса занимают 12.0–14.7 млн км2 и являются вторым по значимости лесным биомом в мире после тропических лесов (Baldocchi et al., 2000). В России их площадь составляет ~95% лесопокрытой территории, чистый бюджет углерода в них достигает 49‒117 г С/(м2 · год) в зависимости от лесорастительных условий (Швиденко, Щепаченко, 2014). В северных широтах основной фактор, регулирующий процессы углеродного цикла, – температура воздуха. Существуют две основные гипотезы относительно реакции экосистем бореальных лесов на дальнейшее потепление климата в XXI в. Одни эксперты предсказывают увеличение стока углерода из атмосферы в лесные биомы вследствие удлинения вегетационного сезона и увеличения фитомассы (Barr et al., 2007), другие – снижение баланса потоков СО2 в результате стимулирования экосистемного дыхания (Goulden et al., 1998; Ueyama et al., 2014). С повышением температуры лесные экосистемы северных широт, прежде всего в зоне распространения многолетней мерзлоты, могут превратиться в источник углерода уже к концу XXI в. (Gauthier et al., 2015).
Нетто-обмен СО2 и испарение влаги – фундаментальные процессы биогеохимического цикла, характеризующие состояние и адаптацию наземных экосистем к климатическим условиям. Современные методы измерений позволяют исследовать влияние климатических факторов на нетто-обмен СО2 между лесом и атмосферой в разном временнóм интервале (Amiro et al., 2006; Arneth et al., 2006; McCaughey et al., 2006; Чебакова и др., 2014; Kazurinen et al., 2014), а также сопряженность потоков диоксида углерода и эвапотранспирации (Amiro et al., 2006; McCaughey et al., 2006; Brummer et al., 2012). На территории России измерительные системы для изучения энергомассообмена наземных экосистем пульсационным методом, за рубежом известные как eddy covariance, действуют лишь в 12 географических точках, в то время как во всем мире их насчитывается >200 (Alekseychik et al., 2016). По данным этих измерений суммарный сток углерода в лесах России, Украины, Беларуси и Казахстана составляет 0.342 Гт С/год (Dolman et al., 2012). Испарение в хвойных лесах бореальной зоны составляет 254−364 мм/год (Amiro et al., 2006; Launianen, 2010).
На северо-востоке европейской части России доминируют еловые фитоценозы, характеризующиеся низкой продуктивностью, что связано с недостатком тепла для роста растений (Галенко, 1983). Чистая продукция фитомассы (NEP) в хвойных и хвойно-лиственных фитоценозах средней тайги, рассчитанная весовым методом, составляет 1.6–1.71 т С/(га · год) (Биопродукционный…, 2001). Нетто-сток углерода в ельниках, определенный аэродинамическим методом, соответствует 0.47 т С/(га · год) (Мартынюк и др., 1998), а с учетом продукционно-деструкционных процессов — 0.36 т С/(га · год) (Кузнецов, 2010).
Цель работы – выявление закономерностей обмена диоксида углерода, тепла и влаги между атмосферой и еловым насаждением с использованием результатов измерений методом микровихревых пульсаций (eddy covariance) в течение одного года.
МАТЕРИАЛЫ И МЕТОДЫ
Измерения потоков СО2 и тепла методом микровихревых пульсаций были проведены в 2013 г. в Княжпогостском районе Республики Коми (подзона средней тайги, 62°17′ с.ш., 50°40′ в.д.). Измерительная система установлена в еловом насаждении лесного заказника “Ляльский”, в 83 км севернее г. Сыктывкара. В пределах лесного массива развиваются ельник разнотравно-черничный, ельник чернично-сфагновый и хвойно-лиственный фитоценоз (Биопродукционный…, 2001; Коренные…, 2006). В составе древостоя преобладает Picea obovata Ledeb., в примеси встречаются Pinus sylvestris L., Abies sibirica Ledeb., Betula pubescens Ehrh., Populus tremula L. Высота ели составляет 20–22 м, возраст деревьев варьирует от 80 до 215 лет, число растущих деревьев – от 595 до 783 шт./га.
При характеристике структуры растительного покрова участка измерений использованы данные обработки четырех каналов спектрозональной спутниковой съемки Sentinel 2b (пространственного разрешения 10 м, от 08.08.2016) методами управляемой классификации по сигнатурам, полученным для выделенных при полевых исследованиях эталонов. Для статистических расчетов учитывали процентный вклад выделенных классов в пределах восьми секторов на площади радиусом 500 м от измерительной системы (рис. 1а). Характеристика распределения основных типов сообществ в каждом из них представлена в табл. 1. Для расчета соотношения хвойных и лиственных пород на участках использовали принципы субпиксельного разложения спектральных смесей (SMA-анализ) (Барталев и др., 2009).
Рис. 1.
Структура растительного покрова (а) и распределение направлений ветра (б) в районе исследования. 1 − хвойно-лиственный, 2 − сосновый, 3 − еловый, 4 − березовый леса соответственно, 5 − зарастающие сельскохозяйственные земли, 6 − зарастающая линия ЛЭП. I–VIII – номер сектора.
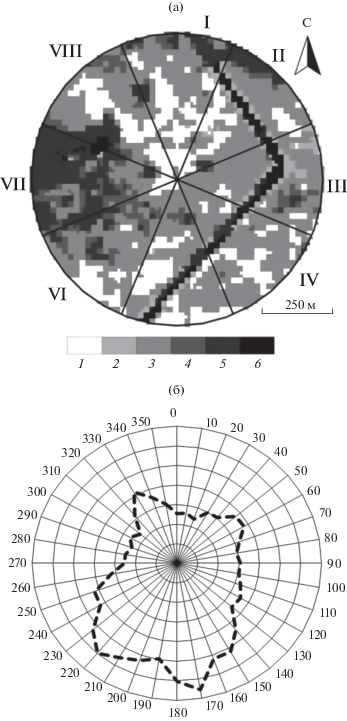
Таблица 1.
Проективное покрытие (%) разных классов сообществ растений на территории, примыкающей к площадке измерений
| Классы | Номер сектора (рис. 1а) | |||||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | VI | VII | VIII | |
| Лес | ||||||||
| хвойно-лиственный | 27.95 | 19.98 | 5.78 | 20.53 | 30.90 | 18.28 | 3.17 | 26.78 |
| сосновый | 2.50 | 7.19 | 12.87 | 2.25 | 5.31 | 0.00 | 0.50 | 0.00 |
| еловый | 49.11 | 50.65 | 62.72 | 68.23 | 49.95 | 56.69 | 19.41 | 47.00 |
| березовый | 6.15 | 3.70 | 6.79 | 1.63 | 2.84 | 14.71 | 17.92 | 10.79 |
| Зарастающие с/х земли | 13.45 | 11.89 | 3.75 | 4.39 | 5.78 | 10.32 | 57.23 | 13.39 |
| Зарастающая линия ЛЭП | 0.83 | 6.59 | 8.11 | 2.86 | 5.02 | 0.00 | 1.78 | 2.02 |
| Соотношение хвойные/ лиственные | 0.75/0.25 | 0.72/0.28 | 0.71/0.25 | 0.78/0.21 | 0.77/0.21 | 0.74/0.26 | 0.46/0.54 | 0.73/0.27 |
Согласно полученным данным в семи из восьми секторов ельники занимали 47–68% территории, они преобладали в восточно-юго-восточном направлении от участка инструментальных измерений. Хвойно-лиственный лес, образованный елью, сосной, березой и осиной, занимал 6–31% площади, высокие их доли были в северо-северо-западном и южном секторах. На преобладание хвойных растений на территории измерений указывало отношение породного состава (хвойные/лиственные), за исключением седьмого сектора, где более половины площади занимали зарастающие лесом сельскохозяйственные земли.
Метод микровихревых пульсаций был подробно описан ранее (Baldocchi et al., 1988). В бесснежный период 2013 г. в районе исследования преобладал ветер южного и юго-западного направлений (рис. 1б). Анализ футпринта показал, что в 76% случаев 90% общего объема потока воздуха, который использовался системой для расчета потока СО2, формировалось на расстоянии <200 м от измерительной системы, при этом в 90% случаев максимальный поток воздуха поступал с расстояния <100 м.
Параметры микроклимата (температура и влажность воздуха, интенсивности фотосинтетически активной радиации (ФАР), падающей и отраженной солнечной радиации, радиационный баланс) на высоте 30 м, а также теплообмен почвы регистрировали автоматической метеостанцией с использованием регистратора CR3000 (Campbell Scientific, США). Система для измерений газообмена СО2 между экосистемой и атмосферой на высоте 30 м включала в себя ультразвуковой анемометр, измеряющий скорость ветра в трех проекциях и акустическую температуру воздуха (CSAT3, Campbell Scientific Inc., США), и инфракрасный газоанализатор открытого типа (EC-150, Campbell Scientific Inc.), позволяющий получать данные о скорости и направлении вертикального потока СО2. Регистрация данных происходила с частотой 20 Гц, обрабатывали их с помощью программного обеспечения LoggerNet (Campbell Scientific Inc.). В соответствии с этой программой поток диоксида углерода имел знак “–”, если он был направлен из атмосферы в экосистему, и знак “+” в случае его эмиссии с поверхности растительного покрова в атмосферу. В противоположность этому поток тепла из атмосферы в еловый биогеоценоз был с положительным, а обратный поток ‒ с отрицательным знаком.
Программный анализ включал в себя математическую и статистическую обработку первичных данных за 30 мин. Из всего массива удаляли некачественные данные, полученные при нестабильном функционировании газометрической системы, низкой турбулентности и непостоянстве факторов среды (Foken, Wichura, 1996). В 2013 г. наиболее часто проблемы с системой возникали в марте и сентябре.
На следующем этапе оценивали качество выбранных данных с учетом соотношения показателя стабильности в пограничном слое атмосферы (z/L) с динамической скоростью ветра (u*) в момент измерения. В результате проведенного анализа пороговое значение u* для отбора данных составило 0.2 м/с, поэтому значения СО2-обмена при более низкой турбулентности атмосферы (u* < 0.2 м/с) далее не учитывали. На последнем этапе удаляли выбросы, которые не соответствовали действительности, но не были обнаружены в процессе предыдущего отбора данных. В итоге из 15 882 зарегистрированных значений за 302 дня (с 01.01 по 31.12. 2013 г.) в работе были использованы 10 273. Суммарное значение обмена СО2 между еловым лесом и атмосферой было рассчитано как интеграл данных с шагом измерения 30 мин за определенный промежуток времени.
Важный показатель качества проводимых измерений − замыкание уравнения теплового баланса (H + LE = Rn − G) (Lafleur, 1999), где Rn –радиационный баланс, H – турбулентный теплообмен между деятельным слоем леса и атмосферой, LE – затраты тепла на эвапотранспирацию, G –теплообмен почвы. Замыкание уравнения теплового баланса в 2013 г. составило H + LE = = 1.0969(Rn − G) + 5.732 (r2= 0.88), что свидетельствует о вполне удовлетворительном качестве полученных данных.
Измеренный поток диоксида углерода ${{F}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ эквивалентен нетто-обмену СО2 (NEE), который представляет собой сумму гросс-фотосинтеза (Pgross) и дыхания экосистемы (Reco). Дыхание экосистемы моделировали по температуре воздуха (Та) в ночное время в соответствии с регрессионным уравнением Reco = 0.0292e0.0966Та. Результаты моделирования экстраполировали для оценки Reco в дневное время суток, как это было сделано в исследованиях газообмена СО2 экосистем тундры (Zamolodchikov et al., 2003; Kutzbach et al., 2007). Pgross рассчитывали как разность между измеренным значением NEE и смоделированным экосистемным дыханием, при ФАР < 20 мкмоль/(м2 · с) его приравнивали к нулю.
Эвапотранспирацию с поверхности елового насаждения рассчитывали по уравнению ET = LE/λ, где λ – теплопарообразование при 20°С. Эффективность использования воды на продукцию органического вещества растений (WUE) рассчитывали как отношение гросс-фотосинтеза и эвапотранспирации (Brummer et al., 2012).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Погодные условия. В районе исследований в 2013 г. самым холодным месяцем был январь, когда среднесуточная температура воздуха опускалась до −20°С. Холодная погода сохранялась до середины марта, в первой декаде средняя температура воздуха составила −15°С. Весной положительные среднесуточные значения температуры атмосферного воздуха регистрировали после 13 апреля (рис. 2). Сход снежного покрова в лесу был отмечен в начале мая. Погода в мае и июне была относительно теплой, а июль был жарким, среднемесячная температура воздуха составила 17°С. Теплая погода сохранялась в августе, первые ночные заморозки наблюдали в конце сентября. В 2013 г. продолжительность вегетационного периода (когда среднесуточная температура воздуха превышала 5°С) составила 146 сут. В мае был отмечен незначительный недобор осадков, а в июне–августе сумма осадков была существенно ниже многолетней нормы (табл. 2). Количество выпавших осадков в апреле‒августе составило 30% годовой суммы.
Рис. 2.
Годичный цикл среднесуточной температуры воздуха на высоте 30 м (1), почвы на глубине 8 см (2) и сумма осадков в ельнике в 2013 г.
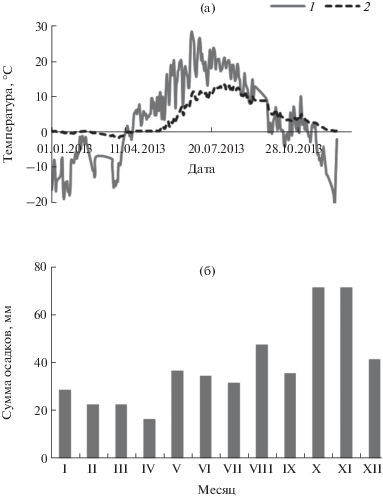
Таблица 2.
Средняя за месяц температура приземного воздуха и сумма осадков в 2013 г.*
| Месяц | Температура, °С | Осадки, мм/мес. | ||
|---|---|---|---|---|
| среднее | отклонение** | среднее | отклонение** | |
| Март | −14.4 | −8.3 | 38.9 | 15.0 |
| Апрель | 2.2 | 1.0 | 15.3 | −16.6 |
| Май | 8.9 | 0.8 | 38.6 | −2.1 |
| Июнь | 17.4 | 3.4 | 34.9 | −23.4 |
| Июль | 19.5 | 2.4 | 31.3 | −41.2 |
| Август | 16.2 | 2.5 | 40.2 | −19.1 |
Температура почвы в ельнике следовала за изменением температуры в течение года (рис. 2). Весной, до середины апреля, температура в лесной подстилке (на глубине 8 см) была близка к нулю, резкое ее повышение наблюдали после 14 мая, когда днем воздух прогревался до +15°С. В конце июля она достигла +14°С и не опускалась ниже +10°С до сентября. Температура подстилки оставалась положительной до конца ноября.
Количество ФАР, поступающей к верхней границе елового фитоценоза, постепенно увеличивалось в первой половине года, достигнув в июле 1600 мкмоль/(м2 · с) (рис. 3a). Среднедневное значение интенсивности ФАР в конце августа снизилось на 20, в сентябре ‒ на 32, в октябре ‒ на 55% по сравнению с июльскими значениями.
Рис. 3.
Годичный цикл фотосинтетически активной радиации (а), альбедо (б) и теплообмена (в) на верхней границе елового фитоценоза в 2013 г. 1 − радиационный баланс, 2 − затраты тепла на эвапотранспирацию, 3 − турбулентный теплообмен, 4 – теплообмен почвы; 1−4 − сглаженные кривые среднесуточных значений.
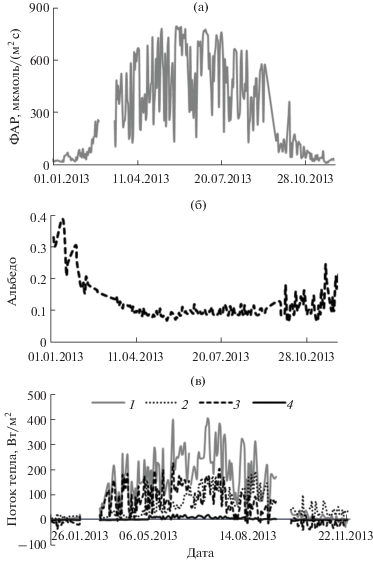
Среднесуточное альбедо в холодный период года соответствовало 0.4, заметно снизилось после схода снежного покрова, а в летние месяцы варьировало от 0.1 до 0.2 (рис. 3б). В весенне-летний период с уменьшением альбедо повышался радиационный баланс.
Радиационный баланс (Rn) и теплообмен. Rn – это главная приходная составляющая энергообменных процессов между поверхностью земли и атмосферой. Суточная и месячная сумма Rn определяется в основном высотой солнца в полдень и продолжительностью дня. Основные расходные составляющие Rn – турбулентные потоки тепла и влаги, которые возникают по причине существующего градиента температуры и влажности воздуха между земной поверхностью и атмосферой (Павлов, 1984).
Согласно нашим наблюдениям, значения суточного Rn на верхней границе леса были положительными (т.е. поток тепла был направлен из атмосферы в экосистему) уже в конце марта‒начале апреля, когда под пологом древостоя сохранялся снежный покров (рис. 3в). В лесных ценозах Якутии в некоторые годы этот переход отмечали уже в феврале (Павлов, 1984). Теплообмен в ельнике увеличивался в мае‒июне, достигнув наибольших значений в июле, в августе наметился его спад. В ноябре‒ декабре значения Rn были отрицательными.
Суточный ход радиационного баланса и его расходных составляющих на границе фитоценоза и атмосферы был хорошо выражен в теплый период года, максимальные значения Rn, H и LE регистрировали в полдень (рис. 4). Отношение суммарных за сутки значений H и LE не было постоянным в течение года, так как они менялись не синхронно (табл. 3). Весной турбулентный теплообмен значительно превосходил затраты тепла на эвапотранспирацию, его интенсивность возрастала в мае, достигнув максимума в конце июня. Именно в этот период происходил значительный прирост среднесуточной температуры воздуха в ельнике, который составил почти 14°С за май и 10°С за июнь. Затраты тепла на эвапотранспирацию существенно повысились в июне, в период активного формирования фотосинтетического аппарата у древесных растений, и достигали наибольших значений в июле. Во второй половине лета в экосистеме елового леса турбулентный теплообмен снижался быстрее, чем затраты тепла на эвапотранспирацию. В некоторые дни августа после выпадения обильных осадков в ельнике наблюдали кратковременное увеличение LE. В целом с апреля по сентябрь отношение суммарных за сутки значений H/Rn снизилось от 73 до 27%, а отношение LE/Rn характеризовалась обратной тенденцией. Доля теплообмена почвы в радиационном балансе в летние месяцы не превышала 6%.
Рис. 4.
Суточный теплообмен между ельником и атмосферой в апреле (а), июне (б), июле (в) и сентябре (г) 2013 г. 1 − затраты тепла на эвапотранспирацию; 2 − турбулентный теплообмен, 3 − радиационный баланс, 4 – теплообмен почвы; 1−4 – сглаженные кривые средних значений за 30-мин интервал измерений.
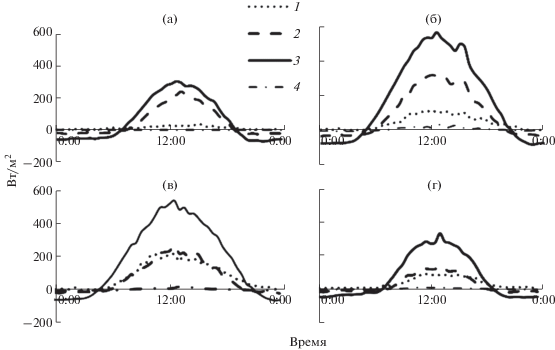
Таблица 3.
Суммарный поток тепла (МДж/(м2 сут)) и диоксида углерода (г СО2/(м2 сут)) между ельником и атмосферой в 2013 г.
| Показатель | Месяц | |||||||
|---|---|---|---|---|---|---|---|---|
| II | IV | V | VI | VII | VIII | IX | X | |
| Rn | −0.36 | 5.71 | 10.77 | 16.49 | 16.36 | 10.05 | 6.04 | 1.23 |
| LE | 1.02 | 0.98 | 2.73 | 4.15 | 7.66 | 7.11 | 2.78 | 1.86 |
| H | −1.46 | 4.21 | 5.44 | 9.02 | 6.76 | 2.69 | 2.24 | −0.81 |
| G | −0.08 | −0.04 | 0.60 | 0.84 | 0.61 | 0.23 | −0.11 | −0.30 |
| NEE | 2.30 | −0.59 | −10.38 | −13.18 | −16.68 | −5.16 | −5.90 | 7.19 |
Отношение Боуэна (β = H/LE) в некоторые дни апреля достигало 8, но в течение лета по мере увеличения эвапотранспирации постепенно снижалось и в августе−сентябре составило <1. Сходная динамика отношения Боуэна в годичном цикле была выявлена в сосновых лесах Сибири (Чебакова и др., 2013) и Финляндии (Launianen, 2010). Согласно имеющимся результатам пульсационных измерений в лесных экосистемах отношение Боуэна летом может меняться от 0.42 до 1.21 в зависимости от погодных условий (Launianen, 2010). По мнению других авторов, в хвойных лесах европейской тайги в июне–августе затраты на турбулентный теплообмен и эвапотранспирацию примерно равны и составляют 0.42–0.48 радиационного тепла (Галенко, 1983).
Суммарное испарение или эвапотранспирация (ET) лесной экосистемы – результат физического испарения воды с поверхностей и транспирации растений. Согласно результатам пульсационных измерений ET контролируется в основном устьичной проводимостью, которая в свою очередь сильно зависит от содержания влаги в атмосферном воздухе (Kasurinen et al., 2014). Однако зависимость этих процессов нелинейная: увеличение дефицита влаги в атмосфере (VPD) до 2 кПа положительно влияет на проводимость устьиц и, соответственно, обмен воды и диоксида углерода между растением и атмосферой увеличивается, а при более высоких значениях VPD фотосинтез и транспирация уменьшаются (McCaughey et al., 2006). Эвапотранспирация характеризуется межгодовой вариабельностью. Так, в хвойных лесах Северной Америки в разные годы суммарное испарение менялось от 230 до 305 мм (Brummer et al., 2012), в сосняках Финляндии ‒ от 218 до 361 мм (Launianen, 2010) и не всегда зависело от количества осадков.
В исследованном нами ельнике скорость эвапотранспирации увеличивалась в мае‒июле и достигла наибольших значений к началу августа; в последующем происходил спад активности этого процесса. Рассчитанное нами суммарное испарение влаги с поверхности елового насаждения в апреле‒августе 2013 г. составило 247 мм. Транспирация древостоя в сосново-еловом фитоценозе подзоны средней тайги в июне−августе достигала 130 мм (Сенькина, 2013), что соответствует 42% рассчитанной нами суммарной эвапотранспирации. По мнению других авторов, транспирация в хвойных фитоценозах таежной зоны может составлять 80% суммарной эвапотранспирации (Галенко, 1983). Вклад почвы и напочвенного покрова в суммарное испарение влаги сосновых фитоценозов соответствует 18−25% (Launianen, 2010).
Потоки диоксида углерода. Суточный ход газообмена СО2 между еловым насаждением и атмосферой хорошо выражен в теплый период года с максимумом в полдень (рис. 5). В зимние месяцы значения нетто-обмена СО2 были положительными, т.е. поток был направлен с поверхности деятельного слоя в атмосферу. Слабый сток СО2 в экосистему ельника регистрировали уже во второй половине марта‒начале апреля, когда в лесу еще сохранялся снежный покров и температура воздуха была отрицательной (рис. 5). Суточный нетто-обмен СО2 между лесом и атмосферой заметно усиливался в мае‒июне, в период наиболее интенсивного накопления тепла солнечной радиации в экосистеме (табл. 3). В августе‒сентябре суточный сток СО2 снижался, а в начале октября ельник переключился со стока на эмиссию. Суммарное за сутки значение NEE составило в апреле 4, мае ‒ 62, июне ‒ 79, августе и сентябре ‒ 31% июльского значения. Суммарное нетто-поглощение СО2 ельником в апреле–августе соответствовало –327 г С/м2.
Рис. 5.
Суточный обмен СО2 между ельником и атмосферой в апреле (а), июне (б), июле (в) и сентябре (г) 2013 г. 1 – экосистемное дыхание, 2 – гросс-фотосинтез, 3 – нетто-обмен СО2. 1−3 – сглаженные кривые средних значений за 30-мин интервал измерений.
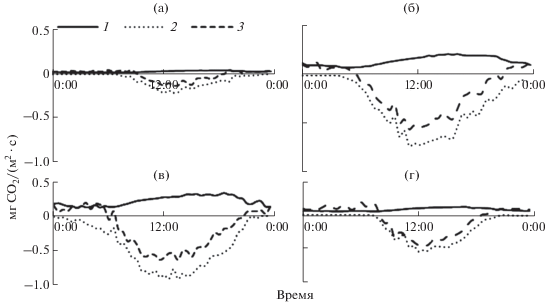
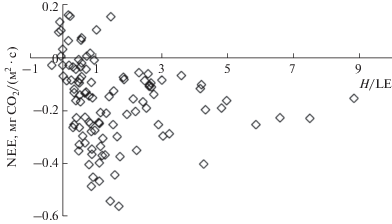
Рис. 6.
Зависимость среднесуточных значений нетто-обмена СО2 (NEE) от отношения Боуэна (H/LE) в еловом насаждении.
Полученные нами значения NEE согласуются с результатами пульсационных измерений в ельниках других регионов. Так, в Северной Америке в спелом ельнике годовой сток углерода составил 174 г С/м2 (Hollinger et al., 2004). Нетто-поглощение в южно-таежном мелкотравно-зеленомошном ельнике на Валдае соответствовало 300 г С/(м2 · год) (Замолодчиков и др., 2017), а южно-таежный ельник чернично-сфагновый был источником углерода для атмосферы (Ольчев и др., 2009). При антропогенном нарушении бореальные лесные экосистемы становятся источником углерода в первые 20 лет восстановления растительного покрова (Amiro et al., 2006).
Скорость экосистемного дыхания в еловом насаждении в конце марта‒начале апреля не превышала 0.03 мкмоль СО2/(м2 · с), постепенно возрастала в мае, достигнув наибольшего значения в июне‒июле (рис. 5). В течение 1 сут его максимум отмечали в вечерние часы. В некоторые дни июля суммарное значение Reco достигало 30.7 г СО2/(м2 · сут). В августе наметился его спад, а в октябре скорость дыхания не превышала 3 г СО2/(м2 · сут). Суммарное экосистемное дыхание в ельнике в апреле–августе составило 512 г С/м2.
Значение гросс-фотосинтеза следовало за динамикой нетто-обмена СО2, возрастая с апреля по июль и постепенно снижаясь во второй половине вегетационного периода (рис. 5). Максимальное суточное значение Pgross в июле соответствовало 45 г СО2/(м2 · сут), в августе оно снизилось на 40, сентябре – на 55, а в октябре составило 20% июльского. Суммарный гросс-фотосинтез в апреле‒августе составил −839 г С/м2.
Таким образом, в исследованном нами еловом насаждении поглощение СО2 наблюдали уже в апреле при отрицательной температуре воздуха. В этот период радиационный баланс превышал в 7 раз значения, полученные в зимние месяцы. Благодаря увеличению теплообмена температура поверхности кроны дерева весной может на 4°С превышать температуру воздуха (Павлов, 1984). Вероятно, этого тепла достаточно для запуска фотосинтеза у хвойных растений на Севере.
В последние десятилетия появилось много работ, где анализировали обмен СО2 и влаги экосистем бореальных лесов в связи с изменением глобального климата. В процессе эволюции хвойные растения приспособились фотоассимилировать СО2 при отрицательных температурах (Дроздов, Курец, 2003). Фотосинтез у хвойных растений весной возможен при температуре воздуха 3−4°С, а осенью ‒ при −7°С (Sevanto et al., 2006). Имеются сведения о возможном запуске этого процесса на 1.5 мес. раньше, чем начнет оттаивать почва (Suni et al., 2003). По мнению авторов, в этот период в процессе фотоассимиляции СО2 используется вода, накопленная в стволах деревьев, так как транспирационная влага не может поступать в растения через корни из замороженной почвы. Переход от источника к стоку углерода ранней весной при отрицательных среднесуточных температурах был установлен в результате измерений потоков СО2 методом микровихревых пульсаций в разных типах бореальных лесов (Hollinger et al., 1999; Arneth et al., 2006).
По мнению большинства авторов, температура – основной фактор, определяющий сезонный ход и межгодовые различия нетто-обмена СО2 между лесом и атмосферой (Goulden et al., 1998; Hollinger et al., 1999). Повышение температуры весной положительно влияет на продуктивность растений бореальных лесов, а осенью – на экосистемное дыхание (Piao et al., 2008; Ueyama et al., 2014). Однако чувствительность потоков СО2 в лесных экосистемах к температурному фактору зависит от содержания влаги в атмосфере, что в свою очередь влияет на годовой баланс обмена СО2 между лесом и атмосферой (Barr et al., 2007).
Восстановление физиологической активности растений после зимнего покоя приводит к изменению распределения радиационного тепла в лесной экосистеме. Согласно результатам наших исследований с сезонным развитием растений в ельнике увеличивается расход тепла на испарение влаги и снижается турбулентный теплообмен. С теплообменом в приземном слое атмосферы связана интенсивность нетто-обмена СО2 ельника (табл. 3). В теплый период года, когда радиационный баланс положительный, высокая скорость поступления СО2 из атмосферы в экосистему ельника была отмечена при H/LE = 0.5−2.0 (рис. 6), что согласуется с данными, полученными для сосновых насаждений Сибири (Чебакова и др., 2014). При очень низких (прохладно и влажно) или высоких (жарко и сухо) значениях H/LE нетто-поглощение СО2 экосистемой ельника снижалось.
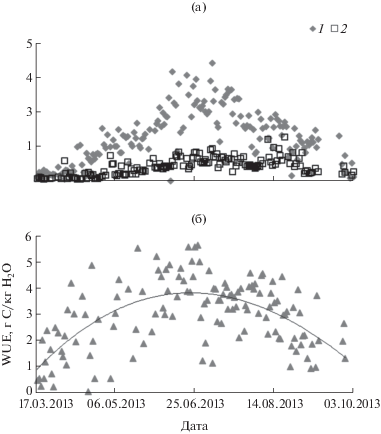
Рис. 7.
Динамика гросс-фотосинтеза, г СО2/(м2 · сут) (1), эвапотранспирации, кг Н2О/(м2 · сут) (2) (а) и показателя эффективности использования воды на фотосинтез (б) в ельника в теплый период 2013 г.
Компиляция результатов измерений методом эдди-коварианс на 65 станциях бореальной и арктической зон показала, что затраты тепла на эвапотранспирацию в лесных экосистемах выше, чем в тундровых и болотных сообществах, и зависят от содержания влаги в атмосфере (Kasurinen et al., 2014). Тесная связь гросс-фотосинтеза и эвапотранспирации в экосистеме леса в сезонной динамике обусловлена устьичным контролем обмена СО2 и влаги (McCaughey et al., 2006; Brummer et al., 2012). Хвойные бореальные леса характеризуются менее активной эвапотранспирацией и, соответственно, менее активным нетто-обменом СО2, чем лиственные (Amiro et al., 2006).
В еловом насаждении в апреле–августе 2013 г. гросс-фотосинтез составил 839 г С/м2, а эвапотранспирация ‒ 247 кг Н2О/м2, в результате среднее значение эффективности использования воды на продукцию органического вещества растений (WUE) соответствовало 3.3 г С/кг Н2О. Однако отношение гросс-фотосинтеза к эвапотранспирации менялось в течение вегетационного сезона. Наиболее высокие значения WUE отмечены в конце мае−июне, в период активного формирования фотосинтетического аппарата у древесных растений (рис. 7). Согласно данным пульсационных измерений, среднегодовое значение WUE характеризуется относительным постоянством, но зависит от структуры растительного покрова, поэтому в разных типах хвойных бореальных лесов оно меняется от 3 до 6 г С/кг Н2О (Brummer et al., 2012).
Таким образом, на основании результатов измерений методом микровихревых пульсаций в среднетаежном ельнике в течение одного года нами установлены суточная и сезонная вариабельности обмена диоксида углерода, тепла и влаги между лесной экосистемой и атмосферой. В период вегетации еловое насаждение выполняло функцию стока СО2 из атмосферы, с апреля по август суммарный нетто-обмен СО2 составил –327 г С/м2, а гросс-фотосинтез – 839 г С/м2. В сезонной динамике суточные значения нетто-обмена СО2 ельника были тесно сопряжены с радиационным балансом и турбулентным теплообменом, высокие значения NEE наблюдали при отношении Боуэна 0.5−2.0. В теплый период года гросс-фотосинтез достигал максимальных значений в июле, эвапотранспирация – в июле–августе. Средняя за сезон эффективность использования воды на продукцию органического вещества в ельнике составила 3.3 г С/ кг Н2О, его максимум был отмечен в конце мая–июне, в период активного формирования ассимиляционного аппарата древесных растений хвойного фитоценоза. Еловое насаждение выполняло функцию стока СО2 в течение года наблюдений, однако для выявления межгодовой вариабельности потоков углерода, тепла и влаги в экосистеме необходимы многолетние эколого-климатические исследования.
Работа выполнена в рамках Комплексной программы фундаментальных научных исследований УрО РАН 2018–2020 гг. Подпрограмма “Живая природа и климат”, проект № 18-4-4-17.
Список литературы
Барталев С.А., Ховратович Т.С., Елсаков В.В. Использование спутниковых изображений для оценки потерь углерода лесными экосистемами в результате вырубок // Соврем. проблемы дистанц. зондирования Земли из космоса. 2009. Вып. 6. Т. 2. С. 343‒351.
Биопродукционный процесс в лесных экосистемах Севера. СПб.: Наука, 2001. 278 с.
Галенко Э.П. Фитоклимат и энергетические факторы продуктивности хвойного леса Европейского Севера. Л.: Наука, 1983. 129 с.
Дроздов С.Н., Курец В.К. Некоторые аспекты экологической физиологии растений. Петрозаводск: Изд-во ПГУ, 2003. 172 с.
Замолодчиков Д.Г., Гитарский М.Л., Шилкин А.В., Марунич А.С., Карелин Д.В., Блинов В.Г., Иващенко А.И. Мониторинг циклов диоксида углерода и водяного пара на полигоне “Лог таёжный” (Валдайский национальный парк) // Фундам. и прикл.климатология. 2017. Т. 1. С. 54‒68.
Коренные еловые леса Севера: биоразнообразие, структура, функции. СПб.: Наука, 2006. 337 с.
Кузнецов М.А. Динамика содержания органического углерода в заболоченных ельниках средней тайги: Автореф. дис. канд. биол. наук (спец. 03.02.08 экология). Сыктывкар: Ин-т биологии КомиНЦ УрО РАН, 2010. 18 с.
Мартынюк З.П., Бобкова К.С., Тужилкина В.В. Баланс углерода в лесных фитоценозах // Физиология растений. 1998. Т. 45. № 6. С. 794−798.
Ольчев А.В., Курбатова Ю.А., Татаринов Ф.А., Молчанов А.Г., Варлагин А.В., Горшков И.И., Выгодская Н.Н. Оценка первичной валовой и чистой продуктивности еловых лесов центрально-европейской части России с помощью полевых измерений и математической модели // Успехи соврем. биологии. 2009. Т. 129. № 6. С. 565‒578.
Павлов А.В. Энергообмен в ландшафтной сфере Земли. Новосибирск: Наука, 1984. 254 с.
Сенькина С.Н. Биопродукционные показатели влагообмена сосны и ели в хвойных фитоценозах средней тайги // Хвойные бореал. зоны. 2013. Т. 31. № 3‒4. С. 71‒75.
Чебакова Н.М., Выгодская Н.Н., Арнет А., Белелли Марчезини Л., Колле О., Курбатова Ю.А., Парфенова Е.И., Валентини Р., Ваганов Е.А., Шульце Е.-Д. Энерго- и массообмен и продуктивность основных экосистем Сибири (по результатам измерений методом турбулентных пульсаций). 1. Структура теплового баланса за период вегетации // Изв. РАН. Сер. биол. 2013. № 6. С. 727‒737.
Чебакова Н.М., Выгодская Н.Н., Арнет А., Белелли Марчезини Л., Курбатова Ю.А., Парфенова Е.И., Валентини Р., Верховец С.В., Ваганов Е.А., Шульце Е.-Д. Энерго- и массообмен и продуктивность основных экосистем Сибири (по результатам измерений методом турбулентных пульсаций). 2. Углеродный обмен и продуктивность // Изв. РАН. Сер. биол. 2014. № 1. С. 65‒75.
Швиденко А.З., Щепаченко Д.Г. Углеродный бюджет лесов России // Сиб. лес. журн. 2014. № 1. С. 69‒92.
Alekseychik P., Lappalainen H., Petäjä T., Zaitseva N., Heimann M., Laurila T., Lihavainen H., Asmi E., Arshinov M., Shevchenko V., Makshtas A., Dubtsov S., Mikhailov E., Lapshina E., Kirpotin S., Kurbatova Yu., Ding A., Guo H., Park S., Lavric J., Reum F., Panov A., Prokushkin A., Kulmala M. Ground-based station network in Arctic and Subarctic Eurasia: an overview // Geogr. Envir. Sustain. 2016. № 2. V. 9. P. 75‒81.
Amiro B.D., Barr A.G., Black T.A., Iwashita H., Kljun N., McCaughey J.H., Morgenstern K., Murayama S., Nesic Z., Orchansky A.L., Saigusa N. Carbon, energy and water fluxes at mature and disturbed forest sites, Saskatchewan, Canada // Agricult. Forest Meteorol. 2006. V. 136. P. 237‒251.
Arneth A., Veenendaal E., Best C., Timmermans W., Kolle O., Montagnani L., Shibistova O. Water use strategies and ecosystem-atmosphere exchange of CO2 in two highly seasonal environments // Biogeosciences. 2006. V. 3. P. 421‒437.
Baldocchi D.D., Hincks B.B., Meyers T.P. Measuring biosphere-atmosphere exchanges of biologically related gases with micrometeorological methods // Ecology. 1988. V. 69. № 5. P. 1331‒1340.
Baldocchi D., Kelliher F., Black T., Jarvis P. Climate and vegetation controls on boreal zone energy exchange // Glob. Change Biol. 2000. V. 6 (Suppl. 1). P. 69‒83.
Barr A., Black T., Hogg E., Griffits T., Morgenstern K., Kljun N., Theede A., Nesic Z. Climatic control on the carbon and water balances of boreal aspen forest, 1994–2003 // Glob. Change Biol. 2007. V. 13. P. 561‒576.
Bronson D., Gower S. Ecosystem warming does not affect photosynthesis or aboveground autotrophic respiration for boreal black spruce // Tree Physiol, 2010. V. 30. P. 441‒449.
Brummer Ch., Black T.A., Jassal R., Grant N., Spittlehouse D., Chen B., Nesic Z., Amiro B., Arain M.A., Barr A., Bourque Ch., Coursolle C., Dunn A., Flanagan L.B., Humphreys E., Lafleur P., Margolis H., McCoughey J.H., Wofsy S. How climate and vegetation type influence evapotranspiration and water use efficiency in Canadian forest, peatland and grassland ecosystems // Agricult. Forest Meteorol. 2012. V. 153. P. 14‒30.
Dolman A.J., Shvidenko A., Schepachenko D., Ciais P., Tchebakova N., Chen T., van der Molen M.K., Belelli Marchesini L., Maximov T., Maksyutov S., Shulze E.-D. An estimate of the terrestrial carbon budget of Russia using inventory-based, eddy covariance and inversion methods // Biogeosciences. 2012. V. 9. P. 5323‒5340.
Foken Th., Wichura B. Tools for quality assessment of surface-based flux measurements // Agricult. Forest Meteorol. 1996. V. 78. P. 83‒105.
Gauthier S., Bernier P., Kuuluvainen T., Shvidenko A.Z., Schepaschenko D.G. Boreal forest health and global change // Science. 2015. V. 349. P. 819‒822.
Goulden M., Wofsy S., Harden J., Trumbore S., Crill P., Gower S., Fires T., Daube B., Fan S.-M., Sutton D., Bazzaz A., Munger J. Sensitivity of boreal forest carbon balance to soil thaw // Science. 1998. V. 279. P. 214‒217.
Hollinger D.Y., Golts S.M., Davidson E.A., Lee J.T., Tu K., Valentine H.T. Seasonal patterns and environmental controls of carbon dioxide and water vapor exchange in an ecotonal boreal forest // Glob. Change Biol. 1999. V. 5. P. 891‒902.
Hollinger D.Y., Aber J., Dail B., Davidson E.A., Goltz S.M., Hughes H., Leclerc M.Y., Lee J.T., Richardson A.D., Rodrigues C., Scott N.A., Achuatavarier D., Walsh J. Spatial and temporal variability in forest-atmosphere CO2 exchange // Glob. Change Biol. 2004. V. 10. P. 1689‒1706.
Kasurinen V., Alfredsen K., Kolari P., Mammarella I., Alekseychik P., Rinne J., Vesala T., Bernier P., Boike J., Langer M., Bellelli Marshesini L., Huisstened K.V., Dolman H., Sachs T., Ohta T., Varlagin A., Rocha A., Arain A., Oechel W., Lund M., Grelle A., Lindroth A., Black A., Aurela M., Laurila T., Lohila A., Berninger F. Latent heat exchange in the boreal and arctic biomes // Glob. Change Biol. 2014. V. 20. P. 3439‒3456.
Kutzbach L., Wille C., Pfeiffer E.-M. The exchange of carbon dioxide between wet arctic tundra and the atmosphere at the Lena River Delta, Northern Siberia // Biogeosciences. 2007. V. 4. № 5. P. 869‒890.
Lafleur P.M. Growing season energy and CO2 exchange at a subarctic boreal woodland // J. Geophys. Res. Atmospheres. 1999. V. 104. P. 9571‒9580.
Launianen S. Seasonal and inter-annual variability of energy exchange above a boreal Scots pine forest // Biogeosciences. 2010. V. 7. P. 3921‒3940.
McCaughey J.H., Pejam M.R., Arain M.A., Cameron D.A. Carbon dioxide and energy fluxes from a boreal mixedwood forest ecosystem in Ontario, Canada // Agricult. Forest Meteorol. 2006. V. 140. P. 79‒96.
Piao S., Ciais P., Friedlingstein P., Peylin P., Reichstein M., Luyssaert S., Margolis H., Fang J., Barr A., Chen A., Grelle A., Holliger D., Laurila T., Lindroth A., Richardson A., Vesala T. Net carbon dioxide losses of northern ecosystems in response to autumn warming // Nature. 2008. № 456. P. 49‒52.
Sevanto S., Suni T., Pumpanen L., Grönholm T., Kolari P., Nikinmaa E., Hari P., Vesala T. Wintertime photosynthesis and water uptake in boreal forest // Tree Physiol. 2006. V. 26. P. 749‒757.
Suni T., Berninger F., Vesala T., Markkanen T., Hari P., Makela A., Ilvesniemi H., Hanninen H., Nikinmaa E., Lindroth A., Arneth A., Shibistova O., Lloid J. Air temperature triggers the recovery of evergreen boreal forest photosynthesis in spring // Glob. Change Biol. 2003. V. 9. P. 1410‒1426.
Ueyama M., Iwata H., Harazono Y. Autumn warming reduces the CO2 sink of a black spruce forest in interior Alaska on a nine-year eddy covariance measurement // Glob. Change Biol. 2014. V. 20. P. 1161‒1173.
Zamolodchikov D., Karelin D., Ivaschenko A., Oechel W., Hastings S. CO2 flux measurements in Russian Far East tundra using eddy covariance and closed chamber techniques // Tellus. 2003. № 55B. P. 879‒892.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


