Известия РАН. Серия биологическая, 2020, № 4, стр. 339-346
Содержание жирных кислот в гепатопанкреасе камчатского краба Баренцева моря
А. Г. Дворецкий 1, *, Ф. А. Бичкаева 2, Н. Ф. Баранова 2, В. Г. Дворецкий 1
1 Мурманский морской биологический институт Кольского научного центра РАН
183010 Мурманск, ул. Владимирская, 17, Россия
2 Институт физиологии природных адаптаций Федерального исследовательского центра комплексного изучения Арктики РАН
163000 Архангельск, просп. Ломоносова, 249, Россия
* E-mail: dvoretskiya@mmbi.info
Поступила в редакцию 14.08.2018
После доработки 27.07.2019
Принята к публикации 06.08.2019
Аннотация
Проведено исследование жирно-кислотного (ЖК) состава гепатопанкреаса камчатского краба Баренцева моря. Установлено, что основную его долю составили полиненасыщенные ЖК (11792 ± 592 мкг/г, 45.3 ± 0.7% суммы метиловых эфиров ЖК). Отмечено, что насыщенные и мононенасыщенные ЖК встречались примерно в равной пропорции, 7825 ± 454 мкг/г (28.3 ± 0.4%) и 7661 ± 510 мкг/г (26.4 ± ± 0.6%) соответственно. Выявлены межгодовые и межполовые различия в ЖК-профилях изученных животных. Обнаружено, что размеры особей, возраст экзоскелета и число травмированных ног, приходящееся на одного краба, не оказывали влияния на ЖК-состав гепатопанкреаса. С учетом высокой концентрации эссенциальных ЖК семейств омега-3 и омега-6 гепатопанкреас баренцевоморского камчатского краба можно рассматривать как источник для экстракции этих ценных веществ.
Нативный ареал камчатского краба Paralithodes camtschaticus – тихоокеанский регион. Для пополнения ресурсов Баренцева моря этот вид был вселен в новое место обитания (Кузьмин, Гудимова, 2002). К настоящему времени камчатский краб сформировал новую устойчивую популяцию, коммерческая эксплуатация которой в Российской Федерации была начата в 2004 г. (Дворецкий, 2014; Dvoretsky, Dvoretsky, 2015a, 2018).
Камчатский краб – одновременно вид-вселенец и ценный промысловый ресурс – стал объектом пристального внимания ученых. Наряду с исследованиями, касающимися влияния краба на местную экосистему (Дворецкий, 2012, 2013а, 2013б, 2014; Dvoretsky, Dvoretsky, 2015a), изучались его рост, развитие, линька и симбиотические связи (Кузьмин, Гудимова, 2002; Камчатский…, 2003; Дворецкий, Кузьмин, 2008; Дворецкий, 2013б; Dvoretsky, Dvoretsky, 2013, 2014, 2015b, 2016), динамика промысловых показателей вида (Стесько, 2015; Dvoretsky, Dvoretsky, 2018), а также физиология и биохимия (Камчатский…, 2003; Зензеров, Типисова, 2009; Dvoretsky, Dvoretsky, 2010; Дворецкий, 2012; Павлова, 2015).
В пищеварительной системе ракообразных гепатопанкреас – орган, который выполняет функции, аналогичные тем, что выполняют печень и поджелудочная железа у позвоночных животных. Гепатопанкреас секретирует большое количество пищеварительных ферментов, обладающих широкой специфичностью и высокой активностью, и поэтому используется как источник нетоксичного сырья для получения ферментных препаратов (Камчатский…, 2003). Активность этого органа может изменяться при энергозатраных физиологических процессах, связанных с линькой, регенерацией конечностей и размножением (Gibson, Barker, 1979). Однако гепатопанкреас содержит также и другие ценные компоненты, включая жирные кислоты (ЖК). Масса данного органа составляет 8–10% общей массы тела камчатского краба. В литературе приводятся данные о процентном содержании ЖК в гепатопанкреасе P. camtschaticus, обитающего в Баренцевом море (Камчатский…, 2003) и Тихоокеанском регионе (Latyshev et al., 2009), однако для прикладной и фундаментальной науки полезно иметь сведения об абсолютном содержании этих веществ. Также следует отметить малую изученность вариаций содержания ЖК гепатопанкреаса краба в зависимости от разных факторов.
Цель работы – определить содержание ЖК в гепатопанкреасе камчатского краба, обитающего в прибрежье Баренцева моря, и проверить гипотезу о различии содержания ЖК у животных в зависимости от пола, размера, стадии линочного цикла и числа травмированных конечностей.
МАТЕРИАЫ И МЕТОДЫ
Материал для исследований был отобран в ходе береговых экспедиций (губа Дальнезеленецкая, июль 2015 и 2016 гг.). Крабов отлавливали водолазы с глубин 8–38 м.
Обработку животных проводили в лаборатории биостанции Мурманского морского биологического института. Стандартная процедура включала в себя промеры, взвешивание, определение пола, линочной категории, стадий зрелости самок краба. Пол крабов определяли путем внешнего осмотра абдомена и его придатков. После вскрытия животного проводили отбор пробы гепатопанкреаса (10–30 г) с помощью пинцета и ножниц. Пробы помещали в маркированный пластиковый пакет и замораживали (при –24°С) для дальнейшей транспортировки и анализа в лаборатории Института физиологии природных адаптаций ФГБУН ФИЦКИА РАН. Образец ткани гепатопанкреаса в замороженном виде (2–3 г) гомогенизировали в фарфоровой ступке пестиком 3–5 мин до пластичной однородной массы. Экстрагирование липидов и метилирование ЖК проводили методом Бичкаевой и др. (Бичкаева и др., 2019). В колбу, содержавшую 0.3–0.5 г гомогенизированной ткани гепатопанкреаса, добавляли 10 мл экстрагирующей смеси хлороформ–метанол (2 : 1) и рассчитанное количество раствора внутреннего стандарта нонадекановой кислоты (С19:0) в хлороформе (см3), соответствующее 0.2 мг С19:0. Содержимое колбы перемешивали в течение 30 мин и оставляли на 10–12 ч в термостате при 25°С для полной экстракции липидов. После расслоения раствора на две фазы верхний слой, содержавший водорастворимые примеси, удаляли пипеткой Пастера, не задевая нижний слой, содержавший липиды. Далее в пробирку добавляли 0.5–1 мл метанола до исчезновения мути и упаривали под вакуумом на приборе “Мультивапор”. После окончания упаривания проводили метилирование. Упаренный экстракт растворяли в 0.2 мл смеси хлороформ–метанол (2 : 1), перемешивали и добавляли 2 мл метилирующей смеси (1.5% раствора H2SO4 в метаноле), закрывали переходником с герметичной септой и устанавливали на платформу “Мультивапор” для инкубации (температура водяной бани 90°С) при постоянном перемешивании (120 об./мин) на 30 мин. По окончании инкубации пробу переносили в пробирку с притертой пробкой (10 мл), смывали остатки пробы 1.5 мл гексаноэфирной смесью. Затем в пробу добавляли 0.8 мл дистиллированной воды, перемешивали в течение 1 мин на встряхивателе и оставляли на 2–4 ч до расслоения и исчезновения мути в нижней фазе. Верхний слой отбирали в виалу вместимостью 2 мл, и проводили экстракцию в пробирке еще раз тем же количеством гексаноэфирной смеси. После расслоения верхний слой переносили в виалу с первым экстрактом. Далее пробы в виале упаривали до объема 200 мкл под вакуумом в библиотеке “Мультивапора” по растворителю “гексан”, подбирая режим: температуру воды в бане (45°С), остаточное давление (195 мбар) и температуру кипения (25°С). Полученные метиловые эфиры ЖК разделяли на хроматографе Agilent 7890A (пламенно-ионизационный детектор (ПИД), капиллярная колонка Agilent DB-23, 60*0.25*0.15) в режиме программирования температуры колонки: 130°С (6.5°С/мин) → 170°С (2°С/мин) → 200°С (4°С/мин) → 230°С (7 мин) и скорости газа-носителя азота: 0.65 мл/мин (24 мин) → 1.15 мл/мин (5 мин) → 0.65 мл/мин (9.5 мин). Идентификацию ЖК осуществляли с использованием стандарта NU-CHEK PREP INS GLC RTFERENCE STANDARD 569 B (США). Количественный расчет ЖК проводили методом внутреннего стандарта (нонадекановая кислота) в программе Agilent Chem Station B.03.01 (США).
Общее число крабов, у которых изучали ЖК, составило 83 экз., из них 69 самок и 14 самцов (табл. 1).
Таблица 1.
Вариации размеров и массы камчатских крабов, использованных для биохимических исследований
| Пол | Ширина карапакса, мм | Масса, г | |||||||
|---|---|---|---|---|---|---|---|---|---|
| n | Х | SE | min | max | Х | SE | min | max | |
| 2015 г. | |||||||||
| Самки | 30 | 148.7 | 1.9 | 120.0 | 167.2 | 1778.9 | 60.2 | 984 | 2352 |
| Самцы | 7 | 175.1 | 6.6 | 140.5 | 189.8 | 2989.1 | 311.4 | 1341 | 3822 |
| Самки + самцы | 37 | 153.7 | 2.6 | 120.0 | 189.8 | 2007.9 | 108.0 | 984 | 3822 |
| 2016 г. | |||||||||
| Самки | 39 | 147.5 | 2.1 | 101.0 | 173.5 | 1817.3 | 69.1 | 591 | 2915 |
| Самцы | 7 | 174.6 | 13.7 | 122.5 | 230.0 | 3115.1 | 728.7 | 980 | 6320 |
| Самки + самцы | 46 | 151.6 | 3.0 | 101.0 | 230.0 | 2014.8 | 137.9 | 591 | 6320 |
| Общее | |||||||||
| Самки | 69 | 148.0 | 1.4 | 101.0 | 173.5 | 388.5 | 46.8 | 591 | 2915 |
| Самцы | 14 | 174.9 | 7.3 | 122.5 | 230.0 | 1425.9 | 381.1 | 980 | 6320 |
| Самки + самцы | 83 | 152.5 | 2.0 | 101.0 | 230.0 | 818.4 | 89.8 | 591 | 6320 |
Примечание. min, max, X – соответственно минимальное, максимальное и среднее значение, SE – стандартная ошибка, n – объем выборки; для табл. 1 и 2.
Статистическую обработку полученных данных проводили с использованием компьютерного пакета прикладных программ NCSS PASS 2004. Средние значения были представлены со стандартной ошибкой (±SE). Сравнение средних концентраций ЖК у разных групп крабов осуществляли с применением однофакторного дисперсионного анализа (F) или теста Краскела–Уоллиса (H), когда распределение данных отличалось от нормального.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Отмечена более низкая средняя ширина карапакса у самок по сравнению с таковой у самцов (df = 1, H = 14.77, p < 0.001). Средняя масса тела также была достоверно более низкой у самок P. camtschaticus (df = 1, H = 14.21, p < 0.001).
В выборке были представлены крабы разных стадий линьки, среди них преобладали животные, возраст экзоскелета которых составлял 5–6 мес. Все самки, кроме одной, находились на второй стадии линочного цикла, тогда как среди самцов таковых было 5 экз. Остальные 10 крабов имели более старый экзоскелет (третья ранняя и третья поздняя стадии линьки).
Данные о содержании ЖК в гепатопанкреасе камчатского краба обобщены в табл. 2. Среди насыщенных жирных кислот (НЖК), на которые приходилось в среднем 28.2–28.9% общего количества метиловых эфиров ЖК, преобладали пальмитиновая (С16:0) (3923 ± 2411 мкг/г, 15.1 ± 0.3% у самок и 5381 ± 902 мкг/г, 14.6 ± 0.6% у самцов) и стеариновая (С18:0) (1811 ± 102 мкг/г, 7.3 ± 0.2% у самок и 2737 ± 352 мкг/г, 7.9 ± 0.5% у самцов) кислоты. Доля мононенасыщенных жирных кислот (МНЖК) составила 26.1–27.7%, в первую очередь за счет олеиновой C18:1n9 (3047 ± 247 мкг/г, 11.3 ± 0.4% у самок и 4401 ± 737 мкг/г, 11.9 ± 0.7% у самцов) и пальмитоолеиновой C16:1 (2022 ± ± 149 мкг/г, 7.4 ± 0.3% у самок и 3238 ± 741 мкг/г, 8.0 ± 1.0% у самцов) кислот. В гепатопанкреасе камчатского краба преобладали полиненасыщенные жирные кислоты (ПНЖК) (среднее содержание 43.4–45.73%), среди которых особую роль играют семейства омега-3 и омега-6 ЖК. Основной вклад в омега-3 ЖК, средняя доля которых составила 32.8–36.7%, обеспечивали эйкозапентаеновая кислота (ЭПК, С20:5n3) (4692 ± 231 мкг/г, 19.8 ± 0.5% у самок и 6312 ± 811мкг/г, 18.4 ± 0.7% у самцов) и докозагексаеновая кислота (ДГК, С22:6n3) (3608 ± 246 мкг/г, 14.4 ± 0.5% у самок и 3963 ± 562 мкг/г, 12.0 ± 1.1% у самцов). Среди омега-6 ЖК (9.4–10.6%) преобладала арахидоновая кислота (С20:4n6) (1246 ± 85 мкг/г, 5.3 ± 0.3% у самок и 1993.5 ± 265.3 мкг/г, 6.1 ± 0.7% у самцов). Если объединить данные по самкам и самцам, то содержание ЖК будет следующим: ПНЖК – 11 792 ± 592 мкг/г (45.3 ± 0.7%), НЖК – 7825 ± ± 454 мкг/г (28.3 ± 0.4%) и МНЖК – 7661 ± ± 510 мкг/г (26.4 ± 0.6%).
Таблица 2.
Содержание жирных кислот в гепатопанкреасе камчатского краба из губы Дальнезеленецкая, Баренцево море
| Жирная кислота |
Абсолютное количество, мкг/г | Относительное содержание, % суммы метиловых эфиров | ||||||
|---|---|---|---|---|---|---|---|---|
| самки | самцы | самки | самцы | |||||
| min–max | X ± SE | min–max | X ± SE | min–max | X ± SE | min–max | X ± SE | |
| С6:0 | 0.4–60.3 | 4.4 ± 1.1 | 0.7–96.6 | 19.6 ± 9.5 | 0.00–0.33 | 0.02 ± 0.00 | 0.00–0.39 | 0.05 ± 0.03 |
| С8:0 | 1.0–15.1 | 5.2 ± 0.4 | 0.9–32.5 | 8.8 ± 2.1 | 0.00–0.09 | 0.02 ± 0.00 | 0.01–0.13 | 0.03 ± 0.01 |
| С9:0 | 0.7–9.9 | 3.4 ± 0.2 | 0.9–8.8 | 4.3 ± 0.6 | 0.01–0.04 | 0.01 ± 0.00 | 0.01–0.02 | 0.01 ± 0.00 |
| С10:0 | 1.1–20.9 | 9.6 ± 0.6 | 1.4–73.7 | 25.9 ± 5.5 | 0.02–0.10 | 0.04 ± 0.00 | 0.03–0.15 | 0.07 ± 0.01 |
| С11:0 | 0.7–50.3 | 5.1 ± 0.8 | 0.8–7.8 | 4.6 ± 0.5 | 0.01–0.24 | 0.02 ± 0.00 | 0.01–0.02 | 0.01 ± 0.00 |
| С12:0 | 2.2–50.4 | 16.7 ± 1.2 | 4.9–74.2 | 27.7 ± 5 | 0.02–0.13 | 0.07 ± 0.00 | 0.03–0.13 | 0.08 ± 0.01 |
| С13:0 | 0.9–32 | 11 ± 0.8 | 1.3–30.5 | 15.2 ± 2 | 0.01–0.11 | 0.04 ± 0.00 | 0.02–0.08 | 0.05 ± 0.01 |
| С14:0 | 23.3–2377.2 | 757.5 ± 59.6 | 33.8–2683.7 | 1125.0 ± 193.2 | 0.53–6.03 | 2.71 ± 0.12 | 0.75–5.53 | 2.95 ± 0.32 |
| С15:0 | 19.7–400.9 | 210.6 ± 12.7 | 29.1–623.1 | 351.3 ± 45.6 | 0.41–1.37 | 0.82 ± 0.03 | 0.65–1.85 | 1.01 ± 0.10 |
| С16:0 | 492.5–9418.5 | 3923 ± 241.1 | 650.5–11402.2 | 5380.5 ± 902.4 | 9.57–27.31 | 15.11 ± 0.29 | 10.01–19.18 | 14.6 ± 0.64 |
| С17:0 | 39.4–331.9 | 175 ± 9.1 | 50.9–479.8 | 280.4 ± 31.5 | 0.30–1.38 | 0.75 ± 0.03 | 0.55–1.46 | 0.86 ± 0.08 |
| С18:0 | 284.3–4465.8 | 1811.3 ± 101.9 | 340.8–5317.9 | 2736.5 ± 351.7 | 4.18–11.8 | 7.26 ± 0.17 | 5.4–11.36 | 7.93 ± 0.50 |
| С20:0 | 6.4–328.4 | 116.2 ± 8.4 | 6.1–260.5 | 134.2 ± 21.7 | 0.15–1.00 | 0.44 ± 0.02 | 0.08–0.70 | 0.36 ± 0.04 |
| С21:0 | 1.6–179.6 | 37.6 ± 4.1 | 1.3–257.6 | 77.8 ± 20.2 | 0.02–0.52 | 0.15 ± 0.01 | 0.03–0.41 | 0.2 ± 0.04 |
| С22:0 | 2.9–146.9 | 36.0 ± 3.5 | 4.9–64 | 28.4 ± 4.6 | 0.05–0.59 | 0.15 ± 0.01 | 0.05–0.11 | 0.08 ± 0.01 |
| С23:0 | 0.1–417.4 | 97.7 ± 13.1 | 0.2–559 | 163.4 ± 50.4 | 0.00–1.20 | 0.34 ± 0.04 | 0.00–1.05 | 0.37 ± 0.10 |
| С24:0 | 0.3–313.4 | 67.7 ± 9.7 | 3.8–393.7 | 113.8 ± 35 | 0.00–1.31 | 0.24 ± 0.03 | 0.00–0.63 | 0.25 ± 0.06 |
| С14:1t | 0.3–15.1 | 4.9 ± 1.2 | 0.4–23.9 | 6.2 ± 3.3 | 0.00–0.09 | 0.01 ± 0.00 | 0.00–0.05 | 0.01 ± 0.00 |
| C14:1 | 2.2–105.7 | 22.9 ± 2.1 | 0.9–141.6 | 40.7 ± 9.6 | 0.03–0.26 | 0.09 ± 0.01 | 0.02–0.43 | 0.11 ± 0.03 |
| С15:1 | 0.6–237.3 | 83.3 ± 6.8 | 0.3–133.2 | 66.3 ± 19.6 | 0.00–1.01 | 0.30 ± 0.03 | 0.00–0.50 | 0.13 ± 0.05 |
| С16:1t | 0.4–135.3 | 36.9 ± 4.3 | 0.1–92.1 | 25.6 ± 9.1 | 0.00–0.84 | 0.14 ± 0.02 | 0.00–0.37 | 0.07 ± 0.03 |
| C16:1C | 116.2–5355.1 | 2022.1 ± 148.7 | 96.3–9930 | 3237.7 ± 740.8 | 2.69–14.6 | 7.38 ± 0.32 | 2.14–15.81 | 8.02 ± 1.04 |
| С17:1 | 0.5–29.1 | 9.2 ± 0.7 | 1.7–27.6 | 13.8 ± 2.2 | 0.01–0.13 | 0.04 ± 0.00 | 0.00–0.05 | 0.03 ± 0.00 |
| С18:1n9t | 12.3–941.7 | 168.4 ± 15.7 | 18.2–578 | 277.5 ± 39.4 | 0.00–3.81 | 0.66 ± 0.06 | 0.40–1.05 | 0.77 ± 0.05 |
| C18:1n9 | 145.8–10718.3 | 3047.2 ± 246.9 | 551.1–9706.5 | 4400.5 ± 736.6 | 0.51–20.96 | 11.33 ± 0.38 | 8.57–16.45 | 11.88 ± 0.61 |
| С20:1 | 33.6–6264.3 | 1373.1 ± 119.2 | 53.8–5156.2 | 1885.7 ± 395.1 | 0.80–12.25 | 4.84 ± 0.25 | 1.20–17.36 | 5.39 ± 1.13 |
| С22:1 | 0.7–823.2 | 238.5 ± 19.7 | 0.8–1038.2 | 368.4 ± 74.1 | 0.02–1.61 | 0.85 ± 0.05 | 0.02–2.14 | 1.02 ± 0.17 |
| С24:1 | 0.2–350.5 | 123.9 ± 11.5 | 0.3–287.8 | 103.9 ± 25.4 | 0.01–1.21 | 0.44 ± 0.03 | 0.00–1.13 | 0.29 ± 0.08 |
| С18:2n6t | 1.0–402.8 | 56.3 ± 13.5 | 0.9–42.1 | 18.0 ± 3.0 | 0.00–1.06 | 0.14 ± 0.03 | 0.02–0.11 | 0.05 ± 0.01 |
| С18:2n6 | 39.6–1856.2 | 323.1 ± 31.4 | 74.9–1015.7 | 439.4 ± 77.6 | 0.69–3.63 | 1.22 ± 0.05 | 0.58–2.09 | 1.21 ± 0.10 |
| С18:3n3 | 3.5–773.6 | 164.8 ± 15.3 | 10.6–561.5 | 219.1 ± 42.2 | 0.04–1.51 | 0.61 ± 0.03 | 0.24–1.34 | 0.59 ± 0.09 |
| С18:3n6 | 0.7–198.3 | 39.9 ± 4.8 | 0.8–212.2 | 52.2 ± 15.8 | 0.02–0.50 | 0.14 ± 0.01 | 0.02–0.33 | 0.12 ± 0.02 |
| С20:2n6 | 62.4–1255.8 | 420.3 ± 28.7 | 92.1–1377.2 | 685.4 ± 98.3 | 0.85–2.78 | 1.65 ± 0.05 | 1.00–4.14 | 2.02 ± 0.21 |
| С20:3n6 | 3.2–163.9 | 51.1 ± 4.2 | 3.7–221.9 | 107.4 ± 16.4 | 0.07–0.42 | 0.19 ± 0.01 | 0.08–0.67 | 0.29 ± 0.04 |
| С20:4n6 | 281.7–4163.3 | 1246.3 ± 84.6 | 353.1–4350.4 | 1993.5 ± 265.3 | 1.75–14.34 | 5.30 ± 0.26 | 3.29–13.09 | 6.07 ± 0.66 |
| С22:2n6 | 0.4–41.2 | 11.8 ± 0.9 | 1.3–27.1 | 14.8 ± 2.2 | 0.01–0.09 | 0.04 ± 0.00 | 0.02–0.07 | 0.04 ± 0.00 |
| С20:5n3 | 1098.2–10374.4 | 4691.7 ± 230.6 | 1075.7–13290.5 | 6312.1 ± 811.3 | 9.40–28.82 | 19.8 ± 0.52 | 14.92–23.96 | 18.44 ± 0.71 |
| С22:6n3 | 582.6–10839 | 3608 ± 246 | 953.7–9674.7 | 3962.5 ± 561.7 | 7.50–25.05 | 14.38 ± 0.46 | 7.73–21.24 | 12.02 ± 1.05 |
| С20:3n3 | 7.9–622.6 | 147.9 ± 14.1 | 7.2–698.4 | 208.7 ± 45 | 0.00–1.35 | 0.54 ± 0.04 | 0.16–2.10 | 0.6 ± 0.13 |
| С22:4n6 | 5.3–225.7 | 83.8 ± 6.5 | 5.3–454.9 | 186.2 ± 40.2 | 0.13–0.65 | 0.32 ± 0.01 | 0.12–0.77 | 0.46 ± 0.05 |
| С22:3n3 | 0.1–31.1 | 7.2 ± 0.6 | 0.2–18.7 | 8.9 ± 1.9 | 0.00–0.06 | 0.03 ± 0.00 | 0.01–0.06 | 0.02 ± 0.00 |
| С22:5n6 | 8.2–424.6 | 98.2 ± 9.3 | 12.5–246.1 | 110.0 ± 18.8 | 0.18–1.27 | 0.38 ± 0.02 | 0.16–0.42 | 0.30 ± 0.02 |
| С22:5n3 | 9.7–611.4 | 263 ± 17.4 | 45–907.8 | 400.6 ± 63.2 | 0.06–1.88 | 1.01 ± 0.04 | 0.72–1.69 | 1.12 ± 0.07 |
| ∑НЖК | 931.9–17582.3 | 7284.6 ± 429.6 | 1129.3–20464.7 | 10487.7 ± 1514 | 20.82–46.96 | 28.19 ± 0.41 | 25.15–31.91 | 28.92 ± 0.60 |
| ∑МНЖК | 627.1–20889.5 | 7109.1 ± 499.7 | 723.9–19853.1 | 10381.7 ± 1614.3 | 14.46–40.85 | 26.07 ± 0.63 | 16.12–35.97 | 27.73 ± 1.47 |
| ∑ПНЖК | 2367.6–24034.6 | 11197.8 ± 600.5 | 2637.1–26385.7 | 14718.7 ± 1740.6 | 21.88–61.3 | 45.74 ± 0.80 | 35.09–58.73 | 43.36 ± 1.66 |
| Сумма | 4074.2–57358.2 | 25591.5 ± 1478.8 | 4490.4–64715.6 | 35588.0 ± 4765.2 | 100–100 | 100 | 100–100 | 100 |
| W-3 | 1901.9–18845.6 | 8880.0 ± 470.3 | 2092.5–20624.5 | 11111.9 ± 1368.6 | 18.03–49.09 | 36.37 ± 0.68 | 27.37–46.6 | 32.79 ± 1.41 |
| W-6 | 452.3–7099.3 | 2317.8 ± 155.7 | 544.6–6676.7 | 3606.8 ± 466.1 | 3.85–18.01 | 9.37 ± 0.32 | 7.16–20.09 | 10.57 ± 0.87 |
| W-9 | 477.1–18154.2 | 4948.7 ± 377.7 | 624.2–13557.7 | 7028.5 ± 1041.5 | 10.96–35.5 | 18.12 ± 0.50 | 13.52–29.83 | 19.36 ± 1.31 |
| W-7 | 117.3–5493.2 | 2063.9 ± 150.2 | 98.1–9957.6 | 3271.5 ± 740.6 | 2.75–14.73 | 7.55 ± 0.31 | 2.19–15.86 | 8.12 ± 1.03 |
| W-3/W-6 | 2.0–7.1 | 4.1 ± 0.1 | 1.5–5.5 | 3.3 ± 0.3 | 2.0–7.1 | 4.1 ± 0.1 | 1.5–5.5 | 3.3 ± 0.3 |
Двухфакторный дисперсионный анализ выявил достоверные различия в содержании ЖК как в зависимости от года исследований (df = 1, F = 19.36, p < 0.001), так и в зависимости от пола краба (df = 1, F = 9.45, p = 0.003). В 2015 г. среднее количество всех ЖК, найденное в гепатопанкреасе краба, составило 20 723 ± 1608, а в 2016 г. – 32 550 ± 2113 мкг/г. Достоверные различия между самцами и самками (p < 0.05) прослеживаются для 20 ЖК из 43 отмеченных, включая С16:0, С18:0, C18:1n9, С20:5n3 и С20:4n6. Различий в содержании омега-3 ПНЖК между самцами и самками не прослеживается (df = 1, F = 3.41, p = 0.067), обратный результат отмечен для омега-6 ПНЖК (df = 1, Н = 7.89, p = 0.005). В среднем в гепатопанкреасе самки содержалось 25 592 ± 1479, самца – 35 588 ± 4765 мкг/г ЖК.
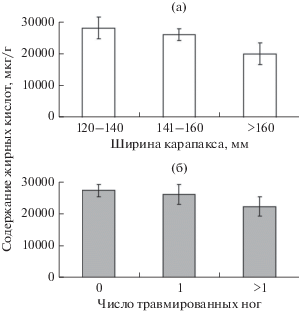
Вариации содержания ЖК в гепатопанкреасе камчатских крабов (использованы данные по числу самок, n = 69) у особей разного размера и с разным числом травмированных конечностей показаны на рис. 1. Результаты статистического анализа не выявили достоверного влияния указанных факторов в обоих случаях: df = 1, F = 1.35, p = 0.267 для ширины карапакса; df = 1, F = 1.06, p = 0.353 для уровня травматизма. На примере самцов камчатского краба проведена оценка роли возраста экзоскелета в формировании ЖК-профилей гепатопанкреаса. У особей второй стадии линьки общая сумма ЖК составила 31 479 ± 8315 мкг/г (n = 5), у особей третьей стадии линьки – 35 757 ± ± 5794 мкг/г (n = 10). Полученные величины не различались (df = 1, F = 0.18, p = 0.678).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследованном прибрежном районе самки встречались чаще, чем самцы. Это объясняется разным миграционным поведением особей: самцы после весеннего спаривания отправляются на откорм в открытое море, тогда как основная доля самок остается на небольших глубинах (Стесько, 2015; Dvoretsky, Dvoretsky, 2013, 2015a, 2018). Самки отличались меньшими размерами и массой тела, чем самцы схожего возраста. Это связано с тем, что темпы роста у половозрелых особей различаются: самки тратят энергию на откладку и вынашивание икры, тогда как самцы – только на соматический рост (Dvoretsky, Dvoretsky, 2013, 2015b).
Ранее проводились исследования содержания ЖК в гепатопанкреасе камчатского краба из Баренцева моря (Камчатский…, 2003). Установлено, что доли НЖК составили 15.2, МНЖК – 33.8, ПНЖК – 52.3%. В нашем случае эти показатели равнялись 28.3, 26.4 и 45.3% соответственно. Вероятно, полученные различия связаны с тем, что предыдущие исследования захватывали лишь самцов камчатского краба, тогда как у нас использовались сведения и о самцах, и о самках. Также отметим, что данные более ранних исследований затрагивают особей, отловленных на больших глубинах в другом районе (губа Ура, Западный Мурман), а мы рассматривали крабов, обитавших на относительно малых глубинах. Фактором глубины в данном случае обусловливаются различия видового состава биоценозов и, соответственно, кормовой базы крабов (Дворецкий, 2012).
Качественный состав ЖК был сходен с тем, что приводится для пищеварительного тракта, икры и мяса камчатского краба (Камчатский…, 2003; Latyshev et al., 2009). Относительное содержание омега-3 ЖК (35.8%) в гепатопанкреасе было близким к приводимому для пищевого продукта – мяса камчатского краба (42.4%) (Latyshev et al., 2009).
Соотношение омега-3/омега-6 в нашем исследовании составило 4.1 : 1 у самок и 3.3 : 1 у самцов. Для человека в питании оптимально соотношение 1 : 3–1 : 6, однако в современной диете жителей многих стран наблюдается преимущественное потребление омега-6 ЖК, в соотношении 15 : 1–20 : 1 к омега-3 ЖК (Nettleton, 1995; Patil, Gislerød, 2006). В связи с этим возникает необходимость в получении продуктов и препаратов с повышенным содержанием омега-3 ЖК. Гепатопанкреас камчатского краба может рассматриваться как потенциальный источник для экстракции этих веществ.
Выявлены межгодовые вариации в содержании ЖК, которые были тесно связаны с различиями в ЖК-составе гепатопанкреаса у самцов и самок (табл. 2). Видимо, пол краба имел решающее значение. Результаты сравнительного анализа показали, что другие факторы (размеры, число травмированных ног и возраст экзоскелета краба) не влияли на изучаемые показатели. Как отмечено выше, самцы и самки различаются по своей миграционной активности (Стесько, 2015; Dvoretsky, Dvoretsky, 2015a, 2018), поэтому спектр посещаемых биотопов, на которых происходит откорм животных, у крабов также варьирует в широких пределах (Дворецкий, 2012; Павлова, 2015). Ранее было показано, что именно питание – основной источник поступления ЖК в организм животных высоких трофических уровней (Iverson et al., 2002; Castell et al., 2004; Hall et al., 2006; Richoux, Froneman, 2008; Нефедова и др., 2018). Вероятно, именно различия биохимического состава пищевых объектов оказывают влияние на содержание ЖК в гепатопанкреасе крабов разного пола. Однако для подтверждения гипотезы о влиянии особенностей питания на ЖК-состав гепатопанкреаса P. camtschaticus необходимо продолжение биохимических исследований. Нельзя исключать возможные различия в физиологии половозрелых самцов и самок камчатского краба, связанные с особенностями энергозатрат на рост и размножение (Dvoretsky, Dvoretsky, 2014, 2015b), в результате чего возможно изменение биохимического состава гепатопанкреаса, как было показано на примере омара Nephrops norvegicus (Rosa, Nunes, 2002) и краба Portunus pelagicus (Abol-Munafi et al., 2016).
ЗАКЛЮЧЕНИЕ
В гепатопанкреасе камчатского краба основную долю составляют ПНЖК, на втором месте по встречаемости – НЖК, на третьем – МНЖК. Гепатопанкреас самок характеризовался меньшим суммарным содержанием ЖК по сравнению с самцами. Связь между размерами, возрастом экзоскелета, а также числом травмированных ног у крабов и их ЖК-профилями не установлена.
Выявлены высокие концентрации ценных омега-3 (8880 ± 470 мкг/г у самок и 11 111.9 ± ± 1368.6 мкг/г у самцов) и омега-6 ПНЖК (2318 ± ± 156 у самок и 3607 ± 466 мкг/г у самцов). Это позволяет рассматривать гепатопанкреас камчатского краба как альтернативный источник для экстракции ценных веществ пищевого и медицинского назначения.
Работа выполнена за счет финансирования Министерства науки и высшего образования РФ.
Список литературы
Бичкаева Ф.А., Баранова Н.Ф., Власова О.С., Третьякова Т.В., Нестерова Е.В., Шенгоф Б.А., Бичкаев А.А., Волкова Н.И. Методика измерений массовой концентрации метиловых эфиров жирных кислот (МЭЖК) в сыворотке крови методом газожидкостной хроматографии // Реестр методик измерений УрО РАН. № 88-16365-001-2019. № ФР.1.31.2019.33742.
Дворецкий А.Г. Вселение камчатского краба в Баренцево море и его воздействие на экосистему (обзор). 1. Выедание бентоса // Вопр. рыболовства. 2012. Т. 13. № 1(49). С. 18–34.
Дворецкий А.Г. Вселение камчатского краба в Баренцево море и его воздействие на экосистему (обзор). 2. Конкуренция с местными видами // Вопр. рыболовства. 2013а. Т. 14. № 1(53). С. 16–25.
Дворецкий А.Г. Вселение камчатского краба в Баренцево море и его воздействие на экосистему (обзор). 3. Ассоциированные организмы // Вопр. рыболовства. 2013б. Т. 14. № 3(55). С. 406–420.
Дворецкий А.Г. Вселение камчатского краба в Баренцево море и его воздействие на экосистему (обзор). 4. Промысел и социально-экономические аспекты // Вопр. рыболовства. 2014. Т. 15. № 1. С. 7–20.
Дворецкий А.Г., Кузьмин С.А. Симбионты камчатского краба в прибрежье Мурмана Баренцева моря // Вопр. рыболовства. 2008. Т. 9. № 3(35). С. 526–535.
Зензеров В.С., Типисова Е.В. Первые данные об уровнях тиреоидных гормонов (тироксин, трийодтиронин) и тиреотропного гормона гипофиза в гемолимфе камчатского краба Баренцева моря // Докл. РАН. 2009. Т. 428. № 6. С. 835–837.
Камчатский краб в Баренцевом море. Мурманск: Изд-во ПИНРО, 2003. 383 с.
Кузьмин С.А., Гудимова Е.Н. Вселение камчатского краба в Баренцево море. Особенности биологии, перспективы промысла. Апатиты: Изд-во КНЦ РАН, 2002. 236 с.
Нефедова З.А., Мурзина С.А., Пеккоева С.Н., Немова Н.Н. Сравнительная характеристика жирно-кислотного профиля смолтов кумжи Salmo trutta L. и атлантического лосося Salmo salar L. в период смолтификации (река Индера, бассейн Белого моря) // Изв. РАН. Сер. биол. 2018. № 2. С. 144–149.
Павлова Л.В. Экологический рацион камчатского краба в прибрежной мелководной зоне Баренцева моря // Докл. РАН. 2015. Т. 463. № 2. С. 244–249.
Стесько А.В. Распределение и состояние запаса камчатского краба в территориальных водах России в Баренцевом море // Вопр. рыболовства. 2015. № 2. С. 175–192.
Abol-Munafi A.B., Mukrim M.S., Amin R.M., Azra M.N., Azmie G., Ikhwanuddin M. Histological profile and fatty acid composition in hepatopancreas of blue swimming crab, Portunus pelagicus (Linnaeus, 1758) at different ovarian maturation stages // Turk. J. Fish. Aquat. Sci. 2016. V. 16. P. 251–258.
Castell J.D., Kennedy E.J., Robinson S.M.C., Parsons G.J., Blair T.J., Gonzalez-Duran E. Effect of dietary lipids on fatty acid composition and metabolism in juvenile green sea urchins (Strongylocentrotus droebachiensis) // Aquaculture. 2004. V. 242. P. 417–435.
Dvoretsky A.G., Dvoretsky V.G. Hemolymph molting hormone concentrations in red king crabs from the Barents Sea // Polar Biol. 2010. V. 33. P. 1293–1298.
Dvoretsky A.G., Dvoretsky V.G. Population dynamics of the invasive lithodid crab, Paralithodes camtschaticus, in a typical bay of the Barents Sea // ICES J. Mar. Sci. 2013. V. 70. P. 1255–1262.
Dvoretsky A.G., Dvoretsky V.G. Size-at-age of juvenile red king crab (Paralithodes camtschaticus) in the coastal Barents Sea // Cah. Biol. Mar. 2014. V. 55. № 1. P. 43–48.
Dvoretsky A.G., Dvoretsky V.G. Commercial fish and shellfish in the Barents Sea: Have introduced crab species affected the population trajectories of commercial fish? // Rev. Fish Biol. Fish. 2015a. V. 25. № 2. P. 297–322.
Dvoretsky A.G., Dvoretsky V.G. Size at maturity of female red king crab, Paralithodes camtschaticus, from the costal zone of Kola Peninsula (southern Barents Sea) // Cah. Biol. Mar. 2015b. V. 56. № 1. P. 49–54.
Dvoretsky A.G., Dvoretsky V.G. Inter-annual dynamics of the Barents Sea red king crab (Paralithodes camtschaticus) stock indices in relation to environmental factors // Polar Sci. 2016. V. 10. № 4. P. 541–552.
Dvoretsky A.G., Dvoretsky V.G. Red king crab (Paralithodes camtschaticus) fisheries in Russian waters: historical review and present status // Rev. Fish Biol. Fisheries. 2018. V. 28. № 2. P. 331–353.
Gibson R., Barker P.L. The decapod hepatopancreas // Oceanogr. Mar. Biol. Ann. Rev. 1979. V. 17. P. 285–346.
Hall D., Lee S.Y., Meziane T. Fatty acids as trophic tracers in an experimental estuarine food chain: tracer transfer // J. Exp. Mar. Biol. Ecol. 2006. V. 336. P. 42–53.
Iverson S.J., Frost K.J., Lang S.L. Fat content and fatty acid composition of forage fish and invertebrates in Prince William Sound, Alaska: factors contributing to among and within species variability // Mar. Ecol. Prog. Ser. 2002. V. 241. P. 161–181.
Latyshev N.A., Kasyanov S.P., Kharlamenko V.I., Svetashev V.I. Lipids and fatty acids of edible crabs of the north-western Pacific // Food Chem. 2009. V. 116. P. 657–661.
Nettleton J.A. Omega-3 fatty acids and health. N.Y.: Chapman and Hall, 1995. 359 p.
Patil V., Gislerød H.R. The importance of omega-3 fatty acids in diet // Curr. Sci. 2006. V. 90. № 7. P. 908–909.
Richoux N.B., Froneman P.W. Trophic ecology of dominant zooplankton and macrofauna in a temperate, oligotrophic South African estuary: a fatty acid approach // Mar. Ecol. Prog. Ser. 2008. V. 357. P. 121–137.
Rosa R., Nunes M.L. Biochemical changes during the reproductive cycle of the deep-sea decapod Nephrops norvegicus on the south coast of Portugal // Mar. Biol. 2002. V. 141. P. 1001–1009.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая