Известия РАН. Серия биологическая, 2020, № 4, стр. 347-351
Влияние модификации изотопного состава среды на рост и метаболическую активность представителей Rhodococcus и Saccharomyces
Н. Н. Волченко 1, А. А. Самков 1, В. В. Малышко 2, 3, А. А. Худокормов 1, А. В. Моисеев 4, А. А. Елкина 1, 3, *, М. Г. Барышев 1, 3, С. М. Першин 5
1 Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
2 Кубанский государственный медицинский университет Минздрава России
350063 Краснодар, ул. Седина, 4, Россия
3 ФИЦ Южный научный центр РАН
344006 Ростов-на-Дону, просп. Чехова, 41, Россия
4 Кубанский государственный аграрный университет
350004 Краснодар, ул. Калинина, 13, Россия
5 Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: 013194@mail.ru
Поступила в редакцию 11.03.2019
После доработки 08.08.2019
Принята к публикации 29.08.2019
Аннотация
Определены уровень продукции СО2 и динамика прироста биомассы бактерий Rhodococcus erythropolis VKM Ac2017D (Россия) и дрожжей штамма Saccharomyces cerevisiae OenofermC2 (Франция) в средах культивирования с по-разному сниженной (от 10 до 150 ppm) концентрацией дейтерия. В средах с концентрацией дейтерия 50 ppm и менее выявлен наибольший прирост биомассы родококков. Отмечено, что продукция СО2 как интегральный показатель биологической активности клеток более выражена у родококков по сравнению с дрожжами. Обнаружено, что при в целом схожей динамике кривых выделения СО2 прокариоты проявили более широкую временнýю динамику его продукции.
Изотопный состав среды оказывает существенное влияние на жизнедеятельность филогенетически отдаленных организмов (Gorokhova, 2017; Pershin et al., 2017; Шихлярова и др., 2018; Kolesnichenko et al., 2018; Nacu et al., 2018; Syroeshkin et al., 2018), так как сверхнизкие концентрации тяжелых нерадиоактивных изотопов биогенных элементов (2H, 13C, 15N, 17O, 18O и др.) способны воздействовать на функциональную активность биологических молекулярных систем (Чернуха и др., 2016; Koltover et al., 2016; Letuta, Avdeeva, 2017). В биообъектах особый интерес представляет исследование эффектов, вызванных изменением в среде соотношения D/H, формируемого парой изотопов c сильно различающимися массами и широко распространенными в живых системах (Kirkina et al., 2014; Xie, Zubarev, 2014; O’Brien, 2015; Dzhimak et al., 2018; Kosenkov et al., 2018; Lobyshev, 2018; Basov et al., 2019). Благодаря современным высокоэффективным методам получения обедненной дейтерием воды (ректификация воды в колоннах (Тхет Мьйо Аунг, Селиваненко, 2017; Александров и др., 2018), метод электролитического разделения (Барышев и др., 2013), диффузия водорода через палладиевые мембраны (Petriev et al., 2018a, b)) эти исследования получили широкое распространение. Известно, что ион водорода – ключевой элемент энергетического метаболизма любой клетки, осуществляющей окислительное фосфорилирование, поскольку формирование трансмембранного градиента протонов является важнейшим фактором функционирования АТФ-синтазы.
Объекты исследования выбирали с учетом результатов сравнения способности прокариотических и эукариотических организмов адаптироваться к модификации изотопного D/H-состава среды культивирования, ориентируясь, в частности, на значительную эволюционную отдаленность Saccharomyces cerevisiae и Rhodococcus erythropolis. Этот фактор в контексте энергетического метаболизма подразумевает у них принципиально разную локализацию клеточных структур, участвующих в создании трансмембранного градиента протонов, который необходим для функционирования АТФ-синтазы. При этом у бактерий этот градиент формируется на цитоплазматической мембране и ее производных, а у дрожжевых грибов – на внутренней мембране митохондрий.
Цель исследования – оценка уровня продукции СО2 и динамики роста биомассы прокариот (бактерий R. erythropolis VKM Ac2017D, Россия) и эукариот (дрожжей штамма S. cerevisiae OenofermC2, Франция) в средах культивирования с различной концентрацией дейтерия.
МАТЕРИАЛЫ И МЕТОДЫ
Культивирование микроорганизмов осуществляли в жидких минеральных средах с конечными концентрациями дейтерия 10, 50, 100 и 150 ppm. В качестве единственного субстрата углерода и энергии использовали сахарозу (146 мМ) (Samkov et al., 2015). Инокуляцию сред биомассой родококка осуществляли до концентрации, соответствующей оптической плотности 0.10–0.12 усл. ед. ((5.0–5.9) × 107 КОЕ/мл), инокуляцию сахаромицетами до концентрации, соответствующей оптической плотности 2.16–2.20 усл. ед. ((2.1–2.9) × × 108 КОЕ/мл), проводили с учетом рекомендуемых производственных инструкций культивирования исследуемого штамма S. cerevisiae OenofermC2 (Belo et al., 2003; http://www.krolsan.com.pl/krolsan/enzymy2/spir/oenofermc2.pdf). Продукцию CO2 регистрировали с помощью цифрового датчика газообразной углекислоты CO2-BTA (Vernier, США), динамику роста микроорганизмов – по оптической плотности клеточных суспензий при длине волны 670 нм на спектрофотометре Leki SS2107 (Финляндия). Содержание СО2 измеряли ежедневно с 1-х по 9-е сут, оптическую плотность измеряли на 1-, 4- и 9-е сут. Экспериментальные сосуды с культурой дрожжей находились в неподвижном состоянии при температурном оптимуме 38.0 ± 0.5°С, с культурой бактерий – в условиях встряхивания на орбитальном шейкере (120 об./мин) при оптимальной для данного штамма температуре 25.0 ± 0.5°С. Воду c пониженным cодеpжанием дейтеpия получали на уcтановке ЛВ-1 в бизнеc-инкубатоpе Кубанcкого государственного унивеpcитета. Концентрацию дейтеpия в полученной воде определяли (три повтора для каждого образца) на импульcном ЯМP-cпектpометpе JEOL JNM-ECA 400 MHz (Япония) (Dzhimak et al., 2015).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены результаты измерения оптической плотности клеточных суспензий микроорганизмов в процессе роста на жидких питательных средах с различным изотопным составом. Максимальный прирост концентрации клеточной биомассы родококков к 4-м сут роста был отмечен на среде с содержанием дейтерия 50 ppm, что могло быть обусловлено ускоренным прохождением цикла роста в периодической культуре с некоторым его замедлением на 9-е сут. Минимальный рост на протяжении всего периода культивирования наблюдался на среде с концентрацией дейтерия 100 ppm. Наибольший рост R. erythropolis VKM Ac2017D был обнаружен в средах с концентрацией дейтерия 50 ppm и менее, что могло быть опосредовано более благоприятными условиями их метаболизма при данном изотопном D/H-соотношении (O’Brien et al., 2014; Xie, Parmon, 2015; Zubarev, 2015). Полученные данные соответствуют математической модели, описывающей результаты разных авторов (Xie, Zubarev, 2015; Gorokhova, 2017):
Таблица 1.
Оптическая плотность клеточных суспензий микроорганизмов в процессе роста на жидких питательных средах с различным изотопным составом
| D, ppm M ± m | 1-е сут | 4-е сут | 9-е сут | |||
|---|---|---|---|---|---|---|
| S | R | S | R | S | R | |
| 10 | 2.16 ± 0.053 | 0.12 ± 0.003 | 2.23 ± 0.067 | 1.72 ± 0.043* | 2.43 ± 0.049 | 1.88 ± 0.039* |
| 50 | 2.19 ± 0.048 | 0.10 ± 0.003 | 2.27 ± 0.045 | 1.89 ± 0.040* | 2.38 ± 0.061 | 1.80 ± 0.037* |
| 100 | 2.20 ± 0.062 | 0.12 ± 0.004 | 2.25 ± 0.056 | 1.29 ± 0.023* | 2.34 ± 0.047 | 1.34 ± 0.034* |
| 150 | 2.19 ± 0.045 | 0.11 ± 0.002 | 2.28 ± 0.048 | 1.41 ± 0.035 | 2.39 ± 0.053 | 1.62 ± 0.049 |
где B > A, C = $\frac{{1.5 \times {{{10}}^{4}}}}{{{\pi }B}}$ + 300%.
Продукция CO2 как интегральный показатель биологической активности клеток была более выражена у родококков по сравнению с таковой у дрожжей. Пик продукционной активности углекислоты у R. erythropolis был отмечен на 2-е–3-и сут роста с дальнейшим постепенным его понижением к 9-м сут (рис. 1), а для S. cerevisiae нарастание выделения СО2 завершалось к 4-м–5-м сут с его снижением к 7-м сут и последующим вторичным повышением газовыделения (рис. 2).
Рис. 1.
Динамика содержания СО2 в газовой фазе сосуда культивирования при росте Rhodococcus erythropolis VKM Ac2017D (а) и Saccharomyces cerevisiae (б) при различных концентрациях дейтерия 10, 50, 100, 150 ppm (1–4 соответственно).
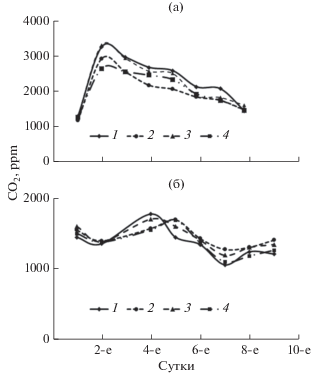
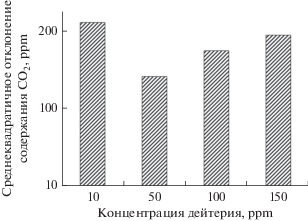
Рис. 2.
Среднеквадратичное отклонение содержания СО2 в газовой фазе сосуда культивирования при росте Saccharomyces cerevisiae OenofermC2 при различных концентрациях дейтерия.
Наблюдаемые особенности объясняются тем, что период снижения продукции СО2 соответствует наступлению стационарной фазы. При этом два пика продукции углекислоты у дрожжей могут быть связаны с более сложным характером катаболизма углеводов данными организмами. При достаточном количестве кислорода и наличии углеводного субстрата в среде родококки и дрожжи выделяют СО2 и демонстрируют прирост биомассы за счет окислительного декарбоксилирования пирувата и работы цикла трикарбоновых кислот. В то же время при недостатке конечного акцептора электронов дрожжи в отличие от родококков могут участвовать в процессе брожения, прежде всего спиртового, в результате которого под действием пируватдекарбоксилазы также образуется СО2. Динамика концентрации СО2 в газовой фазе сосуда культивирования показана на рис. 1 и 2.
Также следует отметить, что при в целом сходной форме динамики кривых выделения СО2 (для родококков логарифмические функции находились в диапазоне от ymin = 1.17ln(x) + 0.22, R2 = 0.89 до ymax = 1.66ln(x) + 0.27, R2 = 0.84, для сахаромицетов – от ymin = 0.12ln(x) + 2.19, R2 = 0.90 до ymax = = 0.23ln(x) + 2.14, R2 = 0.83)) в течение ростового эксперимента прокариоты проявили более высокую вариабельность его продукции согласно данным среднеквадратичного отклонения содержания СО2 в газовой фазе сосуда, показатели которого у дрожжей были ниже на 61.9−74.5% (рис. 3 ).
Это отличие, на наш взгляд, обусловлено более совершенными механизмами адаптации эукариотических дрожжевых микроорганизмов S. cerevisiae к вариациям изотопного D/H-состава среды по сравнению с таковыми у прокариотических клеток R. erythropolis. Для обоих исследуемых микроорганизмов была характерна более активная продукция СО2 в фазу логарифмического роста в средах с концентрацией дейтерия 10 ppm, чем в средах с концентрациями 50, 100, 150 ppm.
Для сравнительной оценки динамики роста на каждом этапе рассчитывали удельную скорость роста микроорганизмов (μ, ч–1) по формуле (Перт, 1978) μ = 2.3(lgXi − lgX0)/(ti − t0), где Xi и X0 − концентрации клеток в моменты времени ti и t0 соответственно. При этом удельная метаболическая активность, принятая в 1-е сут эксперимента у обоих микроорганизмов за 100%, у прокариот последовательно снижалась в течение всего эксперимента и составляла на 4-е сут 11–21% (соответственно μ = 0.0330–0.0408 ч–1), а на 9-е сут 7–11% (соответственно μ = 0.0003–0.0012 ч–1), что отражало постепенное замедление биохимических процессов по мере перехода из лаг-фазы в фазу экспоненциального роста, далее в стационарную и фазу отмирания. У S. cerevisiae аналогичный показатель характеризовался отсутствием отрицательной динамики на 4-е сут (98–119% или μ = = 0.0003–0.0006 ч–1) и достаточно постепенным снижением на 9-е сут (75−84% или μ = 0.0003–0.0007 ч–1). Это свидетельствует о менее резких колебаниях метаболической активности в зависимости от концентрации клеток.
Сверхнизкую концентрацию дейтерия в среде следует рассматривать как стрессовый фактор, в данном случае влияющий на сопряжение начальных этапов катаболизма сахаров (что характерно для обоих видов микроорганизмов (гликолиз)), а также на образование АТФ. В качестве показателя дисбаланса живой системы оценивали среднеквадратичное отклонение концентрации СО2, существенно зависящее от уровня эволюционной организации исследуемых микроорганизмов при их культивировании в средах с различным изотопным D/H-составом. При этом больший разброс значений среднеквадратичного отклонения был отмечен у S. cerevisiae (рис. 2).
Полученные результаты могут быть объяснены существенными в геохронологическом масштабе колебаниями концентрации дейтерия в гидросфере с достоверным ее возрастанием (Wang et al., 2009; Gorokhova, 2018), что подтверждается данными исследований, проведенных на оз. Восток в Антарктиде (Ekaykin et al., 2016). Все это, возможно, имело значение в процессе эволюции микроорганизмов, которая происходила при более низких концентрациях дейтерия в окружающей среде. При этом у прокариот и эукариот могли сформироваться различные адаптационные механизмы к определенным пониженным значениям соотношений D/Н, что подтверждается в том числе особенностями продукции СО2 и ростовой активности R. erythropolis и S. cerevisiae.
Работа выполнена при финансовой поддержке РФФИ (грант 19-44-233005) и государственного задания ЮНЦ РАН (№ АААА-А19-119040390083-6).
Список литературы
Александров Р.А., Лагунцов Н.И., Курчатов И.М., Сарычев Г.А., Нечаев И.А. Система водоснабжения с получением легкой воды на базе ядерного опреснительного комплекса // Атом. энергия. 2018. Т. 124. № 6. С. 336–339.
Барышев М.Г., Болотин С.Н., Фролов В.Ю., Джимак С.С., Пикула А.А., Долгов М.А., Шашков Д.И., Петриев И.С. Способы получения воды с пониженным содержанием дейтерия // Экол. вест. науч. центров Черноморск. эконом. сотрудничества. 2013. № 1. С. 13–17.
Перт С.Д. Основы культивирования микроорганизмов и клеток. М.: Мир, 1978. 330 с.
Тхет Мьйо Аунг, Селиваненко И.Л. Эффективность разделения изотопов водорода ректификацией воды в колоннах с пленочным и затопленным режимами работы насадки // Хим. пром-сть сегодня. 2017. № 2. С. 3–10.
Чернуха И.М., Федулова Л.В., Котенкова Е.А., Василевская Е.Р., Лисицин А.Б. Изучение влияния воды с модифицированным изотопным (D/H) составом на репродуктивную функцию, формирование и развитие потомства крыс // Вопр. питания. 2016. № 5. С. 36–43.
Шихлярова А.И., Жукова Г.В., Кит О.И., Куркина Т.А., Ширнина Е.А., Протасова Т.П., Елкина А.А., Барышев М.Г. Влияние питьевого рациона с пониженным содержанием дейтерия на показатели эстрального цикла и адаптационные возможности организма у крыс-самок в предстарческом возрасте // Мед. вестн. Сев. Кавказа. 2018. Т. 13. № 1. С. 85–90.
Basov A.A., Elkina A.A., Samkov A.A., Volchenko N.N., Moiseev A.V., Fedulova L.V., Baryshev M.G., Dzhimak S.S. Influence of deuterium-depleted water on the isotope D/H composition of liver tissue and morphological development ofrats at different periods of ontogenesis // Iran. Biomed. J. 2019. V. 23. № 2. P. 129–141.
Belo I., Pinheiro R., Mota M. Fed-batch cultivation of Saccharomyces cerevisiae in a hyperbaric bioreactor // Biotech. Prog. 2003. V. 19. № 2. P. 665–671.
Dzhimak S.S., Basov A.A., Elkina A.A., Fedulova L.V., Kotenkova E.A., Vasilevskaya E.R., Lyasota O.M., Baryshev M.G. Influence of deuterium-depleted water on hepatorenal toxicity // Jundishapur J. Nat. Pharmaceut. Prod. 2018. V. 13. № 2. P. e69557.
Dzhimak S.S., Basov A.A., Kopytov G.F., Kashaev D.V., Sokolov M.E., Artsybasheva O.M., Sharapov K.S., Baryshev M.G. Application of NMR spectroscopy to the determination of low concentrations of nonradioactive isotopes in liquid media // Russ. Phys. J. 2015. V. 58. № 7. P. 923–929.
Ekaykin A.A., Lipenkov V.Y., Kozache, A.V., Vladimirova D. Stable water isotopic composition of the Antarctic Subglacial Lake Vostok: implications for understanding the lake’s hydrology // Isotop. Envir. Health Stud. 2016. V. 52. P. 468–476.
Gorokhova E. Shifts in rotifer life history in response to stable isotope enrichment: testing theories of isotope effects on organismal growth // Roy. Soc. Open Sci. 2017. V. 4. P. 160810.
Gorokhova E. Individual growth as a non-dietary determinant of the isotopic niche metrics // Meth. Ecol. Evol. 2018. V. 9. № 2. P. 269–277.
Kirkina, A.A., Lobyshev, V.I., Lopina, O.D., Doronin Yu.K., Burdeinaya T.N., Chernopyatko A.S. Isotopic effects of low concentration of deuterium in water on biological systems // Biophysics. 2014. V. 59(2). P. 326–333.
Kolesnichenko P.D., Reznikov K.M., Efremova O.A., Zhernakova N.I., Stepchenko A.A. Natality and mortality with reduced RED-OX potential drinking water // J. Intern. Pharmaceut. Res. 2018. V. 45. P. 450–453.
Koltover V.K., Labyntseva R.D., Kosterin S.O., Karandashev V.K. Magnetic isotope of magnesium accelerates ATP hydrolysis catalyzed by myosin // Biophysics. 2016. V. 61. № 2. P. 200–206.
Kosenkov A.V., Gulyaev M.V., Lobyshev V.I., Yusubalieva G.M., Baklaushev V.P. The reversible effect of deuteration on tissue fluid and biopolymers in normal and tumor tissues of mice // Biophysics. 2018. V. 63(5). P. 820–824.
Letuta U.G., Avdeeva E.I. Magnetic-dependent ATP pool in Escherichia coli // Dokl. Biochem. Biophys. 2017. V. 474. P. 196–199.
Lobyshev V.I. Biphasic response of biological objects on variation of low deuterium concentration in water // Intern. J. High Dilution Res. 2018. V. 17. № 2. P. 12–13.
Nacu G., Boisteanu P.C., Pop L.M., Zăhan M., Simeanu D. Research regarding the effect of deuterium depleted water from diluent on sows’fecundity // Sci. Papers-series d-animal Sci. 2018. V. 61. № 1. P. 149–153.
O’Brien D.M. Stable isotope ratios as biomarkers of diet for health research // Ann. Rev. Nutrition. 2015. V. 35. № 1. P. 565–594.
O’Brien D.M., Kristal A.R., Nash S.H., Hopkins S.E., Luick B.R., Stanhope K.L., Havel P.J., Boyer B.B. A stable isotope biomarker of marine food intake captures associations between n-3 fatty acid intake and chronic disease risk in a Yup’ik study population, and detects new associations with blood pressure and adiponectin // J. Nutrition. 2014. V. 144. № 5. P. 706–713.
Parmon V.N. On the possibility of observing kinetic isotopic effects in the life cycles of living organisms at ultralow concentrations of deuterium // Herald Russ. Acad. Sci. 2015. V. 85. № 2. P. 170–172.
Pershin S.M., Ismailov E.Sh., Dibirova M.M., Akhmedov M.E., Tagirova F.V., Shashkov D.I., Abdulmagomedova Z.N. Multiple increase in productivity of the yeast at reducing the fraction of D2O in water // Dokl. Biochem. Biophys. 2017. V. 476. P. 299–302.
Petriev I.S., Bolotin S.N., Frolov V.Y., Baryshev M.G., Sozayev V.A. Hydrogen permeability of a foil of pd–ag alloy modified with a nanoporous palladium coating // Bull. Russ. Acad. Sci. Phys. 2018a. V. 82. № 7. P. 807–810.
Petriev I.S., Frolov V.Y., Bolotin S.N., Baryshev M.G., Kopytov G.F. Kinetic characteristics of hydrogen transfer through palladium-modified membrane // Russ. Phys. J. 2018b. V. 60. № 9. P. 1611–1617.
Samkov A.A., Dzhimak S.S., Barishev M.G., Volchenko N.N., Khudokormov A.A., Samkova S.M., Karaseva E.V. The effect of water isotopic composition on Rhodococcus erythropolis biomass production // Biophysics. 2015. V. 60. № 1. P. 107–112.
Syroeshkin A.V., Antipova N.V., Zlatska A.V., Zlatskiy I.A., Skylska M.D., Grebennikova T.V., Goncharuk V.V. The effect of the deuterium depleted water on the biological activity of the eukaryotic cells // J. Trace Elem. Med. Biol. 2018. V. 50. P. 629–633.
Wang Y.V., O’Brien D.M., Jenson J., Francis D., Wooller M.J. The influence of diet and water on the stable oxygen and hydrogen isotope composition of Chironomidae (Diptera) with paleoecological implications // Oecologia. 2009. V. 160. № 2. P. 225–233.
Xie X., Zubarev R.A. Effects of low-level deuterium enrichment on bacterial growth // PLoS One. 2014. V. 9. № 7. P. e102071.
Xie X., Zubarev R.A. Isotopic resonance hypothesis: experimental verification by Escherichia coli growth measurements // Sci. Rep. 2015. V. 5. P. 9215.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


