Известия РАН. Серия биологическая, 2020, № 5, стр. 453-460
Механизм подавления хронической инфекции гепатита С препаратом Стимфорте
Д. В. Мишин 1, Е. И. Исаева 1, С. С. Григорян 2, А. А. Балакина 3, А. В. Ильичев 4, П. Г. Дерябин 1, Д. Г. Мальдов 4, *
1 Институт вирусологии им. Д.И. Ивановского, Федеральный научно-исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава РФ
123098 Москва, ул. Гамалеи, 16, Россия
2 Институт эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Федеральный научно-исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи Минздрава РФ
123098 Москва, ул. Гамалеи, 18, Россия
3 Институт проблем химической физики РАН
142432 г. Черноголовка, Московская обл., просп. акад. Семенова, 1, Россия
4 ЗАО СКАЙ ЛТД
129301 Москва, ул. Космонавтов, 18/2, Россия
* E-mail: maldov-dg@yandex.ru
Поступила в редакцию 17.09.2017
После доработки 05.03.2019
Принята к публикации 13.12.2019
Аннотация
Исследовано влияние препарата Стимфорте на инфекцию вируса гепатита С (ВГС). Отмечено, что через 24 ч после введения препарата Стимфорте в дозе 100 мкг/мышь инфекция подавляется частично, а в дозе 300 мкг/мышь – практически полностью. Обнаружено также, что сыворотки мышей, образовавшиеся через 24 ч в присутствии Стимфорте (100 и 300 мкг/мышь), эффективно подавляют продукцию ВГС. Установлено, что дозы 150, 200 и 250 мкг Стимфорте/мышь не эффективны. Отмечено что стимуляция продукции интерферона-β (ИФН-β) наблюдается только при дозах препарата 100 и 300 мкг/мышь и хорошо объясняет нейтрализующую способность сывороток. Зафиксировано, что количество ИФН-γ также хорошо коррелирует с противовирусной активностью и нейтрализующей активностью сывороток мышей. Обнаружено, что продукция ИФН-λ практически не стимулируется препаратом.
Гепатит С относится к индикаторам социального и медицинского благополучия общества. В мире вирусом гепатита С (ВГС) инфицировано ~3% населения (170–180 млн. человек), что в 5 раз превышает распространенность вируса иммунодефицита человека. Отсутствие протективного иммунитета после острого гепатита С и отсутствие вакцины против этого вируса делают особенно актуальным поиск механизмов, с помощью которых вирус избегает идентификации и элиминации нейтрализующими антителами и клетками иммунной системы, также подавляющих развитие этой инфекции.
Ранее нами было обнаружено действие препарата Стимфорте на хроническую инфекцию ВГС у мышей (Дерябин и др., 2009) и принадлежность его к группе иммуностимуляторов, активирующих иммунную систему преимущественно через толлподобный рецептор 4 (TLR-4) (Мальдов и др., 2011a). Механизм действия любого препарата также во многом определяет рамки его применения. При этом сама вирусная инфекция значительно модулирует действие иммуномодулирующих средств, так как, с одной стороны, вирусы вызывают ответ клеток иммунной системы хозяина и клеток-мишеней, с другой стороны, ряд вирусных белков ВГС подавляет реакции хозяина на инфекцию (Ивашкин, 2009). Один из самых быстрых и сильных ответов на вирусную инфекцию – продукция интерферонов (ИФН) (Samuel, 2001).
Клинические испытания показали эффективность использования ИФН-β (Festi et al., 2004; Lin, Young, 2014) и ИФН-λ (Pagliaccetti, Robek, 2010). Нами показана способность Стимфорте индуцировать ИФН-ответ (Мальдов и др., 2011б). ИФН-α и ИФН-β связываются с теми же рецепторами (Crow, 2014), но спектр активируемых ИФН-β генов несколько шире (de Weerd et al., 2013), поэтому ИФН-α в данной работе не определялся. Кроме того, необходимо проверить, как будут влиять на инфекцию ВГС дозы препарата, бóльшие, чем вызывающие максимальный эффект Стимфорте in vitro, и усиливающие инфекцию при генитальном герпесе (Мальдов и др., 2009, 2011б).
Цель работы – исследование действия препарата Стимфорте на подавление хронической инфекции ВГС у мышей и определение роли ИФН в этом процессе.
МАТЕРИАЛЫ И МЕТОДЫ
В опытах 50 белых беспородных мышей массой 18–20 г заражали внутрибрюшинным способом: по 0.2 мл заражали ВГС (субтип 1b) в виде вируссодержащей пробы культуральной жидкости, собранной из культур клеток Vero-V в период манифестации инфекции, при 50% тканевой цитопатической инфекционной дозы (ТЦИД) – lg 6 бляшкообразующих единиц (БОЕ). За инфицированными мышами наблюдали в течение 14 сут. В каждом варианте опыта использовали по 10 мышей. Контрольную группу составляли мыши, содержащиеся в тех же условиях и получавшие физиологический раствор вместо препарата.
В работе использовали перевиваемую линию клеток почки эмбриона зеленой мартышки, вакцинный клон (Vero-V). Культуру клеток выращивали на питательной среде Игла МЭМ с добавлением 100 ЕД. на 1 мл пенициллина и стрептомицина, глютамина и 10% эмбриональной сыворотки телят. Монослой клеток выращивали в 48-луночных пластиковых культуральных панелях. Для изучения инфекционной активности ВГС и для постановки реакции биологической нейтрализации использовали одно- или двухсуточный монослой клеток.
В работе использовали Стимфорте (ЗАО СКАЙ ЛТД), полученный на Опытном биотехнологическом производстве Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. Разводили препарат в физрастворе. Стимфорте вводили мышам подкожным способом по 0.1 мл в концентрациях 100, 150, 200, 250 и 300 мкг/мышь, причем стимулятор в дозе 100 мкг/мышь вводили животным двукратно с интервалом 2 сут, а в дозе 300 мкг/мышь вводили однократно. Сыворотки крови мышей отбирали на 1, 2 и 4-е сут от момента введения Стимфорте.
Репродукцию ВГС в организме определяли методом титрования проб тканей головного мозга мышей и сыворотки крови в культурах клеток Vero-V, выращенных в виде монослоя в 48-луночных панелях. В лунки 48-луночного планшета для микротитрования разливали по 100 мкл среды с 0.5% гомогената органа мыши или сыворотки крови (treated tissue culture (ТС)). Аликвоты каждого разведения вируса вносили в три лунки. В каждую лунку добавляли по 100 мкл суспензии клеток Vero-V, снятых с монослоя (3 × 105 кл./мл), в той же среде с ТС. Планшеты инкубировали 3–4 сут при 37°С в атмосфере 5% СO2. Для выявления цитопатогенного действия (ЦПД) планшет просматривали под микроскопом. С учетом кратности разведений определяли титр вируса по тому разведению, которое вызывает 50% ЦПД. Титром ВГС считали наибольшее разведение вируса, заражение которым приводило к гибели 50% клеток монослоя на 5-е–6-е сут после заражения. Титр ВГС выражали в десятичных логарифмах и определяли методом Рида и Менча.
Для детекции РНК ВГС у животных отбирали пробы органов (головной мозг, печень) и сыворотку крови. Сыворотку крови и гомогенизированную суспензию органов из опытной и контрольной групп мышей использовали для выделения РНК. Обнаружение РНК ВГС проводили методом двухраундовой полимеразной цепной реакции с обратной транскрипцией (ОТ ПЦР) согласно методу Окамото (Okamoto et al., 1992). Для выделения РНК ВГС использовали набор “Проба-НК” (НПО ДНК-Технология, Россия). Обратную транскрипцию РНК осуществляли системой “РЕВЕРТА-L” (ЦНИИэпидемиологии Роспотребнадзора). Первый и второй раунды ОТ ПЦР проводили с использованием специфических праймеров (SYNTOL) к 5'-нетранслируемой области генома ВГС (Okamoto et al., 1992) в последовательности
#32 5'-CTG-TGA-GGA-ACT-ACT-GTC-TT-3',
#33 5'-TTC-ACG-CAG-AAA-GCG-TCT-AG-3',
#299 5'-ACC-CAA-CAC-TAC-TCG-GCT-AG-3',
#194 5'-TAT-CAG-GCA-GTA-CCA-CAA-GG-3'.
На протяжении 19 сут после заражения ВГС каких-либо признаков инфекции у мышей не наблюдали. Животные не теряли в весе, выживаемость к концу опыта составила 100%, а их масса достигала 30 г. Таким образом, заражение ВГС привело к развитию и становлению персистентной инфекции у мышей. Инфекция характеризовалась постоянной продукцией вируса в организме, а циркуляция вируса обнаруживалась, в частности, в крови (инфекционный титр lg ТЦИД50/мл ВГС = 3.5), в печени и в головном мозге (инфекционный титр lg ТЦИД50/мл ВГС = 4.5) зараженных животных при низком уровне циркуляции антител в сыворотке крови этих животных. Антитела к ВГС в сыворотке крови по данным ИФА выявлялись при разведении 1 : 10, а вируснейтрализующие антитела – при разведении 1 : 20. Эти данные свидетельствуют о том, что в организме мышей была сформирована хроническая (персистентная) инфекция, вызванная ВГС.
Вестернблот для определения ИФН-γ проводили по описанной ранее методике (Ступина и др., 2011) с первичными антителами (PBL Interferon Source, США). Для определения ИФН-β и ИФН-λ использовали наборы для иммуноферментного анализа (PBL Interferon Source). Полученные результаты были обработаны в статистическом пакете в электронных таблицах Microsoft Excel с использованием описательной статистики и двухвыборочного t-теста с различными дисперсиями (распределение Стьюдента).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На 18-е сут после заражения ВГС мышам вводили Стимфорте и через 48 и 96 ч наблюдали уменьшение титра вируса до 0 в крови и органах животных, получавших 300 мкг/мышь этого препарата. В дозе 100 мкг/мышь (3.3 мг/кг массы) Стимфорте снижает инфекционный титр ВГС с 3.0 до 2.0 lg БОЕ (табл. 1). Эта модель инфекции послужила объектом для проведения исследований иммуностимулирующего действия Стимфорте при персистентной инфекции, вызванной ВГС у белых беспородных мышей.
Таблица 1.
Данные инфекционной активности вируса гепатита С (ВГС) и полимеразной цепной реакции с обратной транскриптазой (ОТ ПЦР) при исследовании проб сывороток крови и головного мозга хронически инфицированных ВГС мышей
| № сыворотки и гомогената | Десятикратные разведения вируса | Титр вируса lg БОЕ | Результаты ОТ ПЦР | |||||
|---|---|---|---|---|---|---|---|---|
| 10–1 | 10–2 | 10–3 | 10–4 | 10–5 | ||||
| В головном мозге | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 3 | ++++ | ++ | 0 | 0 | 0 | 2.0 | 0 | |
| 4 | ++++ | +++ | ++ | 0 | 0 | 3.0 | 0 | |
| 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| В сыворотках крови | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 3 | ++++ | ++ | 0 | 0 | 0 | 2,0 | РНК ВГС + | |
| 4 | ++++ | +++ | + | 0 | 0 | 2.8 | РНК ВГС + | |
| 5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
Примечание. 1 – сыворотка крови или гомогенат мозга мышей (С и Г) при однократном введении Стимфорте в дозе 300 мкг/мышь (анализ через 2 сут после введения препарата); 2 – С и Г. после однократного введения Стимфорте в дозе 300 мкг/мышь (анализ через 4 сут после введения препарата); 3 – С и Г от мышей после двукратного введения Стимфорте в дозе 100 мкг/мышь (анализ через 2 сут после последнего введения препарата); 4 –С и Г мышей, не получивших Стимфорте; 5 – С и Г контрольной группы незараженных мышей.
Показано, что Стимфорте в концентрации 300 мкг/мышь стимулирует образование вируснейтрализующих агентов в организме мышей, хронически инфицированных ВГС (рис. 1). Титры нейтрализации превышали таковые для контрольной группы хронически инфицированных мышей в 4 раза на 2-е сут и в 7 раз на 1-е сут. В 4 раза увеличивался титр в сыворотке крови мышей, получивших двукратно Стимфорте по 100 мкг/мышь на 1‑е сут. Сколько-нибудь существенного повышения титра антител не было отмечено в группе мышей, получивших Стимфорте в концентрации 300 мкг/мышь, сыворотки которых проверяли на наличие антител в реакции биологической нейтрализации (РБН) через 4 или 7 сут после введения препарата.
Рис. 1.
Нейтрализующая способность сывороток мышей с хроническим гепатитом С, получавших Стимфорте в различных дозах в 1-е (1), 2-е (2), 4-е сут (3) после применения Стимфорте.
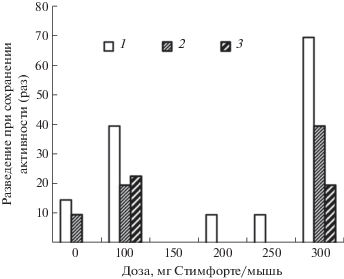
Полученные результаты исследования сывороток мышей в РБН были сходны с результатами РБН, когда устанавливали индекс нейтрализации (рис. 1). Видно, что максимальной вируснейтрализующей активностью, а именно способностью снижать концентрацию инфекционного вируса, обладали пробы сыворотки от группы мышей, которым Стимфорте вводили в концентрации 300 мкг/мышь. По сравнению с контрольной группой животных титры ВГС в этой группе мышей снижались в 100 раз, в то время как в других группах животных наблюдали лишь десятикратное снижение инфекционных титров вируса.
Результаты, полученные в РБН, полностью совпали с показателями ТЦИД50/мл. Инфекционный вирус был обнаружен в головном мозге и в пробах сывороток крови лишь в группах мышей, не получавших Стимфорте, или в группах мышей, получивших этот препарат в дозе 100 мкг/мышь. Аналогичные результаты были получены и при исследовании проб сыворотки крови мышей методом ОТ ПЦР (табл. 1): РНК ВГС была обнаружена в крови мышей, получивших Стимфорте в дозе 100 мкг/мышь, что согласуется с данными, полученными при изучении сывороток крови от разных групп мышей методом иммуноферментного анализа, где в качестве антигена были использованы вируссодержащая культуральная жидкость (гомологичный антиген) и рекомбинантные антигены ВГС: Core-c, Ns3-c, Ns4-c, Ns5-c.
Так как результаты анализов вируснейтрализующих компонентов разными методами совпадают, имеется возможность определить механизм подавления инфекции ВГС препаратом Стимфорте. Наиболее успешно инфекция подавлялась на 1-е сут и хуже всего на 4-е. Сыворотка мышей, взятая в это время, также обладала наиболее сильной нейтрализующей способностью на 1-е и хуже всего на 4-е сут. Наиболее вероятная причина этих эффектов – усиление продукции ИФН 1–3-й групп (табл. 1).
У незараженных мышей после введения 100 мкг/мышь Стимфорте наблюдается следующая динамика продукции ИФН в сыворотке: два пика активности через 24 и 72 ч после введения препарата. Через 48 ч при этой концентрации активность интерферонов была значительно ниже (табл. 2). Основной ИФН, продуцирующийся через 24 ч, – ИФН-β, концентрация которого возрастает с 3–20 пг/мл сыворотки крови до 405 ± 42.5. Кроме него продуцируются ИФН-α (250 ± 47), ИФН-γ (106.5 ± 11). Продукция ИФН-λ в данных условиях не наблюдается (табл. 2).
Таблица 2.
Динамика изменения продукции ИФН в сыворотке незараженных мышей после введения 100 мкг Стимфорте/мышь
| Виды ИФН | Концентрация, пг/мл | ||||
|---|---|---|---|---|---|
| ИФН-λ2/3 | 1.5 ± 0.5 | 3.0 ± 0 | 1.5 ± 0.5 | 1.0 ± 0,0 | 1.0 ± 0 |
| ИФН-α | 22 ± 1.0 | 250 ± 47* | – | 31.5 ± 21 | – |
| ИФН-β | 28 ± 1.5 | 405 ± 42.5* | – | 29 ± 19.5 | – |
| ИФН-γ | 12 ± 0.5 | 106.5 ± 11* | – | 175.5 ± 16.8* | – |
| Время опыта, ч | 6 | 24 | 48 | 72 | 96 |
| Активность ИФН (титр) | <2 | 64–128 | <2 | 32–64 | 8–16 |
При заражении мышей ВГС продукция ИФН-β в сыворотке резко увеличивалась по сравнению с таковой у незараженных животных, с 17 ± 1.41 до 125.5 ± 3.54 пг/мл (рис. 2). У мышей, получивших 150, 200 и 250 мкг Стимфорте/мышь или 5. 6.6 и 8.3 мг Стимфорте/кг, количество этого ИФН оставалось таким же, как и у зараженных нелеченых животных. Однако у мышей, получивших Стимфорте в дозах 100 и 300 мкг/ мышь, количество ИФН-β достоверно возрастает до 226 ± 7.8 и 265 ± 21.21 пг/мл сыворотки соответственно (рис. 2).
Рис. 2.
Продукция ИФН-β (1) и ИФН-λ (2) в сыворотке крови мышей на 18-е сут инфицирования вирусом гепатита С, получивших за 24 ч до заражения однократно Стимфорте в дозах от 100 до 300 мкг/мышь. Различия в продукции ИФН-β и ИФН-λ (показаны между зараженными нелечеными мышами (0), с незараженными мышами (н) и мышами, леченными дозами 100 и 300 мкг Стимфорте/мышь (P < 0.01)). Различия между количеством ИФН в дозах Стимфорте 100 и 300 мкг (P < 0.05).
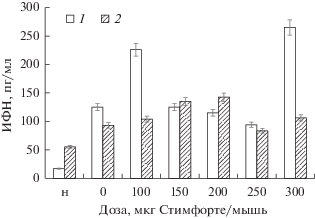
Следовательно, действие Стимфорте на продукцию ИФН-β зараженных ВГС мышей значительно отличалось от его действия у интактных животных. Этот результат хорошо коррелирует со способностью сыворотки нейтрализовать ВГС (рис. 1), особенно у животных, получивших Стимфорте за 1 сут до завершения опыта.
Продукция ИФН-λ в сыворотках крови животных из этих же опытов увеличивается не более чем в 1.5 раза по сравнению с таковой у нелеченых животных. Наиболее значительная стимуляция продукции этого цитокина происходила при использовании доз Стимфорте 150 и 200 мкг/мышь, что неудивительно, так как препарат не влияет на продукцию этого цитокина у незараженных животных (табл. 2). Рост количества ИФН-λ достигался скорее всего за счет увеличения числа клеток – продуцентов вируса. Увеличение числа лейкоцитов и моноцитов было отмечено ранее (Мальдов и др., 2011б).
Введение Стимфорте за 24 ч до тестирования в дозах 100 и 300 мкг/мышь вызывает дополнительное двукратное повышение содержания ИФН-β в мозге мышей (до 111.5 ± 2.12 и 125.5 ± 3.54 пг/г соответственно) по сравнению с таковым у животных, не получавших препарат (51.5 ± 27.38 пг/г). В печени мышей введение препарата в указанных дозах способствует повышению продукции ИФН-β только в 1.2 и 1.4 раза по сравнению с группой контроля вируса гепатита С (табл. 3). По-видимому, основные источники ИФН-β – это клетки иммунной системы, локализованные в крови экспериментальных животных, продукция которых стимулируется Стимфорте в дозах 100 и 300 мкг/мышь. ИФН-γ у незараженных мышей практически не обнаруживается на Вестернблоте. В сыворотке зараженных ВГС животных наблюдается полоса в области 17 кДа. Она значительно увеличивается при лечении мышей дозой Стимфорте 100 мкг/мышь и далее еще сильнее увеличивается под действием дозы 300 мкг/мышь (рис. 3). Данный результат свидетельствует о том, что продукция ИФН-γ стимулируется ВГС, а у зараженных этим вирусом животных – инъекциями Стимфорте. Таким образом, противовирусное действие препарата Стимфорте, по-видимому, во многом определяется ИФН-β и ИФН-γ.
Таблица 3.
Продукция ИФН-β и ИФН-λ в органах мышей на 18-е сут инфицирования вирусом гепатита С и получивших за 24 ч до заражения однократно Стимфорте
| ИФН, пг/г | Мыши интактные | Мыши зараженные | ||
|---|---|---|---|---|
| Стимфорте, мкг/мышь | ||||
| 0 | 0 | 100 | 300 | |
| Гомогенат печени | ||||
| ИФН-β | 30 ± 4.24 | 85.5 ± 2.83 | 99.5 ± 16.2 | 46 ± 1.41 |
| ИФН-λ | 136 ± 5.76 | 125.5 ± 3.5 | 764 ± 19↑↑* | 107 ± 1.41 |
| Гомогенат мозга | ||||
| ИФН-β | 26 ± 7.07 | 51.5 ± 27.58 | 111.5 ± 2.12↑* | 125.5 ± 3.54↑* |
| ИФН-λ | 119.5 ± 2.12 | 747 ± 12.7 | 163.5 ± 3.54 ↓↓* | 148.5 ± 13.44↓↓* |
Рис. 3.
Изменение продукции ИФН-γ в сыворотке мышей, хронически инфицированных гепатитом С, через 24 ч лечения Стимфорте в дозах 100 и 300 мкг на 18-е сут после введения вируса гепатита C. Выравнивание количества материала на дорожку проводилось по общему белку сыворотки. Вверху – альбумин, окрашенный Понсо; внизу Вестернблот ИФН-γ. Источники сыворотки: 0 – интактные мыши; 1 – инфицированные нелеченые мыши; 2 – инфицированные мыши, получавшие Стимфорте в дозе 100 мкг/мышь; 3 – инфицированные мыши, получавшие Стимфорте в дозе 300 мкг/мышь.
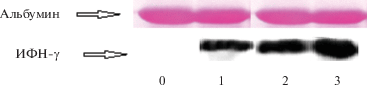
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ.
Колоколообразный характер кривой, описывающей концентрационную зависимость действия доз препарата, подтвердился, однако при концентрации 300 мкг/мышь появляется активность, не обнаруживаемая при близких, но более низких концентрациях. Об этом свидетельствует элиминация вируса до не обнаруживаемых количеств ВГС и довольно высокая вируснейтрализующая активность сыворотки крови.
Несмотря на быструю активацию врожденного иммунитета в ответ на проникновение ВГС в организм человека, распространение вируса и повышение его концентрации в сыворотке крови происходят в течение нескольких суток после инфицирования (Wieland, Chisari, 2005). Об этом свидетельствует высокая вирусная нагрузка, обнаруживаемая уже в первые сутки инфицирования. В основе этого феномена лежит способность ВГС к включению различных активных и комплементарных механизмов, снижающих эффективность врожденного иммунитета
Хотя ВГС может вмешиваться во многие физиологические процессы хозяев, это вмешательство легко обнаруживается клеточными рецепторами, с последующим запуском реакций врожденного иммунитета (Su et al., 2002; Thimme et al., 2002), в том числе выработки интерферонов I типа и активации генов-мишеней, понижающих вирусную нагрузку клеток хозяина. Адаптивный иммунный ответ на ВГС-инфекции развивается в течение нескольких недель (Thimme et al., 2001). Причина такой задержки не ясна, но понятно, что масштабы, разнообразие и качество адаптивного иммунного ответа – факторы, определяющие результат заражения.
Хотя все ядерные клетки млекопитающих способны секретировать ИФН I типа, первым ответом на заражение ВГС считается продукция ИФН-β именно инфицированными гепатоцитами. Они инициируются через двойное распознавание: TLR3 и рецепторов ретиноевой кислоты. TLR3 связывается с дцРНК в эндосомах, а рецептор ретиноевой кислоты узнает полиуридиновый мотив 3'РНК ВГС в цитоплазме (Saito et al., 2008).
В частности, блокируется ряд этапов внутриклеточных сигнальных каскадов, необходимых для продукции ИФН I типа и экспрессии стимулируемого интерфероном гена (ИСГ). Продукт неструктурного гена NS3/4A может блокировать сигнальные пути, индуцируемые толлподобным рецептором 3 и R1G-1, которые обеспечивают активацию продукции ИФН I типа; коровый белок ВГС может блокировать реакции JAK-STAT сигнального каскада, которые служат важными звеньями в экспрессии ИСГ. Помимо этого ВГС может непосредственно противодействовать специфическим функциям ИСГ (ингибировать протеинкиназу R и 2'-5'‑олигоаденилатсинтетазу посредством NS5A и Е2) и угнетать функцию компонентов врожденного иммунитета – клеток натуральных киллеров и дендритных клеток (Sun et al., 2015).
Благодаря введению больших доз Стимфорте, по-видимому, преодолевается действие вирусных белков-супрессоров иммунной системы. ИФН-β – основной или один из основных эффекторов, вызывающих подавление ВГС в РБН. Его роль в подавлении развития инфекции в организме животных бесспорна, но неизвестно, является ли она единственной.
ИФН-λ – семейство трех различных, но родственных цитокинов (ИФН-λ1, ИФН-λ2 и ИФН-λ3). Они, как и интерлейкин 29 (ИЛ-29), ИЛ-28А и ИЛ-28В, отнесены к ИФН III типа. Геномная структура ИФН-λ имеет большее сходство с таким членом семейства ИЛ, как ИЛ-10, однако на аминокислотном уровне и функционально ИФН-λ более сходны с ИФН I типа. Все ИФН III типа, как ИФН I типа, обладают антивирусной, иммуномодулирующей и противоопухолевой активностью. В целом ИФН-λ – эволюционно связующее звено между ИЛ-10 и ИФН I типа (Donnelly, Kotenko, 2010). ИФН-λ – ключевые цитокины в патогенезе ВГС человека – проявляют ингибирующее действие на репликацию как ВГС, так и гепатита В (HВV). В гепатоцитах нормальной печени преобладает экспрессия гена рецептора ИФН-λ, а именно ИФН-λR.
Показано, что ИФН-λ2 эффективно ингибирует репликацию РНК ВГС в клетках гепатомы человека, активирует антивирусные сигнальные пути JAK–STAT, индуцирует экспрессию генов ИСГ и антигенов HLA первого класса. Кроме того, ИФН-λ блокируют репликацию субгеномной и геномной РНК ВГС в культуре гепатоцитов человека Huh 7 (Pagliaccetti et al., 2010; Thomas et al., 2012). Значительное влияние ИФН-λ как фактора, сдерживающего ВГС-инфекцию, очевидно. Но несовпадение наиболее высоких значений количества этого цитокина и активности сывороток в РБН и небольшое (на грани достоверности) увеличение продукции его под действием Стимфорте, а также отсутствие влияния препарата на продукцию ИФН-λ в организме интактных мышей не позволяют считать его значимым участником непосредственного подавления репликации ВГС с помощью этого препарата.
ИФН-γ, как правило, не рассматривается как ИФН защиты первого ряда. Основная функция ИФН-γ регуляторная. Он активирует клеточный иммунитет (врожденный и адаптивный) и может играть значительную роль в подавлении ВГС-инфекции (Gattoni et al., 2006). Активация Стимфорте продукции ИФН-γ у мышей с хронической ВГС-инфекцией очевидна, связь с подавлением этой инфекции очень вероятна. Данный ИФН активируется и у незараженных мышей. К тому же препарат активирует разные компетентные иммунные клетки: макрофаги, моноциты (Мальдов и др., 2011в), нейтрофилы (Ильичев и др., 2009), натуральные и токсические киллеры (Мальдов и др., 2011б).
ЗАКЛЮЧЕНИЕ
В модельной системе на экспериментальных животных показана значительная эффективность Стимфорте в подавлении хронической ВГС-инфекции. Стимфорте подавляет инфекцию ВГС через 24 ч после введения препарата в дозе 100 мкг/мышь частично, а в дозе 300 мкг/мышь практически полностью. Сыворотки мышей, образовавшиеся через 24 ч после введения доз Стимфорте 100 и 300 мкг/мышь, эффективно подавляют продукцию ВГС. Обнаружены корреляции между нейтрализацией ВГС сывороткой получавших препарат мышей и продукцией ИФН-β и ИФН-γ под действием Стимфорте в сыворотке крови и гомогенатах мозга и печени. Выявленные феномены в значительной степени объясняют противовирусное действие препарата.
Список литературы
Дерябин П.Г., Исаева Е.И., Мальдов Д.Г., Ильичев А.В., Пичугина Л.В., Львов Д.К. Действие Стимфорте на устойчивый к интерферону генотип штамма вируса гепатита С // Вопр. вирусологии. 2009. № 2. С. 17–20.
Ивашкин В.Т. Иммунная система и повреждения печени при хронических гепатитах В и С // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. 2009. Т. 19. № 6. С. 4–10.
Ильичев А.В., Бельков А.П., Мальдов Д.Г., Асташкин Е.И. Секреция гранул нейтрофилов человека под действием формилпептида и препарата “Стимфорте” // Иммунология. 2009. № 3. С. 159–161.
Мальдов Д.Г., Бельков А.П., Ильичев А.В., Асташкин Е.И. Влияние комплексного гидрофильного низкомолекулярного препарата “Стимфорте” на функциональную активность фагоцитов крови человека // Иммунология. 2009. № 2. С. 95–97.
Мальдов Д.Г., Чирвон Е.А., Ильичев А.В., Бабаян С.С. Активация препаратом Стимфорте моноцитов и макрофагов // Иммунология. 2011a. Т. 5. С. 105–112.
Мальдов Д.Г., Григорян С.С., Галегов Г.А., Андронова В.Л., Бельков А.П., Ильичев. Действие иммуномодулирующего препарата Стимфорте на герпесвирусную инфекцию // Иммунология. 2011б. № 5. С. 250–256.
Мальдов Д.Г., Лебединская О.В., Четвертных В.А., Ахматова Н.К., Мелехин С.В., Лебединская Е.А., Фадеева Е.В., Ильичев А.В., Годовалов А.П., Киселевский М.В. Действие Стимфорте на мононуклеарные лейкоциты и лимфоидные органы мышей на фоне введения циклофосфана // Мед. иммунология. 2011в. № 2. С. 133–138.
Ступина Т.С., Пархоменко И.И., Балалаева И.В., Костюк Г.В., Санина Н.А., Терентьев А.А. Цитотоксические свойства нитрозильного комплекса железа с фенилтиилом // Изв. РАН. Сер. хим. 2011. № 7. С. 1464–1469.
Crow M.K. Advances in understanding the role of type I interferons in systemic lupus erythematosus // Curr. Opin. Rheumatol. 2014. V. 26 (5). P. 467–474.
de Weerd N.A., Vivian J.P., Nguyen T.K., Mangan N.E., Gould J.A., Braniff S.J., Zaker-Tabrizi L., Fung K.Y., Forster S.C., Beddoe T., Reid H.H., Rossjohn J., Hertzog P.J. Structural basis of a unique interferon-beta signaling axis mediated via the receptor IFNAR1 // Nat. Immunol. 2013. V. 14. P. 901–907.
Donnelly R.P., Kotenko S.V. Interferon-lambda: a new addition to an old family // J. Interferon & Cytok. Res. 2010. V. 8. P. 555–564.
Festi D.I., Sandri L., Mazzella G., Roda E., Sacco T., Staniscia T., Capodicasa S., Vestito A., Colecchia A., Safety of interferon beta treatment for chronic HCV hepatitis // World J. Gastroenterol. 2004. V. 10(1). P. 12–16.
Gattoni A., Parlato A., Vangieri B., Bresciani M., Derna R. Interferon-gamma: biologic functions and HCV terapy (type I/II) (2 of 2 parts) // Clin Ter. 2006. V. 157(5). P. 457–468.
Lin F.-C., Young H.A. Interferons: Success in anti-viral immunotherapy // Cytok. Growth Factor Rev. 2014. V. 25(4). P. 369–376.
Okamoto H., Sugiyama Y., Okada S., Kurai K., Akahane Y., Sugai Y., Tanaka T., Sato K., Tsuda F., Miyakawa Y., Mayumi M. Typing hepatitis C virus by polymerase chain reaction with type-specific primers: application to clinical surveys and tracing infectious sources // J. Gen. Virol. 1992. V. 73. P. 673–679.
Pagliaccetti N.E., Robek M.D. Interferon-λ in the immune response to hepatitis B and hepatitis C virus // J. Inter. Cytok. Res. 2010. V. 30. № 8. P. 585–590.
Saito T., Owen D.M., Jiang F., Marcotrigiano J., Gale M., Jr. Innate immunity induced by composition-dependent RIG-I recognition of hepatitis C virus RNA // Nature. 2008, V. 454. P. 523–527.
Samuel C.E. Antiviral actions of interferons // Clin. Microbiol. Rev. 2001. V. 14(4). P. 778–809.
Su A.I., Pezacki J.P., Wodicka L., Brideau A.D., Supekova L., Thimme R., Wieland S., Bukh J., Purcell R.H., Schultz P.G., Chisari F.V. Genomic analysis of the host response to hepatitis C virus infection // Proc. Natl Acad. Sci. USA. 2002. V. 99. P. 15669–15674.
Sun J., Rajsbaum R.Y.M. Immune and non-immune responses to hepatitis C virus infection // World J. Gastroenterol. 2015. V. 21(38). P. 10739–10748.
Thimme R., Chang K.M., Pemberton J., Sette A., Chisari F.V. Degenerate immunogenicity of an HLA-A2-restricted hepatitis B virus nucleocapsid cytotoxic T-lymphocyte epitope that is also presented by HLA-B51 // J. Virol. 2001. V. 75. P. 3984–3987.
Thimme R., Bukh J., Spangenberg H.C., Wieland S., Pemberton J., Steiger C., Govindarajan S., Purcell R.H., Chisari F.V. Viral and immunological determinants of hepatitis C virus clearance, persistence, and disease // Proc. Natl Acad. Sci. USA. 2002. V. 99. P. 15661–15668.
Thomas E., Gonzalez V.D., Li Q., Modi A.A., Chen W., Noureddin M., Rotman Y., Liang T.J. HCV infection induces a unique hepatic innate immune response associated with robust production of type 3 interferons // Gastroenterology. 2012. V. 142. P. 978–988.
Wieland S.F., Chisari F.V. Stealth and cunning: hepatitis B and hepatitis C viruses.// J. Virol. 2005. V. 79. № 15. P. 9369–9380.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия биологическая


